Method Article
ב Planta ביטוי גנים ועריכת גנים בעלי במבוק מוסו
In This Article
Summary
במחקר זה פותח בבמבוק רומן בשיטת ביטוי גנים של צמחים ובשיטת עריכת גנים בתיווך אגרובקטריום . שיטה זו שיפרה מאוד את יעילות אימות תפקוד הגנים בבמבוק, דבר שיש לו השלכות משמעותיות על האצת תהליך גידול הבמבוק.
Abstract
שיטה חדשנית בטרנספורמציה גנטית של צמחים פותחה עבור במבוק, אשר מונעת את הצורך בתהליכי השראת יבלות והתחדשות הגוזלים זמן רב ודורשים עבודה. שיטה זו כוללת ביטוי גנים בתיווך אגרובקטריום באמצעות פציעה ואקום עבור שתילי במבוק. הוא הדגים בהצלחה ביטוי של גנים אקסוגניים, כגון כתב רובי וגן Cas9 , בעלי במבוק. יעילות הטרנספורמציה הגבוהה ביותר להצטברות בטאליין בשתילי רובי הושגה באמצעות זן GV3101, עם אחוז של 85.2% לאחר ההדבקה. למרות שהדנ"א הזר לא השתלב בגנום הבמבוק, השיטה הייתה יעילה בביטוי הגנים האקסוגניים. יתר על כן, פותחה גם מערכת עריכה גנטית עם כתב יליד בשיטה זו, ממנה מוטציה באתרה הנוצרת על ידי הגן הערוך ויולקסנטין דה-אפוקסידז (PeVDE) בעלי במבוק, עם שיעור מוטציות של 17.33%. המוטציה של PeVDE גרמה לירידה בערכי המרווה הלא-פוטוכימית (NPQ) תחת אור גבוה, אשר ניתן לזהות במדויק על ידי פלואורומטר. זה הופך את PeVDE הערוך לכתב מקומי פוטנציאלי עבור גנים אקסוגניים ואנדוגניים בבמבוק. עם הכתב של PeVDE, גן cinnamoyl-CoA רדוקטאז נערך בהצלחה עם שיעור מוטציה של 8.3%. פעולה זו מונעת את התהליך של תרבית רקמה או השראת יבלות, שהוא מהיר ויעיל לביטוי גנים אקסוגניים ועריכת גנים אנדוגניים בבמבוק. שיטה זו יכולה לשפר את היעילות של אימות תפקוד גנים ותסייע לחשוף את המנגנונים המולקולריים של מסלולים מטבוליים מרכזיים בבמבוק.
Introduction
חקירת תפקוד הגנים בבמבוק טומנת בחובה הבטחה גדולה להבנה מתקדמת של במבוק ולמימוש הפוטנציאל שלו לשינוי גנטי. דרך יעילה לכך יכולה להיות מושגת באמצעות תהליך של זיהום בתיווך אגרובקטריום בעלי במבוק, שבו מקטע T-DNA המכיל גנים אקסוגניים מוכנס לתוך התאים, מה שמוביל לאחר מכן לביטוי הגנים בתוך תאי העלה.
במבוק הוא משאב יקר ומתחדש עם מגוון רחב של יישומים בייצור, אמנות ומחקר. לבמבוק תכונות עץ מצוינות כגון חוזק מכני גבוה, קשיחות, קשיחות בינונית וגמישות1, הנמצא כיום בשימוש נרחב במגוון מוצרים ביתיים ותעשייתיים, כולל מברשות שיניים, קשיות, כפתורים, כלי שולחן חד פעמיים, צינורות תת קרקעיים ומילוי מגדל קירור לייצור חשמל תרמי. לכן, גידול במבוק ממלא תפקיד מכריע בהשגת זני במבוק בעלי תכונות עץ מצוינות להחלפת פלסטיק והפחתת השימוש בפלסטיק, הגנה על הסביבה והתמודדות עם שינויי אקלים, כמו גם יצירת ערך כלכלי משמעותי.
עם זאת, גידול הבמבוק המסורתי עומד בפני אתגרים בשל שלב הצמיחה הווגטטיבי הארוך ותקופת הפריחה הלא ודאית. למרות שטכניקות גידול מולקולריות פותחו ויושמו בגידול במבוק, תהליך השינוי של גן הבמבוק גוזל זמן, דורש עבודה רבה ומסובך בשל תהליכי השראת והתחדשות היבמבוק 2,3,4,5. טרנספורמציה גנטית יציבה דורשת לעתים קרובות שיטות בתיווך אגרובקטריום, המערבות תהליכי תרבית רקמה כגון השראת יבלות והתחדשות. עם זאת, לבמבוק יש יכולת נמוכה להתחדשות יבלות, מה שמגביל מאוד את היישום של טרנספורמציה גנטית יציבה בבמבוק. לאחר שאגרובקטריום מדביק תאי צמחים, מקטע T-DNA נכנס לתאי הצמח, כאשר רוב מקטעי T-DNA נותרים לא משולבים בתאים, וכתוצאה מכך נוצר ביטוי חולף. רק חלק קטן ממקטעי T-DNA משתלבים באופן אקראי בכרומוזום שלו, מה שמוביל לביטוי יציב. רמות הביטוי הארעי מראות עקומת הצטברות שיכולה להשתנות עבור כל גן המתבטא בדנ"א T המועבר על ידי אגרובקטריום. ברוב המקרים, רמות הביטוי הגבוהות ביותר מתרחשות 3-4 ימים לאחר החדירה ויורדות במהירות לאחר 5-6 ימים 6,7. מחקרים קודמים הראו כי יותר משליש מהמוטציות בצמחים ערוכים גנטית המתקבלות ללא לחץ ברירה לעמידות מגיעות מהביטוי הארעי של CRISPR/Cas9, בעוד שפחות מ-2/3 הנותרות מגיעות מביטוי יציב לאחר שילוב DNA בגנום8. הדבר מצביע על כך ששילוב T-DNA בגנום הצמח אינו הכרחי לעריכת גנים. יתר על כן, לחץ הבחירה להתנגדות מעכב באופן משמעותי את הצמיחה של תאים שאינם טרנסגניים, המשפיעים ישירות על תהליך התחדשות של צמחים נגועים. לכן, על ידי שימוש בביטוי חולף ללא לחץ ברירה לעמידות בבמבוק, ניתן להשיג ביטוי לא משולב של גנים אקסוגניים ולחקור את תפקוד הגנים ישירות באיברי הצמח. לפיכך, ניתן לפתח שיטה קלה וחוסכת זמן לביטוי ועריכה של גנים אקסוגניים בבמבוק9.
שיטת ביטוי הגנים האקסוגנית המפותחת ושיטת עריכת הגנים מאופיינת בפשטותה, בעלות-תועלתה ובהיעדר ציוד יקר או פרוצדורות מורכבות9. בשיטה זו, הגן האנדוגני ויולקסנטין דה-אפוקסידז (PeVDE) שימש ככתב לביטוי גנים אקסוגניים ללא לחץ ברירה. הסיבה לכך היא שה-PeVDE הערוך בעלי במבוק מפחית את יכולת ההגנה מפני אור באור גבוה ומדגים ירידה בערך המרווה הלא-פוטוכימית (NPQ), שניתן לזהות באמצעות הדמיית כלורופיל פלואורסצנטית. כדי להדגים את יעילותה של שיטה זו, גן אנדוגני נוסף מבמבוק, הגן cinnamoyl-CoA reductase (PeCCR5)9, הושמד באמצעות מערכת זו ויצר בהצלחה מוטנטים של גן זה. טכניקה זו יכולה לשמש לאפיון פונקציונלי של גנים שיש להם תפקידים בעלי במבוק. על ידי ביטוי יתר של גנים אלה באופן ארעי בעלי במבוק, ניתן לשפר את רמות הביטוי שלהם, או על ידי עריכת גנים, ניתן להפיל את הביטוי שלהם, מה שמאפשר לחקור את רמות ביטוי הגנים במורד הזרם, פנוטיפים של עלים, ותכולת המוצר. זה מספק גישה יעילה ואפשרית יותר לחקר תפקודי גנים בבמבוק. טכניקה זו יכולה להיות מיושמת לאפיון פונקציונלי של גנים המתפקדים בעלי במבוק. על ידי ביטוי יתר של גנים אלה באופן ארעי בעלי במבוק, ניתן לשפר את רמות הביטוי שלהם, או על ידי עריכת גנים, ניתן להפיל את הביטוי שלהם, מה שמאפשר לחקור את רמות ביטוי הגנים במורד הזרם, פנוטיפים של עלים, ותכולת המוצר. בנוסף, חשוב לציין כי בשל פוליפלואידיזציה נרחבת, רוב הגנים החשובים מבחינה מסחרית בגנום הבמבוק נמצאים במספר עותקים, וכתוצאה מכך יתירות גנטית. הדבר מציב אתגר לביצוע עריכת גנום מרובה בבמבוק. לפני היישום של טרנספורמציה גנטית יציבה או טכניקות עריכת גנים, חיוני לאמת במהירות את תפקודי הגנים. בהתמודדות עם הבעיה של עותקי גנים מרובים, גישה אחת היא לנתח פרופילי ביטוי שעתוק כדי לזהות גנים המתבטאים באופן פעיל בשלבים ספציפיים. יתר על כן, מיקוד התחומים הפונקציונליים השמורים של עותקי גנים אלה מאפשר תכנון של רצפי מטרה משותפים או שילוב של אתרי מטרה מרובים באותו וקטור CRISPR/Cas9, המאפשר נוקאאוט בו זמנית של גנים אלה. זה מספק גישה יעילה ואפשרית יותר לחקר תפקודי גנים בבמבוק.
Protocol
1. הכנת שתילי במבוק
- הכינו שתילי בוסו במבוק (Phyllostachys edulis) באמצעות זרעים שנקטפו בגווילין, גואנגשי, סין. התחילו בהשריית הזרעים במים למשך 2-3 ימים, והקפידו להחליף את המים מדי יום. לאחר מכן, ליצור מצע על ידי ערבוב אדמה ורמיקוליט ביחס של 3: 1.
- זורעים את הזרעים המושרים במצע לנביטה. לשמור על שתילים בתנאי מעבדה, שמירה על הטמפרטורה בין 18-25 °C (75 °F). הבטיחו תקופת אור של 16 שעות/8 שעות כהות עם עוצמת אור של 250-350 μmol/m2/s במהלך שלב האור.
- שומרים על לחות יחסית של כ-60%. עבור זיהום Agrobacterium, להשתמש שתילים כי הם 15 ימים יש גובה של 2-10 ס"מ, המהווה את השלב הטוב ביותר עבור טרנספורמציה.
הערה: מכיוון שפריחת במבוק אינה צפויה, זרעים אינם זמינים מדי שנה. הזרעים מאוחסנים בדרך כלל במשך 2-3 שנים ב 4 מעלות צלזיוס בסביבה יבשה ועדיין יכולים לשמור על כדאיות של מעל 20%.
2. הכנת פלסמידים ואגרובקטריום
- פלסמידים: כדי לאמת את אפקט הביטוי הארעי, השתמש במבנה pHDE-35S::RUBY המכיל גן מדווח גלוי המונע על ידי מקדם CaMV 35S 10. לעריכת גנים, השתמש במבנה pCambia1300-Ubi::Cas9, הנושא את הגן Cas9 המונע על ידי מקדם Ubi תירס 11. הכנס את הרצפים המנחים של sgRNA של PeVDE וגני מטרה אחרים בין שני אתרי AarI במבנה pCambia1300-Ubi::Cas9 9.
- הכנס את רצפי הרנ"א המנחים CRISPR/Cas9 בין שני אתרי אנדונוקלאז הגבלת AarI של מבנה pCambia1300-Ubi::Cas9 , כולל גני המטרה PeVDE ו - PeCCR5 .
- הוסף את GGCA לקצה 5' של רצף 20 הנוקלאוטידים וסנתז רצף DNA חד-גדילי. משלימים לאחור את רצף 20 הנוקלאוטידים ומוסיפים AAAC לקצה 5', ואז מסנתזים רצף DNA חד-גדילי נוסף.
- יש לדלל את שני רצפי הדנ"א החד-גדיליים לריכוז של 10 ננומטר לליטר במים מדוללים, לערבב היטב ולחמם בטמפרטורה של 95°C למשך 5 דקות. תנו לתערובת להתקרר לטמפרטורת החדר, וכתוצאה מכך נוצרו מתאמים דו-גדיליים.
- חבר את המתאמים עם מקטע pCambia1300-Ubi ליניארי::Cas9 שעוכל על ידי אנדונוקלאז AarI באמצעות ליגאז DNA T4 ורצף את וקטור CRISPR/Cas9 שנבנה כדי לקבל את מבנה מיקוד הגנים הרצוי.
- כדי להפוך פלסמידים לאגרובקטריום, השתמש בשיטת הקפאה-הפשרה באופן הבא: ערבב 1 μL של פלסמידים (ריכוז: 10 - 1,000 ng/μL) עם 100 μL של תאים בעלי יכולת אגרובקטריום (יעילות תרגום: > 1 x 104 יחידות יוצרות מושבה / מיקרוגרם) וערבב אותם בעדינות. מניחים את התערובת על קרח למשך 5 דקות. מעבירים את התערובת לחנקן נוזלי למשך 5 דקות.
- הפשירו את התערובת באמבט מים בטמפרטורה 37°C למשך 5 דקות. מוסיפים 500 μL של Luria-Bertani (LB) בינוני לתערובת ודגרים אותו על אינקובטור רועד ב 28 ° C ב 200 סל"ד במשך 2-3 שעות. עבור פלסמידים מסוג pHDE-35S::RUBY, הכנס אותם בנפרד לזנים AGL1, GV3101, LBA4044 ו-EHA105 של Agrobacterium tumefaciens (A. tumefaciens)12. עבור פלסמידים מסוג CRISPR/Cas9, הכניסו אותם לזן GV3101 של A. tumefaciens.
- לגדל אגרובקטריום בתמצית שמרים פפטון (YEP) בינוני (10 גרם תמצית בקר, 10 גרם תמצית שמרים ו-5 גרם NaCl לליטר) עם האנטיביוטיקה המתאימה (ספקטינומיצין עבור 35S::RUBY וקנמיצין עבור קריספר/Cas9) ב-28°C. המושבות הבודדות נצפו 36-48 שעות לאחר העיבוד.
- קטפו והעבירו את המושבות למדיום YEP נוזלי (עם אנטיביוטיקה מתאימה) להמשך גדילה. לאחר 24-36 שעות, השתמש בפריימרים של RUBY-F ו- RUBY-R (טבלה 1) כדי לבצע PCR כדי לאשר העברה מוצלחת של פלסמידים לתוך Agrobacterium.
- להעביר 1 מ"ל של אגרובקטריום בהצלחה הפך לתוך 100 מ"ל של נוזל טרי YEP בינוני (עם אנטיביוטיקה מתאימה) ולאחר מכן לגדול בן לילה ב 28 ° C ל OD600 של 0.8.
- צנטריפוגה את התרחיף החיידקי ב 4,000 x גרם במשך 5 דקות ב 4 ° C, לשטוף את גלולה חיידקית פעם אחת עם מתלים חדירת בינוני (10 mM MgCl2 ו 10 mM MES-KOH [pH 5.6]), ולאחר מכן צנטריפוגה שוב. יש להשהות מחדש את כדורית החיידקים בתווך חדירת תרחיף ל-OD600 של 0.6 לצורך טרנספורמציה של במבוק.
3. אגרובקטריום - מתווך במערכת טרנספורמציה של צמחים
- היכונו לטרנספורמציה; הסר בזהירות את השתילים עם שורשים המחוברים לאדמה מהמצע, וודא שהשורשים נשארים שלמים. עטפו את השתילים ברדיד אלומיניום כדי לשמור על לחות ולמנוע היפרדות אדמה (איור 1A).
- העבירו את השתילים העטופים לסביבה עם לחות גבוהה יותר (לחות אוויר יחסית >90%) ותאורה נמוכה יותר (עוצמה של פחות מ-50 μmol/m2/s) למשך שעתיים.
- בעזרת מחט חדה ממזרק, פצעו את החלק העליון של עלים לא בוגרים מסולסלים (בערך 1-2 ס"מ מהחלק העליון) של שתילי הבמבוק פעם או פעמיים (כפי שמצוין במשולשים האדומים באיור 1A).
- לאחר מכן, טובלים את החלק העליון הפצוע של השתילים בתרחיפים של אגרובקטריום. בצעו את התהליך כולו, מהפציעה ועד לטבילה מהירה באגרובקטריום , שכן הפצע הטרי יגביר את יעילות החיסון.
- העבירו מיד את השתילים לתא ואקום בלחץ של 25-27 מ"מ כספית למשך 2 דקות (איור 1B).
- לאחר שאיבה, בזהירות לפתוח את השתילים ולשתול אותם מחדש לתוך המצע. מניחים את השתילים באור עמום או בחושך (<50 μmol/m2/s) עם לחות גבוהה (RH>90%) בטמפרטורת החדר (18-25 מעלות צלזיוס) למשך יומיים. לאחר מכן, תרבית את השתילים בתנאי גידול נורמליים, להשקות אותם כל 5-7 ימים. שימו לב לפנוטיפים שלהם כדי לספק חומרים לניסויים הבאים.
4. תכנון רנ"א מנחה יחיד (sgRNAs) לעריכת גנים
- זהה אתר מוטיב סמוך פרוטוספייסר (PAM) הממוקם בסמוך לתחום ספציפי ושמור של רצף גן המטרה. ודא שרצף ה- PAM הספציפי הוא NGG במערכת CRISPR/Cas9 זו. אמת את הספציפיות של הרצף שנבחר על ידי ביצוע חיפוש BlastN מול מסד הנתונים של גנום הבמבוק. ודא כי sgRNA הוא ייחודי, במיוחד באזור במעלה הזרם קרוב PAM 9,11.
הערה: השוואה זו תפחית ביעילות אתרים פוטנציאליים מחוץ למטרה בגנום המושפעים מתהליך עריכת הגנים. - תכננו שני sgRNA (sgRNA-1 ו-sgRNA-2) על האקסון הראשון של הגן PeVDE 13. כלול אתרי הגבלה של גיל I במעלה הזרם של PAM ב- sgRNA-1 ואתרי הגבלה של XbaI במעלה הזרם שלPAM ב- sgRNA-2. תכננו sgRNA אחד על האקסון הרביעי של הגן PeCCR5, המקודד את המוטיב השמור של KNWYCYGK. מוטיב זה הוא קריטי לקטליזה של CCRs14.
- תכנן רצף ספייסר של 20 נוקלאוטידים בסמוך לאתר PAM. רצף ספייסר זה ינחה את האנזים Cas9 לאתר היעד לצורך פיצול DNA ועריכת גנים לאחר מכן.
הערה: מומלץ לבחור אזור יעד במעלה הזרם של אתר מחשוף האנזים אנדונוקלאז בתוך אתר PAM. זה יקל על אימות יעילות עריכת הגנים.
5. עיצוב פריימר ו-PCR
- תכנון ידני של פריימרים ספציפיים להגברה של מקטעי PeVDE ו-PeCCR5 . תכננו את הפריימרים במעלה ובמורד הזרם כך שימוקמו לפחות 100 bp מחוץ לאתר המטרה, עם הפרש אורך של מעל 100 bp כדי לאפשר הפרדת פס ברורה במהלך אלקטרופורזה. תכנון פריימרים להגברה של RUBY בתוך 500 bp הראשונים של הגן. רשימה של כל הפריימרים שנעשה בהם שימוש מופיעה בטבלה 1.
- השתמש פולימראז DNA באיכות גבוהה עבור PCR. במקרה זה, השתמש ב- DNA פולימראז עם נאמנות גבוהה והגברה יעילה בשיבוט גנים.
- הכינו את תערובת תגובת ה-PCR באופן הבא: מאגר 5x (Mg2+ Plus): 4 μL; תערובת dNTP (2.5 mM כל אחד): 1.6 μL; פריימרים קדימה ואחורה (10 pmol כל אחד): 1 μL כל אחד; דנ"א גנום במבוק (כ-50 ננוגרם); DNA פולימראז (2.5 U/μL): 0.2 μL; לדלל מים לנפח כולל של 20 μL.
- עקוב אחר תנאי הפעולה של PCR: דנטורציה ראשונית ב- 98 ° C למשך 5 דקות; דנטורציה ב 98 °C במשך 10 שניות; חישול ב 56 ° C במשך 5 שניות; הארכה ב 72 ° C במשך 30 שניות; חזרה על דנטורציה להארכה למשך 32 מחזורים; הארכה סופית ב-72°C למשך 5 דקות; החזק בטמפרטורה של 4°C ללא הגבלת זמן.
הערה: תנאי PCR מסופקים כדוגמה וייתכן שיהיה צורך למטב אותם עבור יישומים או יעדים ספציפיים.
6. מיצוי DNA, עיכול אנזים אנדונוקלאז וריצוף
- הפרד את האזור עם ערכי NPQ נמוכים יותר מלהבי עלי במבוק טריים באמצעות מספריים, כפי שזוהה על-ידי פלואורומטר הדמיה-PAM (עיין בשלב 7.4). מקפיאים את דגימות העלים בחנקן נוזלי ומעבירים את דגימות העלים הקפואות למכתש. טוחנים את הדגימות לאבקה דקה באמצעות מזיק, ומוסיפים מספיק חנקן נוזלי בתהליך הטחינה. שלב זה מסייע בשחרור התוכן התאי, כולל DNA.
- חלץ DNA גנומי מאבקת העלים באמצעות שיטת Cetyltrimethylammonium Ammonium Bromide (CTAB). הוסף 50 מ"ג של דגימות אבקת עלים ל 800 μL של תמיסת CTAB 2%. יש לערבב היטב את הדגימה ולדגור בטמפרטורה של 65°C למשך 30 דקות, תוך ניעור עדין כל 5 דקות.
- מוסיפים נפח שווה של כלורופורם/איזואמיל אלכוהול (24:1, v/v) ומנערים במרץ את התערובת. לאחר צנטריפוגה במשקל 8,000 גרם למשך 8 דקות, מעבירים את הסופרנאטנט לצינור חדש.
- הוסף נפח שווה של אלכוהול כלורופורם/איזואמיל וחזור על שלב 6.3. הוסף נפח שווה של איזופרופנול קר כקרח, והפוך את הצינור מספר פעמים לפני הנחתו ב -20 ° C למשך 30 דקות. לאחר צנטריפוגה ב 8,000 x גרם במשך 5 דקות, להשליך את supernatant.
- לשטוף את גלולת ה- DNA 2x עם אתנול 75% ב 4 ° C, ולאחר מכן להמיס ב 50 μL של מים.
- להגביר את הדנ"א הגנומי המכיל את אתר המטרה של גני המטרה הן מעלי במבוק מסוג בר והן מעלי במבוק נגועים באגרובוקטריום עם הפרוטוקול בשלב 5.4.
- בצע עיכול אנזים endonuclease של מוצרי PCR. בחר אנזים ספציפי המזהה את אתרי ההגבלה הרצויים בתוך מקטעי ה- DNA המוגבר. השתמש גילI ו XbaI endonucleases לעיכול.
- הכינו תערובת תגובה המורכבת מגילI או XbaI (20 יחידות/μL)- 1 μL, 1 מיקרוגרם מוצרי PCR, חיץ 10x - 5 μL, והוסיפו מים לנפח כולל של 50 μL. דגרו ב-37°C למשך שעה.
- לנתח את חלקם של קטעי DNA מעוכל באמצעות אלקטרופורזה ג'ל. השוו את המקטעים המעוכלים מדגימות נגועות בטבע ובאגרובקטריום כדי להעריך את יעילות עריכת הגנים.
- תייג את מתאם הטרנספוזאז TCGTCGGCAGCGTCAGATGTGTATAAGACAG ורצפי GTCTCGTGGGCTCGGAGATGTATAAGACAG לקצה 5' של הפריימרים קדימה ואחורה, בהתאמה, להגברה של מקטעי PeVDE ו- PeCCR5 9,15. השתמש בפרוטוקול המתואר בשלב 5.4 להגברה. הכינו את מוצרי ה-PCR (לפני העיכול) לריצוף עמוק.
7. מדידת פלואורסצנטיות כלורופיל של ערכי NPQ בעלים
- לפני המדידות, חשוף את שתילי הבמבוק לתנאי עוצמת אור גבוהה של 1200 μmol/m2/s למשך שעתיים. חשיפה זו מגדילה את כמות האור הנבלע ומפעילה את מערכת ההגנה מפני אור בעלים.
- השתמש בפלאורומטר Imaging-PAM כדי למדוד את הפלואורסצנטיות של כלורופיל PS II in vivo של עלי במבוק. הגדר את עוצמת האור האקטינית ל- 800 μmol/m2/s למשך 6 דקות מדידות פלואורסצנטיות. במהלך תקופה זו, יש להפעיל פולס רווי כל 30 שניות כדי לקבל עקומות פלואורסצנטיות של כלורופיל. הערכים היציבים של העקומות ישמשו לחישובים13.
- חשב את המרווה הלא פוטוכימית (NPQ) באמצעות הנוסחה:
NPQ = (F m - F m') / F m'
כאשר F m מייצג את הפלואורסצנטיות המרבית במצב מותאם כהה, ו- Fm' מייצג את הפלואורסצנטיות המרבית בכל מצב מותאם אור. - נטר את ערכי NPQ מהממשק החזותי של תוכנת ההדמיה. התוכנה מאפשרת ניתוח והצגה בזמן אמת של נתוני הפלואורסצנטיות, כולל ערכי NPQ.
תוצאות
אגרובקטריום בתיווך ביטוי גנים צמחיים בעלי במבוק
הגן RUBY reporter הוכח כיעיל בהדמיה של ביטוי גנים חולפים בשל יכולתו לייצר בטאליין אדום חי מטירוזין10. במחקר זה, טרנספורמציה בתיווך אגרובקטריום נוצלה כדי לבטא באופן ארעי את הגן האקסוגני RUBY בעלי במבוק (איור 1). ב-3 הימים שלאחר ההדבקה נצפה צבע אדום בעלים המקופלים הלא בשלים, שנעשו חיים יותר ביוםה-5 לאחר שהעלים נפרשו. תוצאות אלה מראות כי אגרובקטריום תיווך בהצלחה את הביטוי של הגן האקסוגני RUBY בעלי במבוק וכי סינתזת betalain התרחשה.
יתר על כן, ארבעה זנים של אגרובקטריום (AGL1, LBA4404, EHA105 ו- GV3101) הושוו ומצאו כי זן GV3101 גרם להצטברות הבטאליין המשמעותית ביותר בעלי במבוק נגועים, כאשר האחוז הגבוה ביותר של 85.2% מהשתילים הצטברו בטאליין לאחר שנדבקו, ואחריו AGL1 (76.9%) ולאחר מכן EHA105 (49.1%) ו- LBA4404 (31.3%; איור 1D). זה מצביע על כך ש- GV3101 הוא הזן המתאים ביותר למטרה זו. PCR בנאמנות גבוהה נערך כדי לזהות אם מקטע T-DNA בתיווך אגרובקטריום השתלב בכרומוזום הבמבוק. לאחר 40 מחזורים של PCR, לא זוהו רצועות של הגן RUBY , מה שמצביע על כך שמקטע T-DNA לא השתלב או שולב במספר כה נמוך שלא ניתן היה לזהות אותו. לפיכך, תוצאות אלה מסיקות כי ביטוי גן זה הוא חולף.
בסך הכל, ממצאים אלה מדגימים את ההיתכנות של חולף בתיווך אגרובקטריום בביטוי גנים צמחיים בבמבוק באמצעות הגן RUBY reporter. עם זאת, צבע הבטאליין האדום נמצא לא יציב ונעלם לאחר 3 חודשים של זיהום, מה שמעיד על כך שמערכת הביטוי הארעית אינה יציבה להשגחה ארוכת טווח.
בעריכה גנטית של הגן לבמבוק ויולקסנטין דה-אפוקסידז (PeVDE)
אגרובקטריום בתיווך ביטוי גנים של צמחים היא שיטה חולפת לביטוי גנים בבמבוק. כדי לחקור אם מערכת CRISPR/Cas9 חולפת יכולה להשיג עריכה גנטית בעלי במבוק, האנזים העיקרי במחזור הקסנתופיל של הבמבוק, ויולקסנטין דה-אפוקסידז (PeVDE), נבחר כיעד לעריכת גנים בניסוי. רנ"א מנחה יחיד (sgRNAs) תוכנן על האקסון הראשון של הגן PeVDE (sgRNA-1), אשר מכיל אתרי הגבלה של גילI במעלה הזרם של מוטיב הפרוטוספייסר הסמוך (PAM) כדי להקל על אימות עריכת גנים (איור 2A).
מבנה CRISPR/Cas9 הנושא sgRNA-1 הודבק לתוך אגרובקטריום כדי להפוך עלי במבוק. לאחר הדבקה של אגרובקטריום המכיל מבני CRISPR/Cas9 הנושאים sgRNA-1 במשך 5 ימים, שתילי במבוק היו נתונים לטיפול באור גבוה, ולאחר מכן בוצע זיהוי פרמטר פלואורסצנטי של כלורופיל. אזורים מסוימים של להבי עלים נמצאו עם ערכי מרווה לא-פוטוכימיים (NPQ) נמוכים יותר (איור 2B), מה שמצביע על כך שיכולת ההגנה מפני אור של אזורים אלה הופחתה תחת אור חזק. מכיוון שלגן PeVDE יש את היכולת לפזר אנרגיית אור נספגת עודפת13, אזורים אלה עם ערכי NPQ נמוכים יותר צפויים להיות האזורים שבהם נערך הגן PeVDE. לאחר מכן, בוצע ניתוח עיכול וריצוף אנזימים של מקטע הגן PeVDE באזורים האלה של להבי העלים (איור 2C-D) ונמצא ששיעור המוטציות של sgRNA-1 היה 17.33%, מה שמצביע על כך שעריכת גנים הייתה מוצלחת באזורים אלה של הגן PeVDE.
בנוסף, אתר מיקוד sgRNA נוסף, sgRNA-2, המכיל אתר הגבלת XbaI, תוכנן על האקסון הראשון של PeVDE. כדי לחקור את האפשרות של מחיקת מקטעים ארוכים עם מיקוד sgRNA כפול, בוצעה עריכת גנים בשני אתרי היעד, וכתוצאה מכך מחיקת מקטעים ארוכים (איור 2E).
מוטנט PeVDE ערוך המשמש ככתב במערכת עריכת גנים חולפים
נבדקה השאלה האם ה-PeVDE sgRNA יכול לשמש ככתב במערכת עריכת הגנים הארעית. הגן cinnamoyl-CoA רדוקטאז (PeCCR5) (מזהה גן: PH02Gene42984.t1) נבחר באופן אקראי, כדי להעריך את כתב PeVDE . מטרת sgRNA אחת עבור PeCCR5 תוכננה במוטיב השמור שלה על האקסון הרביעי. מבנה ה-CRISPR/Cas9 שנושא את שני ה-sgRNA, PeVDE ו-PeCCR5, הפך לעלי במבוק (איור 3A).
לאחר זיהום אגרובקטריום במשך 30 יום, השתילים טופלו באור בעוצמה גבוהה במשך 20 דקות. נצפה כי רק לאזורי העלים שנערכו עבור הגן PeCCR5 לא הייתה השפעה על ערכי NPQ, בעוד שאזורי העלה שנדבקו על-ידי sgRNA הן של PeVDE והן של PeCCR5 הציגו ערכי NPQ נמוכים יותר (איור 3B).
לאחר מכן, מקטע PeCCR5 מאזורי העלה עם ערכי NPQ נמוכים יותר הוגבר ורוצף ומצא יעילות מוטציה של 8.3% באמצעות ריצוף עמוק. לכן, כתב PeVDE שימש בהצלחה ככתב עריכת גנים חולף וניתן להשתמש בו כדי לסנן עריכה גנטית של גנים אחרים מבמבוק.
בסך הכל, תוצאות אלה מדגימות את ההיתכנות של עריכת גנים במבוק באמצעות CRISPR/Cas9 בבמבוק.
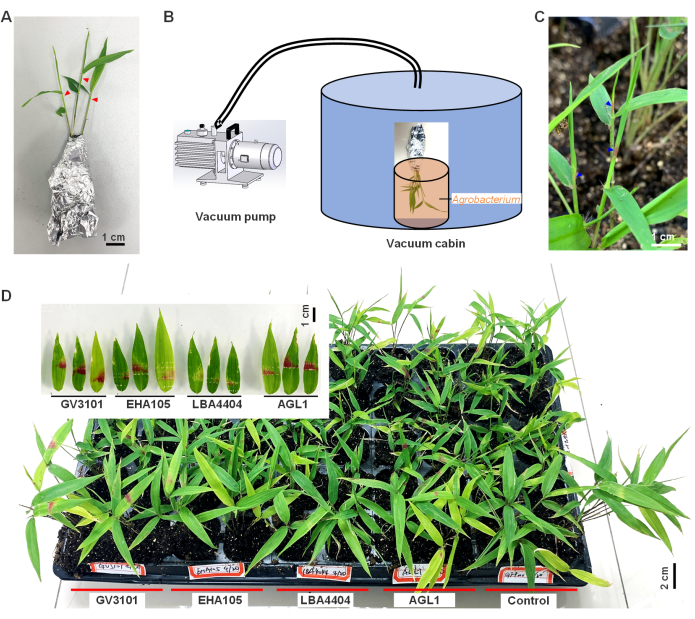
איור 1: בביטוי צמחי של גן RUBY והצטברות בטאליין בעלי במבוק מוסו. (A) שתילי במבוק מוסו עטופים ברדיד פח ומוכנים לזיהום אגרובקטריום , עם משולשים אדומים המציינים מיקומים שנפגעו ממחט חדה ממזרק. (B) תהליך חדירת ואקום של שתילי במבוק. (C) הצטברות בטאלין בעלי במבוק לאחר 3 ימים של הדבקה שנצפתה באמצעות שינויים פנוטיפיים. (D) כאן בוצע ארבעה זני אגרובקטריום , AGL1, LBA4404, EHA105 ו-GV3101 בתיווך גן RUBY בעלי במבוק. GV3101 המכיל את מבנה GFP שימש כבקרה שלילית. נתון זה שונהמ-9. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: בביטוי צמחים ובעריכה גנטית של גן PeVDE בעלי במבוק. (A) מידע על מיקום ורצף המטרה של sgRNA בגן PeVDE. משולשים אדומים מציינים את מיקומם של פריימרים קדימה ואחורה להגברת פרגמנט. (B) NPQ והדמיה גולמית של עלי במבוק לאחר ההדבקה. מספרים בתמונת NPQ מייצגים ערכי NPQ בצג תוכנת ההדמיה. (C) תוצאות אלקטרופורזה של מקטע PeVDE לפני ואחרי עיכול גילI. WT מציין את העלים הלא נגועים מסוג בר, ו- + ו- מייצגים שברי PeVDE עם או בלי עיכול גילI, בהתאמה. (D) תוצאות ריצוף עמוק של מקטע PeVDE בעלים בעלי ערך NPQ נמוך יותר. הגופנים האדום, הכחול והאפור ברצפים מייצגים את אתרי היעד, PAM והוספות, בהתאמה. המקפים האדומים מציינים נוקלאוטידים שנמחקו. (E) תוצאות ריצוף Sanger של מקטע PeVDE לאחר עריכה הן על ידי sgRNA-1 והן על ידי sgRNA-2. נתון זה שונהמ-9. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 3: PeVDE sgRNA ככתב לסינון עריכה גנטית של PeCCR5. (A) ייצוג סכמטי של מבני CRISPR/Cas9 המכילים PeVDE ו-PeCCR5 sgRNAs. (B) NPQ ותמונות גולמיות של עלי במבוק לאחר הדבקה במבנים שב-(A). משולשים לבנים מציינים אזורים עם ערכי NPQ נמוכים יותר. צבע הקשת מייצג את הערך של NPQ/4, כאשר אדום מתאים לערך המינימלי וסגול מתאים ל- 1. (C) הגופנים האדום, הכחול והאפור ברצפים מייצגים את אתרי היעד, PAM והוספות, בהתאמה. המקפים האדומים מציינים נוקלאוטידים שנמחקו. נתון זה שונהמ-9. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| שם גן | רצף פריימר (5'-3') | יישום | ||
| אודם | F: ATGGATCATGCGACCCTCG | להגברת PCR בעלי במבוק נגועים | ||
| R: GTACTCGTAGAGCTGCTGCAC | ||||
| PeVDE | F: TGTGGCTTCTAAAGCTCTGCAATCT | לשיבוט וריצוף גנים | ||
| R: TGTCAATGCTACAAGTCCTGGCA | ||||
| PeVDE-Target1 | F: GGCATAGCCCTCACGCAGCACCGG | לתכנון יעד PeVDE sgRNA-1 | ||
| R: AAACCCGGTGCTGCGTGAGGGCTA | ||||
| PeVDE-Target2 | F: GGCACTCCACGGTCCCAAATCTAG | לתכנון יעד PeVDE sgRNA-2 | ||
| R: AAACCTAGATTTGGGACCGTGGAG | ||||
| PeCCR5-יעד | F: GGCACTGGTACTGCTACGCTAAGA | לתכנון יעד PeCCR5 sgRNA | ||
| R: AAACTCTTAGCGTAGCAGTACCAG | ||||
טבלה 1: מידע הרצף של פריימרים.
Discussion
שיטה זו מפחיתה משמעותית את הזמן הנדרש בהשוואה לשיטות טרנספורמציה גנטית מסורתיות, אשר בדרך כלל אורכות 1-2 שנים, ומשיגה ביטוי חולף של גנים אקסוגניים ועריכת גנים של גנים אנדוגניים תוך 5 ימים. עם זאת, לשיטה זו יש מגבלות מכיוון שהיא יכולה להפוך רק חלק קטן מהתאים, והעלים הערוכים גנטית הם כימריים וחסרים את היכולת להתחדש לצמחים שלמים. עם זאת, זה בביטוי גנים צמחיים וטכנולוגיית עריכת גנים מספק גישה רבת עוצמה לאימות פונקציונלי של גנים במבוק אנדוגניים.
כיום, בצמח ביטוי גנים וטכנולוגיית עריכת גנים יכולים להתבצע רק בעלים לא בוגרים (מסולסלים), ולא בעלים בוגרים. ככל שהעלים מתפתחים ומתרחבים, מספר התאים הערוכים גנטית שעוברים חלוקה גדל, מה שמאפשר עריכת גנים באזורי עלים ספציפיים. עם זאת, שיטת הטרנספורמציה בתיווך אגרובקטריום אינה גורמת להחדרה של T-DNA אקסוגני לכרומוזום הבמבוק, מה שמקשה על שימוש בגנים של סמן יציב בבמבוק 6,9. לכן, זה מאתגר לקבוע את המיקומים המדויקים של אזורים אלה. כדי לטפל בכך, הגן PeVDE נערך, והאזור הערוך הציג יכולת פוטו-הגנה מופחתת תחת טיפול באור גבוה, כפי שמצוין על ידי ערכי NPQ נמוכים יותר, אשר ניתן לזהות בקלות באמצעות הדמיית פלואורומטר כלורופיל-PAM. לפיכך, PeVDE פותח כסמן בבמבוק כדי לזהות את ההתרחשות של ביטוי גנים אקסוגני ועריכת גנים. בשל השימור הגבוה של גן זה במינים שונים 13, הוא יכול להיות מיושם באופן נרחב גם על צמחים אחרים.
בשל שקיעת שכבת שעווה עורית על האפידרמיס של עלי במבוק, יחד עם המורפולוגיה המסולסלת והעטופה היטב האופיינית של עלים לא בוגרים, הנגישות של אגרובקטריום לתאי העלה נפגעת באופן משמעותי. על מנת לשפר את היעילות של זיהום אגרובקטריום, נעשה שימוש בגישות פיזיות, כולל חדירת פצעים ואקום, כדי לקדם את חדירת אגרובקטריום לתוך עלי הבמבוק המסולסלים הסגורים. תהליך זה מאפשר קרבה בין אגרובקטריום לתאי העלה, ובכך משפר את יעילות הטרנספורמציה הגנטית. בינתיים, מערכת עריכת גנים זו הוגבלה עד כה לעלי במבוק ואינה יכולה להתבטא באיברים בעלי יכולת רבייה, כגון זרעים וניצנים רוחביים שיכולים לעבור בירושה לדור הבא. יישומים עתידיים של הטכניקה יעברו אופטימיזציה להשגת ביטוי גנים בתוך הצמח וטכנולוגיית עריכת גנים באיברים בעלי יכולת רבייה, במטרה להשיג צמחים מתחדשים תורשתיים יציבים.
Disclosures
המחברים מצהירים כי אין להם אינטרסים מתחרים.
Acknowledgements
המחברים רוצים להודות לתוכנית הלאומית למחקר ופיתוח מפתח של סין (מענק מס' 2021YFD2200502), לקרן הלאומית למדעי הטבע של סין (מענק מס' 31971736) על התמיכה הכספית.
Materials
| Name | Company | Catalog Number | Comments |
| 35S::RUBY | Addgene, United States | 160908 | Plamid construct |
| Agrobacterium competent cells of GV3101, EHA105,LBA4404, and AGL1 | Biomed, China | BC304-01, BC303-01, BC301-01, and BC302-01 | For Agrobacterium infection |
| CTAB | Sigma-Aldrich, United States | 57-09-0 | DNA extraction |
| Imaging-PAM fluorometer | Walz, Effeltrich, Germany | Detect chlorophyll fluorescence of bamboo leaves | |
| ImagingWin | Walz, Effeltrich, Germany | Software for Imaging-PAM fluorometer | |
| Paq CI or Aar I | NEB, United States | R0745S | Incorporate the target sequence onto the CRISPR/Cas9 vector. |
| PrimeSTAR Max DNA polymerase | Takara, Japan | R045Q | For gene cloning |
| T4 DNA ligase | NEB, United States | M0202V | Incorporate the target sequence onto the CRISPR/Cas9 vector. |
References
- Jiang, Z. H. World Bamboo and Rattan (in Chinese). , Liaoning Science and Technology Publishing House. Shenyang, China. (2002).
- Ye, S., et al. An efficient plant regeneration and transformation system of ma bamboo (Dendrocalamus latiflorus Munro) started from young shoot as explant. Frontiers in Plant Science. 8, 1298(2017).
- Ye, S., et al. Robust CRISPR/Cas9 mediated genome editing and its application in manipulating plant height in the first generation of hexaploid Ma bamboo (Dendrocalamus latiflorus Munro). Plant Biotechnology Journal. 18 (7), 1501-1503 (2020).
- Xiang, M., et al. Production of purple Ma bamboo (Dendrocalamus latiflorus Munro) with enhanced drought and cold stress tolerance by engineering anthocyanin biosynthesis. Planta. 254 (3), 50(2021).
- Huang, B., et al. An efficient genetic transformation and CRISPR/Cas9-based genome editing system for moso bamboo (Phyllostachys edulis). Frontiers in Plant Science. 13, 822022(2022).
- Lee, M. W., Yang, Y. Transient expression assay by agroinfiltration of leaves. Methods in Molecular Biology. 323, 225-229 (2006).
- Canto, T. Transient expression systems in plants: potentialities and constraints. Advances in Experimental Medicine and Biology. 896, 287-301 (2016).
- Chen, L., et al. A method for the production and expedient screening of CRISPR/Cas9-mediated non-transgenic mutant plants. Horticulture Research. 5, 13(2018).
- Sun, H., et al. A new biotechnology for in-planta gene editing and its application in promoting flavonoid biosynthesis in bamboo leaves. Plant Methods. 19 (1), 20(2023).
- He, Y., Zhang, T., Sun, H., Zhan, H., Zhao, Y. A reporter for noninvasively monitoring gene expression and plant transformation. Horticulture Research. 7 (1), 152(2020).
- Wang, C., Shen, L., Fu, Y., Yan, C., Wang, K. A simple CRISPR/Cas9 system for multiplex genome editing in rice. Journal of Genetics and Genomics. 42 (12), 703-706 (2015).
- McCormick, S., et al. Leaf disc transformation of cultivated tomato (L. esculentum) using Agrobacterium tumefaciens. Plant Cell Reports. 5 (2), 81-84 (1986).
- Lou, Y., et al. a violaxanthin de-epoxidase gene from moso bamboo, confers photoprotection ability in transgenic Arabidopsis under high light. Frontiers in Plant Science. 13, 927949(2022).
- Zhou, R., et al. Distinct cinnamoyl CoA reductases involved in parallel routes to lignin in Medicago truncatula. Proceedings of the National Academy of Sciences of the United States of America. 107 (41), 17803-17808 (2010).
- De Roeck, A., et al. Deleterious ABCA7 mutations and transcript rescue mechanisms in early onset Alzheimer's disease. Acta Neuropathologica. 134 (3), 475-487 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved