Method Article
في بلانتا التعبير الجيني وتحرير الجينات في أوراق الخيزران موسو
In This Article
Summary
في هذه الدراسة ، تم تطوير رواية في التعبير الجيني للنباتات وطريقة تحرير الجينات بوساطة Agrobacterium في الخيزران. حسنت هذه الطريقة بشكل كبير من كفاءة التحقق من صحة وظيفة الجينات في الخيزران ، والتي لها آثار كبيرة على تسريع عملية تربية الخيزران.
Abstract
تم تطوير طريقة جديدة في تحويل الجينات النباتية للخيزران ، والتي تتجنب الحاجة إلى عمليات تحريض الكالس وتجديده التي تستغرق وقتا طويلا وكثيفة العمالة. تتضمن هذه الطريقة التعبير الجيني بوساطة Agrobacterium عن طريق الجرح والفراغ لشتلات الخيزران. لقد أظهر بنجاح التعبير عن الجينات الخارجية ، مثل مراسل RUBY وجين Cas9 ، في أوراق الخيزران. تم تحقيق أعلى كفاءة تحويل لتراكم البيتالين في شتلات الياقوت باستخدام سلالة GV3101 ، بنسبة 85.2٪ بعد الإصابة. على الرغم من أن الحمض النووي الأجنبي لم يندمج في جينوم الخيزران ، إلا أن الطريقة كانت فعالة في التعبير عن الجينات الخارجية. علاوة على ذلك ، تم أيضا تطوير نظام تحرير الجينات مع مراسل أصلي باستخدام هذه الطريقة ، والتي يتم من خلالها إنشاء طفرة في الموقع بواسطة جين de-epoxidase المحرر من الخيزران (PeVDE) في أوراق الخيزران ، بمعدل طفرة يبلغ 17.33٪. أدت طفرة PeVDE إلى انخفاض قيم التبريد غير الكيميائي الضوئي (NPQ) تحت الضوء العالي ، والتي يمكن اكتشافها بدقة بواسطة مقياس الفلورومتر. هذا يجعل PeVDE المحرر مراسلا أصليا محتملا لكل من الجينات الخارجية والداخلية في الخيزران. مع مراسل PeVDE ، تم تحرير جين اختزال سينامويل-CoA بنجاح بمعدل طفرة 8.3٪. تتجنب هذه العملية عملية زراعة الأنسجة أو تحريض الكالس ، وهي سريعة وفعالة للتعبير عن الجينات الخارجية وتحرير الجينات الداخلية في الخيزران. يمكن لهذه الطريقة تحسين كفاءة التحقق من وظائف الجينات وستساعد في الكشف عن الآليات الجزيئية لمسارات التمثيل الغذائي الرئيسية في الخيزران.
Introduction
إن التحقيق في وظيفة الجينات في الخيزران يحمل وعدا كبيرا للفهم المتقدم للخيزران وإطلاق العنان لإمكاناته للتعديل الوراثي. يمكن تحقيق طريقة فعالة لذلك من خلال عملية العدوى بوساطة Agrobacterium في أوراق الخيزران ، حيث يتم إدخال جزء T-DNA الذي يحتوي على جينات خارجية في الخلايا ، مما يؤدي لاحقا إلى التعبير عن الجينات داخل خلايا الأوراق.
الخيزران هو مورد قيم ومتجدد مع مجموعة واسعة من التطبيقات في التصنيع والفن والبحث. يمتلك الخيزران خصائص خشبية ممتازة مثل القوة الميكانيكية العالية والمتانة والصلابة المعتدلة والمرونة1 ، والتي تستخدم الآن على نطاق واسع في مجموعة متنوعة من اللوازم المنزلية والصناعية ، بما في ذلك فرش الأسنان والقش والأزرار وأدوات المائدة التي تستخدم لمرة واحدة وخطوط الأنابيب تحت الأرض وحشوات برج التبريد لتوليد الطاقة الحرارية. لذلك ، تلعب تربية الخيزران دورا حاسما في الحصول على أصناف الخيزران ذات الخصائص الخشبية الممتازة لاستبدال البلاستيك وتقليل استخدام البلاستيك ، وحماية البيئة ، ومعالجة تغير المناخ ، فضلا عن توليد قيمة اقتصادية كبيرة.
ومع ذلك ، فإن تربية الخيزران التقليدية تواجه تحديات بسبب مرحلة النمو الخضري الطويلة وفترة الإزهار غير المؤكدة. على الرغم من تطوير تقنيات التربية الجزيئية وتطبيقها على تربية الخيزران ، إلا أن عملية التحول الجيني للخيزران تستغرق وقتا طويلا وتتطلب عمالة مكثفة ومعقدة بسبب عمليات تحريض الكالسوتجديده 2،3،4،5. غالبا ما يتطلب التحول الوراثي المستقر طرقا بوساطة Agrobacterium ، والتي تتضمن عمليات زراعة الأنسجة مثل تحريض الكالس وتجديده. ومع ذلك ، فإن الخيزران لديه قدرة منخفضة على تجديد الكالس ، مما يحد بشكل كبير من تطبيق التحول الجيني المستقر في الخيزران. بعد أن تصيب Agrobacterium الخلايا النباتية ، تدخل جزء T-DNA إلى الخلايا النباتية ، مع بقاء غالبية شظايا T-DNA غير مدمجة في الخلايا ، مما يؤدي إلى تعبير عابر. فقط جزء صغير من شظايا T-DNA يندمج بشكل عشوائي في كروموسومه ، مما يؤدي إلى تعبير مستقر. تظهر مستويات التعبير العابر منحنى تراكم يمكن أن يختلف لكل جين يتم التعبير عنه من الحمض النووي التائي الذي يتم تسليمه بواسطة Agrobacterium. في معظم الحالات ، تحدث أعلى مستويات التعبير بعد 3-4 أيام من التسلل وتنخفض بسرعة بعد 5-6 أيام 6,7. أظهرت الدراسات السابقة أن أكثر من 1/3rd من الطفرات في النباتات المحررة جينيا التي تم الحصول عليها دون ضغط اختيار للمقاومة تأتي من التعبير العابر ل CRISPR / Cas9 ، في حين أن الطفرات المتبقية أقل من 2/3rd تأتي من التعبير المستقر بعد دمج الحمض النووي في الجينوم8. يشير هذا إلى أن تكامل T-DNA في جينوم النبات ليس ضروريا لتحرير الجينات. علاوة على ذلك ، فإن ضغط الاختيار للمقاومة يمنع بشكل كبير نمو الخلايا غير المعدلة وراثيا ، مما يؤثر بشكل مباشر على عملية تجديد النباتات المصابة. لذلك ، باستخدام التعبير العابر دون ضغط اختيار للمقاومة في الخيزران ، من الممكن تحقيق تعبير غير متكامل للجينات الخارجية ودراسة وظيفة الجينات مباشرة في أعضاء النبات. وبالتالي ، يمكن تطوير طريقة سهلة وموفرة للوقت للتعبير الجيني الخارجي وتحريره في الخيزران9.
تتميز طريقة التعبير الجيني الخارجي وتحرير الجينات المطورة ببساطتها وفعاليتها من حيث التكلفة وعدم وجود معدات باهظة الثمن أو إجراءات معقدة9. في هذه الطريقة ، تم استخدام جين الفيولاكسانثين ديبوكسيديز الداخلي من الخيزران (PeVDE) كمراسل للتعبير الجيني الخارجي دون ضغط الاختيار. وذلك لأن PeVDE المحرر في أوراق الخيزران يقلل من قدرة الحماية الضوئية تحت الضوء العالي ويوضح انخفاضا في قيمة التبريد غير الكيميائي الضوئي (NPQ) ، والتي يمكن اكتشافها من خلال التصوير الفلوري بالكلوروفيل. لإثبات فعالية هذه الطريقة ، تم التخلص من جين داخلي آخر من الخيزران ، وهو جين اختزال cinnamoyl-CoA (PeCCR5) 9 ، باستخدام هذا النظام ونجح في توليد طفرات من هذا الجين. يمكن استخدام هذه التقنية للتوصيف الوظيفي للجينات التي لها وظائف في أوراق الخيزران. من خلال الإفراط في التعبير عن هذه الجينات بشكل عابر في أوراق الخيزران ، يمكن تحسين مستويات تعبيرها ، أو عن طريق تحرير الجينات ، يمكن هدم تعبيرها ، مما يسمح بدراسة مستويات التعبير الجيني في اتجاه مجرى النهر ، والأنماط الظاهرية للأوراق ، ومحتويات المنتج. وهذا يوفر نهجا أكثر كفاءة وجدوى لأبحاث وظائف الجينات في الخيزران. يمكن تطبيق هذه التقنية على التوصيف الوظيفي للجينات التي تعمل في أوراق الخيزران. من خلال الإفراط في التعبير عن هذه الجينات بشكل عابر في أوراق الخيزران ، يمكن تحسين مستويات تعبيرها ، أو عن طريق تحرير الجينات ، يمكن هدم تعبيرها ، مما يسمح بدراسة مستويات التعبير الجيني في اتجاه مجرى النهر ، والأنماط الظاهرية للأوراق ، ومحتويات المنتج. بالإضافة إلى ذلك ، من المهم ملاحظة أنه بسبب تعدد الصبغيات على نطاق واسع ، فإن غالبية الجينات المهمة تجاريا في جينومات الخيزران موجودة في نسخ متعددة ، مما يؤدي إلى التكرار الجيني. هذا يشكل تحديا لإجراء تحرير الجينوم المتعدد في الخيزران. قبل تطبيق التحول الجيني المستقر أو تقنيات تحرير الجينات ، من الأهمية بمكان التحقق بسرعة من وظائف الجينات. في معالجة مسألة النسخ الجينية المتعددة ، يتمثل أحد الأساليب في تحليل ملفات تعريف تعبير النسخ لتحديد الجينات التي يتم التعبير عنها بنشاط خلال مراحل محددة. علاوة على ذلك ، فإن استهداف المجالات الوظيفية المحفوظة لهذه النسخ الجينية يسمح بتصميم تسلسلات مستهدفة مشتركة أو دمج مواقع مستهدفة متعددة في نفس ناقل CRISPR / Cas9 ، مما يتيح الضربة القاضية المتزامنة لهذه الجينات. وهذا يوفر نهجا أكثر كفاءة وجدوى لأبحاث وظائف الجينات في الخيزران.
Protocol
1. تحضير شتلات الخيزران
- تحضير شتلات موسو الخيزران (Phyllostachys edulis) باستخدام البذور التي تم حصادها في قويلين ، قوانغشي ، الصين. ابدأ بنقع البذور في الماء لمدة 2-3 أيام ، مع التأكد من تغيير الماء يوميا. بعد ذلك ، قم بإنشاء ركيزة عن طريق خلط التربة والفيرميكوليت بنسبة 3: 1.
- زرع البذور المنقوعة في الركيزة للإنبات. الحفاظ على الشتلات تحت ظروف المختبر ، والحفاظ على درجة الحرارة بين 18-25 درجة مئوية. تأكد من فترة ضوئية مظلمة لمدة 16 ساعة / 8 ساعات مع شدة ضوء تبلغ 250-350 ميكرومول / م2 / ثانية خلال مرحلة الضوء.
- الحفاظ على رطوبة نسبية تبلغ حوالي 60٪. بالنسبة لعدوى Agrobacterium ، استخدم الشتلات التي يبلغ عمرها 15 يوما ويبلغ ارتفاعها 2-10 سم ، وهي أفضل مرحلة للتحول.
ملاحظة: نظرا لأن ازدهار الخيزران لا يمكن التنبؤ به ، فإن البذور غير متوفرة كل عام. عادة ما يتم تخزين البذور لمدة 2-3 سنوات عند 4 درجات مئوية في بيئة جافة ولا يزال بإمكانها الحفاظ على صلاحيتها لأكثر من 20٪.
2. إعداد البلازميدات و Agrobacterium
- البلازميدات: للتحقق من صحة تأثير التعبير العابر، استخدم بنية pHDE-35S::RUBY التي تحتوي على جين مراسل مرئي مدفوع بواسطة مروج CaMV 35S 10. لتحرير الجينات ، استخدم بنية pCambia1300-Ubi::Cas9 ، والتي تحمل جين Cas9 الذي يقوده مروج الذرة Ubi 11. أدخل التسلسلات التوجيهية sgRNA ل PeVDE والجينات المستهدفة الأخرى بين موقعي AarI في pCambia1300-Ubi::Cas9 build9.
- أدخل تسلسل الحمض النووي الريبي لدليل CRISPR / Cas9 بين موقعي نوكلياز تقييد AarI لبناء pCambia1300-Ubi::Cas9 ، بما في ذلك الجينات المستهدفة PeVDE و PeCCR5 .
- أضف GGCA إلى نهاية 5 'من تسلسل 20 نيوكليوتيد وقم بتوليف تسلسل DNA أحادي الشريط. استكمل عكسيا تسلسل 20 نيوكليوتيد وأضف AAAC إلى نهاية 5 '، ثم قم بتجميع تسلسل DNA آخر أحادي الشريط.
- قم بتخفيف كل من تسلسل الحمض النووي أحادي الشريط إلى تركيز 10 نانومتر / لتر في الماء المخفف ، واخلطه جيدا ، وقم بتسخينه عند 95 درجة مئوية لمدة 5 دقائق. اترك الخليط يبرد إلى درجة حرارة الغرفة ، مما يؤدي إلى تكوين محولات مزدوجة تقطعت بهم السبل.
- قم بتوصيل المحولات بجزء pCambia1300-Ubi::Cas9 الخطي الذي تم هضمه بواسطة نوكلياز AarI باستخدام T4 DNA ligase وتسلسل ناقل CRISPR / Cas9 المبني للحصول على بنية استهداف الجينات المطلوبة.
- لتحويل البلازميدات إلى Agrobacterium ، استخدم طريقة التجميد والذوبان على النحو التالي: امزج 1 ميكرولتر من البلازميدات (التركيز: 10 - 1000 نانوغرام / ميكرولتر) مع 100 ميكرولتر من الخلايا ذات الكفاءة الزراعية (كفاءة الترجمة: > 1 × 104 وحدات تشكيل مستعمرة / ميكروغرام) واخلطها برفق. ضع الخليط على الثلج لمدة 5 دقائق. انقل الخليط إلى النيتروجين السائل لمدة 5 دقائق.
- يذوب المزيج في حمام مائي على حرارة 37 درجة مئوية لمدة 5 دقائق. أضف 500 ميكرولتر من وسط Luria-Bertani (LB) إلى الخليط واحتضانه على حاضنة اهتزاز عند 28 درجة مئوية عند 200 دورة في الدقيقة لمدة 2-3 ساعات. بالنسبة لبلازميدات الياقوت pHDE-35S::RUBY، أدخلها كل على حدة في سلالات AGL1 وGV3101 و LBA4044 وEHA105 من البكتيريا الزراعية tumefaciens (A. tumefaciens)12. بالنسبة لبلازميدات كريسبر / كاس9 ، أدخلها في سلالة GV3101 من A. tumefaciens.
- تنمو Agrobacterium في وسط مستخلص الخميرة الببتون (YEP) (10 جم من مستخلص اللحم البقري ، و 10 جم من خلاصة الخميرة ، و 5 جم من كلوريد الصوديوم لكل لتر) مع المضادات الحيوية المقابلة (سبكتينومايسين ل 35S::RUBY وكاناميسين ل CRISPR / Cas9) عند 28 درجة مئوية. لوحظت المستعمرات الفردية بعد 36-48 ساعة من الزراعة.
- اختر ونقل المستعمرات إلى وسط YEP السائل (مع المضادات الحيوية المقابلة) لمزيد من النمو. بعد 24-36 ساعة ، استخدم بادئات RUBY-F و RUBY-R (الجدول 1) لإجراء تفاعل البوليميراز المتسلسل لتأكيد النقل الناجح للبلازميدات إلى Agrobacterium.
- انقل 1 مل من Agrobacterium المحول بنجاح إلى 100 مل من وسط YEP السائل الطازج (مع المضادات الحيوية المقابلة) ثم تنمو بين عشية وضحاها عند 28 درجة مئوية إلىOD 600 من 0.8.
- أجهزة الطرد المركزي التعليق البكتيري عند 4000 × جم لمدة 5 دقائق عند 4 درجات مئوية ، اغسل الحبيبات البكتيرية مرة واحدة باستخدام وسط تسلل معلقات (10 mM MgCl2 و 10 mM MES-KOH [درجة الحموضة 5.6]) ، ثم الطرد المركزي مرة أخرى. أعد تعليق الحبيبات البكتيرية في وسط تسلل معلق إلىOD 600 من 0.6 لتحويل الخيزران.
3. Agrobacterium بوساطة في نظام تحويل النبات
- الاستعداد للتحول ؛ قم بإزالة الشتلات بعناية ذات الجذور المرتبطة بالتربة من الركيزة ، مما يضمن بقاء الجذور سليمة. لف الشتلات بورق القصدير للحفاظ على الرطوبة ومنع انفصال التربة (الشكل 1 أ).
- انقل الشتلات المغلفة إلى بيئة ذات رطوبة أعلى (رطوبة هواء نسبية >90٪) وإضاءة أقل (كثافة أقل من 50 ميكرومول / م2 / ثانية) لمدة ساعتين.
- باستخدام إبرة حادة من حقنة ، قم بجرح الجزء العلوي من الأوراق غير الناضجة المجعدة (حوالي 1-2 سم من الأعلى) من شتلات الخيزران مرة أو مرتين (كما هو موضح في المثلثات الحمراء في الشكل 1 أ).
- بعد ذلك ، اغمس الجزء العلوي المصاب من الشتلات في معلقات Agrobacterium. قم بإجراء العملية بأكملها ، من الجرح إلى الغمس في Agrobacterium بسرعة ، لأن الجرح الجديد سيزيد من كفاءة التلقيح.
- نقل الشتلات على الفور إلى غرفة فراغ مع ضغط 25-27 مم زئبق لمدة 2 دقيقة (الشكل 1B).
- بعد التنظيف بالمكنسة الكهربائية ، قم بفك الشتلات بعناية وإعادة زرعها في الركيزة. ضع الشتلات في ضوء خافت أو ظلام (<50 ميكرومول / م2 / ثانية) مع رطوبة عالية (RH>90٪) في درجة حرارة الغرفة (18-25 درجة مئوية) لمدة يومين. بعد ذلك ، قم بزراعة الشتلات في ظل ظروف النمو الطبيعية ، وسقيها كل 5-7 أيام. راقب أنماطها الظاهرية لتوفير المواد اللازمة للتجارب اللاحقة.
4. تصميم دليل واحد RNAs (sgRNAs) لتحرير الجينات
- تحديد موقع الشكل المجاور للفضاء الأولي (PAM) الموجود بالقرب من مجال محدد ومحفوظ لتسلسل الجينات المستهدف. تأكد من أن تسلسل PAM المحدد هو NGG في نظام CRISPR / Cas9 هذا. تحقق من الخصوصية على الهدف للتسلسل المحدد عن طريق إجراء بحث BlastN مقابل قاعدة بيانات جينوم الخيزران. تأكد من أن sgRNA فريد من نوعه ، خاصة في منطقة المنبع وعلى مقربة من PAM 9,11.
ملاحظة: ستقلل هذه المقارنة بشكل فعال من المواقع المحتملة خارج الهدف في الجينوم المتأثرة بعملية تحرير الجينات. - صمم اثنين من sgRNAs (sgRNA-1 و sgRNA-2) على أول إكسون لجين PeVDE 13. قم بتضمين مواقع تقييد العمرI في المنبع من PAM في مواقع تقييد sgRNA-1 و XbaI في المنبع من PAM في sgRNA-2. صمم sgRNA واحدا على الإكسون الرابع من جين PeCCR5 ، والذي يشفر الشكل المحفوظ ل KNWYCYGK. هذا الشكل أمر بالغ الأهمية لتحفيزCCRs 14.
- صمم تسلسل فاصل 20 نيوكليوتيد مجاور لموقع PAM. سيوجه هذا التسلسل المباعد إنزيم Cas9 إلى الموقع المستهدف لانقسام الحمض النووي وتحرير الجينات اللاحق.
ملاحظة: من المستحسن اختيار منطقة مستهدفة في المنبع من موقع انشقاق إنزيم النوكلياز الداخلي داخل موقع PAM. هذا سيسهل التحقق من كفاءة تحرير الجينات.
5. تصميم التمهيدي و PCR
- تصميم بادئات محددة يدويا لتضخيم شظايا PeVDE و PeCCR5 . صمم بادئات المنبع والمصب لتكون موجودة على الأقل 100 نقطة أساس خارج الموقع المستهدف ، مع اختلاف في الطول يزيد عن 100 نقطة أساس للسماح بفصل النطاق المميز أثناء الرحلان الكهربائي. تصميم الاشعال لتضخيم روبي داخل أول 500 bp من الجين. يتم توفير قائمة بجميع الاشعال المستخدمة في الجدول 1.
- استخدم بوليميراز الحمض النووي عالي الدقة لتفاعل البوليميراز المتسلسل. في هذه الحالة ، استخدم بوليميراز الحمض النووي بدقة عالية وتضخيم فعال في استنساخ الجينات.
- تحضير خليط تفاعل PCR على النحو التالي: 5x عازلة (Mg2+ Plus): 4 ميكرولتر ؛ خليط dNTP (2.5 مللي متر لكل منهما): 1.6 ميكرولتر ؛ الاشعال الأمامية والخلفية (10 مساء لكل منهما): 1 ميكرولتر لكل منهما ؛ الحمض النووي لجينوم الخيزران (حوالي 50 نانوغرام) ؛ بوليميراز الحمض النووي (2.5 وحدة / ميكرولتر): 0.2 ميكرولتر ؛ تمييع الماء إلى حجم إجمالي قدره 20 ميكرولتر.
- اتبع ظروف تشغيل PCR: تمسخ أولي عند 98 درجة مئوية لمدة 5 دقائق ؛ تمسخ عند 98 درجة مئوية لمدة 10 ثوان ؛ التلدين عند 56 درجة مئوية لمدة 5 ثوان ؛ تمديد عند 72 درجة مئوية لمدة 30 ثانية ؛ كرر تمسخ لتمديد لمدة 32 دورة ؛ التمديد النهائي عند 72 درجة مئوية لمدة 5 دقائق ؛ يمسك عند 4 درجات مئوية إلى أجل غير مسمى.
ملاحظة: يتم توفير شروط تفاعل البوليميراز المتسلسل كمثال وقد تحتاج إلى تحسينها لتطبيقات أو أهداف محددة.
6. استخراج الحمض النووي ، هضم إنزيم النوكلياز الداخلي ، والتسلسل
- افصل المنطقة ذات قيم NPQ المنخفضة عن شفرات أوراق الخيزران الطازجة باستخدام المقص ، كما هو محدد بواسطة مقياس الفلور التصوير - PAM (راجع الخطوة 7.4). قم بتجميد عينات الأوراق بالنيتروجين السائل وانقل عينات الأوراق المجمدة إلى ملاط. قم بطحن العينات إلى مسحوق ناعم باستخدام مدقة ، مع إضافة ما يكفي من النيتروجين السائل أثناء عملية الطحن. تساعد هذه الخطوة في إطلاق المحتوى الخلوي ، بما في ذلك الحمض النووي.
- استخرج الحمض النووي الجينومي من الورقة المسحوقة باستخدام طريقة سيتيل تريميثيل أمونيوم بروميد الأمونيوم (CTAB). أضف 50 مجم من عينات مسحوق الأوراق إلى 800 ميكرولتر من محلول CTAB بنسبة 2٪. امزج العينة جيدا واحتضانها على حرارة 65 درجة مئوية لمدة 30 دقيقة ، مع رج لطيف كل 5 دقائق.
- أضف كمية متساوية من كحول الكلوروفورم / الأيزو أميل (24: 1 ، v / v) ورج الخليط بقوة. بعد الطرد المركزي عند 8000 جم لمدة 8 دقائق ، انقل المادة الطافية إلى أنبوب جديد.
- أضف حجما متساويا من كحول الكلوروفورم / الأيزو أميل وكرر الخطوة 6.3. أضف كمية متساوية من الأيزوبروبانول المثلج ، واقلب الأنبوب عدة مرات قبل وضعه عند -20 درجة مئوية لمدة 30 دقيقة. بعد الطرد المركزي عند 8000 × جم لمدة 5 دقائق ، تخلص من المادة الطافية.
- اغسل حبيبات الحمض النووي 2x بإيثانول 75٪ عند 4 درجات مئوية ، ثم قم بإذابة 50 ميكرولتر من الماء.
- تضخيم الحمض النووي الجينومي الذي يحتوي على الموقع المستهدف للجينات المستهدفة من كل من أوراق الخيزران من النوع البري والبكتيريا الزراعية المصابة بالبروتوكول في الخطوة 5.4.
- أداء هضم إنزيم النوكلياز الداخلي لمنتجات PCR. حدد إنزيما معينا يتعرف على مواقع التقييد المطلوبة داخل شظايا الحمض النووي المضخمة. استخدم النوكليازات الداخلية من العمرالأول و XbaI للهضم.
- تحضير خليط تفاعل يتكون من العمرI أو XbaI (20 وحدة / ميكرولتر) - 1 ميكرولتر ، 1 ميكروغرام من منتجات تفاعل البوليميراز المتسلسل ، 10x buffer- 5 ميكرولتر ، وإضافة الماء إلى حجم إجمالي قدره 50 ميكرولتر. احتضان عند 37 درجة مئوية لمدة 1 ساعة.
- تحليل نسبة شظايا الحمض النووي المهضومة باستخدام هلام الكهربائي. قارن الشظايا المهضومة من العينات البرية والمصابة بالبكتيريا الزراعية لتقييم كفاءة تحرير الجينات.
- ضع علامة على تسلسل محول transposase TCGTCGGCAGCGTCAGATGTGTATAAGAGACAG و GTCTCGTGGGCTCGGAGATGTGTATAAGAGACAG إلى نهاية 5 'من البادئات الأمامية والخلفية ، على التوالي ، لتضخيم شظايا PeVDE و PeCCR5 9,15. استخدم البروتوكول الموضح في الخطوة 5.4 للتضخيم. تحضير منتجات PCR (قبل الهضم) للتسلسل العميق.
7. قياس مضان الكلوروفيل لقيم NPQ في الأوراق
- قبل القياسات ، قم بتعريض شتلات الخيزران لظروف شدة ضوء عالية تبلغ 1200 ميكرومول / م2 / ثانية لمدة ساعتين. يزيد هذا التعرض من كمية الضوء الممتص وينشط نظام الحماية الضوئية في الأوراق.
- استخدم مقياس فلورو التصوير PAM لقياس مضان الكلوروفيل PS II في الجسم الحي لأوراق الخيزران. اضبط شدة الضوء الأكتيني على 800 ميكرومول / م2 / ثانية لقياسات مضان لمدة 6 دقائق. خلال هذه الفترة ، ضع نبضة مشبعة كل 30 ثانية للحصول على منحنيات مضان الكلوروفيل. سيتم استخدام القيم المستقرة للمنحنيات للحسابات13.
- احسب التبريد غير الكيميائي الضوئي (NPQ) باستخدام الصيغة:
NPQ = (F m - F m') / F m'
حيث يمثل F m الحد الأقصى للتألق في الحالة المتكيفة مع الظلام ، ويمثل Fm الحد الأقصى للتألق في أي حالة متكيفة مع الضوء. - راقب قيم NPQ من الواجهة المرئية لبرنامج التصوير. يسمح البرنامج بالتحليل في الوقت الحقيقي وعرض بيانات التألق ، بما في ذلك قيم NPQ.
النتائج
Agrobacterium بوساطة في التعبير الجيني بلانتا في أوراق الخيزران
وقد ثبت أن جين مراسل روبي فعال في تصور التعبير الجيني العابر بسبب قدرته على إنتاج بيتالين أحمر زاهي من التيروزين10. في هذه الدراسة ، تم استخدام التحول بوساطة Agrobacterium للتعبير بشكل عابر عن جين RUBY الخارجي في أوراق الخيزران (الشكل 1). في3 أيام بعد الإصابة ، لوحظ اللون الأحمر في الأوراق المطوية غير الناضجة ، والتي أصبحت أكثر حيويةفي اليوم الخامس بمجرد أن تكشفت الأوراق (مثلث أزرق ، الشكل 1 ج). توضح هذه النتائج أن Agrobacterium نجحت في التوسط في التعبير عن جين RUBY الخارجي في أوراق الخيزران وأن تخليق betalain حدث.
علاوة على ذلك ، تمت مقارنة أربع سلالات من Agrobacterium (AGL1 و LBA4404 و EHA105 و GV3101) ووجدت أن سلالة GV3101 تسببت في تراكم البيتالين الأكثر أهمية في أوراق الخيزران المصابة ، مع أعلى نسبة 85.2٪ من الشتلات المتراكمة باليتالين بعد الإصابة ، تليها AGL1 (76.9٪) ثم EHA105 (49.1٪) و LBA4404 (31.3٪ ؛ الشكل 1 د). هذا يشير إلى أن GV3101 هو السلالة الأنسب لهذا الغرض. تم إجراء تفاعل البوليميراز المتسلسل عالي الدقة لاكتشاف ما إذا كان جزء T-DNA بوساطة Agrobacterium قد اندمج في كروموسوم الخيزران. بعد 40 دورة من تفاعل البوليميراز المتسلسل ، لم يتم الكشف عن أي نطاقات من جين RUBY ، مما يشير إلى أن جزء T-DNA لم يندمج أو تم دمجه في عدد منخفض بحيث لا يمكن اكتشافه. وهكذا ، خلصت هذه النتائج إلى أن هذا التعبير الجيني عابر.
بشكل عام ، توضح هذه النتائج جدوى عابر بوساطة Agrobacterium في التعبير الجيني للنبات في الخيزران باستخدام جين مراسل RUBY . ومع ذلك ، تم العثور على لون betalain الأحمر غير مستقر واختفى بعد 3 أشهر من الإصابة ، مما يشير إلى أن نظام التعبير العابر غير مستقر للمراقبة على المدى الطويل.
في تحرير الجينات النباتية لجين الخيزران فيولاكسانثين دي إيبوكسيديز (PeVDE)
Agrobacterium بوساطة في التعبير الجيني لبلانتا هي طريقة عابرة للتعبير الجيني في الخيزران. للتحقق مما إذا كان نظام CRISPR / Cas9 العابر يمكن أن يحقق تحرير الجينات في أوراق الخيزران ، تم اختيار الإنزيم الرئيسي في دورة زانثوفيل الخيزران ، فيولاكسانثين دي إيبوكسيديز (PeVDE) ، كهدف لتحرير الجينات التجريبية. تم تصميم الحمض النووي الريبي أحادي الدليل (sgRNAs) على أول إكسون لجين PeVDE (sgRNA-1) ، والذي يحتوي على مواقع تقييد من العمرالأول في المنبع من الشكل المجاور للفضاء الأولي (PAM) لتسهيل التحقق من صحة تحرير الجينات (الشكل 2 أ).
تم نقل بنية CRISPR / Cas9 التي تحمل sgRNA-1 إلى Agrobacterium لتحويل أوراق الخيزران. بعد إصابة Agrobacterium التي تحتوي على تركيبات CRISPR / Cas9 التي تحمل sgRNA-1 لمدة 5 أيام ، تعرضت شتلات الخيزران لمعالجة الضوء العالي ، وبعد ذلك ، تم الكشف عن معلمة مضان الكلوروفيل. تم العثور على مناطق معينة من شفرات الأوراق التي تحتوي على قيم تبريد غير كيميائية ضوئية (NPQ) أقل (الشكل 2B) ، مما يشير إلى أن قدرة الحماية الضوئية لهذه المناطق قد انخفضت تحت الضوء الشديد. نظرا لأن جين PeVDE لديه القدرة على تبديد الطاقة الضوئية الزائدة الممتصة13 ، فمن المحتمل أن تكون هذه المناطق ذات قيم NPQ المنخفضة هي المناطق التي تم فيها تحرير جين PeVDE. بعد ذلك ، تم إجراء هضم الإنزيم وتحليل التسلسل لجزء جين PeVDE في هذه المناطق من شفرات الأوراق (الشكل 2C-D) ووجد أن معدل طفرة sgRNA-1 كان 17.33٪ ، مما يشير إلى أن تحرير الجينات كان ناجحا في هذه المناطق من جين PeVDE.
بالإضافة إلى ذلك ، تم تصميم موقع استهداف sgRNA آخر ، sgRNA-2 ، يحتوي على موقع تقييد XbaI ، على أول إكسون من PeVDE. للتحقيق في إمكانية حذف الشظايا الطويلة مع استهداف sgRNA المزدوج ، تم إجراء تحرير الجينات في كلا الموقعين المستهدفين ، مما أدى إلى حذف شظية طويلة (الشكل 2E).
تم استخدام طفرة PeVDE المحررة كمراسل في نظام تحرير الجينات العابرة
تم التحقيق فيما إذا كان PeVDE sgRNA يمكن أن يعمل كمراسل في نظام تحرير الجينات العابر. تم اختيار جين اختزال سينامويل-CoA (PeCCR5) (معرف الجين: PH02Gene42984.t1) عشوائيا ، لتقييم مراسل PeVDE . تم تصميم هدف sgRNA واحد ل PeCCR5 في شكله المحفوظ على الإكسون الرابع. تم تحويل بنية CRISPR / Cas9 التي تحمل كلا من sgRNAs و PeVDE و PeCCR5 إلى أوراق الخيزران (الشكل 3 أ).
بعد الإصابة بالبكتيريا الزراعية لمدة 30 يوما ، عولجت الشتلات بضوء عالي الكثافة لمدة 20 دقيقة. لوحظ أن مناطق الأوراق التي تم تحريرها فقط لجين PeCCR5 لم يكن لها أي تأثير على قيم NPQ ، في حين أن مناطق الأوراق التي تم نقلها بواسطة sgRNAs لكل من PeVDE و PeCCR5 أظهرت قيم NPQ أقل (الشكل 3B).
بعد ذلك ، تم تضخيم جزء PeCCR5 من مناطق الأوراق ذات قيم NPQ المنخفضة وتسلسلها ووجد كفاءة طفرة بنسبة 8.3٪ باستخدام التسلسل العميق. لذلك ، عمل مراسل PeVDE بنجاح كمراسل عابر لتحرير الجينات ويمكن استخدامه لفحص تحرير الجينات لجينات الخيزران الداخلية الأخرى.
بشكل عام ، توضح هذه النتائج جدوى تحرير جينات الخيزران باستخدام CRISPR / Cas9 في الخيزران.
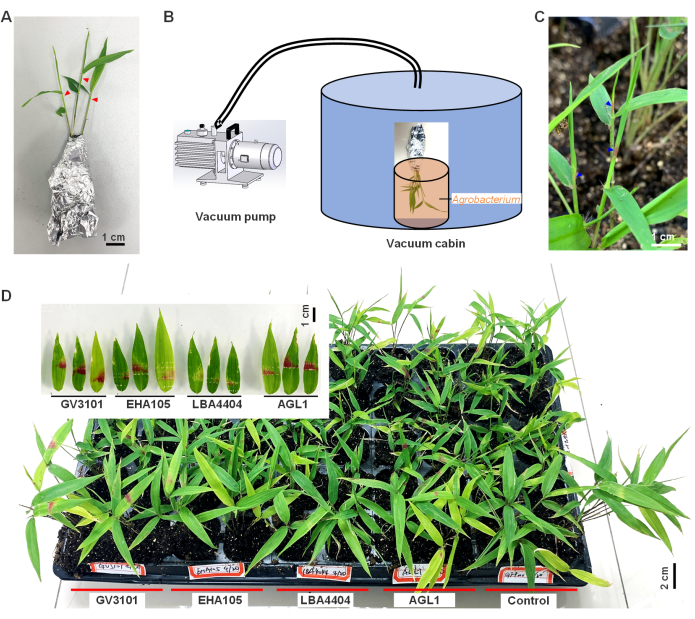
الشكل 1: في تعبير النبات عن جين الياقوت وتراكم البيتالين في أوراق خيزران الموسو. (أ) شتلات خيزران موسو ملفوفة بورق القصدير وجاهزة للعدوى بالبكتيريا الزراعية ، مع مثلثات حمراء تشير إلى المواضع التي أصيبت بإبرة حادة من حقنة. (ب) عملية التسلل الفراغي لشتلات الخيزران. (ج) تراكم بيتالين في أوراق الخيزران بعد 3 أيام من الإصابة التي لوحظت من خلال التغيرات المظهرية. (د) هنا ، تم إجراء أربع سلالات من Agrobacterium ، AGL1 و LBA4404 و EHA105 و GV3101 بوساطة التحول الجيني RUBY في أوراق الخيزران. تم استخدام GV3101 الذي يؤوي بنية GFP كعنصر تحكم سلبي. تم تعديل هذا الرقم من9. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: في تعبير النبات والتحرير الجيني لجين PeVDE في أوراق الخيزران. (أ) معلومات الموقع والتسلسل المستهدف ل sgRNA في جين PeVDE. تشير المثلثات الحمراء إلى مواضع البادئات الأمامية والخلفية لتضخيم الشظايا. (ب) NPQ والتصوير الخام لأوراق الخيزران بعد الإصابة. تمثل الأرقام الموجودة في صورة NPQ قيم NPQ في شاشة برنامج التصوير. (ج) نتائج الرحلان الكهربائي لجزء PeVDE قبل وبعد عملية الهضم في العمرالأول. يشير WT إلى الأوراق البرية غير المصابة ، و + و - تمثل شظايا PeVDE مع أو بدون هضم العمرالأول ، على التوالي. (د) نتائج التسلسل العميق لجزء PeVDE في أوراق قيمة NPQ المنخفضة. تمثل الخطوط الحمراء والزرقاء والرمادية في التسلسلات المواقع المستهدفة و PAM والإدخالات على التوالي. تشير الشرطات الحمراء إلى النيوكليوتيدات المحذوفة. (ه) نتائج تسلسل سانجر لجزء PeVDE بعد تحريره بواسطة كل من sgRNA-1 و sgRNA-2. تم تعديل هذا الرقم من9. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: PeVDE sgRNA كمراسل لفحص التحرير الجيني ل PeCCR5. (أ) التمثيل التخطيطي لتركيبات كريسبر/كاس 9 التي تحتوي على PeVDE وPeCCR5 sgRNAs. (ب) NPQ والصور الخام لأوراق الخيزران بعد الإصابة بالتركيبات في (A). تشير المثلثات البيضاء إلى المناطق ذات قيم NPQ الأقل. يمثل لون قوس قزح قيمة NPQ / 4 ، حيث يتوافق اللون الأحمر مع القيمة الدنيا ويتوافق اللون الأرجواني مع 1. (ج) تمثل الخطوط الحمراء والزرقاء والرمادية في التسلسلات المواقع المستهدفة و PAM والإدخالات ، على التوالي. تشير الشرطات الحمراء إلى النيوكليوتيدات المحذوفة. تم تعديل هذا الرقم من9. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| اسم الجين | تسلسل التمهيدي (5'-3') | تطبيق | ||
| ياقوت | F: ATGGATCATGCGACCCTCG | لتضخيم PCR في أوراق الخيزران المصابة | ||
| R: GTACTCGTAGAGCTGCTGCAC | ||||
| بيفي دي | F: TGTGGCTTCTAAAGCTCTGCAATCT | لاستنساخ الجينات وتسلسلها | ||
| R: TGTCAATGCTACAAGTCCTGGCA | ||||
| PeVDE-الهدف1 | F: GGCATAGCCCTCACGCAGCACCGG | لتصميم هدف PeVDE sgRNA-1 | ||
| R: AAACCCGGTGCTGCGTGAGGGCTA | ||||
| PeVDE-Target2 | F: GGCACTCCACGGTCCCAAATCTAG | لتصميم هدف PeVDE sgRNA-2 | ||
| R: AAACCTAGATTTGGGGGGGTGGAG | ||||
| PeCCR5-الهدف | F: GGCACTGGTACTGCTACGCTAAGA | لتصميم هدف PeCCR5 sgRNA | ||
| R: AAACTCTTAGCGTAGCAGTACCAG | ||||
الجدول 1: معلومات تسلسل الاشعال.
Discussion
تقلل هذه الطريقة بشكل كبير من الوقت المطلوب مقارنة بطرق التحول الجيني التقليدية ، والتي تستغرق عادة 1-2 سنوات ، وتحقق تعبيرا عابرا عن الجينات الخارجية وتحرير الجينات للجينات الداخلية في غضون 5 أيام. ومع ذلك ، فإن هذه الطريقة لها قيود لأنها لا يمكنها تحويل سوى نسبة صغيرة من الخلايا ، والأوراق المعدلة جينيا وهمية وتفتقر إلى القدرة على التجدد إلى نباتات كاملة. ومع ذلك ، فإن هذا في التعبير الجيني للنباتات وتكنولوجيا تحرير الجينات يوفر نهجا قويا للتحقق الوظيفي من جينات الخيزران الداخلية.
حاليا ، في بلانتا ، لا يمكن إجراء تقنية التعبير الجيني وتحرير الجينات إلا في الأوراق غير الناضجة (المجعدة) ، وليس في الأوراق الناضجة. مع تكشف الأوراق وتكبيرها ، يزداد عدد الخلايا المحررة جينيا التي تخضع للانقسام ، مما يسمح بتحرير الجينات في مناطق أوراق معينة. ومع ذلك ، فإن طريقة التحول بوساطة Agrobacterium المستخدمة لا تؤدي إلى إدخال الحمض النووي التائي الخارجي في كروموسوم الخيزران ، مما يجعل من الصعب استخدام جينات علامة مستقرة في الخيزران 6,9. لذلك ، من الصعب تحديد المواقع الدقيقة لهذه المناطق. لمعالجة هذا الأمر ، تم تحرير جين PeVDE ، وأظهرت المنطقة المحررة قدرة منخفضة على الحماية الضوئية تحت المعالجة بالضوء العالي ، كما يتضح من انخفاض قيم NPQ ، والتي يمكن اكتشافها بسهولة باستخدام تصوير مقياس فلوروفيل - PAM. وهكذا ، تم تطوير PeVDE كعلامة في الخيزران للكشف عن حدوث التعبير الجيني الخارجي وتحرير الجينات. نظرا للحفظ العالي لهذا الجين عبر الأنواع المختلفة 13 ، يمكن أيضا تطبيقه على نطاق واسع على النباتات الأخرى.
بسبب ترسب طبقة الشمع الجلدية على بشرة أوراق الخيزران ، إلى جانب التشكل المميز المجعد والملفوف بإحكام للأوراق غير الناضجة ، فإن إمكانية وصول Agrobacterium إلى خلايا الأوراق تعوق بشكل كبير. من أجل تحسين فعالية عدوى Agrobacterium ، تم استخدام الأساليب الفيزيائية ، بما في ذلك تسلل الجروح والفراغ ، لتعزيز دخول Agrobacterium إلى أوراق الخيزران المجعدة المغلقة. تتيح هذه العملية القرب الوثيق بين Agrobacterium وخلايا الأوراق ، وبالتالي تعزيز كفاءة التحول الجيني. وفي الوقت نفسه ، اقتصر نظام تحرير الجينات هذا حتى الآن على أوراق الخيزران ولا يمكن التعبير عنه في الأعضاء ذات القدرة الإنجابية ، مثل البذور والبراعم الجانبية التي يمكن أن يرثها الجيل التالي. سيتم تحسين التطبيقات المستقبلية لهذه التقنية لتحقيق التعبير الجيني في النبات وتكنولوجيا تحرير الجينات في الأعضاء ذات القدرة الإنجابية ، بهدف الحصول على نباتات متجددة وراثية ثابتة.
Disclosures
يعلن أصحاب البلاغ أنه ليس لديهم مصالح متنافسة.
Acknowledgements
يود المؤلفون أن يشكروا البرنامج الوطني للبحث والتطوير الرئيسي في الصين (المنحة رقم 2021YFD2200502) ، والمؤسسة الوطنية للعلوم الطبيعية في الصين (المنحة رقم 31971736) على الدعم المالي.
Materials
| Name | Company | Catalog Number | Comments |
| 35S::RUBY | Addgene, United States | 160908 | Plamid construct |
| Agrobacterium competent cells of GV3101, EHA105,LBA4404, and AGL1 | Biomed, China | BC304-01, BC303-01, BC301-01, and BC302-01 | For Agrobacterium infection |
| CTAB | Sigma-Aldrich, United States | 57-09-0 | DNA extraction |
| Imaging-PAM fluorometer | Walz, Effeltrich, Germany | Detect chlorophyll fluorescence of bamboo leaves | |
| ImagingWin | Walz, Effeltrich, Germany | Software for Imaging-PAM fluorometer | |
| Paq CI or Aar I | NEB, United States | R0745S | Incorporate the target sequence onto the CRISPR/Cas9 vector. |
| PrimeSTAR Max DNA polymerase | Takara, Japan | R045Q | For gene cloning |
| T4 DNA ligase | NEB, United States | M0202V | Incorporate the target sequence onto the CRISPR/Cas9 vector. |
References
- Jiang, Z. H. World Bamboo and Rattan (in Chinese). , Liaoning Science and Technology Publishing House. Shenyang, China. (2002).
- Ye, S., et al. An efficient plant regeneration and transformation system of ma bamboo (Dendrocalamus latiflorus Munro) started from young shoot as explant. Frontiers in Plant Science. 8, 1298(2017).
- Ye, S., et al. Robust CRISPR/Cas9 mediated genome editing and its application in manipulating plant height in the first generation of hexaploid Ma bamboo (Dendrocalamus latiflorus Munro). Plant Biotechnology Journal. 18 (7), 1501-1503 (2020).
- Xiang, M., et al. Production of purple Ma bamboo (Dendrocalamus latiflorus Munro) with enhanced drought and cold stress tolerance by engineering anthocyanin biosynthesis. Planta. 254 (3), 50(2021).
- Huang, B., et al. An efficient genetic transformation and CRISPR/Cas9-based genome editing system for moso bamboo (Phyllostachys edulis). Frontiers in Plant Science. 13, 822022(2022).
- Lee, M. W., Yang, Y. Transient expression assay by agroinfiltration of leaves. Methods in Molecular Biology. 323, 225-229 (2006).
- Canto, T. Transient expression systems in plants: potentialities and constraints. Advances in Experimental Medicine and Biology. 896, 287-301 (2016).
- Chen, L., et al. A method for the production and expedient screening of CRISPR/Cas9-mediated non-transgenic mutant plants. Horticulture Research. 5, 13(2018).
- Sun, H., et al. A new biotechnology for in-planta gene editing and its application in promoting flavonoid biosynthesis in bamboo leaves. Plant Methods. 19 (1), 20(2023).
- He, Y., Zhang, T., Sun, H., Zhan, H., Zhao, Y. A reporter for noninvasively monitoring gene expression and plant transformation. Horticulture Research. 7 (1), 152(2020).
- Wang, C., Shen, L., Fu, Y., Yan, C., Wang, K. A simple CRISPR/Cas9 system for multiplex genome editing in rice. Journal of Genetics and Genomics. 42 (12), 703-706 (2015).
- McCormick, S., et al. Leaf disc transformation of cultivated tomato (L. esculentum) using Agrobacterium tumefaciens. Plant Cell Reports. 5 (2), 81-84 (1986).
- Lou, Y., et al. a violaxanthin de-epoxidase gene from moso bamboo, confers photoprotection ability in transgenic Arabidopsis under high light. Frontiers in Plant Science. 13, 927949(2022).
- Zhou, R., et al. Distinct cinnamoyl CoA reductases involved in parallel routes to lignin in Medicago truncatula. Proceedings of the National Academy of Sciences of the United States of America. 107 (41), 17803-17808 (2010).
- De Roeck, A., et al. Deleterious ABCA7 mutations and transcript rescue mechanisms in early onset Alzheimer's disease. Acta Neuropathologica. 134 (3), 475-487 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved