Method Article
A Planta Espressione genica e editing genico nelle foglie di bambù Moso
In questo articolo
Riepilogo
In questo studio, nel bambù è stato sviluppato un nuovo metodo di espressione genica e di editing genetico mediato da Agrobacterium . Questo metodo ha notevolmente migliorato l'efficienza della convalida della funzione genica nel bambù, il che ha implicazioni significative per l'accelerazione del processo di selezione del bambù.
Abstract
Per il bambù è stato sviluppato un nuovo metodo di trasformazione genica delle piante, che evita la necessità di processi di induzione e rigenerazione del callo che richiedono tempo e lavoro. Questo metodo prevede l'espressione genica mediata da Agrobacterium tramite ferimento e vuoto per le piantine di bambù. Ha dimostrato con successo l'espressione di geni esogeni, come il reporter RUBY e il gene Cas9, nelle foglie di bambù. La più alta efficienza di trasformazione per l'accumulo di betalaina nelle piantine RUBY è stata raggiunta utilizzando il ceppo GV3101, con una percentuale dell'85,2% dopo l'infezione. Sebbene il DNA estraneo non si sia integrato nel genoma del bambù, il metodo è stato efficiente nell'esprimere i geni esogeni. Inoltre, è stato sviluppato anche un sistema di editing genetico con un reporter nativo che utilizza questo metodo, da cui è stato generato un mutante in situ generato dal gene modificato della violaxantina de-epossidasi di bambù (PeVDE) in foglie di bambù, con un tasso di mutazione del 17,33%. La mutazione di PeVDE ha portato a una diminuzione dei valori di tempra non fotochimica (NPQ) in condizioni di luce elevata, che possono essere rilevati con precisione da un fluorimetro. Questo rende il PeVDE modificato un potenziale reporter nativo sia per i geni esogeni che per quelli endogeni nel bambù. Con il reporter di PeVDE, un gene della cinnamoil-CoA reduttasi è stato modificato con successo con un tasso di mutazione dell'8,3%. Questa operazione evita il processo di coltura tissutale o induzione del callo, che è rapido ed efficiente per l'espressione di geni esogeni e l'editing genetico endogeno nel bambù. Questo metodo può migliorare l'efficienza della verifica della funzione genica e aiuterà a rivelare i meccanismi molecolari delle principali vie metaboliche nel bambù.
Introduzione
Lo studio della funzione genica nel bambù è molto promettente per la comprensione avanzata del bambù e per sbloccare il suo potenziale di modificazione genetica. Un modo efficace per raggiungere questo obiettivo può essere raggiunto attraverso il processo di infezione mediata da Agrobacterium nelle foglie di bambù, in cui il frammento di T-DNA contenente geni esogeni viene introdotto nelle cellule, portando successivamente all'espressione dei geni all'interno delle cellule fogliari.
Il bambù è una risorsa preziosa e rinnovabile con una vasta gamma di applicazioni nella produzione, nell'arte e nella ricerca. Il bambù possiede eccellenti proprietà del legno come elevata resistenza meccanica, tenacità, rigidità moderata e flessibilità1, che ora è ampiamente utilizzato in una varietà di forniture domestiche e industriali, tra cui spazzolini da denti, cannucce, bottoni, stoviglie usa e getta, condutture sotterranee e riempitivi per torri di raffreddamento per la generazione di energia termica. Pertanto, la coltivazione del bambù svolge un ruolo cruciale nell'ottenere varietà di bambù con eccellenti proprietà del legno per sostituire la plastica e ridurre l'uso di plastica, proteggere l'ambiente e affrontare il cambiamento climatico, oltre a generare un valore economico significativo.
Tuttavia, l'allevamento tradizionale del bambù deve affrontare sfide a causa della lunga fase di crescita vegetativa e del periodo di fioritura incerto. Sebbene le tecniche di selezione molecolare siano state sviluppate e applicate all'allevamento del bambù, il processo di trasformazione genica del bambù richiede tempo, lavoro e complicazione a causa dei processi di induzione e rigenerazione del callo 2,3,4,5. La trasformazione genetica stabile richiede spesso metodi mediati da Agrobacterium, che coinvolgono processi di coltura tissutale come l'induzione e la rigenerazione del callo. Tuttavia, il bambù ha una bassa capacità di rigenerazione del callo, limitando notevolmente l'applicazione della trasformazione genetica stabile nel bambù. Dopo che l'Agrobacterium ha infettato le cellule vegetali, il frammento di T-DNA entra nelle cellule vegetali, con la maggior parte dei frammenti di T-DNA che rimangono non integrati nelle cellule, con conseguente espressione transitoria. Solo una piccola porzione di frammenti di T-DNA si integra in modo casuale nel suo cromosoma, portando a un'espressione stabile. I livelli di espressione transitori mostrano una curva di accumulo che può variare per ogni gene espresso da un T-DNA consegnato da Agrobacterium. Nella maggior parte dei casi, i livelli di espressione più elevati si verificano 3-4 giorni dopo l'infiltrazione e diminuiscono rapidamente dopo 5-6 giorni 6,7. Studi precedenti hanno dimostrato che più di 1/3 delle mutazioni in piante geneticamente modificate ottenute senza pressione selettiva per la resistenza provengono dall'espressione transitoria di CRISPR/Cas9, mentre i restanti meno di 2/3 provengono dall'espressione stabile dopo l'integrazione del DNA nel genoma8. Ciò indica che l'integrazione del T-DNA nel genoma della pianta non è necessaria per l'editing genetico. Inoltre, la pressione selettiva per la resistenza inibisce significativamente la crescita di cellule non transgeniche, influenzando direttamente il processo di rigenerazione degli espianti infetti. Pertanto, utilizzando l'espressione transitoria senza pressione selettiva per la resistenza nel bambù, è possibile ottenere un'espressione non integrata di geni esogeni e studiare la funzione genica direttamente negli organi vegetali. Quindi, è possibile sviluppare un metodo semplice e rapido per l'espressione e l'editing genico esogeno nel bambù9.
Il metodo sviluppato per l'espressione genica esogena e l'editing genetico si caratterizzano per la semplicità, l'economicità e l'assenza di apparecchiature costose o procedure complesse9. In questo metodo, il gene endogeno della violaxantina de-epossidasi del bambù (PeVDE) è stato utilizzato come reporter per l'espressione genica esogena senza pressione selettiva. Questo perché il PeVDE modificato nelle foglie di bambù riduce la capacità di fotoprotezione in condizioni di luce intensa e dimostra una diminuzione del valore di tempra non fotochimica (NPQ), che può essere rilevato attraverso l'imaging a fluorescenza della clorofilla. Per dimostrare l'efficacia di questo metodo, un altro gene endogeno del bambù, il gene della cinnamoil-CoA reduttasi (PeCCR5)9, è stato eliminato utilizzando questo sistema e ha generato con successo mutanti di questo gene. Questa tecnica può essere utilizzata per la caratterizzazione funzionale di geni che hanno funzioni nelle foglie di bambù. Sovraesprimendo questi geni in modo transitorio nelle foglie di bambù, i loro livelli di espressione possono essere migliorati o, mediante l'editing genetico, la loro espressione può essere abbattuta, consentendo lo studio dei livelli di espressione genica a valle, dei fenotipi fogliari e del contenuto del prodotto. Ciò fornisce un approccio più efficiente e fattibile per la ricerca sulla funzione genica nel bambù. Questa tecnica può essere applicata alla caratterizzazione funzionale dei geni che funzionano nelle foglie di bambù. Sovraesprimendo questi geni in modo transitorio nelle foglie di bambù, i loro livelli di espressione possono essere migliorati o, mediante l'editing genetico, la loro espressione può essere abbattuta, consentendo lo studio dei livelli di espressione genica a valle, dei fenotipi fogliari e del contenuto del prodotto. Inoltre, è importante notare che, a causa dell'estesa poliploidizzazione, la maggior parte dei geni commercialmente importanti nei genomi di bambù sono presenti in più copie, con conseguente ridondanza genetica. Ciò rappresenta una sfida per l'esecuzione dell'editing del genoma multiplex nel bambù. Prima di applicare tecniche di trasformazione genetica stabile o di editing genetico, è fondamentale convalidare rapidamente le funzioni geniche. Nell'affrontare il problema delle copie multiple del gene, un approccio consiste nell'analizzare i profili di espressione del trascrittoma per identificare i geni che sono attivamente espressi durante fasi specifiche. Inoltre, il targeting dei domini funzionali conservati di queste copie geniche consente la progettazione di sequenze target comuni o l'incorporazione di più siti target nello stesso vettore CRISPR/Cas9, consentendo il knockout simultaneo di questi geni. Ciò fornisce un approccio più efficiente e fattibile per la ricerca sulla funzione genica nel bambù.
Protocollo
1. Preparazione delle piantine di bambù
- Prepara piantine di bambù moso (Phyllostachys edulis) utilizzando semi raccolti a Guilin, Guangxi, Cina. Inizia immergendo i semi in acqua per 2-3 giorni, assicurandoti di cambiare l'acqua ogni giorno. Successivamente, crea un substrato mescolando terreno e vermiculite in un rapporto di 3:1.
- Semina i semi imbevuti nel substrato per la germinazione. Mantenere le piantine in condizioni di laboratorio, mantenendo la temperatura tra i 18-25 °C. Garantire un fotoperiodo di 16 ore di luce/8 ore di buio con un'intensità luminosa di 250-350 μmol/m2/s durante la fase di luce.
- Mantenere un'umidità relativa di circa il 60%. Per l'infezione da Agrobacterium, utilizzare piantine di 15 giorni e con un'altezza di 2-10 cm, che è la fase migliore per la trasformazione.
NOTA: Poiché la fioritura del bambù è imprevedibile, i semi non sono disponibili ogni anno. I semi vengono solitamente conservati per 2-3 anni a 4 °C in un ambiente asciutto e possono ancora mantenere una vitalità superiore al 20%.
2. Preparazione di plasmidi e Agrobacterium
- Plasmidi: per convalidare l'effetto di espressione transitoria, utilizzare il costrutto pHDE-35S::RUBY contenente un gene reporter visibile guidato dal promotore CaMV 35S 10. Per l'editing genetico, utilizzare il costrutto pCambia1300-Ubi::Cas9, che trasporta il gene Cas9 guidato dal promotore Ubi 11 del mais. Inserire le sequenze guida dell'sgRNA di PeVDE e di altri geni bersaglio tra i due siti AarI nel costrutto pCambia1300-Ubi::Cas9 9.
- Inserire le sequenze di RNA guida CRISPR/Cas9 tra i due siti di endonucleasi di restrizione AarI del costrutto pCambia1300-Ubi::Cas9 , inclusi i geni bersaglio PeVDE e PeCCR5 .
- Aggiungi GGCA all'estremità 5' della sequenza di 20 nucleotidi e sintetizza una sequenza di DNA a singolo filamento. Completare inversamente la sequenza di 20 nucleotidi e aggiungere AAAC all'estremità 5', quindi sintetizzare un'altra sequenza di DNA a singolo filamento.
- Diluire entrambe le sequenze di DNA a singolo filamento a una concentrazione di 10 nM/L in acqua diluita, mescolare accuratamente e riscaldare a 95 °C per 5 minuti. Lasciare raffreddare la miscela a temperatura ambiente, con conseguente formazione di adattatori a doppio filamento.
- Collegare gli adattatori con il frammento lineare pCambia1300-Ubi::Cas9 digerito dall'endonucleasi AarI utilizzando la DNA ligasi T4 e sequenziare il vettore CRISPR/Cas9 costruito per ottenere il costrutto di targeting genico desiderato.
- Per trasformare i plasmidi in Agrobacterium, utilizzare il metodo di congelamento-scongelamento come segue: mescolare 1 μL di plasmidi (concentrazione: 10 - 1.000 ng/μL) con 100 μL di cellule competenti per Agrobacterium (efficienza di traduzione: > 1 x 104 unità formanti colonie/μg) e mescolarle delicatamente. Mettere il composto sul ghiaccio per 5 min. Trasferire la miscela in azoto liquido per 5 min.
- Scongelare la miscela a bagnomaria a 37 °C per 5 min. Aggiungere 500 μL di terreno Luria-Bertani (LB) alla miscela e incubarla in un incubatore ad agitazione a 28 °C a 200 giri/min per 2-3 ore. Per i plasmidi pHDE-35S::RUBY, introdurli singolarmente nei ceppi AGL1, GV3101, LBA4044 e EHA105 di Agrobacterium tumefaciens (A. tumefaciens)12. Per i plasmidi CRISPR/Cas9, introdurli nel ceppo GV3101 di A. tumefaciens.
- Coltivare Agrobacterium in terreno peptone di estratto di lievito (YEP) (10 g di estratto di manzo, 10 g di estratto di lievito e 5 g di NaCl per L) con i corrispondenti antibiotici (spectinomicina per 35S::RUBY e kanamicina per CRISPR/Cas9) a 28 °C. Le singole colonie sono state osservate 36-48 ore dopo la coltivazione.
- Raccogliere e trasferire le colonie in un terreno YEP liquido (con antibiotici corrispondenti) per un'ulteriore crescita. Dopo 24-36 ore, utilizzare i primer di RUBY-F e RUBY-R (Tabella 1) per eseguire la PCR per confermare il successo del trasferimento dei plasmidi in Agrobacterium.
- Trasferire 1 mL dell'Agrobacterium trasformato con successo in 100 mL di terreno YEP liquido fresco (con antibiotici corrispondenti) e poi far crescere per una notte a 28 °C fino a un OD600 di 0,8.
- Centrifugare la sospensione batterica a 4.000 x g per 5 minuti a 4 °C, lavare il pellet batterico una volta con mezzo di infiltrazione in sospensione (10 mM MgCl2 e 10 mM MES-KOH [pH 5,6]), quindi centrifugare nuovamente. Risospendere il pellet batterico in un mezzo di infiltrazione in sospensione a un OD600 di 0,6 per la trasformazione del bambù.
3. Agrobatterio mediato nel sistema di trasformazione planta
- Prepararsi alla trasformazione; Rimuovere con cautela le piantine con radici attaccate al terreno dal substrato, assicurandosi che le radici rimangano intatte. Avvolgere le piantine con carta stagnola per mantenere l'umidità e prevenire il distacco del terreno (Figura 1A).
- Trasferire le piantine avvolte in un ambiente con maggiore umidità (umidità relativa dell'aria >90%) e minore illuminazione (intensità inferiore a 50 μmol/m 2/s) per una durata di2 h.
- Usando un ago affilato di una siringa, avvolgere la parte superiore delle foglie immature arricciate (a circa 1-2 cm dalla cima) delle piantine di bambù una o due volte (come indicato dai triangoli rossi nella Figura 1A).
- Successivamente, immergere la parte superiore ferita delle piantine in sospensioni di Agrobacterium. Eseguire rapidamente l'intero processo, dalla ferita all'immersione nell'Agrobacterium , poiché la ferita fresca aumenterà l'efficienza dell'inoculazione.
- Trasferisci immediatamente le piantine in una camera a vuoto con una pressione di 25-27 mmHg per 2 minuti (Figura 1B).
- Dopo aver passato l'aspirapolvere, scartare con cura le piantine e ripiantarle nel substrato. Posizionare le piantine in penombra o al buio (<50 μmol/m 2/s) con elevata umidità (RH>90%) a temperatura ambiente (18-25 °C) per2 giorni. Successivamente, coltivare le piantine in condizioni di crescita normali, annaffiandole ogni 5-7 giorni. Osservate i loro fenotipi per fornire materiali per esperimenti successivi.
4. Progettazione di RNA a guida singola (sgRNA) per l'editing genetico
- Identificare un sito di motivo adiacente al protospacer (PAM) situato vicino a un dominio specifico e conservato della sequenza genica bersaglio. Assicurarsi che la sequenza PAM specifica sia NGG in questo sistema CRISPR/Cas9. Verificare la specificità del bersaglio della sequenza selezionata eseguendo una ricerca BlastN rispetto al database del genoma del bambù. Assicurarsi che l'sgRNA sia unico, specialmente nella regione a monte e vicino al PAM 9,11.
NOTA: Questo confronto ridurrà efficacemente i potenziali siti off-target nel genoma interessato dal processo di editing genetico. - Progettare due sgRNA (sgRNA-1 e sgRNA-2) sul primo esone del gene PeVDE 13. Includere i siti di restrizione dell'etàI a monte del PAM in sgRNA-1 e i siti di restrizione XbaI a monte del PAM in sgRNA-2. Progettare un sgRNA sul quarto esone del gene PeCCR5 , che codifica per il motivo conservato di KNWYCYGK. Questo motivo è fondamentale per la catalisi dei CCR14.
- Progettare una sequenza spaziatrice di 20 nucleotidi adiacente al sito PAM. Questa sequenza di spaziatori guiderà l'enzima Cas9 verso il sito bersaglio per la scissione del DNA e il successivo editing genetico.
NOTA: Si consiglia di scegliere una regione target a monte del sito di scissione dell'enzima endonucleasi all'interno del sito PAM. Ciò faciliterà la convalida dell'efficienza dell'editing genetico.
5. Progettazione del primer e PCR
- Progettare manualmente primer specifici per l'amplificazione dei frammenti di PeVDE e PeCCR5 . Progettare i primer a monte e a valle in modo che siano posizionati ad almeno 100 bp al di fuori del sito target, con una differenza di lunghezza di oltre 100 bp per consentire una separazione di banda distinta durante l'elettroforesi. Progettare primer per l'amplificazione di RUBY entro i primi 500 bp del gene. Un elenco di tutti i primer utilizzati è riportato nella Tabella 1.
- Utilizzare una DNA polimerasi ad alta fedeltà per la PCR. In questo caso, utilizza la DNA polimerasi con alta fedeltà e amplificazione efficiente nella clonazione genica.
- Preparare la miscela di reazione PCR come segue: 5x tampone (Mg2+ Plus): 4 μL; miscela di dNTP (2,5 mM ciascuna): 1,6 μL; Primer diretti e inversi (10 pmol ciascuno): 1 μL ciascuno; DNA del genoma di bambù (circa 50 ng); DNA polimerasi (2,5 U/μL): 0,2 μL; Diluire l'acqua fino a un volume totale di 20 μL.
- Seguire le condizioni di esecuzione della PCR: denaturazione iniziale a 98 °C per 5 min; Denaturazione a 98 °C per 10 s; Ricottura a 56 °C per 5 s; Prolungamento a 72 °C per 30 s; Ripetere la denaturazione fino all'estensione per 32 cicli; Prolungamento finale a 72 °C per 5 min; Tenere a 4 °C a tempo indeterminato.
NOTA: Le condizioni PCR sono fornite a titolo di esempio e potrebbe essere necessario ottimizzarle per applicazioni o target specifici.
6. Estrazione del DNA, digestione enzimatica endonucleasica e sequenziamento
- Separare la regione con valori NPQ più bassi dalle lame di foglie di bambù fresche usando le forbici, come identificato dal fluorimetro PAM per imaging (fare riferimento al passaggio 7.4). Congelare i campioni di foglie con azoto liquido e trasferire i campioni di foglie congelati in un mortaio. Macinare i campioni in una polvere fine usando un pestello, aggiungendo abbastanza azoto liquido durante il processo di macinazione. Questo passaggio aiuta a rilasciare il contenuto cellulare, compreso il DNA.
- Estrarre il DNA genomico dalla foglia in polvere utilizzando il metodo del bromuro di ammonio di cetiltrimetilammonio (CTAB). Aggiungere 50 mg di campioni di polvere di foglie a 800 μL di una soluzione CTAB al 2%. Miscelare accuratamente il campione e incubare a 65 °C per 30 minuti, agitando delicatamente ogni 5 minuti.
- Aggiungere una quantità uguale di alcool cloroformico/isoamilico (24:1, v/v) e agitare energicamente la miscela. Dopo la centrifugazione a 8.000 g per 8 min, trasferire il surnatante in una nuova provetta.
- Aggiungere un volume uguale di cloroformio/alcol isoamilico e ripetere il passaggio 6.3. Aggiungere un volume uguale di isopropanolo ghiacciato e capovolgere più volte la provetta prima di posizionarla a -20 °C per 30 min. Dopo la centrifugazione a 8.000 x g per 5 minuti, scartare il surnatante.
- Lavare il pellet di DNA 2 volte con etanolo al 75% a 4 °C, quindi scioglierlo in 50 μL di acqua.
- Amplificare il DNA genomico contenente il sito bersaglio dei geni bersaglio da foglie di bambù selvatiche e infette da Agrobacterium con il protocollo del passaggio 5.4.
- Eseguire la digestione enzimatica endonucleasica dei prodotti PCR. Selezionare un enzima specifico che riconosca i siti di restrizione desiderati all'interno dei frammenti di DNA amplificati. Utilizzare le endonucleasi AgeI e XbaI per la digestione.
- Preparare una miscela di reazione composta da AgeI o XbaI (20 unità/μL) - 1 μL, 1 μg di prodotti PCR, 10 tamponi - 5 μL e aggiungere acqua per un volume totale di 50 μL. Incubare a 37 °C per 1 ora.
- Analizza la proporzione di frammenti di DNA digeriti utilizzando l'elettroforesi su gel. Confronta i frammenti digeriti dai campioni wild-type e infetti da Agrobacterium per valutare l'efficienza dell'editing genetico.
- Contrassegnare le sequenze dell'adattatore di trasposasi TCGTCGGCAGCGTCAGATGTGTATAAGAGACAG e GTCTCGTGGGCTCGGAGATGTGTATAAGAGACAG all'estremità 5' dei primer in avanti e indietro, rispettivamente, per l'amplificazione dei frammenti di PeVDE e PeCCR5 9,15. Utilizzare il protocollo descritto al punto 5.4 per l'amplificazione. Preparare i prodotti della PCR (prima della digestione) per il sequenziamento profondo.
7. Misura della fluorescenza clorofilliana dei valori di NPQ nelle foglie
- Prima delle misurazioni, esporre le piantine di bambù a condizioni di elevata intensità luminosa di 1200 μmol/m 2/s per2 ore. Questa esposizione aumenta la quantità di luce assorbita e attiva il sistema di fotoprotezione nelle foglie.
- Utilizzare un fluorimetro PAM per misurare la fluorescenza della clorofilla PS II in vivo delle foglie di bambù. Impostare l'intensità della luce attinica su 800 μmol/m2/s per misurazioni di fluorescenza di 6 minuti. Durante questo periodo, applicare un impulso di saturazione ogni 30 s per ottenere curve di fluorescenza della clorofilla. I valori stabili delle curve verranno utilizzati per i calcoli13.
- Calcolare la tempra non fotochimica (NPQ) utilizzando la formula:
NPQ = (F m - F m') / F m'
dove F m rappresenta la massima fluorescenza nello stato adattato al buio e Fm' rappresenta la massima fluorescenza in qualsiasi stato adattato alla luce. - Monitora i valori NPQ dall'interfaccia visiva del software di imaging. Il software consente l'analisi e la visualizzazione in tempo reale dei dati di fluorescenza, compresi i valori NPQ.
Risultati
Agrobatterio-mediato nell'espressione genica delle piante nelle foglie di bambù
È stato dimostrato che il gene reporter RUBY è efficace nella visualizzazione dell'espressione genica transitoria grazie alla sua capacità di produrre betalaina rossa vivida dalla tirosina10. In questo studio, la trasformazione mediata da Agrobacterium è stata utilizzata per esprimere transitoriamente il gene esogeno RUBY nelle foglie di bambù (Figura 1). Al 3° giorno dopo l'infezione, è stata osservata una colorazione rossa nelle foglie piegate immature, che è diventata più vivida il 5° giorno una volta che le foglie si erano dispiegate (triangolo blu, Figura 1C). Questi risultati dimostrano che Agrobacterium ha mediato con successo l'espressione del gene esogeno RUBY nelle foglie di bambù e che si è verificata la sintesi della betalaina.
Inoltre, sono stati confrontati quattro ceppi di Agrobacterium (AGL1, LBA4404, EHA105 e GV3101) e hanno scoperto che il ceppo GV3101 ha causato l'accumulo più significativo di betalaina nelle foglie di bambù infette, con la percentuale più alta dell'85,2% di piantine che hanno accumulato betalaina dopo essere state infettate, seguite da AGL1 (76,9%) e poi EHA105 (49,1%) e LBA4404 (31,3%; Figura 1D). Ciò suggerisce che la GV3101 è la varietà più adatta a questo scopo. La PCR ad alta fedeltà è stata condotta per rilevare se il frammento di T-DNA mediato da Agrobacterium si fosse integrato nel cromosoma del bambù. Dopo 40 cicli di PCR, non sono state rilevate bande del gene RUBY , indicando che il frammento di T-DNA non si è integrato o è stato integrato in un numero così basso da non poter essere rilevato. Pertanto, questi risultati concludono che questa espressione genica è transitoria.
Nel complesso, questi risultati dimostrano la fattibilità di un transiente mediato da Agrobacterium nell'espressione genica delle piante nel bambù utilizzando il gene reporter RUBY . Tuttavia, il colore rosso della betalaina è risultato instabile ed è scomparso dopo 3 mesi dall'infezione, indicando che il sistema di espressione transitorio non è stabile per l'osservazione a lungo termine.
In planta editing genetico del gene della violaxantina de-epossidasi del bambù (PeVDE)
L'espressione genica mediata da agrobatteri nelle piante è un metodo transitorio di espressione genica nel bambù. Per studiare se un sistema CRISPR/Cas9 transitorio potesse ottenere l'editing genetico nelle foglie di bambù, l'enzima chiave nel ciclo della xantofilla del bambù, la violaxantina de-epossidasi (PeVDE), è stato selezionato come bersaglio per l'editing genetico di prova. Gli RNA guida singola (sgRNA) sono stati progettati sul primo esone del gene PeVDE (sgRNA-1), che contiene siti di restrizione di etàI a monte del motivo adiacente al protospacer (PAM) per facilitare la convalida dell'editing genetico (Figura 2A).
Il costrutto CRISPR/Cas9 che trasporta sgRNA-1 è stato trasfettato in Agrobacterium per trasformare le foglie di bambù. Dopo l'infezione dell'Agrobacterium contenente i costrutti CRISPR/Cas9 che trasportano sgRNA-1 per 5 giorni, le piantine di bambù sono state sottoposte a trattamento ad alta luce e, successivamente, è stato condotto il rilevamento dei parametri di fluorescenza della clorofilla. Sono state trovate alcune aree di lame fogliari che avevano valori di estinzione non fotochimica (NPQ) più bassi (Figura 2B), indicando che la capacità di fotoprotezione di queste aree era ridotta in condizioni di luce intensa. Poiché il gene PeVDE ha la capacità di dissipare l'energia luminosa assorbita in eccesso13, queste aree con valori NPQ più bassi sono probabilmente le regioni in cui il gene PeVDE è stato modificato. Successivamente, sono state eseguite analisi di digestione enzimatica e sequenziamento del frammento del gene PeVDE in queste aree delle lame fogliari (Figura 2C-D) ed è stato riscontrato che il tasso di mutazione di sgRNA-1 era del 17,33%, indicando che l'editing genetico ha avuto successo in queste aree del gene PeVDE.
Inoltre, un altro sito di targeting dell'sgRNA, sgRNA-2, contenente un sito di restrizione XbaI, è stato progettato sul primo esone di PeVDE. Per studiare la possibilità di delezione di frammenti lunghi con doppio targeting dell'sgRNA, è stato eseguito l'editing genetico in entrambi i siti bersaglio, con conseguente delezione di frammenti lunghi (Figura 2E).
Modificato il mutante PeVDE utilizzato come reporter nel sistema di editing genetico transitorio
È stato studiato se l'sgRNA PeVDE potesse fungere da reporter nel sistema di editing genetico transitorio. Il gene della cinnamoil-CoA reduttasi (PeCCR5) (Gene ID: PH02Gene42984.t1) è stato selezionato in modo casuale, per valutare il reporter PeVDE . Un bersaglio di sgRNA per PeCCR5 è stato progettato nel suo motivo conservato sul quarto esone. Il costrutto CRISPR/Cas9 che trasporta entrambi gli sgRNA, PeVDE e PeCCR5, è stato trasformato in foglie di bambù (Figura 3A).
Dopo l'infezione da Agrobacterium per 30 giorni, le piantine sono state trattate con luce ad alta intensità per 20 minuti. È stato osservato che solo le aree fogliari modificate per il gene PeCCR5 non hanno avuto alcun effetto sui valori di NPQ, mentre le aree fogliari trasfettate dagli sgRNA di PeVDE e PeCCR5 hanno mostrato valori NPQ più bassi (Figura 3B).
Successivamente, il frammento PeCCR5 delle aree fogliari con valori NPQ più bassi è stato amplificato e sequenziato e ha trovato un'efficienza di mutazione dell'8,3% utilizzando il sequenziamento profondo. Pertanto, il reporter PeVDE ha svolto con successo il ruolo di reporter di editing genetico transitorio e può essere utilizzato per lo screening dell'editing genetico di altri geni endogeni del bambù.
Nel complesso, questi risultati dimostrano la fattibilità dell'editing genetico del bambù utilizzando CRISPR/Cas9 nel bambù.
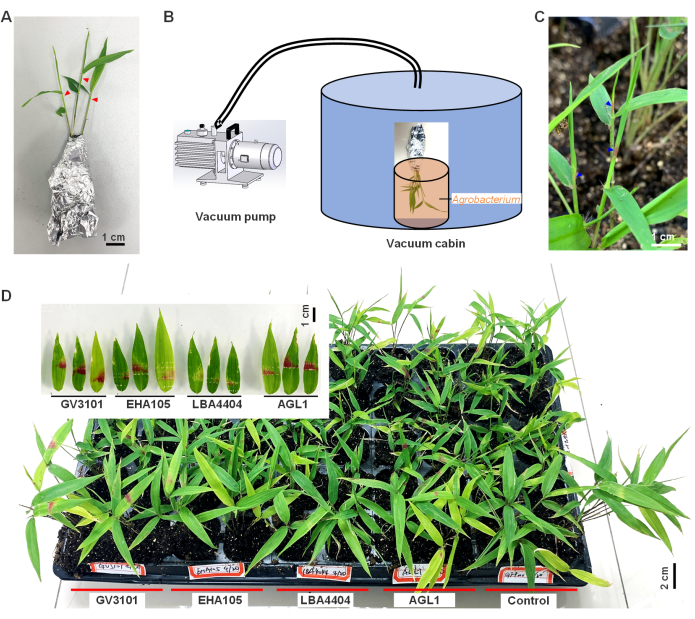
Figura 1: In planta l'espressione del gene RUBY e l'accumulo di betalaina nelle foglie di bambù moso. (A) Piantine di bambù Moso avvolte in carta stagnola e pronte per l'infezione da Agrobacterium , con triangoli rossi che indicano le posizioni che sono state ferite da un ago affilato di una siringa. (B) Processo di infiltrazione sottovuoto di piantine di bambù. (C) Accumulo di betalaina nelle foglie di bambù dopo 3 giorni di infezione osservato attraverso cambiamenti fenotipici. (D) Qui, quattro ceppi di Agrobacterium , AGL1, LBA4404, EHA105 e GV3101 hanno mediato la trasformazione genica RUBY nelle foglie di bambù. GV3101 che ospita il costrutto GFP è stato utilizzato come controllo negativo. Questa cifra è stata modificata da9. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Nell'espressione delle piante e nell'editing genico del gene PeVDE nelle foglie di bambù . (A) Informazioni sulla posizione e sulla sequenza bersaglio dell'sgRNA nel gene PeVDE . I triangoli rossi indicano le posizioni dei primer in avanti e all'indietro per l'amplificazione dei frammenti. (B) NPQ e imaging grezzo delle foglie di bambù dopo l'infezione. I numeri nell'immagine NPQ rappresentano i valori NPQ nel monitor del software di imaging. (C) Risultati dell'elettroforesi del frammento di PeVDE prima e dopo la digestione dell'etàI. WT indica le foglie non infette wild-type, e + e - rappresentano rispettivamente i frammenti di PeVDE con o senza digestione AgeI. (D) Risultati del sequenziamento profondo del frammento di PeVDE in foglie con valore NPQ inferiore. I caratteri rosso, blu e grigio nelle sequenze rappresentano rispettivamente i siti di destinazione, PAM e inserimenti. I trattini rossi indicano i nucleotidi eliminati. (E) Risultati del sequenziamento con metodo Sanger del frammento PeVDE dopo l'editing sia da parte di sgRNA-1 che di sgRNA-2. Questa cifra è stata modificata da9. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: L'sgRNA di PeVDE come reporter per lo screening dell'editing genetico di PeCCR5. (A) Rappresentazione schematica di costrutti CRISPR/Cas9 contenenti sgRNA PeVDE e PeCCR5. (B) NPQ e immagini grezze delle foglie di bambù dopo l'infezione con i costrutti in (A). I triangoli bianchi indicano le aree con valori NPQ più bassi. Il colore dell'arcobaleno rappresenta il valore di NPQ/4, dove il rosso corrisponde al valore minimo e il viola corrisponde a 1. (C) I caratteri rosso, blu e grigio nelle sequenze rappresentano rispettivamente i siti di destinazione, PAM e inserimenti. I trattini rossi indicano i nucleotidi eliminati. Questa cifra è stata modificata da9. Fare clic qui per visualizzare una versione più grande di questa figura.
| Nome del gene | Sequenza primer (5'-3') | Applicazione | ||
| RUBINO | F: ATGGATCATGCGACCCTCG | Per l'amplificazione PCR in foglie di bambù infette | ||
| R: GTACTCGTAGAGCTGCTGCAC | ||||
| PeVDE | F: TGTGGCTTCTAAAGCTCTGCAATCT | Per la clonazione e il sequenziamento genico | ||
| R: TGTCAATGCTACAAGTCCTGGCA | ||||
| PeVDE-Target1 | F: GGCATAGCCCTCACGCAGCACCGG | Per la progettazione di un target sgRNA-1 PeVDE | ||
| R: AAACCCGGTGCTGCGTGAGGGCTA | ||||
| PeVDE-Target2 | F: GGCACTCCACGGTCCCAAATCTAG | Per la progettazione di un target di sgRNA-2 PeVDE | ||
| R: AAACCTAGATTTGGGACCGTGGAG | ||||
| PeCCR5-Target | F: GGCACTGGTACTGCTACGCTAAGA | Per la progettazione di un target di sgRNA PeCCR5 | ||
| R: AAACTCTTAGCGTAGCAGTACCAG | ||||
Tabella 1: Le informazioni sulla sequenza dei primer.
Discussione
Questo metodo riduce significativamente il tempo necessario rispetto ai metodi di trasformazione genetica tradizionali, che in genere richiedono 1-2 anni, e raggiunge l'espressione transitoria dei geni esogeni e l'editing genetico dei geni endogeni entro 5 giorni. Tuttavia, questo metodo ha dei limiti in quanto può trasformare solo una piccola percentuale di cellule e le foglie geneticamente modificate sono chimeriche e non hanno la capacità di rigenerarsi in piante complete. Ciononostante, questa tecnologia di espressione genica e di editing genetico delle piante fornisce un potente approccio per la verifica funzionale dei geni endogeni del bambù.
Attualmente, nella planta l'espressione genica e la tecnologia di editing genetico possono essere eseguite solo in foglie immature (arricciate), non in foglie mature. Man mano che le foglie si dispiegano e si allargano, il numero di cellule geneticamente modificate che subiscono la divisione aumenta, consentendo l'editing genetico in specifiche regioni fogliari. Tuttavia, il metodo di trasformazione mediato da Agrobacterium utilizzato non comporta l'inserimento del T-DNA esogeno nel cromosoma del bambù, rendendo difficile l'utilizzo di geni marcatori stabili nel bambù 6,9. Pertanto, è difficile determinare le posizioni esatte di queste regioni. Per risolvere questo problema, il gene PeVDE è stato modificato e l'area modificata ha mostrato una ridotta capacità di fotoprotezione sotto trattamento ad alta luce, come indicato da valori NPQ più bassi, che possono essere facilmente rilevati utilizzando un fluorimetro clorofilliano-PAM. Pertanto, PeVDE è stato sviluppato come marcatore nel bambù per rilevare l'insorgenza di espressione genica esogena e l'editing genetico. A causa dell'elevata conservazione di questo gene in diverse specie 13, può essere ampiamente applicato anche ad altre piante.
A causa della deposizione di uno strato di cera cuticolare sull'epidermide delle foglie di bambù, unita alla caratteristica morfologia arricciata e strettamente avvolta delle foglie immature, l'accessibilità di Agrobacterium alle cellule fogliari è significativamente ostacolata. Al fine di migliorare l'efficacia dell'infezione da Agrobacterium, sono stati utilizzati approcci fisici, tra cui l'infiltrazione di ferite e sottovuoto, per promuovere l'ingresso di Agrobacterium nelle foglie di bambù arricciate racchiudete. Questo processo consente una stretta vicinanza tra l'Agrobacterium e le cellule fogliari, migliorando così l'efficienza della trasformazione genetica. Nel frattempo, questo sistema di editing genetico è stato finora limitato alle foglie di bambù e non può essere espresso in organi con capacità riproduttiva, come semi e gemme laterali che possono essere ereditate dalla generazione successiva. Le future applicazioni della tecnica saranno ottimizzate per ottenere l'espressione genica in-planta e la tecnologia di editing genetico in organi con capacità riproduttiva, con l'obiettivo di ottenere piante rigeneranti ereditabili in modo stabile.
Divulgazioni
Gli autori dichiarano di non avere interessi concorrenti.
Riconoscimenti
Gli autori desiderano ringraziare il National Key Research and Development Program of China (Grant No. 2021YFD2200502), la National Natural Science Foundation of China (Grant No. 31971736) per il sostegno finanziario.
Materiali
| Name | Company | Catalog Number | Comments |
| 35S::RUBY | Addgene, United States | 160908 | Plamid construct |
| Agrobacterium competent cells of GV3101, EHA105,LBA4404, and AGL1 | Biomed, China | BC304-01, BC303-01, BC301-01, and BC302-01 | For Agrobacterium infection |
| CTAB | Sigma-Aldrich, United States | 57-09-0 | DNA extraction |
| Imaging-PAM fluorometer | Walz, Effeltrich, Germany | Detect chlorophyll fluorescence of bamboo leaves | |
| ImagingWin | Walz, Effeltrich, Germany | Software for Imaging-PAM fluorometer | |
| Paq CI or Aar I | NEB, United States | R0745S | Incorporate the target sequence onto the CRISPR/Cas9 vector. |
| PrimeSTAR Max DNA polymerase | Takara, Japan | R045Q | For gene cloning |
| T4 DNA ligase | NEB, United States | M0202V | Incorporate the target sequence onto the CRISPR/Cas9 vector. |
Riferimenti
- Jiang, Z. H. World Bamboo and Rattan (in Chinese). , Liaoning Science and Technology Publishing House. Shenyang, China. (2002).
- Ye, S., et al. An efficient plant regeneration and transformation system of ma bamboo (Dendrocalamus latiflorus Munro) started from young shoot as explant. Frontiers in Plant Science. 8, 1298(2017).
- Ye, S., et al. Robust CRISPR/Cas9 mediated genome editing and its application in manipulating plant height in the first generation of hexaploid Ma bamboo (Dendrocalamus latiflorus Munro). Plant Biotechnology Journal. 18 (7), 1501-1503 (2020).
- Xiang, M., et al. Production of purple Ma bamboo (Dendrocalamus latiflorus Munro) with enhanced drought and cold stress tolerance by engineering anthocyanin biosynthesis. Planta. 254 (3), 50(2021).
- Huang, B., et al. An efficient genetic transformation and CRISPR/Cas9-based genome editing system for moso bamboo (Phyllostachys edulis). Frontiers in Plant Science. 13, 822022(2022).
- Lee, M. W., Yang, Y. Transient expression assay by agroinfiltration of leaves. Methods in Molecular Biology. 323, 225-229 (2006).
- Canto, T. Transient expression systems in plants: potentialities and constraints. Advances in Experimental Medicine and Biology. 896, 287-301 (2016).
- Chen, L., et al. A method for the production and expedient screening of CRISPR/Cas9-mediated non-transgenic mutant plants. Horticulture Research. 5, 13(2018).
- Sun, H., et al. A new biotechnology for in-planta gene editing and its application in promoting flavonoid biosynthesis in bamboo leaves. Plant Methods. 19 (1), 20(2023).
- He, Y., Zhang, T., Sun, H., Zhan, H., Zhao, Y. A reporter for noninvasively monitoring gene expression and plant transformation. Horticulture Research. 7 (1), 152(2020).
- Wang, C., Shen, L., Fu, Y., Yan, C., Wang, K. A simple CRISPR/Cas9 system for multiplex genome editing in rice. Journal of Genetics and Genomics. 42 (12), 703-706 (2015).
- McCormick, S., et al. Leaf disc transformation of cultivated tomato (L. esculentum) using Agrobacterium tumefaciens. Plant Cell Reports. 5 (2), 81-84 (1986).
- Lou, Y., et al. a violaxanthin de-epoxidase gene from moso bamboo, confers photoprotection ability in transgenic Arabidopsis under high light. Frontiers in Plant Science. 13, 927949(2022).
- Zhou, R., et al. Distinct cinnamoyl CoA reductases involved in parallel routes to lignin in Medicago truncatula. Proceedings of the National Academy of Sciences of the United States of America. 107 (41), 17803-17808 (2010).
- De Roeck, A., et al. Deleterious ABCA7 mutations and transcript rescue mechanisms in early onset Alzheimer's disease. Acta Neuropathologica. 134 (3), 475-487 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon