Method Article
En Planta Expresión génica y edición génica en hojas de bambú Moso
En este artículo
Resumen
En este estudio, se desarrolló en bambú un novedoso método de expresión génica y edición génica en planta mediado por Agrobacterium . Este método mejoró en gran medida la eficiencia de la validación de la función génica en el bambú, lo que tiene implicaciones significativas para acelerar el proceso de mejoramiento del bambú.
Resumen
Se desarrolló un novedoso método de transformación génica in planta para el bambú, que evita la necesidad de procesos de inducción y regeneración de callos que requieren mucho tiempo y mano de obra. Este método implica la expresión génica mediada por Agrobacterium a través de heridas y vacío para plántulas de bambú. Demostró con éxito la expresión de genes exógenos, como el reportero RUBY y el gen Cas9 , en hojas de bambú. La mayor eficiencia de transformación para la acumulación de betalaína en plántulas RUBY se logró utilizando la cepa GV3101, con un porcentaje de 85.2% después de la infección. Aunque el ADN extraño no se integró en el genoma del bambú, el método fue eficiente para expresar los genes exógenos. Además, también se ha desarrollado un sistema de edición génica con un reportero nativo utilizando este método, a partir del cual se ha desarrollado un mutante in situ generado por el gen editado de la violaxantina de-epoxidasa de bambú (PeVDE) en hojas de bambú, con una tasa de mutación del 17,33%. La mutación de PeVDE dio lugar a una disminución de los valores de enfriamiento no fotoquímico (NPQ) bajo alta luz, que puede detectarse con precisión con un fluorómetro. Esto convierte al PeVDE editado en un potencial reportero nativo para genes exógenos y endógenos en el bambú. Con el reportero de PeVDE, se editó con éxito un gen de cinamoil-CoA reductasa con una tasa de mutación del 8,3%. Esta operación evita el proceso de cultivo de tejidos o inducción de callos, que es rápido y eficiente para la expresión de genes exógenos y la edición de genes endógenos en el bambú. Este método puede mejorar la eficiencia de la verificación de la función génica y ayudará a revelar los mecanismos moleculares de las vías metabólicas clave en el bambú.
Introducción
La investigación de la función de los genes en el bambú es muy prometedora para la comprensión avanzada del bambú y para desbloquear su potencial de modificación genética. Una forma efectiva de esto se puede lograr a través del proceso de infección mediada por Agrobacterium en hojas de bambú, mediante el cual el fragmento de ADN-T que contiene genes exógenos se introduce en las células, lo que posteriormente conduce a la expresión de los genes dentro de las células de la hoja.
El bambú es un recurso valioso y renovable con una amplia gama de aplicaciones en la fabricación, el arte y la investigación. El bambú posee excelentes propiedades de madera, como alta resistencia mecánica, tenacidad, rigidez moderada y flexibilidad1, que ahora se usa ampliamente en una variedad de suministros domésticos e industriales, incluidos cepillos de dientes, pajitas, botones, vajillas desechables, tuberías subterráneas y rellenos de torres de enfriamiento para la generación de energía térmica. Por lo tanto, el cultivo de bambú juega un papel crucial en la obtención de variedades de bambú con excelentes propiedades de madera para reemplazar los plásticos y reducir el uso de plástico, proteger el medio ambiente y abordar el cambio climático, además de generar un valor económico significativo.
Sin embargo, la cría tradicional de bambú se enfrenta a desafíos debido a la larga etapa de crecimiento vegetativo y al incierto período de floración. Aunque se han desarrollado y aplicado técnicas de mejoramiento molecular al mejoramiento genético de bambú, el proceso de transformación del gen del bambú requiere mucho tiempo, mano de obra y es complicado debido a los procesos de inducción y regeneración de callos 2,3,4,5. La transformación genética estable a menudo requiere métodos mediados por Agrobacterium, que involucran procesos de cultivo de tejidos como la inducción y regeneración de callos. Sin embargo, el bambú tiene una baja capacidad para la regeneración de callos, lo que limita en gran medida la aplicación de la transformación genética estable en el bambú. Después de que Agrobacterium infecta las células vegetales, el fragmento de ADN-T ingresa a las células vegetales, y la mayoría de los fragmentos de ADN-T permanecen no integrados en las células, lo que resulta en una expresión transitoria. Solo una pequeña porción de fragmentos de ADN-T se integra aleatoriamente en su cromosoma, lo que conduce a una expresión estable. Los niveles de expresión transitoria muestran una curva de acumulación que puede variar para cada gen expresado a partir de un ADN-T entregado por Agrobacterium. En la mayoría de los casos, los niveles más altos de expresión ocurren 3-4 días después de la infiltración y disminuyen rápidamente después de 5-6 días 6,7. Estudios previos han demostrado que más de 1/3 de las mutaciones en plantas editadas genéticamente obtenidas sin presión de selección para resistencia provienen de la expresión transitoria de CRISPR/Cas9, mientras que las restantes menos de 2/3 provienen de la expresión estable después de la integración del ADN en el genoma8. Esto indica que la integración del ADN-T en el genoma de la planta no es necesaria para la edición de genes. Además, la presión de selección para la resistencia inhibe significativamente el crecimiento de células no transgénicas, lo que afecta directamente el proceso de regeneración de los explantes infectados. Por lo tanto, mediante el uso de la expresión transitoria sin presión de selección para la resistencia en el bambú, es posible lograr una expresión no integrada de genes exógenos y estudiar la función génica directamente en los órganos de la planta. Por lo tanto, se puede desarrollar un método fácil y que ahorra tiempo para la expresión y edición de genes exógenos en bambú9.
El método desarrollado de expresión génica exógena y edición génica se caracteriza por su simplicidad, rentabilidad y ausencia de equipos costosos o procedimientos complejos9. En este método, se utilizó el gen endógeno de la violaxantina deepoxidasa (PeVDE) del bambú como indicador de la expresión génica exógena sin presión de selección. Esto se debe a que el PeVDE editado en las hojas de bambú reduce la capacidad de fotoprotección bajo mucha luz y demuestra una disminución en el valor de enfriamiento no fotoquímico (NPQ), que se puede detectar a través de imágenes de fluorescencia de clorofila. Para demostrar la eficacia de este método, otro gen endógeno del bambú, el gen de la cinamoil-CoA reductasa (PeCCR5)9, fue eliminado utilizando este sistema y generó con éxito mutantes de este gen. Esta técnica se puede utilizar para la caracterización funcional de genes que tienen funciones en las hojas de bambú. Al sobreexpresar estos genes transitoriamente en las hojas de bambú, se pueden mejorar sus niveles de expresión o, mediante la edición de genes, se puede reducir su expresión, lo que permite el estudio de los niveles de expresión génica posteriores, los fenotipos de las hojas y el contenido del producto. Esto proporciona un enfoque más eficiente y factible para la investigación de la función génica en el bambú. Esta técnica se puede aplicar a la caracterización funcional de genes que funcionan en hojas de bambú. Al sobreexpresar estos genes transitoriamente en las hojas de bambú, se pueden mejorar sus niveles de expresión o, mediante la edición de genes, se puede reducir su expresión, lo que permite el estudio de los niveles de expresión génica posteriores, los fenotipos de las hojas y el contenido del producto. Además, es importante tener en cuenta que, debido a la extensa poliploidización, la mayoría de los genes comercialmente importantes en los genomas del bambú están presentes en múltiples copias, lo que resulta en redundancia genética. Esto plantea un desafío para realizar la edición multiplexada del genoma en bambú. Antes de la aplicación de técnicas de transformación genética estable o edición de genes, es crucial validar rápidamente las funciones de los genes. Al abordar el problema de las copias múltiples de genes, un enfoque es analizar los perfiles de expresión del transcriptoma para identificar los genes que se expresan activamente durante etapas específicas. Además, dirigirse a los dominios funcionales conservados de estas copias génicas permite el diseño de secuencias diana comunes o la incorporación de múltiples sitios diana en el mismo vector CRISPR/Cas9, lo que permite la eliminación simultánea de estos genes. Esto proporciona un enfoque más eficiente y factible para la investigación de la función génica en el bambú.
Protocolo
1. Preparación de plántulas de bambú.
- Prepare plántulas de bambú moso (Phyllostachys edulis) utilizando semillas cosechadas en Guilin, Guangxi, China. Comience remojando las semillas en agua durante 2-3 días, asegurándose de cambiar el agua diariamente. A continuación, crea un sustrato mezclando tierra y vermiculita en una proporción de 3:1.
- Siembre las semillas empapadas en el sustrato para que germinen. Mantener las plántulas en condiciones de laboratorio, manteniendo la temperatura entre 18-25 °C. Asegurar un fotoperiodo de 16 h de luz/8 h de oscuridad con una intensidad de luz de 250-350 μmol/m2/s durante la fase de luz.
- Mantener una humedad relativa de aproximadamente el 60%. Para la infección por Agrobacterium, use plántulas que tengan 15 días de edad y una altura de 2-10 cm, que es la mejor etapa para la transformación.
NOTA: Debido a que la floración del bambú es impredecible, las semillas no están disponibles todos los años. Las semillas generalmente se almacenan durante 2-3 años a 4 °C en un ambiente seco y aún pueden mantener una viabilidad de más del 20%.
2. Preparación de plásmidos y Agrobacterium
- Plásmidos: Para validar el efecto de expresión transitoria, se emplea la construcción pHDE-35S::RUBY que contiene un gen reportero visible impulsado por el promotor CaMV 35S 10. Para la edición de genes, utilice la construcción pCambia1300-Ubi::Cas9, que lleva el gen Cas9 impulsado por el promotor Ubi 11 del maíz. Inserte las secuencias guía de sgRNA de PeVDE y otros genes diana entre los dos sitios AarI en la construcción pCambia1300-Ubi::Cas9 9.
- Inserte las secuencias de ARN guía CRISPR/Cas9 entre los dos sitios de endonucleasa de restricción AarI de la construcción pCambia1300-Ubi::Cas9 , incluidos los genes diana PeVDE y PeCCR5 .
- Agregue GGCA al extremo 5' de la secuencia de 20 nucleótidos y sintetice una secuencia de ADN monocatenario. Complemente inverso la secuencia de 20 nucleótidos y agregue AAAC al extremo 5', luego sintetice otra secuencia de ADN monocatenario.
- Diluir ambas secuencias de ADN monocatenario a una concentración de 10 nM/L en agua diluida, mezclar bien y calentar a 95 °C durante 5 min. Deje que la mezcla se enfríe a temperatura ambiente, lo que da como resultado la formación de adaptadores de doble hebra.
- Conecte los adaptadores con el fragmento lineal pCambia1300-Ubi::Cas9 digerido por la endonucleasa AarI utilizando la ADN ligasa T4 y secuencie el vector CRISPR/Cas9 construido para obtener la construcción de orientación génica deseada.
- Para transformar plásmidos en Agrobacterium, utilice el método de congelación-descongelación de la siguiente manera: mezcle 1 μL de los plásmidos (concentración: 10 - 1.000 ng/μL) con 100 μL de células competentes para Agrobacterium (eficiencia de traducción: > 1 x 104 unidades formadoras de colonias/μg) y mézclelos suavemente. Coloca la mezcla en hielo durante 5 min. Transfiera la mezcla a nitrógeno líquido durante 5 min.
- Descongelar la mezcla al baño maría a 37 °C durante 5 min. Añadir 500 μL de medio Luria-Bertani (LB) a la mezcla e incubar en una incubadora agitadora a 28 °C a 200 rpm durante 2-3 h. En el caso de los plásmidos pHDE-35S::RUBY, introducirlos individualmente en las cepas AGL1, GV3101, LBA4044 y EHA105 de Agrobacterium tumefaciens (A. tumefaciens)12. En el caso de los plásmidos CRISPR/Cas9, introdúzcalos en la cepa GV3101 de A. tumefaciens.
- Cultivar Agrobacterium en medio de peptona de extracto de levadura (YEP) (10 g de extracto de carne de vacuno, 10 g de extracto de levadura y 5 g de NaCl por L) con los antibióticos correspondientes (espectinomicina para 35S::RUBY y kanamicina para CRISPR/Cas9) a 28 °C. Las colonias individuales se observaron 36-48 h después del cultivo.
- Recoja y transfiera las colonias a medio líquido YEP (con los antibióticos correspondientes) para un mayor crecimiento. Después de 24-36 h, utilice los cebadores de RUBY-F y RUBY-R (Tabla 1) para realizar PCR y confirmar la transferencia exitosa de plásmidos a Agrobacterium.
- Transfiera 1 mL del Agrobacterium transformado con éxito en 100 mL de medio YEP líquido fresco (con los antibióticos correspondientes) y luego crezca durante la noche a 28 °C a un OD600 de 0,8.
- Centrifugar la suspensión bacteriana a 4.000 x g durante 5 min a 4 °C, lavar el gránulo bacteriano una vez con el medio de infiltración de suspensiones (10 mM MgCl2 y 10 mM MES-KOH [pH 5,6]), y luego centrifugar de nuevo. Vuelva a suspender el gránulo bacteriano en un medio de infiltración en suspensión a un diámetro exterior600 de 0,6 para la transformación del bambú.
3. Agrobacteria mediada en el sistema de transformación de plantas
- Prepárate para la transformación; Retire con cuidado las plántulas con raíces adheridas al suelo del sustrato, asegurándose de que las raíces permanezcan intactas. Envuelva las plántulas con papel de aluminio para mantener la humedad y evitar que el suelo se desprenda (Figura 1A).
- Transfiera las plántulas envueltas a un ambiente con mayor humedad (humedad relativa del aire >90%) y menor iluminación (intensidad inferior a 50 μmol/m 2/s) durante2 h.
- Con una aguja afilada de una jeringa, enrolle la parte superior de las hojas inmaduras rizadas (aproximadamente a 1-2 cm de la parte superior) de las plántulas de bambú una o dos veces (como lo indican los triángulos rojos en la Figura 1A).
- Luego, sumerja la parte superior herida de las plántulas en suspensiones de Agrobacterium. Realice todo el proceso, desde la herida hasta la inmersión en Agrobacterium rápidamente, ya que la herida fresca aumentará la eficiencia de la inoculación.
- Transfiera inmediatamente las plántulas a una cámara de vacío con una presión de 25-27 mmHg durante 2 minutos (Figura 1B).
- Después de aspirar, desenvuelva con cuidado las plántulas y vuelva a plantarlas en el sustrato. Coloque las plántulas en luz tenue u oscuridad (<50 μmol/m 2/s) con alta humedad (HR>90%) a temperatura ambiente (18-25 °C) durante2 días. Posteriormente, cultive las plántulas en condiciones normales de crecimiento, regándolas cada 5-7 días. Observar sus fenotipos para proporcionar materiales para experimentos posteriores.
4. Diseño de ARN de guía única (sgRNA) para la edición de genes
- Identificar un sitio de motivo adyacente protoespaciador (PAM) ubicado cerca de un dominio específico y conservado de la secuencia del gen diana. Asegúrese de que la secuencia PAM específica sea NGG en este sistema CRISPR/Cas9. Verifique la especificidad en el objetivo de la secuencia seleccionada realizando una búsqueda de BlastN en la base de datos del genoma del bambú. Asegúrese de que el sgRNA sea único, especialmente en la región aguas arriba y cerca del PAM 9,11.
NOTA: Esta comparación reducirá efectivamente los posibles sitios fuera del objetivo en el genoma afectados por el proceso de edición de genes. - Diseñe dos sgRNAs (sgRNA-1 y sgRNA-2) en el primer exón del gen PeVDE 13. Incluya los sitios de restricción de la edad I aguas arriba de la PAM en sgRNA-1 y los sitios de restricción XbaI aguas arriba de laPAM en sgRNA-2. Diseñe un sgRNA en el cuarto exón del gen PeCCR5, que codifica el motivo conservado de KNWYCYGK. Este motivo es fundamental para la catálisis de CCRs14.
- Diseñe una secuencia espaciadora de 20 nucleótidos adyacente al sitio PAM. Esta secuencia espaciadora guiará a la enzima Cas9 al sitio objetivo para la escisión del ADN y la posterior edición de genes.
NOTA: Es aconsejable elegir una región diana aguas arriba del sitio de escisión de la enzima endonucleasa dentro del sitio PAM. Esto facilitará la validación de la eficiencia de la edición de genes.
5. Diseño de cebadores y PCR
- Diseñe manualmente cebadores específicos para la amplificación de los fragmentos PeVDE y PeCCR5 . Diseñe los cebadores aguas arriba y aguas abajo para que se ubiquen al menos a 100 pb fuera del sitio objetivo, con una diferencia de longitud de más de 100 pb para permitir una separación de bandas distintiva durante la electroforesis. Diseñar cebadores para la amplificación de RUBY dentro de los primeros 500 pb del gen. En la Tabla 1 se proporciona una lista de todas las imprimaciones utilizadas.
- Utilice una ADN polimerasa de alta fidelidad para la PCR. En este caso, utilice la ADN polimerasa con alta fidelidad y amplificación eficiente en la clonación de genes.
- Prepare la mezcla de reacción de PCR de la siguiente manera: tampón 5x (Mg2+ Plus): 4 μL; Mezcla de dNTP (2,5 mM cada una): 1,6 μL; Cebadores directos e inversos (10 pmol cada uno): 1 μL cada uno; ADN del genoma del bambú (aproximadamente 50 ng); ADN polimerasa (2,5 U/μL): 0,2 μL; Diluir el agua hasta un volumen total de 20 μL.
- Siga las condiciones de funcionamiento de la PCR: Desnaturalización inicial a 98 °C durante 5 min; Desnaturalización a 98 °C durante 10 s; Recocido a 56 °C durante 5 s; Extensión a 72 °C durante 30 s; Repita la desnaturalización hasta la extensión durante 32 ciclos; Extensión final a 72 °C durante 5 min; Mantener a 4 °C indefinidamente.
NOTA: Las condiciones de PCR se proporcionan como ejemplo y es posible que deban optimizarse para aplicaciones u objetivos específicos.
6. Extracción de ADN, digestión de enzimas endonucleasas y secuenciación
- Separe la región con valores más bajos de NPQ de las hojas frescas de bambú con unas tijeras, como se identifica en el fluorímetro PAM de imágenes (consulte el paso 7.4). Congele las muestras de hojas con nitrógeno líquido y transfiera las muestras de hojas congeladas a un mortero. Muele las muestras hasta obtener un polvo fino con un mortero, agregando suficiente nitrógeno líquido durante el proceso de molienda. Este paso ayuda a liberar el contenido celular, incluido el ADN.
- Extraiga el ADN genómico de la hoja en polvo utilizando el método de bromuro de amonio de cetiltrimetilamonio (CTAB). Añadir 50 mg de muestras de polvo de hojas a 800 μL de una solución de CTAB al 2%. Mezclar bien la muestra e incubar a 65 °C durante 30 min, agitando suavemente cada 5 min.
- Agregue un volumen igual de cloroformo/alcohol isoamílico (24:1, v/v) y agite vigorosamente la mezcla. Después de la centrifugación a 8.000 g durante 8 min, transfiera el sobrenadante a un tubo nuevo.
- Añadir un volumen igual de cloroformo/alcohol isoamílico y repetir el paso 6.3. Añadir un volumen igual de isopropanol helado e invertir el tubo varias veces antes de colocarlo a -20 °C durante 30 min. Después de centrifugar a 8.000 x g durante 5 min, deseche el sobrenadante.
- Lavar el gránulo de ADN 2 veces con etanol al 75% a 4 °C, luego disolver en 50 μL de agua.
- Amplifique el ADN genómico que contiene el sitio diana de los genes diana de hojas de bambú de tipo salvaje e infectadas con Agrobacterium con el protocolo del paso 5.4.
- Realizar la digestión de la enzima endonucleasa de los productos de PCR. Seleccione una enzima específica que reconozca los sitios de restricción deseados dentro de los fragmentos de ADN amplificados. Utilice las endonucleasas AgeI y XbaI para la digestión.
- Preparar una mezcla de reacción compuesta por AgeI o XbaI (20 unidades/μL)- 1 μL, 1 μg de productos de PCR, 10x tampón- 5 μL, y añadir agua hasta un volumen total de 50 μL. Incubar a 37 °C durante 1 h.
- Analizar la proporción de fragmentos de ADN digeridos mediante electroforesis en gel. Compare los fragmentos digeridos de las muestras de tipo salvaje e infectadas por Agrobacterium para evaluar la eficiencia de la edición de genes.
- Marque las secuencias del adaptador de transposasa TCGTCGGCAGCGTCAGATGTGTGTATAAGAGACAG y GTCTCGTGGGCTCGGAGATGTGTATAAGAGACAG en el extremo 5' de los cebadores directo e inverso, respectivamente, para la amplificación de los fragmentos PeVDE y PeCCR5 9,15. Utilice el protocolo descrito en el paso 5.4 para la amplificación. Preparar los productos de PCR (antes de la digestión) para la secuenciación profunda.
7. Medición de la fluorescencia de la clorofila de los valores de NPQ en hojas
- Antes de las mediciones, exponga las plántulas de bambú a condiciones de alta intensidad de luz de 1200 μmol/m 2/s durante2 h. Esta exposición aumenta la cantidad de luz absorbida y activa el sistema de fotoprotección en las hojas.
- Utilice un fluorímetro PAM para medir la fluorescencia de clorofila PS II in vivo de las hojas de bambú. Ajuste la intensidad de la luz actínica a 800 μmol/m2/s para mediciones de fluorescencia de 6 minutos. Durante este período, aplique un pulso de saturación cada 30 s para obtener curvas de fluorescencia de clorofila. Los valores estables de las curvas se utilizarán para los cálculos13.
- Calcule el enfriamiento no fotoquímico (NPQ) utilizando la fórmula:
NPQ = (F m - F m') / F m'
donde F m representa la fluorescencia máxima en el estado adaptado a la oscuridad, y Fm' representa la fluorescencia máxima en cualquier estado adaptado a la luz. - Supervise los valores de NPQ desde la interfaz visual del software de imágenes. El software permite el análisis y la visualización en tiempo real de los datos de fluorescencia, incluidos los valores NPQ.
Resultados
Expresión génica mediada por agrobacterias en plantas en hojas de bambú
Se ha demostrado que el gen reportero RUBY es eficaz en la visualización de la expresión génica transitoria debido a su capacidad para producir betalaína roja viva a partir de la tirosina10. En este estudio, se utilizó la transformación mediada por Agrobacterium para expresar transitoriamente el gen exógeno RUBY en hojas de bambú (Figura 1). A los3 días después de la infección, se observó una coloración roja en las hojas plegadas inmaduras, que se volvió más vívida al5 día una vez que las hojas se habían desplegado (triángulo azul, Figura 1C). Estos resultados demuestran que Agrobacterium medió con éxito la expresión del gen exógeno RUBY en hojas de bambú y que se produjo la síntesis de betalaína.
Además, se compararon cuatro cepas de Agrobacterium (AGL1, LBA4404, EHA105 y GV3101) y se encontró que la cepa GV3101 causó la acumulación más significativa de betalaína en las hojas de bambú infectadas, con el mayor porcentaje de 85,2% de las plántulas acumuladas de betalaína después de ser infectadas, seguida de AGL1 (76,9%) y luego EHA105 (49,1%) y LBA4404 (31,3%; Figura 1D). Esto sugiere que GV3101 es la cepa más adecuada para este propósito. Se realizó una PCR de alta fidelidad para detectar si el fragmento de ADN-T mediado por Agrobacterium se había integrado en el cromosoma de bambú. Después de 40 ciclos de PCR, no se detectaron bandas del gen RUBY , lo que indica que el fragmento de ADN-T no se integró o se integró en un número tan bajo que no se pudo detectar. Por lo tanto, estos resultados concluyen que esta expresión génica es transitoria.
En general, estos hallazgos demuestran la viabilidad de la expresión génica transitoria en planta mediada por Agrobacterium en bambú utilizando el gen reportero RUBY. Sin embargo, se encontró que el color rojo de la betalaína era inestable y desapareció después de 3 meses de infección, lo que indica que el sistema de expresión transitoria no es estable para la observación a largo plazo.
Edición genética in planta del gen de la violaxantina de-epoxidasa de bambú (PeVDE)
La expresión génica mediada por agrobacterias en plantas es un método transitorio de expresión génica en bambú. Para investigar si un sistema transitorio CRISPR/Cas9 podría lograr la edición de genes en hojas de bambú, se seleccionó la enzima clave en el ciclo de la xantofila del bambú, la violaxantina desepoxidasa (PeVDE), como objetivo para la edición de genes de prueba. Se diseñaron ARN de guía única (sgRNAs) en el primer exón del gen PeVDE (sgRNA-1), que contiene sitios de restricción de la Edad I aguas arriba del motivo adyacente del protoespaciador (PAM) para facilitar la validación de laedición génica (Figura 2A).
La construcción CRISPR/Cas9 portadora de sgRNA-1 se transfectó a Agrobacterium para transformar hojas de bambú. Después de la infección de la Agrobacteria que contenía las construcciones CRISPR/Cas9 portadoras de sgRNA-1 durante 5 días, las plántulas de bambú se sometieron a un tratamiento de alta luz y, posteriormente, se realizó la detección de parámetros de fluorescencia de clorofila. Se encontraron ciertas áreas de las láminas foliares que tenían valores más bajos de enfriamiento no fotoquímico (NPQ) (Figura 2B), lo que indica que la capacidad de fotoprotección de estas áreas se redujo bajo luz intensa. Como el gen PeVDE tiene la capacidad de disipar el exceso de energía luminosa absorbida13, es probable que estas áreas con valores más bajos de NPQ sean las regiones donde se editó el gen PeVDE. A continuación, se realizó la digestión enzimática y el análisis de secuenciación del fragmento del gen PeVDE en estas áreas de las láminas foliares (Figura 2C-D) y se encontró que la tasa de mutación del sgRNA-1 fue del 17,33%, lo que indica que la edición génica fue exitosa en estas áreas del gen PeVDE.
Además, se diseñó otro sitio diana de sgRNA, sgRNA-2, que contiene un sitio de restricción XbaI, en el primer exón de PeVDE. Para investigar la posibilidad de deleción de fragmentos largos con doble objetivo de sgRNA, se realizó la edición de genes en ambos sitios diana, lo que resultó en la deleción de fragmentos largos (Figura 2E).
Mutante PeVDE editado utilizado como reportero en el sistema de edición de genes transitorios
Se investigó si el sgRNA PeVDE podría servir como reportero en el sistema de edición de genes transitorios. Se seleccionó aleatoriamente el gen de la cinamoil-CoA reductasa (PeCCR5) (Gene ID: PH02Gene42984.t1) para evaluar el reportero PeVDE . Se diseñó una diana de ARNg para PeCCR5 en su motivo conservado en el cuarto exón. La construcción CRISPR/Cas9 que contiene ambos sgRNAs, PeVDE y PeCCR5, se transformó en hojas de bambú (Figura 3A).
Después de la infección por Agrobacterium durante 30 días, las plántulas se trataron con luz de alta intensidad durante 20 min. Se observó que solo las áreas foliares editadas para el gen PeCCR5 no tuvieron efecto sobre los valores de NPQ, mientras que las áreas foliares transfectadas por sgRNAs tanto de PeVDE como de PeCCR5 exhibieron valores de NPQ más bajos (Figura 3B).
Posteriormente, se amplificó y secuenció el fragmento de PeCCR5 de las áreas foliares con valores de NPQ más bajos y se encontró una eficiencia de mutación del 8,3% utilizando secuenciación profunda. Por lo tanto, el reportero PeVDE sirvió con éxito como reportero de edición de genes transitorios y se puede utilizar para detectar la edición de genes de otros genes endógenos del bambú.
En general, estos resultados demuestran la viabilidad de la edición genética del bambú utilizando CRISPR/Cas9 en bambú.
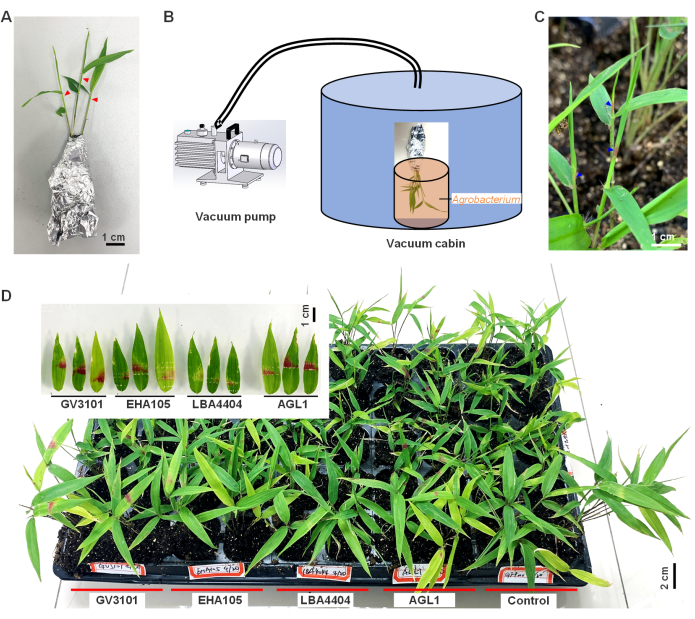
Figura 1: Expresión en planta del gen RUBY y acumulación de betalaína en hojas de bambú moso. (A) Plántulas de bambú Moso envueltas en papel de aluminio y listas para la infección por Agrobacterium, con triángulos rojos que indican las posiciones que fueron heridas por una aguja afilada de una jeringa. (B) Proceso de infiltración al vacío de plántulas de bambú. (C) Acumulación de betalaína en hojas de bambú después de 3 días de infección observada a través de cambios fenotípicos. (D) Aquí, se realizó la transformación del gen RUBY mediada por cuatro cepas de Agrobacterium, AGL1, LBA4404, EHA105 y GV3101 en hojas de bambú. GV3101 que alberga la construcción GFP se utilizó como control negativo. Esta cifra ha sido modificada de9. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: En planta expresión y edición génica del gen PeVDE en hojas de bambú. (A) Información sobre la ubicación y la secuencia diana del sgRNA en el gen PeVDE. Los triángulos rojos indican las posiciones de los cebadores hacia adelante y hacia atrás para la amplificación de fragmentos. (B) NPQ e imágenes crudas de hojas de bambú después de la infección. Los números de la imagen NPQ representan los valores NPQ en el monitor del software de imágenes. (C) Resultados de la electroforesis del fragmento de PeVDE antes y después de la digestión de la EdadI. WT denota las hojas no infectadas de tipo silvestre, y + y - representan fragmentos de PeVDE con o sin digestión de la EdadI, respectivamente. (D) Resultados de secuenciación profunda del fragmento PeVDE en hojas de menor valor NPQ. Las fuentes roja, azul y gris de las secuencias representan los sitios de destino, PAM e inserciones, respectivamente. Los guiones rojos indican nucleótidos eliminados. (E) Resultados de la secuenciación de Sanger del fragmento PeVDE después de la edición por sgRNA-1 y sgRNA-2. Esta cifra ha sido modificada de9. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: PeVDE sgRNA como reportero para la edición génica de cribado de PeCCR5. (A) Representación esquemática de construcciones CRISPR/Cas9 que contienen sgRNAs PeVDE y PeCCR5. (B) NPQ e imágenes crudas de hojas de bambú después de la infección con las construcciones en (A). Los triángulos blancos indican áreas con valores de NPQ más bajos. El color del arco iris representa el valor de NPQ/4, donde el rojo corresponde al valor mínimo y el púrpura corresponde a 1. (C) Las fuentes roja, azul y gris de las secuencias representan los sitios de destino, el PAM y las inserciones, respectivamente. Los guiones rojos indican nucleótidos eliminados. Esta cifra ha sido modificada de9. Haga clic aquí para ver una versión más grande de esta figura.
| Nombre del gen | Secuencia de cebadores (5'-3') | Aplicación | ||
| RUBÍ | F: ATGGATCATGCGACCCTCG | Para la amplificación por PCR en hojas de bambú infectadas | ||
| R: GTACTCGTAGAGCTGCTGCAC | ||||
| PeVDE | F: TGTGGCTTCTAAAGCTCTGCAATCT | Para la clonación y secuenciación de genes | ||
| R: TGTCAATGCTACAAGTCCTGGCA | ||||
| PeVDE-Target1 | F: GGCATAGCCCTCACGCAGCACCGG | Para el diseño de la diana PeVDE sgRNA-1 | ||
| R: AAACCCGGTGCTGGGGTGGCTA | ||||
| PeVDE-Target2 | F: GGCACTCCACGGTCCCAAATCTAG | Para el diseño de la diana PeVDE sgRNA-2 | ||
| R: AAACCTAGATTTGGGACCGTGGAG | ||||
| Objetivo PeCCR5 | F: GGCACTGGTACTGCTACGCTAAGA | Para el diseño de la diana de ARNg de PeCCR5 | ||
| R: AAACTCTTAGCGTAGCAGTACCAG | ||||
Tabla 1: Información de la secuencia de los cebadores.
Discusión
Este método reduce significativamente el tiempo requerido en comparación con los métodos tradicionales de transformación genética, que suelen tardar entre 1 y 2 años, y logra la expresión transitoria de genes exógenos y la edición genética de genes endógenos en 5 días. Sin embargo, este método tiene limitaciones, ya que solo puede transformar una pequeña proporción de células, y las hojas editadas genéticamente son quiméricas y carecen de la capacidad de regenerarse en plantas completas. Sin embargo, esta tecnología de expresión génica y edición génica in plant proporciona un enfoque poderoso para la verificación funcional de genes endógenos de bambú.
Actualmente, la expresión génica en planta y la tecnología de edición génica solo se pueden realizar en hojas inmaduras (rizadas), no en hojas maduras. A medida que las hojas se despliegan y se agrandan, aumenta el número de células editadas genéticamente que se dividen, lo que permite la edición genética en regiones foliares específicas. Sin embargo, el método de transformación mediada por Agrobacterium utilizado no da lugar a la inserción del ADN-T exógeno en el cromosoma de bambú, lo que dificulta el uso de genes marcadores estables en el bambú 6,9. Por lo tanto, es difícil determinar la ubicación exacta de estas regiones. Para abordar esto, se editó el gen PeVDE, y el área editada exhibió una disminución de la capacidad de fotoprotección bajo un tratamiento de alta luz, como lo indican los valores más bajos de NPQ, que se pueden detectar fácilmente utilizando un fluorómetro de clorofila (PAM). Por lo tanto, PeVDE se desarrolló como un marcador en bambú para detectar la aparición de expresión génica exógena y edición de genes. Debido a la alta conservación de este gen en diferentes especies 13, también se puede aplicar ampliamente a otras plantas.
Debido a la deposición de una capa de cera cuticular en la epidermis de las hojas de bambú, junto con la morfología característica rizada y bien envuelta de las hojas inmaduras, la accesibilidad de Agrobacterium a las células de las hojas se ve significativamente obstaculizada. Con el fin de mejorar la eficacia de la infección por Agrobacterium, se han utilizado enfoques físicos, incluida la infiltración de heridas y vacío, para promover la entrada de Agrobacterium en las hojas de bambú rizadas encerradas. Este proceso permite una estrecha proximidad entre Agrobacterium y las células de las hojas, mejorando así la eficiencia de la transformación genética. Mientras tanto, este sistema de edición genética se ha limitado hasta ahora a las hojas de bambú y no puede expresarse en órganos con capacidad reproductiva, como semillas y yemas laterales que pueden ser heredadas por la siguiente generación. Las aplicaciones futuras de la técnica se optimizarán para lograr la expresión génica en planta y la tecnología de edición génica en órganos con capacidad reproductiva, con el objetivo de obtener plantas regeneradoras heredables de manera estable.
Divulgaciones
Los autores declaran que no tienen intereses contrapuestos.
Agradecimientos
Los autores desean agradecer al Programa Nacional de Investigación y Desarrollo Clave de China (Subvención No. 2021YFD2200502), a la Fundación Nacional de Ciencias Naturales de China (Subvención No. 31971736) por el apoyo financiero.
Materiales
| Name | Company | Catalog Number | Comments |
| 35S::RUBY | Addgene, United States | 160908 | Plamid construct |
| Agrobacterium competent cells of GV3101, EHA105,LBA4404, and AGL1 | Biomed, China | BC304-01, BC303-01, BC301-01, and BC302-01 | For Agrobacterium infection |
| CTAB | Sigma-Aldrich, United States | 57-09-0 | DNA extraction |
| Imaging-PAM fluorometer | Walz, Effeltrich, Germany | Detect chlorophyll fluorescence of bamboo leaves | |
| ImagingWin | Walz, Effeltrich, Germany | Software for Imaging-PAM fluorometer | |
| Paq CI or Aar I | NEB, United States | R0745S | Incorporate the target sequence onto the CRISPR/Cas9 vector. |
| PrimeSTAR Max DNA polymerase | Takara, Japan | R045Q | For gene cloning |
| T4 DNA ligase | NEB, United States | M0202V | Incorporate the target sequence onto the CRISPR/Cas9 vector. |
Referencias
- Jiang, Z. H. World Bamboo and Rattan (in Chinese). , Liaoning Science and Technology Publishing House. Shenyang, China. (2002).
- Ye, S., et al. An efficient plant regeneration and transformation system of ma bamboo (Dendrocalamus latiflorus Munro) started from young shoot as explant. Frontiers in Plant Science. 8, 1298(2017).
- Ye, S., et al. Robust CRISPR/Cas9 mediated genome editing and its application in manipulating plant height in the first generation of hexaploid Ma bamboo (Dendrocalamus latiflorus Munro). Plant Biotechnology Journal. 18 (7), 1501-1503 (2020).
- Xiang, M., et al. Production of purple Ma bamboo (Dendrocalamus latiflorus Munro) with enhanced drought and cold stress tolerance by engineering anthocyanin biosynthesis. Planta. 254 (3), 50(2021).
- Huang, B., et al. An efficient genetic transformation and CRISPR/Cas9-based genome editing system for moso bamboo (Phyllostachys edulis). Frontiers in Plant Science. 13, 822022(2022).
- Lee, M. W., Yang, Y. Transient expression assay by agroinfiltration of leaves. Methods in Molecular Biology. 323, 225-229 (2006).
- Canto, T. Transient expression systems in plants: potentialities and constraints. Advances in Experimental Medicine and Biology. 896, 287-301 (2016).
- Chen, L., et al. A method for the production and expedient screening of CRISPR/Cas9-mediated non-transgenic mutant plants. Horticulture Research. 5, 13(2018).
- Sun, H., et al. A new biotechnology for in-planta gene editing and its application in promoting flavonoid biosynthesis in bamboo leaves. Plant Methods. 19 (1), 20(2023).
- He, Y., Zhang, T., Sun, H., Zhan, H., Zhao, Y. A reporter for noninvasively monitoring gene expression and plant transformation. Horticulture Research. 7 (1), 152(2020).
- Wang, C., Shen, L., Fu, Y., Yan, C., Wang, K. A simple CRISPR/Cas9 system for multiplex genome editing in rice. Journal of Genetics and Genomics. 42 (12), 703-706 (2015).
- McCormick, S., et al. Leaf disc transformation of cultivated tomato (L. esculentum) using Agrobacterium tumefaciens. Plant Cell Reports. 5 (2), 81-84 (1986).
- Lou, Y., et al. a violaxanthin de-epoxidase gene from moso bamboo, confers photoprotection ability in transgenic Arabidopsis under high light. Frontiers in Plant Science. 13, 927949(2022).
- Zhou, R., et al. Distinct cinnamoyl CoA reductases involved in parallel routes to lignin in Medicago truncatula. Proceedings of the National Academy of Sciences of the United States of America. 107 (41), 17803-17808 (2010).
- De Roeck, A., et al. Deleterious ABCA7 mutations and transcript rescue mechanisms in early onset Alzheimer's disease. Acta Neuropathologica. 134 (3), 475-487 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados