Method Article
Gen fonksiyonunun analizi için soya fasulyesi tüylü kök transformasyonu
Bu Makalede
Özet
Burada, transgenik soya fasulyesi tüylü köklerinin yüksek verimli üretimi için bir protokol sunuyoruz.
Özet
Soya fasulyesi (Glycine max), binlerce endüstriyel kullanıma sahip tarımda değerli bir üründür. Soya fasulyesi kökleri, azot ve patojenleri sabitlemek için simbiyoz oluşturan toprak kaynaklı mikroplarla etkileşimin birincil bölgesidir ve bu da tarımsal üretimini geliştirmek için soya fasulyesi kökü genetiğini içeren araştırmaları birincil öneme sahiptir. Soya fasulyesi tüylü köklerinin (HR'ler) genetik dönüşümüne Agrobacterium rhizogenes suşu NCPPB2659 (K599) aracılık eder ve soya fasulyesi köklerindeki gen fonksiyonunu incelemek için baştan sona sadece 2 ay süren etkili bir araçtır. Burada, soya fasulyesi HR'lerinde ilgi çekici bir genin aşırı eksprese edilmesi ve susturulması için kullanılan yöntemi özetleyen ayrıntılı bir protokol sunuyoruz. Bu metodoloji, soya fasulyesi tohumu sterilizasyonunu, kotiledonların K599 ile enfeksiyonunu ve RNA izolasyonu için genetik olarak dönüştürülmüş HR'lerin seçimini ve toplanmasını ve gerekirse metabolit analizlerini içerir. Yaklaşımın verimi, birkaç geni veya ağı aynı anda incelemek için yeterlidir ve uzun vadeli kararlı dönüşüm yaklaşımlarına geçmeden önce en uygun mühendislik stratejilerini belirleyebilir.
Giriş
Soya fasulyesi (Glycine max) tarımdaki en değerli ürünler arasındadır. Gıda, hayvan yemi, yağ gibi binlerce ticari ve endüstriyel kullanıma sahiptir ve üretim için hammadde kaynağı olarak1. Azot sabitleyici toprak mikroorganizmalarıyla, yani rizobiya ile simbiyotik bir ilişki kurma yeteneği, soya fasulyesi genetiğinin incelenmesinin önemini daha da arttırmaktadır2. Örneğin, soya fasulyesi köklerindeki azot fiksasyon özelliklerinin ince ayarlanması, karbon emisyonlarının azaltılmasına yol açabilir ve azotlu gübre3 gereksinimlerini büyük ölçüde azaltabilir. Bu nedenle, özellikle soya fasulyesi kök biyolojisinin yönlerini kontrol eden genetiği anlamak, tarım ve endüstride geniş uygulamalara sahiptir. Bu faydaları göz önünde bulundurarak, soya fasulyesi genlerinin işlevini analiz etmek için güvenilir bir protokole sahip olmak önemlidir.
Agrobacterium tumefaciens, transfer DNA'sını (T-DNA) birçok bitki türünün nükleer genomuna entegre etme yeteneğine sahip olduğu için bitki genetik dönüşümü için belki de en yaygın kullanılan araçtır. Agrobacterium bir bitkiyi enfekte ettiğinde, tümör indükleyen (Ti) plazmidi konakçı kromozomuna aktarır ve enfeksiyon bölgesinde bir tümör oluşumuna yol açar. Agrobakteri aracılı dönüşüm, gen fonksiyonel analizi için ve mahsul özelliklerini değiştirmek için on yıllardır yaygın olarak kullanılmaktadır4. İlgilenilen herhangi bir gen, A. tumefaciens aracılı transformasyon yoluyla konakçı bitki hücrelerine kolayca aktarılabilse de, bu yöntemin birkaç dezavantajı vardır; Zaman alıcı, pahalıdır ve soya fasulyesi gibi birçok bitki türü için kapsamlı uzmanlık gerektirir. Birkaç çeşit soya fasulyesi A. tumefaciens kullanılarak kotiledoner düğüm yaklaşımı ile dönüştürülebilse de, bu yaklaşımın verimsizliği hızlı ve yüksek verimli alternatif bir genetik transformasyon teknolojisine ihtiyaç duyulmasını zorunlu kılmaktadır 4,5. Uzman olmayan bir kişi bile bu dezavantajların üstesinden gelmek için bu Agrobacterium rizogenes aracılı tüylü kök (HR) dönüşüm yöntemini kullanabilir.
İK dönüşümü, sadece gen fonksiyonunu analiz etmek için değil, aynı zamanda özel metabolitlerin ve ince kimyasalların üretimi ve karmaşık biyoaktif glikoproteinler 6 gibi biyoteknolojik uygulamalar için de nispeten hızlı biraraçtır. Soya fasulyesi HR'lerinin üretimi, kotiledonların yüzeylerinin yaralanmasıyla üretilebildikleri için kapsamlı uzmanlık gerektirmez, ardından Agrobacterium rhizogenes7 ile aşılama yapılır. A. rhizogenes , T-DNA segmentini bitki hücrelerinin genomuna aktaran, taşıyan ve entegre eden ve aynı zamanda ektopik kök büyümesini uyaran Ti plazmidi tarafından kodlanan virülans (Vir) genlerini ifade eder8.
Doku, hücre ve organ kültürünün biyolistik veya A. tumefaciens tabanlı transformasyonu gibi diğer soya fasulyesi gen ekspresyon sistemleriyle karşılaştırıldığında, İK ekspresyon sistemi çeşitli avantajlar sergiler. İlk olarak, İK'lar genetik olarak stabildir ve hormonsuz medya 1,9,10'da hızlı bir şekilde üretilir. Ek olarak, İK'lar doğal köklere eşdeğer veya daha büyük miktarlarda özel metabolitler üretebilir11,12. Bu avantajlar, İK'ları A. tumefaciens ile uyumsuz olan veya uyumlu dokular oluşturmak için özel doku kültürü koşulları gerektiren bitki türleri için arzu edilen bir biyoteknolojik araç haline getirmektedir. HR yöntemi, RNA dizilimi13,14,15 kullanılarak protein-protein etkileşimlerini, protein hücre altı lokalizasyonunu, rekombinant protein üretimini, fitoremediasyonu, mutagenezi ve genom genişliğindeki etkileri analiz etmek için etkili bir yaklaşımdır. Ayrıca, soya fasulyesinin önemli mikrobiyal patojen Phytophthora sojae'ye karşı savunmasını sağlayan ve insanlarda etkileyici antikanser ve nöroprotektif aktivitelere sahip olan gliserolinler de dahil olmak üzere endüstride değeri olan özel metabolitlerin üretimini incelemek için de kullanılabilir16,17.
Bu rapor, soya fasulyesi HR'leri üretmek için kolay ve verimli bir protokol göstermektedir. Önceki HR dönüşüm yöntemleriyle karşılaştırıldığında, bu protokol, soya fasulyesi kotiledonlarını aşılamadan önce Ti plazmidinin varlığı için A. rhizogenes transformantlarının ön taramasından geçerek HR oluşum oranında önemli bir iyileşme (% 33 -% 50) sağlar. Bu protokolün uygulanabilirliğini, soya fasulyesi transkripsiyon faktörü genlerini aşırı eksprese eden veya susturan birkaç ikili vektörü dönüştürerek gösteriyoruz.
Protokol
NOT: Tüm işlem adımlarının steril koşullar altında yapılması önerilir.
1. Soya tohumu sterilizasyonu
- Bir biyogüvenlik kabininde, 16-20 yuvarlak Williams 82 soya fasulyesi tohumunu bozulmamış durumda (yani çatlak veya leke yok) 50 mL'lik bir santrifüj tüpüne yerleştirin.
- 30 mL% 70 izopropil alkol ekleyin, 30 s boyunca hafifçe çalkalayın ve ardından alkolü boşaltın.
- Tohumları 10 saniye boyunca 30 mL% 10 ağartıcı ile hafifçe çalkalayın ve tohumların oda sıcaklığında (RT, 25 ° C) 5 dakika boyunca çözelti içinde oturmasına izin verin. 5 dakika sonra ağartıcıyı süzün.
- Durulama başına 1 dakika boyunca 30 mL steril ultra safH2O ile çalkalamayı üç kez tekrarlayın ve her durulama arasında H2O'yu atın.
- Sterilize edilmiş tohumları, steril Petri kaplarında 5 mL çimlenme ve birlikte yetiştirme (GC) ortamı (otoklav, yarı mukavemetli sıvı Murashige ve Skoog [MS] ortamı,% 1 sakkaroz [pH = 5.8] ile doymuş filtre kağıdına yerleştirin ve ardından 2.5 mL / L vitaminleri ekleyin.
- Tohumların çimlenmesine izin vermek için plakaları 22 ° C'de 16 saat soğuk beyaz T5 floresan ışıkları (100 μE m-2 · s-1) altında 4 gün boyunca aktarmadan önce 3 gün boyunca RT'de (25 ° C) karanlıkta bırakın.
NOT: Buruşuk veya çatlamış tohumları atın. En iyi tohumlar büyük ve düzgün sarı olanlardır. Bazı tohumlar hasar, hastalıklar veya çimlenememe nedeniyle optimal olmayabileceğinden, iyi kalitede tohumları seçmek için deney için gereken tohum sayısını en az iki katına çıkarın.
2. Kotiledonların K599 ile enfeksiyonu
NOT: pGWB serisi vektörleri kullanın, çünkü ikili seçilimleri tüm T-DNA kasetinin genomik entegrasyonunu sağlar. Elektroporasyon, ilgili geni barındıran ikili bir vektörü A. rhizogenes pRi265918'e dönüştürmek için kullanıldı.
- A. rhizogenes pRi2659 plazmid18 dizisine dayanarak, Ti plazmid geni VirD2'yi (VirD2 ileri: 5 '-CCCGATCGAGCTCAAGTTAT-3'; VirD2 ters: 5'-TCGTCTGGCTGACTTTTTCGT-3'; Beklenen amplifikasyon boyutu: 221 BP). Dönüşümü takiben, bir PCR Kiti kullanarak VirD2'nin polimeraz zincir reaksiyonu (PCR) ile tutulması için Agrobacterium kolonilerini test edin (bakınız Malzeme Tablosu). PCR döngüsü: 3 dakika boyunca 94 °C; 35 döngü (1 dakika boyunca 94 °C, 30 saniye boyunca 58 °C, 1 dakika boyunca 72 °C); ve 10 dakika boyunca 72 ° C.
- Hem VirD2 hem de ilgilenilen geni (GOI) içeren A. rhizogenes kolonisinin seçilmesini takiben, bazılarını ilgilenilen plazmid için uygun antibiyotikleri (50 mg / L) içeren Luria-Bertani (LB) orta plakalarına çizin ve gece boyunca 30 ° C'de inkübe edin. Spektinomisin kullanıyorsanız, 100 mg / L'lik bir konsantrasyon ekleyin.
- LB plakalarından ~1,5 cm uzunluğundaki K599 Agrobakterisini kazımak için bir P200 pipet ucu kullanın ve hücreleri 1 mL fosfat tamponunda yeniden askıya alın (PB; 0,01 M Na2HPO4, 0,15 M NaCl, pH 7,5).
- Agrobakteriyi sterilize edilmiş, ultra safH2O (v / v = 1: 1) ve asetosiringon (AS; dimetil sülfoksit [DMSO] içinde 100 mM stok, v / v = 1: 1000) seyreltin. 600 nm (OD600) optik yoğunlukta bir küvet tüpü kullanarak absorbansı ölçün. Beklenen optimum aralık 0,5 ile 0,8 arasındadır.
- Bir biyogüvenlik kabininde, sterilize edilmiş bir neşteri K599 Agrobacterium çözeltisine batırın ve kotiledonun iç yüzeyi (adaksiyel, düz taraf) boyunca birkaç 1 mm derinliğinde kesim yapın. Aşılama sırasında, kotiledonu stabilize etmek için sterilize edilmiş forseps kullanın.
- Yaklaşık 6-8 kotiledon, AS ile GC ortamına doymuş filtre kağıdı içeren bir Petri kabına yan yana kesilmiş olarak yerleştirin.
NOT: 6 plaka hazırlamak için, 100 μM'lik bir nihai konsantrasyon elde etmek için 50 mL GC ortamı ve 50 μL 100 mM AS yeterlidir. - Plakaları RT'de (25 ° C) 16 saatlik bir fotoperiyot (~ 65 μE) altında 3 gün boyunca inkübe edin.
- Enfekte kotiledonları tüylü kök büyümesi (HRG) plakalarına aktarın (% 3 sakkaroz [pH = 5.8] ve 2.6 g / L Gelzan ile otoklav yarı mukavemetli MS, daha sonra 2.5 mL / L vitamin karışımı ve 500 mg / L timentin ekleyin).
NOT: K599'un ortadan kaldırılmadığı bazı alternatif satıcılardan timentin ile ilgili bazı sorunlar vardı. HRG ortamı için daha uzun Petri çanak plakalarının (100 mm x 25 mm) kullanılması önerilir. - HRG plakalarını bir büyüme odasında 22 ° C'de, parametreleri 2-3 cm uzunluğunda ikincil köklere sahip birincil kökler gözlenene kadar (~ 3-4 hafta) 16 saatlik bir fotoperiyotta 100 μE ışığa ayarlanmış olarak inkübe edin.
3. İK'ların seçimi ve toplanması
- Nasırdan büyüyen ve steril bir neşter ve forseps kullanarak ikincil kökler (2-3 cm uzunluğunda) içeren birincil kökleri (5-7 cm uzunluğunda) hasat edin. Uygun antibiyotikleri içeren HRG plakalarını seçime aktarın. Seçim HRG plakalarında İK'ların 5 gün daha büyümesine izin verin.
NOT: Kanamisin (50 mg / L), higromisin (50 mg / L) veya fosfinotrisin (10 mg / L) tipik olarak seçim için kullanılır. İfade vektörleri için, pGWB2 aşırı ekspresyon için kullanılır, pANDA35HK RNAi susturma için kullanılır, pGWB6 hücre altı lokalizasyon için kullanılır ve pMDC7 indüklenebilir ekspresyon için kullanılır. - 5. günde, 3-6 cm uzunluğunda ikincil kökleri olan transgenik HR'leri hasat edin. Floresan proteinleri gözlemlerseniz, ikincil kökler çok az otofloresansa sahiptir. Elicitor veya kimyasal işlemler yapıyorsanız, ikincil kökleri 1 cm'lik parçalara ayırın ve bir yığın halinde HRG agar üzerine ~ 100 mg yerleştirin. Daha sonra, kazıkları 80 μL uygun işlemle doyurun ve plakaların RT'de (25 ° C) inkübe olmasına izin verin.
- İstenilen tedavi süresinden sonra, RNA veya metabolit ekstraksiyonlarına devam edin.
- RNA için, kökleri sterilize edilmiş bir kağıt havlu üzerinde hızla kurutun ve doğrudan 2 mL'lik bir mikrosantrifüj tüpüne toplayın.
- Parafilm kullanarak tüpün üstünü hemen kapatın, sivri forseps kullanarak iki küçük delik açın ve tüpleri sıvı azota batırın. 3 gün boyunca liyofilize edin, ardından numuneleri -80 ° C'de saklayın.
NOT: Beyaz olan İK'ları seçmek önemlidir. Seçici plakada 5 günlük büyümeden sonra, transgenik HR'ler beyaz kalacaktır, ancak transgenik olmayan kökler kahverengiye dönecektir.
Sonuçlar
Temsili sonuçlar yayınlanan verilerden 19,20'dir. Transforme K599 Agrobakterisinin koloni PCR (cPCR) sonuçları Şekil 1'de gösterilmiştir. Şekil 1'deki pozitif kolonilerin gösterdiği gibi, ilgilenilen gen cPCR ile tespit edilmiştir (Şekil 1A). Bununla birlikte, kolonilerin üçte biri ila yarısı, Ti plazmidinin kaybını gösteren VirD2 gen taraması için negatifti (Şekil 1B) ve nasır veya kıllı kökler üretemezdi. Şekil 2, soya fasulyesi HR'lerinin genel hazırlama prosedürünü ve gen ekspresyon analizini göstermektedir. Şekil 3, GFP-GmJAZ1-6'nın hücre altı lokalizasyonunu göstermektedir. Şekil 4, Williams 82 kıllı köklerinde gliseollin transkripsiyon faktörü GmHSF6-1'in aşırı ekspresyonunu ve GmMYB29A2'nin RNAi-susturulmasını gösteren bir gen ekspresyon analizidir. Benzer sonuçlar yakın tarihli birkaç raporda da elde edilmiştir20,21.

Resim 1: K599 Agrobakterisinin koloni PCR'si (cPCR), ilgili genin veya VirD2'nin koloni PCR primerleri kullanılarak kullanılmıştır. (A) İlgilenilen gen cPCR. (B) VirD2 cPCR. Kısaltmalar: C = koloni; +ve = pozitif kontrol; -ve = negatif kontrol. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 2: Soya fasulyesi tüylü kök (HR) kültürü ve gen fonksiyon analizi prosedürüne genel bakış. Nasır, K599 Agrobacterium enfeksiyonundan 2 hafta sonra yara bölgesinde oluşmuştur. Hücre farklılaşması 1 hafta sonra meydana geldi, daha sonra HR uzaması için 1 hafta geçti. Bunu HR hasadı ve 24 saat boyunca duvar glukan elicitor (WGE) / mock tedavisi izledi. HR'ler sırasıyla ultra performanslı sıvı kromatografisi (UPLC) analizi için metabolit ekstraksiyonuna ve gen ekspresyon analizi için RNA izolasyonuna tabi tutuldu. WGE, Phytophthora sojae'den duvar glukan elicitorudur. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
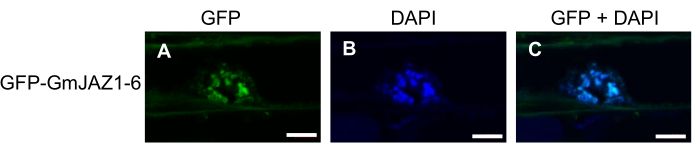
Resim 3: GmJAZ1-6'nın floresan mikroskopisi, transgenik Williams 82 kıllı köklerinde yeşil floresan proteine (GFP) translasyonel olarak kaynaşmıştır. (A) Yeşil kanal (GFP). (B) Mavi kanal (DAPI). (C) Birleştirilmiş yeşil ve mavi kanallar. Tüm görüntüler Zeiss konfokal mikroskop kullanılarak toplandı. DAPI (6 μg/mL) görüntüler nükleer lekelenmeyi gösterir. Ölçek çubukları 5 μm'dir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 4: Gen ekspresyon analizi. (A) GmHSF6-119 Williams 82 soya fasulyesi HR'lerinin 24 saat sahte tedavi altında aşırı ekspresyonunda gen ekspresyonu veya WGE ile 24 saat boyunca ortaya çıkması. (B) RNAi-GmMYB29A2 20 Williams 82 soya fasulyesi HR'lerinde gen ekspresyonu, WGE ile 24 saat boyunca ortaya çıktı. WGE, Phytophthora sojae'den duvar glukan elicitorudur. aKontrolden anlamlı olarak daha büyük ve banlamlı derecede daha az, eşleştirilmiş öğrenciler t-testi (p < 0.01). Hata çubukları SE'yi temsil eder (n ≥ 3 biyolojik replika). Bir birincil kökten toplanan ikincil kökler bir biyolojik replikasyonu gösterdi. Bu rakam Lin ve ark.19 ve Cihan ve ark.20'nin izniyle değiştirilmiştir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Tartışmalar
Son on yılda, soya fasulyesi HR yöntemi, azot fiksasyonu 22,23, biyotik ve abiyotik stres toleransı24,25 ve metabolit biyosentetik yolakları26,27'de yer alan genleri incelemek için güçlü bir araç olarak geliştirilmiştir. Bitkilerin metabolitleri nasıl ürettiklerine dair bilgi, tarımsal üretim ve ilaç endüstrisi için çok sayıda faydaya sahiptir, çünkü patojenlere karşı biyokimyasal savunmalara aracılık eden gen ağlarını incelemek için kullanılabilir28.
Üretkenliği ve maliyet verimliliğini önceliklendirmek için, bu protokol prosedürü basitleştirir. Örneğin, bir jelleştirici madde içeren daha pahalı katı ortamlar kullanmak yerine, soya fasulyesi tohumları, sıvı büyüme ortamına doymuş endüstriyel sınıf kağıt havlular kullanılarak steril koşullar altında çimlenir. Aseptik laboratuvar teknikleri ve steril çalışma koşullarının korunması, İK dönüşüm deneyleri için gereklidir, çünkü mantarlar ve maya gibi çok çeşitli mikroorganizmalar in vitro kültürlerin kontaminasyonuna neden olabilir.
Ek olarak, uygun ışık yoğunluğunu ve fotoperiyodu kullanmak İK kültürü için çok önemlidir. İn vitro kültürlerdeki bitkilerin büyüme ve gelişme süreci, önceki çeşitli çalışmalarda gözlemlendiği gibi, ışık yoğunluğu ve fotoperiyot kalitesinden önemli ölçüde etkilenir. Işık yoğunluğu çok düşük veya çok yüksekse, kök indüksiyon işlemini yavaşlatabilir. Benzer şekilde, fotoperiyot uygun değilse, nasır oluşumunun ve farklılaşmış hücre gelişiminin başarısızlığına yol açabilir29. Dahası, geçmiş deneylerimize dayanarak, transgenik olmayan HR'ler tek antibiyotik olarak kullanıldığında kanamisin'e (50 mg / L) dirençlidir. Bu nedenle, tipik olarak higromisin ve kanamisin için çift direnci kodlayan vektörler kullanıyoruz. Bu sıkı seçim altında, toplam köklerin% 15 -% 30'u arasında pozitif bir transgenik İK oranı elde edebiliyoruz, ancak bu HR'lerin ~% 80'i, vektörler tarafından kodlandığı gibi genleri önemli ölçüde aşırı ifade etti / susturdu.
HR dönüşüm deneylerinin başarısını sağlamak için, deneyde kullanılan A. rhizogenes suşunun virülans genlerini kodlayan Ti plazmidini tutup tutmadığını test etmek çok önemlidir. Ti plazmidinin varlığı, T-DNA'nın bitki genomu4'e başarılı bir şekilde entegrasyonu için gereklidir. Ti plazmidini tespit etmek için cPCR kullanımı bu protokolde önemli bir adım haline gelmiştir. Geçmişte, dönüşümlerimizin% 33 ila% 50'sinin kalli ve kök üretemediğini gördük. Bilmeden, bu, A. rizogenes'in dönüşümü veya daha sonra kültürlenmesi sırasında Ti plazmidinin kaybından kaynaklanıyordu. Şimdi, dönüşümlerini takiben Agrobacterium kolonilerinin PCR analizi ile, Ti plazmidinin mevcut olduğundan ve dönüşüm deneylerinin% 100'ünün kök ürettiğinden emin oluyoruz. Bu protokolde cPCR kullanımının, standart İK dönüşüm prosedürüne değerli bir katkı olduğu kanıtlanmıştır. Başarısız deneylerin sayısını azalttı, böylece hem zamandan hem de kaynaklardan tasarruf sağladı. cPCR adımı, dönüşüm sürecinin amaçlandığı gibi çalıştığını doğrulamamıza ve deneylerin sonuçlarının güvenilir ve tekrarlanabilir olmasını sağlamamıza da izin verdi.
Bununla birlikte, bu basitleştirilmiş yöntemin bazı sınırlamaları vardır. Örneğin, bu protokol transgenik İK'lardaki gen fonksiyonları hakkında temel hücre biyolojik sorularını cevaplayabilir. Bununla birlikte, sürgünler ve yapraklar gibi diğer bitki dokularıyla ilgili sorular İK'larda test edilemeyebilir. İncelenen sürecin ektopik hormon seviyelerinden veya A. rhizogenes tarafından tanıtılan diğer faktörlerden etkilenmediğini doğrulamak her zaman önemlidir. Araştırmacılar, sınırlamalarını not almalı ve doğru ve anlamlı sonuçlar elde etmek için deneyleri dikkatlice tasarlamalıdır.
Özetle, burada gösterilen protokol, soya fasulyesi köklerindeki gen fonksiyonunu araştırmak için oldukça etkili bir yöntemdir. Son zamanlarda, çok genli mühendislik yaklaşımlarını incelemede ve soya fasulyesi biyokimyasal savunmalarının düzenlenmesinde yer alan gen ağlarını anlamada değerini gösterdik19. Yaklaşımın göreceli verimliliği, bitki biyolojisinde çok sayıda genin araştırılmasını gerektiren karmaşık soruları cevaplamak için idealdir.
Açıklamalar
Yazarların açıklayacak hiçbir şeyi yok.
Teşekkürler
Bu araştırma, Kanada Doğa Bilimleri ve Mühendislik Araştırma Konseyi (NSERC) RGPIN-2020-06111 hibe numarası ve Brad Lace'den cömert bir bağış ile finanse edildi. K599 Agrobacterium ve ön protokol için Wayne Parrott'a (Georgia Üniversitesi) ve pGWB2, pGWB6 ve pANDA35HK boş vektörleri için Nakagawa & Hachiya laboratuvarına (Shimane Üniversitesi) teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Acetosyringone | Cayman | 23224 | |
| Bleach | lavo | 21124 | |
| DMSO | Fisher bioreagents | 195679 | |
| Gelzan | Phytotech | HYY3251089A | |
| Hygromycin | Phytotech | HHA0397050B | |
| Isopropyl alcohol | Fisher chemical | 206462 | |
| Kanamycin | Phytotech | SQS0378007G | |
| LB powder | Fisher bioreagents | 200318 | |
| MS powder | Caisson labs | 2210001 | |
| Na2HPO4 | Fisher bioreagents | 194171 | |
| NaCl | Fisher chemical | 192946 | |
| Petri dishes | Fisherbrand | 08-757-11 | 100 mm x 25 mm |
| Phosphinothricin | Cedarlane | P034-250MG | |
| REDExtract-N-Amp PCR Kit | Sigma | R4775 | |
| Sucrose | Bioshop | 2D76475 | |
| Timentin | Caisson labs | 12222002 | |
| Vitamins | Caisson labs | 2211010 |
Referanslar
- Li, S., et al. Optimization of Agrobacterium-mediated transformation in soybean. Frontiers in Plant Science. 8, 246(2017).
- Elhady, A., Hallmann, J., Heuer, H. Symbiosis of soybean with nitrogen fixing bacteria affected by root lesion nematodes in a density-dependent manner. Scientific Reports. 10, 1619(2020).
- Huang, X. -F., et al. Rhizosphere interactions: root exudates, microbes, and microbial communities. Botany. 92 (4), 267-275 (2014).
- Ma, H., et al. Highly efficient Agrobacterium rhizogenes-mediated genetic transformation and applications in citrus. Frontiers in Plant Science. 13, 1039094(2022).
- Hwang, H. -H., Yu, M., Lai, E. -M. Agrobacterium-mediated plant transformation: biology and applications. The Arabidopsis Book. 15, e0186(2017).
- Gutierrez-Valdes, N., et al. Hairy root cultures-a versatile tool with multiple applications. Frontiers in Plant Science. 11, 33(2020).
- Ono, N. N., Tian, L. The multiplicity of hairy root cultures: prolific possibilities. Plant Science. 180 (3), 439-446 (2011).
- Kereszt, A., et al. Agrobacterium rhizogenes-mediated transformation of soybean to study root biology. Nature Protocols. 2 (4), 948-952 (2007).
- Chen, L., et al. Soybean hairy roots produced in vitro by Agrobacterium rhizogenes-mediated transformation. The Crop Journal. 6 (2), 162-171 (2018).
- Song, J., Tóth, K., Montes-Luz, B., Stacey, G. Soybean hairy root transformation: a rapid and highly efficient method. Current Protocols. 1 (7), e195(2021).
- Fattahi, F., Shojaeiyan, A., Palazon, J., Moyano, E., Torras-Claveria, L. Methyl-β-cyclodextrin and coronatine as new elicitors of tropane alkaloid biosynthesis in Atropa acuminata and Atropa belladonna hairy root cultures. Physiologia Plantarum. 172 (4), 2098-2111 (2021).
- Farrell, K., Jahan, M., Kovinich, N. Distinct mechanisms of biotic and chemical elicitors enable additive elicitation of the anticancer Phytoalexin Glyceollin I. Molecules. 22 (8), 1261(2017).
- Cheng, Y., et al. Highly efficient Agrobacterium rhizogenes-mediated hairy root transformation for gene functional and gene editing analysis in soybean. Plant Methods. 17 (1), 73(2021).
- Arora, D., et al. Establishment of proximity-dependent biotinylation approaches in different plant model systems. Plant Cell. 32 (11), 3388-3407 (2020).
- Gomes, C., Dupas, A., Pagano, A., Grima-Pettenati, J., Paiva, J. A. P. Hairy root transformation: a useful tool to explore gene function and expression in Salix spp. recalcitrant to transformation. Frontiers in Plant Science. 10, 1427(2019).
- Ahmed, S., Kovinich, N. Regulation of phytoalexin biosynthesis for agriculture and human health. Phytochemistry Reviews. 20, 483-505 (2021).
- Walker, R. R., et al. Glyceollins trigger anti-proliferative effects in hormone-dependent aromatase-inhibitor-resistant breast cancer cells through the induction of apoptosis. International Journal of Molecular Sciences. 23 (5), 2887(2022).
- Tong, X., et al. The complete genome sequence of cucumopine-type Agrobacterium rhizogenes strain K599 (NCPPB2659), a nature's genetic engineer inducing hairy roots. International Journal of Agriculture Biology. 20 (5), 1167-1174 (2018).
- Lin, J., et al. RNA-Seq dissects incomplete activation of phytoalexin biosynthesis by the soybean transcription factors GmMYB29A2 and GmNAC42-1. Plants. 12 (3), 545(2023).
- Jahan, M. A., et al. Glyceollin transcription factor GmMYB29A2 regulates soybean resistance to Phytophthora sojae. Plant Physiology. 183 (2), 530-546 (2020).
- Jahan, M. A., et al. The NAC family transcription factor GmNAC42-1 regulates biosynthesis of the anticancer and neuroprotective glyceollins in soybean. BMC Genomics. 20, 149(2019).
- Nguyen, C. X., et al. Critical role for uricase and xanthine dehydrogenase in soybean nitrogen fixation and nodule development. The Plant Genome. , e20171(2021).
- Brear, E. M., et al. GmVTL1a is an iron transporter on the symbiosome membrane of soybean with an important role in nitrogen fixation. New Phytologist. 228 (2), 667-681 (2020).
- Chen, Z., et al. Overexpression of transcription factor GmTGA15 enhances drought tolerance in transgenic soybean hairy roots and Arabidopsis plants. Agronomy. 11 (1), 170(2021).
- Savka, M., Ravillion, B., Noel, G., Farrand, S. Induction of hairy roots on cultivated soybean genotypes and their use to propagate the soybean cyst nematode. Phytopathology. 80 (5), 503-508 (1990).
- Subramanian, S., Graham, M. Y., Yu, O., Graham, T. L. RNA interference of soybean isoflavone synthase genes leads to silencing in tissues distal to the transformation site and to enhanced susceptibility to Phytophthora sojae. Plant Physiology. 137 (4), 1345-1353 (2005).
- Sharma, A. R., Gajurel, G., Ahmed, I., Roedel, K., Medina-Bolivar, F. Induction of the prenylated stilbenoids arachidin-1 and arachidin-3 and their semi-preparative separation and purification from hairy root cultures of peanut (Arachis hypogaea l.). Molecules. 27 (18), 6118(2022).
- Lozovaya, V. V., et al. Isoflavonoid accumulation in soybean hairy roots upon treatment with Fusarium solani. Plant Physiology Biochemistry. 42 (7-8), 671-679 (2004).
- Rahimi Khonakdari, M., Rezadoost, H., Heydari, R., Mirjalili, M. H. Effect of photoperiod and plant growth regulators on in vitro mass bulblet proliferation of Narcissus tazzeta L. (Amaryllidaceae), a potential source of galantamine. Plant Cell, Tissue, and Organ Culture. 142 (1), 187-199 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır