Method Article
טרנספורמציה של שורש סויה שעיר לניתוח תפקוד גנים
In This Article
Summary
כאן, אנו מציגים פרוטוקול לייצור יעיל של שורשים שעירים סויה מהונדסים.
Abstract
פולי סויה (Glycine max) הוא גידול יקר ערך בחקלאות שיש לו אלפי שימושים תעשייתיים. שורשי פולי סויה הם האתר העיקרי של אינטראקציה עם מיקרובים הנישאים באדמה היוצרים סימביוזה כדי לתקן חנקן ופתוגנים, מה שהופך את המחקר המערב גנטיקה של שורש סויה לבעל חשיבות עליונה לשיפור הייצור החקלאי שלה. השינוי הגנטי של שורשים שעירים מפולי סויה (HRs) מתווך על ידי זן קנה השורש Agrobacterium NCPPB2659 (K599) והוא כלי יעיל לחקר תפקוד גנים בשורשי סויה, לוקח רק חודשיים מתחילתו ועד סופו. כאן, אנו מספקים פרוטוקול מפורט המתאר את השיטה לביטוי יתר והשתקה של גן בעל עניין ב- HRs סויה. מתודולוגיה זו כוללת עיקור זרעי סויה, זיהום של cotyledons עם K599, ובחירה וקציר של HRs מותמרים גנטית עבור בידוד RNA, ואם יש צורך, ניתוח מטבוליטים. התפוקה של הגישה מספיקה כדי לחקור בו זמנית מספר גנים או רשתות ויכולה לקבוע את האסטרטגיות ההנדסיות האופטימליות לפני התחייבות לגישות טרנספורמציה יציבות ארוכות טווח.
Introduction
פולי סויה (גליצין מקסימלי) הם בין הגידולים היקרים ביותר בחקלאות. יש לו אלפי שימושים מסחריים ותעשייתיים, כגון מזון, מזון לבעלי חיים, נפט, וכמקור לחומרי גלם לייצור1. יכולתו ליצור מערכת יחסים סימביוטית עם מיקרואורגניזמים מקבעי חנקן בקרקע, כלומר ריזוביה, מעלה עוד יותר את החשיבות של חקר גנטיקה של פולי סויה2. לדוגמה, כוונון עדין של תכונות קיבוע חנקן בשורשי סויה יכול להוביל להפחתת פליטות פחמן ולהפחית באופן משמעותי את הדרישות לדשן חנקן3. לפיכך, להבנת הגנטיקה השולטת בהיבטים של ביולוגיית שורש הסויה, בפרט, יש יישומים נרחבים בחקלאות ובתעשייה. בהתחשב ביתרונות אלה, חשוב שיהיה פרוטוקול אמין לניתוח תפקודם של גנים פולי סויה.
Agrobacterium tumefaciens הוא אולי הכלי הנפוץ ביותר לשינוי גנטי של צמחים, שכן יש לו את היכולת לשלב TRANSFER DNA (T-DNA) לתוך הגנום הגרעיני של מיני צמחים רבים. כאשר אגרובקטריום מדביק צמח, הוא מעביר את הפלסמיד מעורר הגידול (Ti) לכרומוזום המארח, מה שמוביל להיווצרות גידול באתר הזיהום. הטרנספורמציה בתיווך אגרובקטריום נמצאת בשימוש נרחב מזה עשרות שנים לניתוח תפקודי גנים ועל מנת לשנות תכונות יבול4. למרות שכל גן מעניין יכול להיות מועבר בקלות לתאי צמח מארח באמצעות טרנספורמציה בתיווך A. tumefaciens, לשיטה זו יש מספר חסרונות; זה גוזל זמן, יקר, ודורש מומחיות נרחבת עבור מיני צמחים רבים, כגון סויה. למרות שכמה זנים של פולי סויה יכולים להשתנות על ידי גישת צומת cotyledonary באמצעות A. tumefaciens, חוסר היעילות של גישה זו מחייב את הצורך בטכנולוגיית טרנספורמציה גנטית חלופית שהיא מהירה ויעילה מאוד 4,5. אפילו מי שאינו מומחה יכול להשתמש בשיטת טרנספורמציה זו של שורש שעיר בתיווך אגרובקטריום (HR) כדי להתגבר על חסרונות אלה.
טרנספורמציה של HR היא כלי מהיר יחסית, לא רק לניתוח תפקוד גנים, אלא גם ליישומים ביוטכנולוגיים, כגון ייצור מטבוליטים מיוחדים וכימיקלים עדינים, וגליקופרוטאינים ביו-אקטיביים מורכבים6. הייצור של HRs סויה אינו דורש מומחיות נרחבת, כפי שהם יכולים להיווצר על ידי פציעת פני השטח של cotyledons, ואחריו חיסון עם קנה שורש Agrobacterium7. A. rhizogenes מבטא גנים אלימים (Vir) המקודדים על ידי פלסמיד Ti שלו המעבירים, נושאים ומשלבים את מקטע T-DNA שלו בגנום של תאי צמח ובו זמנית ממריץ צמיחת שורשים חוץ רחמיים8.
בהשוואה למערכות ביטוי גנים אחרות של פולי סויה, כגון ביוליסטיקה או טרנספורמציה מבוססת A. tumefaciens של תרביות רקמות, תאים ואיברים, מערכת ביטוי HR מציגה מספר יתרונות. ראשית, HRs יציבים גנטית ומיוצרים במהירות על מדיה נטולת הורמונים 1,9,10. בנוסף, HRs יכולים לייצר מטבוליטים מיוחדים בכמויות שוות ערך או גדולות יותר משורשים מקומיים11,12. יתרונות אלה הופכים את HRs לכלי ביוטכנולוגי רצוי עבור מיני צמחים שאינם תואמים ל- A. tumefaciens או הזקוקים לתנאי תרבית רקמה מיוחדים כדי ליצור רקמות תואמות. שיטת HR היא גישה יעילה לניתוח אינטראקציות חלבון-חלבון, לוקליזציה תת-תאית של חלבונים, ייצור חלבונים רקומביננטיים, פיטו-רמדיציה, מוטגנזה והשפעות רחבות גנום באמצעות ריצוף RNA13,14,15. זה יכול לשמש גם כדי ללמוד את הייצור של מטבוליטים מיוחדים שיש להם ערך בתעשייה, כולל glyceollins, אשר תרופות ההגנה של סויה נגד הפתוגן המיקרוביאלי החשוב Phytophthora sojae ויש להם פעילויות אנטי סרטניות מרשימות neuroprotective בבני אדם16,17.
דו"ח זה מדגים פרוטוקול קל ויעיל לייצור HRs פולי סויה. בהשוואה לשיטות טרנספורמציה קודמות של משאבי אנוש, פרוטוקול זה מספק שיפור משמעותי (33%-50%) בקצב היווצרות משאבי אנוש על ידי סינון מוקדם של טרנספורמנטים של A. rhizogenes לנוכחות פלסמיד Ti לפני חיסון cotyledons סויה. אנו מדגימים את הישימות של פרוטוקול זה על ידי טרנספורמציה של מספר וקטורים בינאריים המבטאים יתר על המידה או משתיקים גנים של פקטורי שעתוק פולי סויה.
Protocol
הערה: מומלץ שכל שלבי ההליך יתנהלו בתנאים סטריליים.
1. עיקור זרעי סויה
- בארון בטיחות ביולוגית, הניחו 16-20 זרעי סויה עגולים במצב בתולי (כלומר, ללא סדקים או פגמים) בצינור צנטריפוגה של 50 מ"ל.
- מוסיפים 30 מ"ל של 70% אלכוהול איזופרופיל, מנערים בעדינות במשך 30 שניות, ולאחר מכן מרוקנים את האלכוהול.
- נערו בעדינות את הזרעים עם 30 מ"ל של אקונומיקה 10% למשך 10 שניות ואפשרו לזרעים לשבת בתמיסה במשך 5 דקות בטמפרטורת החדר (RT, 25°C). לאחר 5 דקות, מסננים את האקונומיקה.
- יש לחזור על הניעור שלוש פעמים עם 30 מ"ל של H 2 O סטרילי טהור במיוחד למשךדקה אחת בכל שטיפה ולהשליך את H2O בין כל שטיפה.
- הניחו את הזרעים המעוקרים על נייר פילטר רווי ב-5 מ"ל של מדיום נביטה וגידול משותף (GC) (נוזל אוטוקלאבי בחצי חוזק מורשיגה וסקוג [MS] בינוני עם 1% סוכרוז [pH=5.8] ולאחר מכן הוסיפו 2.5 מ"ל/ליטר ויטמינים) בצלחות פטרי סטריליות.
- מניחים את הצלחות בחושך ב RT (25 ° C) במשך 3 ימים לפני העברת הצלחות ב 22 ° C תחת 16 שעות לבן קריר T5 אורות פלואורסצנטי (100 μE m-2·s-1) במשך 4 ימים כדי לאפשר את הזרעים לנבוט.
הערה: השליכו זרעים מקומטים או סדוקים. הזרעים הטובים ביותר הם אלה שהם גדולים וצהובים באופן אחיד. יש לעקר לפחות פי שניים ממספר הזרעים הדרוש לניסוי כדי לבחור זרעים באיכות טובה, מכיוון שזרעים מסוימים עשויים שלא להיות אופטימליים עקב נזק, מחלות או כישלון לנבוט.
2. זיהום של cotyledons עם K599
הערה: השתמש בווקטורים מסדרת pGWB, מכיוון שהברירה הכפולה שלהם מבטיחה אינטגרציה גנומית של קלטת T-DNA כולה. אלקטרופורציה שימשה להפיכת וקטור בינארי המכיל את הגן המעניין לקנה שורש A . pRi265918.
- בהתבסס על הרצף של A. rhizogenes pRi2659 plasmid18, לתכנן פריימרים כדי לזהות את הגן פלסמיד Ti VirD2 (VirD2 קדימה : 5'-CCCGATCGAGCTCAAGTTAT-3'; VirD2 הפוך: 5'-TCGTCTGGCTGACTTTCGT-3'; גודל הגברה צפוי: 221 bp). לאחר הטרנספורמציה, בדוק את מושבות אגרובקטריום לשימור VirD2 על ידי תגובת שרשרת פולימראז (PCR) באמצעות ערכת PCR (ראה טבלת חומרים). מחזור PCR: 94 °C למשך 3 דקות; 35 מחזורים (94°C למשך דקה אחת, 58°C למשך 30 שניות, 72°C למשך דקה אחת); ו 72 ° C במשך 10 דקות.
- לאחר בחירת מושבת קני השורש A . המכילה גם את VirD2 וגם את הגן המעניין (GOI), פזרו חלק על לוחות בינוניים של לוריא-ברטאני (LB) המכילים את האנטיביוטיקה המתאימה (50 מ"ג/ליטר) לפלסמיד המעניין ודגרו למשך הלילה בטמפרטורה של 30 מעלות צלזיוס. אם אתם משתמשים בספקטינומיצין, יש להוסיף ריכוז של 100 מ"ג/ליטר.
- השתמש בקצה פיפטה P200 כדי לגרד אורך ~ 1.5 ס"מ של K599 Agrobacterium מן לוחות LB ולהשהות מחדש את התאים ב 1 מ"ל של חיץ פוספט (PB; 0.01 M Na2HPO4, 0.15 M NaCl, pH 7.5).
- לדלל את אגרובקטריום ב H2O מעוקר וטהור במיוחד (v/v = 1: 1) ו acetosyringone (AS; 100 mM מלאי בדימתיל סולפוקסיד [DMSO], v/v = 1:1000). מדוד את הספיגה באמצעות צינור קובטה בצפיפות אופטית של 600 ננומטר (OD600). הטווח האופטימלי הצפוי הוא בין 0.5 ל-0.8.
- בארון בטיחות ביולוגית, טבלו אזמל מעוקר בתמיסת K599 Agrobacterium ובצעו מספר חתכים בעומק 1 מ"מ לאורך המשטח הפנימי (צד אדקסיאלי, שטוח) של הקוטיילדון. במהלך החיסון, השתמש במלקחיים מעוקרים כדי לייצב את הקוטיילדון.
- מניחים כ-6-8 קוטילדונים חתוכים על צלחת פטרי המכילה נייר פילטר רווי במדיום GC עם AS.
הערה: כדי להכין 6 צלחות, 50 מ"ל של מדיום GC ו 50 μL של 100 mM AS כדי להשיג ריכוז סופי של 100 μM מספיק. - לדגור על הצלחות ב RT (25 ° C) במשך 3 ימים תחת photoperiod 16 שעות (~ 65 μE).
- העבירו את הקוטילדונים הנגועים לצלחות צמיחת שורשים שעירים (HRG) (טרשת נפוצה אוטוקלאבית בחצי חוזק עם 3% סוכרוז [pH = 5.8] ו-2.6 גרם/ליטר גלזן, ולאחר מכן הוסיפו תערובת ויטמינים של 2.5 מ"ל/ליטר ו-500 מ"ג/ליטר טימנטין).
הערה: היו כמה בעיות עם timentin מכמה ספקים חלופיים, אשר K599 לא בוטל. מומלץ להשתמש בצלחות צלחת פטרי גבוהות יותר (100 מ"מ x 25 מ"מ) עבור מדיום HRG. - לדגור על לוחות HRG ב 22 ° C בתא צמיחה עם הפרמטרים להגדיר 100 μE אור על photoperiod 16 שעות עד שורשים ראשוניים עם שורשים משניים 2-3 ס"מ אורך נצפים (~ 3-4 שבועות).
3. בחירה וקציר של משאבי אנוש
- קוצרים שורשים ראשוניים (5-7 ס"מ אורך) הצומחים מהיבלת ומכילים שורשים משניים (2-3 ס"מ אורך) באמצעות אזמל סטרילי ומלקחיים. מעבירים לבחירה צלחות HRG המכילות את האנטיביוטיקה המתאימה. תן למשאבי אנוש לגדול במשך 5 ימים נוספים על צלחות HRG הבחירה.
הערה: Kanamycin (50 מ"ג / ליטר), היגרומיצין (50 מ"ג / ליטר), או phosphinothricin (10 מ"ג / ליטר) משמשים בדרך כלל לבחירה. עבור וקטורי ביטוי, pGWB2 משמש לביטוי יתר, pANDA35HK משמש להשתקת RNAi, pGWB6 משמש ללוקליזציה תת-תאית, ו-pMDC7 משמש לביטוי אינדוקטיבי. - ביום החמישי, קוצרים HRs טרנסגניים עם שורשים משניים באורך 3-6 ס"מ. אם מתבוננים בחלבונים פלואורסצנטיים, לשורשים המשניים יש מעט אוטופלואורסצנטיות. אם אתם מבצעים טיפולים מעוררי השראה או כימיים, חתכו את השורשים המשניים לחתיכות של 1 ס"מ והניחו ~100 מ"ג על אגר HRG בערימה. לאחר מכן, להרוות את הערימות עם 80 μL של הטיפול המתאים ולאפשר את הצלחות לדגור ב RT (25 ° C).
- לאחר זמן הטיפול הרצוי, להמשיך עם RNA או מיצוי מטבוליטים.
- עבור RNA, לטפוח במהירות את השורשים יבש על מגבת נייר מעוקר ולקצור אותם ישירות לתוך צינור מיקרוצנטריפוגה 2 מ"ל.
- מיד לאטום את החלק העליון של הצינור באמצעות parafilm, לעשות שני חורים קטנים באמצעות מלקחיים מחודדים, לטבול את הצינורות בחנקן נוזלי. Lyophilize במשך 3 ימים, ולאחר מכן לאחסן את הדגימות ב -80 ° C.
הערה: חיוני לבחור משאבי אנוש לבנים. לאחר 5 ימים של צמיחה על הצלחת הסלקטיבית, HRs טרנסגניים יישארו לבנים, אך שורשים שאינם מהונדסים יהפכו חומים.
תוצאות
התוצאות המייצגות הן מתוך הנתונים שפורסמו 19,20. תוצאות PCR (cPCR) של K599 Agrobacterium שעבר טרנספורמציה מוצגות באיור 1. כפי שמצוין על-ידי המושבות החיוביות באיור 1, הגן המעניין זוהה על-ידי cPCR (איור 1A). אולם שליש עד מחצית מהמושבות היו שליליות לבדיקת הגן VirD2 (איור 1B), מה שמצביע על אובדן פלסמיד Ti, ולא היו מסוגלות לייצר יבלות או שורשים שעירים. איור 2 מדגים את תהליך ההכנה הכולל של HRs פולי סויה וניתוח ביטוי גנים. איור 3 מדגים לוקליזציה תת-תאית של GFP-GmJAZ1-6. איור 4 הוא ניתוח ביטוי גנים המראה ביטוי יתר של גורם השעתוק גליצאולין GmHSF6-1 והשתקת RNAi של GmMYB29A2 בוויליאמס 82 שורשים שעירים. תוצאות דומות התקבלו במספר דוחות אחרונים20,21.

איור 1: מושבה PCR (cPCR) של K599 Agrobacterium באמצעות פריימרים PCR מושבה של הגן המעניין או VirD2. (A) גן של עניין cPCR. (B) VirD2 cPCR. קיצורים: C = מושבה; +ve = שליטה חיובית; -ve = שליטה שלילית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: סקירה כללית של תרבית שורש סויה שעיר (HR) והליך ניתוח תפקוד גנים. יבלות נוצרו באתר הפציעה שבועיים לאחר זיהום K599 Agrobacterium . התמיינות התאים התרחשה לאחר שבוע אחד, ואז חלף שבוע אחד להתארכות HR. זה היה ואחריו קצירת HR ו קיר גלוקן elicitor (WGE) / טיפול דמה במשך 24 שעות. HRs היו נתונים למיצוי מטבוליטים עבור ניתוח כרומטוגרפיה נוזלית אולטרה ביצועים (UPLC) ובידוד RNA לניתוח ביטוי גנים, בהתאמה. WGE הוא מעורר גלוקן קיר מ Phytophthora sojae. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
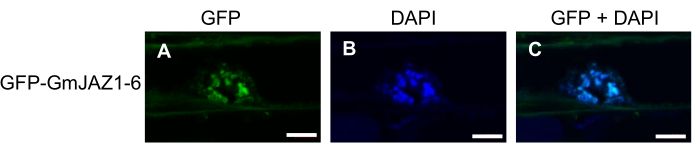
איור 3: מיקרוסקופ פלואורסצנטי של GmJAZ1-6 שהתמזג באופן תרגומי לחלבון פלואורסצנטי ירוק (GFP) בשורשים שעירים מסוג Williams 82 טרנסגניים. (A) תעלה ירוקה (GFP). (B) ערוץ כחול (DAPI). (C) מיזוג ערוצים ירוקים וכחולים. כל התמונות נאספו באמצעות מיקרוסקופ קונפוקלי של Zeiss. תמונות DAPI (6 מיקרוגרם/מ"ל) מצביעות על צביעה גרעינית. פסי קנה מידה הם 5 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 4: ניתוח ביטוי גנים. (A) ביטוי גנים בביטוי יתר GmHSF6-119 Williams 82 soybean HRs תחת 24 שעות טיפול מדומה או עורר במשך 24 שעות עם WGE. (B) ביטוי גנים ב-RNAi-GmMYB29A2 20 Williams 82 soybean HRs שהופקו במשך 24 שעות עם WGE. WGE הוא מעורר גלוקן קיר מ Phytophthora sojae. אגדול משמעותית ונמוךמשמעותית מקבוצת הביקורת, מבחן t של תלמידים זוגיים (עמ' < 0.01). קווי שגיאה מייצגים SE (n ≥ 3 עותקים ביולוגיים). שורשים משניים שנאספו משורש ראשוני אחד הצביעו על העתק ביולוגי אחד. נתון זה שונה באישור Lin et al.19 ו- Jahan et al.20. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
במהלך העשור האחרון, שיטת HR סויה פותחה ככלי רב עוצמה לחקר גנים המעורבים בקיבוע חנקן 22,23, עמידות לעקה ביוטית וא-ביוטית 24,25, ומסלולים ביוסינתטיים מטבוליטים 26,27. לידע על האופן שבו צמחים מייצרים מטבוליטים יש שפע של יתרונות לייצור חקלאי ולתעשיית התרופות, שכן ניתן להשתמש בו לחקר רשתות גנים המעורבות בתיווך הגנות ביוכימיות נגד פתוגנים28.
כדי לתעדף פרודוקטיביות ויעילות בעלויות, פרוטוקול זה מפשט את ההליך. לדוגמה, במקום להשתמש במדיה מוצקה יקרה יותר המכילה חומר ג'לינג, זרעי סויה נובטים בתנאים סטריליים באמצעות מגבות נייר תעשייתיות רוויות במצע גידול נוזלי. טכניקות מעבדה אספטיות ושמירה על תנאי עבודה סטריליים חיוניות לניסויי טרנספורמציה של משאבי אנוש, שכן מגוון רחב של מיקרואורגניזמים, כגון פטריות ושמרים, יכולים לגרום לזיהום של תרביות חוץ גופיות .
בנוסף, שימוש בעוצמה המתאימה של אור ופוטופריוד הוא חיוני לתרבות משאבי אנוש. תהליך הגידול וההתפתחות של צמחים בתרביות חוץ גופיות מושפע באופן משמעותי מאיכות עוצמת האור והפוטופריוד, כפי שנצפה במחקרים קודמים שונים. אם עוצמת האור נמוכה מדי או גבוהה מדי, זה יכול להאט את תהליך השראת השורש. באופן דומה, אם הפוטופריוד אינו מתאים, הוא עלול להוביל לכישלון של היווצרות יבלות ופיתוח תאים ממוינים29. יתר על כן, בהתבסס על ניסויי העבר שלנו, HRs שאינם מהונדסים עמידים לקנמיצין (50 מ"ג / ליטר) כאשר משתמשים בהם כאנטיביוטיקה היחידה. מסיבה זו, אנו משתמשים בדרך כלל בווקטורים המקודדים התנגדות כפולה עבור היגרומיצין וקנמיצין. תחת סלקציה קפדנית זו, אנו מסוגלים לקבל שיעור HR מהונדס חיובי של 15%-30% מכלל השורשים, אך ~80% מאותם HRs ביטאו יתר על המידה / השתיקו גנים באופן משמעותי כפי שמקודדים על ידי הווקטורים.
כדי להבטיח את הצלחת ניסויי טרנספורמציית משאבי אנוש, חיוני לבדוק אם זן קנה השורש A . המשמש בניסוי שומר על פלסמיד Ti המקודד גנים אלימים. נוכחותו של פלסמיד Ti הכרחית לשילוב מוצלח של T-DNA לתוך גנום הצמח4. השימוש ב- cPCR כדי לזהות את פלסמיד Ti הפך לשלב חיוני בפרוטוקול זה. בעבר גילינו ש-33%-50% מהטרנספורמציות שלנו לא יצליחו לייצר קלי ושורשים. ללא ידיעתו, זה היה בגלל אובדן של פלסמיד Ti במהלך טרנספורמציה או טיפוח לאחר מכן של A. rhizogenes. כעת, על ידי ניתוח PCR של מושבות אגרובקטריום לאחר הטרנספורמציה שלהן, אנו מוודאים כי פלסמיד Ti קיים וכי 100% מניסויי הטרנספורמציה מייצרים שורשים. השימוש ב- cPCR בפרוטוקול זה הוכח כתוספת רבת ערך להליך טרנספורמציית משאבי אנוש סטנדרטי. היא הפחיתה את מספר הניסויים הכושלים, ובכך חסכה זמן ומשאבים. שלב cPCR גם אפשר לנו לאשר שתהליך הטרנספורמציה עובד כמתוכנן, ולהבטיח שתוצאות הניסויים אמינות וניתנות לשחזור.
עם זאת, לשיטה פשוטה זו יש כמה מגבלות. לדוגמה, פרוטוקול זה יכול לענות על שאלות ביולוגיות בסיסיות של תאים לגבי תפקודי גנים במשאבי אנוש טרנסגניים. עם זאת, שאלות הנוגעות לרקמות צמחים אחרות, כגון נבטים ועלים, עשויות שלא להיות ניתנות לבדיקה במשאבי אנוש. חשוב תמיד לאשר כי התהליך הנחקר אינו מושפע מרמות הורמונים חוץ רחמיים או גורמים אחרים שהוצגו על ידי A. rhizogenes. על החוקרים לשים לב למגבלותיו ולתכנן בקפידה ניסויים כדי להבטיח תוצאות מדויקות ומשמעותיות.
לסיכום, הפרוטוקול המוצג כאן הוא שיטה יעילה ביותר לחקר תפקוד גנים בשורשי סויה. לאחרונה הוכחנו את ערכו בחקר גישות הנדסה רב-גנית ובהבנת רשתות גנים המעורבות בוויסות הגנות ביוכימיות של פולי סויה19. היעילות היחסית של הגישה הופכת אותה לאידיאלית לענות על שאלות מורכבות בביולוגיה של צמחים הדורשות חקירה של גנים רבים.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
מחקר זה מומן על ידי מועצת המחקר למדעי הטבע וההנדסה של קנדה (NSERC) מספר מענק RGPIN-2020-06111 ועל ידי תרומה נדיבה של בראד לייס. ברצוננו להודות לוויין פארוט (אוניברסיטת ג'ורג'יה) על K599 Agrobacterium והפרוטוקול הראשוני, ולמעבדת Nakagawa & Hachiya (אוניברסיטת שימאנה) עבור הווקטורים הריקים pGWB2, pGWB6 ו-pANDA35HK.
Materials
| Name | Company | Catalog Number | Comments |
| Acetosyringone | Cayman | 23224 | |
| Bleach | lavo | 21124 | |
| DMSO | Fisher bioreagents | 195679 | |
| Gelzan | Phytotech | HYY3251089A | |
| Hygromycin | Phytotech | HHA0397050B | |
| Isopropyl alcohol | Fisher chemical | 206462 | |
| Kanamycin | Phytotech | SQS0378007G | |
| LB powder | Fisher bioreagents | 200318 | |
| MS powder | Caisson labs | 2210001 | |
| Na2HPO4 | Fisher bioreagents | 194171 | |
| NaCl | Fisher chemical | 192946 | |
| Petri dishes | Fisherbrand | 08-757-11 | 100 mm x 25 mm |
| Phosphinothricin | Cedarlane | P034-250MG | |
| REDExtract-N-Amp PCR Kit | Sigma | R4775 | |
| Sucrose | Bioshop | 2D76475 | |
| Timentin | Caisson labs | 12222002 | |
| Vitamins | Caisson labs | 2211010 |
References
- Li, S., et al. Optimization of Agrobacterium-mediated transformation in soybean. Frontiers in Plant Science. 8, 246(2017).
- Elhady, A., Hallmann, J., Heuer, H. Symbiosis of soybean with nitrogen fixing bacteria affected by root lesion nematodes in a density-dependent manner. Scientific Reports. 10, 1619(2020).
- Huang, X. -F., et al. Rhizosphere interactions: root exudates, microbes, and microbial communities. Botany. 92 (4), 267-275 (2014).
- Ma, H., et al. Highly efficient Agrobacterium rhizogenes-mediated genetic transformation and applications in citrus. Frontiers in Plant Science. 13, 1039094(2022).
- Hwang, H. -H., Yu, M., Lai, E. -M. Agrobacterium-mediated plant transformation: biology and applications. The Arabidopsis Book. 15, e0186(2017).
- Gutierrez-Valdes, N., et al. Hairy root cultures-a versatile tool with multiple applications. Frontiers in Plant Science. 11, 33(2020).
- Ono, N. N., Tian, L. The multiplicity of hairy root cultures: prolific possibilities. Plant Science. 180 (3), 439-446 (2011).
- Kereszt, A., et al. Agrobacterium rhizogenes-mediated transformation of soybean to study root biology. Nature Protocols. 2 (4), 948-952 (2007).
- Chen, L., et al. Soybean hairy roots produced in vitro by Agrobacterium rhizogenes-mediated transformation. The Crop Journal. 6 (2), 162-171 (2018).
- Song, J., Tóth, K., Montes-Luz, B., Stacey, G. Soybean hairy root transformation: a rapid and highly efficient method. Current Protocols. 1 (7), e195(2021).
- Fattahi, F., Shojaeiyan, A., Palazon, J., Moyano, E., Torras-Claveria, L. Methyl-β-cyclodextrin and coronatine as new elicitors of tropane alkaloid biosynthesis in Atropa acuminata and Atropa belladonna hairy root cultures. Physiologia Plantarum. 172 (4), 2098-2111 (2021).
- Farrell, K., Jahan, M., Kovinich, N. Distinct mechanisms of biotic and chemical elicitors enable additive elicitation of the anticancer Phytoalexin Glyceollin I. Molecules. 22 (8), 1261(2017).
- Cheng, Y., et al. Highly efficient Agrobacterium rhizogenes-mediated hairy root transformation for gene functional and gene editing analysis in soybean. Plant Methods. 17 (1), 73(2021).
- Arora, D., et al. Establishment of proximity-dependent biotinylation approaches in different plant model systems. Plant Cell. 32 (11), 3388-3407 (2020).
- Gomes, C., Dupas, A., Pagano, A., Grima-Pettenati, J., Paiva, J. A. P. Hairy root transformation: a useful tool to explore gene function and expression in Salix spp. recalcitrant to transformation. Frontiers in Plant Science. 10, 1427(2019).
- Ahmed, S., Kovinich, N. Regulation of phytoalexin biosynthesis for agriculture and human health. Phytochemistry Reviews. 20, 483-505 (2021).
- Walker, R. R., et al. Glyceollins trigger anti-proliferative effects in hormone-dependent aromatase-inhibitor-resistant breast cancer cells through the induction of apoptosis. International Journal of Molecular Sciences. 23 (5), 2887(2022).
- Tong, X., et al. The complete genome sequence of cucumopine-type Agrobacterium rhizogenes strain K599 (NCPPB2659), a nature's genetic engineer inducing hairy roots. International Journal of Agriculture Biology. 20 (5), 1167-1174 (2018).
- Lin, J., et al. RNA-Seq dissects incomplete activation of phytoalexin biosynthesis by the soybean transcription factors GmMYB29A2 and GmNAC42-1. Plants. 12 (3), 545(2023).
- Jahan, M. A., et al. Glyceollin transcription factor GmMYB29A2 regulates soybean resistance to Phytophthora sojae. Plant Physiology. 183 (2), 530-546 (2020).
- Jahan, M. A., et al. The NAC family transcription factor GmNAC42-1 regulates biosynthesis of the anticancer and neuroprotective glyceollins in soybean. BMC Genomics. 20, 149(2019).
- Nguyen, C. X., et al. Critical role for uricase and xanthine dehydrogenase in soybean nitrogen fixation and nodule development. The Plant Genome. , e20171(2021).
- Brear, E. M., et al. GmVTL1a is an iron transporter on the symbiosome membrane of soybean with an important role in nitrogen fixation. New Phytologist. 228 (2), 667-681 (2020).
- Chen, Z., et al. Overexpression of transcription factor GmTGA15 enhances drought tolerance in transgenic soybean hairy roots and Arabidopsis plants. Agronomy. 11 (1), 170(2021).
- Savka, M., Ravillion, B., Noel, G., Farrand, S. Induction of hairy roots on cultivated soybean genotypes and their use to propagate the soybean cyst nematode. Phytopathology. 80 (5), 503-508 (1990).
- Subramanian, S., Graham, M. Y., Yu, O., Graham, T. L. RNA interference of soybean isoflavone synthase genes leads to silencing in tissues distal to the transformation site and to enhanced susceptibility to Phytophthora sojae. Plant Physiology. 137 (4), 1345-1353 (2005).
- Sharma, A. R., Gajurel, G., Ahmed, I., Roedel, K., Medina-Bolivar, F. Induction of the prenylated stilbenoids arachidin-1 and arachidin-3 and their semi-preparative separation and purification from hairy root cultures of peanut (Arachis hypogaea l.). Molecules. 27 (18), 6118(2022).
- Lozovaya, V. V., et al. Isoflavonoid accumulation in soybean hairy roots upon treatment with Fusarium solani. Plant Physiology Biochemistry. 42 (7-8), 671-679 (2004).
- Rahimi Khonakdari, M., Rezadoost, H., Heydari, R., Mirjalili, M. H. Effect of photoperiod and plant growth regulators on in vitro mass bulblet proliferation of Narcissus tazzeta L. (Amaryllidaceae), a potential source of galantamine. Plant Cell, Tissue, and Organ Culture. 142 (1), 187-199 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ISSN 2578-2614
Copyright © 2025 MyJoVE Corporation. All rights reserved
We use cookies to enhance your experience on our website.
By continuing to use our website or clicking “Continue”, you are agreeing to accept our cookies.