Method Article
Трансформация волосатого корня сои для анализа функции генов
В этой статье
Резюме
Здесь мы представляем протокол высокоэффективного производства трансгенных волосатых корней сои.
Аннотация
Соя (Glycine max) является ценной культурой в сельском хозяйстве, которая имеет тысячи промышленных применений. Корни сои являются основным местом взаимодействия с почвенными микробами, которые образуют симбиоз для фиксации азота и патогенов, что делает исследования, связанные с генетикой корней сои, первостепенной важностью для улучшения ее сельскохозяйственного производства. Генетическая трансформация волосатых корней сои (HRs) опосредована штаммом Agrobacterium rhizogenes NCPPB2659 (K599) и является эффективным инструментом для изучения функции генов в корнях сои, занимая всего 2 месяца от начала до конца. Здесь мы приводим подробный протокол, в котором описывается метод сверхэкспрессии и подавления гена, представляющего интерес для HR сои. Эта методология включает стерилизацию семян сои, заражение семядолей K599, а также отбор и сбор генетически трансформированных HR для выделения РНК и, при необходимости, анализа метаболитов. Пропускная способность подхода достаточна для одновременного изучения нескольких генов или сетей и может определить оптимальные инженерные стратегии до перехода к долгосрочным подходам к стабильной трансформации.
Введение
Соя (Glycine max) является одной из самых ценных культур в сельском хозяйстве. Он имеет тысячи коммерческих и промышленных применений, таких как продукты питания, корма для животных, масло, а также в качестве источника сырья для производства1. Его способность формировать симбиотические отношения с азотфиксирующими почвенными микроорганизмами, а именно ризобиями, еще больше повышает важность изучения генетики сои2. Например, тонкая настройка азотфиксирующих свойств в корнях сои может привести к сокращению выбросов углерода и значительно снизить потребность в азотных удобрениях3. Таким образом, понимание генетики, которая контролирует аспекты биологии корня сои, в частности, имеет широкое применение в сельском хозяйстве и промышленности. Учитывая эти преимущества, важно иметь надежный протокол для анализа функции генов сои.
Agrobacterium tumefaciens, пожалуй, является наиболее часто используемым инструментом для генетической трансформации растений, поскольку он обладает способностью интегрировать транспортную ДНК (Т-ДНК) в ядерный геном многих видов растений. Когда Agrobacterium заражает растение, она переносит индуцирующую опухоль (Ti) плазмиду в хромосому хозяина, что приводит к образованию опухоли в месте заражения. Трансформация, опосредованная агробактериями, широко использовалась в течение десятилетий для функционального анализа генов и для модификации признаков сельскохозяйственных культур4. Хотя любой интересующий ген может быть легко перенесен в клетки растений-хозяев посредством опосредованной A. tumefaciens трансформации, этот метод имеет несколько недостатков; Это отнимает много времени, дорого и требует обширных знаний для многих видов растений, таких как соя. Хотя несколько сортов сои могут быть преобразованы с помощью подхода семядольного узла с использованием A. tumefaciens, неэффективность этого подхода обуславливает необходимость в альтернативной технологии генетической трансформации, которая является быстрой и высокоэффективной 4,5. Даже неспециалист может использовать этот метод трансформации волосатого корня (HR), опосредованного Agrobacterium rhizogenes, чтобы преодолеть эти недостатки.
Трансформация HR является относительно быстрым инструментом не только для анализа функции генов, но и для биотехнологических применений, таких как производство специализированных метаболитов и тонких химикатов, а также сложных биологически активных гликопротеинов6. Производство HR сои не требует обширных знаний, так как они могут быть получены путем ранения поверхностей семядолей с последующей инокуляцией Agrobacterium rhizogenes7. A. rhizogenes экспрессирует гены вирулентности (Vir), кодируемые его плазмидой Ti, которые переносят, переносят и интегрируют сегмент Т-ДНК в геном растительных клеток, одновременно стимулируя рост эктопических корней8.
По сравнению с другими системами экспрессии генов сои, такими как биолистика или трансформация культур тканей, клеток и органов на основе A. tumefaciens, система экспрессии HR обладает рядом преимуществ. Во-первых, HR генетически стабильны и быстро продуцируются на безгормональных средах 1,9,10. Кроме того, HR могут продуцировать специализированные метаболиты в количествах, эквивалентных или превышающих родные корни11,12. Эти преимущества делают HR желательным биотехнологическим инструментом для видов растений, которые несовместимы с A. tumefaciens или которым требуются особые условия культивирования тканей для формирования совместимых тканей. Метод HR является эффективным подходом к анализу белково-белковых взаимодействий, субклеточной локализации белка, продукции рекомбинантного белка, фиторемедиации, мутагенеза и полногеномных эффектов с использованием секвенирования РНК13,14,15. Он также может быть использован для изучения производства специализированных метаболитов, имеющих ценность в промышленности, включая глицеоллины, которые защищают сою от важного микробного патогена Phytophthora sojae и обладают впечатляющей противоопухолевой и нейропротекторной активностью у человека16,17.
В этом отчете демонстрируется простой и эффективный протокол производства HR сои. По сравнению с предыдущими методами трансформации HR этот протокол обеспечивает значительное (33-50%) улучшение скорости формирования HR за счет предварительного скрининга трансформантов A. rhizogenes на наличие плазмиды Ti перед инокуляцией семядолей сои. Мы демонстрируем применимость этого протокола, трансформируя несколько бинарных векторов, которые сверхэкспрессируют или подавляют гены фактора транскрипции сои.
протокол
ПРИМЕЧАНИЕ: Рекомендуется, чтобы все процессуальные действия проводились в стерильных условиях.
1. Стерилизация семян сои
- В шкаф биобезопасности поместите 16-20 круглых семян сои Williams 82 в первозданном состоянии (т. е. без трещин или пятен) в центрифужную пробирку объемом 50 мл.
- Добавьте 30 мл 70% изопропилового спирта, осторожно встряхните в течение 30 с, а затем сцедите спирт.
- Осторожно встряхните семена с 30 мл 10% отбеливателя в течение 10 с и оставьте семена в растворе на 5 минут при комнатной температуре (RT, 25 °C). Через 5 минут слейте отбеливатель.
- Повторите встряхивание три раза с 30 мл стерильного сверхчистого H 2 O в течение1 минуты на полоскание и выбрасывайте H2O между каждым полосканием.
- Стерилизованные семена поместить на фильтровальную бумагу, насыщенную 5 мл среды для проращивания и совместного культивирования (GC) (автоклавная жидкость половинной крепости Murashige и среда Skoog [MS] с 1% сахарозой [pH = 5,8], а затем добавьте 2,5 мл / л витаминов) в стерильные чашки Петри.
- Поместите пластины в темноту при RT (25 ° C) на 3 дня, прежде чем перенести пластины при 22 ° C под 16 ч холодно-белыми флуоресцентными лампами T5 (100 мкЭ м-2 · с-1) в течение 4 дней, чтобы дать семенам прорасти.
ПРИМЕЧАНИЕ: Выбросьте сморщенные или потрескавшиеся семена. Лучшими семенами считаются те, которые крупные и равномерно желтые. Стерилизуйте как минимум вдвое больше семян, необходимых для эксперимента, чтобы выбрать семена хорошего качества, так как некоторые семена могут быть неоптимальными из-за повреждений, болезней или непрорастания.
2. Заражение семядолей К599
ПРИМЕЧАНИЕ: Используйте векторы серии pGWB, так как их двойной отбор обеспечивает геномную интеграцию всей кассеты Т-ДНК. Электропорация была использована для преобразования бинарного вектора, содержащего интересующий ген, в A. rhizogenes pRi265918.
- На основе последовательности плазмиды18 A. rhizogenes pRi2659 разработаны праймеры для обнаружения гена плазмиды Ti VirD2 (VirD2 вперед: 5'-CCCGATCGAGCTCAAGTTAT-3'; Реверс VirD2: 5'-TCGTCTGGCTGACTTTCGT-3'; Ожидаемый размер усиления: 221.н.). После трансформации протестируйте колонии Agrobacterium на удержание VirD2 с помощью полимеразной цепной реакции (ПЦР) с использованием набора для ПЦР (см. Таблицу материалов). Цикл ПЦР: 94 °C в течение 3 мин; 35 циклов (94 °C в течение 1 мин, 58 °C в течение 30 сек, 72 °C в течение 1 мин); и 72 °C в течение 10 мин.
- После отбора колонии A. rhizogenes , содержащей как VirD2 , так и интересующий ген (GOI), выложите некоторые из них на средние планшеты Лурия-Бертани (LB), содержащие соответствующие антибиотики (50 мг / л) для интересующей плазмиды, и инкубируйте в течение ночи при 30 ° C. При использовании спектиномицина добавьте концентрацию 100 мг / л.
- С помощью наконечника пипетки P200 соскребите K599 Agrobacterium длиной ~ 1,5 см с планшетов LB и ресуспендируйте клетки в 1 мл фосфатного буфера (PB; 0,01 M Na2HPO4, 0,15 M NaCl, pH 7,5).
- Разведите Agrobacterium в стерилизованном сверхчистом H2O (v/v = 1:1) и ацетосирингоне (AS; 100 мМ в диметилсульфоксиде [ДМСО], v/v = 1:1000). Измерьте поглощение с помощью кюветной трубки при оптической плотности 600 нм (OD600). Ожидаемый оптимальный диапазон составляет от 0,5 до 0,8.
- В шкафу биобезопасности окуните стерилизованный скальпель в раствор K599 Agrobacterium и сделайте несколько надрезов глубиной 1 мм по внутренней поверхности (адаксиальная, плоская сторона) семядоли. Во время инокуляции используйте стерилизованные щипцы для стабилизации семядолей.
- Поместите около 6-8 семядолей, разрезанных стороной вниз, на чашку Петри, содержащую фильтровальную бумагу, насыщенную средой GC с AS.
ПРИМЕЧАНИЕ: Для приготовления 6 планшетов достаточно 50 мл среды ГХ и 50 мкл 100 мМ АС для достижения конечной концентрации 100 мкМ. - Инкубируйте планшеты при RT (25 °C) в течение 3 дней при 16-часовом фотопериоде (~65 мкВ).
- Перенесите зараженные семядоли на пластины для роста волосистых корней (HRG) (автоклавный МС половинной крепости с 3% сахарозой [pH = 5,8] и 2,6 г/л гельзана, затем добавьте смесь витаминов 2,5 мл/л и 500 мг/л тиментина).
ПРИМЕЧАНИЕ: Были некоторые проблемы с тайментином от некоторых альтернативных поставщиков, из которых K599 не был устранен. Рекомендуется использовать более высокие тарелки чашки Петри (100 мм x 25 мм) для HRG medium. - Инкубируйте пластины HRG при 22 °C в камере роста с параметрами, установленными на свет 100 мкЭ, в течение 16-часового фотопериода до тех пор, пока не будут наблюдаться первичные корни со вторичными корнями длиной 2-3 см (~3-4 недели).
3. Отбор и сбор кадров
- Заготавливают первичные корни (5-7 см в длину), которые растут из костной костли и содержат вторичные корни (2-3 см в длину), используя стерильный скальпель и щипцы. Переведите на отбор HRG планшеты, содержащие соответствующие антибиотики. Дайте HR расти еще 5 дней на отборных пластинах HRG.
ПРИМЕЧАНИЕ: Канамицин (50 мг / л), гигромицин (50 мг / л) или фосфинотрицин (10 мг / л) обычно используются для отбора. Для векторов экспрессии pGWB2 используется для сверхэкспрессии, pANDA35HK используется для подавления РНК-интерференции, pGWB6 используется для субклеточной локализации, а pMDC7 используется для индуцируемой экспрессии. - На 5 день заготавливают трансгенные HR со вторичными корнями длиной 3-6 см. При наблюдении за флуоресцентными белками вторичные корни имеют небольшую автофлуоресценцию. Если вы выполняете элиситорную или химическую обработку, разрежьте вторичные корни на кусочки по 1 см и поместите ~ 100 мг на агар HRG в кучу. Затем насытите сваи 80 мкл соответствующей обработки и дайте пластинам инкубироваться при RT (25 °C).
- По истечении желаемого времени лечения приступайте к экстракции РНК или метаболитов.
- Что касается РНК, быстро промокните корни сухими на стерилизованном бумажном полотенце и соберите их непосредственно в микроцентрифужную пробирку объемом 2 мл.
- Немедленно запечатайте верхнюю часть трубки с помощью парапленки, сделайте два небольших отверстия с помощью заостренных щипцов и погрузите трубки в жидкий азот. Лиофилизировать в течение 3 дней, затем хранить образцы при -80 °C.
ПРИМЕЧАНИЕ: Очень важно выбирать HR белого цвета. Через 5 дней роста на селективной пластинке трансгенные HR останутся белыми, а вот нетрансгенные корни станут коричневыми.
Результаты
Репрезентативные результаты взяты из опубликованных данных19,20. Результаты колонии ПЦР (цПЦР) трансформированной K599 Agrobacterium показаны на рисунке 1. Как видно из положительных колоний на рисунке 1, интересующий ген был обнаружен с помощью кПЦР (рис. 1А). Тем не менее, от одной трети до половины колоний были отрицательными для скрининга гена VirD2 (рис. 1B), что указывает на потерю плазмиды Ti, и были бы неспособны генерировать каллус или волосистые корни. На рисунке 2 показана общая процедура подготовки HR сои и анализ экспрессии генов. На рисунке 3 показана субклеточная локализация GFP-GmJAZ1-6. На рисунке 4 показан анализ экспрессии генов, показывающий сверхэкспрессию фактора транскрипции глицеоллина GmHSF6-1 и подавление РНКи-излучения GmMYB29A2 в волосатых корнях Williams 82. Аналогичные результаты были получены в нескольких недавних отчетах20,21.

Рисунок 1: ПЦР колоний (цПЦР) агробактерии K599 с использованием колонийных ПЦР-праймеров интересующего гена или VirD2. (А) Интересующий ген кПЦР. (B) кПЦР VirD2 . Сокращения: C = колония; +ve = положительный контроль; -ve = отрицательный контроль. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Обзор культуры волосатого корня сои (HR) и процедуры анализа функции генов. Мозоли образовались на месте ранения через 2 недели после заражения K599 Agrobacterium . Дифференцировка клеток происходила через 1 неделю, затем прошла 1 неделя для удлинения ЧСС. Затем последовал сбор HR и элиситор настенного глюкана (WGE) / имитационная обработка в течение 24 часов. HR подвергали экстракции метаболитов для анализа ультраэффективной жидкостной хроматографии (UPLC) и выделению РНК для анализа экспрессии генов соответственно. WGE - это настенный элиситор глюкана из Phytophthora sojae. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
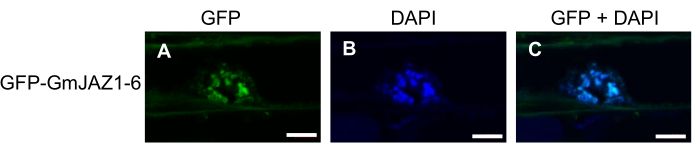
Рисунок 3: Флуоресцентная микроскопия GmJAZ1-6, трансляционно слитого с зеленым флуоресцентным белком (GFP) в трансгенных волосатых корнях Williams 82. (А) Зеленый канал (GFP). (B) Голубой канал (DAPI). (C) Объединенные зеленый и синий каналы. Все изображения были собраны с помощью конфокального микроскопа Zeiss. Изображения DAPI (6 мкг/мл) указывают на ядерное окрашивание. Масштабные линейки имеют длину 5 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Анализ экспрессии генов. (A) Экспрессия генов при сверхэкспрессии GmHSF6-119 HR сои Williams 82 в течение 24 часов имитационной обработки или в течение 24 часов с WGE. (B) Экспрессия генов в RNAi-GmMYB29A2 20 HR сои Williams 82, вызванная в течение 24 ч с WGE. WGE - это настенный элиситор глюкана из Phytophthora sojae. aДостоверно больше и bзначительно меньше, чем у контрольных, парных студентов t-критерий (p < 0,01). Полосы погрешностей представляют SE (n ≥ 3 биологических реплик). Вторичные корни, собранные из одного первичного корня, указывали на одну биологическую реплику. Эта цифра была изменена с разрешения Lin et al.19 и Jahan et al.20. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
В течение последнего десятилетия был разработан метод HR сои в качестве мощного инструмента для изучения генов, участвующих в фиксации азота 22,23, биотической и абиотической стрессоустойчивости 24,25 и путях биосинтеза метаболитов 26,27. Знание того, как растения продуцируют метаболиты, имеет множество преимуществ для сельскохозяйственного производства и фармацевтической промышленности, поскольку оно может быть использовано для изучения генных сетей, которые участвуют в опосредовании биохимической защиты от патогенов28.
Чтобы отдать приоритет производительности и экономической эффективности, этот протокол упрощает процедуру. Например, вместо использования более дорогих твердых сред, содержащих желирующий агент, семена сои проращивают в стерильных условиях с использованием бумажных полотенец промышленного класса, насыщенных жидкой питательной средой. Асептические лабораторные методы и поддержание стерильных условий труда имеют важное значение для экспериментов по трансформации HR, поскольку широкий спектр микроорганизмов, таких как грибы и дрожжи, может вызывать загрязнение культур in vitro .
Кроме того, использование соответствующей интенсивности света и фотопериода имеет решающее значение для культуры HR. На процесс роста и развития растений в культурах in vitro существенно влияет качество интенсивности света и фотопериода, как это наблюдалось в различных предыдущих исследованиях. Если интенсивность света слишком низкая или слишком высокая, это может замедлить процесс индукции корней. Точно так же, если фотопериод неуместен, это может привести к нарушению образования костной костли и дифференцированному развитию клеток29. Более того, основываясь на наших прошлых экспериментах, нетрансгенные HR устойчивы к канамицину (50 мг / л) при использовании в качестве единственного антибиотика. По этой причине мы обычно используем векторы, кодирующие двойную резистентность к гигромицину и канамицину. При таком строгом отборе мы можем получить положительную трансгенную частоту HR 15-30% от общего числа корней, но ~ 80% этих HR имеют значительно сверхэкспрессированные / заглушенные гены, кодируемые векторами.
Чтобы обеспечить успех экспериментов по трансформации HR, крайне важно проверить, сохраняет ли штамм A. rhizogenes , используемый в эксперименте, плазмиду Ti, кодирующую гены вирулентности. Наличие плазмиды Ti необходимо для успешной интеграции Т-ДНК в геномрастения 4. Использование цПЦР для обнаружения Ti-плазмиды стало важным шагом в этом протоколе. В прошлом мы обнаружили, что 33-50% наших преобразований не приводят к образованию каллусов и корней. По незнанию это было связано с потерей плазмиды Ti во время трансформации или последующего культивирования A. rhizogenes. Теперь, с помощью ПЦР-анализа колоний Agrobacterium после их трансформации, мы гарантируем, что плазмида Ti присутствует и что 100% экспериментов по трансформации производят корни. Использование кПЦР в этом протоколе оказалось ценным дополнением к стандартной процедуре трансформации HR. Это сократило количество неудачных экспериментов, тем самым сэкономив как время, так и ресурсы. Этап cPCR также позволил нам подтвердить, что процесс трансформации работает так, как задумано, гарантируя, что результаты экспериментов являются надежными и воспроизводимыми.
Тем не менее, этот упрощенный метод имеет некоторые ограничения. Например, этот протокол может ответить на основные вопросы клеточной биологии о функциях генов в трансгенных HR. Однако вопросы, относящиеся к другим тканям растений, таким как побеги и листья, могут не поддаваться проверке в HR. Всегда важно подтвердить, что на изучаемый процесс не влияет уровень эктопических гормонов или другие факторы, привнесенные A. rhizogenes. Исследователи должны принять к сведению его ограничения и тщательно спланировать эксперименты, чтобы обеспечить точные и значимые результаты.
Таким образом, представленный здесь протокол является высокоэффективным методом исследования функции генов в корнях сои. Недавно мы продемонстрировали его ценность в изучении подходов мультигенной инженерии и понимании генных сетей, участвующих в регуляции биохимической защиты сои19. Относительная эффективность подхода делает его идеальным для ответа на сложные вопросы биологии растений, которые требуют исследования многочисленных генов.
Раскрытие информации
Авторам раскрывать нечего.
Благодарности
Это исследование было профинансировано Советом по естественным наукам и инженерным исследованиям Канады (NSERC) с номером гранта RGPIN-2020-06111 и щедрым пожертвованием Брэда Лейса. Мы хотели бы поблагодарить Уэйна Пэррота (Университет Джорджии) за K599 Agrobacterium и предварительный протокол, а также лабораторию Nakagawa & Hachiya (Университет Симанэ) за пустые векторы pGWB2, pGWB6 и pANDA35HK.
Материалы
| Name | Company | Catalog Number | Comments |
| Acetosyringone | Cayman | 23224 | |
| Bleach | lavo | 21124 | |
| DMSO | Fisher bioreagents | 195679 | |
| Gelzan | Phytotech | HYY3251089A | |
| Hygromycin | Phytotech | HHA0397050B | |
| Isopropyl alcohol | Fisher chemical | 206462 | |
| Kanamycin | Phytotech | SQS0378007G | |
| LB powder | Fisher bioreagents | 200318 | |
| MS powder | Caisson labs | 2210001 | |
| Na2HPO4 | Fisher bioreagents | 194171 | |
| NaCl | Fisher chemical | 192946 | |
| Petri dishes | Fisherbrand | 08-757-11 | 100 mm x 25 mm |
| Phosphinothricin | Cedarlane | P034-250MG | |
| REDExtract-N-Amp PCR Kit | Sigma | R4775 | |
| Sucrose | Bioshop | 2D76475 | |
| Timentin | Caisson labs | 12222002 | |
| Vitamins | Caisson labs | 2211010 |
Ссылки
- Li, S., et al. Optimization of Agrobacterium-mediated transformation in soybean. Frontiers in Plant Science. 8, 246(2017).
- Elhady, A., Hallmann, J., Heuer, H. Symbiosis of soybean with nitrogen fixing bacteria affected by root lesion nematodes in a density-dependent manner. Scientific Reports. 10, 1619(2020).
- Huang, X. -F., et al. Rhizosphere interactions: root exudates, microbes, and microbial communities. Botany. 92 (4), 267-275 (2014).
- Ma, H., et al. Highly efficient Agrobacterium rhizogenes-mediated genetic transformation and applications in citrus. Frontiers in Plant Science. 13, 1039094(2022).
- Hwang, H. -H., Yu, M., Lai, E. -M. Agrobacterium-mediated plant transformation: biology and applications. The Arabidopsis Book. 15, e0186(2017).
- Gutierrez-Valdes, N., et al. Hairy root cultures-a versatile tool with multiple applications. Frontiers in Plant Science. 11, 33(2020).
- Ono, N. N., Tian, L. The multiplicity of hairy root cultures: prolific possibilities. Plant Science. 180 (3), 439-446 (2011).
- Kereszt, A., et al. Agrobacterium rhizogenes-mediated transformation of soybean to study root biology. Nature Protocols. 2 (4), 948-952 (2007).
- Chen, L., et al. Soybean hairy roots produced in vitro by Agrobacterium rhizogenes-mediated transformation. The Crop Journal. 6 (2), 162-171 (2018).
- Song, J., Tóth, K., Montes-Luz, B., Stacey, G. Soybean hairy root transformation: a rapid and highly efficient method. Current Protocols. 1 (7), e195(2021).
- Fattahi, F., Shojaeiyan, A., Palazon, J., Moyano, E., Torras-Claveria, L. Methyl-β-cyclodextrin and coronatine as new elicitors of tropane alkaloid biosynthesis in Atropa acuminata and Atropa belladonna hairy root cultures. Physiologia Plantarum. 172 (4), 2098-2111 (2021).
- Farrell, K., Jahan, M., Kovinich, N. Distinct mechanisms of biotic and chemical elicitors enable additive elicitation of the anticancer Phytoalexin Glyceollin I. Molecules. 22 (8), 1261(2017).
- Cheng, Y., et al. Highly efficient Agrobacterium rhizogenes-mediated hairy root transformation for gene functional and gene editing analysis in soybean. Plant Methods. 17 (1), 73(2021).
- Arora, D., et al. Establishment of proximity-dependent biotinylation approaches in different plant model systems. Plant Cell. 32 (11), 3388-3407 (2020).
- Gomes, C., Dupas, A., Pagano, A., Grima-Pettenati, J., Paiva, J. A. P. Hairy root transformation: a useful tool to explore gene function and expression in Salix spp. recalcitrant to transformation. Frontiers in Plant Science. 10, 1427(2019).
- Ahmed, S., Kovinich, N. Regulation of phytoalexin biosynthesis for agriculture and human health. Phytochemistry Reviews. 20, 483-505 (2021).
- Walker, R. R., et al. Glyceollins trigger anti-proliferative effects in hormone-dependent aromatase-inhibitor-resistant breast cancer cells through the induction of apoptosis. International Journal of Molecular Sciences. 23 (5), 2887(2022).
- Tong, X., et al. The complete genome sequence of cucumopine-type Agrobacterium rhizogenes strain K599 (NCPPB2659), a nature's genetic engineer inducing hairy roots. International Journal of Agriculture Biology. 20 (5), 1167-1174 (2018).
- Lin, J., et al. RNA-Seq dissects incomplete activation of phytoalexin biosynthesis by the soybean transcription factors GmMYB29A2 and GmNAC42-1. Plants. 12 (3), 545(2023).
- Jahan, M. A., et al. Glyceollin transcription factor GmMYB29A2 regulates soybean resistance to Phytophthora sojae. Plant Physiology. 183 (2), 530-546 (2020).
- Jahan, M. A., et al. The NAC family transcription factor GmNAC42-1 regulates biosynthesis of the anticancer and neuroprotective glyceollins in soybean. BMC Genomics. 20, 149(2019).
- Nguyen, C. X., et al. Critical role for uricase and xanthine dehydrogenase in soybean nitrogen fixation and nodule development. The Plant Genome. , e20171(2021).
- Brear, E. M., et al. GmVTL1a is an iron transporter on the symbiosome membrane of soybean with an important role in nitrogen fixation. New Phytologist. 228 (2), 667-681 (2020).
- Chen, Z., et al. Overexpression of transcription factor GmTGA15 enhances drought tolerance in transgenic soybean hairy roots and Arabidopsis plants. Agronomy. 11 (1), 170(2021).
- Savka, M., Ravillion, B., Noel, G., Farrand, S. Induction of hairy roots on cultivated soybean genotypes and their use to propagate the soybean cyst nematode. Phytopathology. 80 (5), 503-508 (1990).
- Subramanian, S., Graham, M. Y., Yu, O., Graham, T. L. RNA interference of soybean isoflavone synthase genes leads to silencing in tissues distal to the transformation site and to enhanced susceptibility to Phytophthora sojae. Plant Physiology. 137 (4), 1345-1353 (2005).
- Sharma, A. R., Gajurel, G., Ahmed, I., Roedel, K., Medina-Bolivar, F. Induction of the prenylated stilbenoids arachidin-1 and arachidin-3 and their semi-preparative separation and purification from hairy root cultures of peanut (Arachis hypogaea l.). Molecules. 27 (18), 6118(2022).
- Lozovaya, V. V., et al. Isoflavonoid accumulation in soybean hairy roots upon treatment with Fusarium solani. Plant Physiology Biochemistry. 42 (7-8), 671-679 (2004).
- Rahimi Khonakdari, M., Rezadoost, H., Heydari, R., Mirjalili, M. H. Effect of photoperiod and plant growth regulators on in vitro mass bulblet proliferation of Narcissus tazzeta L. (Amaryllidaceae), a potential source of galantamine. Plant Cell, Tissue, and Organ Culture. 142 (1), 187-199 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены