Method Article
Transformation racinaire poilue du soja pour l’analyse de la fonction génique
Dans cet article
Résumé
Nous présentons ici un protocole pour la production à haute efficacité de racines velues de soja transgéniques.
Résumé
Le soja (Glycine max) est une culture précieuse en agriculture qui a des milliers d’utilisations industrielles. Les racines de soja sont le principal site d’interaction avec les microbes du sol qui forment une symbiose pour fixer l’azote et les agents pathogènes, ce qui rend la recherche sur la génétique des racines de soja d’une importance primordiale pour améliorer sa production agricole. La transformation génétique des racines velues du soja (HR) est médiée par la souche Agrobacterium rhizogenes NCPPB2659 (K599) et constitue un outil efficace pour étudier la fonction des gènes dans les racines de soja, ne prenant que 2 mois du début à la fin. Ici, nous fournissons un protocole détaillé qui décrit la méthode pour surexprimer et réduire au silence un gène d’intérêt dans les HRs de soja. Cette méthodologie comprend la stérilisation des graines de soja, l’infection des cotylédons par K599, ainsi que la sélection et la récolte de RR génétiquement transformés pour l’isolement de l’ARN et, s’il y a lieu, l’analyse des métabolites. Le débit de l’approche est suffisant pour étudier simultanément plusieurs gènes ou réseaux et pourrait déterminer les stratégies d’ingénierie optimales avant de s’engager dans des approches de transformation stables à long terme.
Introduction
Le soja (Glycine max) est l’une des cultures les plus précieuses en agriculture. Il a des milliers d’utilisations commerciales et industrielles, telles que l’alimentation, l’alimentation animale, l’huile et comme source de matières premières pour la fabrication1. Sa capacité à former une relation symbiotique avec les microorganismes fixateurs d’azote du sol, à savoir les rhizobiums, accroît encore l’importance de l’étude de la génétique du soja2. Par exemple, le réglage fin des propriétés de fixation de l’azote dans les racines de soja peut entraîner une réduction des émissions de carbone et réduire considérablement les besoins en engrais azoté3. Ainsi, la compréhension de la génétique qui contrôle certains aspects de la biologie des racines du soja, en particulier, a de nombreuses applications dans l’agriculture et l’industrie. Compte tenu de ces avantages, il est important de disposer d’un protocole fiable pour analyser la fonction des gènes du soja.
Agrobacterium tumefaciens est peut-être l’outil le plus couramment utilisé pour la transformation phytogénétique, car il a la capacité d’intégrer l’ADN de transfert (ADN-T) dans le génome nucléaire de nombreuses espèces végétales. Lorsque Agrobacterium infecte une plante, il transfère le plasmide induisant la tumeur (Ti) dans le chromosome hôte, conduisant à la formation d’une tumeur sur le site d’infection. La transformation médiée par Agrobacterium est largement utilisée depuis des décennies pour l’analyse fonctionnelle des gènes et pour modifier les caractères des cultures4. Bien que tout gène d’intérêt puisse être facilement transféré dans les cellules végétales hôtes par transformation médiée par A. tumefaciens, cette méthode présente plusieurs inconvénients; Il prend du temps, coûte cher et nécessite une expertise approfondie pour de nombreuses espèces végétales, telles que le soja. Bien que quelques variétés de soja puissent être transformées par l’approche des ganglions cotylédonaires à l’aide d’A. tumefaciens, l’inefficacité de cette approche nécessite une autre technologie de transformation génétique rapide et très efficace 4,5. Même un non-expert peut utiliser cette méthode de transformation de racine velue médiée par Agrobacterium rhizogenes pour surmonter ces inconvénients.
La transformation HR est un outil relativement rapide, non seulement pour analyser la fonction des gènes, mais aussi pour des applications biotechnologiques, telles que la production de métabolites spécialisés et de produits chimiques fins, et de glycoprotéines bioactives complexes6. La production de HRs de soja ne nécessite pas une expertise approfondie, car ils peuvent être générés en blessant la surface des cotylédons, suivi d’une inoculation avec Agrobacterium rhizogenes7. A. rhizogenes exprime des gènes de virulence (Vir) codés par son plasmide Ti qui transfèrent, transportent et intègrent son segment d’ADN-T dans le génome des cellules végétales tout en stimulant simultanément la croissance des racines ectopiques8.
Comparé à d’autres systèmes d’expression génique du soja, tels que la biolistique ou la transformation à base d’A. tumefaciens de la culture tissulaire, cellulaire et organique, le système d’expression HR présente plusieurs avantages. Premièrement, les HR sont génétiquement stables et produites rapidement sur des milieux sans hormones 1,9,10. De plus, les HRs peuvent produire des métabolites spécialisés en quantités équivalentes ou supérieures à celles des racines indigènes11,12. Ces avantages font des HRs un outil biotechnologique souhaitable pour les espèces végétales qui sont incompatibles avec A. tumefaciens ou qui nécessitent des conditions spéciales de culture tissulaire pour former des tissus compatibles. La méthode HR est une approche efficace pour analyser les interactions protéine-protéine, la localisation subcellulaire des protéines, la production de protéines recombinantes, la phytoremédiation, la mutagénèse et les effets à l’échelle du génome en utilisant le séquençage de l’ARN13,14,15. Il peut également être utilisé pour étudier la production de métabolites spécialisés qui ont une valeur dans l’industrie, y compris les glycéollines, qui médicamentent la défense du soja contre l’important agent pathogène microbien Phytophthora sojae et ont des activités anticancéreuses et neuroprotectrices impressionnantes chez l’homme16,17.
Ce rapport démontre un protocole simple et efficace pour produire des HRs de soja. Par rapport aux méthodes précédentes de transformation HR, ce protocole fournit une amélioration significative (33%-50%) du taux de formation HR en présélectionnant les transformateurs A. rhizogenes pour la présence du plasmide Ti avant l’inoculation des cotylédons de soja. Nous démontrons l’applicabilité de ce protocole en transformant plusieurs vecteurs binaires qui surexpriment ou réduisent au silence les gènes du facteur de transcription du soja.
Protocole
REMARQUE : Il est recommandé que toutes les étapes de la procédure soient effectuées dans des conditions stériles.
1. Stérilisation des semences de soja
- Dans une enceinte de biosécurité, placer 16 à 20 graines de soja Williams 82 rondes en parfait état (c.-à-d. sans fissures ni imperfections) dans un tube à centrifuger de 50 mL.
- Ajouter 30 mL d’alcool isopropylique à 70 %, agiter doucement pendant 30 s, puis décanter l’alcool.
- Agiter doucement les graines avec 30 ml d’eau de Javel à 10 % pendant 10 s et laisser reposer les graines dans la solution pendant 5 minutes à température ambiante (RT, 25 °C). Après 5 min, égoutter l’eau de Javel.
- Répéter l’agitation trois fois avec 30 mL deH2Oultrapur stérile pendant 1 min par rinçage et jeter le H2Oentre chaque rinçage.
- Placer les graines stérilisées sur du papier filtre saturé de 5 mL de milieu de germination et de coculture (GC) (liquide autoclave demi-concentré Murashige et milieu Skoog [MS] avec 1 % de saccharose [pH = 5,8], puis ajouter 2,5 mL/L de vitamines) dans des boîtes de Petri stériles.
- Placer les plaques dans l’obscurité à TA (25 °C) pendant 3 jours avant de transférer les plaques à 22 °C sous 16 h de lampes fluorescentes T5 blanc froid (100 μE m-2·s-1) pendant 4 jours pour permettre aux graines de germer.
REMARQUE: Jetez les graines qui sont ridées ou craquelées. Les meilleures graines sont celles qui sont grandes et uniformément jaunes. Stérilisez au moins le double du nombre de graines nécessaires à l’expérience pour sélectionner des graines de bonne qualité, car certaines graines peuvent ne pas être optimales en raison de dommages, de maladies ou d’une absence de germination.
2. Infection des cotylédons par K599
REMARQUE: Utilisez des vecteurs de la série pGWB, car leur double sélection assure l’intégration génomique de l’ensemble de la cassette d’ADN-T. L’électroporation a été utilisée pour transformer un vecteur binaire hébergeant le gène d’intérêt en A. rhizogenes pRi265918.
- Sur la base de la séquence du plasmide18 de A. rhizogenes pRi2659, concevoir des amorces pour détecter le gène du plasmide Ti VirD2 (VirD2 avant: 5'-CCCGATCGAGCTCAAGTTAT-3'; VirD2 inverse: 5'-TCGTCTGGCTGACTTTCGT-3'; Taille d’amplification prévue : 221 pb). Après transformation, tester les colonies d’Agrobacterium pour la rétention de VirD2 par amplification en chaîne de la polymérase (PCR) à l’aide d’un kit de PCR (voir le tableau des matériaux). Cycle PCR : 94 °C pendant 3 min ; 35 cycles (94 °C pendant 1 min, 58 °C pendant 30 sec, 72 °C pendant 1 min); et 72 °C pendant 10 min.
- Après la sélection de la colonie d’A. rhizogenes qui contient à la fois VirD2 et le gène d’intérêt (GOI), en étaler sur des plaques moyennes de Luria-Bertani (LB) contenant les antibiotiques appropriés (50 mg/L) pour le plasmide d’intérêt et incuber pendant la nuit à 30 °C. Si vous utilisez la spectinomycine, ajouter une concentration de 100 mg/L.
- Utiliser un embout de pipette P200 pour gratter une longueur de ~1,5 cm de l’agrobactérie K599 des plaques LB et remettre les cellules en suspension dans 1 mL de tampon phosphate (PB; 0,01 M Na2HPO4, 0,15 M NaCl, pH 7,5).
- Diluer l’Agrobacterium dans duH2Oultrapur stérilisé (v/v = 1:1) et de l’acétosyringone (AS; 100 mM de stock dans du diméthylsulfoxyde [DMSO], v/v = 1:1000). Mesurer l’absorbance à l’aide d’un tube cuvette à une densité optique de 600 nm (OD600). La plage optimale attendue se situe entre 0,5 et 0,8.
- Dans une enceinte de biosécurité, tremper un scalpel stérilisé dans la solution K599 Agrobacterium et effectuer plusieurs coupes de 1 mm de profondeur le long de la surface interne (adaxiale, côté plat) du cotylédon. Pendant l’inoculation, utilisez des pinces stérilisées pour stabiliser le cotylédon.
- Placer environ 6 à 8 cotylédons coupés sur une boîte de Petri contenant du papier filtre saturé de milieu GC avec AS.
NOTE: Pour préparer 6 plaques, 50 mL de milieu GC et 50 μL de 100 mM AS pour atteindre une concentration finale de 100 μM est suffisant. - Incuber les plaques à TA (25 °C) pendant 3 jours sous une photopériode de 16 h (~65 μE).
- Transférer les cotylédons infectés sur des plaques de croissance racinaire velue (MS demi-concentrée autoclave avec 3 % de saccharose [pH = 5,8] et 2,6 g/L de Gelzan, puis ajouter 2,5 mL/L de mélange de vitamines et 500 mg/L de timentine).
REMARQUE: Il y a eu quelques problèmes avec timentin de certains fournisseurs alternatifs, dont le K599 n’a pas été éliminé. Il est recommandé d’utiliser des plaques de Pétri plus hautes (100 mm x 25 mm) pour le milieu HRG. - Incuber les plaques HRG à 22 °C dans une chambre de croissance avec les paramètres réglés sur 100 μE de lumière sur une photopériode de 16 h jusqu’à ce que les racines primaires avec des racines secondaires de 2-3 cm de longueur soient observées (~3-4 semaines).
3. Sélection et récolte des RH
- Récoltez les racines primaires (5-7 cm de longueur) qui poussent à partir du cal et contiennent des racines secondaires (2-3 cm de longueur) à l’aide d’un scalpel stérile et de forceps. Transférer dans des plaques HRG de sélection contenant les antibiotiques appropriés. Laissez les HRs pousser pendant 5 jours de plus sur les plaques HRG de sélection.
REMARQUE : La kanamycine (50 mg/L), l’hygromycine (50 mg/L) ou la phosphinothricine (10 mg/L) sont généralement utilisées pour la sélection. Pour les vecteurs d’expression, pGWB2 est utilisé pour la surexpression, pANDA35HK est utilisé pour le silençage de l’ARNi, pGWB6 est utilisé pour la localisation subcellulaire et pMDC7 est utilisé pour l’expression inductible. - Le jour 5, récoltez des HRs transgéniques avec des racines secondaires de 3 à 6 cm de longueur. Si l’on observe des protéines fluorescentes, les racines secondaires ont peu d’autofluorescence. Si vous effectuez des traitements éliminatoires ou chimiques, coupez les racines secondaires en morceaux de 1 cm et placez ~ 100 mg sur gélose HRG en tas. Ensuite, saturer les piles avec 80 μL du traitement approprié et laisser les plaques incuber à TA (25 °C).
- Après le temps de traitement souhaité, procéder à des extractions d’ARN ou de métabolites.
- Pour l’ARN, tamponnez rapidement les racines sèches sur une serviette en papier stérilisée et récoltez-les directement dans un tube microcentrifuge de 2 mL.
- Scellez immédiatement le haut du tube à l’aide d’un parafilm, faites deux petits trous à l’aide de pinces pointues et immergez les tubes dans de l’azote liquide. Lyophiliser pendant 3 jours, puis conserver les échantillons à -80 °C.
REMARQUE: Il est essentiel de sélectionner des HRs qui sont blancs. Après 5 jours de croissance sur la plaque sélective, les HR transgéniques resteront blanches, mais les racines non transgéniques bruniront.
Résultats
Les résultats représentatifs proviennent des données publiées 19,20. Les résultats de la PCR (cPCR) de la colonie K599 Agrobacterium transformée sont présentés à la figure 1. Comme l’indiquent les colonies positives de la figure 1, le gène d’intérêt a été détecté par PCR (figure 1A). Cependant, un tiers à la moitié des colonies étaient négatives pour le criblage du gène VirD2 (Figure 1B), indiquant la perte du plasmide Ti, et seraient incapables de générer des callosités ou des racines velues. La figure 2 illustre la procédure globale de préparation des HRs de soja et l’analyse de l’expression génique. La figure 3 illustre la localisation subcellulaire de GFP-GmJAZ1-6. La figure 4 est une analyse de l’expression génique montrant la surexpression du facteur de transcription de la glycéolline GmHSF6-1 et le silençage de l’ARNi de GmMYB29A2 dans les racines velues de Williams 82. Des résultats similaires ont été obtenus dans plusieurs rapports récents20,21.

Figure 1 : PCR de colonie (cPCR) de l’Agrobacterium K599 à l’aide d’amorces PCR de colonie du gène d’intérêt ou VirD2. (A) Gène d’intérêt cPCR. b) VirD2 cPCR. Abréviations : C = colonie; +ve = contrôle positif; -ve = contrôle négatif. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Aperçu de la culture de racines velues (HR) du soja et de la procédure d’analyse de la fonction génique. Des callosités se sont formées sur le site de la blessure 2 semaines après l’infection à K599 Agrobacterium. La différenciation cellulaire s’est produite après 1 semaine, puis 1 semaine s’est écoulée pour l’allongement de la FC. Cela a été suivi par la récolte HR et le glucane mural (WGE) / traitement simulé pendant 24 heures. Les HRs ont été soumis à l’extraction de métabolites pour l’analyse par chromatographie liquide ultra performante (UPLC) et à l’isolement de l’ARN pour l’analyse de l’expression génique, respectivement. WGE est le glucane mural de Phytophthora sojae. Veuillez cliquer ici pour voir une version agrandie de cette figure.
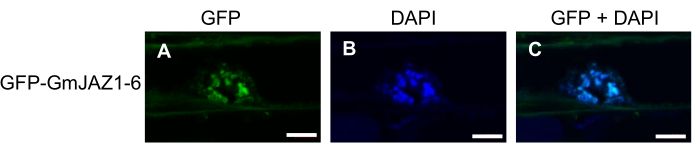
Figure 3 : Microscopie à fluorescence de GmJAZ1-6 fusionnée par translation à une protéine fluorescente verte (GFP) dans des racines velues transgéniques de Williams 82. (A) Canal vert (GFP). (B) Canal bleu (DAPI). (C) Fusion des canaux vert et bleu. Toutes les images ont été recueillies à l’aide d’un microscope confocal Zeiss. Les images DAPI (6 μg/mL) indiquent une coloration nucléaire. Les barres d’échelle sont de 5 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Analyse de l’expression génique. (A) Expression génique dans la surexpression de GmHSF6-119 HRs de soja Williams 82 sous traitement simulé de 24 heures ou déclenchée pendant 24 heures avec WGE. (B) Expression génique dans l’ARNi-GmMYB29A2 20 HRs de soja Williams 82 induite pendant 24 h avec WGE. WGE est le glucane mural de Phytophthora sojae. unSignificativement plus grand et bsignificativement inférieur au test t des étudiants de groupe témoin(p < 0,01). Les barres d’erreur représentent SE (n ≥ 3 réplications biologiques). Les racines secondaires prélevées à partir d’une racine primaire indiquaient une répétition biologique. Ce chiffre a été modifié avec la permission de Lin et al.19 et Jahan et al.20. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Au cours de la dernière décennie, la méthode HR du soja a été développée comme un outil puissant pour étudier les gènes impliqués dans la fixation de l’azote 22,23, la tolérance au stress biotique et abiotique 24,25 et les voies de biosynthèse des métabolites 26,27. La connaissance de la façon dont les plantes produisent des métabolites présente une pléthore d’avantages pour la production agricole et l’industrie pharmaceutique, car elle peut être utilisée pour étudier les réseaux de gènes impliqués dans la médiation des défenses biochimiques contre les agents pathogènes28.
Pour prioriser la productivité et la rentabilité, ce protocole simplifie la procédure. Par exemple, au lieu d’utiliser des supports solides plus coûteux contenant un agent gélifiant, les graines de soja sont germées dans des conditions stériles à l’aide d’essuie-tout de qualité industrielle saturés de milieu de croissance liquide. Les techniques de laboratoire aseptiques et le maintien de conditions de travail stériles sont essentiels pour les expériences de transformation HR, car un large éventail de micro-organismes, tels que les champignons et les levures, peuvent provoquer la contamination des cultures in vitro .
De plus, l’utilisation de l’intensité appropriée de la lumière et de la photopériode est cruciale pour la culture RH. Le processus de croissance et de développement des plantes en cultures in vitro est significativement affecté par la qualité de l’intensité lumineuse et de la photopériode, comme observé dans diverses études antérieures. Si l’intensité lumineuse est trop faible ou trop élevée, elle peut ralentir le processus d’induction des racines. De même, si la photopériode est inappropriée, elle peut conduire à l’échec de la formation des cals et du développement cellulaire différencié29. De plus, d’après nos expériences antérieures, les HRs non transgéniques sont résistants à la kanamycine (50 mg/L) lorsqu’ils sont utilisés comme seul antibiotique. Pour cette raison, nous utilisons généralement des vecteurs codant pour la double résistance pour l’hygromycine et la kanamycine. Dans le cadre de cette sélection rigoureuse, nous sommes en mesure d’obtenir un taux de HR transgénique positif de 15% à 30% des racines totales, mais ~ 80% de ces HR ont significativement surexprimé / réduit au silence les gènes codés par les vecteurs.
Pour assurer le succès des expériences de transformation HR, il est crucial de tester si la souche A. rhizogenes utilisée dans l’expérience conserve le plasmide Ti qui code pour les gènes de virulence. La présence du plasmide Ti est nécessaire pour l’intégration réussie de l’ADN-T dans legénome 4 de la plante. L’utilisation de la cPCR pour détecter le plasmide Ti est devenue une étape essentielle de ce protocole. Dans le passé, nous avons constaté que 33% à 50% de nos transformations ne produiraient pas de calli et de racines. Sans le savoir, cela était dû à la perte du plasmide Ti lors de la transformation ou de la culture ultérieure d’A. rhizogenes. Maintenant, par analyse PCR des colonies d’Agrobacterium suite à leur transformation, nous nous assurons que le plasmide Ti est présent et que 100% des expériences de transformation produisent des racines. L’utilisation de la cPCR dans ce protocole s’est avérée être un ajout précieux à la procédure standard de transformation des RH. Il a réduit le nombre d’expériences ratées, économisant ainsi du temps et des ressources. L’étape de la cPCR nous a également permis de confirmer que le processus de transformation fonctionne comme prévu, en veillant à ce que les résultats des expériences soient fiables et reproductibles.
Néanmoins, cette méthode simplifiée présente certaines limites. Par exemple, ce protocole peut répondre à des questions biologiques cellulaires de base sur les fonctions des gènes dans les HRs transgéniques. Cependant, les questions relatives à d’autres tissus végétaux, tels que les pousses et les feuilles, peuvent ne pas être testables dans les HR. Il est toujours important de confirmer que le processus étudié n’est pas affecté par les niveaux d’hormones ectopiques ou d’autres facteurs introduits par A. rhizogenes. Les chercheurs devraient prendre note de ses limites et concevoir soigneusement les expériences pour assurer des résultats précis et significatifs.
En résumé, le protocole démontré ici est une méthode très efficace pour étudier la fonction des gènes dans les racines de soja. Nous avons récemment démontré sa valeur dans l’étude des approches d’ingénierie multigénique et la compréhension des réseaux de gènes impliqués dans la régulation des défenses biochimiques du soja19. L’efficacité relative de l’approche la rend idéale pour répondre à des questions complexes en biologie végétale qui nécessitent l’étude de nombreux gènes.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette recherche a été financée par le numéro de subvention RGPIN-2020-06111 du Conseil de recherches en sciences naturelles et en génie du Canada (CRSNG) et par un généreux don de Brad Lace. Nous tenons à remercier Wayne Parrott (Université de Géorgie) pour l’Agrobacterium K599 et le protocole préliminaire, et le laboratoire Nakagawa & Hachiya (Université de Shimane) pour les vecteurs vides pGWB2, pGWB6 et pANDA35HK.
matériels
| Name | Company | Catalog Number | Comments |
| Acetosyringone | Cayman | 23224 | |
| Bleach | lavo | 21124 | |
| DMSO | Fisher bioreagents | 195679 | |
| Gelzan | Phytotech | HYY3251089A | |
| Hygromycin | Phytotech | HHA0397050B | |
| Isopropyl alcohol | Fisher chemical | 206462 | |
| Kanamycin | Phytotech | SQS0378007G | |
| LB powder | Fisher bioreagents | 200318 | |
| MS powder | Caisson labs | 2210001 | |
| Na2HPO4 | Fisher bioreagents | 194171 | |
| NaCl | Fisher chemical | 192946 | |
| Petri dishes | Fisherbrand | 08-757-11 | 100 mm x 25 mm |
| Phosphinothricin | Cedarlane | P034-250MG | |
| REDExtract-N-Amp PCR Kit | Sigma | R4775 | |
| Sucrose | Bioshop | 2D76475 | |
| Timentin | Caisson labs | 12222002 | |
| Vitamins | Caisson labs | 2211010 |
Références
- Li, S., et al. Optimization of Agrobacterium-mediated transformation in soybean. Frontiers in Plant Science. 8, 246(2017).
- Elhady, A., Hallmann, J., Heuer, H. Symbiosis of soybean with nitrogen fixing bacteria affected by root lesion nematodes in a density-dependent manner. Scientific Reports. 10, 1619(2020).
- Huang, X. -F., et al. Rhizosphere interactions: root exudates, microbes, and microbial communities. Botany. 92 (4), 267-275 (2014).
- Ma, H., et al. Highly efficient Agrobacterium rhizogenes-mediated genetic transformation and applications in citrus. Frontiers in Plant Science. 13, 1039094(2022).
- Hwang, H. -H., Yu, M., Lai, E. -M. Agrobacterium-mediated plant transformation: biology and applications. The Arabidopsis Book. 15, e0186(2017).
- Gutierrez-Valdes, N., et al. Hairy root cultures-a versatile tool with multiple applications. Frontiers in Plant Science. 11, 33(2020).
- Ono, N. N., Tian, L. The multiplicity of hairy root cultures: prolific possibilities. Plant Science. 180 (3), 439-446 (2011).
- Kereszt, A., et al. Agrobacterium rhizogenes-mediated transformation of soybean to study root biology. Nature Protocols. 2 (4), 948-952 (2007).
- Chen, L., et al. Soybean hairy roots produced in vitro by Agrobacterium rhizogenes-mediated transformation. The Crop Journal. 6 (2), 162-171 (2018).
- Song, J., Tóth, K., Montes-Luz, B., Stacey, G. Soybean hairy root transformation: a rapid and highly efficient method. Current Protocols. 1 (7), e195(2021).
- Fattahi, F., Shojaeiyan, A., Palazon, J., Moyano, E., Torras-Claveria, L. Methyl-β-cyclodextrin and coronatine as new elicitors of tropane alkaloid biosynthesis in Atropa acuminata and Atropa belladonna hairy root cultures. Physiologia Plantarum. 172 (4), 2098-2111 (2021).
- Farrell, K., Jahan, M., Kovinich, N. Distinct mechanisms of biotic and chemical elicitors enable additive elicitation of the anticancer Phytoalexin Glyceollin I. Molecules. 22 (8), 1261(2017).
- Cheng, Y., et al. Highly efficient Agrobacterium rhizogenes-mediated hairy root transformation for gene functional and gene editing analysis in soybean. Plant Methods. 17 (1), 73(2021).
- Arora, D., et al. Establishment of proximity-dependent biotinylation approaches in different plant model systems. Plant Cell. 32 (11), 3388-3407 (2020).
- Gomes, C., Dupas, A., Pagano, A., Grima-Pettenati, J., Paiva, J. A. P. Hairy root transformation: a useful tool to explore gene function and expression in Salix spp. recalcitrant to transformation. Frontiers in Plant Science. 10, 1427(2019).
- Ahmed, S., Kovinich, N. Regulation of phytoalexin biosynthesis for agriculture and human health. Phytochemistry Reviews. 20, 483-505 (2021).
- Walker, R. R., et al. Glyceollins trigger anti-proliferative effects in hormone-dependent aromatase-inhibitor-resistant breast cancer cells through the induction of apoptosis. International Journal of Molecular Sciences. 23 (5), 2887(2022).
- Tong, X., et al. The complete genome sequence of cucumopine-type Agrobacterium rhizogenes strain K599 (NCPPB2659), a nature's genetic engineer inducing hairy roots. International Journal of Agriculture Biology. 20 (5), 1167-1174 (2018).
- Lin, J., et al. RNA-Seq dissects incomplete activation of phytoalexin biosynthesis by the soybean transcription factors GmMYB29A2 and GmNAC42-1. Plants. 12 (3), 545(2023).
- Jahan, M. A., et al. Glyceollin transcription factor GmMYB29A2 regulates soybean resistance to Phytophthora sojae. Plant Physiology. 183 (2), 530-546 (2020).
- Jahan, M. A., et al. The NAC family transcription factor GmNAC42-1 regulates biosynthesis of the anticancer and neuroprotective glyceollins in soybean. BMC Genomics. 20, 149(2019).
- Nguyen, C. X., et al. Critical role for uricase and xanthine dehydrogenase in soybean nitrogen fixation and nodule development. The Plant Genome. , e20171(2021).
- Brear, E. M., et al. GmVTL1a is an iron transporter on the symbiosome membrane of soybean with an important role in nitrogen fixation. New Phytologist. 228 (2), 667-681 (2020).
- Chen, Z., et al. Overexpression of transcription factor GmTGA15 enhances drought tolerance in transgenic soybean hairy roots and Arabidopsis plants. Agronomy. 11 (1), 170(2021).
- Savka, M., Ravillion, B., Noel, G., Farrand, S. Induction of hairy roots on cultivated soybean genotypes and their use to propagate the soybean cyst nematode. Phytopathology. 80 (5), 503-508 (1990).
- Subramanian, S., Graham, M. Y., Yu, O., Graham, T. L. RNA interference of soybean isoflavone synthase genes leads to silencing in tissues distal to the transformation site and to enhanced susceptibility to Phytophthora sojae. Plant Physiology. 137 (4), 1345-1353 (2005).
- Sharma, A. R., Gajurel, G., Ahmed, I., Roedel, K., Medina-Bolivar, F. Induction of the prenylated stilbenoids arachidin-1 and arachidin-3 and their semi-preparative separation and purification from hairy root cultures of peanut (Arachis hypogaea l.). Molecules. 27 (18), 6118(2022).
- Lozovaya, V. V., et al. Isoflavonoid accumulation in soybean hairy roots upon treatment with Fusarium solani. Plant Physiology Biochemistry. 42 (7-8), 671-679 (2004).
- Rahimi Khonakdari, M., Rezadoost, H., Heydari, R., Mirjalili, M. H. Effect of photoperiod and plant growth regulators on in vitro mass bulblet proliferation of Narcissus tazzeta L. (Amaryllidaceae), a potential source of galantamine. Plant Cell, Tissue, and Organ Culture. 142 (1), 187-199 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon