Method Article
Ex Vivo (Canlı Canlı) Akciğer Mekaniğini İncelemek ve Öğretmek için Domuz Deneysel Modeli
Bu Makalede
Özet
Öğretim amaçlı pulmoner mekanik ve alveolar rehtum manevralarının gösterilmesi için bir ex vivo domuz akciğer modeli sunuyoruz. Akciğerler, pulmoner mekanik değişkenlerde minimum değişiklikle bir günden fazla (beş güne kadar) kullanılabilir.
Özet
Mekanik ventilasyon yaygın olarak kullanılmaktadır ve anlaşılması ve yönetilmesi için özel bilgi gerektirir. Bu alandaki sağlık profesyonelleri, yetersiz eğitim ve öğretim yöntemleri nedeniyle kendilerini güvensiz ve bilgi eksikliği hissedebilirler. Bu nedenle, bu makalenin amacı, gelecekte kullanılacak bir ex vivo domuz akciğer modelinin oluşturulmasında yer alan adımları özetlemek, akciğer mekaniğini incelemek ve öğretmektir. Modeli oluşturmak için, beş domuz akciğeri, Hayvan Araştırmaları Etik Kurulu'nun yönergelerine uygun olarak torakstan yeterli özenle dikkatlice çıkarıldı ve bir trakeal kanül aracılığıyla mekanik ventilatöre bağlandı. Bu akciğerler daha sonra alveoler işe alım manevrasına tabi tutuldu. Solunum mekaniği parametreleri kaydedildi ve bu işlem sırasında akciğerlerin videolarını elde etmek için video kameralar kullanıldı. Bu işlem art arda beş gün boyunca tekrarlandı. Kullanılmadığı zaman akciğerler buzdolabında tutuldu. Model, her gün alveoler kalım manevrasından sonra farklı akciğer mekaniği gösterdi; günlerden değil, sadece manevradan etkilenmek. Bu nedenle, ex vivo akciğer modelinin, sürecin tüm aşamalarında görsel geri bildirim yoluyla akciğer mekaniği ve etkilerinin ve hatta alveoler kalım manevrasının daha iyi anlaşılmasını sağlayabileceği sonucuna varıyoruz.
Giriş
Mekanik ventilasyon (MV), yoğun bakım ünitelerinde (YBÜ'ler) ve cerrahi merkezlerde yaygın olarak kullanılmaktadır. Özellikle hastada ciddi akciğer yaralanmalarıolduğunda, asenkronları tanımaya ve tüm hastalar için yaralanmaları önlemeye yardımcı olmak için izlenmesi esastır 1,2,3,4,5,6. Solunum mekaniğinin izlenmesi, hastalığın ilerlemesinin klinik olarak anlaşılmasına ve pozitif ekspiratuar basınç (PEEP) veya alveolar işe alım manevrası (ARM) gibi terapötik uygulamalara da katkıda bulunabilir. Bununla birlikte, bu tekniklerin kullanımı, eğrilerin ve temel akciğer mekaniğinin yetkin bir şekilde anlaşılmasını gerektirir 3,4.
Öğrenciler, asistanlar ve tıp uzmanları, ventilatörün açılması ve ilk ayarlamalardan plato ve sürüş basınçlarının izlenmesine kadar OG yönetimi konusunda kendilerini güvensiz hissederler ve bu güvensizlik, bilgi eksikliği ve yeterli ön eğitimile ilişkilidir 7,8,9,10. Simülasyonlara katılan ve bir akciğer modeli kullanan profesyonellerin daha fazla güven, parametreleri anlama ve akciğer mekaniğinin bileşenlerini anlamabildirdiklerini gözlemledik 8,11,12.
Test akciğerleri, körükler ve pistonlar ile MV'yi incelemek ve eğitmek için modeller, farklı basınç ve hacimlerin yanı sıra farklı akciğer mekaniği koşullarını simüle edebilir 13,14,15. Hesaplamalı ve yazılım modelleri, MV11'in ilkelerini sağlık profesyonellerine öğretmek için kullanılabilecek simülasyonlar üreterek kardiyopulmoner etkileşimin incelenmesine de katkıda bulunur16,17.
Hesaplamalı modeller pulmoner histerezis16'yı temsil etmede zorluklar sunabilirken, test akciğeri ve körüklümodeller 13,14,15 fizyolojik eğriye benzer basınç-hacim eğrileri üretebilir ve pulmoner dinamikleri gösterebilir. Bir avantaj olarak, ex vivo domuz akciğeri, insanlara18 benzer anatomi sunar, ayrıca MV eğrileri, pulmoner histerezis üretir ve akciğer mekaniği analizi sırasında akrilik kutu içindeki akciğerlerin görsel geri bildirimini sağlar. Görsel modeller önemlidir ve hayal edilmesi zor bileşenlerin ve kavramların anlaşılmasına yardımcı olabilir. Bu nedenle, ex vivo akciğer modelleri pratik bir öğretim yöntemini temsil eder.
Pozitif ve negatif basınçlıMV 19,20,21, aerosol dağılımının analizi 22,23, pediatrik simülasyonlar24 ve akciğer perfüzyonu25 gibi ex vivo domuz akciğerleri ile yapılan çalışmalar MV hakkındaki bilgileri geliştirebilir. Pozitif ve negatif basınçtaki modelleri analiz eden son çalışmalar, pozitif basınçlı ventilasyonun, negatif basınç basıncına kıyasla daha fazla lokal deformasyon, daha fazla distansiyon, histerezis eğrisi farklılıkları ve olası doku lezyonları ile ani işe alıma yol açabileceğini göstermiştir 19,20,21. Bununla birlikte, pozitif basınç modelleri gereklidir, çünkü hastalar MV basıncı 19,20,21 sırasında pozitif basınç altındadır. Klinik öncesi çalışmalar için bir akciğer modelinin geliştirilmesi, MV öğretimi ve eğitimi de dahil olmak üzere yeni araştırma ve uygulamalar için olanaklar sunmaktadır.
Burada, çalışma ve eğitim amaçlı bir ex vivo domuz akciğer modeli sunuyoruz. Birincil hedefimiz, pozitif basınçlı MV altında bu ex vivo domuz akciğer modelinin üretilmesi için adımları tanımlamaktır. Gelecekte akciğer mekaniğini incelemek ve öğretmek için kullanılabilir.
Protokol
Protokol, Kurumumuz Hayvan Araştırmaları Etik Kurulu tarafından onaylanmıştır (protokol no. 1610/2021).
1. Anestezi ve hayvan hazırlama
- İlk olarak, hayvanı bir tartıya koyun ve prosedür için gerekli ilaçları ve sedasyonu ayarlamak için ağırlığı kontrol edin.
- Kas içine ketamin 5 mg / kg ve midazolam 0.25 mg / kg uygulayın.
- Marjinal kulak damarını 20 G venöz kateter ile delin ve anestezi indüksiyonu için intravenöz propofol (5 mg / kg) uygulayın.
- Kardiyopulmoner ekstraksiyon ve perfüzyona yardımcı olmak için marjinal kulak damarına intravenöz olarak 3 mL heparin uygulayın.
- Anesteziden sonra, 6,5 mm orotrakeal kanül (OTC) ile orotrakeal entübasyon yapın ve işlem sırasında yer değiştirmesini önlemek için OTC'yi yapışkan bantla sabitleyin.
NOT: Sedasyon derinliği, hemodinamik parametreler izlenerek ve ortalama arteriyel basınç, kalp atış hızı ve solunmuş/süresi dolmuş izofluran konsantrasyonu gibi bir gaz analizörü kullanılarak kontrol edilir.
2. İntraoperatif mekanik ventilasyon
- Solunan oksijen fraksiyonunun (FiO2) %50'sinde %1,5 izofluran ve fentanil 10 mcg/kg bolus + 10 mcg/kg/saat sürekli infüzyon ile sedasyonu koruyarak hayvanı OTC yoluyla MV'ye bağlayın.
- Mekanik ventilatör ekranına dokunun ve hacim kontrollü ventilasyon (VCV) modunu seçin, gelgit hacmi (TV) düğmesini seçin ve gelgit hacmi değeri 8 mL/kg'a karşılık gelene kadar kaydırma tekerleğini çevirin.
- Mekanik ventilatör ekranına dokunun. FiO2'yi seçin ve %50 değerine ulaşılana kadar kaydırma tekerleğini çevirin.
- Mekanik ventilatör ekranına dokunun ve solunum hızını (RR) seçin. Mekanik ventilatöre bağlı kapnografi ile ölçülen 35-45 mmHg'lik son kullanma tarihi geçmiş bir CO2'yi korumak için tekerleği ideal değere ulaşana kadar çevirin.
NOT: Sedasyon derinliği, hemodinamik parametreler izlenerek ve ortalama arteriyel basınç, kalp atış hızı ve solunmuş/süresi dolmuş izofluran konsantrasyonu gibi bir gaz analizörü kullanılarak kontrol edilir.
3. Doku diseksiyonu ve OTC değişimi
- Torasik boşluğa erişmek için manubriumun 2 cm yukarısından sternumun ksifoid işleminin 2 cm altına kadar medial sternal bir kesi yapın. Prosedür sırasında görüş alanını genişleterek kaburga ekartörlerini konumlandırın.
- Yeni bir trakeal kanül sokacak kadar geniş krikoid kıkırdağın yüksekliğinde (sadece ilk trakeal halkalarda) yatay bir trakeal kesi yapmak için bir neşter kullanın.
- Hava yolunun içindeki OTC manşetini söndürün ve çıkarmak için yavaşça çekin. Bu arada, eski OTC'yi çıkardıktan sonra soluk borusunda yapılan kesiye yeni OTC'yi yerleştirin. Sönmüş manşet nedeniyle sızıntı meydana gelebilir ve yeni OTC'yi yeniden konumlandırırken durabilir.
- Pilot balona 20 mL'lik bir şırınga bağlayarak yeni takılan trakeal tüp manşetini şişirin. Şırınga, basınç altında hava verir ve pilot balonu ve manşeti şişirir. Manşet şiştikten sonra şırıngayı çıkarın.
- Akciğeri pleksiglas ventilasyon kutusuna yerleştirirken sızıntı ve hareketi önlemek için yeni trakeal kanülü 2-0 polyester ile doğrudan trakeaya bağlayın.
- Neşter ile, kardiyopulmoner organları torakstan çıkarmak için dokuları inceleyin.
4. Hayvan ötenazisi
- İzofluran konsantrasyonunu% 5'e yükseltin ve 10 mL% 19.1 potasyum klorür uygulayın. Daha sonra, hayati belirtilerin yokluğunu kontrol edin.
NOT: Bu prosedür, Laboratuvar Hayvanlarının Bakımı ve Kullanımı için Ulusal Sağlık Enstitüleri Kılavuzu'na göre gerçekleştirilmiştir.
5. Kardiyopulmoner ekstraksiyon
- Ötenaziden sonra, akciğerleri çıkarmak için solunum bağını inceleyin.
- Doku diseksiyonundan sonra, inspirasyonun sonunda OTC'yi uygun Kelly forseps ile sıkıştırın ve akciğerleri şişirin.
- OTC'yi mekanik ventilatörden ayırın, ancak kelepçeli tutun.
- Aort arterini bölümlere ayırın, ekstravaze kanı çıkarmak için aspiratörü göğüs boşluğunun içine yerleştirin, diseksiyonları bitirirken boşluğun görselleştirilmesini sağlayın ve çıkarılacak organları göğüs boşluğundan serbest bırakın.
NOT: Pulmoner yırtılmayı önlemek için inferior pulmoner ligament dikkatlice serbest bırakılmalıdır. - Kalbi ve akciğeri OTC klempli olarak göğüs kafesinden ayırmadan çıkarın ve bir tepsiye yerleştirin.
6. Kardiyopulmoner hazırlık
- Akciğer bir tepsi üzerindeyken, pulmoner arteri büyük delikli tek lümenli bir kateter ile kanüle edin ve sürekli olarak 2.000 mL soğuk% 0.9 salin solüsyonu (SS) uygulamak için veya aorttan berrak sıvı akana kadar infüzyon setine bağlayın.
NOT: SS normal oranda uygulanmalıdır, intravenöz (IV) torbayı sıkmaktan kaçının. - Akışı temizledikten sonra, aort arterini 2-0 polyester ile dikin ve 100 mL daha% 0.9 SS uygulayın.
- OTC'yi açın, akciğerlerin söneceğini ve kapalı kalacağını, MV ve ARM'yi almaya hazır olacağını unutmayın.
7. Akrilik kutu içinde MV
- Hazırlandıktan sonra akrilik kutuyu açın ve akciğerleri kutunun içine dikey olarak yerleştirin. OTC'yi kapaktaki delikten geçirin ve trakeal kanülü mekanik ventilatöre bağlayın.
NOT: Trakeal kanülün trakeaya sıkıca sabitlendiğinden emin olun. - Havalandırmayı Başlat düğmesini seçin.
- Mekanik ventilatör ekranına dokunun ve VCV için mekanik ventilatörü seçin.
- VCV modu ayarları ekranına dokunun ve TV düğmesini seçin, tekerleği 6 mL/kg değerine ulaşana kadar çevirin. PEEP'i 5 cm H2O'ya, FiO2 % 21'e , RR'yi dakikada 15 nefese ve inspiratuar duraklama süresini% 10'a ayarlamak için aynısını yapın.
8. KOL
- İşe alıma başlamak için, PEEP'i 5 cmH2O'dan 6 cmH2O'yayükseltin ve ardından 14 cmH2O'ya ulaşana kadar 2 cm H2O'luk adım adım artırın. Değeri artırmak için çarkı çevirin.
- Her PEEP için, mekanik ventilatör ekranında görüntülenen pik basınç, plato basıncı, dinamik uyumluluk ve hava yolu direnci değerlerini not edin. Plato basınç değeri eksi o sırada ayarlanan PEEP değeri olan sürüş basıncını not edin.
- 14 cmH2O'ya ulaştıktan sonra, PEEP'i 6 cmH2O'yaulaşana kadar 2 cmH2O'lukadım adım azaltımlarla azaltın, ardından 5 cm H2O'ya düşürün. Değeri azaltmak için tekerleği çevirin.
- Her PEEP için, mekanik ventilatör ekranında görüntülenen pik basınç, plato basıncı, dinamik uyumluluk ve hava yolu direnci değerlerini not edin. Plato basınç değeri eksi o sırada ayarlanan PEEP değeri olan sürüş basıncını not edin.
NOT: Her PEEP değerini artırma sırasında 10 dakika ve azaltma sırasında her adımda 5 dakika koruyun.
- Her PEEP için, mekanik ventilatör ekranında görüntülenen pik basınç, plato basıncı, dinamik uyumluluk ve hava yolu direnci değerlerini not edin. Plato basınç değeri eksi o sırada ayarlanan PEEP değeri olan sürüş basıncını not edin.
9. Kardiyopulmoner bakım
- İşe alım aşamasının sonunda, inspirasyon sırasında trakeal kanülü kelepçe ile hafifçe kelepçeleyin ve akciğerleri şişirin. Akrilik kutuyu açın.
- Akciğerleri akrilik kutudan çıkarın ve dikkatlice bir cam kaba koyun.
NOT: Trakeal kanülün trakeaya sıkıca sabitlendiğinden emin olun. - 500 mL% 0.9 SS dökün.
- Buzdolabında plastik kaplı cam kapta 2 ila 8 °C sıcaklıkta 24 saat saklayın.
- 7, 8 ve 9 numaralı adımları art arda beş gün boyunca tekrarlayın.

Şekil 1: Çalışma akış şeması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Ağırlıkları 23.4-26.9 kg arasında değişen beş dişi domuz kullandık ve kardiyopulmoner ekstraksiyon ve akciğer mekaniği analizi için tarif edilen protokolü izledik. Amacımız, modelin doğrudan mekanik ventilatör ekranından toplanan pik basınç, plato basıncı, direnç, sürüş basıncı ve dinamik uyum değişkenlerini analiz ederek akciğer mekaniği çalışması için yararlı olmasıdır. Model akış şeması Şekil 1'de gösterilmektedir.
Akciğerler, protokolün 7.2, 8.1, 8.2, 9.1, 9.2 ve 9.3 maddelerinde açıklanan tüm süreci tekrarlayarak art arda beş gün boyunca analiz edildi. Akciğer değişkenlerinin işe alım öncesi ve sonrası nasıl davrandığını göstermeye ve ex vivo pulmoner modelin belirlenen dönemdeki dayanıklılığını doğrulamaya çalıştık.
ARM öncesi ve sonrası arasında tüm değişkenler için anlamlı farklılıklar (p < 0.05) gözlendi. Manevra sonrası pik basınç, plato basıncı (Şekil 2) ve sürüş basıncı (Şekil 3) azalırken (p=0.0005), dinamik uyum (p=0.0007) artmıştır (Şekil 4), açık çökmüş alveoller ve akciğer alanı kazanımı göstermiştir. Direnç (Şekil 5) işe alımdan sonra da arttı (p = 0.0348). Değişkenlerin hiçbiri günden önemli ölçüde etkilenmedi.
Bu sonuçlara dayanarak, modelin ARM aracılığıyla görsel akciğer mekaniği değişikliklerini göstermede (Şekil 6) ve akciğer mekaniğini incelemede ve öğretmede (Şekil 7) etkili olduğunu gösterdik. Ek olarak, modelin art arda en az beş gün kullanılabileceğini gösterdik. Modeli bu sürenin ötesinde değerlendirmediğimiz için, akciğer modelinin nihai dayanıklılığını teyit edemiyoruz.

Şekil 2: Basınçlar. (A) Tepe basıncı. ARM öncesi Ppeak 21 ± 3.2 ila 23 ± 2.3cmH2O arasında değişirken, ARM sonrası Ppeak beş akciğerde 9 ± 0.6 ± 1.4 cmH2O arasında değişiyordu. Anlamlı kabul edilen 0.0005 p değerini hesaplamak için iki yönlü ANOVA istatistiksel analizi kullanıldı. (B) Plato basıncı. ARM öncesi Pplateau 21 ± 3.2 ila 22 ± 2.3cmH2O arasında değişirken, ARM sonrası Pplateau beş akciğerde 8.8 ± 0.4 ile 11.6 ± 1.6 cmH2O arasında değişiyordu. Anlamlı kabul edilen 0.0005 p değerini hesaplamak için iki yönlü ANOVA istatistiksel analizi kullanıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
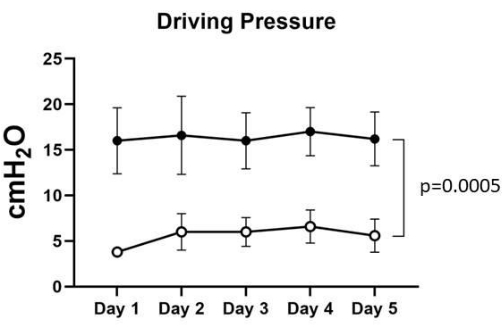
Şekil 3: Sürüş basıncı. ARM öncesi Sürüş basıncı 16 ± 3.2 ila 17 ± 2.3 cmH2O arasında değişirken, ARM sonrası Sürüş basıncı beş akciğerde 3.8 ± 0.4 ± 6.6 1.6 cmH2O arasında değişiyordu. Anlamlı kabul edilen 0.0005 p değerini hesaplamak için iki yönlü ANOVA istatistiksel analizi kullanıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Dinamik uyumluluk. ARM öncesi Dinamik uyum 9.1 ± 1.2 ila 10.2 ± 2.6 mL / cmH2O arasında değişirken, ARM sonrası Dinamik uyum beş akciğerde 23.6 ± 3.5 ile 43.8 ± 11.3 mL / cmH2O arasında değişiyordu. Anlamlı kabul edilen 0.0007 p değerini hesaplamak için iki yönlü ANOVA istatistiksel analizi kullanıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
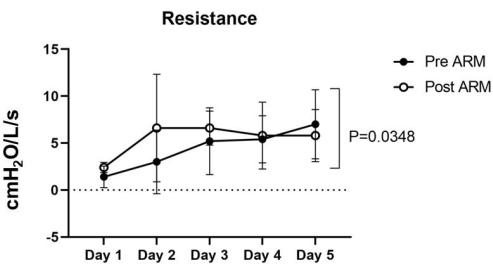
Şekil 5: Direnç. ARM öncesi Direnç 1.4 ± 1.0 ila 7 ± 3.2 cmH2O / L / seg arasında değişirken, ARM sonrası Direnç beş akciğerde 2.4 ila 0.4 ± 6.6 ± 5.1 cmH2O / L / seg arasında değişmektedir. Anlamlı kabul edilen 0.0348 p değerini hesaplamak için iki yönlü ANOVA istatistiksel analizi kullanıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
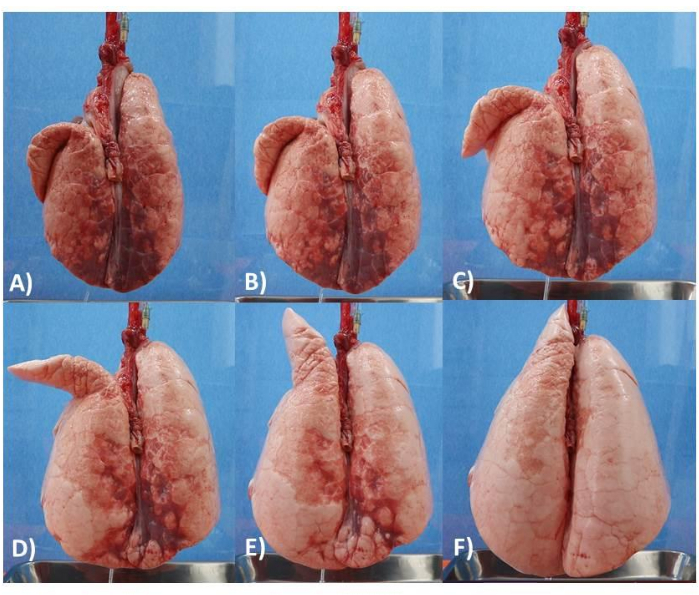
Şekil 6: Akciğer modeli. (A) 5 cm PEEP ile akciğer. (B) 6 cm PEEP ile akciğer. (C) 8 cm PEEP ile akciğer. (D) 10 cm PEEP ile akciğer. (E) 12 cm PEEP ile akciğer. (F) 14 cm PEEP ile akciğer. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
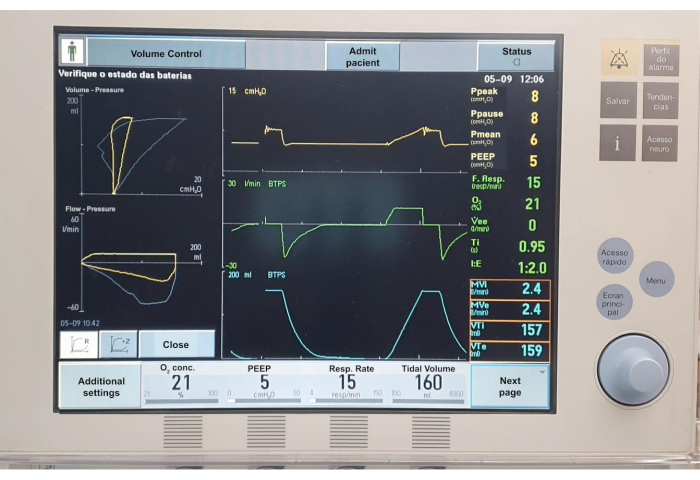
Şekil 7. Mekanik ventilasyon çizelgeleri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Açıklanan protokol, pozitif basınçlı MV altında bir ex vivo domuz akciğer modeli üretmek için kullanışlıdır. Cihaz ekranına yansıtılan eğrilerin ve değerlerin işe alım ve analizi sırasında akciğerlerden gelen görsel geri bildirim yoluyla akciğer mekaniğini incelemek ve öğretmek için kullanılabilir. Bu sonuca ulaşmak için, göğüs kafesi dışındaki akciğerlerin davranışlarını anlamak ve adaptasyon ihtiyacını belirlemek için pilot çalışmalara ihtiyaç vardır.
Kritik noktanın, mekanik ventilatörü bağlarken görüntülenen plevrada kabarcıklar, fistüller ve lezyonların oluşumu olduğunu, solunan ve süresi dolmuş TV ile hacim eğrisindeki değişiklikler arasındaki fark olduğunu belirledik. Bu nedenle, ilk protokol değişikliklerinden biri, kardiyopulmoner organların diseksiyonu sırasında prosedürün başında diyafram insizyonu ile toraksın geniş bir cerrahi açıklığının kullanılmasıydı, bu da yapıların görselleştirilmesini iyileştirebilir ve alt pulmoner bağın dikkatli bir şekilde serbest bırakılmasına yardımcı olabilir, akciğer bütünlüğünü korur. Ayrıca, yapılar diseke edildikten sonra pilot akciğerlerin manuel olarak şişirilmesi, bu şişirmenin basınç sınırlarını aştığını ve kabarcık ve fistül oluşumuna katkıda bulunduğunu gösterdi. Ex vivo akciğerleri kullanan bazı çalışmalar, sızıntılar için fibrin yapıştırıcı kullanma olasılığını olumlu sonuçlarla sundu; Çalışmada bu yaklaşımı kullanmamış olsak da, modeli geliştirmek için bir alternatif olabilir 26,27. Konuyla ilgili bir diğer nokta ise pilot çalışmada akciğerlerin çıkarılıp tamamen söndürülerek organ hazırlığından MV başlanmasına kadar tamamen çökmüş halde tutulması, akciğerlerin MV'ye açılmasını zorlaştırmış ve fistül oluşma ihtimalini arttırmıştır. Bu nedenle, OTC'yi klemplemeye ve diseksiyon sırasında SS uygulanana kadar akciğerleri şişirmeye başladık. Daha sonra, OTC serbest bırakıldı, söndürüldü ve ARM'yi başlatmak için akciğerleri mekanik ventilatöre bağladı ve pulmoner histerezis eğrisini göstermek için akciğer mekaniğinin bir analizi yapıldı. Bu, anestezi uygulanan hastalarda MV 28,29,30,31 sırasında bile atelektazi ve akciğer kompliyansını azalttığı için akciğer alımını veya akciğer mekaniğinin analizini tehlikeye atmadı.
Pilot çalışmada, 5 cm H2O'luk bir başlangıç PEEP'i kullanılmış ve 5 cm H2O artışlarla 25 cm H2O 32,33'e kadar arttırılmıştır. Bununla birlikte, tepe ve plato basınçları fistül oluşumu ile sırasıyla 40 ve 30 cm H2O'dan daha yüksek değerlere ulaşmıştır. Böylece, ex vivo akciğer modelimizde basınçların zaman içindeki davranışını daha iyi analiz etmek ve PEEP sınırlarını anlamak için 2 cmH2Oartışlarında kademeli bir artış gerçekleştirildi. Sürekli ve artımlı enflasyon arasında mortalite açısından bir fark yoktu, ancak artımlı enflasyon en çok kullanılanıdır ve akciğer mekaniğinin aşamalı analizini kolaylaştırabilir34. Negatif basınç 20,21 kullanımına gelince, model sadece pozitif basınç altında test edildi çünkü MV hastaları pozitif basınca maruz kalıyor. Gelecekte negatif basınç kullanımını dışlamıyoruz, ancak akrilik kasa değişiklikleri gerektirecektir.
Literatür, göğüs kafesini simüle eden hava geçirmez şekilde kapatılmış kutulara yerleştirilmiş bir test akciğeri, pistonlar ve bir ex vivo model13,14 ile üretilen bazı modelleri sunmaktadır. Modelimiz, negatif basınç uygulama olasılığını azaltmasına rağmen, modelin üretimini kolaylaştırabilecek geleneksel bir akrilik kutuya yerleştirildi. Klinik öncesi çalışmalar18 için üretilen başka bir model bizimkine benzer, ancak akciğerler yatay olarak konumlandırılırken, bizimki dikey olarak tutulmuş, organların ve göğüs kafesinin desteği olmadan yerçekimi etkisini almıştır. Bu akciğerler ötenaziden sonraki 48 saat içinde deneyler sırasında kullanıldı 18,19,20,21,35. Modelimiz, deneyin 24 saati boyunca 2-8 °C sıcaklıkta tutularak toplam 120 saat kullanıldı ve temsili sonuçlar bölümünde açıklanan olumlu sonuçları gösterdi.
Öğretim ve eğitimdeki boşluk bu ilk anda ele alınmadı, ancak model akciğer mekaniğini analiz etmek için etkilidir ve araştırma ve öğretim için bir araç olarak kullanılabilir. Ek olarak, perfüzyon solüsyonlarını incelemeyi amaçlamadık, ancak adım 6.1'de SS'yi infüze ettiğimiz gibi, perfüzyon ve koruma solüsyonları kullanılabilir ve sunulan aynı modelle çalışmalar için yeni olanaklar açılır.
Bu tekniğin bazı sınırlamaları vardır: 1) akciğerlerin düzgün bir şekilde çıkarılmasını sağlamak için hayvan anatomisi bilgisi; 2) model beş günden fazla değerlendirilmedi; 3) model, ventilasyon öğretimi için uygun görünmektedir, ancak bir öğretim bağlamında test edilmemiştir; 4) Bu bir hayvan modelidir, bu nedenle insanlarda uygulanabilirlik sınırlamalarını dikkate almak önemlidir.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmezler.
Teşekkürler
Bu ex vivo domuz akciğer modeli protokolünün oluşturulmasına katkıda bulunan ve destekleyen tüm meslektaşlarımıza ve profesyonellerimize teşekkür ederiz.
Bu çalışmanın finansman kaynağı yoktu.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.9% Saline solution | 2500ml | ||
| Anesthesia machine - Primus | Drager | REF 8603800-18 | Anesthesia work station used in the procedure |
| Aspirator | For blood aspiration from thorax | ||
| Bedside Monitor - Life Scope | Nihon Kohden | BSM-7363 | Multiparameter monitor used during the procedure |
| Bonney Tissue Forceps | Any tissue forceps is suitable | ||
| Disposable scalper, #23 | Any scalper is suitable | ||
| Disposable syringe needles, 18G x 1 1/2", 23G x 1" | BD | 302814 | Widely available |
| Disposable syringes, 10ml | Widely available | ||
| Electrosurgical unit - SS-501 | WEM | For cutting and coagulation during thorax incision | |
| Fentanyl | 10 mcg/kg bolus + 10 mcg/kg/hour continuous infusion | ||
| Finochietto retractor | Any finochietto retractor is suitable | ||
| heparin | 3ml | ||
| Infusion set | Any infusion set is suitable | ||
| Isoflurane | 1.5% | ||
| Kelly Forceps Curved | Any kelly forceps is suitable | ||
| Ketamine | 5mg/kg | ||
| Lactated Ringer solution | 500ml | ||
| Mechanical ventilator - Servo I | Maquet | REF 6449701 | Mechanical ventilator used in the procedure |
| Metzenbaum Scissor (Straight and curved) | Any metzenbaum scissor is suitable | ||
| Midazolam | 0.25mg/kg | ||
| Orotracheal intubation cannula, #6.5 | Rusch | 112282 | Widely available |
| Plexiglass | Custom made plexiglass box: 30x45x60cm | ||
| Polyester suture, 2-0 | Widely available | ||
| Potassium choride | 10 ml, 19.1% potassium chloride. | ||
| propofol | 5mg/kg | ||
| Three way stopcock | Widely available | ||
| Venous catheter, G20 x 1" | BD | 38183314 | Widely available |
Referanslar
- Roberto, C., Carvalho, R., Toufen Jr, C., Franca, S. A. Mechanical Ventilation: Principles, graphic analysis and ventilation modalities. Jornal Brasileiro de Pneumologia. 33 (2), 54-55 (2007).
- Barbas, C. S. V., et al. Brazilian recommendations for mechanical ventilation 2013. Part I. Revista Brasileira de Terapia Intensiva. 26 (2), 89-121 (2014).
- Walter, J. M., Corbridge, T. C., Singer, B. D. Invasive mechanical ventilation. Southern Medical Journal. 111 (12), 746-753 (2018).
- Faustino, E. A. Concepts and monitoring of pulmonary mechanics in patients under ventilatory support in the intensive care unit. Revista Brasileira de Terapia Intensiva. 19 (2), 161-169 (2007).
- Holanda, M. A., Vasconcelos, R. S., Ferreira, J. C., Pinheiro, B. V. Patient-ventilator asynchrony. Jornal Brasileiro de Pneumologia. 44 (2), 321-333 (2018).
- Rezoagli, E., Laffey, J. G., Bellani, G. Monitoring lung injury severity and ventilation intensity during mechanical ventilation. Seminars in Respiratory and Critical Care Medicine. 43 (3), 346-368 (2022).
- Tallo, F. S. Evaluation of self-perception of mechanical ventilation knowledge among Brazilian final-year medical students, residents, and emergency physicians. Clinics. 72 (2), 65-70 (2017).
- Schroedl, C. J., et al. Impact of simulation-based mastery learning on resident skill managing mechanical ventilators. American Thoracic Society Scholar. 2 (1), 34-48 (2021).
- Wilcox, S. R., et al. Academic emergency medicine physicians' knowledge of mechanical ventilation. The Western Journal of Emergency Medicine. 17 (3), 271-279 (2016).
- Cox, C. E., et al. Effectiveness of medical resident education in mechanical ventilation. American Journal of Respiratory and Critical Care Medicine. 167 (1), 32-38 (2003).
- Keegan, R., Henderson, T., Brown, G. Use of the virtual ventilator, a screen-based computer simulation, to teach the principles of mechanical ventilation. Journal of Veterinary Medical Education. 36 (4), 436-443 (2009).
- Spadaro, S., et al. Simulation training for residents focused on mechanical ventilation: A randomized trial using mannequin-based versus computer-based simulation. Simulation in Healthcare. 12 (6), 349-355 (2017).
- Chase, J. G., Yuta, T., Mulligan, K. J., Shaw, G. M., Horn, B. A novel mechanical lung model of pulmonary diseases to assist with teaching and training. BMC Pulmonary Medicine. 6 (21), 1-11 (2006).
- Kuebler, W. M., Mertens, M., Pries, A. R. A two-component simulation model to teach respiratory mechanics. Advances in Physiology Education. 31 (2), 218-222 (2007).
- Heili-Frades, S., Peces-Barba, G., Rodríguez-Nieto, M. J. Design of a lung simulator for learning lung mechanics in mechanical ventilation. Archivos de Bronconeumología. 43 (12), 674-679 (2007).
- Ngo, C., Dahlmanns, S., Vollmer, T., Misgeld, B., Leonhardt, S. An object-oriented computational model to study cardiopulmonary hemodynamic interactions in humans. Computer Methods and Programs in Biomedicine. 159, 167-183 (2018).
- Lazzari, C. D., Genuini, I., Pisanelli, D. M., D'Ambrosi, A., Fedele, F. Interactive simulator for e-Learning environments: a teaching software for health care professionals. Biomedical Engineering Online. 13 (172), 1-18 (2014).
- Perinel, S., et al. Development of an ex vivo human-porcine respiratory model for preclinical studies. Scientific Reports. 7, 1-6 (2017).
- Aboelnazar, N. S., et al. Negative pressure ventilation decreases inflammation and lung edema during normothermic ex-vivo lung perfusion. The Journal of Heart and Lung Transplantation. 37 (4), 520-530 (2018).
- Sattari, S., et al. Introducing a custom-designed volume-pressure machine for novel measurements of whole lung organ viscoelasticity and direct comparisons between positive- and negative-pressure ventilation. Frontiers in Bioengineering and Biotechnology. 8, 1-12 (2020).
- Sattari, S., et al. Positive- and negative-pressure ventilation characterized by local and global pulmonary mechanics. American Journal of Respiratory and Critical Care Medicine. 207 (5), 577-586 (2023).
- Montigaud, Y., et al. Development of an ex vivo preclinical respiratory model of idiopathic pulmonary fibrosis for aerosol regional studies. Scientific Reports. 9 (1), 17949 (2019).
- Montigaud, Y., et al. Aerosol delivery during invasive mechanical ventilation: development of a preclinical ex vivo respiratory model for aerosol regional deposition. Scientific Reports. 9 (1), 17930 (2019).
- Montigaud, Y., et al. Development of an ex vivo respiratory pediatric model of bronchopulmonary dysplasia for aerosol deposition studies. Scientific Reports. 9 (1), 5720 (2019).
- Buchko, M. T., et al. A low-cost perfusate alternative for ex vivo. lung perfusion. transplantation proceedings. 52 (10), 2941-2946 (2020).
- Kondo, N. Development of an effective method utilizing fibrin glue to repair pleural defects in an ex-vivo pig model. Journal of Cardiothoracic Surgery. 15 (1), 110 (2020).
- Gasek, N., et al. Development of alginate and gelatin-based pleural and tracheal sealants. Acta Biomaterialia. 131, 222-235 (2021).
- Li, X., et al. Effects of individualized positive end-expiratory pressure combined with recruitment maneuver on intraoperative ventilation during abdominal surgery: a systematic review and network meta-analysis of randomized controlled trials. Journal of Anesthesia. 36 (2), 303-315 (2022).
- Hu, M. C., Yang, Y. L., Chen, T. T., Lee, C. I., Tam, K. W. T. Recruitment maneuvers to reduce pulmonary atelectasis after cardiac surgery: A meta-analysis of randomized trials. The Journal of Thoracic and Cardiovascular Surgery. 164 (1), 171-181 (2020).
- Hu, M. C., et al. Recruitment maneuvers in patients undergoing thoracic surgery: a meta-analysis. General Thoracic and Cardiovascular Surgery. 69 (12), 1553-1559 (2021).
- Zeng, C., Lagier, D., Lee, J. W., Melo, M. F. V. Perioperative pulmonary atelectasis: Part I. Biology and mechanisms. Anesthesiology. 136 (1), 181-205 (2022).
- Niman, E., et al. Lung recruitment after cardiac arrest during procurement of atelectatic donor lungs is a protective measure in lung transplantation. Journal of Thoracic Disease. 14 (8), 2802-2811 (2022).
- Calvo, R. N., et al. Comparison of the efficacy of two alveolar recruitment maneuvers in improving the lung mechanics and the degree of atelectasis in anesthetized healthy sheep. Research in Veterinary Science. 150 (5), 164-169 (2022).
- Pensier, J., et al. Effect of lung recruitment maneuver on oxygenation, physiological parameters and mortality in acute respiratory distress syndrome patients: a systematic review and meta-analysis. Intensive Care Medicine. 45 (12), 1691-1702 (2019).
- Mariano, C. A., Sattari, S., Quiros, K. A. M., Nelson, T. M., Eskandari, M. Examining lung mechanical strains as influenced by breathing volumes and rates using experimental digital image correlation. Respiratory Research. 23 (1), 92 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır