Method Article
Ex Vivo Modelo Experimental Porcino para Estudo e Ensino de Mecânica Pulmonar
Neste Artigo
Resumo
Apresentamos um modelo ex vivo de pulmão de porco para demonstração da mecânica pulmonar e manobras de recrutamento alveolar para fins didáticos. Os pulmões podem ser utilizados por mais de um dia (até cinco dias) com mínimas alterações nas variáveis da mecânica pulmonar.
Resumo
A ventilação mecânica é amplamente utilizada e requer conhecimentos específicos para seu entendimento e manejo. Os profissionais de saúde dessa área podem sentir-se inseguros e desconhecedores devido à formação e aos métodos de ensino inadequados. Portanto, o objetivo deste artigo é delinear as etapas envolvidas na geração de um modelo de pulmão suíno ex vivo a ser utilizado no futuro, para estudar e ensinar mecânica pulmonar. Para gerar o modelo, cinco pulmões porcinos foram cuidadosamente retirados do tórax seguindo as orientações do Comitê de Ética em Pesquisa Animal com os cuidados adequados e conectados ao ventilador mecânico através de uma cânula traqueal. Esses pulmões foram então submetidos à manobra de recrutamento alveolar. Parâmetros de mecânica respiratória foram gravados e câmeras de vídeo foram usadas para obter vídeos dos pulmões durante esse processo. Esse processo foi repetido por cinco dias consecutivos. Quando não utilizados, os pulmões foram mantidos refrigerados. O modelo mostrou mecânica pulmonar diferente após a manobra de recrutamento alveolar a cada dia; não sendo influenciado pelos dias, apenas pela manobra. Portanto, concluímos que o modelo pulmonar ex vivo pode proporcionar um melhor entendimento da mecânica pulmonar e seus efeitos, e até mesmo da manobra de recrutamento alveolar através do feedback visual durante todas as etapas do processo.
Introdução
A ventilação mecânica (VM) é amplamente utilizada em unidades de terapia intensiva (UTIs) e centros cirúrgicos. Sua monitorização é essencial para ajudar a reconhecer assincronias e prevenir lesões para todos os pacientes, especialmente quando o paciente apresenta lesões pulmonares graves1,2,3,4,5,6. A monitorização da mecânica respiratória também pode contribuir para o entendimento clínico da progressão da doença e aplicações terapêuticas, como o uso da pressão expiratória final positiva (PEEP) ou a manobra de recrutamento alveolar (MRA). No entanto, o uso dessas técnicas requer um conhecimento proficiente das curvas e da mecânica pulmonar básica 3,4.
Estudantes, residentes e profissionais médicos sentem-se inseguros quanto ao manejo da VM, desde o acionamento do ventilador e ajustes iniciais até a monitorização do platô e da pressão de condução, e essa insegurança está associada à falta de conhecimento e treinamento prévio adequado 7,8,9,10. Observamos que os profissionais que participaram das simulações e utilizaram um modelo de pulmão relataram maior confiança, compreensão dos parâmetros e compreensão dos componentes da mecânica pulmonar 8,11,12.
Modelos para estudo e treinamento da VM com pulmões-teste, fole e pistões podem simular diferentes pressões e volumes, bem como diferentes condições de mecânica pulmonar 13,14,15. Modelos computacionais e de software também contribuem para o estudo da interação cardiopulmonar ao gerar simulações que podem ser utilizadas para ensinar os princípios da VM11 aos profissionais de saúde16,17.
Enquanto modelos computacionais podem apresentar dificuldades para representar a histerese pulmonar16, modelos com pulmão-teste e fole 13,14,15 podem produzir curvas pressão-volume semelhantes à curva fisiológica e demonstrar dinâmica pulmonar. Como vantagem, o pulmão suíno ex vivo apresenta anatomia semelhante à do ser humano18, produzindo também curvas de VM, histerese pulmonar e fornecendo feedback visual dos pulmões dentro da caixa de acrílico durante a análise da mecânica pulmonar. Os modelos visuais são importantes e podem ajudar a entender componentes e conceitos difíceis de imaginar. Assim, modelos pulmonares ex vivo representam uma forma prática de ensino.
Estudos com pulmões suínos ex vivo, como VM com pressão positiva e negativa 19,20,21, análise da distribuição de aerossóis 22,23, simulações pediátricas24 e perfusão pulmonar25 podem melhorar o conhecimento sobre VM. Estudos recentes analisando modelos de pressão positiva e negativa têm demonstrado que a ventilação com pressão positiva pode levar a recrutamento abrupto com maior deformação local, maior distensão, diferenças na curva de histerese e possíveis lesões teciduais em relação à pressão negativa 19,20,21. No entanto, modelos de pressão positiva são necessários, pois os pacientes estão sob pressão positiva durante a VM 19,20,21. O desenvolvimento de um modelo pulmonar para estudos pré-clínicos abre possibilidades para novas pesquisas e aplicações, incluindo ensino e treinamento em VM.
Aqui, apresentamos um modelo de pulmão suíno ex vivo para fins de estudo e treinamento. Nosso objetivo primário é descrever as etapas para a geração deste modelo de pulmão suíno ex vivo sob VM com pressão positiva. Ele pode ser usado no futuro para estudar e ensinar mecânica pulmonar.
Protocolo
O protocolo foi aprovado pelo Comitê de Ética em Pesquisa Animal de nossa Instituição (protocolo nº 1610/2021).
1. Anestesia e preparo dos animais
- Inicialmente, coloque o animal em uma balança e verifique o peso para ajustar as medicações e sedação necessárias para o procedimento.
- Administrar cetamina 5 mg/kg e midazolam 0,25 mg/kg por via intramuscular.
- Puncionar a veia marginal da orelha com cateter venoso 20G e administrar propofol (5 mg/kg) por via venosa para indução anestésica.
- Administrar 3 mL de heparina por via intravenosa no acesso à veia marginal da orelha para auxiliar na extração e perfusão cardiopulmonar.
- Após a anestesia, realizar intubação orotraqueal com cânula orotraqueal (COT) de 6,5 mm e fixar o IOT com fita adesiva, deixando-o firmemente fixado para evitar deslocamento durante o procedimento.
NOTA: A profundidade da sedação é verificada monitorando-se parâmetros hemodinâmicos e com analisador de gases, como pressão arterial média, frequência cardíaca e concentração inspirada/expirada de isoflurano.
2. Ventilação mecânica no intraoperatório
- Conectar o animal via OTC à VM, mantendo a sedação com isoflurano a 1,5% a 50% da fração inspirada de oxigênio (FiO2) e fentanil em bolus de 10 mcg/kg + infusão contínua de 10 mcg/kg/h.
- Toque na tela do ventilador mecânico e selecione o modo de ventilação controlada por volume (VCV), selecione o botão de volume corrente (TV) e gire a roda de rolagem até que o valor do volume corrente corresponda a 8 mL/kg.
- Toque na tela do ventilador mecânico. Selecione o FiO2 e gire a roda de rolagem até que o valor de 50% seja atingido.
- Toque na tela do ventilador mecânico e selecione a frequência respiratória (FR). Gire a roda até atingir o valor ideal para manter um CO2 expirado final de 35-45 mmHg medido por capnografia acoplada ao ventilador mecânico.
NOTA: A profundidade da sedação é verificada monitorando-se parâmetros hemodinâmicos e utilizando-se analisador de gases, como pressão arterial média, frequência cardíaca e concentração inspirada/expirada de isoflurano.
3. Dissecção tecidual e troca OTC
- Faça uma incisão esternal medial de 2 cm acima do manúbrio a 2 cm abaixo do processo xifoide do esterno para acessar a cavidade torácica. Posicione os afastadores de costelas, ampliando o campo de visão durante o procedimento.
- Use um bisturi para fazer uma incisão traqueal horizontal na altura da cartilagem cricóide (apenas nos primeiros anéis traqueais) larga o suficiente para introduzir uma nova cânula traqueal.
- Desinsuflar o manguito OTC que está dentro da via aérea e puxe lentamente para removê-lo. Enquanto isso, insira o novo OTC na incisão feita na traqueia após a remoção do antigo OTC. O vazamento pode ocorrer devido ao manguito desinsuflado, cessando com o reposicionamento do novo OTC.
- Inflar o manguito do tubo traqueal recém-inserido conectando uma seringa de 20 mL ao balão piloto. A seringa fornece ar sob pressão e infla o balão piloto e o manguito. Assim que o manguito inflar, retire a seringa.
- Amarre a nova cânula traqueal diretamente à traqueia com poliéster 2-0 para evitar vazamento e movimento enquanto coloca o pulmão na caixa de ventilação de plexiglass.
- Com o bisturi, disseque os tecidos para remover os órgãos cardiopulmonares do tórax.
4. Eutanásia animal
- Aumentar a concentração de isoflurano para 5% e administrar 10 mL de cloreto de potássio a 19,1%. Posteriormente, verificar a ausência de sinais vitais.
NOTA: Este procedimento foi realizado de acordo com o National Institutes of Health Guide for the Care and Use of Laboratory Animals.
5. Extração cardiopulmonar
- Após a eutanásia, dissecar o ligamento respiratório para remover os pulmões.
- Após a dissecção tecidual, pinçar o COT com a pinça Kelly apropriada durante o final da inspiração, mantendo os pulmões insuflados.
- Desconecte o OTC do ventilador mecânico, mas mantenha-o fixado.
- Seccionar a artéria aórtica, posicionar o aspirador dentro da cavidade torácica para remover o sangue extravasado, manter a visualização da cavidade ao término das dissecções e liberar os órgãos a serem retirados da cavidade torácica.
NOTA: O ligamento pulmonar inferior deve ser cuidadosamente liberado para evitar laceração pulmonar. - Retire o coração e o pulmão da caixa torácica com o OTC fixado, sem separá-los, e coloque-os em uma bandeja.
6. Preparo cardiopulmonar
- Com o pulmão em uma bandeja, canular a artéria pulmonar com um cateter de lúmen único de grande calibre e conectá-la ao conjunto de infusão para administrar continuamente 2.000 mL de solução salina a 0,9% gelada (SS) ou até que o líquido claro flua da aorta.
NOTA: SS deve ser administrado a uma taxa normal, evitar espremer a bolsa intravenosa (IV). - Após a desobstrução do fluxo, sutura da artéria aórtica com poliéster 2-0 e administração de mais 100 mL de SF a 0,9%.
- Desaperte o OTC, observe que os pulmões irão desinchar e permanecer fechados, prontos para receber a VM e a MRA.
7. MV dentro de uma caixa de acrílico
- Após o preparo, abra a caixa de acrílico e posicione os pulmões verticalmente dentro da caixa. Passe o OTC pelo orifício da tampa e conecte a cânula traqueal ao ventilador mecânico.
NOTA: Certifique-se de que a cânula traqueal está firmemente presa na traqueia. - Selecione o botão Iniciar ventilação .
- Toque na tela do ventilador mecânico e selecione o ventilador mecânico para VCV.
- Toque na tela de configurações do modo VCV e selecione o botão da TV , gire a roda até atingir o valor de 6 mL/kg. Faça o mesmo para ajustar a PEEP para 5 cm H2O, FiO2 para 21%, FR para 15 incursões por minuto e tempo de pausa inspiratória para 10%.
8. BRAÇO
- Para iniciar o recrutamento, aumente a PEEP de 5 cm H2O para 6 cm H2O e, em seguida, aumente-a em incrementos passo a passo de 2 cm H2O até atingir 14 cm H2O.A PEEP é aumentada usando o botão na tela abaixo do valor de PEEP exibido na tela. Gire a roda para aumentar o valor.
- Para cada PEEP, anote os valores de pressão de pico, pressão de platô, complacência dinâmica e resistência de vias aéreas exibidos na tela do ventilador mecânico. Anote a pressão motriz, que é o valor da pressão de platô menos o valor da PEEP ajustado naquele momento.
- Depois de atingir 14 cm H2O, reduza a PEEP em decrementos passo a passo de 2 cm H2O até atingir 6 cm H2O, em seguida, reduza-a para 5 cm H2O. A PEEP é reduzida usando o botão na tela abaixo do valor de PEEP exibido na tela. Gire a roda para diminuir o valor.
- Para cada PEEP, anote os valores de pressão de pico, pressão de platô, complacência dinâmica e resistência de vias aéreas exibidos na tela do ventilador mecânico. Anote a pressão motriz, que é o valor da pressão de platô menos o valor da PEEP ajustado naquele momento.
NOTA: Mantenha cada valor de PEEP por 10 min durante o incremento e por 5 min em cada passo durante o decremento.
- Para cada PEEP, anote os valores de pressão de pico, pressão de platô, complacência dinâmica e resistência de vias aéreas exibidos na tela do ventilador mecânico. Anote a pressão motriz, que é o valor da pressão de platô menos o valor da PEEP ajustado naquele momento.
9. Manutenção cardiopulmonar
- Ao final da fase de recrutamento, pinçar suavemente a cânula traqueal com a pinça durante a inspiração, mantendo os pulmões inflados. Abra a caixa de acrílico.
- Retire os pulmões da caixa de acrílico e coloque-os cuidadosamente em um recipiente de vidro.
NOTA: Certifique-se de que a cânula traqueal está firmemente presa na traqueia. - Despejar 500 mL de SF a 0,9%.
- Conservar no frigorífico num recipiente de vidro embrulhado em plástico a uma temperatura de 2 a 8 °C durante 24 horas.
- Repita as etapas 7, 8 e 9 por cinco dias consecutivos.

Figura 1: Fluxograma do estudo. Clique aqui para ver uma versão maior desta figura.
Resultados
Foram utilizadas cinco fêmeas de suínos pesando entre 23,4-26,9 kg e seguindo o protocolo descrito para extração cardiopulmonar e análise da mecânica pulmonar. Nossa intenção é que o modelo seja útil para o estudo da mecânica pulmonar, analisando as variáveis de pico pressórico, pressão de platô, resistência, pressão motriz e complacência dinâmica coletadas diretamente da tela do ventilador mecânico. O fluxograma do modelo é mostrado na Figura 1.
Os pulmões foram analisados por cinco dias consecutivos, repetindo-se todo o processo descrito nos itens 7.2, 8.1, 8.2, 9.1, 9.2 e 9.3 do protocolo. Procurou-se mostrar como as variáveis pulmonares se comportavam pré e pós-recrutamento e verificar a durabilidade do modelo pulmonar ex vivo no período estabelecido.
Foram observadas diferenças significativas (p < 0,05) para todas as variáveis entre os momentos pré e pós-MRA. A pressão de pico, a pressão de platô (Figura 2) e a pressão de condução (Figura 3) diminuíram após a manobra (p = 0,0005), enquanto a complacência dinâmica (p = 0,0007) aumentou (Figura 4), demonstrando alvéolos abertos colapsados e ganho de área pulmonar. A resistência (Figura 5) também aumentou após o recrutamento (p = 0,0348). Nenhuma das variáveis foi influenciada significativamente pelo dia.
Com base nesses resultados, mostramos que o modelo é eficaz em demonstrar alterações visuais da mecânica pulmonar através da MRA (Figura 6) e no estudo e ensino da mecânica pulmonar (Figura 7). Além disso, mostramos que o modelo pode ser utilizado por pelo menos cinco dias consecutivos. Como não avaliamos o modelo além desse período, não podemos confirmar a durabilidade final do modelo pulmonar.

Figura 2: Pressões. (A) Pico de pressão. A Ppico pré-MRA variou de 21 ± 3,2 a 23 ± 2,3 cmH2O, enquanto a Ppico pós-MRA variou entre 9 ± 0,6 e 12,6 ± 1,4 cmH2O nos cinco pulmões. A análise estatística ANOVA two-way foi utilizada para calcular o p-valor de 0,0005, que foi considerado significativo. (B) Pressão de platô. O Pplatô pré-MRA variou de 21 ± 3,2 a 22 ± 2,3 cmH2O, enquanto o Pplatô pós-MRA variou entre 8,8 ± 0,4 e 11,6 ± 1,6 cmH2O nos cinco pulmões. A análise estatística ANOVA two-way foi utilizada para calcular o p-valor de 0,0005, que foi considerado significativo. Clique aqui para ver uma versão maior desta figura.
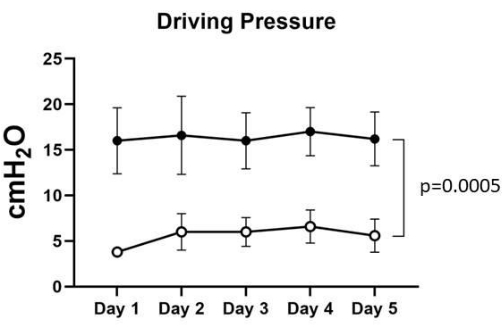
Figura 3: Pressão motriz. A pressão de condução pré-MRA variou de 16 ± 3,2 a 17 ± 2,3 cmH2O, enquanto a pressão de condução pós-MRA variou entre 3,8 ± 0,4 e 6,6 ± 1,6 cmH2O nos cinco pulmões. A análise estatística ANOVA two-way foi utilizada para calcular o p-valor de 0,0005, que foi considerado significativo. Clique aqui para ver uma versão maior desta figura.

Figura 4: Conformidade dinâmica. A complacência dinâmica pré-MRA variou de 9,1 ± 1,2 a 10,2 ± 2,6 mL/cmH2O, enquanto a complacência dinâmica pós-MRA variou entre 23,6 ± 3,5 e 43,8 ± 11,3 mL/cmH2O nos cinco pulmões. A análise estatística ANOVA two-way foi utilizada para calcular o p-valor de 0,0007, que foi considerado significativo. Clique aqui para ver uma versão maior desta figura.
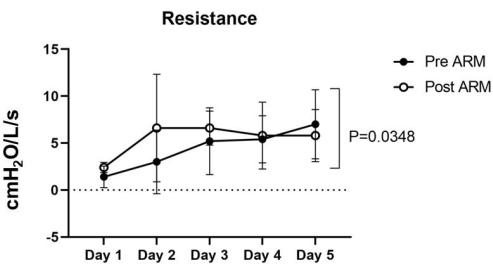
Figura 5: Resistência. A Resistência pré-MRA variou de 1,4 ± 1,0 a 7 ± 3,2 cmH2O/L/seg, enquanto a Resistência pós-MRA variou entre 2,4 ± 0,4 e 6,6 ± 5,1 cmH2O/L/seg nos cinco pulmões. A análise estatística ANOVA two-way foi utilizada para calcular o p-valor de 0,0348, considerado significativo. Clique aqui para ver uma versão maior desta figura.
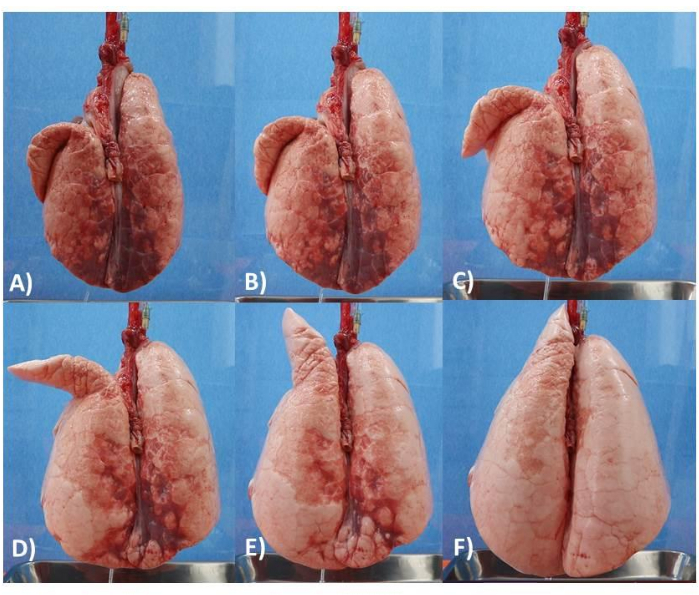
Figura 6: Modelo pulmonar. (A) Pulmão com PEEP de 5 cm. (B) Pulmão com PEEP de 6 cm. (C) Pulmão com PEEP de 8 cm. (D) Pulmão com PEEP de 10 cm. (E) Pulmão com PEEP de 12 cm. (F) Pulmão com PEEP de 14 cm. Clique aqui para ver uma versão maior desta figura.
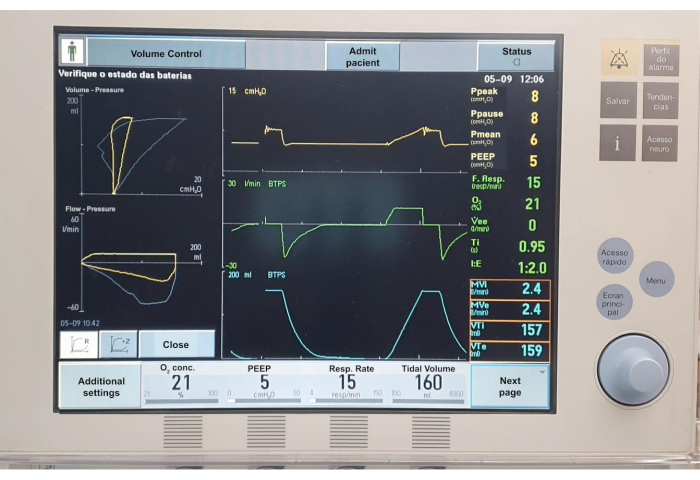
Gráfico 7. Gráficos de ventilação mecânica. Clique aqui para ver uma versão maior desta figura.
Discussão
O protocolo descrito é útil para produzir um modelo de pulmão suíno ex vivo sob VM com pressão positiva. Pode ser usado para estudar e ensinar mecânica pulmonar através do feedback visual dos pulmões durante o recrutamento e análise das curvas e valores projetados na tela do dispositivo. Para esse resultado, estudos piloto são necessários para entender o comportamento dos pulmões fora da caixa torácica e identificar a necessidade de adaptações.
Identificamos que o ponto crítico foi a formação de bolhas, fístulas e lesões na pleura que foram visualizadas ao conectar o ventilador mecânico, com diferença entre VC inspirado e expirado e mudanças na curva de volume. Assim, uma das primeiras modificações no protocolo foi a utilização de uma ampla abertura cirúrgica do tórax, com incisão diafragmática no início do procedimento durante a dissecção dos órgãos cardiopulmonares, o que pode melhorar a visualização das estruturas e auxiliar na liberação cuidadosa do ligamento pulmonar inferior, mantendo a integridade pulmonar. Além disso, a insuflação manual dos pulmões do piloto após a dissecação das estruturas mostrou que essa insuflação excede os limites pressóricos e contribui para a formação de bolhas e fístulas. Alguns estudos utilizando pulmões ex vivo apresentaram a possibilidade do uso de cola de fibrina para vazamentos, com resultados positivos; Embora não tenhamos utilizado essa abordagem no estudo, ela poderia ser uma alternativa para melhorar o modelo26,27. Outro ponto relevante é que os pulmões foram retirados e completamente desinsuflados no estudo piloto, mantendo-os totalmente colapsados desde o preparo do órgão até o início da VM, o que dificultou a abertura dos pulmões para VM e aumentou a possibilidade de formação de fístula. Assim, passamos a pinçar o COT e manter os pulmões insuflados durante a dissecção até a administração de SS. Em seguida, o COT foi liberado, desinsuflado e conectado os pulmões ao ventilador mecânico para iniciar a MRA, e uma análise da mecânica pulmonar foi realizada para demonstrar a curva de histerese pulmonar. Isso não comprometeu o recrutamento pulmonar ou a análise da mecânica pulmonar, pois pacientes anestesiados apresentam atelectasias e complacência pulmonar reduzidas mesmo durante a VM 28,29,30,31.
No estudo piloto, foi utilizada uma PEEP inicial de 5 cm H2O e aumentada em incrementos de 5 cm H2O até 25 cm H2O32,33. Entretanto, as pressões de pico e platô atingiram valores superiores a 40 e 30 cm H2O, respectivamente, com a formação de fístula. Assim, um aumento gradual nos incrementos de 2 cm H2O foi realizado para melhor analisar o comportamento das pressões ao longo do tempo e entender os limites de PEEP em nosso modelo pulmonar ex vivo. Não houve diferença na mortalidade entre a insuflação sustentada e a incremental, mas a insuflação incremental é a mais utilizada e pode facilitar a análise passo a passo da mecânica pulmonar34. Quanto ao uso da pressãonegativa20,21, o modelo foi testado apenas sob pressão positiva, pois os pacientes em VM estão sujeitos à pressão positiva. Não descartamos o uso de pressão negativa no futuro, mas isso exigiria trocas de caixa de acrílico.
A literatura apresenta alguns modelos produzidos com pulmão-teste, pistões e modelo ex vivo 13,14 que foram colocados em caixas hermeticamente fechadas que simulavam a caixa torácica. Nosso modelo foi colocado em uma caixa de acrílico convencional, que, apesar de reduzir a possibilidade de aplicação de pressão negativa, pode facilitar a produção do modelo. Outro modelo produzido para estudospré-clínicos18 é semelhante ao nosso, porém os pulmões foram posicionados horizontalmente enquanto os nossos foram mantidos verticalmente, recebendo a ação da gravidade sem o apoio dos órgãos e da caixa torácica. Esses pulmões foram utilizados durante experimentos dentro de 48 horas após a eutanásia 18,19,20,21,35. Nosso modelo foi utilizado por um total de 120 h, sendo mantido a uma temperatura de 2-8 °C durante as 24 h do experimento, mostrando os resultados positivos descritos na seção de resultados representativos.
A lacuna no ensino e treinamento não foi abordada neste primeiro momento, mas o modelo é efetivo para analisar a mecânica pulmonar e pode ser utilizado como ferramenta de pesquisa e ensino. Além disso, não pretendemos estudar soluções de perfusão, mas da mesma forma que infundimos SS na etapa 6.1, soluções de perfusão e preservação podem ser utilizadas, abrindo novas possibilidades para estudos com o mesmo modelo apresentado.
Essa técnica tem algumas limitações: 1) conhecimento da anatomia animal para garantir que os pulmões sejam removidos adequadamente; 2) o modelo não foi avaliado além de cinco dias; 3) o modelo parece ser apropriado para o ensino da ventilação, mas não foi testado em um contexto de ensino; 4) é um modelo animal, por isso é importante considerar suas limitações de aplicabilidade em humanos.
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
Agradecemos a todos os colegas e profissionais que contribuíram e apoiaram a construção deste protocolo de modelo de pulmão suíno ex vivo .
Este estudo não teve fontes de financiamento.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.9% Saline solution | 2500ml | ||
| Anesthesia machine - Primus | Drager | REF 8603800-18 | Anesthesia work station used in the procedure |
| Aspirator | For blood aspiration from thorax | ||
| Bedside Monitor - Life Scope | Nihon Kohden | BSM-7363 | Multiparameter monitor used during the procedure |
| Bonney Tissue Forceps | Any tissue forceps is suitable | ||
| Disposable scalper, #23 | Any scalper is suitable | ||
| Disposable syringe needles, 18G x 1 1/2", 23G x 1" | BD | 302814 | Widely available |
| Disposable syringes, 10ml | Widely available | ||
| Electrosurgical unit - SS-501 | WEM | For cutting and coagulation during thorax incision | |
| Fentanyl | 10 mcg/kg bolus + 10 mcg/kg/hour continuous infusion | ||
| Finochietto retractor | Any finochietto retractor is suitable | ||
| heparin | 3ml | ||
| Infusion set | Any infusion set is suitable | ||
| Isoflurane | 1.5% | ||
| Kelly Forceps Curved | Any kelly forceps is suitable | ||
| Ketamine | 5mg/kg | ||
| Lactated Ringer solution | 500ml | ||
| Mechanical ventilator - Servo I | Maquet | REF 6449701 | Mechanical ventilator used in the procedure |
| Metzenbaum Scissor (Straight and curved) | Any metzenbaum scissor is suitable | ||
| Midazolam | 0.25mg/kg | ||
| Orotracheal intubation cannula, #6.5 | Rusch | 112282 | Widely available |
| Plexiglass | Custom made plexiglass box: 30x45x60cm | ||
| Polyester suture, 2-0 | Widely available | ||
| Potassium choride | 10 ml, 19.1% potassium chloride. | ||
| propofol | 5mg/kg | ||
| Three way stopcock | Widely available | ||
| Venous catheter, G20 x 1" | BD | 38183314 | Widely available |
Referências
- Roberto, C., Carvalho, R., Toufen Jr, C., Franca, S. A. Mechanical Ventilation: Principles, graphic analysis and ventilation modalities. Jornal Brasileiro de Pneumologia. 33 (2), 54-55 (2007).
- Barbas, C. S. V., et al. Brazilian recommendations for mechanical ventilation 2013. Part I. Revista Brasileira de Terapia Intensiva. 26 (2), 89-121 (2014).
- Walter, J. M., Corbridge, T. C., Singer, B. D. Invasive mechanical ventilation. Southern Medical Journal. 111 (12), 746-753 (2018).
- Faustino, E. A. Concepts and monitoring of pulmonary mechanics in patients under ventilatory support in the intensive care unit. Revista Brasileira de Terapia Intensiva. 19 (2), 161-169 (2007).
- Holanda, M. A., Vasconcelos, R. S., Ferreira, J. C., Pinheiro, B. V. Patient-ventilator asynchrony. Jornal Brasileiro de Pneumologia. 44 (2), 321-333 (2018).
- Rezoagli, E., Laffey, J. G., Bellani, G. Monitoring lung injury severity and ventilation intensity during mechanical ventilation. Seminars in Respiratory and Critical Care Medicine. 43 (3), 346-368 (2022).
- Tallo, F. S. Evaluation of self-perception of mechanical ventilation knowledge among Brazilian final-year medical students, residents, and emergency physicians. Clinics. 72 (2), 65-70 (2017).
- Schroedl, C. J., et al. Impact of simulation-based mastery learning on resident skill managing mechanical ventilators. American Thoracic Society Scholar. 2 (1), 34-48 (2021).
- Wilcox, S. R., et al. Academic emergency medicine physicians' knowledge of mechanical ventilation. The Western Journal of Emergency Medicine. 17 (3), 271-279 (2016).
- Cox, C. E., et al. Effectiveness of medical resident education in mechanical ventilation. American Journal of Respiratory and Critical Care Medicine. 167 (1), 32-38 (2003).
- Keegan, R., Henderson, T., Brown, G. Use of the virtual ventilator, a screen-based computer simulation, to teach the principles of mechanical ventilation. Journal of Veterinary Medical Education. 36 (4), 436-443 (2009).
- Spadaro, S., et al. Simulation training for residents focused on mechanical ventilation: A randomized trial using mannequin-based versus computer-based simulation. Simulation in Healthcare. 12 (6), 349-355 (2017).
- Chase, J. G., Yuta, T., Mulligan, K. J., Shaw, G. M., Horn, B. A novel mechanical lung model of pulmonary diseases to assist with teaching and training. BMC Pulmonary Medicine. 6 (21), 1-11 (2006).
- Kuebler, W. M., Mertens, M., Pries, A. R. A two-component simulation model to teach respiratory mechanics. Advances in Physiology Education. 31 (2), 218-222 (2007).
- Heili-Frades, S., Peces-Barba, G., Rodríguez-Nieto, M. J. Design of a lung simulator for learning lung mechanics in mechanical ventilation. Archivos de Bronconeumología. 43 (12), 674-679 (2007).
- Ngo, C., Dahlmanns, S., Vollmer, T., Misgeld, B., Leonhardt, S. An object-oriented computational model to study cardiopulmonary hemodynamic interactions in humans. Computer Methods and Programs in Biomedicine. 159, 167-183 (2018).
- Lazzari, C. D., Genuini, I., Pisanelli, D. M., D'Ambrosi, A., Fedele, F. Interactive simulator for e-Learning environments: a teaching software for health care professionals. Biomedical Engineering Online. 13 (172), 1-18 (2014).
- Perinel, S., et al. Development of an ex vivo human-porcine respiratory model for preclinical studies. Scientific Reports. 7, 1-6 (2017).
- Aboelnazar, N. S., et al. Negative pressure ventilation decreases inflammation and lung edema during normothermic ex-vivo lung perfusion. The Journal of Heart and Lung Transplantation. 37 (4), 520-530 (2018).
- Sattari, S., et al. Introducing a custom-designed volume-pressure machine for novel measurements of whole lung organ viscoelasticity and direct comparisons between positive- and negative-pressure ventilation. Frontiers in Bioengineering and Biotechnology. 8, 1-12 (2020).
- Sattari, S., et al. Positive- and negative-pressure ventilation characterized by local and global pulmonary mechanics. American Journal of Respiratory and Critical Care Medicine. 207 (5), 577-586 (2023).
- Montigaud, Y., et al. Development of an ex vivo preclinical respiratory model of idiopathic pulmonary fibrosis for aerosol regional studies. Scientific Reports. 9 (1), 17949 (2019).
- Montigaud, Y., et al. Aerosol delivery during invasive mechanical ventilation: development of a preclinical ex vivo respiratory model for aerosol regional deposition. Scientific Reports. 9 (1), 17930 (2019).
- Montigaud, Y., et al. Development of an ex vivo respiratory pediatric model of bronchopulmonary dysplasia for aerosol deposition studies. Scientific Reports. 9 (1), 5720 (2019).
- Buchko, M. T., et al. A low-cost perfusate alternative for ex vivo. lung perfusion. transplantation proceedings. 52 (10), 2941-2946 (2020).
- Kondo, N. Development of an effective method utilizing fibrin glue to repair pleural defects in an ex-vivo pig model. Journal of Cardiothoracic Surgery. 15 (1), 110 (2020).
- Gasek, N., et al. Development of alginate and gelatin-based pleural and tracheal sealants. Acta Biomaterialia. 131, 222-235 (2021).
- Li, X., et al. Effects of individualized positive end-expiratory pressure combined with recruitment maneuver on intraoperative ventilation during abdominal surgery: a systematic review and network meta-analysis of randomized controlled trials. Journal of Anesthesia. 36 (2), 303-315 (2022).
- Hu, M. C., Yang, Y. L., Chen, T. T., Lee, C. I., Tam, K. W. T. Recruitment maneuvers to reduce pulmonary atelectasis after cardiac surgery: A meta-analysis of randomized trials. The Journal of Thoracic and Cardiovascular Surgery. 164 (1), 171-181 (2020).
- Hu, M. C., et al. Recruitment maneuvers in patients undergoing thoracic surgery: a meta-analysis. General Thoracic and Cardiovascular Surgery. 69 (12), 1553-1559 (2021).
- Zeng, C., Lagier, D., Lee, J. W., Melo, M. F. V. Perioperative pulmonary atelectasis: Part I. Biology and mechanisms. Anesthesiology. 136 (1), 181-205 (2022).
- Niman, E., et al. Lung recruitment after cardiac arrest during procurement of atelectatic donor lungs is a protective measure in lung transplantation. Journal of Thoracic Disease. 14 (8), 2802-2811 (2022).
- Calvo, R. N., et al. Comparison of the efficacy of two alveolar recruitment maneuvers in improving the lung mechanics and the degree of atelectasis in anesthetized healthy sheep. Research in Veterinary Science. 150 (5), 164-169 (2022).
- Pensier, J., et al. Effect of lung recruitment maneuver on oxygenation, physiological parameters and mortality in acute respiratory distress syndrome patients: a systematic review and meta-analysis. Intensive Care Medicine. 45 (12), 1691-1702 (2019).
- Mariano, C. A., Sattari, S., Quiros, K. A. M., Nelson, T. M., Eskandari, M. Examining lung mechanical strains as influenced by breathing volumes and rates using experimental digital image correlation. Respiratory Research. 23 (1), 92 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados