Method Article
Ex Vivo Modèle expérimental porcin pour l’étude et l’enseignement de la mécanique pulmonaire
Dans cet article
Résumé
Nous présentons un modèle ex vivo de poumon de porc pour la démonstration de la mécanique pulmonaire et des manœuvres de recrutement alvéolaire à des fins pédagogiques. Les poumons peuvent être utilisés pendant plus d’une journée (jusqu’à cinq jours) avec des changements minimes dans les variables de la mécanique pulmonaire.
Résumé
La ventilation mécanique est largement utilisée et nécessite des connaissances spécifiques pour sa compréhension et sa gestion. Les professionnels de la santé dans ce domaine peuvent se sentir en insécurité et manquer de connaissances en raison d’une formation et de méthodes d’enseignement inadéquates. Par conséquent, l’objectif de cet article est de décrire les étapes impliquées dans la génération d’un modèle de poumon porcin ex vivo qui sera utilisé à l’avenir, pour étudier et enseigner la mécanique pulmonaire. Pour générer le modèle, cinq poumons porcins ont été soigneusement retirés du thorax en suivant les directives du Comité d’éthique de la recherche animale avec les soins adéquats et ont été connectés au ventilateur mécanique par une canule trachéale. Ces poumons ont ensuite été soumis à la manœuvre de recrutement alvéolaire. Les paramètres de la mécanique respiratoire ont été enregistrés, et des caméras vidéo ont été utilisées pour obtenir des vidéos des poumons au cours de ce processus. Ce processus a été répété pendant cinq jours consécutifs. Lorsqu’ils n’étaient pas utilisés, les poumons étaient conservés au réfrigérateur. Le modèle a montré une mécanique pulmonaire différente après la manœuvre de recrutement alvéolaire chaque jour ; n’étant pas influencé par les jours, seulement par la manœuvre. Par conséquent, nous concluons que le modèle pulmonaire ex vivo peut fournir une meilleure compréhension de la mécanique pulmonaire et de ses effets, et même de la manœuvre de recrutement alvéolaire par rétroaction visuelle à toutes les étapes du processus.
Introduction
La ventilation mécanique (MT) est largement utilisée dans les unités de soins intensifs (USI) et les centres chirurgicaux. Sa surveillance est essentielle pour aider à reconnaître les asynchronies et à prévenir les blessures pour tous les patients, en particulier lorsque le patient présente des lésions pulmonaires graves 1,2,3,4,5,6. La surveillance de la mécanique respiratoire peut également contribuer à la compréhension clinique de la progression de la maladie et aux applications thérapeutiques, telles que l’utilisation de la pression expiratoire positive (PEEP) ou de la manœuvre de recrutement alvéolaire (ARM). Cependant, l’utilisation de ces techniques nécessite une compréhension approfondie des courbes et de la mécanique pulmonaire de base 3,4.
Les étudiants, les résidents et les professionnels de la santé ne se sentent pas en sécurité à l’égard de la gestion des MV, de la mise en marche du ventilateur et des ajustements initiaux à la surveillance du plateau et des pressions de conduite, et cette insécurité est associée à un manque de connaissances et à une formation préalable adéquate 7,8,9,10. Nous avons observé que les professionnels qui ont participé à des simulations et utilisé un modèle pulmonaire ont fait état d’une plus grande confiance, d’une meilleure compréhension des paramètres et d’une meilleure compréhension des composantes de la mécanique pulmonaire 8,11,12.
Les modèles d’étude et d’entraînement de la MV avec des poumons d’essai, des soufflets et des pistons peuvent simuler différentes pressions et volumes, ainsi que différentes conditions de mécanique pulmonaire 13,14,15. Les modèles computationnels et logiciels contribuent également à l’étude de l’interaction cardiopulmonaire en générant des simulations qui peuvent être utilisées pour enseigner les principes de MV11 aux professionnels de la santé16,17.
Alors que les modèles informatiques peuvent présenter des difficultés à représenter l’hystérésis pulmonaire16, les modèles avec poumon d’essai et soufflet 13,14,15 peuvent produire des courbes pression-volume similaires à la courbe physiologique et démontrer la dynamique pulmonaire. Comme avantage, le poumon porcin ex vivo présente une anatomie similaire à celle de l’homme18, produisant également des courbes MV, une hystérésis pulmonaire et fournissant un retour visuel des poumons à l’intérieur de la boîte acrylique lors de l’analyse de la mécanique pulmonaire. Les modèles visuels sont importants et peuvent aider à comprendre des composants et des concepts difficiles à imaginer. Ainsi, les modèles pulmonaires ex vivo représentent une méthode pratique d’enseignement.
Des études sur des poumons porcins ex vivo, tels que ceux sur MV à pression positive et négative 19,20,21, l’analyse de la distribution des aérosols 22,23, des simulations pédiatriques24 et la perfusion pulmonaire25 peuvent améliorer les connaissances sur la MV. Des études récentes analysant des modèles en pression positive et négative ont montré que la ventilation à pression positive peut conduire à un recrutement brutal avec une plus grande déformation locale, une plus grande distension, des différences de courbe d’hystérésis et d’éventuelles lésions tissulaires par rapport à la pression négative 19,20,21. Néanmoins, les modèles à pression positive sont nécessaires car les patients sont sous pression positive pendant la pression MT 19,20,21. Le développement d’un modèle pulmonaire pour les études précliniques ouvre des possibilités pour de nouvelles recherches et applications, y compris l’enseignement et la formation MV.
Nous présentons ici un modèle de poumon porcin ex vivo à des fins d’étude et de formation. Notre objectif principal est de décrire les étapes de la génération de ce modèle de poumon porcin ex vivo sous MV à pression positive. Il peut être utilisé à l’avenir pour étudier et enseigner la mécanique pulmonaire.
Protocole
Le protocole a été approuvé par le Comité d’éthique de la recherche animale de notre institution (protocole n° 1610/2021).
1. Anesthésie et préparation des animaux
- Dans un premier temps, placez l’animal sur une balance et vérifiez son poids pour ajuster les médicaments et la sédation nécessaires à la procédure.
- Administrer 5 mg/kg de kétamine et 0,25 mg/kg de midazolam par voie intramusculaire.
- Ponctionner la veine marginale de l’oreille à l’aide d’un cathéter veineux de 20 G et administrer du propofol par voie intraveineuse (5 mg/kg) pour l’induction de l’anesthésie.
- Administrer 3 mL d’héparine par voie intraveineuse dans l’accès à la veine marginale de l’oreille pour faciliter l’extraction cardiopulmonaire et la perfusion.
- Après l’anesthésie, effectuez une intubation orotrachéale avec une canule orotrachéale (OTC) de 6,5 mm et fixez l’OTC avec du ruban adhésif, en le laissant fermement fixé pour éviter tout déplacement pendant la procédure.
REMARQUE : La profondeur de la sédation est vérifiée en surveillant les paramètres hémodynamiques et en utilisant un analyseur de gaz, tels que la pression artérielle moyenne, la fréquence cardiaque et la concentration d’isoflurane inspirée/expirée.
2. Ventilation mécanique peropératoire
- Connectez l’animal via l’OTC à MV, en maintenant la sédation avec 1,5 % d’isoflurane à 50 % de la fraction inspirée d’oxygène (FiO2) et de fentanyl 10 mcg/kg de bolus + 10 mcg/kg/h de perfusion continue.
- Appuyez sur l’écran du ventilateur mécanique et sélectionnez le mode de ventilation à volume contrôlé (VCV), sélectionnez le bouton de volume courant (TV) et tournez la molette de défilement jusqu’à ce que la valeur du volume courant corresponde à 8 mL/kg.
- Appuyez sur l’écran du ventilateur mécanique. Sélectionnez le FiO2 et tournez la molette de défilement jusqu’à ce que la valeur de 50 % soit atteinte.
- Appuyez sur l’écran du ventilateur mécanique et sélectionnez la fréquence respiratoire (RR). Tournez la roue jusqu’à ce qu’elle atteigne la valeur idéale pour maintenir un CO2 expiré de 35 à 45 mmHg mesuré par capnographie couplée au ventilateur mécanique.
REMARQUE : La profondeur de la sédation est vérifiée en surveillant les paramètres hémodynamiques et en utilisant un analyseur de gaz tels que la pression artérielle moyenne, la fréquence cardiaque et la concentration d’isoflurane inspirée/expirée.
3. Dissection tissulaire et échange en vente libre
- Faites une incision sternale médiale de 2 cm au-dessus du manubrium à 2 cm en dessous de l’apophyse xiphoïde du sternum pour accéder à la cavité thoracique. Positionnez les écarteurs de nervures, en élargissant le champ de vision pendant la procédure.
- Utilisez un scalpel pour faire une incision trachéale horizontale à la hauteur du cartilage cricoïde (juste au niveau des premiers anneaux trachéaux) suffisamment large pour introduire une nouvelle canule trachéale.
- Dégonflez le brassard en vente libre qui se trouve à l’intérieur des voies respiratoires et tirez lentement pour le retirer. Pendant ce temps, insérez le nouvel OTC dans l’incision pratiquée dans la trachée après avoir retiré l’ancien OTC. Des fuites peuvent se produire en raison du brassard dégonflé, cessant lors du repositionnement du nouvel OTC.
- Gonflez le brassard du tube trachéal nouvellement inséré en connectant une seringue de 20 ml au ballon-pilote. La seringue délivre de l’air sous pression et gonfle le ballon pilote et le brassard. Une fois le brassard gonflé, retirez la seringue.
- Attachez la nouvelle canule trachéale directement à la trachée avec du polyester 2-0 pour éviter les fuites et les mouvements tout en plaçant le poumon dans le caisson de ventilation en plexiglas.
- À l’aide du scalpel, disséquez les tissus pour retirer les organes cardiopulmonaires du thorax.
4. Euthanasie animale
- Augmenter la concentration d’isoflurane à 5 % et administrer 10 mL de chlorure de potassium à 19,1 %. Par la suite, vérifiez l’absence de signes vitaux.
REMARQUE : Cette procédure a été effectuée conformément au Guide des National Institutes of Health pour le soin et l’utilisation des animaux de laboratoire.
5. Extraction cardiopulmonaire
- Après l’euthanasie, disséquez le ligament respiratoire pour enlever les poumons.
- Après la dissection tissulaire, serrez l’OTC avec la pince Kelly appropriée pendant la fin de l’inspiration, en gardant les poumons gonflés.
- Débranchez l’OTC du ventilateur mécanique, mais maintenez-le serré.
- Sectionnez l’artère aortique, positionnez l’aspirateur à l’intérieur de la cavité thoracique pour éliminer le sang extravasé, maintenez la visualisation de la cavité tout en terminant les dissections et libérez les organes à retirer de la cavité thoracique.
REMARQUE : Le ligament pulmonaire inférieur doit être relâché avec précaution pour éviter une lacération pulmonaire. - Retirez le cœur et le poumon de la cage thoracique avec l’OTC serré, sans les séparer, et placez-les sur un plateau.
6. Préparation cardio-pulmonaire
- Avec le poumon sur un plateau, canulez l’artère pulmonaire à l’aide d’un cathéter à lumière unique de gros calibre et connectez-le au dispositif de perfusion pour administrer en continu 2 000 mL de solution saline froide à 0,9 % ou jusqu’à ce qu’un liquide clair s’écoule de l’aorte.
REMARQUE : SS doit être administré à un taux normal, évitez de presser la poche intraveineuse (IV). - Après avoir dégagé l’écoulement, suturez l’artère aortique avec du polyester 2-0 et administrez 100 mL supplémentaires de SS à 0,9 %. Fermez la sortie du cathéter à une seule lumière car le liquide restera à l’intérieur jusqu’à la fin de l’expérience.
- Détachez l’OTC, notez que les poumons se dégonfleront et resteront fermés, prêts à recevoir la MV et l’ARM.
7. MV à l’intérieur d’une boîte en acrylique
- Après la préparation, ouvrez la boîte en acrylique et positionnez les poumons verticalement à l’intérieur de la boîte. Passez l’OTC à travers le trou du couvercle et connectez la canule trachéale au ventilateur mécanique.
REMARQUE : Assurez-vous que la canule trachéale est fermement fixée dans la trachée. - Sélectionnez le bouton Démarrer la ventilation .
- Appuyez sur l’écran du ventilateur mécanique et sélectionnez le ventilateur mécanique pour VCV.
- Appuyez sur l’écran des paramètres du mode VCV et sélectionnez le bouton TV , tournez la roue jusqu’à ce qu’elle atteigne la valeur de 6 mL/kg. Faites de même pour ajuster la PEEP à 5 cm H2O, la FiO2 à 21 %, la RR à 15 respirations par minute et le temps de pause inspiratoire à 10 %.
8. BRAS
- Pour commencer le recrutement, augmentez la PEEP de 5 cm H2O à 6 cm H2O, puis augmentez-la par incréments de 2 cm H2O jusqu’à atteindre 14 cm H2O.La PEEP est augmentée à l’aide du bouton à l’écran situé sous la valeur PEEP affichée à l’écran. Tournez la roue pour augmenter la valeur.
- Pour chaque PEEP, notez les valeurs de pression de pointe, de pression de plateau, de conformité dynamique et de résistance des voies respiratoires affichées sur l’écran du ventilateur mécanique. Notez la pression d’entraînement, c’est-à-dire la valeur de la pression de plateau moins la valeur PEEP ajustée à ce moment-là.
- Après avoir atteint 14 cm H2O, réduire la PEEP par décréments progressifs de 2 cm H2O jusqu’à atteindre 6 cm H2O, puis la réduire à 5 cm H2O. La PEEP est réduite à l’aide du bouton à l’écran situé sous la valeur de la PEEP affichée à l’écran. Tournez la molette pour diminuer la valeur.
- Pour chaque PEEP, notez les valeurs de pression de pointe, de pression de plateau, de conformité dynamique et de résistance des voies respiratoires affichées sur l’écran du ventilateur mécanique. Notez la pression d’entraînement, c’est-à-dire la valeur de la pression de plateau moins la valeur PEEP ajustée à ce moment-là.
REMARQUE : Maintenez chaque valeur PEEP pendant 10 min pendant l’incrément et pendant 5 min à chaque étape pendant le décrémentage.
- Pour chaque PEEP, notez les valeurs de pression de pointe, de pression de plateau, de conformité dynamique et de résistance des voies respiratoires affichées sur l’écran du ventilateur mécanique. Notez la pression d’entraînement, c’est-à-dire la valeur de la pression de plateau moins la valeur PEEP ajustée à ce moment-là.
9. Entretien cardio-pulmonaire
- À la fin de l’étape de recrutement, serrez doucement la canule trachéale avec la pince pendant l’inspiration, en gardant les poumons gonflés. Ouvrez la boîte en acrylique.
- Retirez les poumons de la boîte en acrylique et placez-les soigneusement dans un récipient en verre.
REMARQUE : Assurez-vous que la canule trachéale est fermement fixée dans la trachée. - Verser 500 mL de 0,9 % d’acier inoxydable.
- Conservez-le au réfrigérateur dans un récipient en verre emballé dans du plastique à une température de 2 à 8 °C pendant 24 h.
- Répétez les étapes 7, 8 et 9 pendant cinq jours consécutifs.

Figure 1 : Organigramme de l’étude. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
Nous avons utilisé cinq porcs femelles pesant entre 23,4 et 26,9 kg et avons suivi le protocole décrit pour l’extraction cardiopulmonaire et l’analyse de la mécanique pulmonaire. Notre intention est que le modèle soit utile pour l’étude de la mécanique pulmonaire en analysant la pression de pointe, la pression de plateau, la résistance, la pression d’entraînement et les variables de conformité dynamique collectées directement à partir de l’écran du ventilateur mécanique. L’organigramme du modèle est illustré à la figure 1.
Les poumons ont été analysés pendant cinq jours consécutifs, en répétant l’ensemble du processus décrit aux points 7.2, 8.1, 8.2, 9.1, 9.2 et 9.3 du protocole. Nous avons essayé de montrer comment les variables pulmonaires se comportaient avant et après le recrutement et de vérifier la durabilité du modèle pulmonaire ex vivo dans la période établie.
Des différences significatives (p < 0,05) ont été observées pour toutes les variables entre la période pré- et la période post-ARM. La pression de pointe, la pression de plateau (figure 2) et la pression d’entraînement (figure 3) ont diminué après la manœuvre (p = 0,0005), tandis que la compliance dynamique (p = 0,0007) a augmenté (figure 4), ce qui montre un gain d’alvéoles et de poumons affaissés. La résistance (figure 5) a également augmenté après le recrutement (p = 0,0348). Aucune des variables n’a été influencée de manière significative par la journée.
Sur la base de ces résultats, nous avons montré que le modèle est efficace pour démontrer les changements de la mécanique pulmonaire visuelle à travers l’ARM (Figure 6) et pour étudier et enseigner la mécanique pulmonaire (Figure 7). De plus, nous avons montré que le modèle peut être utilisé pendant au moins cinq jours consécutifs. Comme nous n’avons pas évalué le modèle au-delà de cette période, nous ne pouvons pas confirmer la durabilité finale du modèle pulmonaire.

Figure 2 : Pressions. (A) Pression de pointe. Le pic de croissance avant l’ARM variait de 21 ± 3,2 à 23 ± 2,3 cmH2O, tandis que le pic post-ARM variait entre 9 ± 0,6 et 12,6 ± 1,4 cmH2O dans les cinq poumons. L’analyse statistique de l’ANOVA à deux facteurs a été utilisée pour calculer la valeur de p de 0,0005, qui a été considérée comme significative. (B) Pression de plateau. Le plateau pré-ARM variait de 21 ± 3,2 à 22 ± 2,3 cmH2O, tandis que le Pplateau post-ARM variait entre 8,8 ± 0,4 et 11,6 ± 1,6 cmH2O dans les cinq poumons. L’analyse statistique de l’ANOVA à deux facteurs a été utilisée pour calculer la valeur de p de 0,0005, qui a été considérée comme significative. Veuillez cliquer ici pour voir une version agrandie de cette figure.
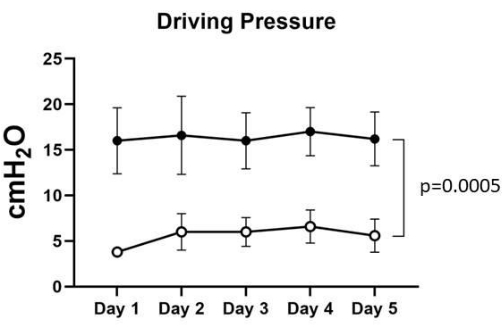
Figure 3 : Pression d’entraînement. La pression d’entraînement avant l’ARM variait de 16 ± 3,2 à 17 ± 2,3 cmH2O, tandis que la pression d’entraînement post-ARM variait entre 3,8 ± 0,4 et 6,6 ± 1,6 cmH2O dans les cinq poumons. L’analyse statistique de l’ANOVA à deux facteurs a été utilisée pour calculer la valeur de p de 0,0005, qui a été considérée comme significative. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Conformité dynamique. La compliance dynamique pré-ARM variait de 9,1 ± 1,2 à 10,2 ± 2,6 mL/cmH2O, tandis que la compliance dynamique post-ARM variait entre 23,6 ± 3,5 et 43,8 ± 11,3 mL/cmH2O dans les cinq poumons. L’analyse statistique de l’ANOVA à deux facteurs a été utilisée pour calculer la valeur de p de 0,0007, qui a été considérée comme significative. Veuillez cliquer ici pour voir une version agrandie de cette figure.
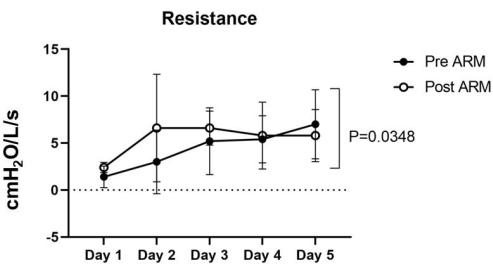
Figure 5 : Résistance. La résistance pré-ARM variait de 1,4 ± 1,0 à 7 ± 3,2 cmH2O/L/seg, tandis que la résistance post-ARM variait entre 2,4 ± 0,4 et 6,6 ± 5,1 cmH2O/L/seg dans les cinq poumons. L’analyse statistique de l’ANOVA à deux facteurs a été utilisée pour calculer la valeur de p de 0,0348, ce qui a été considéré comme significatif. Veuillez cliquer ici pour voir une version agrandie de cette figure.
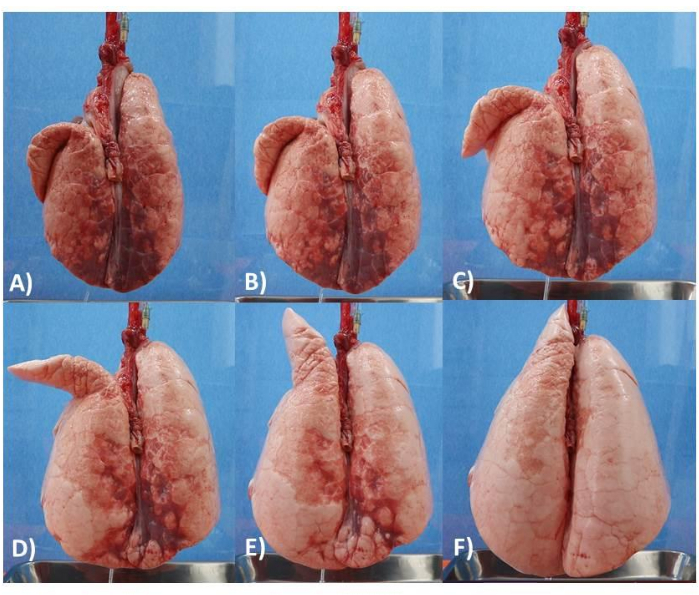
Figure 6 : Modèle de poumon. (A) Poumon avec PEEP de 5 cm. (B) Poumon avec PEEP de 6 cm. (C) Poumon avec PEEP de 8 cm. (D) Poumon avec PEEP de 10 cm. (E) Poumon avec PEEP de 12 cm. (F) Poumon avec PEEP de 14 cm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
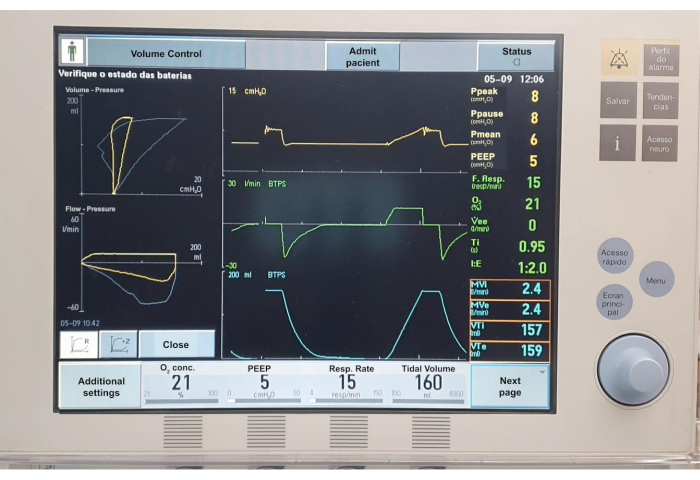
Graphique 7. Tableaux de ventilation mécanique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Le protocole décrit est utile pour produire un modèle de poumon porcin ex vivo sous MV à pression positive. Il peut être utilisé pour l’étude et l’enseignement de la mécanique pulmonaire grâce à un retour visuel des poumons lors du recrutement et de l’analyse des courbes et des valeurs projetées sur l’écran de l’appareil. Pour arriver à ce résultat, des études pilotes sont nécessaires pour comprendre le comportement des poumons à l’extérieur de la cage thoracique et identifier le besoin d’adaptations.
Nous avons identifié que le point critique était la formation de bulles, de fistules et de lésions dans la plèvre qui ont été visualisées lors de la connexion du ventilateur mécanique, avec une différence entre la télévision inspirée et expirée et des changements dans la courbe de volume. Ainsi, l’une des premières modifications du protocole a été d’utiliser une large ouverture chirurgicale du thorax, avec une incision du diaphragme au début de la procédure lors de la dissection des organes cardiopulmonaires, ce qui peut améliorer la visualisation des structures et aider à la libération prudente du ligament pulmonaire inférieur, en maintenant l’intégrité pulmonaire. De plus, le gonflage manuel des poumons pilotes après la dissection des structures a montré que ce gonflage dépasse les limites de pression et contribue à la formation de cloques et de fistules. Certaines études utilisant des poumons ex vivo ont présenté la possibilité d’utiliser de la colle de fibrine pour les fuites, avec des résultats positifs ; Bien que nous n’ayons pas utilisé cette approche dans l’étude, elle pourrait être une alternative pour améliorer le modèle26,27. Un autre point pertinent est que les poumons ont été retirés et complètement dégonflés dans l’étude pilote, ce qui les a maintenus totalement effondrés de la préparation de l’organe à l’initiation de la MV, ce qui a rendu difficile l’ouverture des poumons à la MV et a augmenté la possibilité de formation de fistule. Par conséquent, nous avons commencé à clamper l’OTC et à garder les poumons gonflés pendant la dissection jusqu’à ce que le SS soit administré. Par la suite, l’OTC a été relâché, dégonflé et connecté les poumons au ventilateur mécanique pour démarrer l’ARM, et une analyse de la mécanique pulmonaire a été effectuée pour démontrer la courbe d’hystérésis pulmonaire. Cela n’a pas compromis le recrutement pulmonaire ou l’analyse de la mécanique pulmonaire car les patients anesthésiés ont une atélectasie et une compliance pulmonaire réduite même pendant MV 28,29,30,31.
Dans l’étude pilote, une PEEP initiale de 5 cm H2O a été utilisée et augmentée par incréments de 5 cm H2O jusqu’à 25 cm H2O32,33. Cependant, les pressions de pointe et de plateau ont atteint des valeurs supérieures à 40 et 30 cm H2O, respectivement, avec formation de fistule. Ainsi, une augmentation progressive des incréments de 2 cm H2O a été réalisée afin de mieux analyser le comportement des pressions dans le temps et de comprendre les limites de la PEEP dans notre modèle pulmonaire ex vivo. Il n’y avait pas de différence de mortalité entre l’inflation soutenue et l’inflation incrémentale, mais l’inflation incrémentale est la plus utilisée et peut faciliter l’analyse par étapes de la mécanique pulmonaire34. En ce qui concerne l’utilisation de la pression négative20,21, le modèle n’a été testé qu’en pression positive car les patients sous MV sont soumis à une pression positive. Nous n’excluons pas l’utilisation de la pression négative à l’avenir, mais cela nécessiterait des changements de boîtier en acrylique.
La littérature présente quelques modèles produits avec un poumon d’essai, des pistons et un modèle ex vivo 13,14 qui ont été placés dans des boîtes hermétiquement fermées qui simulaient la cage thoracique. Notre modèle a été placé dans une boîte en acrylique conventionnelle, qui, bien qu’elle réduise la possibilité d’appliquer une pression négative, peut faciliter la production du modèle. Un autre modèle produit pour les études précliniques18 est similaire au nôtre, mais les poumons étaient positionnés horizontalement tandis que les nôtres étaient maintenus verticalement, recevant l’action de la gravité sans le soutien des organes et de la cage thoracique. Ces poumons ont été utilisés lors d’expériences dans les 48 heures suivant l’euthanasie 18,19,20,21,35. Notre modèle a été utilisé pendant un total de 120 h, maintenu à une température de 2 à 8 °C pendant les 24 h de l’expérience, montrant les résultats positifs décrits dans la section des résultats représentatifs.
L’écart dans l’enseignement et la formation n’a pas été comblé à ce moment-là, mais le modèle est efficace pour analyser la mécanique pulmonaire et peut être utilisé comme outil de recherche et d’enseignement. De plus, nous n’avions pas pour objectif d’étudier des solutions de perfusion, mais de la même manière que nous avons infusé la SS à l’étape 6.1, des solutions de perfusion et de conservation peuvent être utilisées, ouvrant de nouvelles possibilités pour des études avec le même modèle présenté.
Cette technique présente certaines limites : 1) la connaissance de l’anatomie animale pour s’assurer que les poumons sont correctement enlevés ; 2) le modèle n’a pas été évalué au-delà de cinq jours ; 3) le modèle semble approprié pour l’enseignement de la ventilation, mais n’a pas été testé dans un contexte d’enseignement ; 4) il s’agit d’un modèle animal, il est donc important de considérer ses limites d’applicabilité chez l’homme.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Nous remercions tous les collègues et professionnels qui ont contribué et soutenu la construction de ce protocole de modèle de poumon porcin ex vivo .
Cette étude n’avait pas de sources de financement.
matériels
| Name | Company | Catalog Number | Comments |
| 0.9% Saline solution | 2500ml | ||
| Anesthesia machine - Primus | Drager | REF 8603800-18 | Anesthesia work station used in the procedure |
| Aspirator | For blood aspiration from thorax | ||
| Bedside Monitor - Life Scope | Nihon Kohden | BSM-7363 | Multiparameter monitor used during the procedure |
| Bonney Tissue Forceps | Any tissue forceps is suitable | ||
| Disposable scalper, #23 | Any scalper is suitable | ||
| Disposable syringe needles, 18G x 1 1/2", 23G x 1" | BD | 302814 | Widely available |
| Disposable syringes, 10ml | Widely available | ||
| Electrosurgical unit - SS-501 | WEM | For cutting and coagulation during thorax incision | |
| Fentanyl | 10 mcg/kg bolus + 10 mcg/kg/hour continuous infusion | ||
| Finochietto retractor | Any finochietto retractor is suitable | ||
| heparin | 3ml | ||
| Infusion set | Any infusion set is suitable | ||
| Isoflurane | 1.5% | ||
| Kelly Forceps Curved | Any kelly forceps is suitable | ||
| Ketamine | 5mg/kg | ||
| Lactated Ringer solution | 500ml | ||
| Mechanical ventilator - Servo I | Maquet | REF 6449701 | Mechanical ventilator used in the procedure |
| Metzenbaum Scissor (Straight and curved) | Any metzenbaum scissor is suitable | ||
| Midazolam | 0.25mg/kg | ||
| Orotracheal intubation cannula, #6.5 | Rusch | 112282 | Widely available |
| Plexiglass | Custom made plexiglass box: 30x45x60cm | ||
| Polyester suture, 2-0 | Widely available | ||
| Potassium choride | 10 ml, 19.1% potassium chloride. | ||
| propofol | 5mg/kg | ||
| Three way stopcock | Widely available | ||
| Venous catheter, G20 x 1" | BD | 38183314 | Widely available |
Références
- Roberto, C., Carvalho, R., Toufen Jr, C., Franca, S. A. Mechanical Ventilation: Principles, graphic analysis and ventilation modalities. Jornal Brasileiro de Pneumologia. 33 (2), 54-55 (2007).
- Barbas, C. S. V., et al. Brazilian recommendations for mechanical ventilation 2013. Part I. Revista Brasileira de Terapia Intensiva. 26 (2), 89-121 (2014).
- Walter, J. M., Corbridge, T. C., Singer, B. D. Invasive mechanical ventilation. Southern Medical Journal. 111 (12), 746-753 (2018).
- Faustino, E. A. Concepts and monitoring of pulmonary mechanics in patients under ventilatory support in the intensive care unit. Revista Brasileira de Terapia Intensiva. 19 (2), 161-169 (2007).
- Holanda, M. A., Vasconcelos, R. S., Ferreira, J. C., Pinheiro, B. V. Patient-ventilator asynchrony. Jornal Brasileiro de Pneumologia. 44 (2), 321-333 (2018).
- Rezoagli, E., Laffey, J. G., Bellani, G. Monitoring lung injury severity and ventilation intensity during mechanical ventilation. Seminars in Respiratory and Critical Care Medicine. 43 (3), 346-368 (2022).
- Tallo, F. S. Evaluation of self-perception of mechanical ventilation knowledge among Brazilian final-year medical students, residents, and emergency physicians. Clinics. 72 (2), 65-70 (2017).
- Schroedl, C. J., et al. Impact of simulation-based mastery learning on resident skill managing mechanical ventilators. American Thoracic Society Scholar. 2 (1), 34-48 (2021).
- Wilcox, S. R., et al. Academic emergency medicine physicians' knowledge of mechanical ventilation. The Western Journal of Emergency Medicine. 17 (3), 271-279 (2016).
- Cox, C. E., et al. Effectiveness of medical resident education in mechanical ventilation. American Journal of Respiratory and Critical Care Medicine. 167 (1), 32-38 (2003).
- Keegan, R., Henderson, T., Brown, G. Use of the virtual ventilator, a screen-based computer simulation, to teach the principles of mechanical ventilation. Journal of Veterinary Medical Education. 36 (4), 436-443 (2009).
- Spadaro, S., et al. Simulation training for residents focused on mechanical ventilation: A randomized trial using mannequin-based versus computer-based simulation. Simulation in Healthcare. 12 (6), 349-355 (2017).
- Chase, J. G., Yuta, T., Mulligan, K. J., Shaw, G. M., Horn, B. A novel mechanical lung model of pulmonary diseases to assist with teaching and training. BMC Pulmonary Medicine. 6 (21), 1-11 (2006).
- Kuebler, W. M., Mertens, M., Pries, A. R. A two-component simulation model to teach respiratory mechanics. Advances in Physiology Education. 31 (2), 218-222 (2007).
- Heili-Frades, S., Peces-Barba, G., Rodríguez-Nieto, M. J. Design of a lung simulator for learning lung mechanics in mechanical ventilation. Archivos de Bronconeumología. 43 (12), 674-679 (2007).
- Ngo, C., Dahlmanns, S., Vollmer, T., Misgeld, B., Leonhardt, S. An object-oriented computational model to study cardiopulmonary hemodynamic interactions in humans. Computer Methods and Programs in Biomedicine. 159, 167-183 (2018).
- Lazzari, C. D., Genuini, I., Pisanelli, D. M., D'Ambrosi, A., Fedele, F. Interactive simulator for e-Learning environments: a teaching software for health care professionals. Biomedical Engineering Online. 13 (172), 1-18 (2014).
- Perinel, S., et al. Development of an ex vivo human-porcine respiratory model for preclinical studies. Scientific Reports. 7, 1-6 (2017).
- Aboelnazar, N. S., et al. Negative pressure ventilation decreases inflammation and lung edema during normothermic ex-vivo lung perfusion. The Journal of Heart and Lung Transplantation. 37 (4), 520-530 (2018).
- Sattari, S., et al. Introducing a custom-designed volume-pressure machine for novel measurements of whole lung organ viscoelasticity and direct comparisons between positive- and negative-pressure ventilation. Frontiers in Bioengineering and Biotechnology. 8, 1-12 (2020).
- Sattari, S., et al. Positive- and negative-pressure ventilation characterized by local and global pulmonary mechanics. American Journal of Respiratory and Critical Care Medicine. 207 (5), 577-586 (2023).
- Montigaud, Y., et al. Development of an ex vivo preclinical respiratory model of idiopathic pulmonary fibrosis for aerosol regional studies. Scientific Reports. 9 (1), 17949(2019).
- Montigaud, Y., et al. Aerosol delivery during invasive mechanical ventilation: development of a preclinical ex vivo respiratory model for aerosol regional deposition. Scientific Reports. 9 (1), 17930(2019).
- Montigaud, Y., et al. Development of an ex vivo respiratory pediatric model of bronchopulmonary dysplasia for aerosol deposition studies. Scientific Reports. 9 (1), 5720(2019).
- Buchko, M. T., et al. A low-cost perfusate alternative for ex vivo. lung perfusion. transplantation proceedings. 52 (10), 2941-2946 (2020).
- Kondo, N. Development of an effective method utilizing fibrin glue to repair pleural defects in an ex-vivo pig model. Journal of Cardiothoracic Surgery. 15 (1), 110(2020).
- Gasek, N., et al. Development of alginate and gelatin-based pleural and tracheal sealants. Acta Biomaterialia. 131, 222-235 (2021).
- Li, X., et al. Effects of individualized positive end-expiratory pressure combined with recruitment maneuver on intraoperative ventilation during abdominal surgery: a systematic review and network meta-analysis of randomized controlled trials. Journal of Anesthesia. 36 (2), 303-315 (2022).
- Hu, M. C., Yang, Y. L., Chen, T. T., Lee, C. I., Tam, K. W. T. Recruitment maneuvers to reduce pulmonary atelectasis after cardiac surgery: A meta-analysis of randomized trials. The Journal of Thoracic and Cardiovascular Surgery. 164 (1), 171-181 (2020).
- Hu, M. C., et al. Recruitment maneuvers in patients undergoing thoracic surgery: a meta-analysis. General Thoracic and Cardiovascular Surgery. 69 (12), 1553-1559 (2021).
- Zeng, C., Lagier, D., Lee, J. W., Melo, M. F. V. Perioperative pulmonary atelectasis: Part I. Biology and mechanisms. Anesthesiology. 136 (1), 181-205 (2022).
- Niman, E., et al. Lung recruitment after cardiac arrest during procurement of atelectatic donor lungs is a protective measure in lung transplantation. Journal of Thoracic Disease. 14 (8), 2802-2811 (2022).
- Calvo, R. N., et al. Comparison of the efficacy of two alveolar recruitment maneuvers in improving the lung mechanics and the degree of atelectasis in anesthetized healthy sheep. Research in Veterinary Science. 150 (5), 164-169 (2022).
- Pensier, J., et al. Effect of lung recruitment maneuver on oxygenation, physiological parameters and mortality in acute respiratory distress syndrome patients: a systematic review and meta-analysis. Intensive Care Medicine. 45 (12), 1691-1702 (2019).
- Mariano, C. A., Sattari, S., Quiros, K. A. M., Nelson, T. M., Eskandari, M. Examining lung mechanical strains as influenced by breathing volumes and rates using experimental digital image correlation. Respiratory Research. 23 (1), 92(2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon