Method Article
Ex Vivo Modello sperimentale suino per lo studio e l'insegnamento della meccanica polmonare
In questo articolo
Riepilogo
Presentiamo un modello ex vivo di polmone di maiale per la dimostrazione della meccanica polmonare e delle manovre di reclutamento alveolare a scopo didattico. I polmoni possono essere utilizzati per più di un giorno (fino a cinque giorni) con variazioni minime delle variabili della meccanica polmonare.
Abstract
La ventilazione meccanica è molto utilizzata e richiede conoscenze specifiche per la comprensione e la gestione. I professionisti della salute in questo campo possono sentirsi insicuri e privi di conoscenze a causa di una formazione e di metodi di insegnamento inadeguati. Pertanto, l'obiettivo di questo articolo è quello di delineare i passaggi coinvolti nella generazione di un modello di polmone suino ex vivo da utilizzare in futuro, per studiare e insegnare la meccanica polmonare. Per generare il modello, cinque polmoni suini sono stati accuratamente rimossi dal torace seguendo le linee guida del Comitato etico per la ricerca sugli animali con adeguata cura e sono stati collegati al ventilatore meccanico attraverso una cannula tracheale. Questi polmoni sono stati poi sottoposti alla manovra di reclutamento alveolare. Sono stati registrati i parametri della meccanica respiratoria e sono state utilizzate videocamere per ottenere video dei polmoni durante questo processo. Questo processo è stato ripetuto per cinque giorni consecutivi. Quando non venivano utilizzati, i polmoni venivano conservati in frigorifero. Il modello ha mostrato una meccanica polmonare diversa dopo la manovra di reclutamento alveolare ogni giorno; non facendosi influenzare dai giorni, ma solo dalla manovra. Pertanto, concludiamo che il modello polmonare ex vivo può fornire una migliore comprensione della meccanica polmonare e dei suoi effetti, e anche della manovra di reclutamento alveolare attraverso il feedback visivo durante tutte le fasi del processo.
Introduzione
La ventilazione meccanica (MV) è ampiamente utilizzata nelle unità di terapia intensiva (ICU) e nei centri chirurgici. Il suo monitoraggio è essenziale per aiutare a riconoscere le asincronie e prevenire lesioni per tutti i pazienti, soprattutto quando il paziente ha gravi lesioni polmonari 1,2,3,4,5,6. Il monitoraggio della meccanica respiratoria può anche contribuire alla comprensione clinica della progressione della malattia e delle applicazioni terapeutiche, come l'uso della pressione positiva di fine espirazione (PEEP) o la manovra di reclutamento alveolare (ARM). Tuttavia, l'uso di queste tecniche richiede una buona comprensione delle curve e della meccanica polmonaredi base 3,4.
Gli studenti, gli specializzandi e i professionisti del settore medico si sentono insicuri riguardo alla gestione della MV, dall'accensione del ventilatore e dalle regolazioni iniziali al monitoraggio del plateau e delle pressioni di guida, e questa insicurezza è associata a una mancanza di conoscenza e di un'adeguata formazione precedente 7,8,9,10. Abbiamo osservato che i professionisti che hanno partecipato alle simulazioni e hanno utilizzato un modello polmonare hanno riportato una maggiore fiducia, comprensione dei parametri e comprensione delle componenti della meccanica polmonare 8,11,12.
I modelli per lo studio e l'addestramento della MV con polmoni, soffietti e pistoni di prova possono simulare diverse pressioni e volumi, nonché diverse condizioni di meccanica polmonare 13,14,15. Anche i modelli computazionali e software contribuiscono allo studio dell'interazione cardiopolmonare generando simulazioni che possono essere utilizzate per insegnare i principi della MV11 agli operatori sanitari16,17.
Mentre i modelli computazionali possono presentare difficoltà nel rappresentare l'isteresi polmonare16, i modelli con polmone e soffietto di prova 13,14,15 possono produrre curve pressione-volume simili alla curva fisiologica e dimostrare la dinamica polmonare. Come vantaggio, il polmone suino ex vivo presenta un'anatomia simile a quella degli esseri umani18, producendo anche curve MV, isteresi polmonare e fornendo un feedback visivo dei polmoni all'interno della scatola acrilica durante l'analisi della meccanica polmonare. I modelli visivi sono importanti e possono aiutare a comprendere componenti e concetti difficili da immaginare. Pertanto, i modelli polmonari ex vivo rappresentano un modo pratico di insegnare.
Gli studi con polmoni suini ex vivo, come quelli sulla MV con pressione positiva e negativa 19,20,21, l'analisi della distribuzione dell'aerosol 22,23, le simulazioni pediatriche24 e la perfusione polmonare25 possono migliorare le conoscenze sulla MV. Recenti studi che analizzano modelli in pressione positiva e negativa hanno dimostrato che la ventilazione a pressione positiva può portare a un reclutamento brusco con maggiore deformazione locale, maggiore distensione, differenze della curva di isteresi e possibili lesioni tissutali rispetto alla pressione a pressione negativa 19,20,21. Tuttavia, i modelli a pressione positiva sono necessari perché i pazienti sono sotto pressione positiva durante la pressione MV 19,20,21. Lo sviluppo di un modello polmonare per gli studi preclinici apre la possibilità di nuove ricerche e applicazioni, tra cui l'insegnamento e la formazione sulla MV.
Qui presentiamo un modello di polmone suino ex vivo per scopi di studio e formazione. Il nostro obiettivo primario è quello di descrivere le fasi per la generazione di questo modello di polmone suino ex vivo in MV a pressione positiva. Può essere utilizzato in futuro per studiare e insegnare la meccanica polmonare.
Protocollo
Il protocollo è stato approvato dal Comitato Etico per la Ricerca Animale della nostra Istituzione (protocollo n. 1610/2021).
1. Anestesia e preparazione dell'animale
- Inizialmente, posizionare l'animale su una bilancia e controllare il peso per regolare i farmaci e la sedazione necessari per la procedura.
- Somministrare ketamina 5 mg/kg e midazolam 0,25 mg/kg per via intramuscolare.
- Perforare la vena marginale dell'orecchio con un catetere venoso da 20 G e somministrare propofol per via endovenosa (5 mg/kg) per l'induzione dell'anestesia.
- Somministrare 3 ml di eparina per via endovenosa nell'accesso alla vena dell'orecchio marginale per facilitare l'estrazione cardiopolmonare e la perfusione.
- Dopo l'anestesia, eseguire l'intubazione orotracheale con una cannula orotracheale (OTC) da 6,5 mm e fissare l'OTC con nastro adesivo, lasciandolo saldamente fissato per evitare lo spostamento durante la procedura.
NOTA: La profondità della sedazione viene controllata monitorando i parametri emodinamici e utilizzando un analizzatore di gas, come la pressione arteriosa media, la frequenza cardiaca e la concentrazione di isoflurano inspirato/espirato.
2. Ventilazione meccanica intraoperatoria
- Collegare l'animale tramite l'OTC alla MV, mantenendo la sedazione con isoflurano all'1,5% al 50% della frazione inspirata di ossigeno (FiO2) e fentanil 10 mcg/kg in bolo + 10 mcg/kg/h in infusione continua.
- Toccare lo schermo del ventilatore meccanico e selezionare la modalità di ventilazione controllata dal volume (VCV), selezionare il pulsante del volume corrente (TV) e ruotare la rotella di scorrimento fino a quando il valore del volume corrente corrisponde a 8 ml/kg.
- Toccare lo schermo del ventilatore meccanico. Selezionare il FiO2 e ruotare la rotella di scorrimento fino a raggiungere il valore del 50%.
- Toccare lo schermo del ventilatore meccanico e selezionare la frequenza respiratoria (RR). Ruotare la ruota fino a raggiungere il valore ideale per mantenere una CO2 espirata di 35-45 mmHg misurata mediante capnografia accoppiata al ventilatore meccanico.
NOTA: La profondità della sedazione viene controllata monitorando i parametri emodinamici e utilizzando un analizzatore di gas come la pressione arteriosa media, la frequenza cardiaca e la concentrazione di isoflurano inspirato/espirato.
3. Dissezione tissutale e scambio OTC
- Praticare un'incisione sternale mediale da 2 cm sopra il manubrio a 2 cm sotto il processo xifoideo dello sterno per accedere alla cavità toracica. Posizionare i divaricatori delle costole, espandendo il campo visivo durante la procedura.
- Utilizzare un bisturi per praticare un'incisione tracheale orizzontale all'altezza della cartilagine cricoide (solo in corrispondenza dei primi anelli tracheali) abbastanza larga da introdurre una nuova cannula tracheale.
- Sgonfiare il bracciale OTC che si trova all'interno delle vie aeree e tirare lentamente per rimuoverlo. Nel frattempo, inserire il nuovo OTC nell'incisione praticata nella trachea dopo aver rimosso il vecchio OTC. A causa del bracciale sgonfio, possono verificarsi perdite, che cessano quando si riposiziona il nuovo OTC.
- Gonfiare la cuffia del tubo tracheale appena inserita collegando una siringa da 20 ml al palloncino pilota. La siringa eroga aria sotto pressione e gonfia il palloncino pilota e il bracciale. Una volta gonfiato il bracciale, rimuovere la siringa.
- Legare la nuova cannula tracheale direttamente alla trachea con poliestere 2-0 per evitare perdite e movimenti mentre si posiziona il polmone nella scatola di ventilazione in plexiglass.
- Con il bisturi, sezionare i tessuti per rimuovere gli organi cardiopolmonari dal torace.
4. Eutanasia animale
- Aumentare la concentrazione di isoflurano al 5% e somministrare 10 mL di cloruro di potassio al 19,1%. Successivamente, verificare l'assenza di segni vitali.
NOTA: Questa procedura è stata eseguita secondo la Guida del National Institutes of Health per la cura e l'uso degli animali da laboratorio.
5. Estrazione cardiopolmonare
- Dopo l'eutanasia, sezionare il legamento respiratorio per rimuovere i polmoni.
- Dopo la dissezione del tessuto, clamp l'OTC con l'apposita pinza Kelly durante la fine dell'inspirazione, mantenendo i polmoni gonfiati.
- Scollegare l'OTC dal ventilatore meccanico, ma tenerlo clamped.
- Sezionare l'arteria aortica, posizionare l'aspiratore all'interno della cavità toracica per rimuovere il sangue stravasato, mantenere la visualizzazione della cavità mentre si terminano le dissezioni e liberare gli organi da rimuovere dalla cavità toracica.
NOTA: Il legamento polmonare inferiore deve essere rilasciato con cautela per evitare lacerazioni polmonari. - Rimuovere il cuore e il polmone dalla gabbia toracica con l'OTC clamped, senza separarli, e posizionarli su un vassoio.
6. Preparazione cardiopolmonare
- Con il polmone su un vassoio, incannulare l'arteria polmonare con un catetere a lume singolo di grande diametro e collegarlo al set di infusione per somministrare continuamente 2.000 ml di soluzione salina fredda allo 0,9% (SS) o fino a quando il liquido limpido non fuoriesce dall'aorta.
NOTA: La SS deve essere somministrata a una velocità normale, evitare di schiacciare la sacca endovenosa (IV). - Dopo aver eliminato il flusso, suturare l'arteria aortica con poliestere 2-0 e somministrare altri 100 ml di SS allo 0,9%. Chiudere l'uscita del catetere a lume singolo poiché il liquido rimarrà all'interno fino alla fine dell'esperimento.
- Sganciare l'OTC, notare che i polmoni si sgonfieranno e rimarranno chiusi, pronti a ricevere MV e ARM.
7. MV all'interno di una scatola acrilica
- Dopo la preparazione, aprire la scatola in acrilico e posizionare i polmoni verticalmente all'interno della scatola. Far passare l'OTC attraverso il foro nel coperchio e collegare la cannula tracheale al ventilatore meccanico.
NOTA: Assicurarsi che la cannula tracheale sia saldamente fissata nella trachea. - Selezionare il pulsante Avvia ventilazione .
- Toccare lo schermo del ventilatore meccanico e selezionare il ventilatore meccanico per VCV.
- Toccare la schermata delle impostazioni della modalità VCV e selezionare il pulsante TV , ruotare la rotellina fino a raggiungere il valore di 6 mL/kg. Fai lo stesso per regolare la PEEP a 5 cm H2O, FiO2 al 21%, RR a 15 respiri al minuto e il tempo di pausa inspiratoria al 10%.
8. BRACCIO
- Per iniziare il reclutamento, aumentare la PEEP da 5 cm H2O a 6 cm H2O e quindi aumentarla gradualmente di 2 cm H2O fino a raggiungere 14 cm H2O. La PEEP viene aumentata utilizzando il pulsante sullo schermo sotto il valore PEEP visualizzato sullo schermo. Ruotare la rotellina per aumentare il valore.
- Per ogni PEEP, annotare i valori di pressione di picco, pressione di plateau, conformità dinamica e resistenza delle vie aeree visualizzati sullo schermo del ventilatore meccanico. Annotare la pressione di azionamento, che è il valore della pressione di plateau meno il valore PEEP regolato in quel momento.
- Dopo aver raggiunto i 14 cm H2O, ridurre la PEEP in decrementi graduali di 2 cm H2O fino a raggiungere 6 cm H2O, quindi ridurla a 5 cm H2O. La PEEP viene ridotta utilizzando il pulsante sullo schermo sotto il valore PEEP visualizzato sullo schermo. Ruotare la rotellina per diminuire il valore.
- Per ogni PEEP, annotare i valori di pressione di picco, pressione di plateau, conformità dinamica e resistenza delle vie aeree visualizzati sullo schermo del ventilatore meccanico. Annotare la pressione di azionamento, che è il valore della pressione di plateau meno il valore PEEP regolato in quel momento.
NOTA: Mantenere ciascun valore PEEP per 10 minuti durante l'incremento e per 5 minuti ad ogni passo durante il decremento.
- Per ogni PEEP, annotare i valori di pressione di picco, pressione di plateau, conformità dinamica e resistenza delle vie aeree visualizzati sullo schermo del ventilatore meccanico. Annotare la pressione di azionamento, che è il valore della pressione di plateau meno il valore PEEP regolato in quel momento.
9. Mantenimento cardiopolmonare
- Al termine della fase di reclutamento, clampare delicatamente la cannula tracheale con la pinza durante l'inspirazione, mantenendo i polmoni gonfiati. Apri la scatola acrilica.
- Rimuovere i polmoni dalla scatola acrilica e riporli con cura in un contenitore di vetro.
NOTA: Assicurarsi che la cannula tracheale sia saldamente fissata nella trachea. - Versare 500 ml di SS allo 0,9%.
- Conservare in frigorifero in un contenitore di vetro avvolto nella pellicola a una temperatura compresa tra 2 e 8 °C per 24 ore.
- Ripeti i passaggi 7, 8 e 9 per cinque giorni consecutivi.

Figura 1: Diagramma di flusso dello studio. Fare clic qui per visualizzare una versione più grande di questa figura.
Risultati
Sono state utilizzate cinque suine femmine di peso compreso tra 23,4 e 26,9 kg e sono stati seguiti il protocollo descritto per l'estrazione cardiopolmonare e l'analisi della meccanica polmonare. La nostra intenzione è che il modello sia utile per lo studio della meccanica polmonare analizzando la pressione di picco, la pressione di plateau, la resistenza, la pressione di guida e le variabili di compliance dinamica raccolte direttamente dallo schermo del ventilatore meccanico. Il diagramma di flusso del modello è illustrato nella Figura 1.
I polmoni sono stati analizzati per cinque giorni consecutivi, ripetendo l'intero processo descritto nei punti 7.2, 8.1, 8.2, 9.1, 9.2 e 9.3 del protocollo. Abbiamo cercato di mostrare come le variabili polmonari si comportavano prima e dopo il reclutamento e di verificare la durabilità del modello polmonare ex vivo nel periodo stabilito.
Differenze significative (p < 0,05) sono state osservate per tutte le variabili tra pre e post-ARM. La pressione di picco, la pressione di plateau (Figura 2) e la pressione di guida (Figura 3) sono diminuite dopo la manovra (p = 0,0005), mentre la compliance dinamica (p = 0,0007) è aumentata (Figura 4), dimostrando alveoli collassati aperti e guadagno dell'area polmonare. Anche la resistenza (Figura 5) è aumentata dopo il reclutamento (p = 0,0348). Nessuna delle variabili è stata influenzata in modo significativo dal giorno.
Sulla base di questi risultati, abbiamo dimostrato che il modello è efficace nel dimostrare i cambiamenti della meccanica polmonare visiva attraverso l'ARM (Figura 6) e nello studio e nell'insegnamento della meccanica polmonare (Figura 7). Inoltre, abbiamo dimostrato che il modello può essere utilizzato per almeno cinque giorni consecutivi. Poiché non abbiamo valutato il modello oltre questo periodo, non possiamo confermare la durata finale del modello polmonare.

Figura 2: Pressioni. (A) Pressione di picco. Il Ppeak pre-ARM variava da 21 ± 3,2 a 23 ± 2,3 cmH2O, mentre il Ppeak post-ARM variava tra 9 ± 0,6 e 12,6 ± 1,4 cmH2O nei cinque polmoni. L'analisi statistica ANOVA bidirezionale è stata utilizzata per calcolare il valore p di 0,0005, che è stato considerato significativo. (B) Pressione di plateau. Il Pplateau pre-ARM variava da 21 ± 3,2 a 22 ± 2,3 cmH2O, mentre il Pplateau post-ARM variava tra 8,8 ± 0,4 e 11,6 ± 1,6 cmH2O nei cinque polmoni. L'analisi statistica ANOVA bidirezionale è stata utilizzata per calcolare il valore p di 0,0005, che è stato considerato significativo. Fare clic qui per visualizzare una versione più grande di questa figura.
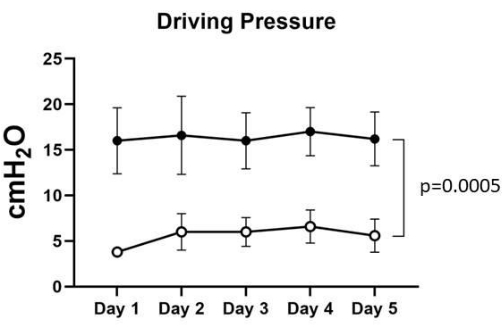
Figura 3: Pressione di azionamento. La pressione di azionamento pre-ARM variava da 16 ± 3,2 a 17 ± 2,3 cmH2O, mentre la pressione di azionamento post-ARM variava tra 3,8 ± 0,4 e 6,6 ± 1,6 cmH2O nei cinque polmoni. L'analisi statistica ANOVA bidirezionale è stata utilizzata per calcolare il valore p di 0,0005, che è stato considerato significativo. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Conformità dinamica. La compliance dinamica pre-ARM variava da 9,1 ± 1,2 a 10,2 ± 2,6 mL/cmH2O, mentre la compliance dinamica post-ARM variava tra 23,6 ± 3,5 e 43,8 ± 11,3 mL/cmH2O nei cinque polmoni. L'analisi statistica ANOVA bidirezionale è stata utilizzata per calcolare il valore p di 0,0007, che è stato considerato significativo. Fare clic qui per visualizzare una versione più grande di questa figura.
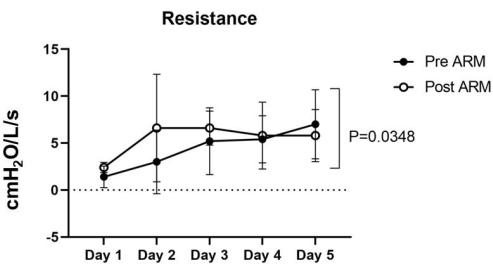
Figura 5: Resistenza. La resistenza pre-ARM variava da 1,4 ± 1,0 a 7 ± 3,2 cmH2O/L/seg, mentre la resistenza post-ARM variava da 2,4 ± 0,4 e 6,6 ± 5,1 cmH2O/L/seg nei cinque polmoni. L'analisi statistica ANOVA bidirezionale è stata utilizzata per calcolare il valore p di 0,0348, che è stato considerato significativo. Fare clic qui per visualizzare una versione più grande di questa figura.
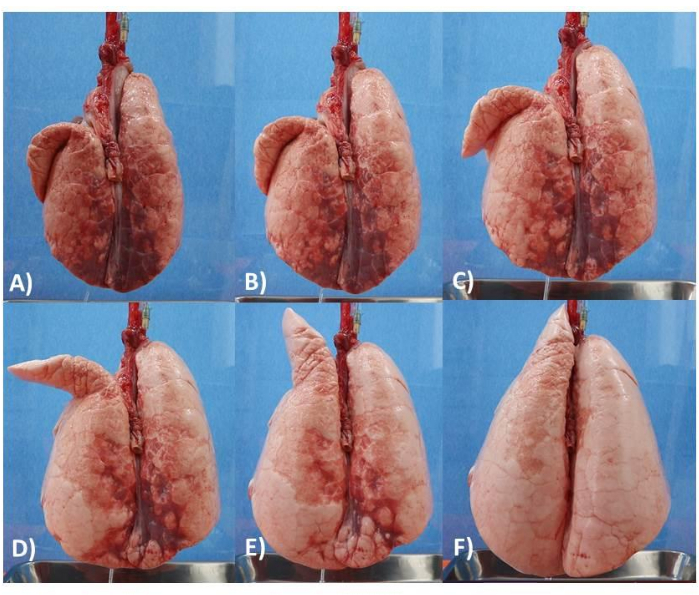
Figura 6: Modello di polmone. (A) Polmone con PEEP di 5 cm. (B) Polmone con PEEP di 6 cm. (C) Polmone con PEEP di 8 cm. (D) Polmone con PEEP di 10 cm. (E) Polmone con PEEP di 12 cm. (F) Polmone con PEEP di 14 cm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
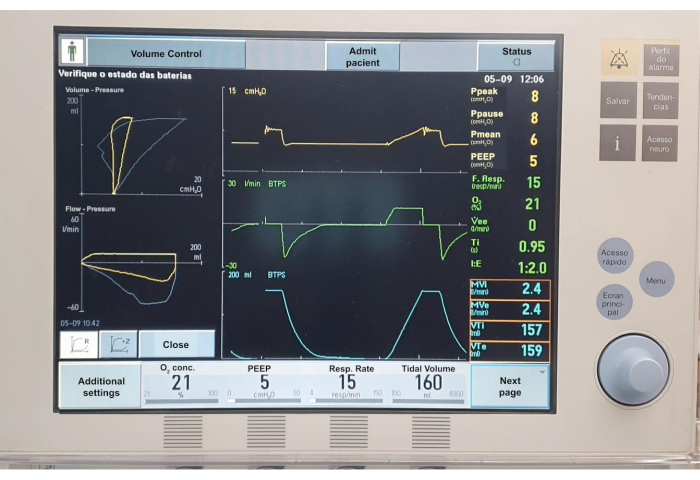
Figura 7. Tabelle di ventilazione meccanica. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Il protocollo descritto è utile per produrre un modello di polmone suino ex vivo in condizioni di MV a pressione positiva. Può essere utilizzato per lo studio e l'insegnamento della meccanica polmonare attraverso il feedback visivo dei polmoni durante il reclutamento e l'analisi delle curve e dei valori proiettati sullo schermo del dispositivo. Per ottenere questo risultato, sono necessari studi pilota per comprendere il comportamento dei polmoni al di fuori della gabbia toracica e per identificare la necessità di adattamenti.
Abbiamo identificato che il punto critico era la formazione di bolle, fistole e lesioni nella pleura che venivano visualizzate quando si collegava il ventilatore meccanico, con una differenza tra TV inspirata e spirata e cambiamenti nella curva del volume. Pertanto, una delle prime modifiche del protocollo è stata quella di utilizzare un'ampia apertura chirurgica del torace, con incisione del diaframma all'inizio della procedura durante la dissezione degli organi cardiopolmonari, che può migliorare la visualizzazione delle strutture e aiutare l'attento rilascio del legamento polmonare inferiore, mantenendo l'integrità polmonare. Inoltre, il gonfiaggio manuale dei polmoni pilota dopo che le strutture sono state sezionate ha mostrato che questo gonfiaggio supera i limiti di pressione e contribuisce alla formazione di vesciche e fistole. Alcuni studi che utilizzano polmoni ex vivo hanno presentato la possibilità di utilizzare colla di fibrina per le perdite, con risultati positivi; Anche se non abbiamo utilizzato questo approccio nello studio, potrebbe essere un'alternativa per migliorare il modello26,27. Un altro punto rilevante è che i polmoni sono stati rimossi e completamente sgonfiati nello studio pilota, mantenendoli totalmente collassati dalla preparazione dell'organo all'inizio della MV, il che ha reso difficile l'apertura dei polmoni alla MV e ha aumentato la possibilità di formazione di fistole. Quindi, abbiamo iniziato a bloccare l'OTC e a mantenere i polmoni gonfiati durante la dissezione fino a quando non è stata somministrata la SS. Successivamente, l'OTC è stato rilasciato, sgonfiato e collegato i polmoni al ventilatore meccanico per avviare l'ARM, ed è stata eseguita un'analisi della meccanica polmonare per dimostrare la curva di isteresi polmonare. Ciò non ha compromesso il reclutamento polmonare o l'analisi della meccanica polmonare perché i pazienti anestetizzati hanno atelettasia e ridotta compliance polmonare anche durante i MV 28,29,30,31.
Nello studio pilota è stata utilizzata una PEEP iniziale di 5 cm H2O e aumentata con incrementi di 5 cm H2O fino a 25 cm H2O32,33. Tuttavia, le pressioni di picco e plateau hanno raggiunto valori superiori a 40 e 30 cm H2O, rispettivamente, con formazione di fistole. Pertanto, è stato eseguito un graduale aumento degli incrementi di 2 cm H2O per analizzare meglio il comportamento delle pressioni nel tempo e per comprendere i limiti della PEEP nel nostro modello polmonare ex vivo. Non c'è stata alcuna differenza nella mortalità tra inflazione sostenuta e incrementale, ma l'inflazione incrementale è la più utilizzata e può facilitare l'analisi graduale della meccanica polmonare34. Per quanto riguarda l'uso della pressione negativa20,21, il modello è stato testato solo a pressione positiva perché i pazienti in MT sono sottoposti a pressione positiva. Non escludiamo l'uso della pressione negativa in futuro, ma richiederebbe modifiche alla cassa in acrilico.
La letteratura presenta alcuni modelli prodotti con un polmone di prova, pistoni e un modello ex vivo 13,14 che sono stati inseriti in scatole sigillate ermeticamente che simulavano la gabbia toracica. Il nostro modello è stato collocato in una scatola acrilica convenzionale, che, nonostante riduca la possibilità di applicare una pressione negativa, può facilitare la produzione del modello. Un altro modello prodotto per gli studi preclinici18 è simile al nostro, ma i polmoni erano posizionati orizzontalmente mentre i nostri erano mantenuti verticalmente, ricevendo l'azione della gravità senza il supporto degli organi e della gabbia toracica. Questi polmoni sono stati utilizzati durante gli esperimenti entro 48 ore dall'eutanasia 18,19,20,21,35. Il nostro modello è stato utilizzato per un totale di 120 ore, mantenendosi ad una temperatura di 2-8 °C durante le 24 ore dell'esperimento, mostrando i risultati positivi descritti nella sezione dei risultati rappresentativi.
Il divario nell'insegnamento e nella formazione non è stato affrontato in questo primo momento, ma il modello è efficace per l'analisi della meccanica polmonare e può essere utilizzato come strumento per la ricerca e l'insegnamento. Inoltre, non abbiamo mirato a studiare soluzioni di perfusione, ma nello stesso modo in cui abbiamo infuso SS nella fase 6.1, le soluzioni di perfusione e conservazione possono essere utilizzate, aprendo nuove possibilità per studi con lo stesso modello presentato.
Questa tecnica ha alcune limitazioni: 1) conoscenza dell'anatomia animale per garantire che i polmoni vengano rimossi correttamente; 2) il modello non è stato valutato oltre i cinque giorni; 3) il modello sembra essere appropriato per la ventilazione didattica ma non è stato testato in un contesto didattico; 4) è un modello animale, quindi è importante considerare i suoi limiti di applicabilità nell'uomo.
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Ringraziamo tutti i colleghi e i professionisti che hanno contribuito e sostenuto la costruzione di questo protocollo modello di polmone suino ex vivo .
Questo studio non aveva fonti di finanziamento.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.9% Saline solution | 2500ml | ||
| Anesthesia machine - Primus | Drager | REF 8603800-18 | Anesthesia work station used in the procedure |
| Aspirator | For blood aspiration from thorax | ||
| Bedside Monitor - Life Scope | Nihon Kohden | BSM-7363 | Multiparameter monitor used during the procedure |
| Bonney Tissue Forceps | Any tissue forceps is suitable | ||
| Disposable scalper, #23 | Any scalper is suitable | ||
| Disposable syringe needles, 18G x 1 1/2", 23G x 1" | BD | 302814 | Widely available |
| Disposable syringes, 10ml | Widely available | ||
| Electrosurgical unit - SS-501 | WEM | For cutting and coagulation during thorax incision | |
| Fentanyl | 10 mcg/kg bolus + 10 mcg/kg/hour continuous infusion | ||
| Finochietto retractor | Any finochietto retractor is suitable | ||
| heparin | 3ml | ||
| Infusion set | Any infusion set is suitable | ||
| Isoflurane | 1.5% | ||
| Kelly Forceps Curved | Any kelly forceps is suitable | ||
| Ketamine | 5mg/kg | ||
| Lactated Ringer solution | 500ml | ||
| Mechanical ventilator - Servo I | Maquet | REF 6449701 | Mechanical ventilator used in the procedure |
| Metzenbaum Scissor (Straight and curved) | Any metzenbaum scissor is suitable | ||
| Midazolam | 0.25mg/kg | ||
| Orotracheal intubation cannula, #6.5 | Rusch | 112282 | Widely available |
| Plexiglass | Custom made plexiglass box: 30x45x60cm | ||
| Polyester suture, 2-0 | Widely available | ||
| Potassium choride | 10 ml, 19.1% potassium chloride. | ||
| propofol | 5mg/kg | ||
| Three way stopcock | Widely available | ||
| Venous catheter, G20 x 1" | BD | 38183314 | Widely available |
Riferimenti
- Roberto, C., Carvalho, R., Toufen Jr, C., Franca, S. A. Mechanical Ventilation: Principles, graphic analysis and ventilation modalities. Jornal Brasileiro de Pneumologia. 33 (2), 54-55 (2007).
- Barbas, C. S. V., et al. Brazilian recommendations for mechanical ventilation 2013. Part I. Revista Brasileira de Terapia Intensiva. 26 (2), 89-121 (2014).
- Walter, J. M., Corbridge, T. C., Singer, B. D. Invasive mechanical ventilation. Southern Medical Journal. 111 (12), 746-753 (2018).
- Faustino, E. A. Concepts and monitoring of pulmonary mechanics in patients under ventilatory support in the intensive care unit. Revista Brasileira de Terapia Intensiva. 19 (2), 161-169 (2007).
- Holanda, M. A., Vasconcelos, R. S., Ferreira, J. C., Pinheiro, B. V. Patient-ventilator asynchrony. Jornal Brasileiro de Pneumologia. 44 (2), 321-333 (2018).
- Rezoagli, E., Laffey, J. G., Bellani, G. Monitoring lung injury severity and ventilation intensity during mechanical ventilation. Seminars in Respiratory and Critical Care Medicine. 43 (3), 346-368 (2022).
- Tallo, F. S. Evaluation of self-perception of mechanical ventilation knowledge among Brazilian final-year medical students, residents, and emergency physicians. Clinics. 72 (2), 65-70 (2017).
- Schroedl, C. J., et al. Impact of simulation-based mastery learning on resident skill managing mechanical ventilators. American Thoracic Society Scholar. 2 (1), 34-48 (2021).
- Wilcox, S. R., et al. Academic emergency medicine physicians' knowledge of mechanical ventilation. The Western Journal of Emergency Medicine. 17 (3), 271-279 (2016).
- Cox, C. E., et al. Effectiveness of medical resident education in mechanical ventilation. American Journal of Respiratory and Critical Care Medicine. 167 (1), 32-38 (2003).
- Keegan, R., Henderson, T., Brown, G. Use of the virtual ventilator, a screen-based computer simulation, to teach the principles of mechanical ventilation. Journal of Veterinary Medical Education. 36 (4), 436-443 (2009).
- Spadaro, S., et al. Simulation training for residents focused on mechanical ventilation: A randomized trial using mannequin-based versus computer-based simulation. Simulation in Healthcare. 12 (6), 349-355 (2017).
- Chase, J. G., Yuta, T., Mulligan, K. J., Shaw, G. M., Horn, B. A novel mechanical lung model of pulmonary diseases to assist with teaching and training. BMC Pulmonary Medicine. 6 (21), 1-11 (2006).
- Kuebler, W. M., Mertens, M., Pries, A. R. A two-component simulation model to teach respiratory mechanics. Advances in Physiology Education. 31 (2), 218-222 (2007).
- Heili-Frades, S., Peces-Barba, G., Rodríguez-Nieto, M. J. Design of a lung simulator for learning lung mechanics in mechanical ventilation. Archivos de Bronconeumología. 43 (12), 674-679 (2007).
- Ngo, C., Dahlmanns, S., Vollmer, T., Misgeld, B., Leonhardt, S. An object-oriented computational model to study cardiopulmonary hemodynamic interactions in humans. Computer Methods and Programs in Biomedicine. 159, 167-183 (2018).
- Lazzari, C. D., Genuini, I., Pisanelli, D. M., D'Ambrosi, A., Fedele, F. Interactive simulator for e-Learning environments: a teaching software for health care professionals. Biomedical Engineering Online. 13 (172), 1-18 (2014).
- Perinel, S., et al. Development of an ex vivo human-porcine respiratory model for preclinical studies. Scientific Reports. 7, 1-6 (2017).
- Aboelnazar, N. S., et al. Negative pressure ventilation decreases inflammation and lung edema during normothermic ex-vivo lung perfusion. The Journal of Heart and Lung Transplantation. 37 (4), 520-530 (2018).
- Sattari, S., et al. Introducing a custom-designed volume-pressure machine for novel measurements of whole lung organ viscoelasticity and direct comparisons between positive- and negative-pressure ventilation. Frontiers in Bioengineering and Biotechnology. 8, 1-12 (2020).
- Sattari, S., et al. Positive- and negative-pressure ventilation characterized by local and global pulmonary mechanics. American Journal of Respiratory and Critical Care Medicine. 207 (5), 577-586 (2023).
- Montigaud, Y., et al. Development of an ex vivo preclinical respiratory model of idiopathic pulmonary fibrosis for aerosol regional studies. Scientific Reports. 9 (1), 17949 (2019).
- Montigaud, Y., et al. Aerosol delivery during invasive mechanical ventilation: development of a preclinical ex vivo respiratory model for aerosol regional deposition. Scientific Reports. 9 (1), 17930 (2019).
- Montigaud, Y., et al. Development of an ex vivo respiratory pediatric model of bronchopulmonary dysplasia for aerosol deposition studies. Scientific Reports. 9 (1), 5720 (2019).
- Buchko, M. T., et al. A low-cost perfusate alternative for ex vivo. lung perfusion. transplantation proceedings. 52 (10), 2941-2946 (2020).
- Kondo, N. Development of an effective method utilizing fibrin glue to repair pleural defects in an ex-vivo pig model. Journal of Cardiothoracic Surgery. 15 (1), 110 (2020).
- Gasek, N., et al. Development of alginate and gelatin-based pleural and tracheal sealants. Acta Biomaterialia. 131, 222-235 (2021).
- Li, X., et al. Effects of individualized positive end-expiratory pressure combined with recruitment maneuver on intraoperative ventilation during abdominal surgery: a systematic review and network meta-analysis of randomized controlled trials. Journal of Anesthesia. 36 (2), 303-315 (2022).
- Hu, M. C., Yang, Y. L., Chen, T. T., Lee, C. I., Tam, K. W. T. Recruitment maneuvers to reduce pulmonary atelectasis after cardiac surgery: A meta-analysis of randomized trials. The Journal of Thoracic and Cardiovascular Surgery. 164 (1), 171-181 (2020).
- Hu, M. C., et al. Recruitment maneuvers in patients undergoing thoracic surgery: a meta-analysis. General Thoracic and Cardiovascular Surgery. 69 (12), 1553-1559 (2021).
- Zeng, C., Lagier, D., Lee, J. W., Melo, M. F. V. Perioperative pulmonary atelectasis: Part I. Biology and mechanisms. Anesthesiology. 136 (1), 181-205 (2022).
- Niman, E., et al. Lung recruitment after cardiac arrest during procurement of atelectatic donor lungs is a protective measure in lung transplantation. Journal of Thoracic Disease. 14 (8), 2802-2811 (2022).
- Calvo, R. N., et al. Comparison of the efficacy of two alveolar recruitment maneuvers in improving the lung mechanics and the degree of atelectasis in anesthetized healthy sheep. Research in Veterinary Science. 150 (5), 164-169 (2022).
- Pensier, J., et al. Effect of lung recruitment maneuver on oxygenation, physiological parameters and mortality in acute respiratory distress syndrome patients: a systematic review and meta-analysis. Intensive Care Medicine. 45 (12), 1691-1702 (2019).
- Mariano, C. A., Sattari, S., Quiros, K. A. M., Nelson, T. M., Eskandari, M. Examining lung mechanical strains as influenced by breathing volumes and rates using experimental digital image correlation. Respiratory Research. 23 (1), 92 (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon