Method Article
Manyetik Rezonans Rehberliğinde Yüksek Yoğunluklu Odaklanmış Ultrason Tarafından Üretilen Hipertermi: Bir Murin Rabdomiyosarkom Modelinde Uygulanabilir Bir Tedavi Yöntemi
Bu Makalede
Erratum Notice
Özet
Burada, rabdomiyosarkom fare modelinde sıcaklığa duyarlı lipozomlardan ilaç salınımını tetiklemek için manyetik rezonans rehberliğinde yüksek yoğunluklu odaklanmış ultrason tarafından üretilen kontrollü hipertermiyi kullanmak için bir protokol sunulmaktadır.
Özet
Manyetik rezonans rehberliğinde yüksek yoğunluklu odaklanmış ultrason (MRgHIFU), lokalize hipertermi üretmek için kurulmuş bir yöntemdir. Gerçek zamanlı görüntüleme ve akustik enerji modülasyonu göz önüne alındığında, bu modalite, tanımlanmış bir alanda hassas sıcaklık kontrolü sağlar. Termosensitif lipozomal taşıyıcılardan ilaçları serbest bırakmak için hipertermi üretimi gibi bu invaziv olmayan, iyonlaştırıcı olmayan teknoloji ile birçok termal uygulama araştırılmaktadır. Bu ilaçlar, doz sınırlayıcı sistemik yan etkiler, yani kardiyotoksisite nedeniyle hedeflenen salınımın istendiği doksorubisin gibi kemoterapileri içerebilir. Doksorubisin, çeşitli malign tümörlerin tedavisinde temel dayanaktır ve nükseden veya tekrarlayan rabdomiyosarkomda (RMS) yaygın olarak kullanılır. RMS, çocuklarda ve genç erişkinlerde en sık görülen solid yumuşak doku ekstrakraniyal tümörüdür. Agresif, multimodal tedaviye rağmen, RMS sağkalım oranları son 30 yıldır aynı kalmıştır. Bu karşılanmamış ihtiyacı karşılamak için bir çözüm araştırmak amacıyla, ilaç salınımı için hipertermi kaynağı olarak MRgHIFU kullanılarak, immün yetkin, sinjenik bir RMS fare modelinde termosensitif lipozomal doksorubisin (TLD) salınımını değerlendirmek üzere deneysel bir protokol geliştirilmiştir.
Giriş
Rabdomiyosarkom (RMS), en sık çocuklarda ve genç erişkinlerde görülen bir iskelet kası tümörüdür1. Lokalize hastalık genellikle kemoterapi, iyonlaştırıcı radyasyon ve cerrahi dahil olmak üzere multimodal tedavi ile tedavi edilir. Çoklu ilaç kemoterapi rejimlerinin kullanımı pediatrik hastalarda daha yaygındır ve yetişkin meslektaşlarına kıyasla daha iyi sonuçlar elde edilmiştir2; Bununla birlikte, devam eden araştırma çabalarına rağmen, 5 yıllık sağkalım oranı, hastalığın en agresif formunda yaklaşık% 30'da kalmaktadır 3,4. Kemoterapi bakım standardı, vinkristin, siklofosfamid ve aktinomisin D içeren çoklu ilaç rejimidir. Nüks veya tekrarlayan hastalık vakalarında, standart (serbest) doksorubisin (FD) ve ifosfamid1 dahil olmak üzere alternatif kemoterapiler kullanılır. Tüm bu kemoterapiler sistemik toksisiteye sahipken, doksorubisin kardiyotoksisitesiyaşam boyu doz sınırlaması 5-7 getirmektedir. Tümöre verilen ilacın miktarını arttırmak ve sistemik toksisiteyi en aza indirmek için, lipozomal kapsülleme de dahil olmak üzere alternatif formülasyonlar geliştirilmiştir. Bunlar, meme kanseri ve hepatosellüler karsinomun tedavisi için onaylanmış ısıya duyarlı olmayan doksorubisin veya klinik çalışmaları devam eden 8,9,10,11,12,13 ısıya duyarlı doksorubisin olabilir. Multi-veziküler lipozomlar ve ligand hedefli lipozomlar gibi lipozomal kapsüllü ilaçların verilmesi için alternatif yöntemler değerlendirilmiş ve tümörlerin tedavisi için umut vaat etmektedir9. Bu çalışmada, ısı ilavesi, ilaç salınımı14 de dahil olmak üzere çok faktörlü etkilere sahiptir. Manyetik rezonans rehberliğinde yüksek yoğunluklu odaklanmış ultrason (MRgHIFU) ve termosensitif lipozomal doksorubisin (TLD) ile oluşturulan hipertermi (HT) kombinasyonu, doz sınırlayıcı toksisiteyi en aza indirirken ve potansiyel olarak tümöre karşı bağışıklık tepkisini arttırırken, RMS'yi tedavi etmek için bu toksik ancak etkili ilacı kullanmak için yeni bir multimodal terapötik yaklaşımdır.
Doksorubisin, TLD'den >39 ° C, ortalama insan vücudu sıcaklığı olan 37 ° C'nin çok üzerinde, ancak doku hasarına veya ablasyona neden olacak kadar yüksek olmayan sıcaklıklarda hızla salınır; Bu, 43 ° C'de gerçekleşmeye başlar, ancak sıcaklıklar 60 ° C'ye yaklaştıkça daha hızlı gerçekleşir15. HT in vivo üretmek için lazerler, mikrodalgalar, radyofrekans ablasyon ve odaklanmış ultrason dahil olmak üzere çeşitli yöntemler kullanılmıştır ve bunların çoğu invaziv ısıtma yöntemleridir16. MRgHIFU, in situ hedef doku içinde hassas sıcaklık ayarlarını kolaylaştıran invaziv olmayan, iyonlaştırıcı olmayan bir ısıtma yöntemidir. Manyetik rezonans (MR) görüntüleme, tedavi boyunca dokunun termometri ölçümünü hesaplamak için bilgisayar yazılımının kullanılabileceği gerçek zamanlı görüntüleme sağlar; Daha sonra, bu veriler, istenen sıcaklık ayar noktası17'ye ulaşmak ve korumak için ultrason tedavisini gerçek zamanlı olarak kontrol etmek için kullanılabilir. MRgHIFU çeşitli doku tiplerinde test edilmiştir ve hafif HT'den ablasyona kadar çok çeşitli sıcaklık tedavileri için ve ayrıca ağrılı kemik metastazlarını başarılı bir şekilde tedavi etmek için klinik olarak kullanılabilir18. Ek olarak, HT'nin tümör sitotoksisitesine neden olduğu, protein ekspresyonunu modüle ettiği ve tümör mikroortamında bağışıklık tepkisini değiştirdiği gösterilmiştir 19,20,21,22. Bir çalışma, hafif HT'yi TLD ile birleştirdi, ardından sinerjik bir R1 sıçan modeli23'te MRgHIFU ile ablasyon, tümör çekirdeğinde nekroz ve periferiye ilaç verilmesi ile sonuçlandı. Geleneksel olarak, radyoterapi tümör hücrelerine zarar vermek ve lokal hastalık nüksünü azaltmak için yardımcı bir tedavi olarak kullanılmıştır. Bununla birlikte, kullanımı ömür boyu dozlama ve hedef dışı hasar1 ile sınırlıdır. Bu nedenle, HT, aynı toksisiteler veya sınırlamalar olmadan aynı etkilerden bazılarına neden olabileceği için benzersizdir.
RMS için preklinik hayvan modelleri, immün sistemi baskılanmış konakçılarda sinjenik immünokompetan modelleri ve hasta kaynaklı ksenogreftleri (PDX) içerir. İmmün sistemi baskılanmış modeller insan tümörlerinin büyümesine izin verirken, uygun tümör mikroçevresinden yoksundurlar ve immün yanıtı inceleme yeteneklerinde sınırlıdırlar24. FGFR4-aktive edici mutasyon, kötü prognoz için umut verici bir belirteçtir ve erişkin ve pediatrik RMS 1,25'te potansiyel bir terapötik hedeftir. Gladdy laboratuvarında geliştirilen sinjenik RMS modellerinde, tümörler, tümör26'ya doğuştan gelen ve adaptif immün yanıtlar geliştiren immünokompetan bir konakçıda büyüyebilirler. HT immün yanıtı etkilediğinden, murin immün yanıtındaki değişimin gözlenmesi bu tümör modelinin değerli bir avantajıdır. Hem FD'ye kıyasla TLD'ye tümör yanıtını hem de tümörün hem kemoterapi hem de HT'ye karşı immün yanıtındaki değişikliği test etmek için, bu çalışmanın odak noktası olan MRgHIFU ve TLD kullanarak sinjenik murin RMS tümörlerini in vivo olarak tedavi etmek için bir protokol geliştirilmiş ve kullanılmıştır.
Protokol
Araştırma, Fenogenomik Merkezi (TCP) ve Üniversite Sağlık Ağı (UHN) Hayvan Kaynakları Merkezi (ARC) hayvan araştırma tesislerinde denetleyici bir veteriner altında onaylanmış hayvan kullanım protokollerine sahip hayvan bakım komitelerine uygun olarak gerçekleştirilmiştir. MRgHIFU hariç, hayvanları içeren tüm prosedürler, hayvanların dış havaya veya duyarlı enfeksiyona maruz kalmasını en aza indirmek için biyolojik bir güvenlik kabininde (BSC) yapılmıştır.
1. Fare yetiştiriciliği
NOT: Pilot çalışmaya toplam 65 fare (B6.129S2-Trp53tm1Tyj/J suşu) dahil edildi (erkek: n = 23; dişi: n = 42). Hem erkek hem de dişi fareler 7-9 haftalıkken kullanıldı. Yavruları sütten kesildi ve genotiplendirildi ve deneyler için p53 heterozigot fareler kullanıldı.
- Üreme kafesleri oluşturmak için her erkek fareyle iki dişi fare barındırın. Yavrularının yaşlarını doğumdan itibaren sayın (doğum = gün 0).
- 10. günde, yavruları bir kulak çentiği ile tanımlayın. Hücre hattı enjeksiyonundan önce genotipleme için kuyruk kesikleri toplayın.
2. Fare genotipleme
- Ticari bir DNA ekstraksiyon kiti kullanarak toplanan 2 mm'lik kuyruk kırpıntılarından DNA'yı çıkarın (bkz.
- Bir spektrofotometre üzerinde 260-280 nm'de absorbansı ölçerek DNA konsantrasyonunu ve saflığını belirleyin (bakınız Malzeme Tablosu).
- Polimeraz zincir reaksiyonu (PCR) gerçekleştirin.
- Gerekli sayıda numune için 12.5:0.25:10.75 (μL) oranında ticari bir PCR karışımı (Taq polimeraz, dNTPS ve MgCl 2 içeren; bkz. Malzeme Tablosuna bakınız), astar ve dH2O içeren bir ana karışım oluşturun. Her PCR tüpüne 1 μL DNA örneği ekleyin ve PCR kontrolleri olarak dH2O, boş bir örnek (p53 mutasyonu için homozigot), bir heterozigot örnek (p53 mutasyonu için heterozigot) ve vahşi tip (normal p53 için homozigot) numune ekleyin.
- DNA içeren her PCR tüpüne ana karışımın 24 μL'sini ekleyin. DNA'yı ana karışım boyunca dağıtmak için her PCR tüpündeki çözeltiyi yukarı ve aşağı pipetleyin.
- Reaksiyon tüplerini bir termal döngüleyiciye yerleştirin ve aşağıdaki özelliklere göre çevrim yapın: 2 dakika boyunca 95 °C, 15 s için 40 °C 95 °C, 15 s için 60 °C ve 1 dakika boyunca 72 °C ve daha sonra jel üzerinde analiz edilmeye hazır olana kadar 4 °C'de tutun.
- PCR ürünlerini agaroz jel elektroforezi kullanarak analiz edin.
- TAE'deki agarozu ısıtarak ve çözünene kadar karıştırarak% 2'lik bir jel (50 mL 1x TAE ve 1 g agaroz) hazırlayın. Soğutulduğunda ve hala sıvı olduğunda, agaroza 2.5 μL DNA jel lekesi ekleyin ve karıştırın. Jeli taraklı bir jel kutusuna dökün. Jeli elektroforetik aparatın içine yerleştirin (bakınız Malzeme Tablosu) ve 1x TAE ile örtün.
- Jel üzerine 10 μL 1 kB DNA Merdiveni yükleyin. Her numuneden 12,5 μL yükleyin. Jeli 135 V'ta 25 dakika çalıştırın.
- Jeli, üreticinin talimatlarına göre bir jel görüntüleyicide kullanılan DNA jel boyası için uygun ayarları kullanarak görüntüleyin (bkz.
3. Tümör modeli hazırlama (Şekil 1)
- Enjeksiyon tarihinden 1 hafta önce M25FV24C hücre hattını (pasaj 12-15) tam büyüme ortamında (Dulbecco'nun Modifiye Kartal Ortamı [DMEM], katkı maddeleri ile: %10 FBS, %1 Penisilin/Streptomisin ve 2 mM L-alanil-L-glutamin dipeptid) 75 mL'lik bir şişede, 37 °C ve %5 CO2'de büyütün. Hücreler ~% 80 birleştikten sonra, ortamı aspire edin ve hücreleri 1x 5 mL Dulbecco'nun fosfat tamponlu salin (DPBS) ile yıkayın.
NOT: M25FV24C, pediatrik ve yetişkin RMS1,26'da gözlenen mutant FGFR4V550E'yi aşırı eksprese etmek için tasarlanmış bir murin hücre hattıdır. - Plakanın yanına 0.5 mL% 0.25 tripsin çözeltisi ekleyerek ve kabı oda sıcaklığında 2-3 dakika inkübe ederek hücreleri kaldırın. Hücreler ayrılmış göründüğünde, tripsini inaktive etmek için oda sıcaklığında 2.5 mL tam büyüme ortamı ekleyin. Bir hemositometre ve tripan mavisi dışlaması kullanarak canlı hücrelerin hücre konsantrasyonunu belirlemek için 10 μL'lik bir numune aliquot kullanın.
- Enjeksiyon için DPBS süspansiyonlu hücrelerin doğru hacmini hazırlayın ve 1,5 mL'lik bir mikrosantrifüj tüpüne yerleştirin: santrifüje hacim = (fare sayısı × fare başına hücre sayısı) / (hücre konsantrasyonu), burada fare sayısı = enjekte edilecek fareler + hata için 10 ekstra fare ve fare başına hücre sayısı = 104.
- 153 x g'de 5 dakika boyunca santrifüj. Hücre peletini, miyo-enjeksiyon tamponunun (F10 ortamı +% 0.5 FBS) uygun hacminde (fare başına 10 μL × fare sayısı) yeniden askıya alın ve fareleri bu süspansiyonun hazırlanmasından sonraki 1 saat içinde enjekte edin.
4. Kas içi hücre enjeksiyonu
NOT: M25FV24C hücreleri, 4 ila 6 haftalık farelerin sağ arka bacağına enjekte edilir. 4 haftada enjeksiyon, HT dispersiyonu için daha az çevre doku olduğu için tedavi edilmesi daha zor olabilecek bir tümöre sahip küçük bir fare üretir; 6 haftaya kadar beklemek daha büyük bir fare verir ve tümörü tedavi etmeyi kolaylaştırır.
- Hücrelerin çözelti içinde eşit olarak dağıtılmasına yardımcı olmak için aspirasyondan önce hücre süspansiyonunu birkaç kez ters çevirin. Bir mikrolitre şırınga kullanarak 10 μL'yi (104 hücreli) aspire edin (bkz. Fareyi fırçalayın; Kısıtlandıktan sonra, arka bacağın uzatılmasıyla kaudal uyluk kaslarına erişim sağlanabilir. Bacağınızı kesme makineleri kullanarak tıraş edin ve% 70 etanol ile silin.
- M25FV24C hücre süspansiyonunu (10 μL, 104 hücreli) 4-6 haftalık bir farenin sağ arka bacak uyluk kas yapısına, 26s G iğneli gaz geçirmez bir mikrolitre şırınga kullanarak enjekte edin.
NOT: İğne, siyatik sinire çarpmamaya özen gösterilerek femura paralel olarak diz doğru sokulmalıdır. Arka bacağın küçük kas kütlesi nedeniyle sadece iğnenin noktasını (yaklaşık 2 mm) yerleştirin. - Çözümü sabit bir hareketle uygulayın. İğneyi çıkarın ve kanamanın oluşmadığından emin olun. Fareyi ikinci bir kafese geri döndürün.
- Hayvanları günlük olarak değerlendirin ve palpasyon yoluyla tümör büyümesi için arka bacaklarını izleyin. Aşağıdaki erken uç noktalardan herhangi biriyle karşılaşılırsa fareleri karbondioksit kullanarak ötenazi yapın: çapı 1,5 cm'yi aşan tümör boyutu, tümör ülserasyonu veya sistemik hastalık belirtileri (piloereksiyon, kambur duruş, hareketsizlik veya yiyecek veya su alımının azalması).
5. Tarama MRI taraması
- Fareyi, pençe sıkma ile hareketin olmadığı bir seviyeye, aşağıdaki parametreler altında izofluran ile uyuşturun: 1.5 LPM'de% 4'lük bir odaya indükleyin, daha sonra MRI tarayıcı kızağındaki burun konisine aktarın ve 0.75 LPM'de% 1.5 -% 2 ile burun konisi üzerinde izofluran bakımına devam edin. Solunum monitörünü takın. Anestezi altındayken kuruluğu önlemek için gözlerde veteriner merhemi kullanın.
- MRI tarayıcısını kullanarak anestezi uygulanan fareyi görüntüleyin (bkz. T2 ağırlıklı görüntüde (Ax_Screen edinimi, Tablo 1), düzlem içi boyutları ve tümörün içinde göründüğü eksenel dilimlerin sayısını not edin. Ultrason dalgasının gireceği uyluğun femur ve lateral yüzeyine atıfta bulunarak tümörün yerini not edin.
NOT: Tümör, kas içinde karşı taraftan asimetrik olan hiperintens bir kitle olarak ortaya çıkar. Çoklu tedaviler için iyi bir başlangıç tümör boyutu, akut veya sağkalım çalışmaları için 2 mm x 2 mm x 2 mm'dir. Çok daha büyükse, tümör üç haftalık tedaviyi tamamlamadan önce bir boyut bitiş noktasına ulaşacağı için sadece akut çalışmalar için iyi olacaktır. HIFU tedavisi için dışlama kriterleri şunları içerir: femur etrafına sarılmış, femura çok yakın, farede çok arkada, femura medial, rektuma çok yakın. - Fareyi tarayıcıdan çıkarın ve bir taban çizgisi ağırlığı elde edin. Fareyi orta vücudundan ayaklarına kadar anestezi altında elektrikli tıraş makinesi ile tıraş edin.
NOT: İdeal olarak, tıraş tedaviden 1 gün önce yapılır, çünkü farenin tüy dökücü kremin daha verimli çalışmasını sağlayan tımar yapmasına izin verir. - Kafesin bir ucunun altında bir ısıtma yastığı kullanarak fareyi BSC'de kurtarın. Sternal yatmayı yeniden kazandığında fareyi kafesine geri döndürün.
6. Deney: HIFU tedavi günü hayvan hazırlığı
- Küçük delikli HIFU ( Malzeme Tablosuna bakınız) sistemini hazırlamak için, jeneratörü açın ve membran dönüştürücünün altına genişleyene kadar dönüştürücüyü yeterli miktarda deiyonize suyla doldurun, ancak fareyi sıkıştıracak kadar sağlam değil. Çözünmüş oksijeni ortamdan uzaklaştırmak için dönüştürücü devresindeki suyun gazını 30 dakika boyunca boşaltın.
- İlişkili bilgisayar sistemini hazırlayın.
- Kontrol bilgisayarını açın ve ethernet üzerinden HIFU jeneratörüne ve USB üzerinden termal prob ekranına bağlandığından emin olun. Yazılımı başlatın ve fareyi takmadan önce dönüştürücüyü barındırmak için Ana Sayfa'yı tıklatın.
- Fiberoptik termal probları kalibre edin: Temel oda sıcaklıklarını alın ve MRI odasındaki sıcaklık değişimini not edin. Manyetik alan kuvveti nedeniyle her prob için sıcaklık sürüklenmesinin büyüklüğüne dikkat edin. Tarama sırasında sıcaklık kalibrasyonu için sürüklenme tüpü sıcaklık probunu gadolinyum dolgulu bir cam tüpe yerleştirin ve sürüklenme tüpünü bantla sabitleyin.
NOT: Temel oda sıcaklığı (sürüklenme tüpü), yazılımdaki GUI'ye termometri parametresi olarak manuel olarak eklenir. Herhangi bir sıcaklık kaymasını tespit etmek için MR görüntüsündeki sürüklenme tüpü içinde bir ilgi alanı (ROI) ayarlanır ve termometri görüntülerini otomatik olarak düzeltir. - Enjekte edilecek ilacı 1 mL'lik bir şırıngaya çekin ve otomatik dağıtım pompasına yerleştirin (bkz. Otomatik dağıtım pompası üzerindeki manuel dağıtım düğmesine basarak ilaç hattı tamamen doldurana kadar farenin kuyruk damarı kateterine bağlanacak hattı astarlayın.
- Anestezi odasına transfer edilmeden önce kafeslerdeki fareleri ~ 20 dakika ısıtmak için bir ısı lambası kullanın.
NOT: Ön ısıtma, fare uyuşturulur uyuşturulmaz karşılaşılacak vazodilatasyonu teşvik eder ve kateter yerleştirilmesine yardımcı olur.
- Fareyi izofluran ile uyuşturun (indüksiyon: 1.5 LPM'de% 4; bakım: 0.75 LPM'de% 1.5 -% 2) ve bir burun konisine aktarın. Anestezi altında göz kırpma refleksinin olmaması nedeniyle hasarı önlemek için gözlere bir kornea kayganlaştırıcısı uygulayın.
- Tüm sağ arka bacak da dahil olmak üzere tıraş edilen bölgeye tüy dökücü krem uygulayın ve epilasyon için üreticinin talimatlarını izleyin.
NOT: BSC'deyken anestezi altında epilasyon sırasında termoregülasyona yardımcı olmak için fareyi bir ısı lambasının altına yerleştirin. - Tüy dökücü kremayı ılık suyla yıkadıktan sonra, fareyi dijital bir ölçekte tartın ve ilaç dozu için kayıt yapın.
- Fareyi MRI kızağındaki MRI uyumlu bir burun konisine getirin. MRG'ye hazırlanırken sıcak tutmak için farenin üzerine bir ısı lambası yerleştirin. Fareyi, tümör olmayan rulman tarafı aşağı ve tümör üstün, kızak üzerindeki 3D baskılı bir fare tutucunun içine gelecek şekilde lateral dekübit konumuna yerleştirin (Ek Şekil 1 ve Şekil 2). Tümörün uygun şekilde konumlandırıldığından emin olun (yani, bobinin merkezinde, yatay ve dikey olarak, ultrason dönüştürücü tarafından sıkıştırmayı hesaba katmak için fare tutucunun kenarlarının hemen üstündeki yükseklikle).
NOT: Gerekirse, farenin altına koymak için sıkıştırılmış bir ultrason jel pedi segmentini kesin, tutucunun altını kaplayın, tümörü tutucunun üstüne düzleştirmek için bir kalınlık ile. - Tutulmamış bacağı, farenin altında veya tümör bacağı bükülmüş olarak uzatarak tümör bacağından uzağa çekin. Ayakların tümörün ve ultrason ışın yolunun yakın alanında veya uzak alanında olmadığından emin olun. Kuyruk damarına kateter yerleştirilmesi için ısı lambasını kuyruktan 15 cm uzağa ısıtacak şekilde yerleştirin.
- Özofagus sıcaklık probunu yerleştirin.
- Özofagus probunu burun konisinden geçirin ve farenin boynunu ovalayın. Başını uzatarak ağzından doğrudan midesine doğru bir çizgi oluşturmak için fare burnunu yukarı doğru eğin. Termal probu dilin üzerinde fare yemek borusuna yaklaşık 0,5 cm kaydırın ve burun konisini farenin burnunun etrafına yerleştirin. Özofagus probunu ve burun konisini kızağın üstüne sabitleyin.
NOT: Trakeaya yanlış yerleştirilebileceğinden, yerleştirildikten hemen sonra solunum sıkıntısı belirtilerini izleyin.
- Özofagus probunu burun konisinden geçirin ve farenin boynunu ovalayın. Başını uzatarak ağzından doğrudan midesine doğru bir çizgi oluşturmak için fare burnunu yukarı doğru eğin. Termal probu dilin üzerinde fare yemek borusuna yaklaşık 0,5 cm kaydırın ve burun konisini farenin burnunun etrafına yerleştirin. Özofagus probunu ve burun konisini kızağın üstüne sabitleyin.
- Rektal sıcaklık probunu takın.
NOT: Rektal ve özofagus sıcaklık probları birbirlerinden 3 °C uzaklıkta olmalıdır. - Solunum monitörünü bağlantı kablosuyla farenin kafasına doğru yerleştirin, böylece ultrason dönüştürücüsünün yerleştirilmesine müdahale etmez. Bant ile sabitleyin.
- 27 G kelebek iğne kuyruk damarı kateterini, 20 μL ölü alan ve bant ile mikrotüplere bağlı bir lateral kuyruk damarına güvenli bir şekilde yerleştirin. Bantlamadan sonra, kateterin hala iyi kızardığından emin olun.
- Hazırlanan fare, fare kızağı, anestezi hattı, solunum hattı, kuyruk damarı kateteri ve termal prob kablolarını MRI tarayıcısına taşımak ve MRI kızak tutucusuna yerleştirmek için iki kişi kullanın.
- HIFU yazılımı ( Malzeme Tablosuna bakınız) operatörünün, ilk hizalama27 için görsel muayene yoluyla dönüştürücünün menisküsünü doğrudan tümör üzerinde hareket ettirmesini sağlayın. Tümörün üzerindeki tüysüz cilde göz yağlayıcısı veya gazdan arındırılmış ultrason jeli uygulayın ve HIFU dönüştürücüsünü tümör bölgesine bağlayın.
- İlaç dağıtım hattını otomatik pompadan kuyruk damarı kateterine bağlayın. Kuyruk damar hattındaki ve bağlantı hattındaki ölü alan miktarını hesaplayın. MRI rayları üzerindeki fare HIFU kızağını MRG'nin ortasına kaydırın.
- İlaç türüne ve konsantrasyonuna ve hayvanın ağırlığına bağlı olarak pompadaki ilaç infüzyonu miktarını ayarlayın ve ölü alan miktarını ekleyin. Pompayı 200 μL/dak infüzyon hızına ayarlayın.
NOT: Bu çalışmada, FD ve TLD 2 mg / mL konsantrasyonda ve 5 mg / kg vücut ağırlığı dozunda kullanılmıştır. - Temel termal prob sıcaklıklarını kaydedin.
- Hava konveksiyonlu ısıtma cihazını ( bakınız Malzeme Tablosu) en sıcak ayara yerleştirin. Üfleme havasını MRI deliğinin ortasındaki fareye doğru yönlendirin ve bantla sabitleyin. Isıtma cihazı daha sonra sonikasyon sırasında farenin aşırı ısınmasını önlemek için en düşük ayarına (32 ° C) döndürülecektir.
- Anket MR görüntülerini edinin (Ax_Loc, Sag_Loc; Tablo 1) derinlik dahil olmak üzere sonikasyon hedefleme için tümör yerini belirlemek için. HIFU yazılımını kullanarak görüntü üzerinde ölçülen istenen hareket mesafesini ekleyerek ve ardından hareket etmek için ok yönünü tıklatarak dönüştürücü konumunu uygun şekilde ayarlayın (Şekil 3A). Ayrıca sürüklenme tüpünün yerini de not edin. Gerektiğinde tekrarlayın.
- Test_Shot termometri edinimi sırasında kısa bir 5 s x 50 mV genlik sürekli 'test atışı' sonikasyonu gerçekleştirerek dönüştürücünün koronal düzlemdeki odak noktasının yerini belirleyin (Tablo 1).
- MR anket görüntülerini, HIFU yazılımı içindeki odak noktasının koronal görünümüyle hizalayın. Tümör lokalizasyonu için görüntüleri kemik yapısına ve rektuma göre gözden geçirin ve transdüser pozisyonunu gerekli görüldüğü şekilde gözden geçirin.
- Minimum hedef dışı ısıtma ile tümör hacminde eşit ve doğru ısıtma olup olmadığını doğrulamak için dokuz tekrarlı Therm görüntüleme sırasında test atışı sonikasyonunu tekrarlayın (Tablo 1). Dilim konumunu, dönüştürücü konumunu ve direksiyon derinliğini ayarlayın ve gerekli görülen şekilde tekrarlanan "test atışları" ile ısıtma performansını onaylayın.
- HIFU arıtma izleme yazılımını kullanarak, hareket edilecek mesafeyi ölçerek ve ardından programdaki ızgara koordinatlarını değiştirerek son ısıtma profili içinde termometri izleme için ROI'yi tanımlayın. Sürüklenme düzeltmesi için sürüklenme tüpünün etrafında bir ROI ayarlayın. Termometri ölçümleri için rektal prob sıcaklığına göre taban çizgisi sıcaklığını girin. HIFU sistemi, HIFU tedavisi sonikasyonunu başlatmak ve termometri izleme için kullanılır.
- Yazılımda 20 dakikalık hipertermi tedavi özelliklerini açın ve referans MR görüntüleri toplandıktan ve termometri başladıktan sonra sonikasyona başlayın.
- Dahili orantılı-bütünleştirici-türev (PID) denetleyici yazılımını kullanarak Therm görüntüleme sırasında (Tablo 1) 20 dakikalık bir işlem gerçekleştirin (Şekil 3B). ROI'deki sıcaklık istenen sıcaklığa (40 ° C) ısındıktan sonra, seçilen ilacı 1,5 dakikada enjekte edin.
- Tedavi boyunca çekirdek sıcaklığını izleyin. Tedavi sırasında rektal sıcaklık hızla artıyorsa, 10 veya 20 dakikalık tedavi süresi boyunca rektal ısınmayı önlemek için farenin yeniden konumlandırılması gerekebilir. Rektal sıcaklık >40 ° C'ye yükselirse tedaviyi durdurun.
7. Deney: Akut çalışmalar için fare modeli görüntüleme ve sonikasyon prosedürü
- Tedavinin tamamlanmasından sonra, fareyi MRI deliğinden çıkarın ve kuyruk damarı kateter yerleştirme bölgesinde hemostaz sağlayın. Fareyi BSC'ye aktarın ve devam eden anestezi için burun konisine yerleştirin.
- Fareyi sırtına, uzuvları tutulmuş ve kalbi açıkta kalacak şekilde mavi emici bir ped üzerine yerleştirin.
- Fareleri kardiyak ponksiyon yoluyla exsanguinasyon yoluyla ötenazi yapın ve ardından kalbin çıkarılması. Hemen kanı alın ve 10 dakika boyunca 10.621 x g'de plazma ayırma için santrifüj yapın.
- Nekropsi yapın ve organları analiz için gerektiği gibi saklayın. Organları sıvı azot içinde dondurun ve -80 ° C'de birkaç ay veya uzun süre sıvı azot tankında saklayın.
- Dokuz kat fazla (w/w) deiyonize su ekleyerek ve boncuk atan bir homojenizatör kullanarak dokuyu parçalayarak tümör dokusunu mekanik olarak homojenize edin. Sırasıyla 75 μL 300 mg/mL gümüş nitrat, 75 μL 10 mM sülfürik asit ve 2,5 mL 1:1 izopropanol:kloroform ekleyerek 600 μL homojenize dokudan doksorubisin ekstraktı edin. 20 dakika boyunca vorteks ve gece boyunca -20 ° C'de saklayın.
- Yüksek performanslı sıvı kromatografisi (HPLC) için numuneler hazırlamak üzere, çözeltiyi adım 7,5'ten itibaren 4.500 x g'de santrifüj edin, organik çözücü tabakasını çıkarın ve izopropanol:kloroformu bir azot gazı akışı altında kurutun. 100 μL 2:1 MeOH:H2O'da yeniden askıya alın. HPLC-MS/MS 28 kullanarak doksorubisin konsantrasyonunu ölçün.
8. Deney: Hayatta kalma çalışmaları için fare modeli görüntüleme ve sonikasyon prosedürü
NOT: Hayatta kalma çalışmaları için, HIFU tedavi günü hayvan hazırlama prosedürünü izleyin (adım 6.1 ila 6.25).
- Tedavinin tamamlanmasından sonra, iyileşmesine izin vermek için fareyi bir ısı lambasının altına yerleştirin ve sternal yatmayı geri kazanana kadar nefes almasını ve hareketini izleyin. Ardından, hayvanı kafesine geri döndürün.
NOT: Kafesin yarısının bir ısı lambası ile aynı hizada olduğundan emin olun, çünkü hayvanların termal regülasyonu anestezi ve HT tedavisinden etkilenir. - Fareleri günlük olarak davranış, beslenme düzenleri ve herhangi bir sıkıntı belirtisi için solunum hızı açısından izleyin.
- Art arda 3 hafta boyunca 6.1 ila 6.25 arasındaki adımları izleyerek haftada bir kez tedavi uygulayın.
- Haftada iki kez, tümör ölçümü için farelerin MRI görüntülemesini yapın. Tedavi sırasındaki haftalar boyunca, her hafta bir MRI taraması ve bir ultrason yapın. Tedavi tamamlandıktan sonra, iki haftada bir ultrason görüntüleme yapın.
- Bir dizi tedaviyi tamamladıktan 60 gün sonra veya insancıl bir son noktaya ulaşıldığında (tümör boyutu >1,5cm3 veya tümörden morbidite) fareyi ötenazi yapın, ardından tümörlü nekropsi ve analiz için organ çıkarılması.
Sonuçlar
MRgHIFU tarafından oluşturulan hipertermi protokolünü kullanarak, arka bacaktaki tümörler, tedavi süresince sürekli olarak istenen ayarlanan sıcaklığa ısıtılabildi (Şekil 4 , temsili bir tedaviyi göstermektedir, 10 veya 20 dakika, n = 65). Bir tedavinin başarılı olduğunu düşünmek için, ROI'nin tedavinin tamamı boyunca 39 ° C'nin üzerinde, tedavi boyunca <6 ° C varyasyonla ve hedef dışı dokunun ısıtılmadan tutulması gerekiyordu. Ek olarak, rektal prob veya başlangıç rektal sıcaklığına artı özofagus probu sıcaklığındaki değişime bağlı olarak çekirdek sıcaklığının 39 ° C'nin altında kalması gerekiyordu (Ek Şekil 2). MRgHIFU'nun sonikasyonu durdurulduktan sonra, tümör hızla temel sıcaklığa geri döndü.
Tümörler, 43 ° C'nin üzerindeki kümülatif sıcaklık etkilerinden kaçınırken, hızlı ilaç salınımı için bir sıcaklığa ulaşmak için 40.5 ° C'ye hedeflendi. Tedavi edilen tüm tümörlerde ROI'nin ortalama sıcaklığı 40.6 ° C (n = 65) idi ve 10. persentil vokseller arasında ortalama fark 4.3 ° C'dir. Ortalama sıcaklığın standart sapması, hem 10 hem de 20 dakikalık tedaviler için tedavi süresi boyunca 1.3 ° C idi (Şekil 5). Dahil etme kriterlerini karşılamaya yönelik tedavilerin başarı oranı, çalışma süresi boyunca% 11'den% 100'e belirgin şekilde iyileşmiştir (Şekil 6).
Tedavi protokolü optimize edildikten sonra, hipertermi süresi, normotermik (NT) farelere kıyasla ilaç salınım etkinliği açısından değerlendirildi. Daha ileri çalışmalar için optimal hipertermi tedavi süresini belirlemek için iki tedavi süresi test edildi: 10 dakika ve 20 dakika. Bu süreler, çekirdek normotermi ve tümör hipertermisinin tutarlı bir şekilde sürdürülmesinin fizibilitesi için seçildi. Tümörlerdeki doksorubisin miktarını değerlendirmek ve test edilen süreler arasındaki doksorubisin birikiminin farkını ölçmek için yüksek performanslı sıvı kromatografisi ve kütle spektrometresi (HPLC-MS) kullanıldı. 20 dakikalık HT + TLD ile tedavi edilen farelerde TLD 20 dakikalık NT farelere kıyasla 20 dakikalık ilk doz doksorubisin başlangıç dozunun (%ID) anlamlı derecede yüksek bir yüzdesi vardı (Şekil 7, q = 0.000108). 10 dk ve 20 dk HT + TLD grupları arasında anlamlı fark yoktu; Bununla birlikte, 10 dakikalık tedavi grubunda 20 dakikalık gruba kıyasla daha büyük bir standart sapma vardı (3.698'e karşı % 2.065 ID / g tümör). Özellikle, 10 dakikalık HT + TLD tedavi grubunda, hepsi tek bir TLD partisi ile tedavi edilen sıfıra yakın dört değer vardı. TLD, daha önce Dunne ve ark.28 tarafından tanımlandığı gibi, in vivo deneylerde kullanılmadan önce karakterize edilmiştir. Kısaca, TLD büyüklüğü, zeta potansiyeli, erime fazı geçiş sıcaklığı ve ilaç konsantrasyonu açısından karakterize edildi ve lipozomlar 4 ° C'de depolamadan sonraki 72 saat içinde kullanıldı. TLD'nin tüm partileri kullanımdan önce test edilmiş olsa da, lipozomların deneysel kurulum sırasında, kullanımdan önce doksorubisin salgılamış olmaları mümkündür. Ek olarak, tarama sırasındaki hareket, yazılımda yanlış şekilde yükseltilmiş sıcaklık hesaplamalarına neden olabilir, böylece tümörün az ısınmasına ve daha düşük ilaç salınımına neden olabilir. Alternatif olarak, ilaç hiç enjekte edilmemişse, örneğin kuyruk damarı kateteri çıkarılmış veya yanlış yerleştirilmişse, yanlış düşük değerlere de neden olabilir. Yukarıda görüldüğü gibi, MRG kızağının kurulumu, sıcaklık probu yerleştirme (rektal ve özofagus), kuyruk damarı kateteri yerleştirme ve solunum monitörü yerleştirme, ardından kızak, fare, kuyruk damarı kateteri, üç fiber optik sıcaklık probu, solunum monitörü ve anestezi hatlarının MRI deliğine taşınmasını içeriyordu. Bu işlem sırasında kuyruk damarı kateterinin yerinden çıkabileceği birden fazla zaman noktası vardır. Bu, hatta kan geri akışını kontrol ederek, kateter yerleştirme bölgesinden kanama ve tedaviden sonra bandın altında ilaç birikmesi ile kontrol edildi, ancak hata bir olasılık olmaya devam ediyor.
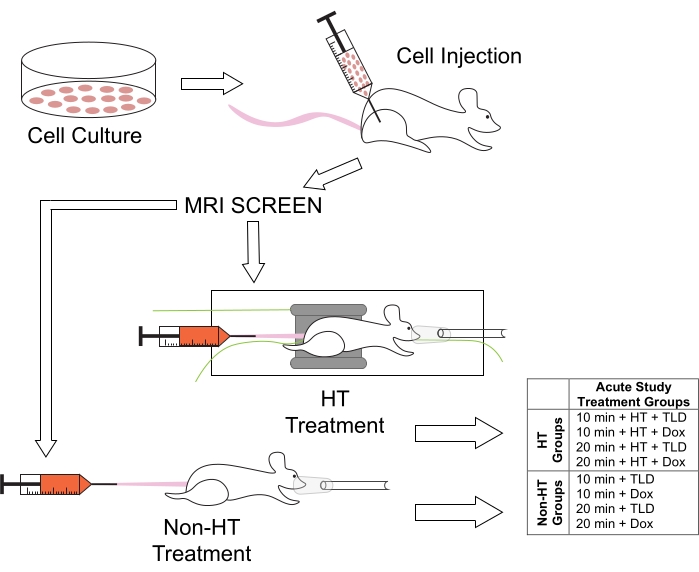
Şekil 1: HT süre çalışmaları için hayvan tedavileri ve ilişkili tedavi grupları için deneysel protokol. Farelere sağ arka bacaklarında M25FV24C hücreleri enjekte edildi ve 2-3 hafta sonra MRG kullanılarak tümör oluşumu açısından tarandı. Daha sonra normotermik (HT olmayan) veya hipertermik (HT) gruplara ayrıldılar, TLD veya FD 10 veya 20 dakikalık sürelerde kısaltıldı: Dox = Doksorubisin. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 2: HIFU tedavisi sırasında fare kurulumu . (A) İç kauçuk astarlı (kırmızı) 3D baskılı bir tutucu (beyaz) ve fare konumlandırması için ultrason ışını geçişine izin veren bir kesik. (B) Rektal sıcaklık tutma (yeşil kablo), kuyruk damarı kateteri (beyaz) ve solunum monitörü (mavi) olan 3D baskılı bir fare tutucu içinde fare kurulumu. (C) İşlem sırasında MRI HIFU yatağında fare pozisyonu. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
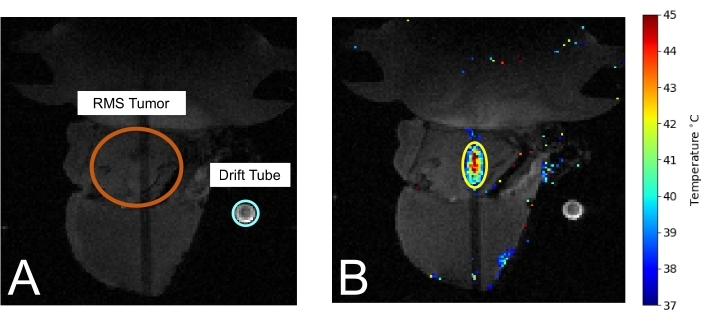
Şekil 3: MRIgHIFU tedavisi sırasında MRG'de fare. (A) Tümör (turuncu renkte daire içine alınmış) ve ortam sıcaklığını ölçmek için kullanılan sürüklenme tüpü (açık mavi renkte daire içine alınmış) görülebilir. (B) Tedavi sırasında, termometri sıcaklık ölçümü MRI görüntüsü üzerine bindirilir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
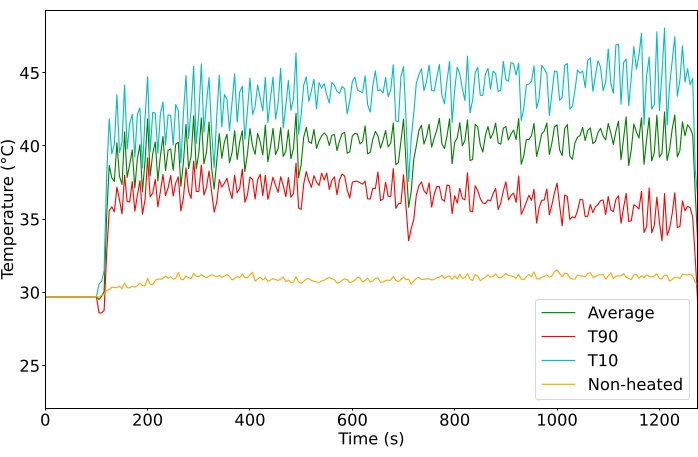
Şekil 4: Tedavi sırasında izlenen sıcaklık (°C). YG'deki tüm voksellerin ortalama (yeşil), ilk 10.yüzdelik dilim (kırmızı) ve en iyi 90. yüzdelik (camgöbeği) sıcaklıkları. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 5: Optimizasyon aşamasında test edilen her fare için ROI dahilinde tedavi sırasında ortalama sıcaklıklar ve tedavi sırasında standart sapma . Tedavi sırasında genel ortalama sıcaklık ve standart sapma da gösterilmiştir (turuncu). Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
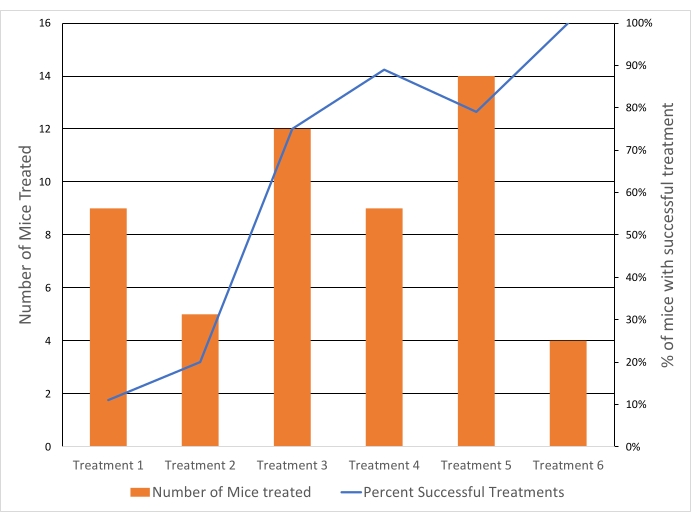
Şekil 6: Hipertermi tedavisinin başarı oranları zamanla iyileşmiştir. Tedavi başarısı dahil etme kriterlerine bağlıydı (sistemik sıcaklık, tümör sıcaklığı ve ROI ile varyasyon ve distal ısıtma olmaması). Mavi çizgi = Tedavinin başarılı olduğu farelerin% 'si. Turuncu çubuklar = HT ile tedavi edilen farelerin sayısı. Her tedavi (tedavi 1-6), deneylerin yapıldığı ayrı bir tarihi ifade eder. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 7: İlaç tedavisinden sonra tümördeki doksorubisin miktarı. (A) HPLC-MS sonuçlarının çoklu karşılaştırmaları için FDR düzeltmeli çoklu Mann-Whitney testleri, NT kontrolüne kıyasla 20 dakikalık TLD + HT grubundaki tümördeki doksorubisin miktarı arasında anlamlılık (q < 0.05) göstermektedir. (B) FD gruplarında tümörde fark görülmedi. %ID = başlangıç dozunun yüzdesi. = q < 0,0001. Kısaltmalar: HT = hipertermi, NT = normotermi. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
| Sıra Adı | Ax_Screen | Ax_Loc | Sag_Loc | Cor_TestShot | Therm |
| Sıra Türü | T2W NADİR | T2W NADİR | T2W NADİR | FLAŞ | FLAŞ |
| Yönelim | Eksenel | Eksenel | Sagittal | Koronal | Eksenel/Sagital |
| Yankı süresi (ms) | 40 | 72 | 72 | 6 | 6 |
| Tekrarlama süresi (ms) | 3200 | 4500 | 4500 | 39.06 | 39.06 |
| Çevirme açısı (derece) | 90/180 | 90/180 | 90/180 | 10 | 10 |
| Görüş alanı (mm) | 28,8 x 28,8 | 36 x 36 | 35 x 35 | 35 x 35 | |
| Matris boyutu | 128 x 128 | 128 x 128 | 128 x 128 | 128 x 128 | 128 x 128 |
| Çözünürlük (mm) | 0,225 x 0,225 | 0,281 x 0,281 | 0,281 x 0,281 | 0,273 x 0,273 | 0,273 x 0,273 |
| Dilim numarası | 20 | 20 | 20 | 3 | 2 |
| Dilim kalınlığı (mm) | 1 | 1 | 1 | 1.5 | 1.25 |
| # Ortalamalar | 3 | 1 | 1 | 1 | 1 |
| # Tekrarlar | 1 | 1 | 1 | 9 | 9 veya 300 |
| Tarama süresi | 4 dk 0 s | 1 dk 12 sn | 1 dk 12 sn | 45 sn | 25 dk |
Tablo 1: İlişkili dizi adlarıyla MRG yakalama parametreleri.
Ek Şekil 1: İç kauçuk astarlı (kırmızı) bir 3B model fare tutucu (beyaz). Boyutlar: uzunluk = 43 mm, dış yarıçap = 15 mm, iç genişlik = 20,7 mm. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 2: Tedavi sırasında izlenen sıcaklık (°C). Rektal (mavi) ve özofagus (turuncu) probları ile ölçülen çekirdek sıcaklığı. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Kodlama Dosyası 1: Fare tutucu için 3D baskı dosyası. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Burada geliştirilen protokol, hafif HT tedavisi için MRgHIFU kullanılarak arka ekstremite tümörlerini hedeflemek ve kapsüllenmiş ilaçları in vivo olarak lipozomlardan serbest bırakmak için kullanılmıştır. Pilot çalışma sırasında bu protokolde birkaç kritik adımla karşılaşıldı ve bu kritik adımların optimize edilmesi, pilot çalışmaya göre tedavi başarısının artmasını sağladı. Birincisi, sonikleştirilecek bölgedeki saçların tamamen çıkarılmasıdır. Kürk içinde sıkışan herhangi bir gaz, ultrason ışınının geçmesini önler ve hedef dokuya ultrason geçişini engeller1. İkincisi, fare konumlandırma başarılı bir tedavi için hayati öneme sahiptir; Tümör, ultrason dönüştürücüsü ile daha yakın temas halinde olması için fare tutucusuna üstün bir şekilde yerleştirilmelidir. Ek olarak, kemikli yapılar fareye zarar vermeden ultrason ışın yolunun dışına yerleştirilmelidir. Kemik, ultrason dalgalarını verimli bir şekilde emdiği ve daha sonra in situ bir ısıtma kaynağı olarak işlev gördüğü gösterilmiştir. İlgilenilen bölgeye ultrason iletimini engellerken ısıtma profilini etkileyebilir4. Kontralateral uzuv ayrıca, bacağı vücudun geri kalanının altına sıkıştırarak veya uzatarak ve bacaklar arasındaki havayı ultrason jeli veya bir jel ped ile doldurarak ultrason yolunun dışına yerleştirilmelidir. Rektum, hedef dışı ısıtmayı ve sıcaklık probundan yansımayı önlemek için ultrason yolunun dışında da olmalıdır. Dikkatli tümör pozisyonu, başarılı bir tedaviyi tamamlamanın en önemli adımıdır.
Doğru konumlandırmadan sonra, trakea tıkanıklığını önlemek için özofagus sıcaklık probunun yerleştirilmesi dikkatli bir şekilde yapılmalıdır. Fareyi MRI deliğine yerleştirirken, kuyruktaki kateter ile enjeksiyon pompası kateteri arasındaki metal bağlantı göbeği, artefakt oluşumunu önlemek için görüntüleme alanına distal bantla sabitlenmelidir. Ultrason dönüştürücü, bacağın kürksüz bölgesi ile temas halinde olacak ve solunum monitörünü yerinden etmeyecek şekilde yerleştirilmelidir. Tedavi sırasında farenin çekirdek vücut sıcaklığının dikkatli bir şekilde izlenmesi ve ardından konveksiyonlu ısıtma sisteminin ayarlanması, farenin hayatta kalması için gereklidir. Bazı farelerde rektumun ve tümörün yakınlığı nedeniyle, özofagus probunun eklenmesi, çekirdek sıcaklık değişimini belirlemek için önemliydi, çünkü rektal sıcaklık, çekirdek vücut ısıtmasının aksine yalnızca yerel ısıtmayı yansıtabiliyordu.
Bu protokolün tasarlanması ve uygulanmasında, kapsamlı sorun giderme işlemi multidisipliner bir ekip tarafından başarıyla yürütülmüştür. Fare konumlandırması için, prosedürel vücut ısısı ayarı için farenin etrafındaki ısıtılmış havanın akışına izin vermek için bir fare MRI kızağında kullanılmak üzere bir fare tutucu tasarlanmış ve 3D basılmıştır. Bu tutucunun malzemeleri, ultrason iletimine izin verirken fareyi güvenli bir şekilde tutma yeteneklerine göre seçildi. Basılı tutucunun içindeki kauçuk bir ek, bireysel fare ayarlamalarına izin verirken, alttaki kesim ultrason dalgası yansımasını ve istenmeyen ısıtmayı önledi.
Tümörlerin sırasıyla ultrason dalgalarını emebilen veya yansıtabilen yakındaki yapılara (kemik (femur) ve rektuma yakınlığı gibi modelle ilişkili sınırlamalar vardır. Femurun istemeden ısıtılması kemik iliği yıkımına ve ağrıya neden olabilirken, rektumdaki havadan ultrason yansıması lokal ısınmaya ve doku hasarına neden olabilir. Ek olarak, hayatta kalma farelerinde tedaviden sonra cildin yeniden büyümesi nedeniyle ultrason dalgasının sıkışması örnekleri vardı ve bu da cildin lokalize ısınmasına neden oldu. Bunun, dönüştürücü ve cilt arasındaki ultrason jeli ile yer değiştirmeyen saç folikülünün etrafında hava sıkışmasından kaynaklandığından şüphelenilmektedir. Her durumda, cilt çevreleyen tüysüz deriden daha koyu görünüyordu. Bu fare uzuvlarının immünohistokimya kesitlerinde, epidermisin içinde kıllar görüldü, ancak ultrasonun neden deri ve deri altı dokulardan geçemeyeceğine dair tümör fibrozu veya başka bir açıklama bulunamadı.
Bu protokolün geliştirilmesiyle birlikte, HT ve TLD ile tedavi için osteosarkom ve miksofibrosarkom gibi diğer pediatrik solid tümörleri test etmek için model sistemlerinin genişletilmesi için daha ileri çalışmalar planlanmaktadır. Bu hastalar bu klinik bağlamda sınırlı tedavi seçenekleriyle zayıflatıcı ağrı ile karşı karşıya kalabilecekleri için bu umut vericidir. Bu protokol, MRgHIFU29,30 ile hedeflenebilen ekstremitelerde bulunan diğer solid tümör tiplerine genişletilebilir. Sonuç olarak, veriler, ısıya duyarlı lipozomların kombinasyonunun, hedeflenen ilaç dağıtımının yararlı olacağı ve MRgHIFU gibi invaziv olmayan bir ısıtma biçimine sahip olmanın ideal olacağı diğer kemoterapi formlarını veya ilaçları kapsüllemek için ekstrapolasyona tabi tutulabileceğini desteklemektedir.
Açıklamalar
Yazarların açıklayacak finansal çıkarları veya çıkar çatışmaları yoktur.
Teşekkürler
Bu proje için finansman kaynaklarımızı ve C17 Araştırma Bursu, Kanada Yüksek Lisans Bursu, Ontario Öğrenci Fırsatı Güven Fonu ve James J. Hammond Fonu dahil olmak üzere ilgili personeli kabul etmek isteriz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1.5mL Eppendorf tubes | Eppendorf | 22363204 | |
| 1kb plus DNA Ladder | Froggabio | DM015-R500 | |
| 2x HS-Red Taq (PCR mix) | Wisent | 801-200-MM | |
| 7 Tesla MRI BioSpec | Bruker | T184931 | 70/30 BioSpec, Bruker, Ettlingen, Germany |
| C1000 Thermal cycler | Biorad | 1851148 | |
| Clippers | Whal Peanut | 8655 | |
| Compressed ultrasound gel | Aquaflex | HF54-004 | |
| Convection heating device | 3M Bair Hugger | 70200791401 | |
| Depiliatory cream | Nair | 61700222611 | Shopper's Drug Mart |
| DMEM | Wisent | 219-065-LK | |
| DNeasy extraction kit | Qiagen | 69504 | |
| DPBS | Wisent | 311-420-CL | |
| Drug injection system | Harvard Apparatus | PY2 70-2131 | PHD 22/2200 MRI compatible Syringe Pump |
| Eye lubricant | Optixcare | 50-218-8442 | |
| F10 Media | Wisent | 318-050-CL | |
| FBS | Wisent | 081-105 | |
| Froggarose | FroggaBio | A87 | |
| Gel Molecular Imager | BioRad | GelDocXR | |
| Glutamax | Wisent | 609-065-EL | |
| Heat Lamp | Morganville Scientific | HL0100 | Similar to this product |
| Intravascular Polyethylene tubing (0.015" ID x 0.043" OD, 20G) | SAI infusion | PE-20-100 | |
| Isoflurane | Sigma | 792632 | |
| M25FV24C Cell line | Gladdy Lab | N/A | |
| Microliter Syringe | Hamilton | 01-01-7648 | |
| Molecular Imager Gel Doc XR | Biorad | 170-8170 | |
| Mouse holder | The 3D printing material used was ABS-M30i, and it was printed on FDM Fortus 380mc machine | N/A | Dimensions: length = 43 mm, outer radius = 15 mm, inner width (where the mouse would sit) = 20.7 mm. |
| MyRun Machine | Cosmo Bio Co Ltd | CBJ-IMR-001-EX | |
| Nanodrop 8000 Spectrophotometer | Thermo Scientific | ND-8000-GL | |
| p53 primers | Eurofins | N/A | Custom Primers |
| PCR tubes | Diamed | SSI3131-06 | |
| Penicillin/Streptomycin | Wisent | 450-200-EL | |
| Proteus software | Pichardo lab | N/A | |
| Respiratory monitoring system | SAII | Model 1030 | MR-compatible monitoring and gating system for small animals |
| Small Bore HIFU device, LabFUS | Image Guided Therapy | N/A | LabFUS, Image Guided Therapy, Pessac, France Number of elements 8 frequency 2.5 MHz diameter 25 mm radius of curvature 20 mm Focal spot size 0.6 mm x 0.6 mm x 2.0 mm Motor: axes 2 Generator: Number of channels 8 Maximum electrical power/channel Wel 4 Maximum electrical power Wel 32 Bandwidth 0.5 - 5 MHz Control per channel: Freq., Phase and. amplitude Measurements per channel: Vrms, Irms, cos(theta) Duty Cycle at 100% power % 100% for 1 min. Transducer: Number of elements 8 frequency 2.5 MHz diameter 25 mm radius of curvature 20 mm Focal spot size 0.6 mm x 0.6 mm x 2.0 mm |
| SYBR Safe | ThermoFisher Scientific | S33102 | |
| TAE | Wisent | 811-540-FL | |
| Tail vein catheter (27G 0.5" ) | Terumo Medical Corp | 15253 | |
| Thermal probes | Rugged Monitoring | L201-08 | |
| Trypan blue | ThermoFisher Scientific | 15250061 | |
| Trypsin | Wisent | 325-052-EL | |
| Ultrasound Gel | Aquasonic | PLI 01-08 |
Referanslar
- Skapek, S. X., et al. Rhabdomyosarcoma. Nature Reviews Disease Primers. 5 (1), (2019).
- Ferrari, A., et al. Impact of rhabdomyosarcoma treatment modalities by age in a population-based setting. Journal of Adolescent and Young Adult Oncology. 10 (3), 309-315 (2021).
- . Pediatric rhabdomyosarcoma surgery: Background, anatomy, pathophysiology Available from: https://emedicine.medscape.com/article/939156-overview#a2 (2019)
- Ognjanovic, S., Linabery, A. M., Charbonneau, B., Ross, J. A. Trends in childhood rhabdomyosarcoma incidence and survival in the United States, 1975-2005. Cancer. 115 (18), 4218-4226 (2009).
- Mulrooney, D. A., et al. Cardiac outcomes in a cohort of adult survivors of childhood and adolescent cancer: retrospective analysis of the Childhood Cancer Survivor Study cohort. BMJ. 339, (2009).
- Lipshultz, S. E., Cochran, T. R., Franco, V. I., Miller, T. L. Treatment-related cardiotoxicity in survivors of childhood cancer. Nature Reviews Clinical Oncology. 10 (12), 697-710 (2013).
- Winter, S., Fasola, S., Brisse, H., Mosseri, V., Orbach, D. Relapse after localized rhabdomyosarcoma: Evaluation of the efficacy of second-line chemotherapy. Pediatric Blood & Cancer. 62 (11), 1935-1941 (2015).
- Wood, B. J., et al. Phase I study of heat-deployed liposomal doxorubicin during radiofrequency ablation for hepatic malignancies. Journal of Vascular and Interventional Radiology. 23 (2), 248-255 (2012).
- Bulbake, U., Doppalapudi, S., Kommineni, N., Khan, W. Liposomal formulations in clinical use: an updated review. Pharmaceutics. 9 (2), 12 (2017).
- Zagar, T. M., et al. Two phase I dose-escalation/pharmacokinetics studies of low temperature liposomal doxorubicin (LTLD) and mild local hyperthermia in heavily pretreated patients with local regionally recurrent breast cancer. International Journal of Hyperthermia. 30 (5), 285-294 (2014).
- . A phase I study of lyso-thermosensitive liposomal doxorubicin and MR-HIFU for pediatric refractory solid tumors Available from: https://clinicaltrials.gov/ct2/show/NCT02536183 (2019)
- PanDox: targeted doxorubicin in pancreatic tumours (PanDox). University of Oxford Available from: https://clinicaltrials.gov/ct2/show/NCT04852367 (2021)
- . Image-guided targeted doxorubicin delivery with hyperthermia to optimize loco-regional control in breast cancer (i-GO) Available from: https://clinicaltrials.gov/ct2/show/NCT03749850 (2018)
- De Vita, A., et al. Lysyl oxidase engineered lipid nanovesicles for the treatment of triple negative breast cancer. Scientific Reports. 11 (1), 5107 (2021).
- Sapareto, S. A., Dewey, W. C. Thermal dose determination in cancer therapy. International Journal of Radiation Oncology, Biology, Physics. 10 (6), 787-800 (1984).
- Kok, H. P., et al. Heating technology for malignant tumors: a review. International Journal of Hyperthermia. 37 (1), 711-741 (2020).
- Kokuryo, D., Kumamoto, E., Kuroda, K. Recent technological advancements in thermometry. Advanced Drug Delivery Reviews. 163, 19-39 (2020).
- Bongiovanni, A., et al. 3-T magnetic resonance-guided high-intensity focused ultrasound (3 T-MR-HIFU) for the treatment of pain from bone metastases of solid tumors. Support Care Cancer. 30 (7), 5737-5745 (2022).
- Seifert, G., et al. Regional hyperthermia combined with chemotherapy in paediatric, adolescent and young adult patients: current and future perspectives. Radiation Oncology. 11, 65 (2016).
- Dewhirst, M. W., Lee, C. -. T., Ashcraft, K. A. The future of biology in driving the field of hyperthermia. International Journal of Hyperthermia. 32 (1), 4-13 (2016).
- Dewhirst, M. W., Vujaskovic, Z., Jones, E., Thrall, D. Re-setting the biologic rationale for thermal therapy. International Journal of Hyperthermia. 21 (8), 779-790 (2005).
- Repasky, E. A., Evans, S. S., Dewhirst, M. W. Temperature matters! And why it should matter to tumor immunologists. Cancer Immunology Research. 1 (4), 210-216 (2013).
- Hijnen, N., et al. Thermal combination therapies for local drug delivery by magnetic resonance-guided high-intensity focused ultrasound. Proceedings of the National Academy of Sciences. 114 (24), E4802-E4811 (2017).
- Shultz, L. D., et al. Human cancer growth and therapy in immunodeficient mouse models. Cold Spring Harbor Protocols. 2014 (7), 694-708 (2014).
- De Vita, A., et al. Deciphering the genomic landscape and pharmacological profile of uncommon entities of adult rhabdomyosarcomas. International Journal of Molecular Sciences. 22 (21), 11564 (2021).
- McKinnon, T., et al. Functional screening of FGFR4-driven tumorigenesis identifies PI3K/mTOR inhibition as a therapeutic strategy in rhabdomyosarcoma. Oncogene. 37 (20), 2630-2644 (2018).
- Zaporzan, B., et al. MatMRI and MatHIFU: software toolboxes for real-time monitoring and control of MR-guided HIFU. Journal of Therapeutic Ultrasound. 1, (2013).
- Dunne, M., et al. Heat-activated drug delivery increases tumor accumulation of synergistic chemotherapies. Journal of Controlled Release. 308, 197-208 (2019).
- Zhao, Y. X., Hu, X. Y., Zhong, X., Shen, H., Yuan, Y. High-intensity focused ultrasound treatment as an alternative regimen for myxofibrosarcoma. Dermatologic Therapy. 34 (2), 14816 (2021).
- Vanni, S., et al. Myxofibrosarcoma landscape: diagnostic pitfalls, clinical management and future perspectives. Therapeutic Advances in Medical Oncology. 14, 17588359221093973 (2022).
Erratum
Formal Correction: Erratum: Magnetic Resonance-Guided High Intensity Focused Ultrasound Generated Hyperthermia: A Feasible Treatment Method in a Murine Rhabdomyosarcoma Model
Posted by JoVE Editors on 2/08/2023. Citeable Link.
An erratum was issued for: Magnetic Resonance-Guided High Intensity Focused Ultrasound Generated Hyperthermia: A Feasible Treatment Method in a Murine Rhabdomyosarcoma Model . The Authors section was updated from:
Claire Wunker1,2
Karolina Piorkowska3
Ben Keunen3
Yael Babichev2
Suzanne M. Wong3,4
Maximilian Regenold5
Michael Dunne5
Julia Nomikos1,2
Maryam Siddiqui6
Samuel Pichardo6
Warren Foltz7
Adam C. Waspe3,8
Justin T. Gerstle3,9
Rebecca A. Gladdy1,2,10
1 Institute of Medical Science, University of Toronto
2 2Lunenfeld-Tanenbaum Research Institute, Mount Sinai Hospital
3 The Wilfred and Joyce Posluns Centre for Image-Guided Innovation and Therapeutic Intervention, The Hospital for Sick Children
4 Institute of Biomedical Engineering, University of Toronto
5 Leslie Dan Faculty of Pharmacy, University of Toronto
6 Departments of Radiology and Clinical Neurosciences, University of Calgary
7 Department of Radiation Oncology, University of Toronto
8 Department of Medical Imaging, University of Toronto
9 Department of Pediatric Surgery, University of Toronto
10 Department of Surgery, University of Toronto
to:
Claire Wunker1,2
Karolina Piorkowska3
Ben Keunen3
Yael Babichev2
Suzanne M. Wong3,4
Maximilian Regenold5
Michael Dunne5
Julia Nomikos1,2
Maryam Siddiqui6
Samuel Pichardo6
Warren Foltz7
Adam C. Waspe3,8
Justin T. Gerstle3,9
James M. Drake1,3,4,10
Rebecca A. Gladdy1,2,10
1 Institute of Medical Science, University of Toronto
2 Lunenfeld-Tanenbaum Research Institute, Mount Sinai Hospital
3 The Wilfred and Joyce Posluns Centre for Image-Guided Innovation and Therapeutic Intervention, The Hospital for Sick Children
4 Institute of Biomedical Engineering, University of Toronto
5 Leslie Dan Faculty of Pharmacy, University of Toronto
6 Departments of Radiology and Clinical Neurosciences, University of Calgary
7 Department of Radiation Oncology, University of Toronto
8 Department of Medical Imaging, University of Toronto
9 Department of Pediatric Surgery, University of Toronto
10 Department of Surgery, University of Toronto
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır