Method Article
Hipertermia gerada por ultrassom focalizado de alta intensidade guiado por ressonância magnética: um método de tratamento viável em um modelo de rabdomiossarcoma murino
Neste Artigo
Erratum Notice
Resumo
Apresentamos aqui um protocolo para usar hipertermia controlada, gerada por ultrassom focalizado de alta intensidade guiado por ressonância magnética, para desencadear a liberação de drogas de lipossomas sensíveis à temperatura em um modelo de rabdomiossarcoma em camundongos.
Resumo
O ultrassom focalizado de alta intensidade guiado por ressonância magnética (MRgHIFU) é um método estabelecido para produzir hipertermia localizada. Dada a imagem em tempo real e a modulação da energia acústica, esta modalidade permite o controle preciso da temperatura dentro de uma área definida. Muitas aplicações térmicas estão sendo exploradas com essa tecnologia não invasiva e não ionizante, como a geração de hipertermia, para liberar fármacos de portadores lipossomais termossensíveis. Essas drogas podem incluir quimioterapias como a doxorrubicina, para as quais a liberação direcionada é desejada devido aos efeitos colaterais sistêmicos limitantes da dose, ou seja, cardiotoxicidade. A doxorrubicina é um pilar para o tratamento de uma variedade de tumores malignos e é comumente usada no rabdomiossarcoma (RMS) recidivante ou recorrente. RMS é o tumor extracraniano sólido de partes moles mais comum em crianças e adultos jovens. Apesar da terapia agressiva e multimodal, as taxas de sobrevida da RMS permaneceram as mesmas nos últimos 30 anos. Para explorar uma solução para atender a essa necessidade não atendida, um protocolo experimental foi desenvolvido para avaliar a liberação de doxorrubicina lipossomal termossensível (TLD) em um modelo de RMS singênico imunocompetente usando MRgHIFU como fonte de hipertermia para liberação de fármacos.
Introdução
O rabdomiossarcoma (RMS) é um tumor de músculo esquelético que ocorre mais comumente em crianças e adultosjovens1. A doença localizada é frequentemente tratada com tratamento multimodal, incluindo quimioterapia, radiação ionizante e cirurgia. O uso de esquemas quimioterápicos multidrogas é mais prevalente em pacientes pediátricos, com melhores resultados em comparação com seus pares adultos2; no entanto, apesar dos esforços de pesquisa em andamento, a taxa de sobrevida em 5 anos permanece em torno de 30% na forma mais agressiva da doença 3,4. O tratamento padrão de quimioterapia é um esquema multidrogas que inclui vincristina, ciclofosfamida e actinomicina D. Em casos de doença recidivante ou recorrente, quimioterapias alternativas são usadas, incluindo doxorrubicina (FD) padrão (livre) e ifosfamida1. Embora todas essas quimioterapias tenham toxicidade sistêmica, a cardiotoxicidade da doxorrubicina impõe uma limitação de dose por toda a vida 5-7. Para aumentar a quantidade de fármaco entregue ao tumor e minimizar a toxicidade sistêmica, formulações alternativas têm sido desenvolvidas, incluindo o encapsulamento lipossomal. Podem ser doxorrubicina não termossensível, aprovada para o tratamento de câncer de mama e carcinoma hepatocelular, ou doxorrubicina termossensível, cujos ensaios clínicos estão em andamento 8,9,10,11,12,13. Métodos alternativos para a administração de drogas lipossomais encapsuladas, como lipossomas multivesiculares e lipossomas direcionados por ligantes, têm sido avaliados e se mostram promissores para o tratamento detumores9. Neste estudo, a adição de calor tem impactos multifatoriais, incluindo a liberação do fármaco14. A combinação de hipertermia (HT) gerada com ultrassom focalizado de alta intensidade guiado por ressonância magnética (MRgHIFU) e doxorrubicina lipossomal termossensível (TLD) é uma nova abordagem terapêutica multimodal para o uso dessa droga tóxica, mas eficaz no tratamento da SMR, minimizando a toxicidade limitante da dose e potencialmente aumentando a resposta imune ao tumor.
A doxorrubicina liberta-se rapidamente de TLD a temperaturas >39 °C, muito acima da temperatura média do corpo humano de 37 °C, mas não suficientemente elevada para causar danos nos tecidos ou ablação; isso começa a ocorrer a 43 °C, mas ocorre mais rapidamente quando as temperaturas se aproximam de 60 °C15. Vários métodos têm sido utilizados para gerar TH in vivo, incluindo lasers, micro-ondas, ablação por radiofrequência e ultrassom focado, muitos dos quais são métodos invasivos de aquecimento16. MRgHIFU é um método de aquecimento não invasivo e não ionizante que facilita ajustes precisos de temperatura dentro do tecido alvo in situ. A ressonância magnética (RM) fornece imagens em tempo real, onde o software de computador pode ser usado, para calcular uma medida de termometria do tecido durante o tratamento; Posteriormente, esses dados podem ser utilizados para controlar a terapia ultrassônica em tempo real para atingir e manter um set point de temperaturadesejado17. O MRgHIFU tem sido testado em vários tipos de tecidos e pode ser usado para uma ampla gama de tratamentos de temperatura, desde TH leve até ablação, bem como clinicamente para tratar com sucesso metástases ósseas dolorosas18. Além disso, foi demonstrado que a TH causa citotoxicidade tumoral, modula a expressão proteica e altera a resposta imune no microambiente tumoral 19,20,21,22. Um estudo combinou TH leve com DTL, seguido de ablação com MRgHIFU, em um modelo sinérgico de R1 emratos23, resultando em necrose no núcleo do tumor e liberação da droga para a periferia. Tradicionalmente, a radioterapia tem sido usada como terapia adjuvante para danificar as células tumorais e diminuir a recorrência local da doença. No entanto, seu uso é limitado pela dosagem ao longo da vida e danos fora do alvo1. Assim, a HT é única na medida em que pode causar alguns dos mesmos efeitos sem as mesmas toxicidades ou limitações.
Modelos animais pré-clínicos para RMS incluem modelos imunocompetentes singênicos e xenoenxertos derivados de pacientes (PDX) em hospedeiros imunocomprometidos. Embora os modelos imunocomprometidos permitam o crescimento dos tumores humanos, eles não possuem o microambiente tumoral apropriado e são limitados em sua capacidade de estudar a resposta imune24. A mutação ativadora do FGFR4 é um marcador promissor de mau prognóstico e um potencial alvo terapêutico em RMS adulto e pediátrico 1,25. Nos modelos singênicos de RMS desenvolvidos no laboratório de Gladdy, os tumores são capazes de crescer em um hospedeiro imunocompetente, que desenvolve respostas imunes inatas e adaptativas aotumor26. Como a TH influencia a resposta imune, a observação da alteração na resposta imune murina é uma vantagem valiosa desse modelo tumoral. Para testar tanto a resposta tumoral ao TLD em comparação com a DF, quanto a mudança na resposta imune do tumor tanto à quimioterapia quanto à TH, um protocolo foi desenvolvido e empregado para tratar tumores RMS murinos singênicos in vivo usando MRgHIFU e TLD, que é o foco deste estudo.
Protocolo
A pesquisa foi realizada em conformidade com os comitês de cuidados com animais com protocolos de uso de animais aprovados sob um veterinário supervisor nas instalações de pesquisa animal do Centro de Fenogenômica (TCP) e do Centro de Recursos Animais (ARC) da University Health Network (UHN). Todos os procedimentos, exceto o MRgHIFU, envolvendo os animais foram realizados em um gabinete de segurança biológica (BSC) para minimizar a exposição dos animais ao ar externo ou infecção suscetível.
1. Criação de camundongos
NOTA: Um total de 65 camundongos (linhagem B6.129S2-Trp53tm1Tyj/J) foram incluídos no estudo piloto (macho: n = 23; fêmea: n = 42). Camundongos machos e fêmeas foram usados com 7-9 semanas de idade. Seus filhotes foram desmamados e genotipados, e os camundongos heterozigotos p53 foram utilizados para os experimentos.
- Abrigar dois camundongos fêmeas com cada camundongo macho para criar gaiolas de reprodução. Conte as idades de seus filhotes desde o nascimento (nascimento = dia 0).
- No dia 10, identifique os filhotes com um entalhe na orelha. Colete snips de cauda para genotipagem antes da injeção de linha celular.
2. Genotipagem em camundongos
- Extrair o DNA dos recortes de cauda de 2 mm coletados usando um kit comercial de extração de DNA (consulte a Tabela de Materiais), seguindo as instruções do fabricante.
- Determinar a concentração e pureza do ADN medindo a absorbância a 260-280 nm num espectrofotómetro (ver Tabela de Materiais).
- Realizar reação em cadeia da polimerase (PCR).
- Crie uma mistura mestre contendo uma mistura comercial de PCR (contendo Taq polimerase, dNTPS e MgCl 2; consulte Tabela de Materiais), primer e dH2 O em umaproporção de 12,5:0,25:10,75 (μL) para o número necessário de amostras. Adicionar 1 μL de amostra de DNA a cada tubo de PCR e incluir dH2O, uma amostra nula (homozigótica para a mutação p53), uma amostra heterozigótica (heterozigota para a mutação p53) e uma amostra selvagem (homozigota para p53 normal) como controles de PCR.
- Adicionar 24 μL da mistura principal a cada tubo de PCR contendo ADN. Pipetar a solução em cada tubo de PCR para cima e para baixo para distribuir o DNA por toda a mistura principal.
- Coloque os tubos de reação em um termociclador e cicle de acordo com as seguintes especificações: 95 °C por 2 min, 40 ciclos de 95 °C por 15 s, 60 °C por 15 s e 72 °C por 1 min, e depois mantenha a 4 °C até estar pronto para analisar no gel.
- Analisar os produtos de PCR usando eletroforese em gel de agarose.
- Preparar um gel a 2% (50 ml de 1x TAE e 1 g de agarose) aquecendo a agarose no TAE e misturando até dissolver. Quando arrefecer e ainda líquido, adicionar 2,5 μL de coloração de gel de ADN à agarose e misturar. Jogue o gel em uma caixa de gel com um pente. Coloque o gel no aparelho eletroforético (ver Tabela de Materiais) e cubra com 1x TAE.
- Carregar 10 μL de 1 kB DNA Ladder no gel. Carregar 12,5 μL de cada amostra. Passe o gel durante 25 minutos a 135 V.
- Imagem do gel usando as configurações apropriadas para a coloração de gel de DNA usada em um imageador de gel (consulte a Tabela de Materiais), de acordo com as instruções do fabricante.
3. Preparo do modelo tumoral (Figura 1)
- Cultivar a linhagem celular M25FV24C (passagem 12-15) 1 semana antes da data de injeção em meio de crescimento completo (Dulbecco's Modified Eagle Medium [DMEM] com aditivos: 10% FBS, 1% Penicilina/Estreptomicina e 2 mM L-alanil-L-glutamina dipeptídeo) em um frasco de 75 mL, a 37 °C e 5% CO2. Uma vez que as células estejam ~80% confluentes, aspirar o meio e lavar as células 1x com 5 mL de solução salina tamponada com fosfato (DPBS) de Dulbecco.
NOTA: M25FV24C é uma linhagem celular murina projetada para superexpressar o mutante FGFR4V550E, que é observado em RMS pediátrico e adulto 1,26. - Levantar as células adicionando 0,5 mL de solução de tripsina a 0,25% ao lado da placa e incubando o vaso por 2-3 min à temperatura ambiente. Uma vez que as células aparecem destacadas, adicionar 2,5 mL de meio de crescimento completo à temperatura ambiente para inativar a tripsina. Use uma alíquota de amostra de 10 μL para determinar a concentração celular de células viáveis usando um hemocitômetro e exclusão de azul de tripano.
- Prepare o volume correto de células suspensas em DPBS para injeção e coloque em um tubo de microcentrífuga de 1,5 mL: volume para centrífuga = (número de camundongos × número de células por camundongo)/ (concentração de células), onde o número de camundongos = os camundongos a serem injetados + 10 camundongos extras para erro, e o número de células por camundongo = 104.
- Centrifugar por 5 min a 153 x g. Ressuspender o pellet celular no volume apropriado (10 μL por camundongo × número de camundongos) de tampão de mioinjeção (meio F10 + 0,5% FBS) e injetar os camundongos dentro de 1 h após a preparação desta suspensão.
4. Injeção intramuscular de células
NOTA: As células M25FV24C são injetadas no membro posterior direito de camundongos entre 4 e 6 semanas de idade. A injeção em 4 semanas produz um pequeno camundongo com um tumor que pode ser mais difícil de tratar, pois há menos tecido circundante para dispersão de HT; esperar até 6 semanas rende um camundongo maior, facilitando o tratamento do tumor.
- Inverter a suspensão celular várias vezes antes da aspiração para ajudar a distribuir uniformemente as células dentro da solução. Aspirar 10 μL (104 células) utilizando uma seringa de microlitros (ver Tabela de Materiais). Aperte o rato; Uma vez contido, o acesso aos músculos caudais da coxa pode ser obtido estendendo a perna traseira. Faça a barba na perna usando cortadores e limpe com etanol 70%.
- Injetar a suspensão celular M25FV24C (10 μL, 10 4 células) na musculatura da coxa do membro posterior direito de um camundongo de4-6 semanas usando uma seringa de microlitro estanque ao gás com uma agulha G 26s.
NOTA: A agulha deve ser inserida paralelamente ao fêmur em direção ao joelho, tomando cuidado para não atingir o nervo ciático. Inserir apenas a ponta da agulha (aproximadamente 2 mm) devido à pequena massa muscular do membro posterior. - Administre a solução em movimento constante. Remova a agulha e certifique-se de que não ocorra sangramento. Retorne o mouse para uma segunda gaiola.
- Avaliar os animais diariamente e monitorar os membros pélvicos quanto ao crescimento do tumor através da palpação. Eutanasiar os camundongos usando dióxido de carbono se qualquer um dos seguintes desfechos iniciais for encontrado: tamanho do tumor superior a 1,5 cm de diâmetro, ulceração tumoral ou sinais sistêmicos de doença (piloereção, postura curvada, inatividade ou diminuição da ingestão de alimentos ou água).
5. Ressonância magnética de rastreamento
- Anestesiar o camundongo, até um nível em que não haja movimento com o aperto da pata, com isoflurano sob os seguintes parâmetros: induzir em uma câmara com 4% a 1,5 LPM, em seguida, transferir para o cone nasal no trenó do scanner de RM e continuar a manutenção do isoflurano no cone nasal com 1,5%-2% a 0,75 LPM. Conecte o monitor respiratório. Use pomada veterinária nos olhos para evitar o ressecamento durante a anestesia.
- Imagem do mouse anestesiado usando o scanner de ressonância magnética (ver Tabela de Materiais). Na imagem ponderada em T2 (aquisição Ax_Screen, Tabela 1), anote-se as dimensões no plano e o número de cortes axiais em que o tumor aparece. Observe a localização do tumor em referência ao fêmur e à face lateral da coxa, onde entraria a onda ultrassônica.
NOTA: O tumor aparece como uma massa hiperintensa dentro do músculo que é assimétrica do lado oposto. Um bom tamanho inicial do tumor para múltiplos tratamentos é de 2 mm x 2 mm x 2 mm para estudos agudos ou de sobrevida. Se for muito maior, só será bom para estudos agudos, pois o tumor atingirá um ponto final de tamanho antes de completar três tratamentos semanais. Os critérios de exclusão para o tratamento com HIFU incluem: enrolado ao redor do fêmur, muito perto do fêmur, muito posterior no camundongo, medial ao fêmur, muito perto do reto. - Remova o mouse do scanner e obtenha um peso basal. Faça a barba do rato do meio do corpo até os pés sob anestesia com um barbeador elétrico.
OBS: O ideal é que o barbear seja feito 1 dia antes do tratamento, pois permite que o mouse realize a tosa, o que permite que o creme depilatório funcione de forma mais eficiente. - Recupere o mouse no BSC, usando uma almofada de aquecimento sob uma extremidade da gaiola. Devolver o rato à sua gaiola quando recuperar o decúbito esternal.
6. Experimento: preparação animal do dia do tratamento de HIFU
- Para preparar o sistema HIFU (ver Tabela de Materiais) de pequeno furo, ligue o gerador e encha o transdutor com água deionizada suficiente até que a membrana seja expandida abaixo do transdutor, mas não tão firme a ponto de comprimir o mouse. Desgaseifique a água no circuito do transdutor por 30 min para remover o oxigênio dissolvido do meio.
- Prepare o sistema de computador associado.
- Ligue o computador de controle e certifique-se de que ele esteja conectado via ethernet ao gerador HIFU e via USB ao display da sonda térmica. Inicie o software e clique em Início para iniciar o transdutor antes de inserir o mouse.
- Calibrar as sondas térmicas de fibra óptica: Obtenha as temperaturas ambientes basais e observe a mudança de temperatura na sala de ressonância magnética. Observe a magnitude da deriva de temperatura para cada sonda devido à intensidade do campo magnético. Insira a sonda de temperatura do tubo de deriva em um tubo de vidro preenchido com gadolínio para calibração da temperatura durante a digitalização e prenda o tubo de deriva com fita adesiva.
NOTA: A temperatura ambiente basal (tubo de deriva) é adicionada manualmente como um parâmetro de termometria na GUI do software. Uma região de interesse (ROI) é definida dentro do tubo de deriva na imagem de RM para detectar qualquer desvio de temperatura e corrigirá automaticamente as imagens de termometria. - Retirar o medicamento a ser injetado em uma seringa de 1 mL e colocá-lo na bomba de entrega automática (ver Tabela de Materiais). Prima a linha que se conectará ao cateter da veia da cauda do mouse até que o medicamento tenha preenchido completamente a linha, pressionando o botão de entrega manual na bomba de entrega automática.
- Use uma lâmpada de calor para aquecer os ratos nas gaiolas por ~20 minutos antes de transferir para a câmara anestésica.
OBS: O pré-aquecimento promove vasodilatação, que será encontrada assim que o camundongo for anestesiado e auxilia na colocação do cateter.
- Anestesiar o camundongo com isoflurano (indução: 4% a 1,5 LPM; manutenção: 1,5%-2% a 0,75 LPM) e transferir para um cone nasal. Aplique um lubrificante corneano nos olhos para evitar danos devido à falta de reflexo de piscar sob anestesia.
- Aplique creme depilatório na área raspada, incluindo todo o membro posterior direito, e siga as instruções do fabricante para a depilação.
NOTA: Posicione o mouse sob uma lâmpada de calor enquanto estiver no BSC para ajudar na termorregulação durante a depilação sob anestesia. - Depois de lavar o creme depilatório com água morna, pesar o mouse em uma balança digital e registrar a dosagem do medicamento.
- Mova o mouse para um cone nasal compatível com ressonância magnética no trenó de ressonância magnética. Posicione uma lâmpada de calor no mouse para mantê-lo aquecido enquanto se prepara para a ressonância magnética. Coloque o camundongo em decúbito lateral com o suporte não tumoral para baixo e o tumor superior dentro de um suporte de mouse impresso em 3D no trenó (Figura 1 e Figura 2 suplementares). Garantir o posicionamento adequado do tumor (ou seja, no centro da bobina horizontal e verticalmente, com a altura logo acima das bordas do suporte do mouse para dar conta da compressão pelo transdutor de ultrassom).
NOTA: Se necessário, corte um segmento de almofada de gel de ultrassom comprimido para colocar sob o mouse, forrando a parte inferior do suporte, com uma espessura para nivelar o tumor à parte superior do suporte. - Empurre a perna não envolvida para longe da perna do tumor, sob o camundongo ou estendida com a perna do tumor flexionada. Certifique-se de que os pés não estão no campo próximo ou distante do tumor e no caminho do feixe de ultrassom. Posicione a lâmpada de calor a 15 cm da cauda para aquecer para inserção do cateter na veia caudal.
- Inserir a sonda de temperatura esofágica.
- Enfie a sonda esofágica através do cone nasal e raspe o pescoço do rato. Incline o nariz do rato para cima para criar uma linha da boca até ao estômago, estendendo a cabeça. Deslize a sonda térmica acima da língua cerca de 0,5 cm no esôfago do camundongo e substitua o cone nasal ao redor do nariz do camundongo. Fixe a sonda esofágica e o cone nasal na parte superior do trenó.
NOTA: Monitore sinais de desconforto respiratório imediatamente após a inserção, pois pode ser inserido incorretamente na traqueia.
- Enfie a sonda esofágica através do cone nasal e raspe o pescoço do rato. Incline o nariz do rato para cima para criar uma linha da boca até ao estômago, estendendo a cabeça. Deslize a sonda térmica acima da língua cerca de 0,5 cm no esôfago do camundongo e substitua o cone nasal ao redor do nariz do camundongo. Fixe a sonda esofágica e o cone nasal na parte superior do trenó.
- Insira a sonda de temperatura retal.
NOTA: As sondas de temperatura retal e esofágica devem estar a menos de 3 °C uma da outra. - Coloque o monitor respiratório com o cabo de conexão em direção à cabeça do mouse para que ele não interfira na colocação do transdutor de ultrassom. Proteja com fita.
- Insira um cateter de agulha de cauda com agulha de borboleta de 27 G em uma veia lateral da cauda conectada à microtubulação com 20 μL de espaço morto e fita adesiva com segurança. Após a gravagem, certifique-se de que o cateter ainda esteja lavando bem.
- Use duas pessoas para carregar o mouse preparado, o trenó do mouse, a linha de anestesia, a linha respiratória, o cateter da veia da cauda e os cordões da sonda térmica no scanner de ressonância magnética e coloque no suporte do trenó de ressonância magnética.
- Peça ao operador do software HIFU (ver Tabela de Materiais) que mova o menisco do transdutor diretamente sobre o tumor por inspeção visual para um alinhamento inicial27. Aplique lubrificante ocular ou gel de ultrassom desgaseificado na pele sem pelos acima do tumor e acople o transdutor HIFU à área do tumor.
- Conecte a linha de administração de medicamentos da bomba automática ao cateter da veia caudal. Calcule a quantidade de espaço morto na linha da veia caudal e na linha de conexão. Deslize o trenó HIFU do mouse nos trilhos da ressonância magnética para o centro da ressonância magnética.
- Defina a quantidade de infusão de drogas na bomba, dependendo do tipo e concentração do medicamento e do peso do animal, e adicione a quantidade de espaço morto. Ajustar a bomba a uma taxa de perfusão de 200 μL/min.
NOTA: Neste estudo, DF e TLD foram usados na concentração de 2 mg/mL e na dose de 5 mg/kg de peso corporal. - Registre as temperaturas basais da sonda térmica.
- Coloque o dispositivo de aquecimento por convecção de ar (consulte Tabela de Materiais) na configuração mais quente. Aponte o tubo que sopra o ar em direção ao mouse no centro do furo da ressonância magnética e prenda com fita adesiva. O dispositivo de aquecimento será posteriormente ligado à sua configuração mais baixa (32 °C) para evitar o superaquecimento do mouse durante a sonicação.
- Adquirir o levantamento de imagens de RM (Ax_Loc, Sag_Loc; Tabela 1) para determinar a localização do tumor para o alvo de sonicação, incluindo a profundidade. Ajuste a posição do transdutor de acordo com o software HIFU inserindo a distância de movimento desejada medida na imagem e, em seguida, clicando na direção da seta para se mover (Figura 3A). Observe também a localização do tubo de deriva. Repita conforme necessário.
- Determinar a localização do ponto focal do transdutor no plano coronal realizando uma breve sonicação contínua de "test shot" de 5 s x 50 mV de amplitude durante a aquisição da termometria Test_Shot (Tabela 1).
- Alinhe as imagens da pesquisa de RM com a visão coronal do ponto focal dentro do software HIFU. Revisar as imagens quanto à localização do tumor, em relação à estrutura óssea e ao reto, e revisar o posicionamento do transdutor quando necessário.
- Repetir a sonicação do tiro de teste durante a imagem de Therm de nove repetições (Tabela 1) para confirmar se há aquecimento uniforme e preciso no volume do tumor com aquecimento mínimo fora do alvo. Ajuste a localização da fatia, a localização do transdutor e a profundidade da direção e confirme o desempenho de aquecimento com "disparos de teste" repetidos, conforme necessário.
- Usando o software de monitoramento de tratamento HIFU, defina o ROI para o monitoramento de termometria dentro do perfil de aquecimento final, medindo a distância a ser movida e, em seguida, alterando as coordenadas da grade no programa. Defina um ROI ao redor do tubo de deriva para correção de deriva. Insira a temperatura basal com base na temperatura da sonda retal para medições de termometria. O sistema HIFU é usado para iniciar a sonicação do tratamento HIFU e para o monitoramento da termometria.
- Abra as especificações de tratamento de hipertermia de 20 minutos no software e inicie a sonicação assim que as imagens de RM de referência forem coletadas e a termometria começar.
- Execute um tratamento de 20 min (Figura 3B) durante a imagem Therm (Tabela 1) usando o software controlador integrado de derivada integrativa proporcional (PID). Injetar o fármaco selecionado em 1,5 min, após a temperatura na ROI aquecer para a temperatura desejada (40 °C).
- Monitorar a temperatura central durante todo o tratamento. Se a temperatura retal estiver aumentando rapidamente durante o tratamento, o reposicionamento do camundongo pode ser necessário para evitar o aquecimento retal durante os 10 ou 20 minutos de duração do tratamento. Interromper o tratamento se a temperatura retal aumentar para >40 °C.
7. Experimento: Procedimento de imagem e sonicação de modelo de camundongo para estudos agudos
- Após a conclusão do tratamento, remova o camundongo do furo da ressonância magnética, garantindo a hemostasia no local de inserção do cateter da veia caudal. Transfira o camundongo para o BSC e coloque no cone nasal para continuar a anestesia.
- Coloque o rato de costas sobre uma almofada absorvente azul com os membros contidos e o coração exposto.
- Eutanásia dos camundongos através de exsanguinação via punção cardíaca seguida de remoção do coração. Tome o sangue imediatamente e centrifuja para a separação do plasma a 10,621 x g durante 10 minutos.
- Realizar necropsia e armazenar os órgãos conforme necessário para análise. Congelar os órgãos em azoto líquido e armazenar a -80 °C durante vários meses ou a longo prazo num tanque de azoto líquido.
- Homogeneizar mecanicamente o tecido tumoral adicionando um excesso de nove vezes (p/p) de água deionizada e quebrando o tecido usando um homogeneizador batendo contas. Extrair doxorrubicina de 600 μL de tecido homogeneizado adicionando sequencialmente 75 μL de 300 mg/mL de nitrato de prata, 75 μL de ácido sulfúrico 10 mM e 2,5 mL de isopropanol:clorofórmio 1:1. Vórtice por 20 min e armazene a -20 °C durante a noite.
- Para preparar amostras para cromatografia líquida de alta eficiência (HPLC), centrifugar a solução da etapa 7.5 a 4.500 x g, remover a camada de solvente orgânico e secar o isopropanol:clorofórmio sob uma corrente de gás nitrogênio. Ressuspender em 100 μL de 2:1 MeOH:H2O. Medir a concentração de doxorrubicina usando HPLC-MS/MS28.
8. Experimento: Procedimento de imagem e sonicação de modelo de camundongo para estudos de sobrevivência
NOTA: Para estudos de sobrevivência, siga o procedimento de preparação do animal no dia do tratamento com HIFU (passo 6.1 a 6.25).
- Após a conclusão do tratamento, coloque o rato sob uma lâmpada de calor para permitir que ele se recupere e monitore sua respiração e movimento até que recupere o decúbito esternal. Em seguida, devolva o animal à sua gaiola.
NOTA: Certifique-se de que metade da gaiola esteja alinhada com uma lâmpada de calor, pois a regulação térmica dos animais é afetada pela anestesia e pelo tratamento HT. - Monitore os ratos diariamente quanto ao comportamento, padrões de alimentação e frequência respiratória em busca de quaisquer sinais de angústia.
- Realizar tratamentos uma vez por semana seguindo os passos 6.1 a 6.25 durante 3 semanas consecutivas.
- Duas vezes por semana, realizar imagens de ressonância magnética dos camundongos para medição do tumor. Durante as semanas durante o tratamento, realize uma ressonância magnética e uma ultrassonografia por semana. Após o término do tratamento, realizar ultrassonografia quinzenal.
- Eutanasiar o camundongo 60 dias após completar a série de tratamentos, ou quando um desfecho humano tiver sido atingido (tamanho do tumor >1,5 cm3 ou morbidade do tumor), seguido de necropsia com remoção do tumor e órgão para análise.
Resultados
Usando o protocolo de hipertermia gerada por MRgHIFU, os tumores no membro posterior foram capazes de ser consistentemente aquecidos até a temperatura desejada durante o tratamento (Figura 4 mostra um tratamento representativo, 10 ou 20 min, n = 65). Para considerar um tratamento bem-sucedido, a ROI teve que ser mantida acima de 39 °C durante todo o tratamento, com variação de <6 °C ao longo do tratamento e sem aquecimento do tecido fora do alvo. Além disso, a temperatura central deveria permanecer abaixo de 39 °C, com base na sonda retal ou na temperatura retal inicial mais a mudança na temperatura da sonda esofágica (Figura 2 suplementar). Uma vez interrompida a sonicação do MRgHIFU, o tumor retornou rapidamente à temperatura basal.
Os tumores foram direcionados a 40,5 °C para atingir uma temperatura de liberação rápida da droga, evitando efeitos cumulativos de temperatura acima de 43 °C. A temperatura média da ROI em todos os tumores tratados foi de 40,6 °C (n = 65), com uma diferença média entre os voxelsdo percentil 10 edo percentil 90 de 4,3 °C. O desvio padrão da temperatura média foi de 1,3 °C para a duração do tratamento, tanto para os tratamentos de 10 quanto para 20 min (Figura 5). A taxa de sucesso dos tratamentos para atender aos critérios de inclusão melhorou sensivelmente ao longo do estudo, de 11% para 100% (Figura 6).
Após a otimização do protocolo de tratamento, a duração da hipertermia foi avaliada quanto à eficácia da liberação do fármaco em comparação com camundongos normotérmicos (NT). Para determinar o tempo ideal de tratamento da hipertermia para estudos posteriores, duas durações de tratamento foram testadas: 10 min e 20 min. Essas durações foram selecionadas pela viabilidade de manter consistentemente a normotermia central e a hipertermia tumoral. Cromatografia líquida de alta eficiência e espectrometria de massas (HPLC-MS) foi utilizada para avaliar a quantidade de doxorrubicina nos tumores e quantificar a diferença de acúmulo de doxorrubicina entre as durações testadas. Houve uma porcentagem significativamente maior da dose inicial (%ID) de doxorrubicina nos tumores nos camundongos tratados com 20 min HT + TLD em comparação com os camundongos NT de 20 min de TLD (Figura 7, q = 0,000108). Não houve diferença significativa entre os grupos HT + DTL de 10 min e 20 min; no entanto, houve um desvio padrão maior no grupo de tratamento de 10 min em comparação com o grupo de 20 min (3,698 vs. 2,065 %ID/g de tumor). Notavelmente, houve quatro valores próximos de zero dentro do grupo de tratamento HT + TLD de 10 min, que foram todos tratados com um único lote de TLD. TLD foi caracterizado antes do uso em experimentos in vivo , como descrito anteriormente por Dunne et al.28. Resumidamente, TLD foi caracterizado em termos de tamanho, potencial zeta, temperatura de transição de fase de fusão e concentração do fármaco, e lipossomas foram usados dentro de 72 h de armazenamento a 4 °C. Embora todos os lotes de TLD tenham sido testados antes do uso, é possível que os lipossomas tenham liberado a doxorrubicina durante a montagem experimental, antes do uso. Além disso, o movimento durante o exame pode resultar em cálculos de temperatura falsamente elevados no software, subaquecendo o tumor e resultando em menor liberação da droga. Alternativamente, valores falsamente baixos também poderiam ser causados se a droga nunca fosse injetada, por exemplo, se o cateter da veia caudal tivesse sido removido ou colocado inadequadamente. Como visto acima, a configuração do trenó de RM incluiu a inserção de sonda de temperatura (retal e esofágica), inserção de cateter de veia caudal e colocação de monitor respiratório, seguido de movimentação do trenó, mouse, cateter da veia caudal, três sondas de temperatura de fibra óptica, monitor respiratório e linhas de anestesia para o furo da RM. Há vários pontos de tempo durante esse processo que o cateter da veia caudal pode se deslocar. Isso foi controlado verificando o refluxo de sangue na linha, sangramento do local de inserção do cateter e acúmulo de drogas sob a fita após o tratamento, mas o erro continua sendo uma possibilidade.
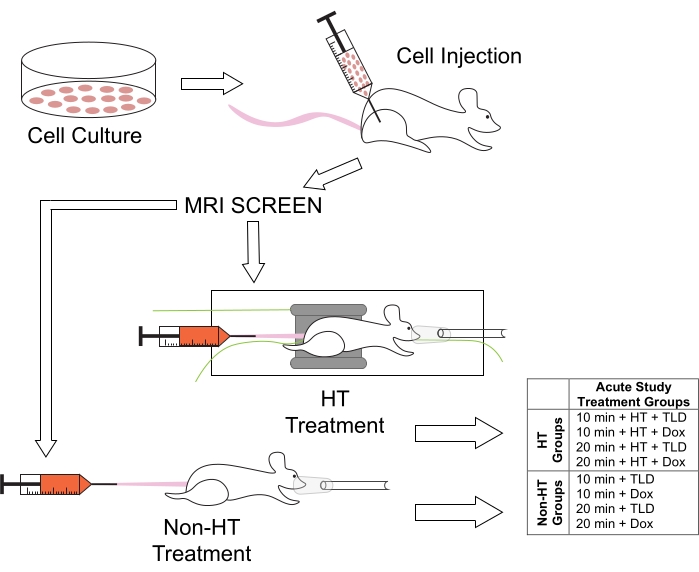
Figura 1: Protocolo experimental para tratamentos com animais e grupos de tratamento associados para os estudos de duração do TH. Os camundongos foram injetados com células M25FV24C em seu membro posterior direito, e foram triados para a formação de tumor usando RM após 2-3 semanas. Eles foram então divididos em grupos normotérmicos (Não-HT) ou hipertérmicos (HT), com DTL ou DF em durações de 10 ou 20 min. Abreviação: Dox = Doxorrubicina. Clique aqui para ver uma versão maior desta figura.

Figura 2: Configuração do mouse durante o tratamento com HIFU . (A) Um suporte impresso em 3D (branco) com forro interno de borracha (vermelho) e um recorte para permitir a passagem do feixe de ultrassom para o posicionamento do mouse. (B) Configuração do mouse dentro de um suporte de mouse impresso em 3D com um suporte de temperatura retal (cabo verde), cateter da veia caudal (branco) e monitor respiratório (azul). (C) Posicionamento do mouse no leito de RM HIFU durante o procedimento. Clique aqui para ver uma versão maior desta figura.
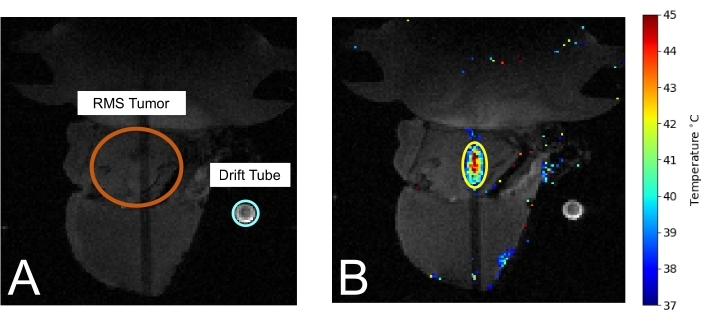
Figura 3: Camundongo na RM durante o tratamento com MRIgHIFU. (A) O tumor (circundado em laranja) e o tubo de deriva usado para medir a temperatura ambiente (circundado em azul claro) são visíveis. (B) Durante o tratamento, a medida da temperatura da termometria é sobreposta à imagem de RM. Clique aqui para ver uma versão maior desta figura.
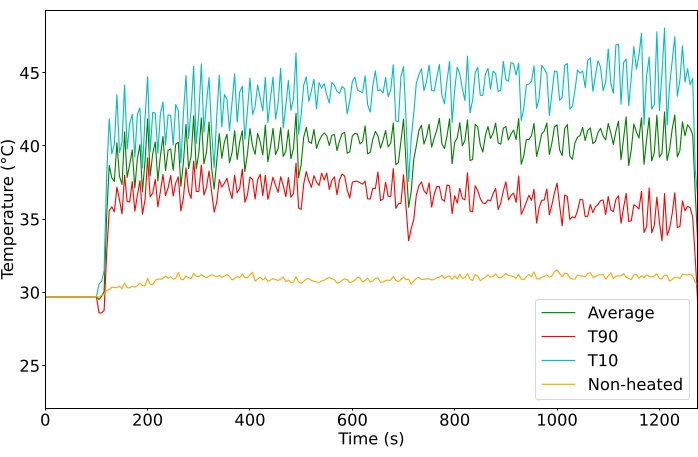
Figura 4: Temperatura (°C) monitorada durante o tratamento. Temperatura média (verde), do percentil 10superior (vermelho) e do percentil 90superior (ciano) de todos os voxels no ROI. Clique aqui para ver uma versão maior desta figura.

Figura 5: Temperaturas médias durante o tratamento dentro da ROI para cada camundongo testado durante a fase de otimização com o desvio padrão durante o tratamento. A temperatura média global e o desvio padrão durante o tratamento também são mostrados (laranja). Clique aqui para ver uma versão maior desta figura.
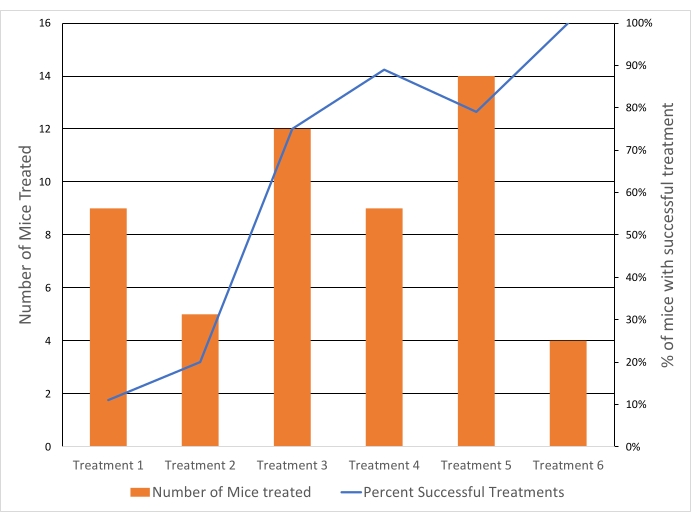
Figura 6: As taxas de sucesso do tratamento da hipertermia melhoraram ao longo do tempo. O sucesso do tratamento foi dependente dos critérios de inclusão (temperatura sistêmica, temperatura tumoral e variação com a ROI, e ausência de aquecimento distal). Linha azul = % de camundongos para os quais o tratamento foi bem-sucedido. Barras laranjas = número de camundongos tratados com HT. Cada tratamento (tratamento 1-6) refere-se a uma data separada em que os experimentos foram conduzidos. Clique aqui para ver uma versão maior desta figura.

Figura 7: Quantidade de doxorrubicina no tumor após tratamento medicamentoso. (A) Múltiplos testes de Mann-Whitney com correção de FDR para comparações múltiplas dos resultados de HPLC-MS demonstram significância (q < 0,05) entre a quantidade de doxorrubicina no tumor no grupo DTL + HT de 20 min em relação ao controle TN. (B) Não foram observadas diferenças no tumor nos grupos DF. %ID = porcentagem da dose inicial. = q < 0,0001. Abreviações: HT = hipertermia, NT = normotermia. Clique aqui para ver uma versão maior desta figura.
| Nome da sequência | Ax_Screen | Ax_Loc | Sag_Loc | Cor_TestShot | Terma |
| Tipo de sequência | TARE T2w | TARE T2w | TARE T2w | LAMPEJO | LAMPEJO |
| Orientação | Axial | Axial | Sagital | Coronal | Axial/Sagital |
| Tempo de eco (ms) | 40 | 72 | 72 | 6 | 6 |
| Tempo de repetição (ms) | 3200 | 4500 | 4500 | 39.06 | 39.06 |
| Ângulo de inversão (graus) | 90/180 | 90/180 | 90/180 | 10 | 10 |
| Campo de visão (mm) | 28,8 x 28,8 | De 36 a 36 anos | De 35 a 35 anos | De 35 a 35 anos | |
| Tamanho da matriz | De 128 a 128 anos | De 128 a 128 anos | De 128 a 128 anos | De 128 a 128 anos | De 128 a 128 anos |
| Resolução (mm) | 0,225 x 0,225 | 0,281 x 0,281 | 0,281 x 0,281 | 0,273 x 0,273 | 0,273 x 0,273 |
| Número da fatia | 20 | 20 | 20 | 3 | 2 |
| Espessura de corte (mm) | 1 | 1 | 1 | 1.5 | 1.25 |
| # Médias | 3 | 1 | 1 | 1 | 1 |
| # Repetições | 1 | 1 | 1 | 9 | 9 ou 300 |
| Tempo de varredura | 4 min 0 s | 1 min 12 s | 1 min 12 s | 45 s | 25 minutos |
Tabela 1: Parâmetros para captura de RM com nomes de sequências associados.
Figura suplementar 1: Um suporte de mouse modelo 3D (branco) com forro interno de borracha (vermelho). Dimensões: comprimento = 43 mm, raio externo = 15 mm, largura interna = 20,7 mm. Clique aqui para baixar este arquivo.
Figura suplementar 2: Temperatura (°C) monitorada durante o tratamento. Temperatura central medida por sondas retal (azul) e esofágica (laranja). Clique aqui para baixar este arquivo.
Arquivo de codificação suplementar 1: arquivo de impressão 3D para o suporte do mouse. Clique aqui para baixar este arquivo.
Discussão
O protocolo aqui desenvolvido foi utilizado para atingir tumores de membros pélvicos utilizando MRgHIFU para tratamento leve de TH e liberação de fármacos encapsulados de lipossomas in vivo. Várias etapas críticas foram encontradas nesse protocolo durante o estudo piloto, e a otimização dessas etapas críticas foi responsável pelo melhor sucesso do tratamento em relação ao estudo piloto. A primeira é a remoção completa dos pelos na área a ser sonicada. Qualquer aprisionamento de gás dentro da pele impede a passagem do feixe de ultrassom e bloqueia a passagem do ultrassom para o tecido alvo1. Em segundo lugar, o posicionamento do mouse é vital para o sucesso do tratamento; O tumor deve ser colocado superiormente no suporte do mouse para ficar em contato mais próximo com o transdutor de ultrassom. Além disso, as estruturas ósseas devem ser posicionadas fora do caminho do feixe de ultrassom sem ferir o camundongo. Foi demonstrado que o osso absorve as ondas de ultrassom de forma eficiente, atuando posteriormente como uma fonte de aquecimento in situ . Pode afetar o perfil de aquecimento enquanto bloqueia a transdução do ultrassom para a região de interesse4. O membro contralateral também deve ser colocado fora do caminho do ultrassom, seja enfiando a perna sob o resto do corpo ou estendendo-a e preenchendo o ar entre as pernas com gel de ultrassom ou uma almofada de gel. O reto também deve estar fora do caminho do ultrassom para evitar o aquecimento fora do alvo e a reflexão da sonda de temperatura. O posicionamento cuidadoso do tumor é o passo mais importante para completar um tratamento bem-sucedido.
Após o correto posicionamento, a colocação da sonda térmica esofágica deve ser realizada com cuidado para evitar a oclusão traqueal. Ao inserir o mouse no furo da RM, o hub de conexão de metal entre o cateter na cauda e o cateter da bomba de injeção deve ser fixado com fita distal à área da imagem para evitar a criação de artefatos. O transdutor de ultrassom deve ser colocado de forma que fique em contato com a área sem pelos da perna e não deslocando o monitor respiratório. Para a sobrevivência do rato, é necessário um cuidadoso controlo da temperatura corporal central do rato durante o tratamento e subsequente ajuste do sistema de aquecimento por convecção. Devido à proximidade do reto e do tumor em alguns camundongos, a adição da sonda esofágica foi importante para determinar a mudança da temperatura central, uma vez que a temperatura retal só poderia refletir o aquecimento local, em oposição ao aquecimento do núcleo corporal.
Na concepção e implementação deste protocolo, a solução de problemas extensiva foi executada com sucesso por uma equipe multidisciplinar. Para o posicionamento do mouse, um suporte de mouse foi projetado e impresso em 3D para uso em um trenó de RM de rato para permitir o fluxo do ar aquecido ao redor do mouse para ajuste intraprocedimento da temperatura corporal. Os materiais para este suporte foram escolhidos com base em sua capacidade de segurar o mouse com segurança, permitindo a transdução de ultrassom. Uma inserção de borracha dentro do suporte impresso permitia ajustes individuais do mouse, enquanto o recorte na parte inferior impedia a reflexão da onda de ultrassom e o aquecimento não intencional.
Existem limitações associadas ao modelo, como a proximidade dos tumores com estruturas próximas - osso (fêmur) e reto - que podem absorver ou refletir ondas de ultrassom, respectivamente. O aquecimento não intencional do fêmur pode resultar em destruição da medula óssea e dor, enquanto a reflexão do ultrassom do ar no reto pode causar aquecimento local e dano tecidual. Além disso, houve casos de aprisionamento da onda de ultrassom devido ao recrescimento da pele após o tratamento nos camundongos sobreviventes, causando aquecimento localizado da pele. Suspeita-se que isso se deva ao aprisionamento de ar ao redor do folículo piloso que não é deslocado com o gel de ultrassom entre o transdutor e a pele. Em cada caso, a pele parecia mais escura do que a pele sem pelos circundante. Nos cortes imunohistoquímicos desses membros de camundongos, pelos foram vistos dentro da epiderme, mas nenhuma fibrose tumoral ou outra explicação foi encontrada para que o ultrassom não pudesse passar através da pele e tecidos subcutâneos.
Com o desenvolvimento desse protocolo, novos estudos estão planejados para ampliar os sistemas modelo para testar outros tumores sólidos pediátricos, como osteossarcoma e mixofibrossarcoma, para tratamento com TH e TLD. Isso é promissor, pois esses pacientes podem enfrentar dor debilitante com opções limitadas de tratamento nesse contexto clínico. Este protocolo pode ser estendido a outros tipos de tumores sólidos localizados nas extremidades que são alvo do MRgHIFU29,30. Em conclusão, os dados suportam que a combinação de lipossomas termossensíveis pode ser extrapolada para encapsular outras formas de quimioterapia ou drogas onde a liberação de drogas direcionadas seria benéfica e ter uma forma não invasiva de aquecimento, como MRgHIFU, seria ideal.
Divulgações
Os autores não têm interesses financeiros ou conflitos de interesse a divulgar.
Agradecimentos
Gostaríamos de reconhecer nossas fontes de financiamento para este projeto e o pessoal envolvido, incluindo: C17 Research Grant, Canada Graduate Scholarship, Ontario Student Opportunity Trust Fund e James J. Hammond Fund.
Materiais
| Name | Company | Catalog Number | Comments |
| 1.5mL Eppendorf tubes | Eppendorf | 22363204 | |
| 1kb plus DNA Ladder | Froggabio | DM015-R500 | |
| 2x HS-Red Taq (PCR mix) | Wisent | 801-200-MM | |
| 7 Tesla MRI BioSpec | Bruker | T184931 | 70/30 BioSpec, Bruker, Ettlingen, Germany |
| C1000 Thermal cycler | Biorad | 1851148 | |
| Clippers | Whal Peanut | 8655 | |
| Compressed ultrasound gel | Aquaflex | HF54-004 | |
| Convection heating device | 3M Bair Hugger | 70200791401 | |
| Depiliatory cream | Nair | 61700222611 | Shopper's Drug Mart |
| DMEM | Wisent | 219-065-LK | |
| DNeasy extraction kit | Qiagen | 69504 | |
| DPBS | Wisent | 311-420-CL | |
| Drug injection system | Harvard Apparatus | PY2 70-2131 | PHD 22/2200 MRI compatible Syringe Pump |
| Eye lubricant | Optixcare | 50-218-8442 | |
| F10 Media | Wisent | 318-050-CL | |
| FBS | Wisent | 081-105 | |
| Froggarose | FroggaBio | A87 | |
| Gel Molecular Imager | BioRad | GelDocXR | |
| Glutamax | Wisent | 609-065-EL | |
| Heat Lamp | Morganville Scientific | HL0100 | Similar to this product |
| Intravascular Polyethylene tubing (0.015" ID x 0.043" OD, 20G) | SAI infusion | PE-20-100 | |
| Isoflurane | Sigma | 792632 | |
| M25FV24C Cell line | Gladdy Lab | N/A | |
| Microliter Syringe | Hamilton | 01-01-7648 | |
| Molecular Imager Gel Doc XR | Biorad | 170-8170 | |
| Mouse holder | The 3D printing material used was ABS-M30i, and it was printed on FDM Fortus 380mc machine | N/A | Dimensions: length = 43 mm, outer radius = 15 mm, inner width (where the mouse would sit) = 20.7 mm. |
| MyRun Machine | Cosmo Bio Co Ltd | CBJ-IMR-001-EX | |
| Nanodrop 8000 Spectrophotometer | Thermo Scientific | ND-8000-GL | |
| p53 primers | Eurofins | N/A | Custom Primers |
| PCR tubes | Diamed | SSI3131-06 | |
| Penicillin/Streptomycin | Wisent | 450-200-EL | |
| Proteus software | Pichardo lab | N/A | |
| Respiratory monitoring system | SAII | Model 1030 | MR-compatible monitoring and gating system for small animals |
| Small Bore HIFU device, LabFUS | Image Guided Therapy | N/A | LabFUS, Image Guided Therapy, Pessac, France Number of elements 8 frequency 2.5 MHz diameter 25 mm radius of curvature 20 mm Focal spot size 0.6 mm x 0.6 mm x 2.0 mm Motor: axes 2 Generator: Number of channels 8 Maximum electrical power/channel Wel 4 Maximum electrical power Wel 32 Bandwidth 0.5 - 5 MHz Control per channel: Freq., Phase and. amplitude Measurements per channel: Vrms, Irms, cos(theta) Duty Cycle at 100% power % 100% for 1 min. Transducer: Number of elements 8 frequency 2.5 MHz diameter 25 mm radius of curvature 20 mm Focal spot size 0.6 mm x 0.6 mm x 2.0 mm |
| SYBR Safe | ThermoFisher Scientific | S33102 | |
| TAE | Wisent | 811-540-FL | |
| Tail vein catheter (27G 0.5" ) | Terumo Medical Corp | 15253 | |
| Thermal probes | Rugged Monitoring | L201-08 | |
| Trypan blue | ThermoFisher Scientific | 15250061 | |
| Trypsin | Wisent | 325-052-EL | |
| Ultrasound Gel | Aquasonic | PLI 01-08 |
Referências
- Skapek, S. X., et al. Rhabdomyosarcoma. Nature Reviews Disease Primers. 5 (1), (2019).
- Ferrari, A., et al. Impact of rhabdomyosarcoma treatment modalities by age in a population-based setting. Journal of Adolescent and Young Adult Oncology. 10 (3), 309-315 (2021).
- . Pediatric rhabdomyosarcoma surgery: Background, anatomy, pathophysiology Available from: https://emedicine.medscape.com/article/939156-overview#a2 (2019)
- Ognjanovic, S., Linabery, A. M., Charbonneau, B., Ross, J. A. Trends in childhood rhabdomyosarcoma incidence and survival in the United States, 1975-2005. Cancer. 115 (18), 4218-4226 (2009).
- Mulrooney, D. A., et al. Cardiac outcomes in a cohort of adult survivors of childhood and adolescent cancer: retrospective analysis of the Childhood Cancer Survivor Study cohort. BMJ. 339, (2009).
- Lipshultz, S. E., Cochran, T. R., Franco, V. I., Miller, T. L. Treatment-related cardiotoxicity in survivors of childhood cancer. Nature Reviews Clinical Oncology. 10 (12), 697-710 (2013).
- Winter, S., Fasola, S., Brisse, H., Mosseri, V., Orbach, D. Relapse after localized rhabdomyosarcoma: Evaluation of the efficacy of second-line chemotherapy. Pediatric Blood & Cancer. 62 (11), 1935-1941 (2015).
- Wood, B. J., et al. Phase I study of heat-deployed liposomal doxorubicin during radiofrequency ablation for hepatic malignancies. Journal of Vascular and Interventional Radiology. 23 (2), 248-255 (2012).
- Bulbake, U., Doppalapudi, S., Kommineni, N., Khan, W. Liposomal formulations in clinical use: an updated review. Pharmaceutics. 9 (2), 12 (2017).
- Zagar, T. M., et al. Two phase I dose-escalation/pharmacokinetics studies of low temperature liposomal doxorubicin (LTLD) and mild local hyperthermia in heavily pretreated patients with local regionally recurrent breast cancer. International Journal of Hyperthermia. 30 (5), 285-294 (2014).
- . A phase I study of lyso-thermosensitive liposomal doxorubicin and MR-HIFU for pediatric refractory solid tumors Available from: https://clinicaltrials.gov/ct2/show/NCT02536183 (2019)
- PanDox: targeted doxorubicin in pancreatic tumours (PanDox). University of Oxford Available from: https://clinicaltrials.gov/ct2/show/NCT04852367 (2021)
- . Image-guided targeted doxorubicin delivery with hyperthermia to optimize loco-regional control in breast cancer (i-GO) Available from: https://clinicaltrials.gov/ct2/show/NCT03749850 (2018)
- De Vita, A., et al. Lysyl oxidase engineered lipid nanovesicles for the treatment of triple negative breast cancer. Scientific Reports. 11 (1), 5107 (2021).
- Sapareto, S. A., Dewey, W. C. Thermal dose determination in cancer therapy. International Journal of Radiation Oncology, Biology, Physics. 10 (6), 787-800 (1984).
- Kok, H. P., et al. Heating technology for malignant tumors: a review. International Journal of Hyperthermia. 37 (1), 711-741 (2020).
- Kokuryo, D., Kumamoto, E., Kuroda, K. Recent technological advancements in thermometry. Advanced Drug Delivery Reviews. 163, 19-39 (2020).
- Bongiovanni, A., et al. 3-T magnetic resonance-guided high-intensity focused ultrasound (3 T-MR-HIFU) for the treatment of pain from bone metastases of solid tumors. Support Care Cancer. 30 (7), 5737-5745 (2022).
- Seifert, G., et al. Regional hyperthermia combined with chemotherapy in paediatric, adolescent and young adult patients: current and future perspectives. Radiation Oncology. 11, 65 (2016).
- Dewhirst, M. W., Lee, C. -. T., Ashcraft, K. A. The future of biology in driving the field of hyperthermia. International Journal of Hyperthermia. 32 (1), 4-13 (2016).
- Dewhirst, M. W., Vujaskovic, Z., Jones, E., Thrall, D. Re-setting the biologic rationale for thermal therapy. International Journal of Hyperthermia. 21 (8), 779-790 (2005).
- Repasky, E. A., Evans, S. S., Dewhirst, M. W. Temperature matters! And why it should matter to tumor immunologists. Cancer Immunology Research. 1 (4), 210-216 (2013).
- Hijnen, N., et al. Thermal combination therapies for local drug delivery by magnetic resonance-guided high-intensity focused ultrasound. Proceedings of the National Academy of Sciences. 114 (24), E4802-E4811 (2017).
- Shultz, L. D., et al. Human cancer growth and therapy in immunodeficient mouse models. Cold Spring Harbor Protocols. 2014 (7), 694-708 (2014).
- De Vita, A., et al. Deciphering the genomic landscape and pharmacological profile of uncommon entities of adult rhabdomyosarcomas. International Journal of Molecular Sciences. 22 (21), 11564 (2021).
- McKinnon, T., et al. Functional screening of FGFR4-driven tumorigenesis identifies PI3K/mTOR inhibition as a therapeutic strategy in rhabdomyosarcoma. Oncogene. 37 (20), 2630-2644 (2018).
- Zaporzan, B., et al. MatMRI and MatHIFU: software toolboxes for real-time monitoring and control of MR-guided HIFU. Journal of Therapeutic Ultrasound. 1, (2013).
- Dunne, M., et al. Heat-activated drug delivery increases tumor accumulation of synergistic chemotherapies. Journal of Controlled Release. 308, 197-208 (2019).
- Zhao, Y. X., Hu, X. Y., Zhong, X., Shen, H., Yuan, Y. High-intensity focused ultrasound treatment as an alternative regimen for myxofibrosarcoma. Dermatologic Therapy. 34 (2), 14816 (2021).
- Vanni, S., et al. Myxofibrosarcoma landscape: diagnostic pitfalls, clinical management and future perspectives. Therapeutic Advances in Medical Oncology. 14, 17588359221093973 (2022).
Erratum
Formal Correction: Erratum: Magnetic Resonance-Guided High Intensity Focused Ultrasound Generated Hyperthermia: A Feasible Treatment Method in a Murine Rhabdomyosarcoma Model
Posted by JoVE Editors on 2/08/2023. Citeable Link.
An erratum was issued for: Magnetic Resonance-Guided High Intensity Focused Ultrasound Generated Hyperthermia: A Feasible Treatment Method in a Murine Rhabdomyosarcoma Model . The Authors section was updated from:
Claire Wunker1,2
Karolina Piorkowska3
Ben Keunen3
Yael Babichev2
Suzanne M. Wong3,4
Maximilian Regenold5
Michael Dunne5
Julia Nomikos1,2
Maryam Siddiqui6
Samuel Pichardo6
Warren Foltz7
Adam C. Waspe3,8
Justin T. Gerstle3,9
Rebecca A. Gladdy1,2,10
1 Institute of Medical Science, University of Toronto
2 2Lunenfeld-Tanenbaum Research Institute, Mount Sinai Hospital
3 The Wilfred and Joyce Posluns Centre for Image-Guided Innovation and Therapeutic Intervention, The Hospital for Sick Children
4 Institute of Biomedical Engineering, University of Toronto
5 Leslie Dan Faculty of Pharmacy, University of Toronto
6 Departments of Radiology and Clinical Neurosciences, University of Calgary
7 Department of Radiation Oncology, University of Toronto
8 Department of Medical Imaging, University of Toronto
9 Department of Pediatric Surgery, University of Toronto
10 Department of Surgery, University of Toronto
to:
Claire Wunker1,2
Karolina Piorkowska3
Ben Keunen3
Yael Babichev2
Suzanne M. Wong3,4
Maximilian Regenold5
Michael Dunne5
Julia Nomikos1,2
Maryam Siddiqui6
Samuel Pichardo6
Warren Foltz7
Adam C. Waspe3,8
Justin T. Gerstle3,9
James M. Drake1,3,4,10
Rebecca A. Gladdy1,2,10
1 Institute of Medical Science, University of Toronto
2 Lunenfeld-Tanenbaum Research Institute, Mount Sinai Hospital
3 The Wilfred and Joyce Posluns Centre for Image-Guided Innovation and Therapeutic Intervention, The Hospital for Sick Children
4 Institute of Biomedical Engineering, University of Toronto
5 Leslie Dan Faculty of Pharmacy, University of Toronto
6 Departments of Radiology and Clinical Neurosciences, University of Calgary
7 Department of Radiation Oncology, University of Toronto
8 Department of Medical Imaging, University of Toronto
9 Department of Pediatric Surgery, University of Toronto
10 Department of Surgery, University of Toronto
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados