Method Article
Ipertermia generata da ultrasuoni focalizzati ad alta intensità guidata da risonanza magnetica: un metodo di trattamento fattibile in un modello di rabdomiosarcoma murino
In questo articolo
Erratum Notice
Riepilogo
Presentato qui è un protocollo per utilizzare l'ipertermia controllata, generata da ultrasuoni focalizzati ad alta intensità guidati da risonanza magnetica, per innescare il rilascio di farmaci da liposomi sensibili alla temperatura in un modello murino di rabdomiosarcoma.
Abstract
L'ultrasuono focalizzato ad alta intensità guidato da risonanza magnetica (MRgHIFU) è un metodo consolidato per produrre ipertermia localizzata. Data l'imaging in tempo reale e la modulazione dell'energia acustica, questa modalità consente un controllo preciso della temperatura all'interno di un'area definita. Molte applicazioni termiche vengono esplorate con questa tecnologia non invasiva e non ionizzante, come la generazione di ipertermia, per rilasciare farmaci da vettori liposomiali termosensibili. Questi farmaci possono includere chemioterapie come la doxorubicina, per la quale è auspicabile un rilascio mirato a causa degli effetti collaterali sistemici dose-limitanti, vale a dire la cardiotossicità. La doxorubicina è un pilastro per il trattamento di una varietà di tumori maligni ed è comunemente usata nel rabdomiosarcoma recidivante o ricorrente (RMS). RMS è il tumore extracranico dei tessuti molli solidi più comune nei bambini e nei giovani adulti. Nonostante la terapia aggressiva e multimodale, i tassi di sopravvivenza della RMS sono rimasti gli stessi negli ultimi 30 anni. Per esplorare una soluzione per affrontare questo bisogno insoddisfatto, è stato sviluppato un protocollo sperimentale per valutare il rilascio di doxorubicina liposomiale termosensibile (TLD) in un modello murino RMS immunocompetente e singeneico utilizzando MRgHIFU come fonte di ipertermia per il rilascio del farmaco.
Introduzione
Il rabdomiosarcoma (RMS) è un tumore del muscolo scheletrico che si verifica più comunemente nei bambini e nei giovani adulti1. La malattia localizzata è spesso trattata con un trattamento multimodale, tra cui chemioterapia, radiazioni ionizzanti e chirurgia. L'uso di regimi chemioterapici multi-farmaco è più diffuso nei pazienti pediatrici, con risultati migliori rispetto alle loro controparti adulte2; Tuttavia, nonostante gli sforzi di ricerca in corso, il tasso di sopravvivenza a 5 anni rimane intorno al 30% nella forma più aggressiva della malattia 3,4. Lo standard di cura della chemioterapia è un regime multifarmaco che include vincristina, ciclofosfamide e actinomicina D. In caso di malattia recidivante o ricorrente, vengono utilizzate chemioterapie alternative, tra cui doxorubicina (FD) standard (libera) e ifosfamide1. Mentre tutte queste chemioterapie hanno tossicità sistemiche, la cardiotossicità della doxorubicina impone una limitazione della dose per tutta la vita 5-7. Per aumentare la quantità del farmaco somministrato al tumore e ridurre al minimo la tossicità sistemica, sono state sviluppate formulazioni alternative, incluso l'incapsulamento liposomiale. Questi possono essere doxorubicina non termosensibile, che è stata approvata per il trattamento del cancro al seno e del carcinoma epatocellulare, o doxorubicina termosensibile, per la quale sono in corso studi clinici 8,9,10,11,12,13. Sono stati valutati metodi alternativi per la somministrazione di farmaci incapsulati liposomiali come liposomi multi-vescicolari e liposomi mirati al ligando e mostrano risultati promettenti per il trattamento dei tumori9. In questo studio, l'aggiunta di calore ha impatti multifattoriali, incluso il rilascio di farmaci14. La combinazione di ipertermia (HT) generata con ultrasuoni focalizzati ad alta intensità guidati da risonanza magnetica (MRgHIFU) e doxorubicina liposomiale termosensibile (TLD) è un nuovo approccio terapeutico multimodale per l'utilizzo di questo farmaco tossico ma efficace per il trattamento della RMS, riducendo al minimo la tossicità dose-limitante e aumentando potenzialmente la risposta immunitaria al tumore.
La doxorubicina si rilascia rapidamente dal TLD a temperature >39 °C, ben al di sopra della temperatura media corporea umana di 37 °C ma non abbastanza alta da causare danni ai tessuti o ablazione; questo inizia a verificarsi a 43 °C, ma si verifica più rapidamente quando le temperature si avvicinano a 60 °C15. Sono stati utilizzati vari metodi per generare HT in vivo, tra cui laser, microonde, ablazione a radiofrequenza e ultrasuoni focalizzati, molti dei quali sono metodi di riscaldamento invasivi16. MRgHIFU è un metodo di riscaldamento non invasivo e non ionizzante che facilita le impostazioni precise della temperatura all'interno del tessuto target in situ. La risonanza magnetica (RM) fornisce fondamentalmente l'imaging in tempo reale, in cui è possibile utilizzare il software del computer, per calcolare una misurazione termometrica del tessuto durante il trattamento; Successivamente, questi dati possono essere utilizzati per controllare la terapia ad ultrasuoni in tempo reale per raggiungere e mantenere un set point di temperatura desiderato17. MRgHIFU è stato testato in vari tipi di tessuto e può essere utilizzato per una vasta gamma di trattamenti termici, dalla lieve HT all'ablazione, nonché clinicamente per trattare con successo le metastasi ossee dolorose18. Inoltre, HT ha dimostrato di causare citotossicità tumorale, modulare l'espressione proteica e alterare la risposta immunitaria nel microambiente tumorale 19,20,21,22. Uno studio ha combinato HT lieve con TLD, seguita da ablazione con MRgHIFU, in un modello sinergico di ratto R123, con conseguente necrosi nel nucleo tumorale e somministrazione di farmaci alla periferia. Tradizionalmente, la radioterapia è stata utilizzata come terapia aggiuntiva per danneggiare le cellule tumorali e ridurre la recidiva locale della malattia. Tuttavia, il suo uso è limitato dal dosaggio a vita e dal danno fuori bersaglio1. Pertanto, HT è unico in quanto può causare alcuni degli stessi effetti senza le stesse tossicità o limitazioni.
I modelli animali preclinici per la RMS includono modelli immunocompetenti singeneici e xenotrapianti derivati dal paziente (PDX) in ospiti immunocompromessi. Mentre i modelli immunocompromessi consentono la crescita dei tumori umani, mancano del microambiente tumorale appropriato e sono limitati nella loro capacità di studiare la risposta immunitaria24. La mutazione attivante FGFR4 è un marcatore promettente per la prognosi sfavorevole e un potenziale bersaglio terapeutico nellaRMS 1,25 adulta e pediatrica. Nei modelli singeneici di RMS sviluppati nel laboratorio Gladdy, i tumori sono in grado di crescere in un ospite immunocompetente, che sviluppa risposte immunitarie innate e adattative al tumore26. Poiché la HT influenza la risposta immunitaria, l'osservazione del cambiamento nella risposta immunitaria murina è un prezioso vantaggio di questo modello tumorale. Per testare sia la risposta tumorale al TLD rispetto alla FD, sia il cambiamento nella risposta immunitaria del tumore sia alla chemioterapia che alla HT, è stato sviluppato un protocollo per trattare i tumori RMS murini singeneici in vivo utilizzando MRgHIFU e TLD, che è al centro di questo studio.
Protocollo
La ricerca è stata eseguita in conformità con i comitati di cura degli animali con protocolli di uso degli animali approvati da un veterinario supervisore presso le strutture di ricerca animale del Centro per la fenogenomica (TCP) e del Centro risorse animali (ARC) della rete sanitaria universitaria (UHN). Tutte le procedure, escluso il MRgHIFU, che coinvolgono gli animali sono state eseguite in un armadio di sicurezza biologica (BSC) per ridurre al minimo l'esposizione degli animali all'aria esterna o alle infezioni sensibili.
1. Allevamento di topi
NOTA: Un totale di 65 topi (ceppo B6.129S2-Trp53tm1Tyj/J) sono stati inclusi nello studio pilota (maschio: n = 23; femmina: n = 42). Sia i topi maschi che le femmine sono stati utilizzati a 7-9 settimane di età. I loro cuccioli sono stati svezzati e genotipati, e i topi eterozigoti p53 sono stati utilizzati per gli esperimenti.
- Ospita due topi femmina con ogni topo maschio per creare gabbie di riproduzione. Conta l'età dei loro cuccioli dalla nascita (nascita = giorno 0).
- Al giorno 10, identifica i cuccioli con una tacca auricolare. Raccogliere i tagli di coda per la genotipizzazione prima dell'iniezione della linea cellulare.
2. Genotipizzazione del topo
- Estrarre il DNA dai ritagli di coda di 2 mm raccolti utilizzando un kit di estrazione del DNA commerciale (vedi Tabella dei materiali), seguendo le istruzioni del produttore.
- Determinare la concentrazione e la purezza del DNA misurando l'assorbanza a 260-280 nm su uno spettrofotometro (vedi Tabella dei materiali).
- Eseguire la reazione a catena della polimerasi (PCR).
- Creare una miscela master contenente una miscela PCR commerciale (contenente Taq polimerasi, dNTPS e MgCl 2; vedere la tabella dei materiali), primer e dH2O in un rapporto 12,5:0,25:10,75 (μL) per il numero richiesto di campioni. Aggiungere 1 μL di campione di DNA a ciascuna provetta PCR e includere dH2O, un campione nullo (omozigote per la mutazione p53), un campione eterozigote (eterozigote per la mutazione p53) e un campione wild type (omozigote per p53 normale) come controlli PCR.
- Aggiungere 24 μL della miscela master a ciascuna provetta PCR contenente DNA. Pipettare la soluzione in ogni provetta PCR su e giù per distribuire il DNA in tutta la miscela principale.
- Posizionare i tubi di reazione in un termociclatore e ciclo secondo le seguenti specifiche: 95 °C per 2 min, 40 cicli di 95 °C per 15 s, 60 °C per 15 s e 72 °C per 1 min, quindi mantenere a 4 °C fino al momento dell'analisi sul gel.
- Analizzare i prodotti PCR utilizzando l'elettroforesi su gel di agarosio.
- Preparare un gel al 2% (50 ml di 1x TAE e 1 g di agarosio) riscaldando l'agarosio nel TAE e mescolando fino a quando non si scioglie. Una volta raffreddato e ancora liquido, aggiungere 2,5 μL di colorazione di gel di DNA all'agarosio e mescolare. Gettare il gel in una scatola di gel con un pettine. Posizionare il gel nell'apparecchio elettroforetico (vedere Tabella dei materiali) e coprire con 1x TAE.
- Caricare 10 μL di 1 kB DNA Ladder sul gel. Caricare 12,5 μL di ciascun campione. Eseguire il gel per 25 minuti a 135 V.
- Immagine del gel utilizzando le impostazioni appropriate per la colorazione di gel DNA usata su un imager gel (vedere la tabella dei materiali), secondo le istruzioni del produttore.
3. Preparazione del modello tumorale (Figura 1)
- Coltivare la linea cellulare M25FV24C (passaggio 12-15) 1 settimana prima della data di iniezione in terreni di coltura completi (Dulbecco's Modified Eagle Medium [DMEM] con additivi: 10% FBS, 1% Penicillina/Streptomicina e 2 mM L-alanil-L-glutammina dipeptide) in un matraccio da 75 ml, a 37 °C e 5% CO2. Una volta che le cellule sono ~ 80% confluenti, aspirare il mezzo e lavare le cellule 1x con 5 ml di soluzione salina tamponata fosfato di Dulbecco (DPBS).
NOTA: M25FV24C è una linea cellulare murina progettata per sovraesprimere il mutante FGFR4V550E, che si osserva nellaRMS 1,26 pediatrica e adulta. - Sollevare le cellule aggiungendo 0,5 ml di soluzione di tripsina allo 0,25% sul lato della piastra e incubare il recipiente per 2-3 minuti a temperatura ambiente. Una volta che le cellule appaiono staccate, aggiungere 2,5 ml di terreno di crescita completo a temperatura ambiente per inattivare la tripsina. Utilizzare un'aliquota campione di 10 μL per determinare la concentrazione cellulare delle cellule vitali utilizzando un emocitometro e l'esclusione del blu di tripano.
- Preparare il volume corretto di cellule sospese DPBS per l'iniezione e metterle in una provetta da microcentrifuga da 1,5 ml: volume da centrifugare = (numero di topi × numero di cellule per topo)/ (concentrazione di cellule), dove il numero di topi = i topi da iniettare + 10 topi in più per errore e il numero di cellule per topo = 104.
- Centrifugare per 5 minuti a 153 x g. Risospendere il pellet cellulare nel volume appropriato (10 μL per topo × numero di topi) di tampone di mioiniezione (mezzo F10 + 0,5% FBS) e iniettare i topi entro 1 ora dalla preparazione di questa sospensione.
4. Iniezione intramuscolare di cellule
NOTA: Le cellule M25FV24C vengono iniettate nell'arto posteriore destro di topi tra le 4 e le 6 settimane di età. L'iniezione a 4 settimane produce un piccolo topo con un tumore che può essere più difficile da trattare in quanto vi è meno tessuto circostante per la dispersione HT; Aspettare fino a 6 settimane produce un topo più grande, rendendo più facile il trattamento del tumore.
- Capovolgere la sospensione cellulare più volte prima dell'aspirazione per aiutare a distribuire uniformemente le cellule all'interno della soluzione. Aspirare 10 μL (104 cellule) utilizzando una siringa da microlitri (vedere Tabella dei materiali). Scruff il mouse; Una volta trattenuto, l'accesso ai muscoli della coscia caudale può essere ottenuto estendendo la zampa posteriore. Rasare la gamba con un tagliacapelli e pulire con etanolo al 70%.
- Iniettare la sospensione cellulare M25FV24C (10 μL, 10 4 cellule) nella muscolatura della coscia dell'arto posteriore destro di un topo di4-6 settimane usando una siringa da microlitro a tenuta di gas con un ago da 26s G.
NOTA: L'ago deve essere inserito parallelamente al femore verso il ginocchio, facendo attenzione a non colpire il nervo sciatico. Inserire solo la punta dell'ago (circa 2 mm) a causa della piccola massa muscolare dell'arto posteriore. - Somministrare la soluzione con un movimento costante. Rimuovere l'ago e assicurarsi che non si verifichi sanguinamento. Riportare il mouse in una seconda gabbia.
- Valutare gli animali quotidianamente e monitorare i loro arti posteriori per la crescita del tumore attraverso la palpazione. Eutanasia i topi usando anidride carbonica se si incontra uno dei seguenti endpoint precoci: dimensioni del tumore superiori a 1,5 cm di diametro, ulcerazione tumorale o segni sistemici di malattia (piloerezione, postura curva, inattività o diminuzione dell'assunzione di cibo o acqua).
5. Screening MRI scansione
- Anestetizzare il topo, ad un livello in cui non c'è movimento con la zampa stretta, con isoflurano sotto i seguenti parametri: indurre in una camera con il 4% a 1,5 LPM, quindi trasferire al cono del naso sulla slitta dello scanner MRI e continuare il mantenimento dell'isoflurano sul cono del naso con 1,5%-2% a 0,75 LPM. Collegare il monitor respiratorio. Utilizzare unguento veterinario sugli occhi per prevenire la secchezza durante l'anestesia.
- Immagine del mouse anestetizzato utilizzando lo scanner MRI (vedere Tabella dei materiali). Nell'immagine pesata in T2 (acquisizione Ax_Screen, Tabella 1), prendere nota delle dimensioni nel piano e del numero di fette assiali all'interno delle quali appare il tumore. Si noti la posizione del tumore in riferimento al femore e alla superficie laterale della coscia, dove entrerebbe l'onda ultrasonica.
NOTA: Il tumore appare come una massa iperintensa all'interno del muscolo che è asimmetrica dal lato opposto. Una buona dimensione iniziale del tumore per trattamenti multipli è di 2 mm x 2 mm x 2 mm per studi acuti o di sopravvivenza. Se è molto più grande, sarà buono solo per gli studi acuti in quanto il tumore raggiungerà un punto finale di dimensioni prima di completare tre trattamenti settimanali. I criteri di esclusione per il trattamento HIFU includono: avvolto intorno al femore, troppo vicino al femore, troppo posteriore sul topo, mediale al femore, troppo vicino al retto. - Rimuovere il mouse dallo scanner e ottenere un peso di base. Rasare il topo dalla metà del corpo fino ai piedi sotto anestesia con un rasoio elettrico.
NOTA: Idealmente, la rasatura viene eseguita 1 giorno prima del trattamento, in quanto consente al mouse di eseguire la toelettatura che consente alla crema depilatoria di funzionare in modo più efficiente. - Recuperare il mouse nel BSC, utilizzando una piastra riscaldante sotto un'estremità della gabbia. Riportare il topo nella sua gabbia quando riacquista la reclienza sternale.
6. Esperimento: preparazione animale del giorno di trattamento HIFU
- Per preparare il sistema HIFU di piccolo diametro (vedi Tabella dei materiali), accendere il generatore e riempire il trasduttore con abbastanza acqua deionizzata fino a quando la membrana non viene espansa sotto il trasduttore, ma non così ferma da comprimere il mouse. Degasare l'acqua nel circuito del trasduttore per 30 minuti per rimuovere l'ossigeno disciolto dal mezzo.
- Preparare il sistema informatico associato.
- Accendere il computer di controllo e assicurarsi che sia collegato via Ethernet al generatore HIFU e via USB al display della sonda termica. Avviare il software e fare clic su Home to home del trasduttore prima di inserire il mouse.
- Calibrare le sonde termiche a fibre ottiche: ottenere le temperature ambiente di base e annotare la variazione di temperatura nella sala MRI. Si noti l'entità della deriva della temperatura per ciascuna sonda a causa dell'intensità del campo magnetico. Inserire la sonda di temperatura del tubo di deriva in un tubo di vetro riempito di gadolinio per la calibrazione della temperatura durante la scansione e fissare il tubo di deriva con del nastro adesivo.
NOTA: La temperatura ambiente di base (tubo di deriva) viene aggiunta manualmente come parametro di termometria nella GUI del software. Una regione di interesse (ROI) viene impostata all'interno del tubo di deriva nell'immagine MR per rilevare qualsiasi deriva della temperatura e correggerà automaticamente le immagini termometriche. - Aspirare il farmaco da iniettare in una siringa da 1 mL e inserirlo nella pompa di erogazione automatica (vedere Tabella dei materiali). Innescare la linea che si collegherà al catetere venoso della coda del mouse fino a quando il farmaco non ha completamente riempito la linea premendo il pulsante di erogazione manuale sulla pompa di erogazione automatica.
- Utilizzare una lampada di calore per riscaldare i topi nelle gabbie per ~ 20 minuti prima del trasferimento nella camera anestetica.
NOTA: Il preriscaldamento favorisce la vasodilatazione, che si verifica non appena il topo viene anestetizzato e aiuta nel posizionamento del catetere.
- Anestetizzare il topo con isoflurano (induzione: 4% a 1,5 LPM; mantenimento: 1,5%-2% a 0,75 LPM) e trasferirlo in un cono nasale. Applicare un lubrificante corneale sugli occhi per prevenire danni dovuti alla mancanza di riflesso del battito delle palpebre in anestesia.
- Applicare la crema depilatoria sulla zona rasata, compreso l'intero arto posteriore destro, e seguire le istruzioni del produttore per la depilazione.
NOTA: Posizionare il mouse sotto una lampada di calore mentre si è nel BSC per aiutare con la termoregolazione durante la depilazione in anestesia. - Dopo aver lavato via la crema depilatoria con acqua tiepida, pesare il mouse su una bilancia digitale e registrare il dosaggio del farmaco.
- Spostare il mouse su un cono nasale compatibile con la risonanza magnetica sulla slitta MRI. Posizionare una lampada di calore sul mouse per tenerlo caldo durante la preparazione per la risonanza magnetica. Posizionare il topo nella posizione di decubito laterale con il lato rivolto verso il basso e il tumore superiore all'interno di un supporto per mouse stampato in 3D sulla slitta (Figura supplementare 1 e Figura 2). Garantire il corretto posizionamento del tumore (cioè al centro della bobina orizzontalmente e verticalmente, con l'altezza appena sopra i bordi del supporto del mouse per tenere conto della compressione da parte del trasduttore ad ultrasuoni).
NOTA: Se necessario, tagliare un segmento di gel compresso ad ultrasuoni da mettere sotto il mouse, foderando il fondo del supporto, con uno spessore per livellare il tumore verso la parte superiore del supporto. - Allontanare la gamba non coinvolta dalla gamba tumorale, sotto il topo o estesa con la gamba tumorale flessa. Assicurarsi che i piedi non siano nel campo vicino o lontano del percorso del tumore e del fascio di ultrasuoni. Posizionare la lampada termica a 15 cm dalla coda per riscaldare per l'inserimento del catetere nella vena della coda.
- Inserire la sonda di temperatura esofagea.
- Infilare la sonda esofagea attraverso il cono del naso e collottola il collo del topo. Inclina il naso del mouse verso l'alto per creare una linea dalla bocca direttamente allo stomaco estendendo la testa. Far scorrere la sonda termica sopra la lingua di circa 0,5 cm nell'esofago del topo e sostituire il cono del naso intorno al naso del topo. Fissare la sonda esofagea e il cono del naso nella parte superiore della slitta.
NOTA: Monitorare i segni di difficoltà respiratoria immediatamente dopo l'inserimento in quanto può essere inserito in modo improprio nella trachea.
- Infilare la sonda esofagea attraverso il cono del naso e collottola il collo del topo. Inclina il naso del mouse verso l'alto per creare una linea dalla bocca direttamente allo stomaco estendendo la testa. Far scorrere la sonda termica sopra la lingua di circa 0,5 cm nell'esofago del topo e sostituire il cono del naso intorno al naso del topo. Fissare la sonda esofagea e il cono del naso nella parte superiore della slitta.
- Inserire la sonda di temperatura rettale.
NOTA: Le sonde di temperatura rettale ed esofagea devono trovarsi entro 3 °C l'una dall'altra. - Posizionare il monitor respiratorio con il cavo di collegamento verso la testa del mouse in modo che non interferisca con il posizionamento del trasduttore a ultrasuoni. Fissare con nastro adesivo.
- Inserire un catetere della vena della coda ad ago a farfalla da 27 G in una vena laterale della coda attaccata al microtubo con 20 μL di spazio morto e nastro adesivo in modo sicuro. Dopo la nastratura, assicurarsi che il catetere sia ancora ben lavato.
- Utilizzare due persone per trasportare il topo preparato, la slitta del topo, la linea di anestesia, la linea respiratoria, il catetere delle vene della coda e i cavi della sonda termica nello scanner MRI e posizionarli nel supporto della slitta MRI.
- Chiedere all'operatore del software HIFU (vedi Tabella dei materiali) di spostare il menisco del trasduttore direttamente sopra il tumore mediante ispezione visiva per un allineamento iniziale27. Applicare lubrificante per gli occhi o gel ad ultrasuoni degassato sulla pelle glabra sopra il tumore e accoppiare il trasduttore HIFU all'area del tumore.
- Collegare la linea di somministrazione del farmaco dalla pompa automatica al catetere della vena caudale. Calcola la quantità di spazio morto nella linea della vena della coda e nella linea di collegamento. Far scorrere la slitta HIFU del mouse su binari MRI al centro della risonanza magnetica.
- Impostare la quantità di infusione di farmaco sulla pompa, in base al tipo di farmaco e alla concentrazione e al peso dell'animale, e aggiungere la quantità di spazio morto. Impostare la pompa su una velocità di infusione di 200 μL/min.
NOTA: In questo studio, FD e TLD sono stati utilizzati a una concentrazione di 2 mg / ml e una dose di 5 mg / kg di peso corporeo. - Registrare le temperature della sonda termica di base.
- Posizionare il dispositivo di riscaldamento a convezione d'aria (vedere Tabella dei materiali) sull'impostazione più calda. Puntare il tubo soffiando aria verso il mouse al centro del foro MRI e fissare con del nastro adesivo. Il dispositivo di riscaldamento verrà successivamente portato alla sua impostazione più bassa (32 ° C) per evitare il surriscaldamento del mouse durante la sonicazione.
- Acquisire le immagini MR del rilievo (Ax_Loc, Sag_Loc; Tabella 1) per determinare la posizione del tumore per il targeting della sonicazione, compresa la profondità. Regolare la posizione del trasduttore di conseguenza utilizzando il software HIFU inserendo la distanza di movimento desiderata misurata sull'immagine e quindi facendo clic sulla direzione della freccia per spostarsi (Figura 3A). Si noti anche la posizione del tubo di deriva. Ripetere se necessario.
- Determinare la posizione del punto focale del trasduttore nel piano coronale eseguendo una breve sonicazione continua di ampiezza 5 s x 50 mV durante l'acquisizione della termometria Test_Shot (Tabella 1).
- Allinea le immagini del rilevamento MR con la vista coronale del punto focale all'interno del software HIFU. Rivedere le immagini per la posizione del tumore, rispetto alla struttura ossea e al retto, e rivedere il posizionamento del trasduttore come ritenuto necessario.
- Ripetere la sonicazione del colpo di prova durante l'imaging termico a nove ripetizioni (Tabella 1) per confermare se c'è un riscaldamento uniforme e accurato nel volume del tumore con un riscaldamento off-target minimo. Regolare la posizione della sezione, la posizione del trasduttore e la profondità dello sterzo e confermare le prestazioni di riscaldamento con ripetuti "colpi di prova" se ritenuto necessario.
- Utilizzando il software di monitoraggio del trattamento HIFU, definire il ROI per il monitoraggio termometrico all'interno del profilo di riscaldamento finale misurando la distanza da percorrere e quindi modificando le coordinate della griglia nel programma. Imposta un ROI attorno al tubo di deriva per la correzione della deriva. Immettere la temperatura di base in base alla temperatura della sonda rettale per le misurazioni termometriche. Il sistema HIFU viene utilizzato per avviare la sonicazione del trattamento HIFU e per il monitoraggio della termometria.
- Aprire le specifiche di trattamento dell'ipertermia di 20 minuti nel software e avviare la sonicazione una volta raccolte le immagini RM di riferimento e iniziata la termometria.
- Eseguire un trattamento di 20 minuti (Figura 3B) durante l'imaging termico (Tabella 1) utilizzando il software di controllo integrato PID (proporzionale-integrativo-derivato). Iniettare il farmaco selezionato a 1,5 minuti, dopo che la temperatura nel ROI si è riscaldata alla temperatura desiderata (40 ° C).
- Monitorare la temperatura interna durante il trattamento. Se la temperatura rettale aumenta rapidamente durante il trattamento, può essere necessario il riposizionamento del topo per evitare il riscaldamento rettale per la durata del trattamento di 10 o 20 minuti. Interrompere il trattamento se la temperatura rettale aumenta a >40 °C.
7. Esperimento: imaging del modello murino e procedura di sonicazione per studi acuti
- Dopo il completamento del trattamento, rimuovere il mouse dal foro della risonanza magnetica, assicurando l'emostasi nel sito di inserimento del catetere della vena caudale. Trasferire il mouse sul BSC e posizionarlo sul cono del naso per continuare l'anestesia.
- Metti il topo sulla schiena su un cuscinetto assorbente blu con gli arti trattenuti e il cuore esposto.
- Eutanasia dei topi attraverso il dissanguamento tramite puntura cardiaca seguita dalla rimozione del cuore. Prelevare immediatamente il sangue e centrifugare per la separazione del plasma a 10.621 x g per 10 minuti.
- Eseguire la necroscopia e conservare gli organi come richiesto per l'analisi. Congelare gli organi in azoto liquido e conservare a -80 °C per diversi mesi o a lungo termine in un serbatoio di azoto liquido.
- Omogeneizzare meccanicamente il tessuto tumorale aggiungendo un eccesso di nove volte (p / p) di acqua deionizzata e abbattendo il tessuto usando un omogeneizzatore che batte le perline. Estrarre la doxorubicina da 600 μL di tessuto omogeneizzato aggiungendo sequenzialmente 75 μL di 300 mg/ml di nitrato d'argento, 75 μL di acido solforico 10 mM e 2,5 ml di isopropanolo:cloroformio 1:1. Vortex per 20 minuti e conservare a -20 °C durante la notte.
- Per preparare i campioni per la cromatografia liquida ad alte prestazioni (HPLC), centrifugare la soluzione dal punto 7,5 a 4.500 x g, rimuovere lo strato di solvente organico e asciugare l'isopropanolo:cloroformio sotto un flusso di azoto gassoso. Risospendere in 100 μL di 2:1 MeOH:H2O. Misurare la concentrazione di doxorubicina utilizzando HPLC-MS/MS28.
8. Esperimento: imaging del modello murino e procedura di sonicazione per studi di sopravvivenza
NOTA: Per gli studi di sopravvivenza, seguire la procedura di preparazione degli animali del giorno di trattamento HIFU (passaggi da 6.1 a 6.25).
- Dopo il completamento del trattamento, posizionare il mouse sotto una lampada di calore per consentirgli di recuperare e monitorare la respirazione e il movimento fino a quando non riacquista la recumbenza sternale. Quindi, riporta l'animale nella sua gabbia.
NOTA: Assicurarsi che metà della gabbia sia in linea con una lampada termica, poiché la regolazione termica degli animali è influenzata dall'anestesia e dal trattamento HT. - Monitorare quotidianamente i topi per il comportamento, i modelli di alimentazione e la frequenza respiratoria per eventuali segni di angoscia.
- Eseguire i trattamenti una volta alla settimana seguendo i passaggi da 6.1 a 6.25 per 3 settimane consecutive.
- Due volte alla settimana, eseguire la risonanza magnetica dei topi per la misurazione del tumore. Per le settimane durante il trattamento, eseguire una risonanza magnetica e un'ecografia ogni settimana. Al termine del trattamento, eseguire l'ecografia bisettimanale.
- Eutanasia del topo 60 giorni dopo aver completato la serie di trattamenti, o quando è stato raggiunto un endpoint umano (dimensione del tumore >1,5 cm3 o morbilità dal tumore), seguita da necroscopia con tumore e rimozione di organi per l'analisi.
Risultati
Utilizzando il protocollo di ipertermia generato da MRgHIFU, i tumori nell'arto posteriore sono stati in grado di essere costantemente riscaldati alla temperatura impostata desiderata per tutta la durata del trattamento (la Figura 4 mostra un trattamento rappresentativo, 10 o 20 min, n = 65). Per considerare un trattamento di successo, il ROI doveva essere mantenuto al di sopra di 39 °C per l'intero trattamento, con una variazione di <6 °C durante il trattamento e senza riscaldamento del tessuto fuori bersaglio. Inoltre, la temperatura interna doveva rimanere al di sotto di 39 °C, in base alla sonda rettale o alla temperatura rettale iniziale più la variazione della temperatura della sonda esofagea (Figura supplementare 2). Una volta interrotta la sonicazione del MRgHIFU, il tumore è tornato rapidamente alla temperatura basale.
I tumori sono stati mirati a 40,5 ° C per raggiungere una temperatura per un rapido rilascio del farmaco evitando effetti cumulativi di temperatura superiori a 43 ° C. La temperatura media del ROI in tutti i tumori trattati è stata di 40,6 °C (n = 65), con una differenza media tra il 10° percentile e il 90° percentile voxel di 4,3 °C. La deviazione standard della temperatura media è stata di 1,3 °C per la durata del trattamento sia per i trattamenti di 10 che per i 20 minuti (Figura 5). Il tasso di successo dei trattamenti per soddisfare i criteri di inclusione è notevolmente migliorato nel corso della durata dello studio dall'11% al 100% (Figura 6).
Dopo aver ottimizzato il protocollo di trattamento, la durata dell'ipertermia è stata valutata per l'efficacia del rilascio del farmaco rispetto ai topi normotermici (NT). Per determinare il tempo ottimale di trattamento dell'ipertermia per ulteriori studi, sono state testate due durate di trattamento: 10 minuti e 20 minuti. Queste durate sono state selezionate per la fattibilità di mantenere costantemente la normotermia centrale e l'ipertermia tumorale. La cromatografia liquida ad alte prestazioni e la spettrometria di massa (HPLC-MS) sono state utilizzate per valutare la quantità di doxorubicina nei tumori e quantificare la differenza di accumulo di doxorubicina tra le durate testate. C'era una percentuale significativamente più alta della dose iniziale (% ID) di doxorubicina nei tumori nei topi trattati con HT + TLD di 20 minuti rispetto ai topi NT TLD di 20 minuti (Figura 7, q = 0,000108). Non c'era alcuna differenza significativa tra i gruppi HT + TLD da 10 minuti e 20 minuti; tuttavia, c'è stata una deviazione standard maggiore nel gruppo di trattamento di 10 minuti rispetto al gruppo di 20 minuti (3,698 vs 2,065% ID / g di tumore). In particolare, c'erano quattro valori vicini allo zero all'interno del gruppo di trattamento HT + TLD di 10 minuti, che sono stati tutti trattati con un singolo lotto di TLD. Il TLD è stato caratterizzato prima dell'uso in esperimenti in vivo , come precedentemente descritto da Dunne et al.28. In breve, il TLD è stato caratterizzato in termini di dimensioni, potenziale zeta, temperatura di transizione di fase di fusione e concentrazione del farmaco e i liposomi sono stati utilizzati entro 72 ore dalla conservazione a 4 °C. Sebbene tutti i lotti di TLD siano stati testati prima dell'uso, è possibile che i liposomi abbiano rilasciato la doxorubicina durante la configurazione sperimentale, prima dell'uso. Inoltre, il movimento durante la scansione può causare calcoli di temperatura erroneamente elevati nel software, riducendo così il tumore e riducendo il rilascio del farmaco. In alternativa, potrebbero anche essere causati valori falsamente bassi se il farmaco non è mai stato iniettato, ad esempio, se il catetere della vena caudale è stato rimosso o posizionato in modo improprio. Come visto sopra, la configurazione della slitta MRI includeva l'inserimento della sonda di temperatura (rettale ed esofagea), l'inserimento del catetere della vena della coda e il posizionamento del monitor respiratorio, seguito dallo spostamento della slitta, del mouse, del catetere della vena caudale, di tre sonde di temperatura a fibre ottiche, del monitor respiratorio e delle linee di anestesia nel foro della risonanza magnetica. Ci sono più punti temporali durante questo processo che il catetere della vena della coda può essere spostato. Questo è stato controllato controllando il flusso di sangue nella linea, il sanguinamento dal sito di inserimento del catetere e il raggruppamento di farmaci sotto il nastro dopo il trattamento, ma l'errore rimane una possibilità.
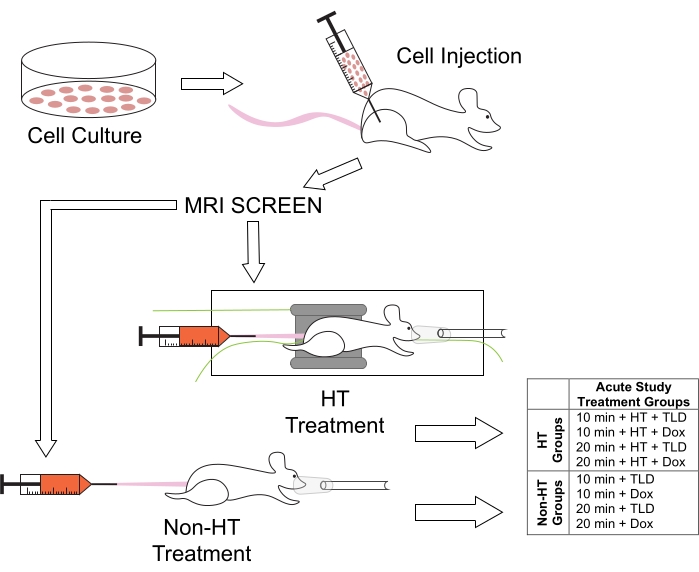
Figura 1: Protocollo sperimentale per i trattamenti animali e i gruppi di trattamento associati per gli studi di durata HT. I topi sono stati iniettati con cellule M25FV24C nell'arto posteriore destro e sono stati sottoposti a screening per la formazione del tumore utilizzando la risonanza magnetica dopo 2-3 settimane. Sono stati quindi divisi in gruppi normotermici (Non-HT) o ipertermici (HT), con TLD o FD a durate di 10 o 20 minuti. Abbreviazione: Dox = Doxorubicina. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 2: Configurazione del mouse durante il trattamento HIFU . (A) Un supporto stampato in 3D (bianco) con rivestimento interno in gomma (rosso) e un ritaglio per consentire il passaggio del fascio di ultrasuoni per il posizionamento del mouse. (B) Configurazione del mouse all'interno di un supporto per mouse stampato in 3D con un mantenimento della temperatura rettale (cavo verde), catetere per vene della coda (bianco) e monitor respiratorio (blu). (C) Posizionamento del mouse sul letto HIFU MRI durante la procedura. Fare clic qui per visualizzare una versione ingrandita di questa figura.
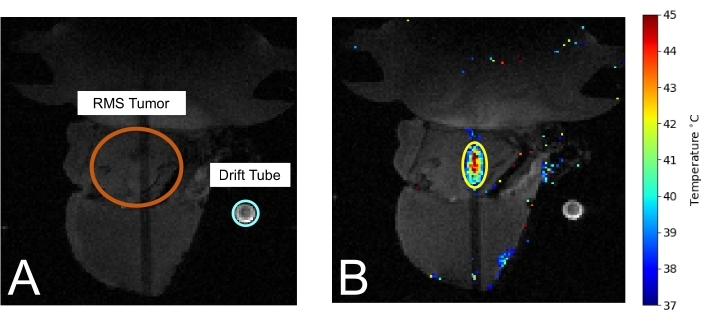
Figura 3: Mouse nella risonanza magnetica durante il trattamento con MRIgHIFU. (A) Il tumore (cerchiato in arancione) e il tubo di deriva utilizzato per misurare la temperatura ambiente (cerchiato in azzurro) sono visibili. (B) Durante il trattamento, la misurazione della temperatura termometrica viene sovrapposta all'immagine MRI. Fare clic qui per visualizzare una versione ingrandita di questa figura.
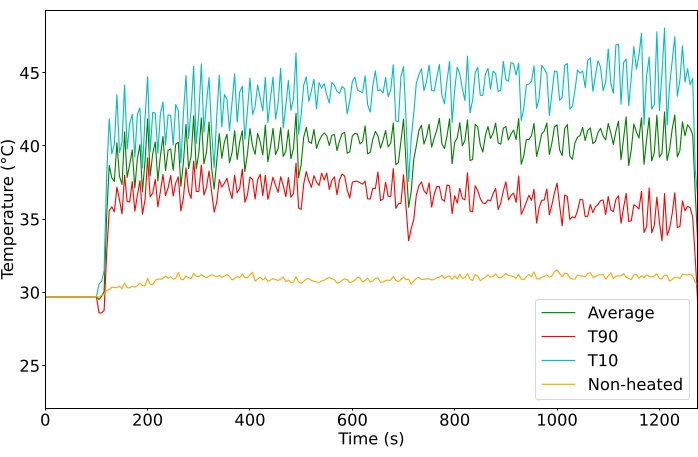
Figura 4: Temperatura (°C) monitorata durante il trattamento. Temperature medie (verdi), del 10° percentile superiore (rosso) e del 90° percentile superiore (ciano) di tutti i voxel nel ROI. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 5: Temperature medie durante il trattamento all'interno del ROI per ogni topo testato durante la fase di ottimizzazione con la deviazione standard durante il trattamento. Viene inoltre mostrata la temperatura media complessiva e la deviazione standard durante il trattamento (arancione). Fare clic qui per visualizzare una versione ingrandita di questa figura.
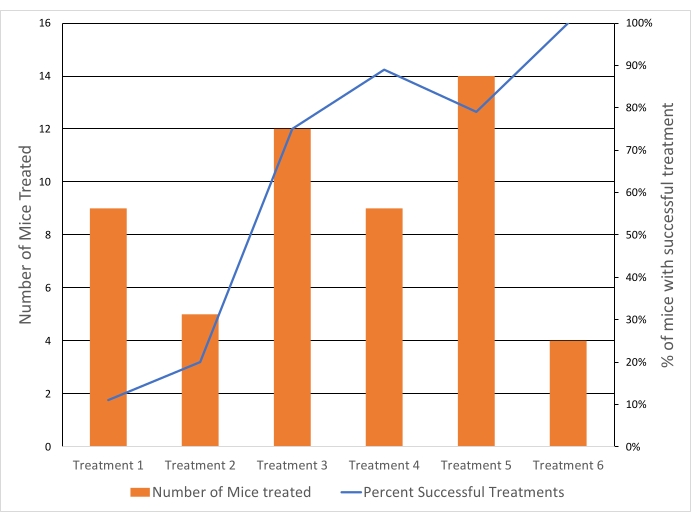
Figura 6: Le percentuali di successo del trattamento dell'ipertermia sono migliorate nel tempo. Il successo del trattamento dipendeva dai criteri di inclusione (temperatura sistemica, temperatura del tumore e variazione con il ROI e nessun riscaldamento distale). Linea blu = % di topi per i quali il trattamento ha avuto successo. Barrette arancioni = numero di topi trattati con HT. Ogni trattamento (trattamento 1-6) si riferisce a una data separata in cui sono stati condotti gli esperimenti. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 7: Quantità di doxorubicina nel tumore dopo il trattamento farmacologico. (A) Test multipli di Mann-Whitney con correzione FDR per confronti multipli dei risultati HPLC-MS dimostrano significatività (q < 0,05) tra la quantità di doxorubicina nel tumore nel gruppo TLD + HT di 20 minuti rispetto al controllo NT. (B) Non sono state osservate differenze nel tumore nei gruppi FD. %ID = percentuale della dose iniziale. = q < 0,0001. Abbreviazioni: HT = ipertermia, NT = normotermia. Fare clic qui per visualizzare una versione ingrandita di questa figura.
| Nome sequenza | Ax_Screen | Ax_Loc | Sag_Loc | Cor_TestShot | Caloria |
| Tipo di sequenza | T2w RARE | T2w RARE | T2w RARE | FLASH | FLASH |
| Orientamento | Assiale | Assiale | Sagittale | Coronale | Assiale/Sagittale |
| Tempo di eco (ms) | 40 | 72 | 72 | 6 | 6 |
| Tempo di ripetizione (ms) | 3200 | 4500 | 4500 | 39.06 | 39.06 |
| Angolo di rotazione (gradi) | 90/180 | 90/180 | 90/180 | 10 | 10 |
| Campo visivo (mm) | 28,8 x 28,8 | 36 x 36 | 35 x 35 | 35 x 35 | |
| Dimensione della matrice | 128 x 128 | 128 x 128 | 128 x 128 | 128 x 128 | 128 x 128 |
| Risoluzione (mm) | 0,225 x 0,225 | 0,281 x 0,281 | 0,281 x 0,281 | 0,273 x 0,273 | 0,273 x 0,273 |
| Numero di sezione | 20 | 20 | 20 | 3 | 2 |
| Spessore fetta (mm) | 1 | 1 | 1 | 1.5 | 1.25 |
| # Medie | 3 | 1 | 1 | 1 | 1 |
| # Ripetizioni | 1 | 1 | 1 | 9 | 9 o 300 |
| Tempo di scansione | 4 min 0 s | 1 min 12 s | 1 min 12 s | 45 secondi | 25 minuti |
Tabella 1: Parametri per l'acquisizione MRI con nomi di sequenza associati.
Figura supplementare 1: Un supporto per mouse modello 3D (bianco) con rivestimento interno in gomma (rosso). Dimensioni: lunghezza = 43 mm, raggio esterno = 15 mm, larghezza interna = 20,7 mm. Clicca qui per scaricare questo file.
Figura supplementare 2: Temperatura (°C) monitorata durante il trattamento. Temperatura interna misurata da sonde rettali (blu) ed esofagee (arancione). Clicca qui per scaricare questo file.
Supplemental Coding File 1: file di stampa 3D per il supporto del mouse. Clicca qui per scaricare questo file.
Discussione
Il protocollo qui sviluppato è stato utilizzato per colpire i tumori degli arti posteriori utilizzando MRgHIFU per il trattamento HT lieve e rilasciare farmaci incapsulati dai liposomi in vivo. Durante lo studio pilota sono stati riscontrati diversi passaggi critici in questo protocollo e l'ottimizzazione di questi passaggi critici ha rappresentato il miglioramento del successo del trattamento rispetto allo studio pilota. Il primo è la rimozione completa dei peli sulla zona da sonicare. Qualsiasi intrappolamento di gas all'interno della pelliccia impedisce il passaggio del fascio di ultrasuoni e blocca il passaggio degli ultrasuoni nel tessuto bersaglio1. In secondo luogo, il posizionamento del mouse è vitale per un trattamento di successo; Il tumore deve essere posizionato superiormente nel supporto del mouse per essere a più stretto contatto con il trasduttore ad ultrasuoni. Inoltre, le strutture ossee devono essere posizionate fuori dal percorso del fascio di ultrasuoni senza ferire il mouse. È stato dimostrato che l'osso assorbe le onde ultrasoniche in modo efficiente, agendo successivamente come fonte di riscaldamento in situ . Può influenzare il profilo di riscaldamento bloccando la trasduzione degli ultrasuoni nella regione di interesse4. L'arto controlaterale dovrebbe anche essere posizionato fuori dal percorso degli ultrasuoni, infilando la gamba sotto il resto del corpo o estendendola e riempiendo l'aria tra le gambe con gel ad ultrasuoni o un cuscinetto di gel. Il retto deve anche essere fuori dal percorso degli ultrasuoni per evitare il riscaldamento fuori bersaglio e la riflessione dalla sonda di temperatura. Un attento posizionamento del tumore è il passo più importante per completare un trattamento di successo.
Dopo il corretto posizionamento, il posizionamento della sonda di temperatura esofagea deve essere eseguito con attenzione per evitare l'occlusione tracheale. Quando si inserisce il mouse nel foro della risonanza magnetica, il mozzo di connessione metallico tra il catetere nella coda e il catetere della pompa di iniezione deve essere fissato con nastro distale all'area di imaging per evitare la creazione di artefatti. Il trasduttore ad ultrasuoni deve essere posizionato in modo che sia in contatto con l'area priva di pelliccia della gamba e non sposti il monitor respiratorio. Per la sopravvivenza del topo è necessario un attento monitoraggio della temperatura corporea interna del topo durante il trattamento e la successiva regolazione del sistema di riscaldamento a convezione. A causa della vicinanza del retto e del tumore in alcuni topi, l'aggiunta della sonda esofagea era importante per determinare il cambiamento della temperatura interna, poiché la temperatura rettale poteva solo riflettere il riscaldamento locale rispetto al riscaldamento del corpo centrale.
Nella progettazione e nell'implementazione di questo protocollo, un'ampia risoluzione dei problemi è stata eseguita con successo da un team multidisciplinare. Per il posizionamento del mouse, è stato progettato un supporto per mouse e stampato in 3D da utilizzare su una slitta MRI per ratti per consentire il flusso dell'aria riscaldata intorno al mouse per la regolazione della temperatura corporea intra-procedurale. I materiali per questo supporto sono stati scelti in base alla loro capacità di tenere saldamente il mouse consentendo la trasduzione degli ultrasuoni. Un inserto in gomma all'interno del supporto stampato consentiva le singole regolazioni del mouse, mentre il taglio nella parte inferiore impediva la riflessione delle onde ultrasoniche e il riscaldamento involontario.
Ci sono limitazioni associate al modello, come la vicinanza dei tumori alle strutture vicine - osso (femore) e retto - che possono assorbire o riflettere le onde ultrasoniche, rispettivamente. Il riscaldamento involontario del femore può causare distruzione e dolore del midollo osseo, mentre la riflessione ad ultrasuoni dall'aria nel retto può causare riscaldamento locale e danni ai tessuti. Inoltre, ci sono stati casi di intrappolamento dell'onda ultrasonica a causa della ricrescita della pelle dopo il trattamento nei topi di sopravvivenza, causando un riscaldamento localizzato della pelle. Si sospetta che ciò sia dovuto all'intrappolamento dell'aria intorno al follicolo pilifero che non viene spostato con il gel ad ultrasuoni tra il trasduttore e la pelle. In ogni caso, la pelle appariva più scura della pelle glabra circostante. Sulle sezioni di immunoistochimica di questi arti di topo, i peli sono stati visti all'interno dell'epidermide, ma non è stata trovata alcuna fibrosi tumorale o altra spiegazione del perché l'ecografia non sarebbe in grado di passare attraverso la pelle e i tessuti sottocutanei.
Con lo sviluppo di questo protocollo, sono previsti ulteriori studi per estendere i sistemi modello per testare altri tumori solidi pediatrici, come l'osteosarcoma e il mixofibrosarcoma, per il trattamento con HT e TLD. Questo è promettente in quanto questi pazienti possono affrontare dolore debilitante con opzioni di trattamento limitate in questo contesto clinico. Questo protocollo può essere esteso ad altri tipi di tumori solidi localizzati nelle estremità che sono bersagliabili con MRgHIFU29,30. In conclusione, i dati supportano che la combinazione di liposomi termosensibili può essere estrapolata per incapsulare altre forme di chemioterapia o farmaci in cui la somministrazione mirata di farmaci sarebbe utile e avere una forma non invasiva di riscaldamento, come MRgHIFU, sarebbe l'ideale.
Divulgazioni
Gli autori non hanno interessi finanziari o conflitti di interesse da divulgare.
Riconoscimenti
Vorremmo riconoscere le nostre fonti di finanziamento per questo progetto e il personale coinvolto, tra cui: C17 Research Grant, Canada Graduate Scholarship, Ontario Student Opportunity Trust Fund e James J. Hammond Fund.
Materiali
| Name | Company | Catalog Number | Comments |
| 1.5mL Eppendorf tubes | Eppendorf | 22363204 | |
| 1kb plus DNA Ladder | Froggabio | DM015-R500 | |
| 2x HS-Red Taq (PCR mix) | Wisent | 801-200-MM | |
| 7 Tesla MRI BioSpec | Bruker | T184931 | 70/30 BioSpec, Bruker, Ettlingen, Germany |
| C1000 Thermal cycler | Biorad | 1851148 | |
| Clippers | Whal Peanut | 8655 | |
| Compressed ultrasound gel | Aquaflex | HF54-004 | |
| Convection heating device | 3M Bair Hugger | 70200791401 | |
| Depiliatory cream | Nair | 61700222611 | Shopper's Drug Mart |
| DMEM | Wisent | 219-065-LK | |
| DNeasy extraction kit | Qiagen | 69504 | |
| DPBS | Wisent | 311-420-CL | |
| Drug injection system | Harvard Apparatus | PY2 70-2131 | PHD 22/2200 MRI compatible Syringe Pump |
| Eye lubricant | Optixcare | 50-218-8442 | |
| F10 Media | Wisent | 318-050-CL | |
| FBS | Wisent | 081-105 | |
| Froggarose | FroggaBio | A87 | |
| Gel Molecular Imager | BioRad | GelDocXR | |
| Glutamax | Wisent | 609-065-EL | |
| Heat Lamp | Morganville Scientific | HL0100 | Similar to this product |
| Intravascular Polyethylene tubing (0.015" ID x 0.043" OD, 20G) | SAI infusion | PE-20-100 | |
| Isoflurane | Sigma | 792632 | |
| M25FV24C Cell line | Gladdy Lab | N/A | |
| Microliter Syringe | Hamilton | 01-01-7648 | |
| Molecular Imager Gel Doc XR | Biorad | 170-8170 | |
| Mouse holder | The 3D printing material used was ABS-M30i, and it was printed on FDM Fortus 380mc machine | N/A | Dimensions: length = 43 mm, outer radius = 15 mm, inner width (where the mouse would sit) = 20.7 mm. |
| MyRun Machine | Cosmo Bio Co Ltd | CBJ-IMR-001-EX | |
| Nanodrop 8000 Spectrophotometer | Thermo Scientific | ND-8000-GL | |
| p53 primers | Eurofins | N/A | Custom Primers |
| PCR tubes | Diamed | SSI3131-06 | |
| Penicillin/Streptomycin | Wisent | 450-200-EL | |
| Proteus software | Pichardo lab | N/A | |
| Respiratory monitoring system | SAII | Model 1030 | MR-compatible monitoring and gating system for small animals |
| Small Bore HIFU device, LabFUS | Image Guided Therapy | N/A | LabFUS, Image Guided Therapy, Pessac, France Number of elements 8 frequency 2.5 MHz diameter 25 mm radius of curvature 20 mm Focal spot size 0.6 mm x 0.6 mm x 2.0 mm Motor: axes 2 Generator: Number of channels 8 Maximum electrical power/channel Wel 4 Maximum electrical power Wel 32 Bandwidth 0.5 - 5 MHz Control per channel: Freq., Phase and. amplitude Measurements per channel: Vrms, Irms, cos(theta) Duty Cycle at 100% power % 100% for 1 min. Transducer: Number of elements 8 frequency 2.5 MHz diameter 25 mm radius of curvature 20 mm Focal spot size 0.6 mm x 0.6 mm x 2.0 mm |
| SYBR Safe | ThermoFisher Scientific | S33102 | |
| TAE | Wisent | 811-540-FL | |
| Tail vein catheter (27G 0.5" ) | Terumo Medical Corp | 15253 | |
| Thermal probes | Rugged Monitoring | L201-08 | |
| Trypan blue | ThermoFisher Scientific | 15250061 | |
| Trypsin | Wisent | 325-052-EL | |
| Ultrasound Gel | Aquasonic | PLI 01-08 |
Riferimenti
- Skapek, S. X., et al. Rhabdomyosarcoma. Nature Reviews Disease Primers. 5 (1), (2019).
- Ferrari, A., et al. Impact of rhabdomyosarcoma treatment modalities by age in a population-based setting. Journal of Adolescent and Young Adult Oncology. 10 (3), 309-315 (2021).
- . Pediatric rhabdomyosarcoma surgery: Background, anatomy, pathophysiology Available from: https://emedicine.medscape.com/article/939156-overview#a2 (2019)
- Ognjanovic, S., Linabery, A. M., Charbonneau, B., Ross, J. A. Trends in childhood rhabdomyosarcoma incidence and survival in the United States, 1975-2005. Cancer. 115 (18), 4218-4226 (2009).
- Mulrooney, D. A., et al. Cardiac outcomes in a cohort of adult survivors of childhood and adolescent cancer: retrospective analysis of the Childhood Cancer Survivor Study cohort. BMJ. 339, (2009).
- Lipshultz, S. E., Cochran, T. R., Franco, V. I., Miller, T. L. Treatment-related cardiotoxicity in survivors of childhood cancer. Nature Reviews Clinical Oncology. 10 (12), 697-710 (2013).
- Winter, S., Fasola, S., Brisse, H., Mosseri, V., Orbach, D. Relapse after localized rhabdomyosarcoma: Evaluation of the efficacy of second-line chemotherapy. Pediatric Blood & Cancer. 62 (11), 1935-1941 (2015).
- Wood, B. J., et al. Phase I study of heat-deployed liposomal doxorubicin during radiofrequency ablation for hepatic malignancies. Journal of Vascular and Interventional Radiology. 23 (2), 248-255 (2012).
- Bulbake, U., Doppalapudi, S., Kommineni, N., Khan, W. Liposomal formulations in clinical use: an updated review. Pharmaceutics. 9 (2), 12 (2017).
- Zagar, T. M., et al. Two phase I dose-escalation/pharmacokinetics studies of low temperature liposomal doxorubicin (LTLD) and mild local hyperthermia in heavily pretreated patients with local regionally recurrent breast cancer. International Journal of Hyperthermia. 30 (5), 285-294 (2014).
- . A phase I study of lyso-thermosensitive liposomal doxorubicin and MR-HIFU for pediatric refractory solid tumors Available from: https://clinicaltrials.gov/ct2/show/NCT02536183 (2019)
- PanDox: targeted doxorubicin in pancreatic tumours (PanDox). University of Oxford Available from: https://clinicaltrials.gov/ct2/show/NCT04852367 (2021)
- . Image-guided targeted doxorubicin delivery with hyperthermia to optimize loco-regional control in breast cancer (i-GO) Available from: https://clinicaltrials.gov/ct2/show/NCT03749850 (2018)
- De Vita, A., et al. Lysyl oxidase engineered lipid nanovesicles for the treatment of triple negative breast cancer. Scientific Reports. 11 (1), 5107 (2021).
- Sapareto, S. A., Dewey, W. C. Thermal dose determination in cancer therapy. International Journal of Radiation Oncology, Biology, Physics. 10 (6), 787-800 (1984).
- Kok, H. P., et al. Heating technology for malignant tumors: a review. International Journal of Hyperthermia. 37 (1), 711-741 (2020).
- Kokuryo, D., Kumamoto, E., Kuroda, K. Recent technological advancements in thermometry. Advanced Drug Delivery Reviews. 163, 19-39 (2020).
- Bongiovanni, A., et al. 3-T magnetic resonance-guided high-intensity focused ultrasound (3 T-MR-HIFU) for the treatment of pain from bone metastases of solid tumors. Support Care Cancer. 30 (7), 5737-5745 (2022).
- Seifert, G., et al. Regional hyperthermia combined with chemotherapy in paediatric, adolescent and young adult patients: current and future perspectives. Radiation Oncology. 11, 65 (2016).
- Dewhirst, M. W., Lee, C. -. T., Ashcraft, K. A. The future of biology in driving the field of hyperthermia. International Journal of Hyperthermia. 32 (1), 4-13 (2016).
- Dewhirst, M. W., Vujaskovic, Z., Jones, E., Thrall, D. Re-setting the biologic rationale for thermal therapy. International Journal of Hyperthermia. 21 (8), 779-790 (2005).
- Repasky, E. A., Evans, S. S., Dewhirst, M. W. Temperature matters! And why it should matter to tumor immunologists. Cancer Immunology Research. 1 (4), 210-216 (2013).
- Hijnen, N., et al. Thermal combination therapies for local drug delivery by magnetic resonance-guided high-intensity focused ultrasound. Proceedings of the National Academy of Sciences. 114 (24), E4802-E4811 (2017).
- Shultz, L. D., et al. Human cancer growth and therapy in immunodeficient mouse models. Cold Spring Harbor Protocols. 2014 (7), 694-708 (2014).
- De Vita, A., et al. Deciphering the genomic landscape and pharmacological profile of uncommon entities of adult rhabdomyosarcomas. International Journal of Molecular Sciences. 22 (21), 11564 (2021).
- McKinnon, T., et al. Functional screening of FGFR4-driven tumorigenesis identifies PI3K/mTOR inhibition as a therapeutic strategy in rhabdomyosarcoma. Oncogene. 37 (20), 2630-2644 (2018).
- Zaporzan, B., et al. MatMRI and MatHIFU: software toolboxes for real-time monitoring and control of MR-guided HIFU. Journal of Therapeutic Ultrasound. 1, (2013).
- Dunne, M., et al. Heat-activated drug delivery increases tumor accumulation of synergistic chemotherapies. Journal of Controlled Release. 308, 197-208 (2019).
- Zhao, Y. X., Hu, X. Y., Zhong, X., Shen, H., Yuan, Y. High-intensity focused ultrasound treatment as an alternative regimen for myxofibrosarcoma. Dermatologic Therapy. 34 (2), 14816 (2021).
- Vanni, S., et al. Myxofibrosarcoma landscape: diagnostic pitfalls, clinical management and future perspectives. Therapeutic Advances in Medical Oncology. 14, 17588359221093973 (2022).
Erratum
Formal Correction: Erratum: Magnetic Resonance-Guided High Intensity Focused Ultrasound Generated Hyperthermia: A Feasible Treatment Method in a Murine Rhabdomyosarcoma Model
Posted by JoVE Editors on 2/08/2023. Citeable Link.
An erratum was issued for: Magnetic Resonance-Guided High Intensity Focused Ultrasound Generated Hyperthermia: A Feasible Treatment Method in a Murine Rhabdomyosarcoma Model . The Authors section was updated from:
Claire Wunker1,2
Karolina Piorkowska3
Ben Keunen3
Yael Babichev2
Suzanne M. Wong3,4
Maximilian Regenold5
Michael Dunne5
Julia Nomikos1,2
Maryam Siddiqui6
Samuel Pichardo6
Warren Foltz7
Adam C. Waspe3,8
Justin T. Gerstle3,9
Rebecca A. Gladdy1,2,10
1 Institute of Medical Science, University of Toronto
2 2Lunenfeld-Tanenbaum Research Institute, Mount Sinai Hospital
3 The Wilfred and Joyce Posluns Centre for Image-Guided Innovation and Therapeutic Intervention, The Hospital for Sick Children
4 Institute of Biomedical Engineering, University of Toronto
5 Leslie Dan Faculty of Pharmacy, University of Toronto
6 Departments of Radiology and Clinical Neurosciences, University of Calgary
7 Department of Radiation Oncology, University of Toronto
8 Department of Medical Imaging, University of Toronto
9 Department of Pediatric Surgery, University of Toronto
10 Department of Surgery, University of Toronto
to:
Claire Wunker1,2
Karolina Piorkowska3
Ben Keunen3
Yael Babichev2
Suzanne M. Wong3,4
Maximilian Regenold5
Michael Dunne5
Julia Nomikos1,2
Maryam Siddiqui6
Samuel Pichardo6
Warren Foltz7
Adam C. Waspe3,8
Justin T. Gerstle3,9
James M. Drake1,3,4,10
Rebecca A. Gladdy1,2,10
1 Institute of Medical Science, University of Toronto
2 Lunenfeld-Tanenbaum Research Institute, Mount Sinai Hospital
3 The Wilfred and Joyce Posluns Centre for Image-Guided Innovation and Therapeutic Intervention, The Hospital for Sick Children
4 Institute of Biomedical Engineering, University of Toronto
5 Leslie Dan Faculty of Pharmacy, University of Toronto
6 Departments of Radiology and Clinical Neurosciences, University of Calgary
7 Department of Radiation Oncology, University of Toronto
8 Department of Medical Imaging, University of Toronto
9 Department of Pediatric Surgery, University of Toronto
10 Department of Surgery, University of Toronto
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon