Method Article
Magnetresonanzgesteuerte, hochintensive, fokussierte, ultraschallerzeugte Hyperthermie: eine praktikable Behandlungsmethode in einem murinen Rhabdomyosarkommodell
In diesem Artikel
Erratum Notice
Zusammenfassung
Hier wird ein Protokoll vorgestellt, um kontrollierte Hyperthermie, die durch magnetresonanzgesteuerten, hochintensiven fokussierten Ultraschall erzeugt wird, zu verwenden, um die Wirkstofffreisetzung von temperaturempfindlichen Liposomen in einem Rhabdomyosarkom-Mausmodell auszulösen.
Zusammenfassung
Der magnetresonanzgesteuerte hochintensive fokussierte Ultraschall (MRgHIFU) ist eine etablierte Methode zur Erzeugung einer lokalisierten Hyperthermie. Aufgrund der Echtzeit-Bildgebung und der akustischen Energiemodulation ermöglicht diese Modalität eine präzise Temperaturregelung innerhalb eines definierten Bereichs. Mit dieser nicht-invasiven, nichtionisierenden Technologie werden viele thermische Anwendungen erforscht, wie z. B. die Erzeugung von Hyperthermie, um Medikamente aus thermosensitiven liposomalen Trägern freizusetzen. Zu diesen Medikamenten können Chemotherapien wie Doxorubicin gehören, bei denen aufgrund der dosisbegrenzenden systemischen Nebenwirkungen, nämlich der Kardiotoxizität, eine gezielte Freisetzung erwünscht ist. Doxorubicin ist eine tragende Säule für die Behandlung einer Vielzahl von bösartigen Tumoren und wird häufig bei rezidivierendem oder rezidivierendem Rhabdomyosarkom (RMS) eingesetzt. RMS ist der häufigste extrakranielle Tumor des soliden Weichgewebes bei Kindern und jungen Erwachsenen. Trotz aggressiver, multimodaler Therapie sind die Überlebensraten des RMS in den letzten 30 Jahren gleich geblieben. Um eine Lösung für diesen ungedeckten Bedarf zu finden, wurde ein experimentelles Protokoll entwickelt, um die Freisetzung von thermosensitivem liposomalem Doxorubicin (TLD) in einem immunkompetenten, syngenen RMS-Mausmodell zu untersuchen, das MRgHIFU als Quelle der Hyperthermie für die Wirkstofffreisetzung verwendet.
Einleitung
Das Rhabdomyosarkom (RMS) ist ein Skelettmuskeltumor, der am häufigsten bei Kindern und jungen Erwachsenen auftritt1. Lokalisierte Erkrankungen werden oft mit einer multimodalen Behandlung behandelt, einschließlich Chemotherapie, ionisierender Strahlung und Operation. Der Einsatz von Multi-Medikamenten-Chemotherapien ist bei pädiatrischen Patienten häufiger anzutreffen und hat im Vergleich zu ihren erwachsenen Kollegen bessere Ergebnisseerzielt 2; Trotz laufender Forschungsbemühungen liegt die 5-Jahres-Überlebensrate bei der aggressivsten Form der Krankheit jedoch nach wie vor bei etwa 30 % 3,4. Die Standardtherapie der Chemotherapie ist ein Multidrug-Schema, das Vincristin, Cyclophosphamid und Actinomycin D umfasst. Bei rezidivierender oder rezidivierender Erkrankung werden alternative Chemotherapien eingesetzt, darunter Standard-Doxorubicin (FD) und Ifosfamid1. Während alle diese Chemotherapien systemische Toxizitäten aufweisen, erzwingt die Kardiotoxizität von Doxorubicin eine lebenslange Dosisbegrenzungvon 5-7. Um die Menge des an den Tumor abgegebenen Arzneimittels zu erhöhen und die systemische Toxizität zu minimieren, wurden alternative Formulierungen entwickelt, einschließlich liposomaler Verkapselung. Dabei kann es sich um nicht-thermosensitives Doxorubicin handeln, das für die Behandlung von Brustkrebs und hepatozellulärem Karzinom zugelassen ist, oder um thermosensitives Doxorubicin, für das klinische Studien laufen 8,9,10,11,12,13. Alternative Methoden zur Verabreichung liposomal verkapselter Arzneimittel wie multivesikuläre Liposomen und Liganden-gerichtete Liposomen wurden evaluiert und sind vielversprechend für die Behandlung von Tumoren9. In dieser Studie hat die Zugabe von Wärme multifaktorielle Auswirkungen, einschließlich der Wirkstofffreisetzung14. Die Kombination von Hyperthermie (HT), die mit magnetresonanzgesteuertem hochintensivem fokussiertem Ultraschall (MRgHIFU) und thermosensitivem liposomalem Doxorubicin (TLD) erzeugt wird, ist ein neuartiger multimodaler therapeutischer Ansatz für den Einsatz dieses toxischen, aber wirksamen Medikaments zur Behandlung von RMS, während gleichzeitig die dosislimitierende Toxizität minimiert und möglicherweise die Immunantwort auf den Tumor erhöht wird.
Doxorubicin wird bei Temperaturen von >39 °C schnell aus TLD freigesetzt, was weit über der durchschnittlichen menschlichen Körpertemperatur von 37 °C liegt, aber nicht hoch genug ist, um Gewebeschäden oder Ablation zu verursachen. Dies beginnt bei 43 °C, tritt aber schneller auf, wenn sich die Temperaturen 60 °C nähern15. Zur Erzeugung von HT in vivo wurden verschiedene Methoden eingesetzt, darunter Laser, Mikrowellen, Radiofrequenzablation und fokussierter Ultraschall, von denen viele invasive Erhitzungsmethoden sind16. MRgHIFU ist eine nicht-invasive, nichtionisierende Heizmethode, die eine präzise Temperatureinstellung innerhalb des Zielgewebes in situ ermöglicht. Die Magnetresonanztomographie (MR) bietet eine Echtzeit-Bildgebung, bei der Computersoftware verwendet werden kann, um eine thermometrische Messung des Gewebes während der gesamten Behandlung zu berechnen. Anschließend können diese Daten verwendet werden, um die Ultraschalltherapie in Echtzeit zu steuern, um einen gewünschten Temperatursollwert17 zu erreichen und zu halten. MRgHIFU wurde in verschiedenen Gewebetypen getestet und kann für eine Vielzahl von Temperaturbehandlungen eingesetzt werden, von der leichten HT bis zur Ablation, sowie klinisch zur erfolgreichen Behandlung schmerzhafter Knochenmetastasen18. Darüber hinaus wurde gezeigt, dass HT Tumorzytotoxizität verursacht, die Proteinexpression moduliert und die Immunantwort in der Tumormikroumgebung verändert 19,20,21,22. In einer Studie wurde eine milde HT mit TLD, gefolgt von einer Ablation mit MRgHIFU, in einem synergetischen R1-Rattenmodell23 kombiniert, was zu einer Nekrose im Tumorkern und einer Medikamentenabgabe in die Peripherie führte. Traditionell wurde die Strahlentherapie als Zusatztherapie eingesetzt, um Tumorzellen zu schädigen und das lokale Wiederauftreten der Krankheit zu verringern. Seine Verwendung ist jedoch durch die lebenslange Dosierung und den Schaden außerhalb des Zielsbegrenzt 1. Daher ist HT insofern einzigartig, als es einige der gleichen Wirkungen ohne die gleichen Toxizitäten oder Einschränkungen verursachen kann.
Zu den präklinischen Tiermodellen für RMS gehören syngene immunkompetente Modelle und patientenabgeleitete Xenotransplantate (PDX) in immungeschwächten Wirten. Die immungeschwächten Modelle ermöglichen zwar das Wachstum der menschlichen Tumore, aber ihnen fehlt die geeignete Tumormikroumgebung und sie sind in ihrer Fähigkeit, die Immunantwort zu untersuchen, eingeschränkt24. Die FGFR4-aktivierende Mutation ist ein vielversprechender Marker für eine schlechte Prognose und ein potenzielles therapeutisches Ziel bei adulter und pädiatrischer RMS 1,25. In den syngenen RMS-Modellen, die im Gladdy-Labor entwickelt wurden, sind die Tumore in der Lage, in einem immunkompetenten Wirt zu wachsen, der eine angeborene und adaptive Immunantwort auf den Tumor entwickelt26. Da HT die Immunantwort beeinflusst, ist die Beobachtung der Veränderung der murinen Immunantwort ein wertvoller Vorteil dieses Tumormodells. Um sowohl die Tumorantwort auf TLD im Vergleich zu FD als auch die Veränderung der Immunantwort des Tumors sowohl auf Chemotherapie als auch auf HT zu testen, wurde ein Protokoll zur Behandlung von syngenen murinen RMS-Tumoren in vivo mit MRgHIFU und TLD entwickelt und eingesetzt, was im Fokus dieser Studie steht.
Protokoll
Die Forschung wurde in Übereinstimmung mit den Tierpflegeausschüssen mit genehmigten Tierverwendungsprotokollen unter einem beaufsichtigenden Tierarzt in den Tierversuchseinrichtungen des Centre for Phenogenomics (TCP) und des University Health Network (UHN) Animal Resource Centre (ARC) durchgeführt. Alle Verfahren, mit Ausnahme des MRgHIFU, an denen die Tiere beteiligt waren, wurden in einer biologischen Sicherheitswerkbank (BSC) durchgeführt, um die Exposition der Tiere gegenüber der Außenluft oder anfällige Infektionen zu minimieren.
1. Mäusezucht
HINWEIS: Insgesamt wurden 65 Mäuse (Stamm B6.129S2-Trp53tm1Tyj/J) in die Pilotstudie eingeschlossen (Männchen: n = 23; Weibchen: n = 42). Sowohl männliche als auch weibliche Mäuse wurden im Alter von 7-9 Wochen verwendet. Ihre Jungtiere wurden entwöhnt und genotypisiert, und die heterozygoten p53-Mäuse wurden für die Experimente verwendet.
- Unterbringe mit jeder männlichen Maus zwei weibliche Mäuse, um Zuchtkäfige zu bauen. Zählen Sie das Alter ihrer Welpen von Geburt an (Geburt = Tag 0).
- Identifizieren Sie die Welpen an Tag 10 mit einer Ohrkerbe. Sammeln Sie Schwanzschnipsel für die Genotypisierung vor der Injektion von Zelllinien.
2. Genotypisierung der Maus
- Extrahieren Sie DNA aus dem gesammelten 2-mm-Schwanzschnitt mit einem handelsüblichen DNA-Extraktionskit (siehe Materialtabelle) gemäß den Anweisungen des Herstellers.
- Bestimmen Sie die DNA-Konzentration und -Reinheit, indem Sie die Absorption bei 260-280 nm auf einem Spektralphotometer messen (siehe Materialtabelle).
- Führen Sie eine Polymerase-Kettenreaktion (PCR) durch.
- Erstellen Sie einen Mastermix, der eine kommerzielle PCR-Mischung (mit Taq-Polymerase, dNTPS und MgCl 2; siehe Materialtabelle), Primer und dH2O in einem Verhältnis von 12,5:0,25:10,75 (μL) für die erforderliche Anzahl von Proben enthält. Geben Sie 1 μl DNA-Probe in jedes PCR-Röhrchen und fügen SiedH2O, eine Nullprobe (homozygot für p53-Mutation), eine heterozygote Probe (heterozygot für p53-Mutation) und eine Wildtyp-Probe (homozygot für normales p53) als PCR-Kontrollen hinzu.
- Geben Sie 24 μl des Mastermixes in jedes PCR-Röhrchen, das DNA enthält. Pipettieren Sie die Lösung in jedem PCR-Röhrchen auf und ab, um die DNA im gesamten Mastermix zu verteilen.
- Legen Sie die Reaktionsgefäße in einen Thermocycler und durchlaufen Sie sie gemäß den folgenden Spezifikationen: 95 °C für 2 Minuten, 40 Zyklen von 95 °C für 15 s, 60 °C für 15 s und 72 °C für 1 Minute und dann bei 4 °C halten, bis Sie bereit sind, auf dem Gel zu analysieren.
- Analysieren Sie die PCR-Produkte mittels Agarose-Gelelektrophorese.
- Bereiten Sie ein 2%iges Gel (50 ml 1x TAE und 1 g Agarose) vor, indem Sie die Agarose in der TAE erhitzen und mischen, bis sie sich aufgelöst hat. Wenn es abgekühlt und noch flüssig ist, fügen Sie der Agarose 2,5 μl DNA-Gelfärbung hinzu und mischen Sie. Gießen Sie das Gel in eine Gelbox mit einem Kamm. Geben Sie das Gel in die elektrophoretische Apparatur (siehe Materialtabelle) und bedecken Sie es mit 1x TAE.
- Laden Sie 10 μL 1 kB DNA Ladder auf das Gel. Laden Sie 12,5 μl jeder Probe. Lassen Sie das Gel 25 Minuten lang bei 135 V laufen.
- Bilde das Gel mit den entsprechenden Einstellungen für die verwendete DNA-Gelfärbung auf einem Gel-Imager (siehe Materialtabelle) gemäß den Anweisungen des Herstellers ab.
3. Vorbereitung des Tumormodells (Abbildung 1)
- Die M25FV24C-Zelllinie (Passage 12-15) wird 1 Woche vor dem Injektionstermin in komplettem Nährmedium (Dulbecco's Modified Eagle Medium [DMEM] mit Zusatzstoffen: 10 % FBS, 1 % Penicillin/Streptomycin und 2 mM L-Alanyl-L-Glutamin-Dipeptid) in einem 75-ml-Kolben bei 37 °C und 5 % CO2 gezüchtet. Sobald die Zellen zu ~80 % konfluent sind, saugen Sie das Medium ab und waschen Sie die Zellen 1x mit 5 ml Dulbeccos phosphatgepufferter Kochsalzlösung (DPBS).
HINWEIS: M25FV24C ist eine murine Zelllinie, die zur Überexpression der Mutante FGFR4V550E entwickelt wurde, die bei pädiatrischen und adulten RMS 1,26 beobachtet wird. - Heben Sie die Zellen an, indem Sie 0,5 ml 0,25%ige Trypsinlösung an die Seite der Platte geben und das Gefäß 2-3 Minuten bei Raumtemperatur inkubieren. Sobald sich die Zellen gelöst zu haben scheinen, fügen Sie 2,5 ml vollständiges Nährmedium bei Raumtemperatur hinzu, um das Trypsin zu inaktivieren. Verwenden Sie ein 10-μl-Probenaliquot, um die Zellkonzentration lebensfähiger Zellen mit einem Hämozytometer und einem Trypanblau-Ausschluss zu bestimmen.
- Bereiten Sie das richtige Volumen der DPBS-suspendierten Zellen für die Injektion vor und geben Sie es in ein 1,5-ml-Mikrozentrifugenröhrchen: zu zentrifugierendes Volumen = (Anzahl der Mäuse × Anzahl der Zellen pro Maus)/ (Konzentration der Zellen), wobei die Anzahl der Mäuse = die zu injizierenden Mäuse + 10 zusätzliche Mäuse für Fehler und die Anzahl der Zellen pro Maus = 104.
- 5 min bei 153 x g zentrifugieren. Resuspendieren Sie das Zellpellet im entsprechenden Volumen (10 μl pro Maus × Anzahl der Mäuse) des Myo-Injektionspuffers (F10-Medium + 0,5 % FBS) und injizieren Sie die Mäuse innerhalb von 1 Stunde nach der Herstellung dieser Suspension.
4. Intramuskuläre Zellinjektion
HINWEIS: M25FV24C-Zellen werden im Alter von 4 bis 6 Wochen in die rechte Hintergliedmaße von Mäusen injiziert. Die Injektion nach 4 Wochen führt zu einer kleinen Maus mit einem Tumor, der schwieriger zu behandeln sein kann, da weniger umgebendes Gewebe für die HT-Dispersion vorhanden ist. Wenn Sie bis zu 6 Wochen warten, erhalten Sie eine größere Maus, was die Behandlung des Tumors erleichtert.
- Invertieren Sie die Zellsuspension vor der Aspiration mehrmals, um die Zellen gleichmäßig in der Lösung zu verteilen. 10 μL (10,4 Zellen) mit einer Mikroliterspritze absaugen (siehe Materialtabelle). Scruff die Maus; Nach der Fixierung kann der Zugang zu den kaudalen Oberschenkelmuskeln durch Streckung des Hinterbeins erlangt werden. Rasieren Sie das Bein mit einer Haarschneidemaschine und wischen Sie es mit 70% Ethanol ab.
- Injizieren Sie die M25FV24C-Zellsuspension (10 μL, 10 4 Zellen) mit einer gasdichten Mikroliterspritze mit einer 26s G-Nadel in die rechte Hinterschenkelmuskulatur einer4-6 Wochen alten Maus.
HINWEIS: Die Nadel sollte parallel zum Oberschenkelknochen in Richtung Knie eingeführt werden, wobei darauf zu achten ist, dass der Ischiasnerv nicht getroffen wird. Führen Sie aufgrund der geringen Muskelmasse der Hintergliedmaße nur die Nadelspitze (ca. 2 mm) ein. - Verabreichen Sie die Lösung in einer gleichmäßigen Bewegung. Entfernen Sie die Nadel und stellen Sie sicher, dass keine Blutungen auftreten. Bringen Sie die Maus in einen zweiten Käfig zurück.
- Untersuchen Sie die Tiere täglich und überwachen Sie ihre Hinterbeine durch Abtasten auf Tumorwachstum. Euthanasieren Sie die Mäuse mit Kohlendioxid, wenn einer der folgenden frühen Endpunkte auftritt: Tumorgröße mit einem Durchmesser von mehr als 1,5 cm, Tumorulzeration oder systemische Krankheitszeichen (Piloerektion, gekrümmte Haltung, Inaktivität oder verminderte Nahrungs- oder Wasseraufnahme).
5. Screening-MRT-Scan
- Betäuben Sie die Maus mit Isofluran unter den folgenden Parametern bis zu einem Niveau, auf dem es keine Bewegung mehr gibt, mit Isofluran: induzieren Sie es in einer Kammer mit 4 % bei 1,5 l/min, übertragen Sie es dann auf den Nasenkegel des MRT-Scanners und setzen Sie die Isofluran-Aufrechterhaltung am Nasenkegel mit 1,5 %-2 % bei 0,75 l/min fort. Bringen Sie den Atemmonitor an. Verwenden Sie Tierarztsalbe auf den Augen, um Trockenheit unter Narkose zu vermeiden.
- Stellen Sie die anästhesierte Maus mit dem MRT-Scanner dar (siehe Materialtabelle). Notieren Sie sich auf dem T2-gewichteten Bild (Ax_Screen Aufnahme, Tabelle 1) die Abmessungen in der Ebene und die Anzahl der axialen Schnitte, in denen der Tumor erscheint. Notieren Sie sich die Lage des Tumors in Bezug auf den Femur und die laterale Oberfläche des Oberschenkels, wo die Ultraschallwelle eintreten würde.
Anmerkung: Der Tumor erscheint als hyperintense Masse innerhalb des Muskels, die von der gegenüberliegenden Seite asymmetrisch ist. Eine gute Ausgangstumorgröße für mehrere Behandlungen beträgt 2 mm x 2 mm x 2 mm für Akut- oder Überlebensstudien. Wenn er viel größer ist, ist er nur für akute Studien geeignet, da der Tumor vor Abschluss von drei wöchentlichen Behandlungen einen Größenendpunkt erreicht. Zu den Ausschlusskriterien für eine HIFU-Behandlung gehören: um den Femur gewickelt, zu nah am Femur, zu posterior bei der Maus, medial des Femurs, zu nah am Rektum. - Nehmen Sie die Maus aus dem Scanner und ermitteln Sie die Basisgewichtung. Rasieren Sie die Maus unter Narkose mit einem Elektrorasierer von der Körpermitte bis zu den Füßen.
Anmerkungen: Idealerweise wird die Rasur 1 Tag vor der Behandlung durchgeführt, da die Maus so die Pflege durchführen kann, wodurch die Enthaarungscreme effizienter wirken kann. - Bringen Sie die Maus mit einem Heizkissen unter einem Ende des Käfigs wieder in die BSC. Bringen Sie die Maus in ihren Käfig zurück, wenn sie das Brustbein wieder aufnimmt.
6. Experiment: HIFU-Behandlungstag Tiervorbereitung
- Um das HIFU-System mit kleinem Durchmesser (siehe Materialtabelle) vorzubereiten, schalten Sie den Generator ein und füllen Sie den Wandler mit genügend deionisiertem Wasser, bis sich die Membran unter dem Wandler ausdehnt, aber nicht so fest, dass sie die Maus zusammendrücken würde. Entgasen Sie das Wasser im Wandlerkreislauf für 30 Minuten, um gelösten Sauerstoff aus dem Medium zu entfernen.
- Bereiten Sie das zugehörige Computersystem vor.
- Schalten Sie den steuernden Computer ein und stellen Sie sicher, dass er über Ethernet mit dem HIFU-Generator und über USB mit dem Display der Wärmesonde verbunden ist. Starten Sie die Software und klicken Sie auf Home, um den Schallkopf zu starten, bevor Sie die Maus einsetzen.
- Kalibrieren Sie die faseroptischen Wärmesonden: Ermitteln Sie die Basis-Raumtemperaturen und notieren Sie die Temperaturänderung im MRT-Raum. Beachten Sie das Ausmaß der Temperaturdrift für jede Sonde aufgrund der magnetischen Feldstärke. Führen Sie den Temperaturfühler des Driftrohrs zur Temperaturkalibrierung während des Scanvorgangs in ein mit Gadolinium gefülltes Glasröhrchen ein und sichern Sie das Driftrohr mit Klebeband.
HINWEIS: Die Basis-Raumtemperatur (Driftrohr) wird manuell als Thermometrieparameter in der GUI in der Software hinzugefügt. Innerhalb des Driftrohrs im MR-Bild wird eine Region of Interest (ROI) eingestellt, um eine Temperaturdrift zu erkennen, und korrigiert die Thermometriebilder automatisch. - Ziehen Sie das zu injizierende Arzneimittel in eine 1-ml-Spritze auf und geben Sie es in die automatische Förderpumpe (siehe Materialtabelle). Bereiten Sie die Leitung, die mit dem Schwanzvenenkatheter der Maus verbunden wird, vor, bis das Medikament die Leitung vollständig gefüllt hat, indem Sie die Taste für die manuelle Abgabe an der automatischen Abgabepumpe drücken.
- Verwenden Sie eine Wärmelampe, um die Mäuse in den Käfigen ~20 Minuten lang zu erwärmen, bevor Sie sie in die Anästhesiekammer bringen.
Anmerkungen: Das Vorheizen fördert die Vasodilatation, die auftritt, sobald die Maus betäubt wird, und hilft bei der Platzierung des Katheters.
- Die Maus wird mit Isofluran betäubt (Induktion: 4 % bei 1,5 l/min; Erhaltung: 1,5 %-2 % bei 0,75 l/min) und in einen Nasenkegel überführt. Tragen Sie ein Hornhautgleitmittel auf die Augen auf, um Schäden durch den fehlenden Blinzelreflex unter Narkose zu vermeiden.
- Tragen Sie Enthaarungscreme auf die rasierte Stelle, einschließlich der gesamten rechten Hintergliedmaße, auf und befolgen Sie die Anweisungen des Herstellers zur Haarentfernung.
Anmerkungen: Positionieren Sie die Maus unter einer Wärmelampe, während sie sich in der BSC befindet, um die Wärmeregulierung während der Haarentfernung unter Narkose zu unterstützen. - Nachdem Sie die Enthaarungscreme mit warmem Wasser abgewaschen haben, wiegen Sie die Maus auf einer digitalen Waage und notieren Sie die Medikamentendosierung.
- Bewegen Sie die Maus zu einem MRT-kompatiblen Nasenkegel auf dem MRT-Schlitten. Positionieren Sie eine Wärmelampe an der Maus, um sie warm zu halten, während Sie sich auf das MRT vorbereiten. Platzieren Sie die Maus in der lateralen Dekubitusposition mit der nicht-tumortragenden Seite nach unten und dem Tumor superior in einem 3D-gedruckten Maushalter auf dem Schlitten (ergänzende Abbildung 1 und Abbildung 2). Stellen Sie sicher, dass der Tumor richtig positioniert ist (d. h. in der Mitte der Spule horizontal und vertikal, mit der Höhe knapp über den Rändern des Maushalters, um die Kompression durch den Ultraschallkopf zu berücksichtigen).
Anmerkungen: Schneiden Sie bei Bedarf ein komprimiertes Ultraschall-Gelpad-Segment ab, um es unter die Maus zu legen und die Unterseite des Halters mit einer Dicke auszukleiden, um den Tumor bis zur Oberseite des Halters auszurichten. - Stecken Sie das unbeteiligte Bein vom Tumorbein weg, entweder unter der Maus oder gestreckt mit gebeugtem Tumorbein. Stellen Sie sicher, dass sich die Füße nicht im Nah- oder Fernfeld des Tumor- und Ultraschallstrahlengangs befinden. Positionieren Sie die Wärmelampe 15 cm vom Schwanz entfernt, um sie für das Einführen des Katheters in die Schwanzvene zu erwärmen.
- Führen Sie den Ösophagustemperaturfühler ein.
- Fädeln Sie die Speiseröhrensonde durch den Nasenkegel und schrubben Sie den Hals der Maus. Neigen Sie die Mausnase nach oben, um eine Linie vom Maul direkt zum Bauch zu bilden, indem Sie den Kopf verlängern. Schieben Sie die Wärmesonde ca. 0,5 cm über die Zunge in die Speiseröhre der Maus und setzen Sie den Nasenkegel wieder um die Nase der Maus ein. Befestigen Sie die Speiseröhrensonde und den Nasenkegel an der Oberseite des Schlittens.
Anmerkungen: Achten Sie unmittelbar nach dem Einführen auf Anzeichen von Atemnot, da es unsachgemäß in die Luftröhre eingeführt werden kann.
- Fädeln Sie die Speiseröhrensonde durch den Nasenkegel und schrubben Sie den Hals der Maus. Neigen Sie die Mausnase nach oben, um eine Linie vom Maul direkt zum Bauch zu bilden, indem Sie den Kopf verlängern. Schieben Sie die Wärmesonde ca. 0,5 cm über die Zunge in die Speiseröhre der Maus und setzen Sie den Nasenkegel wieder um die Nase der Maus ein. Befestigen Sie die Speiseröhrensonde und den Nasenkegel an der Oberseite des Schlittens.
- Führen Sie den rektalen Temperaturfühler ein.
Anmerkungen: Die rektalen und ösophagealen Temperaturfühler sollten innerhalb von 3 °C voneinander entfernt sein. - Platzieren Sie den Atemmonitor mit dem Verbindungskabel in Richtung des Mauskopfes, damit er die Platzierung des Ultraschallwandlers nicht stört. Mit Klebeband sichern.
- Führen Sie einen 27-G-Schmetterlingsnadel-Schwanzvenenkatheter mit 20 μl Totraum und Klebeband in eine seitliche Schwanzvene ein, die an einem Mikroschlauch befestigt ist. Stellen Sie nach dem Tapen sicher, dass der Katheter noch gut spült.
- Tragen Sie die vorbereitete Maus, den Mausschlitten, den Anästhesieschlauch, den Beatmungsschlauch, den Schwanzvenenkatheter und die Wärmesondenschnüre zu zweit in den MRT-Scanner und legen Sie sie in den MRT-Schlittenhalter.
- Lassen Sie den Bediener der HIFU-Software ( siehe Materialtabelle) den Meniskus des Schallkopfs durch Sichtprüfung direkt über den Tumor bewegen, um eine anfängliche Ausrichtung27 zu erreichen. Tragen Sie Augengleitgel oder entgastes Ultraschallgel auf die haarlose Haut über dem Tumor auf und koppeln Sie den HIFU-Schallkopf an den Tumorbereich.
- Schließen Sie die Medikamentenabgabeleitung von der automatischen Pumpe an den Schwanzvenenkatheter an. Berechnen Sie den Totraum in der Schwanzvenenlinie und der Verbindungslinie. Schieben Sie den Maus-HIFU-Schlitten auf MRT-Schienen in die Mitte des MRT.
- Stellen Sie die Menge der Arzneimittelinfusion an der Pumpe ein, abhängig von der Art und Konzentration des Arzneimittels und dem Gewicht des Tieres, und fügen Sie die Menge des Totraums hinzu. Stellen Sie die Pumpe auf eine Infusionsrate von 200 μL/min ein.
HINWEIS: In dieser Studie wurden FD und TLD in einer Konzentration von 2 mg/ml und einer Dosis von 5 mg/kg Körpergewicht verwendet. - Notieren Sie die Basistemperaturen der Wärmefühler.
- Stellen Sie das Luftkonvektionswärmgerät (siehe Materialtabelle) auf die wärmste Stufe. Richten Sie den Schlauch, der Luft in die Mitte der MRT-Bohrung bläst, auf die Maus und befestigen Sie sie mit Klebeband. Das Aufwärmgerät wird später auf die niedrigste Stufe (32 °C) gedreht, um eine Überhitzung der Maus während der Beschallung zu vermeiden.
- Erfassen Sie die MR-Bilder der Vermessung (Ax_Loc, Sag_Loc; Tabelle 1) zur Bestimmung der Tumorlokalisation für das Beschallungsziel, einschließlich der Tiefe. Passen Sie die Position des Gebers mit der HIFU-Software entsprechend an, indem Sie den gewünschten Bewegungsabstand eingeben, der auf dem Bild gemessen wird, und dann auf die Pfeilrichtung klicken, um sich zu bewegen (Abbildung 3A). Beachten Sie auch die Position des Driftrohrs. Wiederholen Sie den Vorgang nach Bedarf.
- Bestimmen Sie die Position des Brennflecks des Schallkopfs in der koronalen Ebene, indem Sie während der Test_Shot Thermometrieaufnahme eine kurze kontinuierliche "Testaufnahme" mit einer Amplitude von 5 s x 50 mV durchführen (Tabelle 1).
- Richten Sie die MR-Survey-Bilder mit der koronalen Ansicht des Brennflecks in der HIFU-Software aus. Überprüfen Sie die Bilder auf die Lokalisation des Tumors in Bezug auf die knöcherne Struktur und das Rektum und überprüfen Sie die Positionierung des Schallkopfs nach Bedarf.
- Wiederholen Sie die Testbeschallung während der Thermo-Bildgebung mit neun Wiederholungen (Tabelle 1), um zu bestätigen, ob das Tumorvolumen gleichmäßig und genau erhitzt wird und nur eine minimale Off-Target-Erwärmung vorliegt. Passen Sie die Scheibenposition, die Position des Gebers und die Lenktiefe an und bestätigen Sie die Heizleistung mit wiederholten "Testschüssen", wenn dies als erforderlich erachtet wird.
- Definieren Sie mit der HIFU-Behandlungsüberwachungssoftware den ROI für die thermometrische Überwachung innerhalb des endgültigen Heizprofils, indem Sie den zu bewegenden Abstand messen und dann die Rasterkoordinaten im Programm ändern. Stellen Sie einen ROI um das Driftrohr herum ein, um die Drift zu korrigieren. Geben Sie die Basistemperatur basierend auf der Temperatur der rektalen Sonde für thermometrische Messungen ein. Das HIFU-System wird verwendet, um die HIFU-Behandlung zu initiieren, die Beschallung durchzuführen und die Thermometrie zu überwachen.
- Öffnen Sie die Spezifikationen für die 20-minütige Hyperthermie-Behandlung in der Software und starten Sie die Beschallung, sobald die Referenz-MRT-Bilder erfasst sind und die Thermometrie beginnt.
- Führen Sie eine 20-minütige Behandlung (Abbildung 3B) während der thermischen Bildgebung (Tabelle 1) mit der integrierten PID-Reglersoftware (Proportional-Integrative-Derivative) durch. Injizieren Sie das ausgewählte Medikament nach 1,5 Minuten, nachdem sich die Temperatur im ROI auf die gewünschte Temperatur (40 °C) erwärmt hat.
- Überwachen Sie die Kerntemperatur während der gesamten Behandlung. Wenn die rektale Temperatur während der Behandlung schnell ansteigt, kann eine Neupositionierung der Maus erforderlich sein, um eine rektale Erwärmung über die Behandlungsdauer von 10 oder 20 Minuten zu vermeiden. Beenden Sie die Behandlung, wenn die rektale Temperatur auf >40 °C ansteigt.
7. Experiment: Bildgebung und Beschallungsverfahren im Mausmodell für akute Studien
- Nach Abschluss der Behandlung wird die Maus aus der MRT-Bohrung entfernt und die Hämostase an der Einführstelle des Schwanzvenenkatheters sichergestellt. Legen Sie die Maus in den BSC und legen Sie sie zur weiteren Anästhesie auf den Nasenkegel.
- Legen Sie die Maus auf den Rücken auf eine blaue, saugfähige Unterlage, wobei die Gliedmaßen gefesselt und das Herz freigelegt ist.
- Euthanasieren Sie die Mäuse durch Ausblutung durch Herzpunktion mit anschließender Entfernung des Herzens. Das Blut wird sofort entnommen und zur Plasmatrennung bei 10.621 x g für 10 min zentrifugiert.
- Führen Sie eine Nekropsie durch und lagern Sie die Organe nach Bedarf für die Analyse. Die Organe in flüssigem Stickstoff einfrieren und bei -80 °C für mehrere Monate oder langfristig in einem Flüssigstickstofftank lagern.
- Homogenisieren Sie das Tumorgewebe mechanisch, indem Sie einen neunfachen Überschuss (w/w) deionisiertes Wasser hinzufügen und das Gewebe mit einem perlschlagenden Homogenisator aufbrechen. Doxorubicin wird aus 600 μl homogenisiertem Gewebe extrahiert, indem nacheinander 75 μl 300 mg/ml Silbernitrat, 75 μl 10 mM Schwefelsäure und 2,5 ml 1:1 Isopropanol:Chloroform hinzugefügt werden. 20 min aufwirbeln und über Nacht bei −20 °C lagern.
- Um Proben für die Hochleistungsflüssigkeitschromatographie (HPLC) vorzubereiten, zentrifugieren Sie die Lösung aus Schritt 7.5 bei 4.500 x g, entfernen Sie die organische Lösungsmittelschicht und trocknen Sie das Isopropanol:Chloroform unter einem Stickstoffgasstrom. Resuspendierung in 100 μl 2:1 MeOH:H2O. Doxorubicin-Konzentration mit HPLC-MS/MS 28 messen.
8. Experiment: Bildgebung und Beschallung von Mausmodellen für Überlebensstudien
HINWEIS: Befolgen Sie für Überlebensstudien das HIFU-Behandlungstag-Tiervorbereitungsverfahren (Schritt 6.1 bis 6.25).
- Legen Sie die Maus nach Abschluss der Behandlung unter eine Wärmelampe, damit sie sich erholen kann, und überwachen Sie ihre Atmung und Bewegung, bis sie wieder sternal liegt. Bringen Sie das Tier dann in seinen Käfig zurück.
Anmerkungen: Stellen Sie sicher, dass die Hälfte des Käfigs mit einer Wärmelampe ausgerichtet ist, da die Wärmeregulierung der Tiere durch die Anästhesie und HT-Behandlung beeinträchtigt wird. - Überwachen Sie die Mäuse täglich auf Verhalten, Fressmuster und Atemfrequenz auf Anzeichen von Stress.
- Führen Sie die Behandlungen einmal wöchentlich nach den Schritten 6.1 bis 6.25 für 3 aufeinanderfolgende Wochen durch.
- Führen Sie zweimal wöchentlich eine MRT-Bildgebung der Mäuse zur Tumormessung durch. Führen Sie in den Wochen während der Behandlung jede Woche eine MRT-Untersuchung und einen Ultraschall durch. Führen Sie nach Abschluss der Behandlung alle zwei Wochen eine Ultraschallbildgebung durch.
- Euthanasieren Sie die Maus 60 Tage nach Abschluss der Behandlungsreihe oder wenn ein humaner Endpunkt erreicht ist (Tumorgröße >1,5 cm3 oder Morbidität des Tumors), gefolgt von einer Sektion mit Tumor- und Organentnahme zur Analyse.
Ergebnisse
Mit Hilfe des MRgHIFU-generierten Hyperthermie-Protokolls konnten die Tumoren in der Hintergliedmaße für die Dauer der Behandlung konstant auf die gewünschte eingestellte Temperatur erhitzt werden (Abbildung 4 zeigt eine repräsentative Behandlung, 10 oder 20 min, n = 65). Um eine Behandlung als erfolgreich zu betrachten, musste der ROI während der gesamten Behandlung über 39 °C gehalten werden, mit einer Schwankung von <6 °C während der gesamten Behandlung und ohne Erwärmung des Off-Target-Gewebes. Zusätzlich musste die Kerntemperatur unter 39 °C bleiben, basierend auf der rektalen Sonde oder der rektalen Ausgangstemperatur plus der Änderung der Temperatur der Ösophagussonde (ergänzende Abbildung 2). Nachdem die Beschallung des MRgHIFU gestoppt wurde, kehrte der Tumor schnell auf die Ausgangstemperatur zurück.
Die Tumore wurden auf 40,5 °C ausgerichtet, um eine Temperatur für eine schnelle Wirkstofffreisetzung zu erreichen und gleichzeitig kumulative Temperatureffekte über 43 °C zu vermeiden. Die durchschnittliche Temperatur des ROI betrug in allen behandelten Tumoren 40,6 °C (n = 65), mit einer durchschnittlichen Differenz zwischen dem Voxel des 10. Perzentils und dem 90. Perzentil von 4,3 °C. Die Standardabweichung der Durchschnittstemperatur betrug 1,3 °C für die Dauer der Behandlung sowohl für die 10- als auch für die 20-minütige Behandlung (Abbildung 5). Die Erfolgsrate der Behandlungen zur Erfüllung der Einschlusskriterien verbesserte sich über die Studiendauer spürbar von 11 % auf 100 % (Abbildung 6).
Nach Optimierung des Behandlungsprotokolls wurde die Dauer der Hyperthermie im Vergleich zu normothermen (NT) Mäusen auf die Wirksamkeit der Wirkstofffreisetzung untersucht. Um die optimale Hyperthermie-Behandlungszeit für weitere Studien zu bestimmen, wurden zwei Behandlungsdauern getestet: 10 min und 20 min. Diese Zeiträume wurden aufgrund der Machbarkeit der konsequenten Aufrechterhaltung der Kernnormothermie und der Tumorhyperthermie ausgewählt. Mittels Hochleistungsflüssigkeitschromatographie und Massenspektrometrie (HPLC-MS) wurde die Menge an Doxorubicin in den Tumoren beurteilt und der Unterschied der Doxorubicin-Akkumulation zwischen den getesteten Zeiträumen quantifiziert. Es gab einen signifikant höheren Prozentsatz der Anfangsdosis (%ID) von Doxorubicin in den Tumoren der 20 min HT + TLD behandelten Mäuse im Vergleich zu den TLD 20 min NT Mäusen (Abbildung 7, q = 0,000108). Es gab keinen signifikanten Unterschied zwischen den 10-minütigen und 20-minütigen HT + TLD-Gruppen; Es zeigte sich jedoch eine größere Standardabweichung in der 10-Minuten-Behandlungsgruppe als in der 20-Minuten-Gruppe (3,698 vs. 2,065 %ID/g des Tumors). Bemerkenswert ist, dass es in der 10-minütigen HT + TLD-Behandlungsgruppe vier Werte nahe Null gab, die alle mit einer einzigen TLD-Charge behandelt wurden. TLD wurde vor der Verwendung in In-vivo-Experimenten charakterisiert, wie zuvor von Dunne et al.28 beschrieben. Kurz gesagt, TLD wurde in Bezug auf seine Größe, sein Zetapotenzial, seine Schmelzphasenübergangstemperatur und seine Wirkstoffkonzentration charakterisiert, und Liposomen wurden innerhalb von 72 Stunden nach Lagerung bei 4 °C verwendet. Obwohl alle TLD-Chargen vor der Verwendung getestet wurden, ist es möglich, dass die Liposomen das Doxorubicin während des Versuchsaufbaus vor der Verwendung freigesetzt hatten. Darüber hinaus kann die Bewegung während des Scans zu fälschlicherweise erhöhten Temperaturberechnungen in der Software führen, wodurch der Tumor unterhitzt wird und die Wirkstofffreisetzung geringer ist. Alternativ könnten auch falsch niedrige Werte verursacht werden, wenn das Medikament nie injiziert wurde, z. B. wenn der Schwanzvenenkatheter entfernt oder falsch platziert wurde. Wie oben zu sehen ist, umfasste der Aufbau des MRT-Schlittens das Einführen der Temperatursonde (rektal und ösophageal), das Einführen des Schwanzvenenkatheters und die Platzierung des Atemmonitors, gefolgt von der Bewegung des Schlittens, der Maus, des Schwanzvenenkatheters, der drei faseroptischen Temperatursonden, des Atemmonitors und der Anästhesieleitungen in die MRT-Bohrung. Während dieses Prozesses gibt es mehrere Zeitpunkte, an denen sich der Schwanzvenenkatheter lösen kann. Dies wurde durch die Überprüfung des Blutrückflusses in die Leitung, der Blutung aus der Kathetereinführstelle und der Ansammlung von Medikamenten unter dem Tape nach der Behandlung kontrolliert, aber Fehler bleiben eine Möglichkeit.
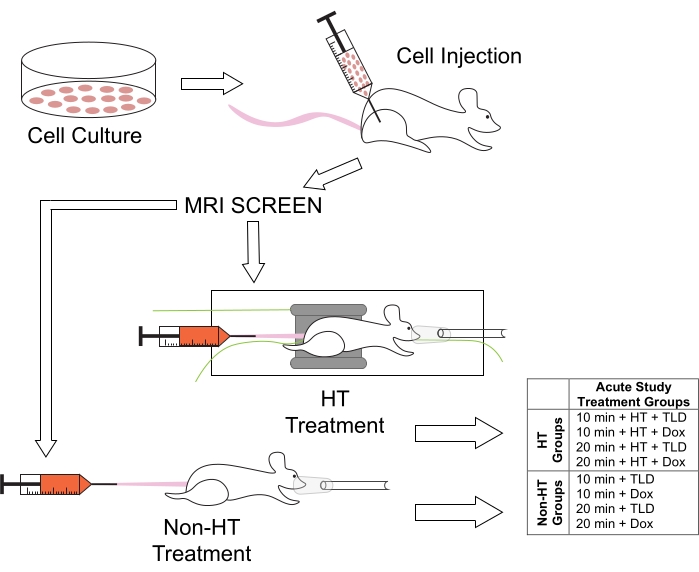
Abbildung 1: Versuchsprotokoll für Tierbehandlungen und die zugehörigen Behandlungsgruppen für die HT-Dauerstudien. Den Mäusen wurden M25FV24C-Zellen in die rechte Hintergliedmaße injiziert und nach 2-3 Wochen mittels MRT auf Tumorbildung untersucht. Sie wurden dann in normotherme (Non-HT) oder hypertherme (HT) Gruppen eingeteilt, wobei entweder TLD oder FD mit einer Dauer von entweder 10 oder 20 Minuten verabreicht wurden. Abkürzung: Dox = Doxorubicin. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: Einrichtung der Maus während der HIFU-Behandlung . (A) Eine 3D-gedruckte Halterung (weiß) mit innerer Gummierung (rot) und einer Aussparung, die einen Ultraschallstrahldurchgang für die Mauspositionierung ermöglicht. (B) Maus-Setup in einem 3D-gedruckten Maushalter mit rektaler Temperaturhaltung (grünes Kabel), Schwanzvenenkatheter (weiß) und Atemmonitor (blau). (C) Positionierung der Maus auf dem MRT-HIFU-Bett während des Eingriffs. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
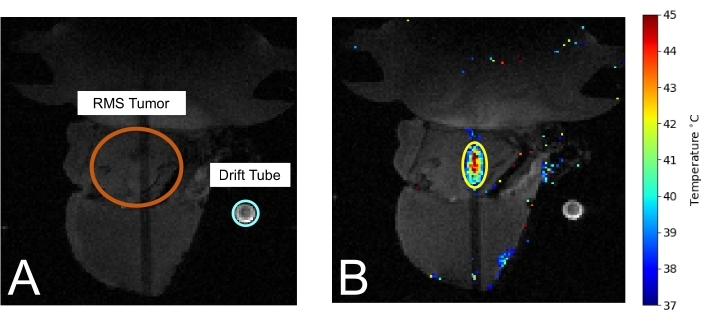
Abbildung 3: Maus im MRT während der MRIgHIFU-Behandlung. (A) Der Tumor (orange eingekreist) und das Driftrohr zur Messung der Umgebungstemperatur (hellblau eingekreist) sind sichtbar. (B) Während der Behandlung wird die thermometrische Temperaturmessung über das MRT-Bild gelegt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
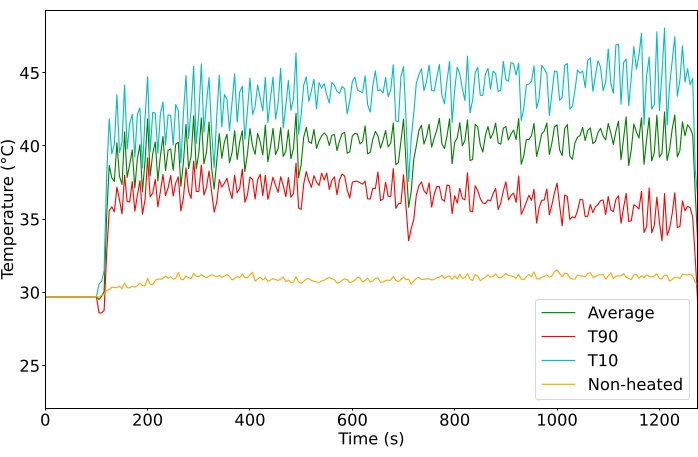
Abbildung 4: Temperatur (°C), die während der Behandlung überwacht wird. Durchschnittliche (grüne), obere 10. Perzentiltemperatur (rot) und obere 90.Perzentiltemperatur (cyan) aller Voxel im ROI. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 5: Durchschnittliche Temperaturen während der Behandlung innerhalb des ROI für jede während der Optimierungsphase getestete Maus mit der Standardabweichung während der Behandlung. Die durchschnittliche Gesamttemperatur und die Standardabweichung während der Behandlung werden ebenfalls angezeigt (orange). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
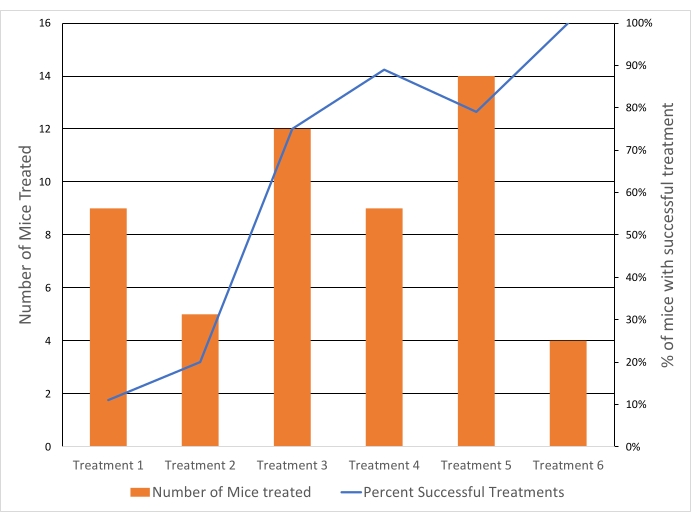
Abbildung 6: Die Erfolgsraten der Hyperthermiebehandlung verbesserten sich im Laufe der Zeit. Der Behandlungserfolg hing von den Einschlusskriterien ab (systemische Temperatur, Tumortemperatur und Variation mit dem ROI sowie keine distale Erwärmung). Blaue Linie = % der Mäuse, bei denen die Behandlung erfolgreich war. Orangefarbene Balken = Anzahl der Mäuse, die mit HT behandelt wurden. Jede Behandlung (Behandlung 1-6) bezieht sich auf ein separates Datum, an dem die Experimente durchgeführt wurden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 7: Menge an Doxorubicin im Tumor nach medikamentöser Behandlung. (A) Mehrere Mann-Whitney-Tests mit FDR-Korrektur für Mehrfachvergleiche der HPLC-MS-Ergebnisse zeigen eine Signifikanz (q < 0,05) zwischen der Menge an Doxorubicin im Tumor in der 20-minütigen TLD + HT-Gruppe im Vergleich zur NT-Kontrolle. (B) Es wurden keine Unterschiede im Tumor in den FD-Gruppen festgestellt. %ID = Prozent der Anfangsdosis. = q < 0,0001. Abkürzungen: HT = Hyperthermie, NT = Normothermie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| Name der Sequenz | Ax_Screen | Ax_Loc | Sag_Loc | Cor_TestShot | Therm |
| Sequenz-Typ | T2w SELTEN | T2w SELTEN | T2w SELTEN | BLITZ | BLITZ |
| Orientierung | Axial | Axial | Sagittal | Koronal | Axial/Sagittal |
| Echozeit (ms) | 40 | 72 | 72 | 6 | 6 |
| Wiederholungszeit (ms) | 3200 | 4500 | 4500 | 39.06 | 39.06 |
| Flip-Winkel (Grad) | 90/180 | 90/180 | 90/180 | 10 | 10 |
| Sichtfeld (mm) | 28,8 x 28,8 cm | 36 x 36 | 35 x 35 | 35 x 35 | |
| Größe der Matrix | 128 x 128 cm | 128 x 128 cm | 128 x 128 cm | 128 x 128 cm | 128 x 128 cm |
| Auflösung (mm) | 0,225 x 0,225 | 0,281 x 0,281 | 0,281 x 0,281 | 0,273 x 0,273 | 0,273 x 0,273 |
| Slice-Nummer | 20 | 20 | 20 | 3 | 2 |
| Schichtdicke (mm) | 1 | 1 | 1 | 1.5 | 1.25 |
| # Durchschnittswerte | 3 | 1 | 1 | 1 | 1 |
| # Wiederholungen | 1 | 1 | 1 | 9 | 9 oder 300 |
| Scan-Zeit | 4 min 0 s | 1 Min. 12 Sek. | 1 Min. 12 Sek. | 45 s | 25 Minuten |
Tabelle 1: Parameter für die MRT-Erfassung mit zugehörigen Sequenznamen.
Ergänzende Abbildung 1: Ein 3D-Modell-Maushalter (weiß) mit innerer Gummiauskleidung (rot). Abmessungen: Länge = 43 mm, Außenradius = 15 mm, Innenbreite = 20,7 mm. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 2: Temperatur (°C), die während der Behandlung überwacht wird. Die Kerntemperatur wird mit rektalen (blau) und ösophagealen (orange) Sonden gemessen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Codierungsdatei 1: 3D-Druckdatei für den Maushalter. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Das hier entwickelte Protokoll wurde verwendet, um Tumore der Hintergliedmaßen unter Verwendung von MRgHIFU für eine milde HT-Behandlung zu behandeln und verkapselte Wirkstoffe aus Liposomen in vivo freizusetzen. Während der Pilotstudie wurden mehrere kritische Schritte in diesem Protokoll festgestellt, und die Optimierung dieser kritischen Schritte führte zu einem verbesserten Behandlungserfolg gegenüber der Pilotstudie. Zuerst werden die Haare an der zu beschallenden Stelle vollständig entfernt. Jeder Gaseinschluss im Fell verhindert den Durchgang des Ultraschallstrahls und blockiert die Ultraschallpassage in das Zielgewebe1. Zweitens ist die Positionierung der Maus entscheidend für eine erfolgreiche Behandlung. Der Tumor sollte überlegen in der Maushalterung platziert werden, um in engeren Kontakt mit dem Ultraschallkopf zu kommen. Zudem sollten knöcherne Strukturen außerhalb des Ultraschallstrahlengangs positioniert werden, ohne die Maus zu verletzen. Es hat sich gezeigt, dass Knochen Ultraschallwellen effizient absorbiert und anschließend als In-situ-Heizquelle fungiert. Es kann das Heizprofil beeinflussen und gleichzeitig die Ultraschallübertragung in den interessierenden Bereichblockieren 4. Die kontralaterale Extremität sollte ebenfalls außerhalb des Ultraschallpfads platziert werden, indem das Bein entweder unter den Rest des Körpers gezogen wird oder indem es gestreckt und die Luft zwischen den Beinen mit Ultraschallgel oder einem Gelkissen gefüllt wird. Das Rektum muss sich auch außerhalb des Pfades des Ultraschalls befinden, um eine Erwärmung außerhalb des Ziels und eine Reflexion durch die Temperatursonde zu vermeiden. Die sorgfältige Positionierung des Tumors ist der wichtigste Schritt für eine erfolgreiche Behandlung.
Nach der korrekten Positionierung muss die Platzierung des Ösophagustemperaturfühlers vorsichtig durchgeführt werden, um einen Trachealverschluss zu vermeiden. Beim Einführen der Maus in die MRT-Bohrung sollte die metallene Verbindungsnabe zwischen dem Katheter im Schwanz und dem Katheter der Injektionspumpe mit Klebeband distal zum Bildgebungsbereich gesichert werden, um Artefaktbildung zu vermeiden. Der Ultraschallwandler sollte so platziert werden, dass er mit dem felllosen Bereich des Beins in Kontakt kommt und den Atemmonitor nicht verschiebt. Eine sorgfältige Überwachung der Körperkerntemperatur der Maus während der Behandlung und die anschließende Einstellung des Konvektionsheizsystems ist für das Überleben der Maus erforderlich. Aufgrund der Nähe des Rektums und des Tumors bei einigen Mäusen war die Hinzufügung der Ösophagussonde wichtig, um die Änderung der Kerntemperatur zu bestimmen, da die rektale Temperatur nur die lokale Erwärmung und nicht die Erwärmung des Kernkörpers widerspiegeln konnte.
Bei der Entwicklung und Implementierung dieses Protokolls wurde eine umfangreiche Fehlerbehebung durch ein multidisziplinäres Team erfolgreich durchgeführt. Für die Positionierung der Maus wurde ein Maushalter entworfen und 3D-gedruckt, der auf einem Ratten-MRT-Schlitten verwendet werden kann, um den Durchfluss der erwärmten Luft um die Maus herum zu ermöglichen und die Körpertemperatur während des Eingriffs anzupassen. Die Materialien für diese Halterung wurden aufgrund ihrer Fähigkeit ausgewählt, die Maus sicher zu halten und gleichzeitig eine Ultraschallübertragung zu ermöglichen. Ein Gummieinsatz im Inneren des gedruckten Halters ermöglichte individuelle Mauseinstellungen, während die Aussparung im Boden die Reflexion von Ultraschallwellen und eine unbeabsichtigte Erwärmung verhinderte.
Es gibt Einschränkungen, die mit dem Modell verbunden sind, wie z. B. die Nähe der Tumore zu benachbarten Strukturen - Knochen (Femur) und Rektum -, die Ultraschallwellen absorbieren bzw. reflektieren können. Eine unbeabsichtigte Erwärmung des Oberschenkelknochens kann zu Knochenmarkszerstörung und Schmerzen führen, während die Ultraschallreflexion von Luft im Rektum zu lokaler Erwärmung und Gewebeschäden führen kann. Darüber hinaus gab es Fälle, in denen die Ultraschallwelle aufgrund des Nachwachsens der Haut nach der Behandlung bei den überlebenden Mäusen eingefangen wurde, was zu einer lokalen Erwärmung der Haut führte. Es wird vermutet, dass dies auf Lufteinschlüsse um den Haarfollikel zurückzuführen ist, der mit dem Ultraschallgel nicht zwischen Schallkopf und Haut verdrängt wird. In jedem Fall erschien die Haut dunkler als die umgebende haarlose Haut. In immunhistochemischen Schnitten dieser Mausgliedmaßen waren Haare in der Epidermis zu sehen, aber es wurde keine Tumorfibrose oder eine andere Erklärung dafür gefunden, warum der Ultraschall nicht in der Lage war, die Haut und das Unterhautgewebe zu durchdringen.
Mit der Entwicklung dieses Protokolls sind weitere Studien geplant, um die Modellsysteme zu erweitern, um andere pädiatrische solide Tumore, wie Osteosarkome und Myxofibrosarkome, für die Behandlung mit HT und TLD zu testen. Dies ist vielversprechend, da diese Patienten in diesem klinischen Kontext mit lähmenden Schmerzen und begrenzten Behandlungsmöglichkeiten konfrontiert sein können. Dieses Protokoll kann auf andere solide Tumorarten in den Extremitäten ausgeweitet werden, die mit MRgHIFU29,30 anvisiert werden können. Zusammenfassend lässt sich sagen, dass die Daten zeigen, dass die Kombination von thermosensitiven Liposomen extrapoliert werden kann, um andere Formen der Chemotherapie oder Medikamente zu verkapseln, bei denen eine gezielte Wirkstoffabgabe von Vorteil wäre und eine nicht-invasive Form der Erhitzung, wie z. B. MRgHIFU, ideal wäre.
Offenlegungen
Die Autoren haben keine finanziellen Interessen oder Interessenkonflikte offenzulegen.
Danksagungen
Wir möchten uns bei unseren Finanzierungsquellen für dieses Projekt und den beteiligten Mitarbeitern bedanken, darunter: C17 Research Grant, Canada Graduate Scholarship, Ontario Student Opportunity Trust Fund und James J. Hammond Fund.
Materialien
| Name | Company | Catalog Number | Comments |
| 1.5mL Eppendorf tubes | Eppendorf | 22363204 | |
| 1kb plus DNA Ladder | Froggabio | DM015-R500 | |
| 2x HS-Red Taq (PCR mix) | Wisent | 801-200-MM | |
| 7 Tesla MRI BioSpec | Bruker | T184931 | 70/30 BioSpec, Bruker, Ettlingen, Germany |
| C1000 Thermal cycler | Biorad | 1851148 | |
| Clippers | Whal Peanut | 8655 | |
| Compressed ultrasound gel | Aquaflex | HF54-004 | |
| Convection heating device | 3M Bair Hugger | 70200791401 | |
| Depiliatory cream | Nair | 61700222611 | Shopper's Drug Mart |
| DMEM | Wisent | 219-065-LK | |
| DNeasy extraction kit | Qiagen | 69504 | |
| DPBS | Wisent | 311-420-CL | |
| Drug injection system | Harvard Apparatus | PY2 70-2131 | PHD 22/2200 MRI compatible Syringe Pump |
| Eye lubricant | Optixcare | 50-218-8442 | |
| F10 Media | Wisent | 318-050-CL | |
| FBS | Wisent | 081-105 | |
| Froggarose | FroggaBio | A87 | |
| Gel Molecular Imager | BioRad | GelDocXR | |
| Glutamax | Wisent | 609-065-EL | |
| Heat Lamp | Morganville Scientific | HL0100 | Similar to this product |
| Intravascular Polyethylene tubing (0.015" ID x 0.043" OD, 20G) | SAI infusion | PE-20-100 | |
| Isoflurane | Sigma | 792632 | |
| M25FV24C Cell line | Gladdy Lab | N/A | |
| Microliter Syringe | Hamilton | 01-01-7648 | |
| Molecular Imager Gel Doc XR | Biorad | 170-8170 | |
| Mouse holder | The 3D printing material used was ABS-M30i, and it was printed on FDM Fortus 380mc machine | N/A | Dimensions: length = 43 mm, outer radius = 15 mm, inner width (where the mouse would sit) = 20.7 mm. |
| MyRun Machine | Cosmo Bio Co Ltd | CBJ-IMR-001-EX | |
| Nanodrop 8000 Spectrophotometer | Thermo Scientific | ND-8000-GL | |
| p53 primers | Eurofins | N/A | Custom Primers |
| PCR tubes | Diamed | SSI3131-06 | |
| Penicillin/Streptomycin | Wisent | 450-200-EL | |
| Proteus software | Pichardo lab | N/A | |
| Respiratory monitoring system | SAII | Model 1030 | MR-compatible monitoring and gating system for small animals |
| Small Bore HIFU device, LabFUS | Image Guided Therapy | N/A | LabFUS, Image Guided Therapy, Pessac, France Number of elements 8 frequency 2.5 MHz diameter 25 mm radius of curvature 20 mm Focal spot size 0.6 mm x 0.6 mm x 2.0 mm Motor: axes 2 Generator: Number of channels 8 Maximum electrical power/channel Wel 4 Maximum electrical power Wel 32 Bandwidth 0.5 - 5 MHz Control per channel: Freq., Phase and. amplitude Measurements per channel: Vrms, Irms, cos(theta) Duty Cycle at 100% power % 100% for 1 min. Transducer: Number of elements 8 frequency 2.5 MHz diameter 25 mm radius of curvature 20 mm Focal spot size 0.6 mm x 0.6 mm x 2.0 mm |
| SYBR Safe | ThermoFisher Scientific | S33102 | |
| TAE | Wisent | 811-540-FL | |
| Tail vein catheter (27G 0.5" ) | Terumo Medical Corp | 15253 | |
| Thermal probes | Rugged Monitoring | L201-08 | |
| Trypan blue | ThermoFisher Scientific | 15250061 | |
| Trypsin | Wisent | 325-052-EL | |
| Ultrasound Gel | Aquasonic | PLI 01-08 |
Referenzen
- Skapek, S. X., et al. Rhabdomyosarcoma. Nature Reviews Disease Primers. 5 (1), (2019).
- Ferrari, A., et al. Impact of rhabdomyosarcoma treatment modalities by age in a population-based setting. Journal of Adolescent and Young Adult Oncology. 10 (3), 309-315 (2021).
- Dasgupta, R. Pediatric rhabdomyosarcoma surgery: Background, anatomy, pathophysiology. , Available from: https://emedicine.medscape.com/article/939156-overview#a2 (2019).
- Ognjanovic, S., Linabery, A. M., Charbonneau, B., Ross, J. A. Trends in childhood rhabdomyosarcoma incidence and survival in the United States, 1975-2005. Cancer. 115 (18), 4218-4226 (2009).
- Mulrooney, D. A., et al. Cardiac outcomes in a cohort of adult survivors of childhood and adolescent cancer: retrospective analysis of the Childhood Cancer Survivor Study cohort. BMJ. 339, (2009).
- Lipshultz, S. E., Cochran, T. R., Franco, V. I., Miller, T. L. Treatment-related cardiotoxicity in survivors of childhood cancer. Nature Reviews Clinical Oncology. 10 (12), 697-710 (2013).
- Winter, S., Fasola, S., Brisse, H., Mosseri, V., Orbach, D. Relapse after localized rhabdomyosarcoma: Evaluation of the efficacy of second-line chemotherapy. Pediatric Blood & Cancer. 62 (11), 1935-1941 (2015).
- Wood, B. J., et al. Phase I study of heat-deployed liposomal doxorubicin during radiofrequency ablation for hepatic malignancies. Journal of Vascular and Interventional Radiology. 23 (2), 248-255 (2012).
- Bulbake, U., Doppalapudi, S., Kommineni, N., Khan, W. Liposomal formulations in clinical use: an updated review. Pharmaceutics. 9 (2), 12(2017).
- Zagar, T. M., et al. Two phase I dose-escalation/pharmacokinetics studies of low temperature liposomal doxorubicin (LTLD) and mild local hyperthermia in heavily pretreated patients with local regionally recurrent breast cancer. International Journal of Hyperthermia. 30 (5), 285-294 (2014).
- Kim, A. A phase I study of lyso-thermosensitive liposomal doxorubicin and MR-HIFU for pediatric refractory solid tumors. , Available from: https://clinicaltrials.gov/ct2/show/NCT02536183 (2019).
- PanDox: targeted doxorubicin in pancreatic tumours (PanDox). University of Oxford. , Available from: https://clinicaltrials.gov/ct2/show/NCT04852367 (2021).
- Suelmann, B. B. M. Image-guided targeted doxorubicin delivery with hyperthermia to optimize loco-regional control in breast cancer (i-GO). , Available from: https://clinicaltrials.gov/ct2/show/NCT03749850 (2018).
- De Vita, A., et al. Lysyl oxidase engineered lipid nanovesicles for the treatment of triple negative breast cancer. Scientific Reports. 11 (1), 5107(2021).
- Sapareto, S. A., Dewey, W. C. Thermal dose determination in cancer therapy. International Journal of Radiation Oncology, Biology, Physics. 10 (6), 787-800 (1984).
- Kok, H. P., et al. Heating technology for malignant tumors: a review. International Journal of Hyperthermia. 37 (1), 711-741 (2020).
- Kokuryo, D., Kumamoto, E., Kuroda, K. Recent technological advancements in thermometry. Advanced Drug Delivery Reviews. 163, 19-39 (2020).
- Bongiovanni, A., et al. 3-T magnetic resonance-guided high-intensity focused ultrasound (3 T-MR-HIFU) for the treatment of pain from bone metastases of solid tumors. Support Care Cancer. 30 (7), 5737-5745 (2022).
- Seifert, G., et al. Regional hyperthermia combined with chemotherapy in paediatric, adolescent and young adult patients: current and future perspectives. Radiation Oncology. 11, 65(2016).
- Dewhirst, M. W., Lee, C. -T., Ashcraft, K. A. The future of biology in driving the field of hyperthermia. International Journal of Hyperthermia. 32 (1), 4-13 (2016).
- Dewhirst, M. W., Vujaskovic, Z., Jones, E., Thrall, D. Re-setting the biologic rationale for thermal therapy. International Journal of Hyperthermia. 21 (8), 779-790 (2005).
- Repasky, E. A., Evans, S. S., Dewhirst, M. W. Temperature matters! And why it should matter to tumor immunologists. Cancer Immunology Research. 1 (4), 210-216 (2013).
- Hijnen, N., et al. Thermal combination therapies for local drug delivery by magnetic resonance-guided high-intensity focused ultrasound. Proceedings of the National Academy of Sciences. 114 (24), E4802-E4811 (2017).
- Shultz, L. D., et al. Human cancer growth and therapy in immunodeficient mouse models. Cold Spring Harbor Protocols. 2014 (7), 694-708 (2014).
- De Vita, A., et al. Deciphering the genomic landscape and pharmacological profile of uncommon entities of adult rhabdomyosarcomas. International Journal of Molecular Sciences. 22 (21), 11564(2021).
- McKinnon, T., et al. Functional screening of FGFR4-driven tumorigenesis identifies PI3K/mTOR inhibition as a therapeutic strategy in rhabdomyosarcoma. Oncogene. 37 (20), 2630-2644 (2018).
- Zaporzan, B., et al. MatMRI and MatHIFU: software toolboxes for real-time monitoring and control of MR-guided HIFU. Journal of Therapeutic Ultrasound. 1, (2013).
- Dunne, M., et al. Heat-activated drug delivery increases tumor accumulation of synergistic chemotherapies. Journal of Controlled Release. 308, 197-208 (2019).
- Zhao, Y. X., Hu, X. Y., Zhong, X., Shen, H., Yuan, Y. High-intensity focused ultrasound treatment as an alternative regimen for myxofibrosarcoma. Dermatologic Therapy. 34 (2), 14816(2021).
- Vanni, S., et al. Myxofibrosarcoma landscape: diagnostic pitfalls, clinical management and future perspectives. Therapeutic Advances in Medical Oncology. 14, 17588359221093973(2022).
Erratum
Formal Correction: Erratum: Magnetic Resonance-Guided High Intensity Focused Ultrasound Generated Hyperthermia: A Feasible Treatment Method in a Murine Rhabdomyosarcoma Model
Posted by JoVE Editors on 2/08/2023. Citeable Link.
An erratum was issued for: Magnetic Resonance-Guided High Intensity Focused Ultrasound Generated Hyperthermia: A Feasible Treatment Method in a Murine Rhabdomyosarcoma Model . The Authors section was updated from:
Claire Wunker1,2
Karolina Piorkowska3
Ben Keunen3
Yael Babichev2
Suzanne M. Wong3,4
Maximilian Regenold5
Michael Dunne5
Julia Nomikos1,2
Maryam Siddiqui6
Samuel Pichardo6
Warren Foltz7
Adam C. Waspe3,8
Justin T. Gerstle3,9
Rebecca A. Gladdy1,2,10
1 Institute of Medical Science, University of Toronto
2 2Lunenfeld-Tanenbaum Research Institute, Mount Sinai Hospital
3 The Wilfred and Joyce Posluns Centre for Image-Guided Innovation and Therapeutic Intervention, The Hospital for Sick Children
4 Institute of Biomedical Engineering, University of Toronto
5 Leslie Dan Faculty of Pharmacy, University of Toronto
6 Departments of Radiology and Clinical Neurosciences, University of Calgary
7 Department of Radiation Oncology, University of Toronto
8 Department of Medical Imaging, University of Toronto
9 Department of Pediatric Surgery, University of Toronto
10 Department of Surgery, University of Toronto
to:
Claire Wunker1,2
Karolina Piorkowska3
Ben Keunen3
Yael Babichev2
Suzanne M. Wong3,4
Maximilian Regenold5
Michael Dunne5
Julia Nomikos1,2
Maryam Siddiqui6
Samuel Pichardo6
Warren Foltz7
Adam C. Waspe3,8
Justin T. Gerstle3,9
James M. Drake1,3,4,10
Rebecca A. Gladdy1,2,10
1 Institute of Medical Science, University of Toronto
2 Lunenfeld-Tanenbaum Research Institute, Mount Sinai Hospital
3 The Wilfred and Joyce Posluns Centre for Image-Guided Innovation and Therapeutic Intervention, The Hospital for Sick Children
4 Institute of Biomedical Engineering, University of Toronto
5 Leslie Dan Faculty of Pharmacy, University of Toronto
6 Departments of Radiology and Clinical Neurosciences, University of Calgary
7 Department of Radiation Oncology, University of Toronto
8 Department of Medical Imaging, University of Toronto
9 Department of Pediatric Surgery, University of Toronto
10 Department of Surgery, University of Toronto
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten