Method Article
אולטרסאונד ממוקד מונחה תהודה מגנטית בעוצמה גבוהה שנוצר היפרתרמיה: שיטת טיפול אפשרית במודל מורין רבדומיוסרקומה
In This Article
Erratum Notice
Summary
מוצג כאן פרוטוקול לשימוש בהיפרתרמיה מבוקרת, הנוצרת על ידי אולטרסאונד ממוקד מונחה תהודה מגנטית בעוצמה גבוהה, כדי להפעיל שחרור תרופות מליפוזומים רגישים לטמפרטורה במודל עכבר rhabdomyoscoma.
Abstract
אולטרסאונד ממוקד מונחה תהודה מגנטית בעוצמה גבוהה (MRgHIFU) הוא שיטה מבוססת לייצור היפרתרמיה מקומית. בהינתן הדמיה בזמן אמת ואפנון אנרגיה אקוסטית, מודל זה מאפשר בקרת טמפרטורה מדויקת בתוך אזור מוגדר. יישומים תרמיים רבים נחקרים באמצעות טכנולוגיה לא פולשנית ובלתי מייננת זו, כגון יצירת היפרתרמיה, לשחרור תרופות מנשאים ליפוזומליים רגישים לחום. תרופות אלה יכולות לכלול כימותרפיות כגון דוקסורוביצין, שעבורן רצוי שחרור ממוקד בשל תופעות הלוואי המערכתיות המגבילות את המינון, כלומר רעילות לב. דוקסורוביצין הוא עמוד התווך לטיפול במגוון גידולים ממאירים והוא נפוץ ברבדומיוסרקומה חוזרת או חוזרת (RMS). RMS הוא הגידול החוץ-גולגולתי הנפוץ ביותר ברקמות רכות מוצקות בקרב ילדים ומבוגרים צעירים. למרות טיפול אגרסיבי ורב-מודאלי, שיעורי ההישרדות של RMS נותרו זהים במשך 30 השנים האחרונות. כדי לחקור פתרון לטיפול בצורך בלתי מסופק זה, פותח פרוטוקול ניסיוני להערכת שחרור דוקסורוביצין ליפוזומלי רגיש לחום (TLD) במודל עכבר RMS סינגני וחיסוני המשתמש ב- MRgHIFU כמקור להיפרתרמיה לשחרור תרופות.
Introduction
Rhabdomyosarcoma (RMS) הוא גידול שריר השלד הנפוץ ביותר אצל ילדים ומבוגרים צעירים1. מחלה מקומית מטופלת לעתים קרובות באמצעות טיפול רב-מודאלי, כולל כימותרפיה, קרינה מייננת וניתוח. השימוש במשטרי כימותרפיה רב-תרופתיים שכיח יותר בחולים ילדים, עם תוצאות משופרות בהשוואה לעמיתיהם הבוגרים2; עם זאת, למרות מאמצי מחקר מתמשכים, שיעור ההישרדות של 5 שנים נשאר סביב 30% בצורה האגרסיבית ביותר של המחלה 3,4. סטנדרט הטיפול הכימותרפי הוא משטר תרופות רב הכולל וינקריסטין, ציקלופוספמיד ואקטינומיצין D. במקרים של מחלה חוזרת או חוזרת, כימותרפיה חלופית משמשים, כולל סטנדרטי (חינם) doxorubicin (FD) ו ifosfamide1. בעוד שלכל הכימותרפיות הללו יש רעילות מערכתית, רעילות הלב של דוקסורוביצין מטילה מגבלת מינוןלכל החיים 5-7. כדי להגדיל את כמות התרופה המועברת לגידול ולמזער רעילות מערכתית, פותחו פורמולציות חלופיות, כולל אנקפסולציה ליפוזומלית. אלה יכולים להיות דוקסורוביצין שאינו רגיש לחום, שאושר לטיפול בסרטן השד וקרצינומה הפטוצלולרית, או דוקסורוביצין רגיש לחום, שעבורו נמשכיםניסויים קליניים 8,9,10,11,12,13. שיטות חלופיות למתן תרופות ליפוזומליות מוקפות כגון ליפוזומים רב-שלפוחיתיים וליפוזומים ממוקדי-ליגנד הוערכו ומראות הבטחה לטיפול בגידולים9. במחקר זה, לתוספת של חום יש השפעות רב-גורמיות, כולל שחרור תרופות14. השילוב של היפרתרמיה (HT) שנוצר עם אולטרסאונד ממוקד מונחה תהודה מגנטית בעוצמה גבוהה (MRgHIFU) ודוקסורוביצין ליפוזומלי רגיש לחום (TLD) הוא גישה טיפולית רב-מודאלית חדשנית לשימוש בתרופה רעילה אך יעילה זו לטיפול ב- RMS, תוך מזעור רעילות מגבילה מינון ופוטנציאל להגביר את התגובה החיסונית לגידול.
דוקסורוביצין משתחרר במהירות מ-TLD בטמפרטורות >39 מעלות צלזיוס, הרבה מעל טמפרטורת גוף האדם הממוצעת של 37 מעלות צלזיוס אך לא גבוהה מספיק כדי לגרום נזק לרקמות או אבלציה; זה מתחיל להתרחש ב 43 °C (75 °F), אבל מתרחשת מהר יותר כמו הטמפרטורות מתקרב 60 °C (60 °F)15. שיטות שונות שימשו ליצירת HT in vivo, כולל לייזרים, מיקרוגל, אבלציה בתדרי רדיו ואולטרסאונד ממוקד, שרבים מהם הם שיטות חימום פולשניות16. MRgHIFU היא שיטת חימום לא פולשנית ולא מייננת המאפשרת הגדרות טמפרטורה מדויקות ברקמת המטרה באתרה. דימות תהודה מגנטית (MR) מספק הדמיה בזמן אמת, שבה ניתן להשתמש בתוכנת מחשב, כדי לחשב מדידת תרמומטריה של הרקמה לאורך הטיפול; לאחר מכן, ניתן להשתמש בנתונים אלה כדי לשלוט בטיפול האולטרסאונד בזמן אמת כדי להגיע ולשמור על נקודת טמפרטורה רצויה17. MRgHIFU נבדק בסוגי רקמות שונים וניתן להשתמש בו למגוון רחב של טיפולי טמפרטורה, החל מ- HT קל ועד אבלציה, כמו גם קלינית לטיפול מוצלח בגרורות כואבותבעצמות 18. בנוסף, הוכח כי HT גורם לציטוטוקסיות של הגידול, מווסת את ביטוי החלבונים ומשנה את התגובה החיסונית במיקרו-סביבה של הגידול 19,20,21,22. מחקר אחד שילב HT קל עם TLD, ואחריו אבלציה עם MRgHIFU, בחולדה סינרגטית R1 מודל23, וכתוצאה מכך נמק בליבת הגידול והעברת תרופות לפריפריה. באופן מסורתי, הקרנות שימשו כטיפול משלים כדי לפגוע בתאי הגידול ולהפחית את הישנות המחלה המקומית. עם זאת, השימוש בו מוגבל על ידי מינון לכל החיים ונזק מחוץ למטרה1. לכן, HT הוא ייחודי בכך שהוא יכול לגרום לחלק מאותן השפעות ללא אותן רעילות או מגבלות.
מודלים פרה-קליניים של בעלי חיים עבור RMS כוללים מודלים סינגניים של יכולת חיסונית וקסנוגרפטים שמקורם במטופלים (PDX) בפונדקאים מדוכאי חיסון. בעוד שהמודלים מדוכאי החיסון מאפשרים צמיחה של גידולים אנושיים, הם חסרים את המיקרו-סביבה המתאימה לגידול והם מוגבלים ביכולתם לחקור תגובה חיסונית24. מוטציה מפעילת FGFR4 היא סמן מבטיח לפרוגנוזה גרועה ויעד טיפולי פוטנציאלי במבוגרים ובילדים RMS 1,25. במודלים הסינגניים של RMS שפותחו במעבדת גלאדי, הגידולים מסוגלים לגדול בפונדקאי חיסוני, המפתח תגובות חיסוניות מולדות ונרכשות לגידול26. מכיוון ש-HT משפיע על התגובה החיסונית, התבוננות בשינוי בתגובה החיסונית של מורין היא יתרון חשוב של מודל הגידול הזה. כדי לבחון הן את תגובת הגידול ל-TLD בהשוואה ל-FD, והן את השינוי בתגובה החיסונית של הגידול הן לכימותרפיה והן ל-HT, פותח פרוטוקול לטיפול בגידולי RMS סינגניים של מורין in vivo באמצעות MRgHIFU ו-TLD, שהוא מוקד מחקר זה.
Protocol
המחקר בוצע בהתאם לוועדות הטיפול בבעלי חיים עם פרוטוקולים מאושרים לשימוש בבעלי חיים תחת וטרינר מפקח במרכז לפנוגנומיקה (TCP) ורשת הבריאות האוניברסיטאית (UHN) מרכז משאבי בעלי חיים (ARC) מתקני מחקר בבעלי חיים. כל הנהלים, למעט MRgHIFU, המערבים את בעלי החיים נעשו בארון בטיחות ביולוגי (BSC) כדי למזער את חשיפת בעלי החיים לאוויר חיצוני או לזיהום רגיש.
1. גידול עכברים
הערה: בסך הכל 65 עכברים (זן B6.129S2-Trp53tm1Tyj/J) נכללו במחקר הפיילוט (זכר: n = 23; נקבה: n = 42). עכברים זכרים ונקבות כאחד שימשו בגיל 7-9 שבועות. הגורים שלהם נגמלו ועברו גנוטיפ, והעכברים ההטרוזיגוטיים p53 שימשו לניסויים.
- אכלסו שתי נקבות עכברים עם כל עכבר זכר כדי ליצור כלובי רבייה. ספרו את גילאי הגורים שלהם מהלידה (לידה = יום 0).
- ביום ה-10, זהו את הגורים עם חריץ באוזן. אספו חתכי זנב לגנוטיפ לפני הזרקת קו התא.
2. גנוטיפ עכבר
- יש לחלץ דנ"א מגזירי זנב בקוטר 2 מ"מ שנאספו באמצעות ערכת מיצוי DNA מסחרית (ראה טבלת חומרים), בהתאם להוראות היצרן.
- לקבוע את ריכוז הדנ"א ואת טוהר הדנ"א על ידי מדידת הספיגה ב 260-280 ננומטר על ספקטרופוטומטר (ראה טבלת חומרים).
- בצע תגובת שרשרת פולימראז (PCR).
- צור תערובת אב המכילה תערובת PCR מסחרית (המכילה Taq פולימראז, dNTPS ו- MgCl 2; ראה טבלת חומרים), פריימר ו- dH2O ביחס של 12.5:0.25:10.75 (μL) עבור מספר הדגימות הנדרש. הוסף 1 μL של דגימת DNA לכל צינור PCR וכלול dH2O, דגימת null (הומוזיגוטית עבור מוטציה p53), דגימה הטרוזיגוטית (הטרוזיגוטית עבור מוטציית p53), ודגימת סוג פראי (הומוזיגוטית עבור p53 נורמלי) כבקרת PCR.
- הוסף 24 μL של תערובת האב לכל צינור PCR המכיל DNA. פיפטה התמיסה בכל צינור PCR למעלה ולמטה כדי להפיץ את ה- DNA ברחבי תערובת האב.
- מניחים את צינורות התגובה במחזור תרמי ומחזורים לפי המפרטים הבאים: 95°C למשך 2 דקות, 40 מחזורים של 95°C למשך 15 שניות, 60°C למשך 15 שניות ו-72°C למשך דקה אחת, ולאחר מכן שומרים על טמפרטורה של 4°C עד שהם מוכנים לניתוח על הג'ל.
- לנתח את מוצרי PCR באמצעות אלקטרופורזה ג'ל agarose.
- מכינים ג'ל 2% (50 מ"ל של 1x TAE ו-1 גרם אגרוז) על ידי חימום האגרוז ב-TAE וערבוב עד להמסה. כאשר מקורר ועדיין נוזלי, להוסיף 2.5 μL של כתם ג'ל DNA לאגרוז ולערבב. יוצקים את הג'ל בקופסת ג'ל עם מסרק. מניחים את הג'ל במכשיר האלקטרופורטי (ראו טבלת חומרים) ומכסים ב-1x TAE.
- טען 10 μL של 1 kB DNA סולם על הג'ל. טען 12.5 μL של כל דגימה. הפעל את הג'ל במשך 25 דקות ב 135 V.
- דמיינו את הג'ל באמצעות ההגדרות המתאימות לכתם ג'ל הדנ"א המשומש על גבי מכונת הדמיית ג'ל (ראו טבלת חומרים), בהתאם להוראות היצרן.
3. הכנת מודל הגידול (איור 1)
- יש לגדל את קו התאים M25FV24C (מעבר 12-15) שבוע לפני מועד ההזרקה במצע גדילה מלא (מדיום הנשר המעובד [DMEM] של Dulbecco עם תוספים: 10% FBS, 1% פניצילין/סטרפטומיצין ו-2 mM L-alanyl-L-גלוטמין דיפפטיד) בבקבוק של 75 מ"ל, בטמפרטורה של 37°C ו-5% CO2. ברגע שהתאים הם ~80% נפגשים, שאפו את המדיה ושטפו את התאים 1x עם 5 מ"ל של מלח חוצץ פוספט של דולבקו (DPBS).
הערה: M25FV24C הוא קו תאי מורין שהונדס לבטא יתר על המידה מוטציה FGFR4V550E, אשר נצפתה בילדים ובמבוגרים RMS 1,26. - הרימו את התאים על ידי הוספת 0.5 מ"ל של תמיסת טריפסין 0.25% לצד הצלחת ודגירת הכלי למשך 2-3 דקות בטמפרטורת החדר. ברגע שהתאים נראים מנותקים, הוסיפו 2.5 מ"ל של מצע גידול מלא בטמפרטורת החדר כדי להשבית את הטריפסין. השתמש aliquot דגימה 10 μL כדי לקבוע את ריכוז התא של תאים קיימא באמצעות hemocytometer ו tripan blue exclusion.
- הכינו את הנפח הנכון של תאים מרחפים DPBS להזרקה והכניסו לצינור מיקרוצנטריפוגה של 1.5 מ"ל: נפח לצנטריפוגה = (מספר עכברים × מספר תאים לעכבר)/ (ריכוז תאים), כאשר מספר העכברים = העכברים שיש להזריק + 10 עכברים נוספים לטעות, ומספר התאים לעכבר = 104.
- צנטריפוגה למשך 5 דקות ב 153 x גרם. השהה מחדש את גלולת התא בנפח המתאים (10 מיקרוליטר לעכבר × מספר עכברים) של חיץ הזרקת מיו (מדיה F10 + 0.5% FBS) והזריק את העכברים תוך שעה אחת מהכנת ההשעיה הזו.
4. הזרקת תאים תוך שריריים
הערה: תאי M25FV24C מוזרקים לגפה האחורית הימנית של עכברים בגילאי 4 עד 6 שבועות. הזרקה בגיל 4 שבועות מייצרת עכבר קטן עם גידול שיכול להיות קשה יותר לטיפול מכיוון שיש פחות רקמה מסביב לפיזור HT; המתנה עד 6 שבועות מניבה עכבר גדול יותר, מה שמקל על הטיפול בגידול.
- הפוך את תרחיף התא מספר פעמים לפני השאיפה כדי לעזור בפיזור שווה של התאים בתוך התמיסה. שאפו 10 מיקרוליטר (10,4 תאים) באמצעות מזרק מיקרוליטר (ראו טבלת חומרים). לקשקש את העכבר; לאחר ריסון, גישה לשרירי הירך הקאודלית ניתן להשיג על ידי הארכת הרגל האחורית. יש לגלח את הרגל באמצעות קוצץ ולנגב באתנול 70%.
- הזריקו את מתלה התאים M25FV24C (10 μL, 10 4 תאים) לשרירי הירך של הגפה האחורית הימנית של עכבר בן4-6 שבועות באמצעות מזרק מיקרוליטר אטום לגז עם מחט 26s G.
הערה: יש להחדיר את המחט במקביל לעצם הירך לכיוון הברך, תוך הקפדה שלא לפגוע בעצב הסיאטי. הכנס רק את נקודת המחט (כ -2 מ"מ) בגלל מסת השריר הקטנה של הגפה האחורית. - נהל את הפתרון בתנועה מתמדת. הסר את המחט וודא שלא מתרחש דימום. החזירו את העכבר לכלוב שני.
- להעריך את בעלי החיים מדי יום ולפקח על הגפיים האחוריות שלהם עבור צמיחת הגידול באמצעות מישוש. הרדימו את העכברים באמצעות פחמן דו-חמצני אם נתקלו באחת מנקודות הקצה המוקדמות הבאות: גודל הגידול העולה על 1.5 ס"מ קוטר, כיב גידולי או סימנים סיסטמיים של מחלה (זקפה, יציבה כפופה, חוסר פעילות או ירידה בצריכת מזון או מים).
5. בדיקת MRI
- מרדימים את העכבר, לרמה שבה אין תנועה עם לחיצת כפות, עם איזופלורן תחת הפרמטרים הבאים: השראה בתא עם 4% ב 1.5 LPM, לאחר מכן להעביר לקונוס האף על מזחלת סורק MRI ולהמשיך תחזוקת isoflurane על חרוט האף עם 1.5%-2% ב 0.75 LPM. חבר את צג הנשימה. יש להשתמש במשחה וטרינרית על העיניים כדי למנוע יובש בזמן הרדמה.
- דמיינו את העכבר המורדם באמצעות סורק MRI (ראו טבלת חומרים). בתמונה המשוקללת T2 (Ax_Screen רכישה, טבלה 1), שימו לב לממדים בתוך המישור ולמספר הפרוסות הציריות שהגידול מופיע בתוכן. שימו לב למיקום הגידול בהתייחס לעצם הירך ולמשטח הצידי של הירך, לשם ייכנס גל האולטרסאונד.
הערה: הגידול מופיע כמסה היפר-אינטנסיבית בתוך השריר שאינה סימטרית מהצד הנגדי. גודל גידול התחלתי טוב עבור טיפולים מרובים הוא 2 מ"מ x 2 מ"מ x 2 מ"מ עבור מחקרים חריפים או הישרדות. אם הוא גדול בהרבה, זה יהיה טוב רק למחקרים חריפים מכיוון שהגידול יגיע לנקודת קצה בגודל לפני השלמת שלושה טיפולים שבועיים. קריטריוני ההדרה לטיפול HIFU כוללים: כרוך סביב עצם הירך, קרוב מדי לעצם הירך, אחורי מדי על העכבר, מדיאלי לעצם הירך, קרוב מדי לפי הטבעת. - הסר את העכבר מהסורק וקבל משקל בסיסי. לגלח את העכבר ממרכז גופו ועד רגליו תחת הרדמה עם מכונת גילוח חשמלית.
הערה: באופן אידיאלי, גילוח נעשה יום אחד לפני הטיפול, כפי שהוא מאפשר לעכבר לבצע טיפוח המאפשר קרם depilatory לעבוד בצורה יעילה יותר. - לשחזר את העכבר BSC, באמצעות כרית חימום מתחת לקצה אחד של הכלוב. החזירו את העכבר לכלוב כאשר הוא חוזר לשכיבה עצם החזה.
6. ניסוי: טיפול HIFU יום הכנת בעלי חיים
- כדי להכין את מערכת HIFU (ראו טבלת חומרים) הקטנה, הפעילו את הגנרטור ומלאו את המתמר במספיק מים שעברו דה-יוניזציה עד שהקרום מורחב מתחת למתמר, אך לא יציב עד כדי דחיסת העכבר. משחררים את המים במעגל המתמרים למשך 30 דקות כדי להסיר חמצן מומס מהתווך.
- הכן את מערכת המחשב המשויכת.
- הפעל את המחשב השולט וודא שהוא מחובר באמצעות Ethernet לגנרטור HIFU ובאמצעות USB לתצוגת הבדיקה התרמית. הפעל את התוכנה ולחץ על בית כדי להפעיל את המתמר לפני הכנסת העכבר.
- כיול בדיקות תרמיות סיב אופטי: קבל את טמפרטורות החדר הבסיסיות ושים לב לשינוי הטמפרטורה בחדר MRI. שימו לב לגודל סחף הטמפרטורה עבור כל גשושית עקב עוצמת השדה המגנטי. הכנס את בדיקת הטמפרטורה של צינור הסחף לתוך צינור זכוכית מלא גדוליניום לצורך כיול טמפרטורה במהלך הסריקה וחבר את צינור הסחף באמצעות סרט הדבקה.
הערה: טמפרטורת החדר הבסיסית (צינור סחף) מתווספת ידנית כפרמטר תרמומטריה בממשק המשתמש הגרפי בתוכנה. אזור עניין (ROI) מוגדר בתוך צינור הסחף בתמונת MR כדי לזהות סחף טמפרטורה כלשהו ויתקן אוטומטית את תמונות התרמומטריה. - צייר את התרופה להזרקה לתוך מזרק 1 מ"ל והכנס אותה למשאבת המסירה האוטומטית (ראה טבלת חומרים). יש לכוון את הקו שיתחבר לצנתר וריד זנב העכבר עד שהתרופה תמלא את הקו לחלוטין על ידי לחיצה על כפתור המסירה הידנית במשאבת המסירה האוטומטית.
- השתמש במנורת חום כדי לחמם את העכברים בכלובים במשך ~ 20 דקות לפני העברתם לחדר ההרדמה.
הערה: חימום מקדים מקדם הרחבת כלי דם, אשר תיתקל ברגע העכבר מורדם ומסייע במיקום קטטר.
- מרדימים את העכבר באיזופלורן (אינדוקציה: 4% ב-1.5 LPM, תחזוקה: 1.5%-2% ב-0.75 LPM) ומעבירים לחרוט באף. החל חומר סיכה הקרנית על העיניים כדי למנוע נזק עקב חוסר רפלקס מצמוץ תחת הרדמה.
- יש למרוח קרם מסיר שיער על האזור המגולח, כולל כל הגפה האחורית הימנית, ולפעול לפי הוראות היצרן להסרת שיער.
הערה: מקם את העכבר מתחת למנורת חום בזמן שהוא ב-BSC כדי לסייע בוויסות חום במהלך הסרת שיער בהרדמה. - לאחר שטיפת קרם depilatory עם מים חמים, לשקול את העכבר על סולם דיגיטלי להקליט מינון סמים.
- העבר את העכבר לקונוס אף תואם MRI במזחלת MRI. מקם מנורת חום על העכבר כדי לשמור על חום גופו בזמן ההכנה ל- MRI. הניחו את העכבר בתנוחת הדקוביטוס הצידית כאשר הצד שאינו נושא את הגידול כלפי מטה והגידול מעולה בתוך מחזיק עכבר מודפס בתלת-ממד על המזחלת (איור משלים 1 ואיור 2). ודא מיקום נכון של הגידול (כלומר, במרכז הסליל אופקית ואנכית, כאשר הגובה בדיוק מעל הקצוות של מחזיק העכבר כדי להסביר דחיסה על ידי מתמר אולטרסאונד).
הערה: במידת הצורך, חתכו מקטע כרית ג'ל אולטרסאונד דחוס כדי לשים מתחת לעכבר, ריפוד החלק התחתון של המחזיק, עם עובי כדי ליישר את הגידול לחלק העליון של המחזיק. - יש להרחיק את הרגל הלא מעורבת מרגל הגידול, מתחת לעכבר או מורחבת כאשר רגל הגידול מכופפת. ודא שכפות הרגליים אינן בשדה הקרוב או הרחוק של נתיב הגידול וקרן האולטרסאונד. מקמו את מנורת החום במרחק של 15 ס"מ מהזנב לחימום לצורך החדרת קטטר לווריד הזנב.
- הכנס את בדיקת טמפרטורת הוושט.
- השחילו את בדיקת הוושט דרך חרוט האף ושפשפו את צוואר העכבר. הטה את אף העכבר כלפי מעלה כדי ליצור קו מפיו היישר אל בטנו על ידי הארכת הראש. החלק את הבדיקה התרמית מעל הלשון כ -0.5 ס"מ לתוך הוושט של העכבר והחלף את חרוט האף סביב אפו של העכבר. אבטחו את בדיקת הוושט ואת חרוט האף בחלק העליון של המזחלת.
הערה: יש לעקוב אחר סימנים של מצוקה נשימתית מיד לאחר ההחדרה מכיוון שהיא עלולה להיות מוחדרת בצורה לא נכונה לקנה הנשימה.
- השחילו את בדיקת הוושט דרך חרוט האף ושפשפו את צוואר העכבר. הטה את אף העכבר כלפי מעלה כדי ליצור קו מפיו היישר אל בטנו על ידי הארכת הראש. החלק את הבדיקה התרמית מעל הלשון כ -0.5 ס"מ לתוך הוושט של העכבר והחלף את חרוט האף סביב אפו של העכבר. אבטחו את בדיקת הוושט ואת חרוט האף בחלק העליון של המזחלת.
- הכנס את בדיקת הטמפרטורה הרקטלית.
הערה: בדיקות הטמפרטורה פי הטבעת והוושט צריכות להיות בטווח של 3 °C (75 °F) זו מזו. - מקם את צג הנשימה עם כבל החיבור לכיוון ראש העכבר כדי שלא יפריע למיקום מתמר האולטרסאונד. אבטח באמצעות סרט הדבקה.
- הכנס צנתר וריד זנב מחט פרפר 27 G לתוך וריד זנב לטרלי המחובר microtubing עם 20 μL של שטח מת וסרט היטב. לאחר ההדבקה, ודא שהקטטר עדיין סומק היטב.
- השתמש בשני אנשים כדי לשאת את העכבר המוכן, מזחלת העכבר, קו ההרדמה, קו הנשימה, קטטר ורידים זנב וכבלי בדיקה תרמית לתוך סורק MRI, והכנס למחזיק מזחלת MRI.
- בקש ממפעיל תוכנת HIFU (ראה טבלת חומרים) להזיז את המניסקוס של המתמר ישירות מעל הגידול על ידי בדיקה חזותית ליישור ראשוני27. יש למרוח חומר סיכה לעיניים או ג'ל אולטרסאונד נטול גז על העור חסר השיער שמעל הגידול ולהצמיד את מתמר HIFU לאזור הגידול.
- חבר את קו אספקת התרופות מהמשאבה האוטומטית לצנתר ורידי הזנב. חשב את כמות השטח המת בקו וריד הזנב והקו המקשר. החלק את מזחלת HIFU של העכבר על מסילות MRI למרכז ה- MRI.
- הגדר את כמות עירוי התרופה על המשאבה, בהתאם לסוג התרופה וריכוזה ולמשקל החיה, והוסף את כמות השטח המת. כוונו את המשאבה לקצב עירוי של 200 מיקרוליטר/דקה.
הערה: במחקר זה נעשה שימוש ב-FD וב-TLD בריכוז של 2 מ"ג/מ"ל ובמינון של 5 מ"ג/ק"ג משקל גוף. - רשום את טמפרטורות הבדיקה התרמית הבסיסית.
- מקם את התקן הסעת האוויר (ראה טבלת חומרים) במצב החם ביותר. כוונו את הצינור הנושף אוויר לכיוון העכבר במרכז ה-MRI ומאובטחים באמצעות נייר דבק. מכשיר ההתחממות יופנה מאוחר יותר להגדרה הנמוכה ביותר שלו (32 מעלות צלזיוס) כדי למנוע התחממות יתר של העכבר במהלך סוניקציה.
- רכוש את הסקר תמונות MR (Ax_Loc, Sag_Loc; טבלה 1) כדי לקבוע את מיקום הגידול עבור מיקוד סוניקציה כולל עומק. כוונן את מיקום המתמר בהתאם באמצעות תוכנת HIFU על-ידי הכנסת מרחק התנועה הרצוי כפי שנמדד בתמונה ולאחר מכן לחיצה על כיוון החץ כדי לזוז (איור 3A). שימו לב גם למיקום צינור הסחף. יש לחזור על הפעולה לפי הצורך.
- קבע את מיקום נקודת המוקד של המתמר במישור העטרה על-ידי ביצוע סוניקציה רציפה של 'יריית מבחן' רציפה של 5 שניות x 50 mV במהלך רכישת התרמומטריה Test_Shot (טבלה 1).
- התאם את תמונות סקר MR לתצוגה העטרה של נקודת המוקד בתוכנת HIFU. סקור את התמונות עבור מיקום הגידול, ביחס למבנה הגרמי ופי הטבעת, ושנה את מיקום המתמר לפי הצורך.
- חזור על סוניקציית צילום הבדיקה במהלך הדמיית תרמית בת תשע חזרות (טבלה 1) כדי לוודא אם יש חימום אחיד ומדויק בנפח הגידול עם חימום מינימלי מחוץ למטרה. כוונן את מיקום הפרוסה, מיקום המתמר ועומק ההיגוי, ואשר את ביצועי החימום באמצעות "צילומי בדיקה" חוזרים לפי הצורך.
- באמצעות תוכנת ניטור הטיפול HIFU, הגדר את החזר ההשקעה לניטור תרמומטריה בתוך פרופיל החימום הסופי על ידי מדידת המרחק לתנועה ולאחר מכן שינוי קואורדינטות הרשת בתוכנית. הגדר החזר השקעה סביב צינור הסחף לתיקון סחף. הזן את הטמפרטורה הבסיסית בהתבסס על טמפרטורת הבדיקה הרקטלית למדידות תרמומטריה. מערכת HIFU משמשת ליזום סוניקציה לטיפול HIFU ולניטור תרמומטריה.
- פתח את מפרט הטיפול בהיפרתרמיה של 20 דקות בתוכנה והתחל סוניקציה לאחר איסוף תמונות MR הייחוס והפעלת התרמומטריה.
- בצעו טיפול של 20 דקות (איור 3B) במהלך הדמיית תרמית (טבלה 1) באמצעות תוכנת בקר פרופורציונלית-אינטגרטיבית-נגזרת (PID) מובנית. הזריקו את התרופה שנבחרה בדקה וחצי, לאחר שהטמפרטורה בהחזר ההשקעה מתחממת לטמפרטורה הרצויה (40 מעלות צלזיוס).
- עקוב אחר טמפרטורת הליבה לאורך הטיפול. אם טמפרטורת פי הטבעת עולה במהירות במהלך הטיפול, ייתכן שיהיה צורך במיקום מחדש של העכבר כדי למנוע התחממות רקטלית במשך 10 או 20 דקות הטיפול. הפסק את הטיפול אם טמפרטורת פי הטבעת עולה ל >40 מעלות צלזיוס.
7. ניסוי: הדמיית מודל עכבר והליך סוניקציה למחקרים אקוטיים
- לאחר סיום הטיפול, הסר את העכבר משעמם MRI, הבטחת hemostasis באתר החדרת קטטר וריד הזנב. מעבירים את העכבר ל-BSC ומניחים על חרוט האף להמשך הרדמה.
- הניחו את העכבר על גבו על כרית סופגת כחולה כשגפיו מרוסנות והלב חשוף.
- להרדים את העכברים באמצעות exsanguination באמצעות ניקוב לב ואחריו הסרת הלב. קח את הדם מיד צנטריפוגה עבור הפרדת פלזמה ב 10,621 x גרם במשך 10 דקות.
- לבצע נקרופסיה, ולאחסן את האיברים כנדרש לניתוח. להקפיא את האיברים בחנקן נוזלי ולאחסן ב -80 ° C למשך מספר חודשים או לטווח ארוך במיכל חנקן נוזלי.
- הומוגניזציה מכנית של רקמת הגידול על ידי הוספת עודף פי תשעה (w/w) של מים שעברו דה-יוניזציה ופירוק הרקמה באמצעות הומוגנייזר המכה בחרוזים. חלץ דוקסורוביצין מ 600 μL של רקמה הומוגנית על ידי הוספה ברצף 75 μL של 300 מ"ג / מ"ל כסף חנקתי, 75 μL של 10 mM חומצה גופרתית, ו 2.5 מ"ל של 1: 1 isopropanol:chloroform. יש לערבב במשך 20 דקות ולאחסן בטמפרטורה של -20°C למשך הלילה.
- כדי להכין דגימות עבור כרומטוגרפיה נוזלית בעלת ביצועים גבוהים (HPLC), צנטריפוגו את התמיסה משלב 7.5 ב 4,500 x גרם, להסיר את שכבת הממס האורגני, ולייבש את isopropanol:chloroform תחת זרם של גז חנקן. יש להשהות מחדש ב-100 מיקרוליטר של 2:1 MeOH:H2O. למדוד ריכוז דוקסורוביצין באמצעות HPLC-MS/MS28.
8. ניסוי: הדמיית מודל עכבר והליך סוניקציה למחקרי הישרדות
הערה: למחקרי הישרדות, בצע את הליך הכנת בעלי החיים ביום לטיפול HIFU (שלב 6.1 עד 6.25).
- לאחר סיום הטיפול, הניחו את העכבר מתחת למנורת חום כדי לאפשר לו להתאושש, ועקבו אחר נשימתו ותנועתו עד שהוא חוזר לשכיבת עצם החזה. לאחר מכן, להחזיר את החיה לכלוב שלה.
הערה: יש לוודא שמחצית הכלוב נמצאת בקו אחד עם מנורת חום, שכן הוויסות התרמי של בעלי החיים מושפע מההרדמה ומהטיפול ב-HT. - עקוב אחר העכברים מדי יום להתנהגות, דפוסי האכלה וקצב נשימה לאיתור סימני מצוקה.
- בצע טיפולים פעם בשבוע לאחר שלבים 6.1 עד 6.25 במשך 3 שבועות רצופים.
- פעמיים בשבוע יש לבצע הדמיית MRI של העכברים למדידת הגידול. במשך שבועות במהלך הטיפול, בצע סריקת MRI אחת ואולטרסאונד אחד בכל שבוע. לאחר סיום הטיפול, בצע הדמיית אולטרסאונד דו-שבועית.
- יש להרדים את העכבר 60 יום לאחר סיום סדרת הטיפולים, או כאשר הגיעו לנקודת קצה הומנית (גודל הגידול >1.5 ס"מ3 או תחלואה מהגידול), ולאחר מכן נקרופסיה עם הסרת הגידול והאיברים לניתוח.
תוצאות
באמצעות פרוטוקול היפרתרמיה שנוצר על ידי MRgHIFU, הגידולים בגפה האחורית היו מסוגלים להיות מחוממים באופן עקבי לטמפרטורה הרצויה שנקבעה למשך הטיפול (איור 4 מראה טיפול מייצג, 10 או 20 דקות, n = 65). כדי להחשיב טיפול כמוצלח, החזר ההשקעה היה צריך להישמר מעל 39 מעלות צלזיוס במשך כל הטיפול, עם שונות של <6 מעלות צלזיוס לאורך הטיפול וללא חימום של רקמה מחוץ למטרה. בנוסף, טמפרטורת הליבה הייתה צריכה להישאר מתחת ל-39°C, בהתבסס על החלחולת או טמפרטורת פי הטבעת ההתחלתית בתוספת השינוי בטמפרטורת הבדיקה של הוושט (איור משלים 2). ברגע שהסוניקציה של MRgHIFU הופסקה, הגידול חזר במהירות לטמפרטורת הבסיס.
הגידולים כוונו לטמפרטורה של 40.5 מעלות צלזיוס כדי להגיע לטמפרטורה לשחרור מהיר של תרופות תוך הימנעות מהשפעות טמפרטורה מצטברות מעל 43 מעלות צלזיוס. הטמפרטורה הממוצעת של החזר ההשקעה בכל הגידולים שטופלו הייתה 40.6 מעלות צלזיוס (n = 65), עם הבדל ממוצעבין אחוזון 10 לווקסליםאחוזון 90 של 4.3 מעלות צלזיוס. סטיית התקן של הטמפרטורה הממוצעת הייתה 1.3 מעלות צלזיוס למשך הטיפול הן בטיפולים של 10 והן ב-20 דקות (איור 5). שיעור ההצלחה של הטיפולים בעמידה בקריטריוני ההכללה השתפר באופן ניכר במהלך המחקר מ-11% ל-100% (תרשים 6).
לאחר אופטימיזציה של פרוטוקול הטיפול, משך ההיפרתרמיה הוערך ליעילות שחרור תרופות בהשוואה לעכברים נורמותרמיים (NT). כדי לקבוע את זמן הטיפול האופטימלי בהיפרתרמיה למחקרים נוספים, נבדקו שני משכי טיפול: 10 דקות ו-20 דקות. משכי זמן אלה נבחרו עבור ההיתכנות של שמירה עקבית על נורמתרמיית ליבה והיפרתרמיה גידולית. כרומטוגרפיה נוזלית בעלת ביצועים גבוהים וספקטרומטריית מסה (HPLC-MS) שימשה להערכת כמות הדוקסורוביצין בגידולים ולכמת את ההבדל בהצטברות דוקסורוביצין בין משכי הזמן הנבדקים. היה אחוז גבוה משמעותית של המינון הראשוני (%ID) של דוקסורוביצין בגידולים בעכברים שטופלו ב-20 דקות HT + TLD בהשוואה לעכברי TLD NT של 20 דקות (איור 7, q = 0.000108). לא היה הבדל משמעותי בין קבוצות HT + TLD של 10 דקות ו -20 דקות; עם זאת, הייתה סטיית תקן גדולה יותר בקבוצת הטיפול של 10 דקות בהשוואה לקבוצת 20 הדקות (3.698 לעומת 2.065% ID/g של גידול). יש לציין שהיו ארבעה ערכים קרובים לאפס בקבוצת הטיפול של 10 דקות HT + TLD, שכולם טופלו באצווה אחת של TLD. TLD אופיין לפני השימוש בניסויי in vivo , כפי שתואר בעבר על ידי Dunne et al.28. בקצרה, TLD אופיין מבחינת גודלו, פוטנציאל הזטה, טמפרטורת מעבר שלב ההתכה וריכוז התרופות, וליפוזומים שימשו תוך 72 שעות מהאחסון ב -4 מעלות צלזיוס. למרות שכל האצוות של TLD נבדקו לפני השימוש, ייתכן שהליפוזומים שחררו את הדוקסורוביצין במהלך ההתקנה הניסיונית, לפני השימוש. בנוסף, תנועה במהלך הסריקה עלולה לגרום לחישובי טמפרטורה גבוהים באופן שגוי בתוכנה, ובכך לחמם את הגידול בחסר וכתוצאה מכך לשחרר תרופות נמוכות יותר. לחלופין, ערכים נמוכים באופן שגוי יכולים להיגרם גם אם התרופה מעולם לא הוזרקה, למשל, אם קטטר ורידי הזנב הוסר או הונח בצורה לא נכונה. כפי שניתן לראות לעיל, ההתקנה של מזחלת MRI כללה החדרת בדיקת טמפרטורה (רקטלית וושט), החדרת קטטר ורידים זנב, ומיקום מוניטור נשימתי, ולאחר מכן העברת המזחלת, עכבר, צנתר ורידי זנב, שלוש בדיקות טמפרטורה סיבים אופטיים, מוניטור נשימתי וקווי הרדמה לתוך משעמם MRI. ישנן מספר נקודות זמן במהלך תהליך זה כי קטטר ורידים זנב יכול לקבל עקירה. זה נשלט על ידי בדיקת זרימת הדם חזרה לקו, דימום מאתר החדרת הצנתר, ואיגום תרופות מתחת לסרט לאחר הטיפול, אך טעות נותרה אפשרות.
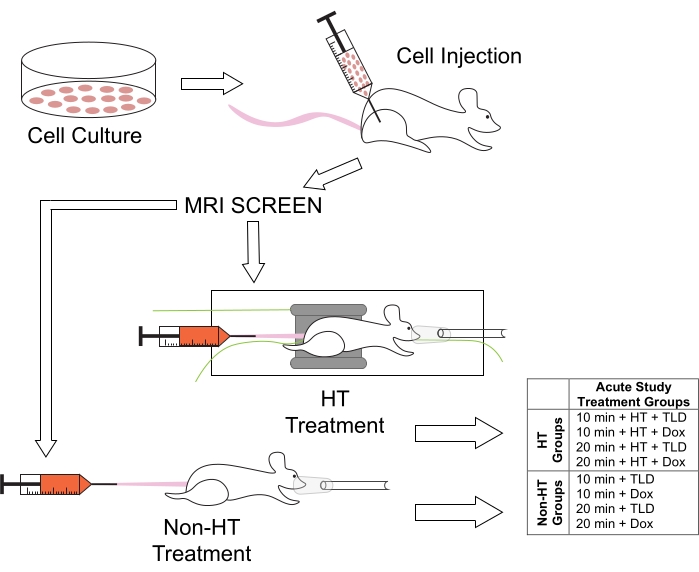
איור 1: פרוטוקול ניסויי עבור טיפולים בבעלי חיים וקבוצות הטיפול הקשורות למחקרי משך HT. לעכברים הוזרקו תאי M25FV24C בגפם האחורית הימנית, ונבדקו להיווצרות הגידול באמצעות MRI לאחר 2-3 שבועות. לאחר מכן הם חולקו לקבוצות נורמותרמיות (Non-HT) או היפרתרמיות (HT), עם TLD או FD במשכי זמן של 10 או 20 דקות. קיצור: Dox = Doxorubicin. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: הגדרת עכבר במהלך טיפול HIFU . (A) מחזיק מודפס בתלת-ממד (לבן) עם בטנת גומי פנימית (אדום) ומגרעת המאפשרת מעבר קרן אולטרסאונד למיקום העכבר. (B) הגדרת עכבר בתוך מחזיק עכבר מודפס בתלת-ממד עם אחיזת טמפרטורה רקטלית (כבל ירוק), צנתר ורידי זנב (לבן) ומוניטור נשימה (כחול). (C) מיקום העכבר על מיטת MRI HIFU במהלך ההליך. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
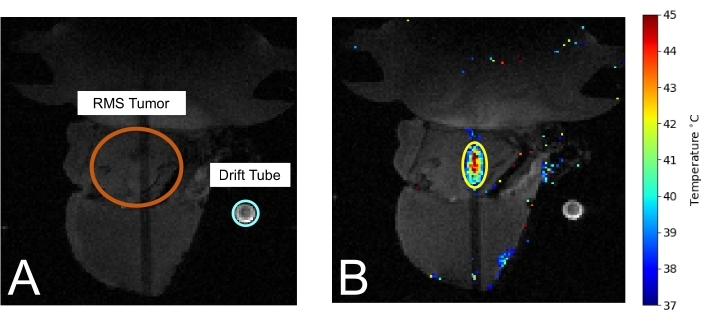
איור 3: עכבר ב-MRI במהלך טיפול MRIgHIFU. (A) הגידול (מסומן בעיגול כתום) וצינור הסחף המשמש למדידת טמפרטורת הסביבה (בעיגול תכלת) גלויים. (B) במהלך הטיפול, מדידת טמפרטורת התרמומטריה מונחת על תמונת MRI. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
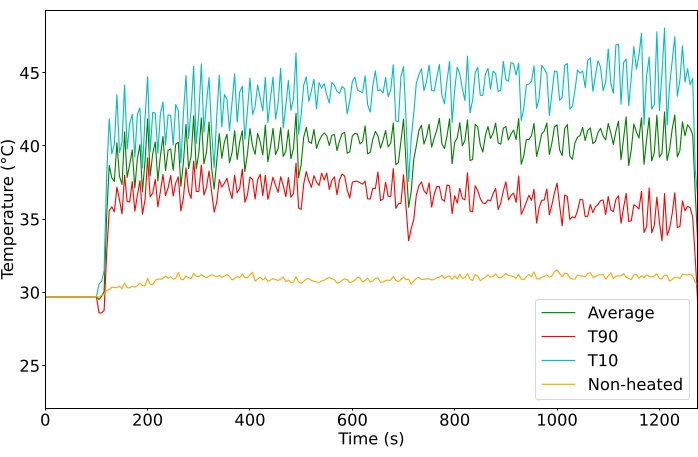
איור 4: טמפרטורה (°C) המנוטרת במהלך הטיפול. טמפרטורות ממוצעות (ירוק), אחוזון 10 עליון (אדום) ואחוזון 90 העליון (ציאן) של כל הווקסלים בהחזר ההשקעה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 5: טמפרטורות ממוצעות במהלך הטיפול במסגרת החזר ההשקעה עבור כל עכבר שנבדק בשלב האופטימיזציה עם סטיית התקן במהלך הטיפול. הטמפרטורה הממוצעת הכוללת וסטיית התקן במהלך הטיפול מוצגת גם היא (כתום). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
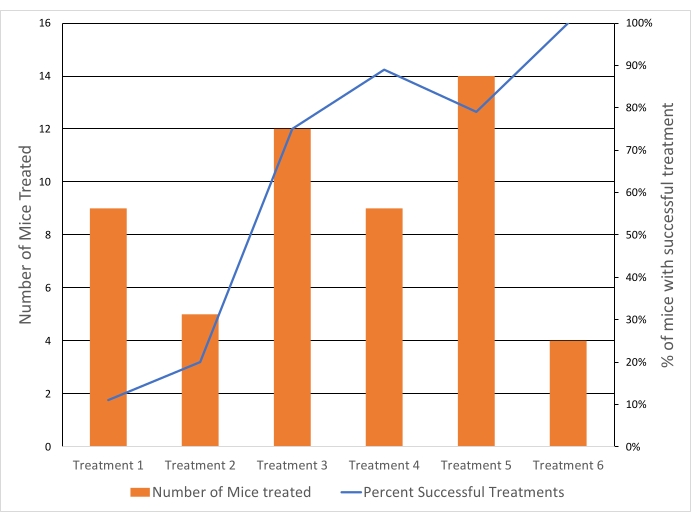
תרשים 6: שיעורי ההצלחה של טיפול בהיפרתרמיה השתפרו עם הזמן. הצלחת הטיפול הייתה תלויה בקריטריוני ההכללה (טמפרטורה מערכתית, טמפרטורת הגידול ושונות עם החזר ההשקעה, וללא חימום דיסטלי). קו כחול = % מהעכברים שהטיפול בהם הצליח. פסים כתומים = מספר העכברים שטופלו ב-HT. כל טיפול (טיפול 1-6) מתייחס לתאריך נפרד שבו נערכו הניסויים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 7: כמות דוקסורוביצין בגידול לאחר טיפול תרופתי. (A) בדיקות מרובות של Mann-Whitney עם תיקון FDR להשוואות מרובות של תוצאות HPLC-MS מראות מובהקות (q < 0.05) בין כמות הדוקסורוביצין בגידול בקבוצת TLD + HT של 20 דקות בהשוואה לביקורת NT. (B) לא נצפו הבדלים בגידול בקבוצות ה-FD. %ID = אחוז מהמנה הראשונית. = q < 0.0001. קיצורים: HT = היפרתרמיה, NT = נורמותרמיה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| שם רצף | Ax_Screen | Ax_Loc | Sag_Loc | Cor_TestShot | תרמי |
| סוג רצף | T2w נדיר | T2w נדיר | T2w נדיר | פלאש | פלאש |
| כיוון | צירית | צירית | מזל קשת | קורונל | צירית/קשת |
| זמן הד (ms) | 40 | 72 | 72 | 6 | 6 |
| זמן חזרה (ms) | 3200 | 4500 | 4500 | 39.06 | 39.06 |
| זווית היפוך (מעלות) | 90/180 | 90/180 | 90/180 | 10 | 10 |
| שדה ראייה (מ"מ) | 28.8 x 28.8 | 36 x 36 | 35 x 35 | 35 x 35 | |
| גודל מטריצה | 128 x 128 | 128 x 128 | 128 x 128 | 128 x 128 | 128 x 128 |
| רזולוציה (מ"מ) | 0.225 x 0.225 | 0.281 x 0.281 | 0.281 x 0.281 | 0.273 x 0.273 | 0.273 x 0.273 |
| מספר פרוסה | 20 | 20 | 20 | 3 | 2 |
| עובי פרוסה (מ"מ) | 1 | 1 | 1 | 1.5 | 1.25 |
| # ממוצעים | 3 | 1 | 1 | 1 | 1 |
| # חזרות | 1 | 1 | 1 | 9 | 9 או 300 |
| זמן סריקה | 4 דקות 0 שניות | 1 דקות 12 שניות | 1 דקות 12 שניות | 45 שניות | 25 דק' |
טבלה 1: פרמטרים ללכידת MRI עם שמות רצפים משויכים.
איור משלים 1: מחזיק עכבר מודל תלת-ממדי (לבן) עם ציפוי גומי פנימי (אדום). מידות: אורך = 43 מ"מ, רדיוס חיצוני = 15 מ"מ, רוחב פנימי = 20.7 מ"מ. אנא לחץ כאן להורדת קובץ זה.
איור משלים 2: טמפרטורה (°C) המנוטרת במהלך הטיפול. טמפרטורת הליבה נמדדה על ידי בדיקות רקטליות (כחולות) וושט (כתום). אנא לחץ כאן כדי להוריד קובץ זה.
קובץ קידוד משלים 1: קובץ הדפסה תלת מימדית עבור מחזיק העכבר. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
הפרוטוקול שפותח כאן שימש לטיפול בגידולי גפיים אחוריות באמצעות MRgHIFU לטיפול קל ב-HT ולשחרור תרופות עטופות מליפוזומים in vivo. פרוטוקול זה נתקל במספר שלבים קריטיים במהלך מחקר הפיילוט, ואופטימיזציה של צעדים קריטיים אלה הסבירה את הצלחת הטיפול המשופרת בהשוואה למחקר הפיילוט. הראשון הוא הסרה מלאה של השיער על האזור להיות sonicated. כל לכידת גז בתוך הפרווה מונעת מקרן האולטרסאונד לעבור וחוסמת את מעבר האולטרסאונד לרקמת המטרה1. שנית, מיקום העכבר חיוני לטיפול מוצלח; הגידול צריך להיות ממוקם מעולה מחזיק העכבר כדי להיות במגע קרוב יותר עם מתמר אולטרסאונד. בנוסף, מבנים גרמיים צריך להיות ממוקם מתוך נתיב קרן אולטרסאונד מבלי לפגוע בעכבר. הוכח כי העצם סופגת גלי אולטרסאונד ביעילות, ולאחר מכן פועלת כמקור חימום באתר . זה יכול להשפיע על פרופיל החימום תוך חסימת העברת אולטרסאונד לאזור העניין4. האיבר הנגדי צריך להיות ממוקם גם מחוץ לנתיב האולטרסאונד, או על ידי תחיבת הרגל מתחת לשאר הגוף או על ידי הרחבתו ומילוי האוויר בין הרגליים עם ג'ל אולטרסאונד או כרית ג'ל. פי הטבעת חייב גם להיות מחוץ לנתיב של אולטרסאונד כדי למנוע חימום מחוץ למטרה השתקפות מן הבדיקה טמפרטורה. מיקום זהיר של הגידול הוא הצעד החשוב ביותר להשלמת טיפול מוצלח.
לאחר מיקום נכון, המיקום של בדיקת טמפרטורת הוושט חייב להתבצע בזהירות כדי למנוע חסימה קנה הנשימה. בעת החדרת העכבר לתוך משעמם MRI, רכזת החיבור המתכתית בין הצנתר בזנב לבין צנתר משאבת ההזרקה צריכה להיות מאובטחת באמצעות סרט דיסטלי לאזור ההדמיה כדי למנוע יצירת חפץ. מתמר האולטרסאונד צריך להיות ממוקם כך שהוא במגע עם האזור ללא פרווה של הרגל ולא לעקור את צג הנשימה. ניטור קפדני של טמפרטורת הגוף המרכזית של העכבר במהלך הטיפול ולאחר מכן התאמה של מערכת חימום הסעה נדרש להישרדות העכבר. בשל הקרבה של פי הטבעת והגידול אצל חלק מהעכברים, התוספת של בדיקת הוושט הייתה חשובה כדי לקבוע את שינוי טמפרטורת הליבה, מכיוון שטמפרטורת פי הטבעת יכלה לשקף רק חימום מקומי בניגוד לחימום גוף הליבה.
בתכנון ויישום פרוטוקול זה, פתרון בעיות נרחב בוצע בהצלחה על ידי צוות רב תחומי. לצורך מיקום העכבר, תוכנן מחזיק עכבר והודפס בתלת-ממד לשימוש על מזחלת MRI של חולדות כדי לאפשר זרימה של האוויר המחומם סביב העכבר לצורך התאמת טמפרטורת גוף תוך פרוצדורלית. החומרים עבור מחזיק זה נבחרו על סמך יכולתם להחזיק את העכבר בבטחה תוך מתן אפשרות להתמרה אולטרסאונד. תוספת גומי בתוך המחזיק המודפס אפשרה התאמות עכבר בודדות, בעוד שהחתך בתחתית מנע השתקפות גלי אולטרסאונד וחימום לא מכוון.
ישנן מגבלות הקשורות למודל, כגון הקרבה של הגידולים למבנים סמוכים - עצם הירך ופי הטבעת - שיכולים לספוג או להחזיר גלי אולטרסאונד, בהתאמה. חימום לא מכוון של עצם הירך עלול לגרום להרס מח עצם וכאב, בעוד שהשתקפות אולטרסאונד מהאוויר בפי הטבעת עלולה לגרום לחימום מקומי ולנזק לרקמות. בנוסף, היו מקרים של לכידה של גל האולטרסאונד עקב צמיחה מחודשת של העור לאחר הטיפול בעכברים השורדים, מה שגרם לחימום מקומי של העור. החשד הוא שהסיבה לכך היא לכידת אוויר סביב זקיק השערה שאינו נעקר עם ג'ל האולטרסאונד בין המתמר לעור. בכל אחד מהמקרים, העור נראה כהה יותר מהעור חסר השיער שמסביב. בחלקים אימונוהיסטוכימיים של גפי עכברים אלה נראו שערות בתוך האפידרמיס, אך לא נמצא פיברוזיס גידולי או הסבר אחר מדוע האולטרסאונד לא יוכל לעבור דרך העור והרקמות התת עוריות.
עם פיתוח פרוטוקול זה, מתוכננים מחקרים נוספים להרחיב את מערכות המודל לבדיקת גידולים מוצקים אחרים בילדים, כגון אוסטאוסרקומה ומיקסופברוסרקומה, לטיפול ב- HT וב- TLD. זה מבטיח מכיוון שחולים אלה יכולים להתמודד עם כאב מתיש עם אפשרויות טיפול מוגבלות בהקשר קליני זה. פרוטוקול זה יכול להיות מורחב לסוגי גידולים מוצקים אחרים הממוקמים בגפיים הניתנים למיקוד עם MRgHIFU29,30. לסיכום, הנתונים תומכים בכך שניתן להסיק את השילוב של ליפוזומים רגישים לחום כדי לתמצת צורות אחרות של כימותרפיה או תרופות שבהן מתן תרופות ממוקד יועיל וצורה לא פולשנית של חימום, כגון MRgHIFU, תהיה אידיאלית.
Disclosures
למחברים אין אינטרסים כספיים או ניגודי עניינים לחשוף.
Acknowledgements
ברצוננו להכיר במקורות המימון שלנו לפרויקט זה ובכוח האדם המעורב, כולל: מענק מחקר C17, מלגת בוגר קנדה, קרן הנאמנות להזדמנויות סטודנטים באונטריו וקרן ג'יימס ג'יי האמונד.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5mL Eppendorf tubes | Eppendorf | 22363204 | |
| 1kb plus DNA Ladder | Froggabio | DM015-R500 | |
| 2x HS-Red Taq (PCR mix) | Wisent | 801-200-MM | |
| 7 Tesla MRI BioSpec | Bruker | T184931 | 70/30 BioSpec, Bruker, Ettlingen, Germany |
| C1000 Thermal cycler | Biorad | 1851148 | |
| Clippers | Whal Peanut | 8655 | |
| Compressed ultrasound gel | Aquaflex | HF54-004 | |
| Convection heating device | 3M Bair Hugger | 70200791401 | |
| Depiliatory cream | Nair | 61700222611 | Shopper's Drug Mart |
| DMEM | Wisent | 219-065-LK | |
| DNeasy extraction kit | Qiagen | 69504 | |
| DPBS | Wisent | 311-420-CL | |
| Drug injection system | Harvard Apparatus | PY2 70-2131 | PHD 22/2200 MRI compatible Syringe Pump |
| Eye lubricant | Optixcare | 50-218-8442 | |
| F10 Media | Wisent | 318-050-CL | |
| FBS | Wisent | 081-105 | |
| Froggarose | FroggaBio | A87 | |
| Gel Molecular Imager | BioRad | GelDocXR | |
| Glutamax | Wisent | 609-065-EL | |
| Heat Lamp | Morganville Scientific | HL0100 | Similar to this product |
| Intravascular Polyethylene tubing (0.015" ID x 0.043" OD, 20G) | SAI infusion | PE-20-100 | |
| Isoflurane | Sigma | 792632 | |
| M25FV24C Cell line | Gladdy Lab | N/A | |
| Microliter Syringe | Hamilton | 01-01-7648 | |
| Molecular Imager Gel Doc XR | Biorad | 170-8170 | |
| Mouse holder | The 3D printing material used was ABS-M30i, and it was printed on FDM Fortus 380mc machine | N/A | Dimensions: length = 43 mm, outer radius = 15 mm, inner width (where the mouse would sit) = 20.7 mm. |
| MyRun Machine | Cosmo Bio Co Ltd | CBJ-IMR-001-EX | |
| Nanodrop 8000 Spectrophotometer | Thermo Scientific | ND-8000-GL | |
| p53 primers | Eurofins | N/A | Custom Primers |
| PCR tubes | Diamed | SSI3131-06 | |
| Penicillin/Streptomycin | Wisent | 450-200-EL | |
| Proteus software | Pichardo lab | N/A | |
| Respiratory monitoring system | SAII | Model 1030 | MR-compatible monitoring and gating system for small animals |
| Small Bore HIFU device, LabFUS | Image Guided Therapy | N/A | LabFUS, Image Guided Therapy, Pessac, France Number of elements 8 frequency 2.5 MHz diameter 25 mm radius of curvature 20 mm Focal spot size 0.6 mm x 0.6 mm x 2.0 mm Motor: axes 2 Generator: Number of channels 8 Maximum electrical power/channel Wel 4 Maximum electrical power Wel 32 Bandwidth 0.5 - 5 MHz Control per channel: Freq., Phase and. amplitude Measurements per channel: Vrms, Irms, cos(theta) Duty Cycle at 100% power % 100% for 1 min. Transducer: Number of elements 8 frequency 2.5 MHz diameter 25 mm radius of curvature 20 mm Focal spot size 0.6 mm x 0.6 mm x 2.0 mm |
| SYBR Safe | ThermoFisher Scientific | S33102 | |
| TAE | Wisent | 811-540-FL | |
| Tail vein catheter (27G 0.5" ) | Terumo Medical Corp | 15253 | |
| Thermal probes | Rugged Monitoring | L201-08 | |
| Trypan blue | ThermoFisher Scientific | 15250061 | |
| Trypsin | Wisent | 325-052-EL | |
| Ultrasound Gel | Aquasonic | PLI 01-08 |
References
- Skapek, S. X., et al. Rhabdomyosarcoma. Nature Reviews Disease Primers. 5 (1), (2019).
- Ferrari, A., et al. Impact of rhabdomyosarcoma treatment modalities by age in a population-based setting. Journal of Adolescent and Young Adult Oncology. 10 (3), 309-315 (2021).
- Dasgupta, R. Pediatric rhabdomyosarcoma surgery: Background, anatomy, pathophysiology. , Available from: https://emedicine.medscape.com/article/939156-overview#a2 (2019).
- Ognjanovic, S., Linabery, A. M., Charbonneau, B., Ross, J. A. Trends in childhood rhabdomyosarcoma incidence and survival in the United States, 1975-2005. Cancer. 115 (18), 4218-4226 (2009).
- Mulrooney, D. A., et al. Cardiac outcomes in a cohort of adult survivors of childhood and adolescent cancer: retrospective analysis of the Childhood Cancer Survivor Study cohort. BMJ. 339, (2009).
- Lipshultz, S. E., Cochran, T. R., Franco, V. I., Miller, T. L. Treatment-related cardiotoxicity in survivors of childhood cancer. Nature Reviews Clinical Oncology. 10 (12), 697-710 (2013).
- Winter, S., Fasola, S., Brisse, H., Mosseri, V., Orbach, D. Relapse after localized rhabdomyosarcoma: Evaluation of the efficacy of second-line chemotherapy. Pediatric Blood & Cancer. 62 (11), 1935-1941 (2015).
- Wood, B. J., et al. Phase I study of heat-deployed liposomal doxorubicin during radiofrequency ablation for hepatic malignancies. Journal of Vascular and Interventional Radiology. 23 (2), 248-255 (2012).
- Bulbake, U., Doppalapudi, S., Kommineni, N., Khan, W. Liposomal formulations in clinical use: an updated review. Pharmaceutics. 9 (2), 12(2017).
- Zagar, T. M., et al. Two phase I dose-escalation/pharmacokinetics studies of low temperature liposomal doxorubicin (LTLD) and mild local hyperthermia in heavily pretreated patients with local regionally recurrent breast cancer. International Journal of Hyperthermia. 30 (5), 285-294 (2014).
- Kim, A. A phase I study of lyso-thermosensitive liposomal doxorubicin and MR-HIFU for pediatric refractory solid tumors. , Available from: https://clinicaltrials.gov/ct2/show/NCT02536183 (2019).
- PanDox: targeted doxorubicin in pancreatic tumours (PanDox). University of Oxford. , Available from: https://clinicaltrials.gov/ct2/show/NCT04852367 (2021).
- Suelmann, B. B. M. Image-guided targeted doxorubicin delivery with hyperthermia to optimize loco-regional control in breast cancer (i-GO). , Available from: https://clinicaltrials.gov/ct2/show/NCT03749850 (2018).
- De Vita, A., et al. Lysyl oxidase engineered lipid nanovesicles for the treatment of triple negative breast cancer. Scientific Reports. 11 (1), 5107(2021).
- Sapareto, S. A., Dewey, W. C. Thermal dose determination in cancer therapy. International Journal of Radiation Oncology, Biology, Physics. 10 (6), 787-800 (1984).
- Kok, H. P., et al. Heating technology for malignant tumors: a review. International Journal of Hyperthermia. 37 (1), 711-741 (2020).
- Kokuryo, D., Kumamoto, E., Kuroda, K. Recent technological advancements in thermometry. Advanced Drug Delivery Reviews. 163, 19-39 (2020).
- Bongiovanni, A., et al. 3-T magnetic resonance-guided high-intensity focused ultrasound (3 T-MR-HIFU) for the treatment of pain from bone metastases of solid tumors. Support Care Cancer. 30 (7), 5737-5745 (2022).
- Seifert, G., et al. Regional hyperthermia combined with chemotherapy in paediatric, adolescent and young adult patients: current and future perspectives. Radiation Oncology. 11, 65(2016).
- Dewhirst, M. W., Lee, C. -T., Ashcraft, K. A. The future of biology in driving the field of hyperthermia. International Journal of Hyperthermia. 32 (1), 4-13 (2016).
- Dewhirst, M. W., Vujaskovic, Z., Jones, E., Thrall, D. Re-setting the biologic rationale for thermal therapy. International Journal of Hyperthermia. 21 (8), 779-790 (2005).
- Repasky, E. A., Evans, S. S., Dewhirst, M. W. Temperature matters! And why it should matter to tumor immunologists. Cancer Immunology Research. 1 (4), 210-216 (2013).
- Hijnen, N., et al. Thermal combination therapies for local drug delivery by magnetic resonance-guided high-intensity focused ultrasound. Proceedings of the National Academy of Sciences. 114 (24), E4802-E4811 (2017).
- Shultz, L. D., et al. Human cancer growth and therapy in immunodeficient mouse models. Cold Spring Harbor Protocols. 2014 (7), 694-708 (2014).
- De Vita, A., et al. Deciphering the genomic landscape and pharmacological profile of uncommon entities of adult rhabdomyosarcomas. International Journal of Molecular Sciences. 22 (21), 11564(2021).
- McKinnon, T., et al. Functional screening of FGFR4-driven tumorigenesis identifies PI3K/mTOR inhibition as a therapeutic strategy in rhabdomyosarcoma. Oncogene. 37 (20), 2630-2644 (2018).
- Zaporzan, B., et al. MatMRI and MatHIFU: software toolboxes for real-time monitoring and control of MR-guided HIFU. Journal of Therapeutic Ultrasound. 1, (2013).
- Dunne, M., et al. Heat-activated drug delivery increases tumor accumulation of synergistic chemotherapies. Journal of Controlled Release. 308, 197-208 (2019).
- Zhao, Y. X., Hu, X. Y., Zhong, X., Shen, H., Yuan, Y. High-intensity focused ultrasound treatment as an alternative regimen for myxofibrosarcoma. Dermatologic Therapy. 34 (2), 14816(2021).
- Vanni, S., et al. Myxofibrosarcoma landscape: diagnostic pitfalls, clinical management and future perspectives. Therapeutic Advances in Medical Oncology. 14, 17588359221093973(2022).
Erratum
Formal Correction: Erratum: Magnetic Resonance-Guided High Intensity Focused Ultrasound Generated Hyperthermia: A Feasible Treatment Method in a Murine Rhabdomyosarcoma Model
Posted by JoVE Editors on 2/08/2023. Citeable Link.
An erratum was issued for: Magnetic Resonance-Guided High Intensity Focused Ultrasound Generated Hyperthermia: A Feasible Treatment Method in a Murine Rhabdomyosarcoma Model . The Authors section was updated from:
Claire Wunker1,2
Karolina Piorkowska3
Ben Keunen3
Yael Babichev2
Suzanne M. Wong3,4
Maximilian Regenold5
Michael Dunne5
Julia Nomikos1,2
Maryam Siddiqui6
Samuel Pichardo6
Warren Foltz7
Adam C. Waspe3,8
Justin T. Gerstle3,9
Rebecca A. Gladdy1,2,10
1 Institute of Medical Science, University of Toronto
2 2Lunenfeld-Tanenbaum Research Institute, Mount Sinai Hospital
3 The Wilfred and Joyce Posluns Centre for Image-Guided Innovation and Therapeutic Intervention, The Hospital for Sick Children
4 Institute of Biomedical Engineering, University of Toronto
5 Leslie Dan Faculty of Pharmacy, University of Toronto
6 Departments of Radiology and Clinical Neurosciences, University of Calgary
7 Department of Radiation Oncology, University of Toronto
8 Department of Medical Imaging, University of Toronto
9 Department of Pediatric Surgery, University of Toronto
10 Department of Surgery, University of Toronto
to:
Claire Wunker1,2
Karolina Piorkowska3
Ben Keunen3
Yael Babichev2
Suzanne M. Wong3,4
Maximilian Regenold5
Michael Dunne5
Julia Nomikos1,2
Maryam Siddiqui6
Samuel Pichardo6
Warren Foltz7
Adam C. Waspe3,8
Justin T. Gerstle3,9
James M. Drake1,3,4,10
Rebecca A. Gladdy1,2,10
1 Institute of Medical Science, University of Toronto
2 Lunenfeld-Tanenbaum Research Institute, Mount Sinai Hospital
3 The Wilfred and Joyce Posluns Centre for Image-Guided Innovation and Therapeutic Intervention, The Hospital for Sick Children
4 Institute of Biomedical Engineering, University of Toronto
5 Leslie Dan Faculty of Pharmacy, University of Toronto
6 Departments of Radiology and Clinical Neurosciences, University of Calgary
7 Department of Radiation Oncology, University of Toronto
8 Department of Medical Imaging, University of Toronto
9 Department of Pediatric Surgery, University of Toronto
10 Department of Surgery, University of Toronto
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved