Method Article
Гипертермия, генерируемая высокоинтенсивным сфокусированным ультразвуком под магнитно-резонансным контролем: возможный метод лечения на модели рабдомиосаркомы у мышей
В этой статье
Erratum Notice
Резюме
Здесь представлен протокол использования контролируемой гипертермии, генерируемой высокоинтенсивным сфокусированным ультразвуком под магнитно-резонансным контролем, для запуска высвобождения лекарства из чувствительных к температуре липосом в мышиной модели рабдомиосаркомы.
Аннотация
Сфокусированный ультразвук высокой интенсивности под магнитно-резонансным контролем (MRgHIFU) является признанным методом получения локализованной гипертермии. Учитывая визуализацию в реальном времени и модуляцию акустической энергии, этот метод позволяет точно контролировать температуру в определенной области. С помощью этой неинвазивной неионизирующей технологии исследуются многие тепловые применения, такие как генерация гипертермии, для высвобождения лекарств из термочувствительных липосомальных носителей. Эти препараты могут включать химиотерапию, такую как доксорубицин, для которой желательно целевое высвобождение из-за системных побочных эффектов, ограничивающих дозу, а именно кардиотоксичности. Доксорубицин является основой для лечения различных злокачественных опухолей и обычно используется при рецидивирующей или рецидивирующей рабдомиосаркоме (РМС). RMS является наиболее распространенной солидной экстракраниальной опухолью мягких тканей у детей и молодых людей. Несмотря на агрессивную мультимодальную терапию, показатели выживаемости RMS остаются неизменными в течение последних 30 лет. Чтобы изучить решение для удовлетворения этой неудовлетворенной потребности, был разработан экспериментальный протокол для оценки высвобождения термочувствительного липосомального доксорубицина (TLD) в иммунокомпетентной сингенной модели мыши RMS с использованием MRgHIFU в качестве источника гипертермии для высвобождения лекарственного средства.
Введение
Рабдомиосаркома (РМС) — это опухоль скелетных мышц, которая чаще всего встречается у детей и молодых людей1. Локализованное заболевание часто лечится мультимодальным лечением, включая химиотерапию, ионизирующее излучение и хирургическое вмешательство. Использование схем химиотерапии с несколькими препаратами более распространено у педиатрических пациентов с улучшенными результатами по сравнению с их взрослыми коллегами2; Однако, несмотря на продолжающиеся исследования, 5-летняя выживаемость остается на уровне около 30% при наиболее агрессивной форме заболевания 3,4. Стандарт химиотерапии представляет собой схему с несколькими препаратами, которая включает винкристин, циклофосфамид и актиномицин D. В случаях рецидива или рецидива заболевания используются альтернативные химиотерапии, включая стандартный (свободный) доксорубицин (ФД) и ифосфамид1. В то время как все эти химиотерапии имеют системную токсичность, кардиотоксичность доксорубицина налагает пожизненное ограничение дозы 5-7. Для увеличения количества препарата, доставляемого к опухоли, и минимизации системной токсичности были разработаны альтернативные лекарственные формы, включая липосомальную инкапсуляцию. Это может быть нетермочувствительный доксорубицин, который был одобрен для лечения рака молочной железы и гепатоцеллюлярной карциномы, или термочувствительный доксорубицин, для которого продолжаются клинические испытания 8,9,10,11,12,13. Альтернативные методы доставки липосомальных инкапсулированных лекарственных средств, такие как мультивезикулярные липосомы и лиганд-таргетные липосомы, были оценены и показывают перспективность для лечения опухолей9. В этом исследовании добавление тепла оказывает многофакторное воздействие, включая высвобождениелекарства 14. Комбинация гипертермии (ГТ), генерируемой высокоинтенсивным сфокусированным ультразвуком (MRgHIFU) под магнитно-резонансным контролем (MRgHIFU) и термочувствительным липосомальным доксорубицином (TLD), является новым мультимодальным терапевтическим подходом для использования этого токсичного, но эффективного препарата для лечения RMS, минимизируя при этом токсичность, ограничивающую дозу, и потенциально увеличивая иммунный ответ на опухоль.
Доксорубицин быстро высвобождается из TLD при температурах >39 °C, что значительно выше средней температуры человеческого тела 37 °C, но недостаточно высоко, чтобы вызвать повреждение тканей или абляцию; это начинает происходить при 43 ° C, но происходит быстрее, когда температура приближается к 60 ° C15. Для получения ГТ in vivo использовались различные методы, включая лазеры, микроволны, радиочастотную абляцию и сфокусированный ультразвук, многие из которых являются инвазивными методами нагрева16. MRgHIFU - это неинвазивный, неионизирующий метод нагрева, который облегчает точные настройки температуры в ткани-мишени in situ. Магнитно-резонансная томография (МРТ) в решающей степени обеспечивает визуализацию в режиме реального времени, где можно использовать компьютерное программное обеспечение, для расчета термометрического измерения ткани на протяжении всего лечения; Впоследствии эти данные могут быть использованы для управления ультразвуковой терапией в режиме реального времени для достижения и поддержания желаемой заданной температуры17. MRgHIFU был протестирован на различных типах тканей и может использоваться для широкого спектра температурных процедур, от легкой ГТ до абляции, а также клинически для успешного лечения болезненных метастазовв кости 18. Кроме того, было показано, что ГТ вызывает цитотоксичность опухоли, модулирует экспрессию белка и изменяет иммунный ответ в микроокружении опухоли 19,20,21,22. В одном исследовании сочетали легкую ГТ с TLD с последующей абляцией с MRgHIFU в синергетической моделиR1 крысы 23, что приводило к некрозу в ядре опухоли и доставке лекарства на периферию. Традиционно лучевая терапия использовалась в качестве вспомогательной терапии для повреждения опухолевых клеток и уменьшения рецидивов местного заболевания. Однако его использование ограничено пожизненным дозированием и нецелевым уроном1. Таким образом, HT уникален тем, что он может вызывать некоторые из тех же эффектов без той же токсичности или ограничений.
Доклинические модели RMS на животных включают сингенные иммунокомпетентные модели и ксенотрансплантаты, полученные от пациента (PDX) у хозяев с ослабленным иммунитетом. В то время как модели с ослабленным иммунитетом допускают рост опухолей человека, они не имеют соответствующего микроокружения опухоли и ограничены в своей способности изучать иммунный ответ24. Мутация, активирующая FGFR4, является многообещающим маркером плохого прогноза и потенциальной терапевтической мишенью у взрослых и детей RMS 1,25. В сингенных моделях RMS, разработанных в лаборатории Глэдди, опухоли способны расти в иммунокомпетентном хозяине, у которого развиваются врожденные и адаптивные иммунные реакции на опухоль26. Поскольку ГТ влияет на иммунный ответ, наблюдение за изменением иммунного ответа мышей является ценным преимуществом этой модели опухоли. Чтобы проверить как реакцию опухоли на TLD по сравнению с FD, так и изменение иммунного ответа опухоли как на химиотерапию, так и на HT, был разработан и использован протокол для лечения сингенных опухолей RMS у мышей in vivo с использованием MRgHIFU и TLD, который находится в центре внимания этого исследования.
протокол
Исследования проводились в соответствии с комитетами по уходу за животными с утвержденными протоколами использования животных под наблюдением ветеринарного врача в исследовательских центрах животных Центра феногеномики (TCP) и Центра ресурсов животных (ARC) Университетской сети здравоохранения (UHN). Все процедуры, за исключением MRgHIFU, с участием животных проводились в шкафу биологической безопасности (BSC), чтобы свести к минимуму воздействие на животных внешнего воздуха или восприимчивой инфекции.
1. Разведение мышей
ПРИМЕЧАНИЕ: Всего в пилотное исследование было включено 65 мышей (штамм B6.129S2-Trp53tm1Tyj/J) (самец: n = 23; самка: n = 42). Как самцов, так и самок мышей использовали в возрасте 7-9 недель. Их детеныши были отняты от груди и генотипированы, а для экспериментов использовались гетерозиготные мыши p53.
- Разместите двух самок мышей с каждой самцом мыши, чтобы создать клетки для размножения. Подсчитайте возраст их щенков с момента рождения (рождение = день 0).
- На 10-й день определите щенков по ушной выемке. Соберите хвостовые фрагменты для генотипирования перед инъекцией клеточной линии.
2. Генотипирование мышей
- Извлеките ДНК из собранных 2-миллиметровых обрезков хвоста с помощью коммерческого набора для экстракции ДНК (см. Таблицу материалов), следуя инструкциям производителя.
- Определите концентрацию и чистоту ДНК путем измерения поглощения на длине волны 260-280 нм на спектрофотометре (см. Таблицу материалов).
- Проводят полимеразную цепную реакцию (ПЦР).
- Создайте мастер-микс, содержащий коммерческую смесь ПЦР (содержащую Taq-полимеразу, dNTPS и MgCl 2; см. Таблицу материалов), праймери dH2 O в соотношении 12,5:0,25:10,75 (мкл) для необходимого количества образцов. Добавьте 1 мкл образца ДНК в каждую пробирку для ПЦР и включите dH2O, нулевой образец (гомозиготный по мутации p53), гетерозиготный образец (гетерозиготный по мутации p53) и образец дикого типа (гомозиготный по нормальному p53) в качестве контроля ПЦР.
- Добавьте 24 мкл основной смеси в каждую ПЦР-пробирку, содержащую ДНК. Нанесите раствор пипеткой в каждую пробирку для ПЦР вверх и вниз, чтобы распределить ДНК по всей основной смеси.
- Поместите реакционные пробирки в термоциклер и выполните цикл в соответствии со следующими спецификациями: 95 °C в течение 2 мин, 40 циклов при 95 °C в течение 15 с, 60 °C в течение 15 с и 72 °C в течение 1 мин, а затем поддерживать при температуре 4 °C до готовности к анализу на геле.
- Анализируют продукты ПЦР с помощью электрофореза в агарозном геле.
- Приготовьте 2% гель (50 мл 1x TAE и 1 г агарозы), нагревая агарозу в TAE и перемешивая до растворения. Когда он остынет и еще жидкий, добавьте 2,5 мкл гелевого красителя ДНК в агарозу и перемешайте. Отлить гель в гелевую коробочку с помощью расчески. Поместите гель в электрофоретический аппарат (см. Таблицу материалов) и накройте 1x TAE.
- Загрузите 10 мкл 1 кБ ДНК-лестницы на гель. Загрузите 12,5 мкл каждого образца. Запустить гель в течение 25 мин при 135 В.
- Отобразите гель, используя соответствующие настройки для использованного пятна геля ДНК на гелевом тепловизоре (см. Таблицу материалов), в соответствии с инструкциями производителя.
3. Подготовка модели опухоли (рис. 1)
- Выращивайте клеточную линию M25FV24C (пассаж 12-15) за 1 неделю до даты инъекции в полной питательной среде (модифицированная среда Dulbecco Eagle Medium [DMEM] с добавками: 10% FBS, 1% пенициллина/стрептомицина и 2 мМ L-аланил-L-глутамин дипептида) в колбе объемом 75 мл при 37 ° C и 5% CO2. После того, как клетки слились ~ 80%, аспирируйте среду и промойте клетки 1 раз 5 мл фосфатно-буферного физиологического раствора Dulbecco (DPBS).
ПРИМЕЧАНИЕ: M25FV24C представляет собой мышиную клеточную линию, сконструированную для сверхэкспрессии мутанта FGFR4V550E, который наблюдается у детей и взрослых RMS 1,26. - Поднимите клетки, добавив 0,5 мл 0,25% раствора трипсина на боковую сторону пластины и инкубируя сосуд в течение 2-3 мин при комнатной температуре. Как только клетки окажутся отделившимися, добавьте 2,5 мл полной питательной среды при комнатной температуре, чтобы инактивировать трипсин. Используйте аликвоту образца 10 мкл для определения клеточной концентрации жизнеспособных клеток с помощью гемоцитометра и исключения трипанового синего.
- Подготовьте правильный объем суспендированных клеток DPBS для инъекции и поместите в микроцентрифужную пробирку объемом 1,5 мл: объем в центрифугу = (количество мышей × количество клеток на мышь) / (концентрация клеток), где количество мышей = мышей, которым нужно ввести инъекцию + 10 дополнительных мышей за ошибку, и количество клеток на мышь = 104.
- Центрифуга в течение 5 мин при 153 х г. Ресуспендируют клеточную гранулу в соответствующем объеме (10 мкл на мышь × количество мышей) миоинъекционного буфера (среда F10 + 0,5% FBS) и вводят мышам в течение 1 ч после приготовления этой суспензии.
4. Внутримышечная инъекция клеток
ПРИМЕЧАНИЕ: Клетки M25FV24C вводят в правую заднюю конечность мышей в возрасте от 4 до 6 недель. Инъекция через 4 недели дает маленькую мышь с опухолью, которую может быть труднее лечить, поскольку вокруг меньше тканей для дисперсии HT; Ожидание до 6 недель дает более крупную мышь, что облегчает лечение опухоли.
- Переверните клеточную суспензию несколько раз перед аспирацией, чтобы помочь равномерно распределить клетки в растворе. Аспирируют 10 мкл (104 клеток) с помощью микролитрового шприца (см. Таблицу материалов). Почистите мышь; После удержания доступ к хвостовым мышцам бедра можно получить, разгибая заднюю ногу. Побрейте ногу с помощью машинки для стрижки и протрите 70% этанолом.
- Введите клеточную суспензию M25FV24C (10 мкл, 10 4 клеток) в мускулатуру правой задней конечности бедра 4-6-недельной мыши с помощью газонепроницаемого микролитрового шприца с иглой 26s G.
ПРИМЕЧАНИЕ: Иглу следует вводить параллельно бедренной кости по направлению к колену, стараясь не задеть седалищный нерв. Вводят только острие иглы (примерно 2 мм) из-за небольшой мышечной массы задней конечности. - Вводите раствор устойчивыми движениями. Извлеките иглу и убедитесь, что кровотечение не возникает. Верните мышь во вторую клетку.
- Ежедневно оценивайте животных и контролируйте их задние конечности на предмет роста опухоли путем пальпации. Усыпьте мышей углекислым газом, если обнаружена какая-либо из следующих ранних конечных точек: размер опухоли, превышающий 1,5 см в диаметре, изъязвление опухоли или системные признаки болезни (пилоэрекция, сгорбленная поза, бездействие или снижение потребления пищи или воды).
5. Скрининговая МРТ
- Обезболить мышей до уровня, при котором нет движения при сжатии лап, изофлураном при следующих параметрах: индуцировать в камере с 4% при 1,5 л/мин, затем перенести в носовой обтекатель на салазках МРТ-сканера и продолжить поддержание изофлурана на носовом конусе с 1,5%-2% при 0,75 л/мин. Прикрепите респираторный монитор. Используйте ветеринарную мазь на глаза, чтобы предотвратить сухость под наркозом.
- Сфотографируйте мышь, находящуюся под наркозом, с помощью МРТ-сканера (см. Таблицу материалов). На Т2-взвешенном изображении (Ax_Screen получении, таблица 1) обратите внимание на размеры в плоскости и количество осевых срезов, в которых появляется опухоль. Обратите внимание на расположение опухоли по отношению к бедренной кости и боковой поверхности бедра, куда войдет ультразвуковая волна.
ПРИМЕЧАНИЕ: Опухоль выглядит как гиперинтенсивная масса внутри мышцы, которая асимметрична с противоположной стороны. Хороший начальный размер опухоли для нескольких видов лечения составляет 2 мм x 2 мм x 2 мм как для острых, так и для исследований выживаемости. Если он намного больше, это будет хорошо только для острых исследований, так как опухоль достигнет конечной точки размера до завершения трех еженедельных процедур. Критерии исключения для лечения HIFU включают: обернутый вокруг бедренной кости, слишком близко к бедренной кости, слишком задний на мыши, медиально к бедренной кости, слишком близко к прямой кишке. - Снимите мышь со сканера и получите базовый вес. Побрейте мышь от середины тела до ног под наркозом с помощью электробритвы.
ПРИМЕЧАНИЕ: В идеале бритье проводится за 1 день до лечения, так как это позволяет мыши выполнять уход, что позволяет крему для депиляции работать более эффективно. - Восстановите мышь в BSC, используя грелку под одним концом клетки. Верните мышь в клетку, когда она вновь обретет лежачее положение грудины.
6. Эксперимент: подготовка дневных животных к лечению HIFU
- Чтобы подготовить малокалиберную систему HIFU (см. Таблицу материалов), включите генератор и наполните преобразователь достаточным количеством деионизированной воды до тех пор, пока мембрана не расширится ниже преобразователя, но не настолько твердая, чтобы сжать мышь. Дегазируйте воду в контуре преобразователя в течение 30 минут, чтобы удалить растворенный кислород из среды.
- Подготовьте связанную компьютерную систему.
- Включите управляющий компьютер и убедитесь, что он подключен через Ethernet к генератору HIFU и через USB к дисплею термозонда. Запустите программное обеспечение и нажмите «Домой», чтобы установить датчик, прежде чем вставлять мышь.
- Откалибруйте волоконно-оптические тепловые датчики: получите базовую температуру в помещении и обратите внимание на изменение температуры в комнате МРТ. Обратите внимание на величину температурного дрейфа для каждого зонда из-за напряженности магнитного поля. Вставьте датчик температуры дрейфовой трубки в стеклянную трубку, заполненную гадолинием, для калибровки температуры во время сканирования и закрепите дрейфовую трубку лентой.
ПРИМЕЧАНИЕ: Базовая комнатная температура (дрейфовая трубка) добавляется вручную в качестве параметра термометрии в графическом интерфейсе программного обеспечения. Область интереса (ROI) устанавливается внутри дрейфовой трубки на МР-изображении для обнаружения любого температурного дрейфа и автоматически корректирует термометрические изображения. - Наберите препарат для инъекции в шприц объемом 1 мл и поместите его в автоматический нагнетательный насос (см. Таблицу материалов). Заправляйте линию, которая будет соединяться с катетером хвостовой вены мыши, до тех пор, пока лекарство полностью не заполнит линию, нажимая кнопку ручной подачи на насосе автоматической доставки.
- Используйте тепловую лампу, чтобы согреть мышей в клетках в течение ~ 20 минут перед переносом в анестезиологическую камеру.
ПРИМЕЧАНИЕ: Предварительный нагрев способствует расширению сосудов, что произойдет, как только мышь будет анестезирована, и поможет в установке катетера.
- Анестезируйте мышь изофлураном (индукция: 4% при 1,5 л/мин; поддерживающая: 1,5%-2% при 0,75 л/мин) и перенесите в носовой конус. Нанесите смазку роговицы на глаза, чтобы предотвратить повреждение из-за отсутствия рефлекса моргания под наркозом.
- Нанесите крем для депиляции на выбритую область, включая всю правую заднюю конечность, и следуйте инструкциям производителя по удалению волос.
ПРИМЕЧАНИЕ: Поместите мышь под нагревательную лампу, находясь в BSC, чтобы помочь с терморегуляцией во время удаления волос под анестезией. - Смыв крем для депиляции теплой водой, взвесьте мышь на цифровых весах и запишитесь на дозировку препарата.
- Переместите мышь на МРТ-совместимый носовой конус на салазках МРТ. Установите нагревательную лампу на мышь, чтобы она оставалась в тепле во время подготовки к МРТ. Поместите мышь в боковое положение пролежня неопулевой стороной вниз, а опухоль находится верхом внутри держателя для мыши, напечатанного на 3D-принтере, на салазках (дополнительные рисунки 1 и 2). Обеспечьте правильное расположение опухоли (т.е. в центре катушки горизонтально и вертикально, с высотой чуть выше краев держателя мыши, чтобы учесть сжатие ультразвуковым датчиком).
ПРИМЕЧАНИЕ: При необходимости отрежьте сжатый сегмент ультразвуковой гелевой подушечки, чтобы положить его под мышь, выровняв нижнюю часть держателя, толщиной, чтобы выровнять опухоль до верхней части держателя. - Оттяните невовлеченную ногу от опухолевой ножки либо под мышь, либо вытянутую с согнутой опухолевой ногой. Убедитесь, что ноги не находятся в ближней или дальней зоне опухоли и пути ультразвукового луча. Расположите тепловую лампу на расстоянии 15 см от хвоста, чтобы она согрелась для введения катетера в заднюю вену.
- Вставьте датчик температуры пищевода.
- Проденьте пищеводный зонд через носовой конус и обмотайте шею мыши. Наклоните нос мыши вверх, чтобы создать линию от ее рта прямо к животу, вытянув голову. Проведите термозондом над языком примерно на 0,5 см в пищевод мыши и замените носовой конус вокруг носа мыши. Закрепите пищеводный зонд и носовой конус в верхней части салазок.
ПРИМЕЧАНИЕ: Следите за признаками респираторного дистресса сразу после введения, так как он может быть неправильно введен в трахею.
- Проденьте пищеводный зонд через носовой конус и обмотайте шею мыши. Наклоните нос мыши вверх, чтобы создать линию от ее рта прямо к животу, вытянув голову. Проведите термозондом над языком примерно на 0,5 см в пищевод мыши и замените носовой конус вокруг носа мыши. Закрепите пищеводный зонд и носовой конус в верхней части салазок.
- Вставьте ректальный датчик температуры.
ПРИМЕЧАНИЕ: Ректальный и пищеводный датчики температуры должны находиться в пределах 3 °C друг от друга. - Поместите дыхательный монитор с соединительным кабелем к голове мыши, чтобы он не мешал размещению ультразвукового датчика. Закрепите скотчем.
- Вставьте катетер для хвостовой вены иглы бабочки весом 27 г в боковую хвостовую вену, прикрепленную к микротрубке с 20 мкл мертвого пространства и надежно заклейте ленту. После тейпирования убедитесь, что катетер все еще хорошо промывается.
- Используйте двух человек, чтобы перенести подготовленную мышь, упряжки для мыши, линию анестезии, дыхательную линию, катетер для хвостовой вены и шнуры термозонда в сканер МРТ и поместить их в держатель салазок МРТ.
- Попросите оператора программного обеспечения HIFU (см. Таблицу материалов) переместить мениск датчика непосредственно над опухолью путем визуального осмотра для первоначального выравнивания27. Нанесите смазку для глаз или дегазированный ультразвуковой гель на безволосую кожу над опухолью и соедините датчик HIFU с областью опухоли.
- Подключите линию подачи лекарства от автоматического насоса к катетеру хвостовой вены. Рассчитайте количество мертвого пространства в линии хвостовой вены и соединительной линии. Сдвиньте салазки мыши HIFU по направляющим МРТ в центр МРТ.
- Установите количество инфузии лекарственного средства на помпу в зависимости от типа и концентрации лекарственного средства, а также веса животного и добавьте количество мертвого пространства. Установите насос на скорость инфузии 200 мкл / мин.
ПРИМЕЧАНИЕ: В этом исследовании FD и TLD использовались в концентрации 2 мг / мл и дозе 5 мг / кг массы тела. - Запишите базовые температуры теплового зонда.
- Установите конвекционное нагревательное устройство (см. Таблицу материалов) на самую теплую настройку. Направьте трубку, выдувающую воздух, на мышь в центре отверстия МРТ и закрепите лентой. Позже нагревательное устройство будет переведено на самую низкую настройку (32 °C), чтобы предотвратить перегрев мыши во время обработки ультразвуком.
- Получение обзорных МР-снимков (Ax_Loc, Sag_Loc; Таблица 1) Чтобы определить местоположение опухоли для нацеливания на обработку ультразвуком, включая глубину. Отрегулируйте положение датчика соответствующим образом с помощью программного обеспечения HIFU, вставив желаемое расстояние перемещения, измеренное на изображении, а затем щелкнув направление стрелки для перемещения (рис. 3A). Также обратите внимание на расположение дрейфовой трубы. При необходимости повторите.
- Определите расположение фокального пятна преобразователя в корональной плоскости, выполнив короткую непрерывную обработку ультразвуком с амплитудой 5 с x 50 мВ во время сбора термометрии Test_Shot (таблица 1).
- Совместите изображения МРТ-съемки с корональным видом фокусного пятна в программном обеспечении HIFU. Просмотрите изображения на предмет расположения опухоли относительно костной структуры и прямой кишки и измените положение датчика по мере необходимости.
- Повторите тестовый выстрел ультразвуком во время девятиповторной термовизуализации (таблица 1), чтобы подтвердить, есть ли равномерный и точный нагрев в объеме опухоли с минимальным нецелевым нагревом. Отрегулируйте расположение среза, расположение датчика и глубину рулевого управления, а также подтвердите эффективность нагрева повторными «тестовыми выстрелами» по мере необходимости.
- Используя программное обеспечение для мониторинга лечения HIFU, определите рентабельность инвестиций для термометрического мониторинга в конечном профиле нагрева, измерив расстояние для перемещения, а затем изменив координаты сетки в программе. Установите ROI вокруг дрейфовой трубы для коррекции дрейфа. Введите базовую температуру на основе температуры ректального зонда для термометрических измерений. Система HIFU используется для инициирования обработки ультразвуком лечения HIFU и для мониторинга термометрии.
- Откройте спецификации 20-минутного лечения гипертермией в программном обеспечении и начните обработку ультразвуком после того, как будут собраны эталонные изображения МРТ и начнется термометрия.
- Выполните 20-минутную обработку (рис. 3B) во время термической визуализации (таблица 1) с помощью встроенного программного обеспечения контроллера пропорционально-интегративно-производной (PID). Вводят выбранный препарат через 1,5 мин, после того как температура в РОИ нагреется до нужной температуры (40 °С).
- Следите за внутренней температурой на протяжении всего лечения. Если ректальная температура быстро повышается во время лечения, может потребоваться изменение положения мыши, чтобы избежать ректального нагрева в течение 10 или 20 минут лечения. Прекратите лечение, если ректальная температура повысится до >40 °C.
7. Эксперимент: визуализация мышиной модели и процедура обработки ультразвуком для острых исследований
- После завершения лечения извлеките мышь из отверстия МРТ, обеспечив гемостаз в месте введения катетера хвостовой вены. Перенесите мышь в BSC и поместите на носовой конус для продолжения анестезии.
- Положите мышь на спину на синюю впитывающую подушечку с ограниченными конечностями и обнаженным сердцем.
- Усыпляют мышей путем обескровливания с помощью пункции сердца с последующим удалением сердца. Немедленно возьмите кровь и центрифугу для разделения плазмы в дозе 10 621 x g в течение 10 мин.
- Проведите вскрытие и сохраните органы, необходимые для анализа. Заморозьте органы в жидком азоте и храните при температуре -80 °C в течение нескольких месяцев или длительное время в резервуаре с жидким азотом.
- Механически гомогенизируйте опухолевую ткань, добавляя девятикратный избыток (мас./мас.) деионизированной воды и расщепляя ткань с помощью гомогенизатора. Извлеките доксорубицин из 600 мкл гомогенизированной ткани путем последовательного добавления 75 мкл 300 мг/мл нитрата серебра, 75 мкл 10 мМ серной кислоты и 2,5 мл изопропанола: хлороформа. Вортите в течение 20 минут и храните при температуре -20 ° C в течение ночи.
- Чтобы подготовить образцы для высокоэффективной жидкостной хроматографии (ВЭЖХ), центрифугируют раствор с этапа 7,5 при 4,500 x g, удаляют слой органического растворителя и сушат изопропанол:хлороформ под потоком газообразного азота. Ресуспендировать в 100 мкл 2:1 MeOH:H2O. Измерьте концентрацию доксорубицина с помощью ВЭЖХ-МС/МС 28.
8. Эксперимент: визуализация модели мыши и процедура обработки ультразвуком для исследований выживания
ПРИМЕЧАНИЕ: Для исследований выживаемости следуйте процедуре дневной подготовки животных при лечении HIFU (этапы с 6.1 по 6.25).
- После завершения лечения поместите мышь под нагревательную лампу, чтобы она могла восстановиться, и следите за ее дыханием и движениями, пока она не восстановит лежачий сустав грудины. Затем верните животное в клетку.
ПРИМЕЧАНИЕ: Убедитесь, что половина клетки находится на одной линии с нагревательной лампой, так как на терморегуляцию животных влияет анестезия и лечение ГТ. - Ежедневно следите за поведением мышей, режимом кормления и частотой дыхания на наличие признаков дистресса.
- Проводите процедуры один раз в неделю, следуя шагам с 6.1 по 6.25, в течение 3 недель подряд.
- Два раза в неделю выполняйте МРТ-визуализацию мышей для измерения опухоли. В течение нескольких недель во время лечения выполняйте одно МРТ и одно УЗИ каждую неделю. После завершения лечения проводите ультразвуковую визуализацию раз в две недели.
- Усыпить мышь через 60 дней после завершения серии процедур или при достижении гуманной конечной точки (размер опухоли >1,5см3 или заболеваемость опухолью) с последующим вскрытием опухоли и удалением органа для анализа.
Результаты
Используя протокол гипертермии, генерируемый MRgHIFU, опухоли в задней конечности можно было последовательно нагревать до желаемой заданной температуры в течение всего периода лечения (на рисунке 4 показано репрезентативное лечение, 10 или 20 минут, n = 65). Чтобы лечение считалось успешным, рентабельность инвестиций должна была поддерживаться выше 39 ° C в течение всего лечения, с изменением <6 ° C на протяжении всего лечения и без нагрева нецелевой ткани. Кроме того, внутренняя температура должна была оставаться ниже 39 °C, исходя из ректального зонда или начальной ректальной температуры плюс изменение температуры пищеводного зонда (дополнительный рисунок 2). После того, как обработка ультразвуком MRgHIFU была остановлена, опухоль быстро вернулась к исходной температуре.
Опухоли были нацелены на 40,5 ° C, чтобы достичь температуры для быстрого высвобождения препарата, избегая при этом кумулятивных температурных эффектов выше 43 ° C. Средняя температура ROI во всех обработанных опухолях составила 40,6 ° C (n = 65), со средней разницей между вокселями 10-го процентиля и90-го процентиля 4,3 ° C. Стандартное отклонение средней температуры составляло 1,3 ° C в течение всего периода лечения как для 10, так и для 20-минутного лечения (рис. 5). Успешность лечения, отвечающего критериям включения, заметно улучшилась на протяжении всего исследования с 11% до 100% (рис. 6).
После оптимизации протокола лечения продолжительность гипертермии оценивалась на эффективность высвобождения препарата по сравнению с нормотермическими (NT) мышами. Для определения оптимального времени лечения гипертермией для дальнейших исследований были протестированы две продолжительности лечения: 10 мин и 20 мин. Эти длительности были выбраны для возможности последовательного поддержания основной нормотермии и гипертермии опухоли. Высокоэффективная жидкостная хроматография и масс-спектрометрия (ВЭЖХ-МС) использовались для оценки количества доксорубицина в опухолях и количественной оценки разницы в накоплении доксорубицина между тестируемыми продолжительностями. Был значительно более высокий процент начальной дозы (% ID) доксорубицина в опухолях у 20-минутных мышей, получавших HT + TLD, по сравнению с 20-минутными мышами TLD NT (рис. 7, q = 0,000108). Не было существенной разницы между 10-минутными и 20-минутными группами HT + TLD; однако в группе 10-минутного лечения наблюдалось большее стандартное отклонение по сравнению с 20-минутной группой (3,698 против 2,065% ID/г опухоли). Примечательно, что в 10-минутной группе лечения HT + TLD было четыре почти нулевых значения, которые лечились одной партией TLD. TLD был охарактеризован до использования в экспериментах in vivo , как ранее описано Dunne et al.28. Вкратце, TLD был охарактеризован с точки зрения его размера, дзета-потенциала, температуры фазового перехода плавления и концентрации лекарственного средства, а липосомы использовались в течение 72 ч хранения при 4 ° C. Несмотря на то, что все партии TLD были протестированы перед использованием, возможно, что липосомы высвобождали доксорубицин во время экспериментальной установки, до использования. Кроме того, движение во время сканирования может привести к ложно завышенной температуре в программном обеспечении, что приведет к недогреву опухоли и снижению высвобождения лекарства. В качестве альтернативы, ложно низкие значения также могут быть вызваны, если препарат никогда не вводился, например, если катетер хвостовой вены был удален или неправильно размещен. Как видно выше, установка саней МРТ включала введение датчика температуры (ректального и пищеводного), введение катетера в хвостовую вену и установку монитора дыхания с последующим перемещением саней, мыши, катетера хвостовой вены, трех волоконно-оптических датчиков температуры, монитора дыхания и линий анестезии в отверстие МРТ. Во время этого процесса существует несколько моментов времени, когда катетер хвостовой вены может быть смещен. Это контролировалось путем проверки обратного потока крови в линию, кровотечения из места введения катетера и скопления лекарств под лентой после лечения, но ошибка остается возможной.
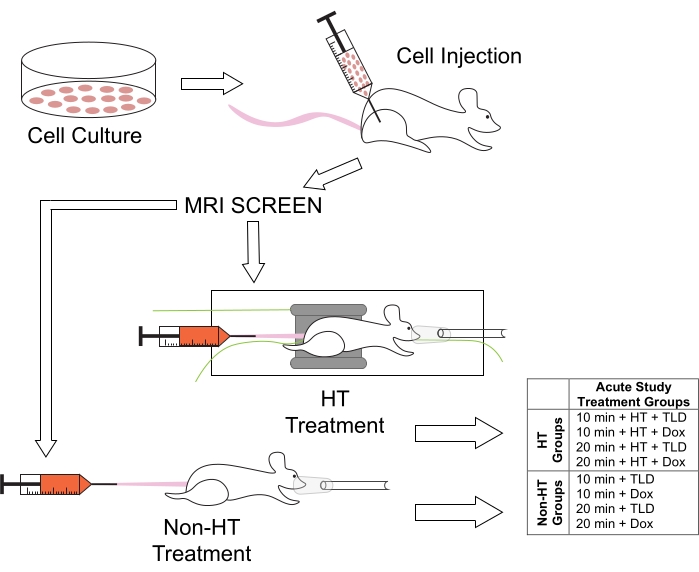
Рисунок 1: Экспериментальный протокол лечения животных и связанных с ним групп лечения для исследований продолжительности ГТ. Мышам вводили клетки M25FV24C в правую заднюю конечность и проверяли на образование опухоли с помощью МРТ через 2-3 недели. Затем они были разделены на нормотермические (не-HT) или гипертермические (HT) группы, с TLD или FD длительностью 10 или 20 минут. Аббревиатура: Dox = Doxorubicin. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Настройка мыши во время лечения HIFU . (A) Напечатанный на 3D-принтере держатель (белый) с внутренней резиновой подкладкой (красный) и вырезом для прохождения ультразвукового луча для позиционирования мыши. (B) Установка мыши внутри держателя для мыши, напечатанного на 3D-принтере, с ректальной фиксацией температуры (зеленый кабель), катетером для хвостовой вены (белый) и монитором дыхания (синий). (C) Положение мыши на кровати МРТ HIFU во время процедуры. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
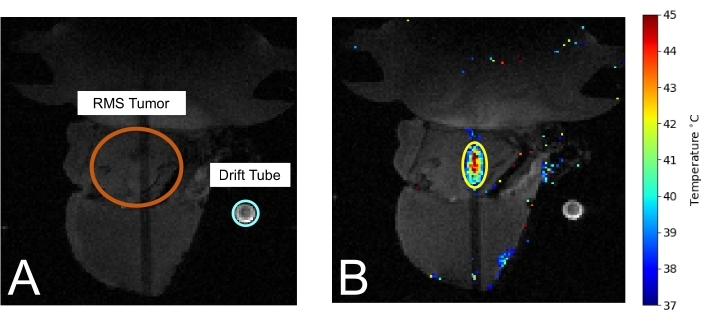
Рисунок 3: Мышь на МРТ во время лечения МРТ gHIFU. (A) Видна опухоль (обведена оранжевым цветом) и дрейфовая трубка, используемая для измерения температуры окружающей среды (обведена голубым цветом). (B) Во время лечения измерение температуры термометрии накладывается на изображение МРТ. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
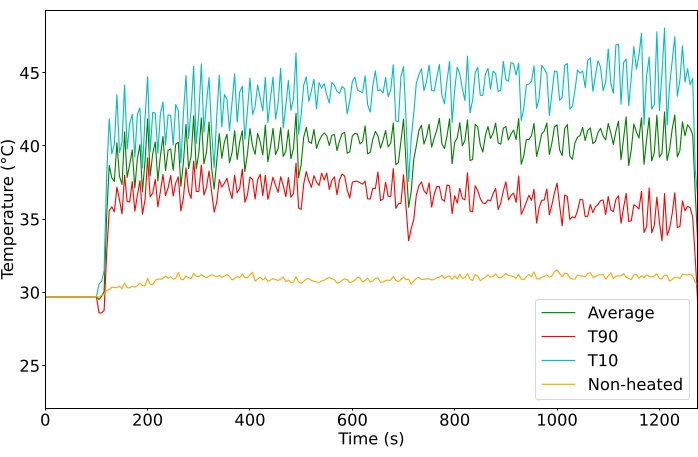
Рисунок 4: Температура (°C) контролируется во время лечения. Средняя (зеленая), верхний 10-й процентиль (красный) и верхний90-й процентиль (голубой) температуры всех вокселей в ROI. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Средние температуры во время лечения в пределах ROI для каждой мыши, протестированной на этапе оптимизации, со стандартным отклонением во время лечения. Также показана общая средняя температура и стандартное отклонение во время лечения (оранжевый цвет). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
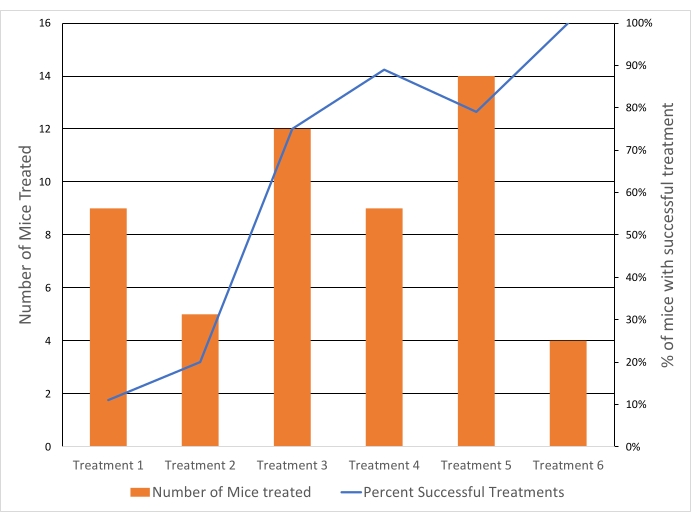
Рисунок 6: Показатели успешности лечения гипертермией улучшались с течением времени. Успех лечения зависел от критериев включения (системная температура, температура опухоли и вариации с ROI, а также отсутствие дистального нагрева). Синяя линия = % мышей, для которых лечение было успешным. Оранжевые полосы = количество мышей, получавших ГТ. Каждое лечение (лечение 1-6) относится к отдельной дате, в которую проводились эксперименты. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 7: Количество доксорубицина в опухоли после медикаментозного лечения. (A) Множественные тесты Манна-Уитни с коррекцией FDR для многократных сравнений результатов ВЭЖХ-МС демонстрируют значимость (q < 0,05) между количеством доксорубицина в опухоли в 20-минутной группе TLD + HT по сравнению с контролем NT. (B) Никаких различий в опухоли в группах ФД не наблюдалось. % ID = процент от начальной дозы. = q < 0,0001. Сокращения: HT = гипертермия, NT = нормотермия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Имя последовательности | Ax_Screen | Ax_Loc | Sag_Loc | Cor_TestShot | Терм |
| Тип последовательности | T2w РЕДКО | T2w РЕДКО | T2w РЕДКО | ВСПЫШКА | ВСПЫШКА |
| Ориентация | Осевой | Осевой | Сагиттальный | Венечный | Осевая/Сагиттальная |
| Время эха (мс) | 40 | 72 | 72 | 6 | 6 |
| Время повторения (мс) | 3200 | 4500 | 4500 | 39.06 | 39.06 |
| Угол переворота (градусы) | 90/180 | 90/180 | 90/180 | 10 | 10 |
| Поле зрения (мм) | 28,8 х 28,8 | 36 х 36 | 35 х 35 | 35 х 35 | |
| Размер матрицы | 128 х 128 | 128 х 128 | 128 х 128 | 128 х 128 | 128 х 128 |
| Разрешение (мм) | 0,225 х 0,225 | 0,281 х 0,281 | 0,281 х 0,281 | 0,273 х 0,273 | 0,273 х 0,273 |
| Номер среза | 20 | 20 | 20 | 3 | 2 |
| Толщина среза (мм) | 1 | 1 | 1 | 1.5 | 1.25 |
| # Средние значения | 3 | 1 | 1 | 1 | 1 |
| # Повторения | 1 | 1 | 1 | 9 | 9 или 300 |
| Время сканирования | 4 мин 0 с | 1 мин 12 с | 1 мин 12 с | 45 с | 25 мин |
Таблица 1: Параметры для захвата МРТ с соответствующими названиями последовательностей.
Дополнительный рисунок 1: Держатель мыши 3D-модели (белый) с внутренней резиновой подкладкой (красный). Размеры: длина = 43 мм, внешний радиус = 15 мм, внутренняя ширина = 20,7 мм. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 2: Температура (°C) контролируется во время лечения. Внутренняя температура измеряется ректальным (синим) и пищеводным (оранжевым) зондами. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл кодирования 1: файл 3D-печати для держателя мыши. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Разработанный здесь протокол был использован для нацеливания на опухоли задних конечностей с использованием MRgHIFU для лечения легкой ГТ и высвобождения инкапсулированных препаратов из липосом in vivo. Во время пилотного исследования в этом протоколе было обнаружено несколько критических шагов, и оптимизация этих критических шагов привела к улучшению успеха лечения по сравнению с пилотным исследованием. Во-первых, это полное удаление волос на участке, подлежащем обработке ультразвуком. Любое улавливание газа в мехе препятствует прохождению ультразвукового луча и блокирует прохождение ультразвука в ткань-мишень1. Во-вторых, позиционирование мыши жизненно важно для успешного лечения; Опухоль должна быть помещена в держатель мыши, чтобы быть в более тесном контакте с ультразвуковым датчиком. Кроме того, костные структуры должны быть расположены вне пути ультразвукового луча, не травмируя мышь. Было показано, что кость эффективно поглощает ультразвуковые волны, впоследствии действуя как источник тепла in situ . Это может повлиять на профиль нагрева, блокируя ультразвуковую трансдукцию в интересующую область4. Контралатеральная конечность также должна быть размещена в стороне от ультразвукового пути, либо подвернув ногу под остальную часть тела, либо вытянув ее и заполнив воздух между ногами ультразвуковым гелем или гелевой подушечкой. Прямая кишка также должна находиться вне пути ультразвука, чтобы избежать нецелевого нагрева и отражения от датчика температуры. Тщательное позиционирование опухоли является наиболее важным шагом к завершению успешного лечения.
После правильного позиционирования установка датчика температуры пищевода должна быть выполнена осторожно, чтобы избежать окклюзии трахеи. При введении мыши в отверстие МРТ металлический соединительный концентратор между катетером в хвосте и катетером инъекционного насоса должен быть закреплен лентой дистальнее области визуализации, чтобы избежать образования артефактов. Ультразвуковой датчик следует размещать так, чтобы он соприкасался с бесшерстной областью ноги и не смещал дыхательный монитор. Для выживания мыши требуется тщательный мониторинг внутренней температуры тела мыши во время лечения и последующая настройка системы конвекционного нагрева. Из-за близости прямой кишки и опухоли у некоторых мышей добавление пищеводного зонда было важно для определения изменения внутренней температуры, поскольку ректальная температура могла отражать только локальный нагрев, а не нагрев тела.
При разработке и внедрении этого протокола многопрофильная команда успешно выполнила обширное устранение неполадок. Для позиционирования мыши был разработан и напечатан на 3D-принтере держатель мыши для использования на салазках МРТ крысы, чтобы обеспечить поток нагретого воздуха вокруг мыши для внутрипроцедурной регулировки температуры тела. Материалы для этого держателя были выбраны на основе их способности надежно удерживать мышь, обеспечивая при этом ультразвуковую трансдукцию. Резиновая вставка внутри печатного держателя позволяла индивидуально настраивать мышь, в то время как вырез в нижней части предотвращал отражение ультразвуковых волн и непреднамеренный нагрев.
Существуют ограничения, связанные с моделью, такие как близость опухолей к близлежащим структурам - кости (бедренной кости) и прямой кишке, которые могут поглощать или отражать ультразвуковые волны соответственно. Непреднамеренное нагревание бедренной кости может привести к разрушению костного мозга и боли, в то время как отражение ультразвука от воздуха в прямой кишке может вызвать локальное нагревание и повреждение тканей. Кроме того, были случаи захвата ультразвуковой волны из-за отрастания кожи после лечения у выживших мышей, вызывая локализованное нагрев кожи. Предполагается, что это происходит из-за захвата воздуха вокруг волосяного фолликула, который не смещается ультразвуковым гелем между датчиком и кожей. В каждом случае кожа казалась темнее, чем окружающая безволосая кожа. На иммуногистохимических срезах этих конечностей мыши волосы были видны в эпидермисе, но не было найдено фиброза опухоли или другого объяснения, почему ультразвук не может пройти через кожу и подкожные ткани.
С развитием этого протокола планируются дальнейшие исследования по расширению модельных систем для тестирования других педиатрических солидных опухолей, таких как остеосаркома и миксофибросаркома, для лечения HT и TLD. Это многообещающе, поскольку эти пациенты могут столкнуться с изнурительной болью с ограниченными возможностями лечения в этом клиническом контексте. Этот протокол может быть распространен на другие типы солидных опухолей, расположенных в конечностях, на которые можно нацелиться с помощью MRgHIFU29,30. В заключение, данные подтверждают, что комбинация термочувствительных липосом может быть экстраполирована для инкапсуляции других форм химиотерапии или лекарств, где целевая доставка лекарств была бы полезной, а неинвазивная форма нагрева, такая как MRgHIFU, была бы идеальной.
Раскрытие информации
У авторов нет финансовых интересов или конфликтов интересов, которые необходимо раскрывать.
Благодарности
Мы хотели бы поблагодарить наши источники финансирования этого проекта и вовлеченный персонал, в том числе: исследовательский грант C17, стипендию для выпускников Канады, Целевой фонд возможностей для студентов Онтарио и Фонд Джеймса Дж.
Материалы
| Name | Company | Catalog Number | Comments |
| 1.5mL Eppendorf tubes | Eppendorf | 22363204 | |
| 1kb plus DNA Ladder | Froggabio | DM015-R500 | |
| 2x HS-Red Taq (PCR mix) | Wisent | 801-200-MM | |
| 7 Tesla MRI BioSpec | Bruker | T184931 | 70/30 BioSpec, Bruker, Ettlingen, Germany |
| C1000 Thermal cycler | Biorad | 1851148 | |
| Clippers | Whal Peanut | 8655 | |
| Compressed ultrasound gel | Aquaflex | HF54-004 | |
| Convection heating device | 3M Bair Hugger | 70200791401 | |
| Depiliatory cream | Nair | 61700222611 | Shopper's Drug Mart |
| DMEM | Wisent | 219-065-LK | |
| DNeasy extraction kit | Qiagen | 69504 | |
| DPBS | Wisent | 311-420-CL | |
| Drug injection system | Harvard Apparatus | PY2 70-2131 | PHD 22/2200 MRI compatible Syringe Pump |
| Eye lubricant | Optixcare | 50-218-8442 | |
| F10 Media | Wisent | 318-050-CL | |
| FBS | Wisent | 081-105 | |
| Froggarose | FroggaBio | A87 | |
| Gel Molecular Imager | BioRad | GelDocXR | |
| Glutamax | Wisent | 609-065-EL | |
| Heat Lamp | Morganville Scientific | HL0100 | Similar to this product |
| Intravascular Polyethylene tubing (0.015" ID x 0.043" OD, 20G) | SAI infusion | PE-20-100 | |
| Isoflurane | Sigma | 792632 | |
| M25FV24C Cell line | Gladdy Lab | N/A | |
| Microliter Syringe | Hamilton | 01-01-7648 | |
| Molecular Imager Gel Doc XR | Biorad | 170-8170 | |
| Mouse holder | The 3D printing material used was ABS-M30i, and it was printed on FDM Fortus 380mc machine | N/A | Dimensions: length = 43 mm, outer radius = 15 mm, inner width (where the mouse would sit) = 20.7 mm. |
| MyRun Machine | Cosmo Bio Co Ltd | CBJ-IMR-001-EX | |
| Nanodrop 8000 Spectrophotometer | Thermo Scientific | ND-8000-GL | |
| p53 primers | Eurofins | N/A | Custom Primers |
| PCR tubes | Diamed | SSI3131-06 | |
| Penicillin/Streptomycin | Wisent | 450-200-EL | |
| Proteus software | Pichardo lab | N/A | |
| Respiratory monitoring system | SAII | Model 1030 | MR-compatible monitoring and gating system for small animals |
| Small Bore HIFU device, LabFUS | Image Guided Therapy | N/A | LabFUS, Image Guided Therapy, Pessac, France Number of elements 8 frequency 2.5 MHz diameter 25 mm radius of curvature 20 mm Focal spot size 0.6 mm x 0.6 mm x 2.0 mm Motor: axes 2 Generator: Number of channels 8 Maximum electrical power/channel Wel 4 Maximum electrical power Wel 32 Bandwidth 0.5 - 5 MHz Control per channel: Freq., Phase and. amplitude Measurements per channel: Vrms, Irms, cos(theta) Duty Cycle at 100% power % 100% for 1 min. Transducer: Number of elements 8 frequency 2.5 MHz diameter 25 mm radius of curvature 20 mm Focal spot size 0.6 mm x 0.6 mm x 2.0 mm |
| SYBR Safe | ThermoFisher Scientific | S33102 | |
| TAE | Wisent | 811-540-FL | |
| Tail vein catheter (27G 0.5" ) | Terumo Medical Corp | 15253 | |
| Thermal probes | Rugged Monitoring | L201-08 | |
| Trypan blue | ThermoFisher Scientific | 15250061 | |
| Trypsin | Wisent | 325-052-EL | |
| Ultrasound Gel | Aquasonic | PLI 01-08 |
Ссылки
- Skapek, S. X., et al. Rhabdomyosarcoma. Nature Reviews Disease Primers. 5 (1), (2019).
- Ferrari, A., et al. Impact of rhabdomyosarcoma treatment modalities by age in a population-based setting. Journal of Adolescent and Young Adult Oncology. 10 (3), 309-315 (2021).
- . Pediatric rhabdomyosarcoma surgery: Background, anatomy, pathophysiology Available from: https://emedicine.medscape.com/article/939156-overview#a2 (2019)
- Ognjanovic, S., Linabery, A. M., Charbonneau, B., Ross, J. A. Trends in childhood rhabdomyosarcoma incidence and survival in the United States, 1975-2005. Cancer. 115 (18), 4218-4226 (2009).
- Mulrooney, D. A., et al. Cardiac outcomes in a cohort of adult survivors of childhood and adolescent cancer: retrospective analysis of the Childhood Cancer Survivor Study cohort. BMJ. 339, (2009).
- Lipshultz, S. E., Cochran, T. R., Franco, V. I., Miller, T. L. Treatment-related cardiotoxicity in survivors of childhood cancer. Nature Reviews Clinical Oncology. 10 (12), 697-710 (2013).
- Winter, S., Fasola, S., Brisse, H., Mosseri, V., Orbach, D. Relapse after localized rhabdomyosarcoma: Evaluation of the efficacy of second-line chemotherapy. Pediatric Blood & Cancer. 62 (11), 1935-1941 (2015).
- Wood, B. J., et al. Phase I study of heat-deployed liposomal doxorubicin during radiofrequency ablation for hepatic malignancies. Journal of Vascular and Interventional Radiology. 23 (2), 248-255 (2012).
- Bulbake, U., Doppalapudi, S., Kommineni, N., Khan, W. Liposomal formulations in clinical use: an updated review. Pharmaceutics. 9 (2), 12 (2017).
- Zagar, T. M., et al. Two phase I dose-escalation/pharmacokinetics studies of low temperature liposomal doxorubicin (LTLD) and mild local hyperthermia in heavily pretreated patients with local regionally recurrent breast cancer. International Journal of Hyperthermia. 30 (5), 285-294 (2014).
- . A phase I study of lyso-thermosensitive liposomal doxorubicin and MR-HIFU for pediatric refractory solid tumors Available from: https://clinicaltrials.gov/ct2/show/NCT02536183 (2019)
- PanDox: targeted doxorubicin in pancreatic tumours (PanDox). University of Oxford Available from: https://clinicaltrials.gov/ct2/show/NCT04852367 (2021)
- . Image-guided targeted doxorubicin delivery with hyperthermia to optimize loco-regional control in breast cancer (i-GO) Available from: https://clinicaltrials.gov/ct2/show/NCT03749850 (2018)
- De Vita, A., et al. Lysyl oxidase engineered lipid nanovesicles for the treatment of triple negative breast cancer. Scientific Reports. 11 (1), 5107 (2021).
- Sapareto, S. A., Dewey, W. C. Thermal dose determination in cancer therapy. International Journal of Radiation Oncology, Biology, Physics. 10 (6), 787-800 (1984).
- Kok, H. P., et al. Heating technology for malignant tumors: a review. International Journal of Hyperthermia. 37 (1), 711-741 (2020).
- Kokuryo, D., Kumamoto, E., Kuroda, K. Recent technological advancements in thermometry. Advanced Drug Delivery Reviews. 163, 19-39 (2020).
- Bongiovanni, A., et al. 3-T magnetic resonance-guided high-intensity focused ultrasound (3 T-MR-HIFU) for the treatment of pain from bone metastases of solid tumors. Support Care Cancer. 30 (7), 5737-5745 (2022).
- Seifert, G., et al. Regional hyperthermia combined with chemotherapy in paediatric, adolescent and young adult patients: current and future perspectives. Radiation Oncology. 11, 65 (2016).
- Dewhirst, M. W., Lee, C. -. T., Ashcraft, K. A. The future of biology in driving the field of hyperthermia. International Journal of Hyperthermia. 32 (1), 4-13 (2016).
- Dewhirst, M. W., Vujaskovic, Z., Jones, E., Thrall, D. Re-setting the biologic rationale for thermal therapy. International Journal of Hyperthermia. 21 (8), 779-790 (2005).
- Repasky, E. A., Evans, S. S., Dewhirst, M. W. Temperature matters! And why it should matter to tumor immunologists. Cancer Immunology Research. 1 (4), 210-216 (2013).
- Hijnen, N., et al. Thermal combination therapies for local drug delivery by magnetic resonance-guided high-intensity focused ultrasound. Proceedings of the National Academy of Sciences. 114 (24), E4802-E4811 (2017).
- Shultz, L. D., et al. Human cancer growth and therapy in immunodeficient mouse models. Cold Spring Harbor Protocols. 2014 (7), 694-708 (2014).
- De Vita, A., et al. Deciphering the genomic landscape and pharmacological profile of uncommon entities of adult rhabdomyosarcomas. International Journal of Molecular Sciences. 22 (21), 11564 (2021).
- McKinnon, T., et al. Functional screening of FGFR4-driven tumorigenesis identifies PI3K/mTOR inhibition as a therapeutic strategy in rhabdomyosarcoma. Oncogene. 37 (20), 2630-2644 (2018).
- Zaporzan, B., et al. MatMRI and MatHIFU: software toolboxes for real-time monitoring and control of MR-guided HIFU. Journal of Therapeutic Ultrasound. 1, (2013).
- Dunne, M., et al. Heat-activated drug delivery increases tumor accumulation of synergistic chemotherapies. Journal of Controlled Release. 308, 197-208 (2019).
- Zhao, Y. X., Hu, X. Y., Zhong, X., Shen, H., Yuan, Y. High-intensity focused ultrasound treatment as an alternative regimen for myxofibrosarcoma. Dermatologic Therapy. 34 (2), 14816 (2021).
- Vanni, S., et al. Myxofibrosarcoma landscape: diagnostic pitfalls, clinical management and future perspectives. Therapeutic Advances in Medical Oncology. 14, 17588359221093973 (2022).
Erratum
Formal Correction: Erratum: Magnetic Resonance-Guided High Intensity Focused Ultrasound Generated Hyperthermia: A Feasible Treatment Method in a Murine Rhabdomyosarcoma Model
Posted by JoVE Editors on 2/08/2023. Citeable Link.
An erratum was issued for: Magnetic Resonance-Guided High Intensity Focused Ultrasound Generated Hyperthermia: A Feasible Treatment Method in a Murine Rhabdomyosarcoma Model . The Authors section was updated from:
Claire Wunker1,2
Karolina Piorkowska3
Ben Keunen3
Yael Babichev2
Suzanne M. Wong3,4
Maximilian Regenold5
Michael Dunne5
Julia Nomikos1,2
Maryam Siddiqui6
Samuel Pichardo6
Warren Foltz7
Adam C. Waspe3,8
Justin T. Gerstle3,9
Rebecca A. Gladdy1,2,10
1 Institute of Medical Science, University of Toronto
2 2Lunenfeld-Tanenbaum Research Institute, Mount Sinai Hospital
3 The Wilfred and Joyce Posluns Centre for Image-Guided Innovation and Therapeutic Intervention, The Hospital for Sick Children
4 Institute of Biomedical Engineering, University of Toronto
5 Leslie Dan Faculty of Pharmacy, University of Toronto
6 Departments of Radiology and Clinical Neurosciences, University of Calgary
7 Department of Radiation Oncology, University of Toronto
8 Department of Medical Imaging, University of Toronto
9 Department of Pediatric Surgery, University of Toronto
10 Department of Surgery, University of Toronto
to:
Claire Wunker1,2
Karolina Piorkowska3
Ben Keunen3
Yael Babichev2
Suzanne M. Wong3,4
Maximilian Regenold5
Michael Dunne5
Julia Nomikos1,2
Maryam Siddiqui6
Samuel Pichardo6
Warren Foltz7
Adam C. Waspe3,8
Justin T. Gerstle3,9
James M. Drake1,3,4,10
Rebecca A. Gladdy1,2,10
1 Institute of Medical Science, University of Toronto
2 Lunenfeld-Tanenbaum Research Institute, Mount Sinai Hospital
3 The Wilfred and Joyce Posluns Centre for Image-Guided Innovation and Therapeutic Intervention, The Hospital for Sick Children
4 Institute of Biomedical Engineering, University of Toronto
5 Leslie Dan Faculty of Pharmacy, University of Toronto
6 Departments of Radiology and Clinical Neurosciences, University of Calgary
7 Department of Radiation Oncology, University of Toronto
8 Department of Medical Imaging, University of Toronto
9 Department of Pediatric Surgery, University of Toronto
10 Department of Surgery, University of Toronto
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены