Method Article
Retina Dokusunda İmmün Boyalı Kaspaz-9'un Miktarının Belirlenmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, kompleks dokulardaki fonksiyonel olarak ilgili kaspazları tanımlamak, doğrulamak ve hedeflemek için ayrıntılı bir immünohistokimya protokolü sunulmaktadır.
Özet
Kaspaz ailesinin, hücre farklılaşması, aksonal yol bulma ve proliferasyon dahil olmak üzere hücre ölümünün ötesinde birçok hücresel yola aracılık ettiği bilinmektedir. Hücre ölümü proteazları ailesinin tanımlanmasından bu yana, gelişim, sağlık ve hastalık durumlarında belirli aile üyelerinin işlevini tanımlamak ve genişletmek için araçlar araştırılmıştır. Bununla birlikte, şu anda yaygın olarak kullanılan ticari olarak temin edilebilen kaspaz araçlarının çoğu, hedeflenen kaspaz için spesifik değildir. Bu yazıda, sinir sistemindeki kaspaz-9'u tanımlamak, doğrulamak ve hedeflemek için kullandığımız yaklaşımı, immünohistokimyasal okumalarla yeni bir inhibitör ve genetik yaklaşımlar kullanarak tanımladık. Spesifik olarak, retinal nöronal dokuyu kaspazların varlığını ve işlevini tanımlamak ve doğrulamak için bir model olarak kullandık. Bu yaklaşım, hücre tipine özgü apoptotik ve apoptotik olmayan kaspaz-9 fonksiyonlarının sorgulanmasını sağlar ve ilgilenilen diğer karmaşık dokulara ve kaspazlara uygulanabilir. Kaspazların fonksiyonlarını anlamak, hücre biyolojisindeki mevcut bilgilerin genişletilmesine yardımcı olabilir ve ayrıca hastalığa katılımları nedeniyle potansiyel terapötik hedefleri tanımlamak için avantajlı olabilir.
Giriş
Kaspazlar, hastalık 1,2'de gelişimsel hücre ölümünü, immün yanıtları ve anormal hücre ölümünü düzenleyen bir proteaz ailesidir. Kaspaz ailesinin üyelerinin çeşitli nörodejeneratif hastalıklarda indüklendiği iyi bilinmekle birlikte, hangi kaspazın hastalık patolojisini yönlendirdiğini anlamak daha zordur3. Bu tür çalışmalar, bireysel kaspaz ailesi üyelerinin işlevini tanımlamak, karakterize etmek ve doğrulamak için araçlar gerektirir. İlgili bireysel kaspazların ayrıştırılması hem mekanik hem de terapötik açıdan önemlidir, çünkü literatürde kaspazların farklı rollerine dair kanıtlar sağlayan çok sayıda çalışma vardır 4,5. Bu nedenle, amaç terapötik bir fayda için bir hastalıkta bir kaspazı hedeflemekse, ilgili aile üyelerinin spesifik olarak hedeflenmesi kritik öneme sahiptir. Dokudaki kaspaz düzeylerini saptamak için kullanılan geleneksel teknikler arasında batı lekelenmesi ve enzimatik ve florometrik yaklaşımlaryer almaktadır 3,6. Bununla birlikte, bu önlemlerin hiçbiri kaspaz seviyelerinin hücreye özgü tespitine izin vermez ve bazı senaryolarda, parçalanmış kaspazlar genellikle geleneksel protein analizi önlemleri ile tespit edilemez. Kaspazların aynı dokuda farklı apoptotik ve apoptotik olmayan roller oynayabileceği bilinmektedir7, bu nedenle gelişimsel ve hastalık yolaklarının doğru anlaşılması için hücreye özgü kaspaz düzeylerinin dikkatli bir şekilde karakterize edilmesi gerekmektedir.
Bu çalışmada nörovasküler hipoksi-iskemi - retinal ven tıkanıklığı (RVO)7,8 modelinde kaspaz aktivasyonu ve fonksiyonu gösterilmiştir. Retina gibi karmaşık bir dokuda, glial hücreler, nöronlar ve vaskülatür7 dahil olmak üzere RVO'da indüklenen hipoksi-iskemiden etkilenebilecek birden fazla hücre tipi vardır. Yetişkin fare retinasında, immünohistokimya (IHC)7 ile ölçüldüğü gibi, sağlıklı dokuda belirgin olan çok az kaspaz ekspresyonu vardır, ancak gelişim9 sırasında veya retina hastalığı10,11 modellerinde durum böyle değildir. IHC, biyomedikal araştırmalarda iyi kurulmuş ve hastalık ve patolojik hedeflerin doğrulanmasına, mekansal lokalizasyon yoluyla yeni rollerin tanımlanmasına ve proteinlerin nicelleştirilmesine izin veren bir tekniktir. Parçalanmış kaspaz ürünlerinin batı lekesi veya florometrik analiz ile tespit edilemediği durumlarda, farklı kaspazların spesifik hücre lokalizasyonu veya lokalizasyon yoluyla kaspaz sinyal yollarının sorgulanması durumunda, IHC kullanılmalıdır.
RVO'da fonksiyonel olarak ilişkili kaspaz (lar) ı belirlemek için, IHC, kaspazlar ve hücresel belirteçler için doğrulanmış antikorlarla birlikte kullanıldı. Laboratuvarda yapılan önceki çalışmalar, kaspaz-9'un bir iskemik inme modelinde ve nöronal disfonksiyon ve ölümden korunan oldukça spesifik bir inhibitör ile kaspaz-9'un inhibisyonunda hızla aktive olduğunu göstermiştir12. Retina, merkezi sinir sisteminin (CNS) bir parçası olduğundan, nörovasküler yaralanmalarda kaspaz-9'un rolünü sorgulamak ve daha fazla araştırmak için bir model sistem olarak hizmet eder13. Bu amaçla, RVO'nun fare modeli, kaspaz-9'un hücreye özgü yerini ve dağılımını ve nörovasküler hasardaki etkisini incelemek için kullanıldı. RVO, çalışan yaşlı erişkinlerde vasküler yaralanmadan kaynaklanan körlüğün yaygın bir nedenidir14. Kaspaz-9'un endotel hücrelerinde apoptotik olmayan bir şekilde eksprese edildiği, ancak nöronlarda eksprese edilmediği bulundu.
Bir doku olarak, retina, vasküler ağların takdir edilmesini sağlayan düz bir montaj veya nöronal retinal tabakaları vurgulayan kesitler olarak görselleştirilme avantajına sahiptir. Enine kesitlerde kaspaz proteini ekspresyonunun nicelleştirilmesi, retinadaki kaspaz (lar) ın lokalizasyonunu tanımlayarak retinal nöronal bağlantı ve görme fonksiyonunda hangi kaspazın potansiyel olarak kritik olduğu konusunda bağlam sağlar. Tanımlama ve validasyondan sonra, tanımlanan kaspazın indüklenebilir hücreye özgü delesyonu kullanılarak ilgilenilen kaspazın hedeflenmesi sağlanır. Potansiyel terapötik sorular için, aktif kaspazı inhibe etmek için özel araçlar kullanılarak ilgilenilen kaspazların alaka düzeyi test edildi. Kaspaz-9 için yüksek seçici inhibitör 7,15 pervane edilen bir hücre, Pen1-XBIR3 kullanıldı. Bu yazıda 2 aylık erkek C57BL/6J suşu ve C57BL/6J arka planlı tamoksifen kaynaklı endotelyal kaspaz-9 nakavt (iEC Casp9KO) suşu kullanıldı. Bu hayvanlar RVO'nun fare modeline maruz bırakıldı ve C57BL / 6J, kaspaz-9 seçici inhibitörü Pen1-XBir3 ile tedavi edildi. Tanımlanan metodoloji, merkezi ve periferik sistemlerdeki diğer hastalık modellerine uygulanabilir 7,15.
Protokol
Bu protokol, Görme ve Oftalmoloji Araştırmaları Derneği'nin (ARVO) oftalmik ve görme araştırmalarında hayvanların kullanımı için yaptığı açıklamayı takip eder. Kemirgen deneyleri, Columbia Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) tarafından onaylanmış ve izlenmiştir.
1. Retina dokusunun hazırlanması ve kriyoseksiyon
- İntraperitoneal anestezi (ketamin (80-100 mg / kg) ve ksilazin (5-10 mg / kg)) uygulayarak hayvanları ötenazi yapın ve RVO'ya maruz kalan fareleri (ayrıntılar için bkz.8 ) peristaltik bir pompa kullanarak% 4 paraformaldehit (PFA) ile perfüze edin.
NOT: Ötanizasyon ve perfüzyona geçmeden önce anestezi derinliğini doğrulamak için hayvanı parmağınızla sıkıştırın. Perfüzyon ile ilgili detaylar16 maddede bulunabilir. - Forseps kullanarak dikkatli bir enükleasyon ile gözleri toplayın ve dünyayı 1 mL% 4 PFA'ya koyun. Gözleri gece boyunca 4 ° C'de bırakın. Gözleri 10 dakika boyunca üç kez yıkayın, 1 mL 1x PBS ekleyin ve çalkalayıcıya yerleştirin.
- Gözleri, sakarozun emilimini gösteren tüpün dibine yerleşene kadar 3 gün boyunca% 30 sakarozun 1 mL'sine batırın.
- Göz yuvarlak bir görünüme (yaklaşık 50 μL) sahip olana kadar gözleri 30 G'lık bir şırınga kullanarak optimum kesme sıcaklığı bileşiği ile doldurun.
- Gözler kapatılana kadar gözleri optimum kesme sıcaklığı bileşiğine sahip bir kriyomolda gömün ve kriyoskopiye hazır olana kadar -80 ° C'de dondurun.
- Bölüm, gözleri 20 μm'de bir kriyostat kullanarak cam slaytlara gömdü.
- Optimum kesme sıcaklığı bileşik bloğunu kriyomolddan çıkarın.
- Optimum kesme sıcaklığı bileşiği ekleyerek ve bloğu mandren üzerine yerleştirerek kriyostat mandren üzerine yerleştirin. Donana kadar kriyostatın içinde bırakın.
- Retina dokusu görülene kadar bloğu 20 μm'de kesmeye devam edin.
NOT: Bu, 30x büyütmede (3x objektif, 10x göz merceği) bir ışık mikroskobu ile doğrulanabilir. Dokular OCT ortamından renk ve şekil ile ayırt edilebilir. - Retina dokusunu mikroskop slaytlarında slayt başına dört bölümden oluşan bir dizi halinde toplayın.
NOT: Retina kesitlerinin yerleştirilmesi önerisi için Şekil 1A'ya bakınız.
- Slaytları, tedaviyi ve genotipi kimliksizleştiren bir kimlikle etiketleyin.
- Kızakları lekelenene kadar -20 °C'de saklayın.
2. İmmünohistokimya
NOT: Hücre morfolojisini korumak için immünohistokimya için sabit kriyokorunmuş doku kullanın. İn vivo7 elde edilen optik koherens tomografi (OCT) görüntüleri düzeyinde olan bölümleri seçin. Kriyostattan toplanan ilk iki slayt serisini veya retina dokusuna 150 μm'den kesitleri kullanın.
- Slaytları karanlık ve nemli bir slayt odasına yerleştirin.
- Geçirgenlik ve blokaj: OCT'yi çıkarmak ve daha sonra atmak için retina kesitlerini 300 μL 1x PBS ile 5 dakika boyunca yıkayın.
- Oda sıcaklığında (RT) 2 saat boyunca% 0.1 Triton X-100 ile 300 μL 1x PBS ekleyerek dokuyu geçirgenleştirin ve daha sonra atın.
- 300 μL bloke edici tampon (% 10 Normal Keçi Serumu (NGS),% 1 Sığır Serumu Albümini (BSA) 1x PBS'de, filtrelenmiş) ekleyerek dokuyu bloke edin ve gece boyunca 4 ° C'de bırakın.
- Primer antikorlar: Bloke edici tampondaki primer antikorları seyreltin. Kullanılan birincil antikorlar arasında 1:800'de anti-cl-kaspaz-9, 1:50'de anti-CD31 ve 1:150'de anti-kaspaz-7-488 (doğrudan etiketli antikor) bulunur.
NOT: Birincil antikorların uygun şekilde seyreltilmesi için üreticinin tavsiyesine uyun.- Bloke edici tamponu kesitlerden dökün ve retinal slaytlara 100 μL birincil antikor kokteyli uygulayın.
- Enine kesitleri gece boyunca 4 ° C'de inkübe edin.
- Bölümleri 300 μL 1x PBS ile 5 dakika boyunca dört kez yıkayın.
NOT: Doku kesitleri çok kırılgansa, retina bölümlerinin yer değiştirmesini önlemek için slaytın köşesine bir doku uygulanarak kılcal etki kullanılarak yıkamalar çıkarılmalıdır. - Aynı konakçı türde yetiştirilen primer antikorların çapraz etiketlenmesini önlemek için, doğrudan etiketlenmiş antikorları uygulamadan önce boyamayı ikincil antikorlarla tamamlayın.
- İkincil antikorlar: İkincil antikorları bloke edici tamponda% 0.1'lik bir konsantrasyonda seyreltin. Örneğin, tavşanda yetiştirilen bir antikor olan anti-cl-caspaz-9'u tespit etmek için keçi-anti-tavşan-568 ikincil kullanın.
- Sekonder antikor kokteylinin 200 μL'sini retinalara uygulayın.
- RT'de dokuyu 2 saat boyunca inkübe edin.
- Bölümleri 300 μL 1x PBS ile 5 dakika boyunca dört kez yıkayın.
- Çekirdekleri% 0.02'lik bir seyreltmede 300 μL DAPI ile 5 dakika boyunca sabitleyin.
- 300 μL 1x PBS ile 5 dakika boyunca bir kez yıkayın.
- Floresan sinyalini koruyan 500 μL floromount-G ortamı kullanarak retinal bölümlere bir kapak kayması yerleştirin ve kapak kaymasını dikkatlice slaytın üstüne yerleştirerek kabarcıkları önleyin.
3. Konfokal görüntüleme
- Konfokal mikroskopi ile lekeli kesitlerin görüntülerini elde edin.
- Konfokal mikroskobu açın.
- Slaytı sahne alanına yerleştirin.
- Retina bölümünü net bir şekilde görmek için odağı ayarlayın.
NOT: Bölüm başına en az dört görüntü ve retina başına dört bölüm görüntü alın. Önerilen görüntüleme alanları için Retinal görüntüleme şemasına bakın (Şekil 1B, C).
- 20x veya 40x hedefi kullanarak, Z-yığını edinimine sahip konfokal bir mikroskop kullanarak görüntü kaspazı, vasküler ve nükleer boyama.
NOT: Görüntüleme parametreleri ve yazılım kurulumu, bir deneydeki tüm görüntüleme için sabit olmalıdır. 20x hedefi, nükleer boyama ile iyi tanımlanmış retina tabakalarına genel bir bakış sağlar. 40x hedefi daha fazla hücresel ayrıntı sağlar.- Alma ayarlarını tıklayarak kanal başına uygun pozlama ve lazer yoğunluğu sürelerini ayarlayın.
- Z serisine tıklayarak tüm bölümü görselleştirmek için Z yığınını ayarlayın ve dokunun derinliğini kapsayacak şekilde parametreleri yukarı ve aşağı ayarlayın.
- Kriyoseksiyon sırasında atanan maskeli kimliği takip eden görüntüleri kaydedin.
4. Kaspaz seviyelerinin ölçülmesi
- 405, 470, 555 ve 640 kanallı görüntü dosyalarını FIJI'nin konsoluna sürükleyin.
- Image (Görüntüyü > Renk > Kanalları Birleştir) seçeneğini tıklatın.
- Dosyalara renkleri aşağıdaki gibi atayın: kırmızıdan 555'e, yeşilden 470'e, griden 405'e, camgöbeği 640'a.
- Image > Stack > Z Project'i tıklatarak Z-yığınını sıkıştırın.
- Projeksiyon Türü: Maksimum Yoğunluk'a tıklayın.
- Image > Color Channels Tool (Renkli Kanallar Aracı) seçeneğini tıklatarak Channels Interface'i açın.
- Parlaklık ve Kontrast arayüzünü açın.
- Kanal başına parametre seçin.
- Kanallar'a gidin ve bir kanal seçin.
- İmleci kaspaz ifade edilen hücrenin üzerine getirin ve piksel değerine açıklama ekleyin.
- İmleci arka planın üzerine getirin ve piksel değerine açıklama ekleyin.
- Test parametreleri
- Parlaklık ve Kontrast arayüzüne gidin.
- Seç'i tıklayın.
- Görüntülenen minimum değeri takın (kaspaz ifade edilen hücrenin açıklamalı piksel değeri).
- Görüntülenen maksimum değeri (arka planın açıklamalı piksel değeri) takın.
- Tamam'ı tıklatın.
- Tüm kanallar için 4.8-4.9 arasındaki adımları yineleyin.
- Kör dokudan rastgele görüntüler seçerek parametreleri test edin.
NOT: Parlaklık ve kontrast parametrelerini yalnızca arka plan değeri diğer görüntüler için yeterli değilse düzenleyin. - Parametreler ayarlandıktan sonra, görüntü dosyalarını açın ve Z-yığınını sıkıştırın.
- Kaspaz kanalı ve izolektin, vasküler belirteç kanalı için parlaklık ve kontrast parametrelerini ekleyin.
- Pozitif alanların okunması olarak vasküler belirtecin kaspaz ekspresyonu ile kolokalizasyonunu kullanarak vasküler pozitif alanların sayısını ölçmek için nokta aracını kullanın.
- Adım 4.14'ü tekrarlayın, ancak Hoechst'i nöronal pozitif alanların belirteci olarak kullanın.
- Resim başına bir e-tablodaki değerlere açıklama ekleyin.
- Değerlerin bölüme göre ortalaması.
- Bölüm değerlerinin ortalaması - bu göz başına okuma olacaktır.
5. Endotel hücre kaspazı-9'un alaka düzeyinin genetik olarak doğrulanması
- RVO7'ye maruz kalan Casp9FL / FL-VECad-CreERT2 farelerinden elde edilen retinaları kullanın.
- Yukarıda bölüm 2'de açıklandığı gibi kaspaz-9 (silinmiş kaspaz), kaspaz-7 (aşağı akış efektörü kaspaz), vasküler belirteçler ve DAPI için retinaları immünoboyar.
- Yukarıda bölüm 3 ve 4'te açıklandığı gibi görüntü ve nicelik.
6. RVO'da kaspaz-9'un hedeflenmesi
- RVO'ya tabi tutulan farelerden gözler elde edin, ardından kaspaz-9 inhibitörü Pen1-XBir3'ün7'de olduğu gibi topikal olarak gözlere uygulanması.
- Yukarıda bölüm 2'de açıklandığı gibi kaspaz-7 (aşağı akış efektör kaspaz), vasküler belirteçler ve DAPI için retinaları immünoboyar.
- Yukarıda bölüm 3 ve 4'te açıklandığı gibi görüntü ve nicelik.
Sonuçlar
Tanımlanan protokol, kullanıcının retina dokusundaki kaspaz-9 seviyelerini analiz etmesini ve ölçmesini sağlar. Ek olarak, kaspaz-9 ve aşağı akış substratlarını daha fazla tanımlamak, doğrulamak ve özellikle hedeflemek için araçlar sunar. Özetlenen adımlar, floresan fotomikrograflarda kaspaz seviyelerinin ve hücresel özgüllüğün ölçülebilir analizini sağlar. Tüm rakamlar, yaralanmamış ve 1 günlük P-RVO retina kesitlerinde toplam retina, endotel hücreleri ve nöronlarda belirtilen kaspaz seviyelerinin temsili fotomikrograflarını ve miktarını göstermektedir. Retinal kesit, Hoechst ile boyandığında retinal ganglion tabakasında (RGL), iç nükleer tabakada (INL) ve dış nükleer tabakada (ONL) retina çekirdeklerinin görüntülenmesini sağlar. Ek olarak, retinal kan damarları retinal pleksiform tabakalarda veya RGL ve INL arasında ve INL ile ONL arasında görülebilir. Kan damarlarının histolojik doğası nedeniyle, retina kesitlendiğinde, kan damarları pleksiform tabakaları besleyen bağlantısız ve ayrı olarak görünecektir. Şekil 2 , kaspaz-9'u yüksek oranda düzenlenmiş 1 günlük P-RVO olarak tanımlamaktadır. Şekil 3 , indüklenebilir endotel hücre nakavt farelerini kullanarak endotel kaspaz-9'un fonksiyonel uygunluğunu doğrulamaktadır. Şekil 4 , aktif kaspaz-9'un hedeflenmesinin farmakolojik olarak kaspaz-9-kaspaz-7'nin aşağı akış hedefinin indüksiyonunu engellediğini göstermektedir. Protokol, kaspazların hücresel lokalizasyonunu ve kaspazların eksprese edildiği nöronal retinal tabakaları tanımlar.

Şekil 1: Retinal görüntüleme şeması . (A) Retina kesitlerinin mikroskop slaydına yerleştirilmesi önerilir. (B) Retinadaki görüntüleme alanlarına genel bakış. (C) Retinal görünümün 20x hedefte gösterilmesi. Retinal tabakalar: RGL = retinal ganglion tabakası, INL = iç nükleer tabaka, ONL = dış nükleer tabaka. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
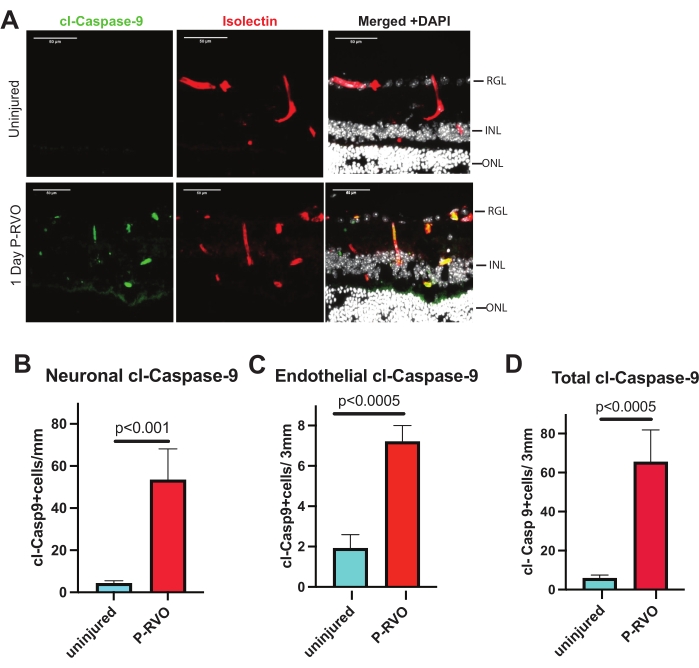
Şekil 2: RVO, endotel hücrelerinde ve nöronlarda kaspaz-9'u indükler. (A) Cl-caspase-9 1:800 (yeşil), izolektin 1:200 (kırmızı) ve DAPI (beyaz) ile boyanmış yaralanmamış ve 1 günlük P-RVO'dan temsili retinal kesitler. (B) Cl-kaspaz-9'lu nöronların sayısının ölçülmesi (antikorlar hakkında ayrıntılar için Malzeme Tablosuna bakınız). (C) Cl-kaspaz-9 ile endotel hücrelerinin sayısının miktarının belirlenmesi. (D) Cl-kaspaz-9'u eksprese eden toplam hücre sayısı. Yaralanmamış, n = 6; 1 günlük P-RVO, n = 5. Hata çubukları SEM'± ortalamasını temsil eder; Tek yönlü ANOVA, Fisher'ın LSD testi. Ölçek çubuğu = 50 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
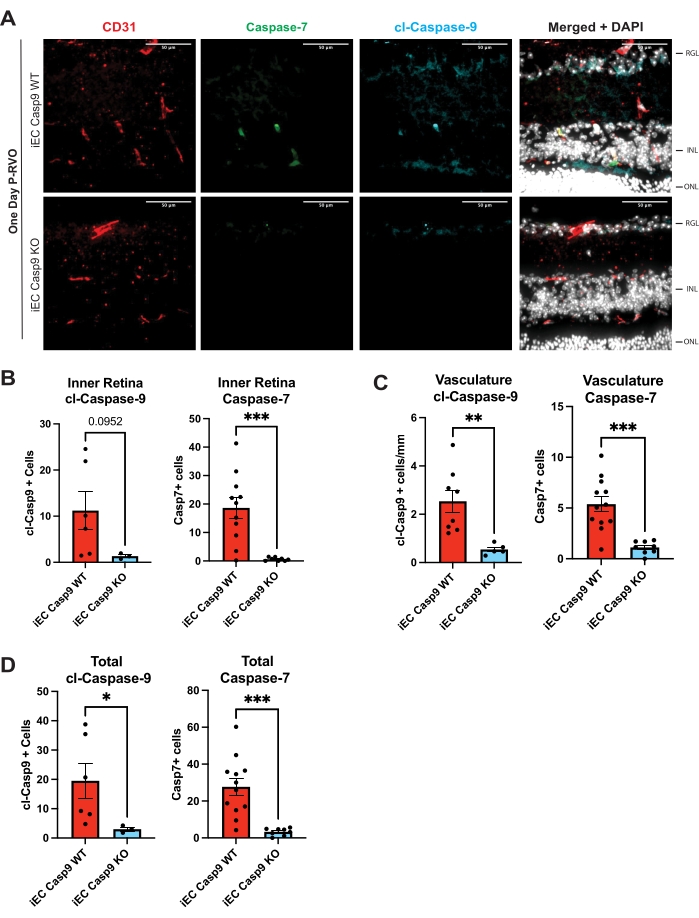
Şekil 3: Endotel kaspaz-9'un endotel hücre delesyonu, kaspaz-7'nin RVO-indüksiyonunu bloke eder. (A) Kaspaz-7 (yeşil), cl-kaspaz-9 (mavi), CD31, vasküler belirteç (kırmızı) ve DAPI (beyaz) ile boyanmış 1 günlük P-RVO 1 günlük P-RVO çöp arkadaşı farelerden temsili retinal kesitler. (B) İç retinadaki hücre sayısının cl-caspaz-9 ve caspaz-7 ile ölçülmesi. (C) Cl-kaspaz-9 ve kaspaz-7 ile endotel hücrelerinin sayısının miktarının ölçülmesi. (D) Cl-kaspaz-9 veya kaspaz-7 eksprese eden toplam hücre sayısı. iEC Casp9WT, n = 6-12; iEC Casp9KO, n = 3-8. Hata çubukları SEM'± ortalamasını temsil eder; Tek yönlü ANOVA, Fisher'ın LSD testi. Ölçek çubuğu = 50 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 4: Kaspaz-9 aktivitesinin inhibisyonu kaspaz-7 ekspresyonu P-RVO'yu inhibe eder. (A) Kaspaz-7 (yeşil), izolektin (kırmızı) ve DAPI (beyaz) ile boyanmış Pen1-XBIR3 ile tedavi edilen veya edilmeyen yaralanmamış ve 1 günlük P-RVO'dan temsili retinal kesitler. (B) Kaspaz-7 ile endotel hücrelerinin sayısının ölçülmesi. (C) Kaspaz-7 ile lökosit sayısının miktarının ölçülmesi. (D) Kaspaz-7 ile nöronal tabaka başına düşen nöron sayısının miktarı. (E) Kaspaz-7 eksprese eden toplam hücre sayısı. Yaralanmamış Pen1 Salin, n = 6; yaralanmamış Pen1-XBIR3, n = 5; 1 günlük P-RVO Pen1 Salin, n = 5; 1 günlük P-RVO Pen1-XBIR3, n = 3. Hata çubukları SEM'± ortalamasını temsil eder; Tek yönlü ANOVA, Fisher'ın LSD testi. Kısaltmalar: RGL = retinal ganglion tabakası, INL = iç nükleer tabaka ve ONL = dış nükleer tabaka. Ölçek çubuğu = 50 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Kaspazlar, hücre ölümü ve inflamasyondaki rolleri için en iyi şekilde çalışılan çok üyeli bir proteaz ailesidir; Bununla birlikte, daha yakın zamanlarda, bazı aile üyeleri için çeşitli ölüm dışı işlevler ortaya çıkarılmıştır 4,5. Kaspaz fonksiyonu hakkındaki anlayışımızın çoğu, hücre kültüründeki çalışmalardan ve insan hastalığından elde edilen çıkarımsal verilerden kaynaklanmaktadır. Hastalıkta kaspazların anormal indüksiyonu, aktivasyonu veya inaktivasyonu olduğu takdir edilmekle birlikte, kaspazların hastalık patolojisine neden olup olmadığını fonksiyonel olarak belirlemek zor olmuştur. Belirli kaspazları değerlendirmek için kullanılan birçok araç, birden fazla aile üyesini tespit eder ve bu reaktiflerle elde edilen verilerin fonksiyonel uygunluğunu zayıflatır17. Burada, retinayı örnek olarak kullanarak karmaşık dokudaki kaspazları incelemek için bir protokol sunuyoruz. Sinir sisteminde, kaspaz ekspresyonu doğum öncesi ve sonrası aşağı regüle edilir. Bu, bir hastalık modelinde kaspaz seviyelerindeki değişiklikleri test etmek için spesifik antikorların kullanılmasına izin verir.
Protokolün odak noktası görüntü işleme ve analiz olsa da, tekniğin başarısı aynı zamanda verilerin tutarlılığını, geçerliliğini ve güvenilirliğini sağlamak için dikkatli doku hazırlığının yanı sıra IHC ve mikroskobik görüntülemeye de dayanmaktadır. Tüm veri kümesini görüntülemek için aynı parametreleri kullanmaya özen gösterilmelidir. Düşük kaliteli görüntüler, düşük kontrast ve bulanık odaklama güvenilir veriler sağlamaz. Retinanın P-RVO bölgelerini kesitlerken ve görüntülerken, yırtılmalardan ve katlanmalardan kaçınılmalıdır, çünkü bu alanlar artefaktlara neden olabilir. Doğrudan hasar gören alanlardan da kaçınılmalıdır. Görüntülemeyi yapan araştırmacının dokunun tedavisine kör olması gerekir. Analiz için, tedavi grubuna kör olmuş iki bağımsız gözlemcinin analizi yapması önerilir. Ek olarak, birincil fare antikorları fare yaralanması modellerinde kullanılmamalıdır, çünkü ikincil antikorlar vaskülatüre spesifik olmayan bir şekilde bağlanır. Bir alternatif, doğrudan konjuge birincil antikorların kullanılmasıdır.
Hücre sayımına alternatif bir yaklaşım, ifade alanının yüzdesinin nicelleştirilmesidir. Bu, hücre sayımı mümkün olmadığında kullanılabilir (örneğin, kaspaz ekspresyonu nöronal süreçlere veya fotoreseptör segmentlerine lokalize ise). Santral ve periferik retina çeşitli yaralanma modellerinde farklı şekillerde etkilenir. Yöntem, farklı retina bölgelerini özel olarak analiz etmek için uyarlanabilir. BRVO yapılıyorsa, gözün yaralı kısmından kesitler seçilmelidir. Protokol ayrıca kaspazın nerede eksprese edildiğini belirlemek için farklı hücre belirteçlerinin boyanmasını sağlar.
Yöntemin sınırlamaları, belirli bir hücredeki yüksek ve düşük kaspaz sinyali seviyeleri arasında ayrım yapmamasını içerir. Ek olarak, nöronal tabakaları tanımlamak için nükleer bir leke kullanmak uygundur, ancak nöronal ekspresyonu kesin olarak göstermez (glia ve lökositler bu katmanlarda da bulunur). Nöronal ekspresyonu doğrulamak için ek nöronal belirteçler kullanılabilir. Kaspaz ekspresyonunu değerlendirmek için çeşitli antikorlar da mevcuttur; bunlar en iyi insan kaspazı-9 için tanımlanmıştır, burada tam uzunluk / yarık (cl) kaspaz-9, otokparçalanmış kaspaz-9 ve kaspaz-3-yarıklı kaspaz-9 için antikorlar vardır.
IHC sinyalinin ortalama yoğunluğu sıklıkla bir niceleme yöntemi olarak bildirilir. Bununla birlikte, kırmızı kan hücrelerinden gelen arka plan gürültüsü veya otofloresan yanlış sonuçlar verebilir. Hücreye özgü niceleme, arka planın, spesifik olmayan boyama ve otofloresanın belirlenmesine ve ayırt edilmesine izin verir.
Bu protokol, bireysel kaspazların ekspresyonundaki doku çapındaki değişiklikleri, endotel hücresi gibi belirli bir hücre tipindeki ekspresyondaki değişiklikleri ve farklı retina katmanlarındaki nöronlar gibi belirli yerlerdeki spesifik hücre tiplerindeki değişiklikleri ölçmek için kullanılabilir. Bu esneklik, deneycinin hastalık durumunun bireysel kaspaz seviyelerini nasıl değiştirdiğini sorgulamasını sağlar. Mevcut / alternatif yöntemler, kaspaz sinyallemesinin yarı kantitatif karşılaştırması için batı lekelenme analizini kullanır, ancak yöntemler bu protokolün ağrıttığı hücresel lokalizasyonun net bir şekilde ayrılmasını sağlamaz. Özellikle, Şekil 3D'de, kaspaz-9 inhibisyonu, RGL'ye kıyasla, INL ve ONL'deki nöronal kaspaz-9'un azaltılmasında daha etkilidir. Bu tür bir çözümün diğer yöntemlerle elde edilmesi zordur. Ek olarak, bütün bir doku biyokimyasal olarak analiz edildiğinde, karmaşık bir dokuda birçok farklı hücre tipi bulunduğundan, değişen kaspaz seviyeleri toplanamayacak kadar düşük olabilir.
Kullanıcı tarafından doğrulanması gereken antikorlar, kaspaz probu için özgüllük sağlar. Kaspaslar kaskadlarda hareket edebilir (yani, başlatıcı aktive edici efektör ve daha sonra sonuca yol açar - ölüm, iltihaplanma, hücre sinyalizasyonu). Bu protokol, hasar sonrası farklı zaman noktalarında toplanan örneklerde kullanılabilir; Burada sunulan örneklerde, örnekler RVO sonrası farklı zamanlarda toplanmaktadır. Daha önce yayınlanmış çalışmalarda, kaspaz-9'un RVO7 sonrası 1 saat içinde arttığı ve bunun da daha fazla doğrulama ve hedefleme çalışmasına yol açtığı bulunmuştur. Endotel kaspaz-9'u RVO patolojisinin potansiyel bir sürücüsü olarak tanımladıktan sonra, endotel kaspaz-9'u doğrulamak için indüklenebilir endotel hücreli kaspaz-9KO'lu bir fare kullanıldı. İndüklenebilir hücreye özgü kaspaz KO farelerinin kullanımı başka bir özgüllük düzeyi sağlar ve yapısal kaspaz-9KO18 ile görülen gelişimsel ölümü önler. Ayrıca, kurucu kaspaz KO farelerde meydana geldiği gösterilen diğer aile üyelerinde telafi edici değişiklikleri önler19. Ayrıca, hücreye özgü indüklenebilir kaspaz KO farelerinin kullanımı, kaspazın dokudaki patolojiyi düzenlediği hücre tipinin tanımlanmasına izin verir. Protokol ayrıca, RVO'da aktif kaspaz-9'u hedef alan terapötik bir yaklaşımın etkinliğini sorgulamak için adımlar sağlar. Bu yaklaşım beyin de dahil olmak üzere diğer dokulara da uygulanabilir.
Açıklamalar
Yazarlar aşağıdaki rakip çıkarları beyan ederler: C.M.T. aşağıdaki patent başvurularına sahiptir US20200164026, US20190142915 ve US20150165061. C.M.T. ve S.S.'nin ABD 20140024597 patent başvurusu var. C.M.T., A.M.P. ve M.I.A.'nın US2020058683 patent başvurusu vardır. C.M.T. ve Y.Y.J.'nin WO2018013519 patent başvurusu vardır. M.I.A ve C.M.T, New York Şehrindeki Columbia Üniversitesi Mütevelli Heyeti tarafından yapılan WO/2020/223212 patent başvurusunda mucit olarak listelenmiştir. Geri kalan yazarlar rakip çıkarlar olmadığını beyan ederler.
Teşekkürler
Bu çalışma, Ulusal Bilim Vakfı Lisansüstü Araştırma Burs Programı (NSF-GRFP) hibe DGE - 1644869 ve Ulusal Sağlık Enstitüleri (NIH) Ulusal Nörolojik Bozukluklar ve İnme Enstitüsü (NINDS), ödül numarası F99NS124180 NIH NINDS Çeşitlilik İhtisas F99 (CKCO'ya), Ulusal Göz Enstitüsü (NEI) 5T32EY013933 (AMP'ye), Ulusal Nörolojik Bozukluklar ve İnme Enstitüsü (RO1 NS081333, R03 NS099920'den CMT'ye) ve Savunma Bakanlığı Ordu/Hava Kuvvetleri (DURIP'ten CMT'ye).
Malzemeler
| Name | Company | Catalog Number | Comments |
| anti-Caspase-7 488 | Novus Biologicals | NB-56529AF488 | use at 1:150 |
| anti-cl-Caspase-9 | Cell Signaling | 9505-S | use at 1:800 |
| anti-CD31 | BD Pharmingen | 553370 | use at 1:50 |
| Confocal Spinning Disc Microscope | Biovision | ||
| FIJI 2.3.0 | open source | ||
| Fluormount G | Fisher | 50-187-88 | |
| Forcep | Roboz | RS-5015 | |
| iCasp9FL/FL X VECad-CreERT2 mice | lab generated | see Avrutsky 2020 | |
| Isolectin (594, 649) | Vector | DL-1207 | use at 1:200 |
| Ketamine Hydrochloride | Henry Schein | NDC: 11695-0702-1 | |
| Perfusion pump | Masterflex | ||
| Pen1-XBir3 | lab generated | see Avrutsky 2020 | |
| Prism 9.1 | GraphPad | ||
| Tissue-Tek O.C.T. | Fisher | 14-373-65 | |
| Vis-a-View 4.0 | Visitron Systems | ||
| Xylazine | Akorn | NDCL 59399-110-20 |
Referanslar
- Van Opdenbosch, N., Lamkanfi, M. Caspases in cell death, inflammation, and disease. Immunity. 50 (6), 1352-1364 (2019).
- Ramirez, M. L. G., Salvesen, G. S. A primer on caspase mechanisms. Seminars in Cell & Developmental Biology. 82, Academic Press. 79-85 (2018).
- Troy, C. M., Jean, Y. Y. Caspases: therapeutic targets in neurologic disease. Neurotherapeutics. 12 (1), 42-48 (2015).
- Avrutsky, M. I., Troy, C. M. Caspase-9: a multimodal therapeutic target with diverse cellular expression in human disease. Frontiers in Pharmacology. 12, 1728(2021).
- Fuchs, Y., Steller, H. Programmed cell death in animal development and disease. Cell. 147 (4), 742-758 (2011).
- Troy, C. M., Akpan, N., Jean, Y. Y. Regulation of caspases in the nervous system: implications for functions in health and disease. Progress in Molecular Biology and Translational Science. 99, 265-305 (2011).
- Avrutsky, M. I., et al. Endothelial activation of caspase-9 promotes neurovascular injury in retinal vein occlusion. Nature Communications. 11 (1), 3173(2020).
- Colon Ortiz, C., Potenski, A., Lawson, J. M., Smart, J., Troy, C. M. Optimization of the retinal vein occlusion mouse model to limit variability. Journal of Visualized Experiments. (174), e62980(2021).
- Tisch, N., et al. Caspase-8 modulates physiological and pathological angiogenesis during retina development. The Journal of Clinical Investigation. 129 (12), 5092-5107 (2019).
- Chi, W., et al. HMGB1 promotes the activation of NLRP3 and caspase-8 inflammasomes via NF-kappaB pathway in acute glaucoma. Journal of Neuroinflammation. 12, 137(2015).
- Thomas, C. N., et al. Caspase-2 mediates site-specific retinal ganglion cell death after blunt ocular injury. Investigative Ophthalmology & Visual Science. 59 (11), 4453-4462 (2018).
- Akpan, N., et al. Intranasal delivery of caspase-9 inhibitor reduces caspase-6-dependent axon/neuron loss and improves neurological function after stroke. Journal of Neuroscience. 31 (24), 8894-8904 (2011).
- London, A., Benhar, I., Schwartz, M. The retina as a window to the brain-from eye research to CNS disorders. Nature Reviews Neurology. 9 (1), 44-53 (2013).
- Song, P., Xu, Y., Zha, M., Zhang, Y., Rudan, I. Global epidemiology of retinal vein occlusion: a systematic review and meta-analysis of prevalence, incidence, and risk factors. Journal of Global Health. 9 (1), 010427(2019).
- Akpan, N., et al. Intranasal delivery of caspase-9 inhibitor reduces caspase-6-dependent axon/neuron loss and improves neurological function after stroke. The Journal of neuroscience. 31 (24), 8894-8904 (2011).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564(2012).
- McStay, G. P., Salvesen, G. S., Green, D. R. Overlapping cleavage motif selectivity of caspases: implications for analysis of apoptotic pathways. Cell Death & Differentiation. 15 (2), 322-331 (2007).
- Kuida, K., et al. Reduced apoptosis and cytochrome c-mediated caspase activation in mice lacking caspase 9. Cell. 94 (3), 325-337 (1998).
- Troy, C. M., et al. Death in the balance: alternative participation of the caspase-2 and -9 pathways in neuronal death induced by nerve growth factor deprivation. Journal of Neuroscience. 21 (14), 5007-5016 (2001).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır