Method Article
Quantificação da Caspase-9 Imunocorada em Tecido Retiniano
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Apresenta-se aqui um protocolo imuno-histoquímico detalhado para identificar, validar e direcionar caspases funcionalmente relevantes em tecidos complexos.
Resumo
A família das caspases é conhecida por mediar muitas vias celulares além da morte celular, incluindo diferenciação celular, pathfinding axonal e proliferação. Desde a identificação da família das proteases de morte celular, tem havido uma busca por ferramentas para identificar e expandir a função de membros específicos da família em estados de desenvolvimento, saúde e doença. No entanto, muitas das ferramentas de caspase atualmente disponíveis comercialmente que são amplamente utilizadas não são específicas para a caspase alvo. Neste relato, delineamos a abordagem que usamos para identificar, validar e direcionar a caspase-9 no sistema nervoso usando um novo inibidor e abordagens genéticas com leituras imuno-histoquímicas. Especificamente, utilizamos o tecido neuronal da retina como modelo para identificar e validar a presença e a função das caspases. Essa abordagem permite o interrogatório de funções específicas da caspase-9 apoptóticas e não apoptóticas do tipo celular e pode ser aplicada a outros tecidos complexos e caspases de interesse. Compreender as funções das caspases pode ajudar a expandir o conhecimento atual em biologia celular, e também pode ser vantajoso para identificar potenciais alvos terapêuticos devido ao seu envolvimento na doença.
Introdução
As caspases são uma família de proteases que regulam a morte celular do desenvolvimento, as respostas imunes e a morte celular aberrante na doença 1,2. Embora seja bem sabido que os membros da família da caspase são induzidos em uma variedade de doenças neurodegenerativas, entender qual caspase impulsiona a patologia da doença é mais desafiador3. Tais estudos requerem ferramentas para identificar, caracterizar e validar a função de membros individuais da família caspase. A análise das caspases individuais relevantes é importante tanto do ponto de vista mecanicista quanto terapêutico, pois a literatura possui múltiplos estudos que fornecem evidências dos diversos papéis das caspases 4,5. Assim, se o objetivo é direcionar uma caspase em uma doença para um benefício terapêutico, é fundamental ter um direcionamento específico do(s) membro(s) relevante(s) da família. As técnicas tradicionais para detectar os níveis de caspase no tecido incluem western blotting e abordagens enzimáticas e fluorométricas 3,6. No entanto, nenhuma dessas medidas permite a detecção específica de células dos níveis de caspase e, em alguns cenários, as caspases clivadas muitas vezes não podem ser detectadas pelas medidas tradicionais de análise de proteínas. Sabe-se que as caspases podem desempenhar diferentes papéis apoptóticos e não apoptóticos no mesmo tecido7, portanto, é necessária uma caracterização cuidadosa dos níveis de caspase específicos das células para a compreensão precisa das vias de desenvolvimento e da doença.
Este estudo mostra a ativação e a função da caspase em um modelo de hipóxia-isquemia neurovascular - oclusão da veia retiniana (RVO)7,8. Em um tecido complexo como a retina, existem vários tipos de células que podem ser afetadas pela hipóxia-isquemia induzida no RVO, incluindo células gliais, neurônios e vasculatura7. Na retina adulta de camundongos, há muito pouca expressão de caspases evidentes no tecido saudável, medida pela imuno-histoquímica (IHC)7, mas esse não é o caso durante o desenvolvimento9 ou em modelos de doença retiniana10,11. A IHC é uma técnica bem estabelecida na pesquisa biomédica e tem permitido a validação de alvos patológicos e patológicos, a identificação de novos papéis por meio da localização espacial e a quantificação de proteínas. Nos casos em que os produtos de caspase clivada não podem ser detectados por western blot ou análise fluorométrica, nem a localização celular específica de caspases distintas ou interrogação de vias de sinalização de caspase através da localização, então o IHC deve ser usado.
Para determinar a(s) caspase(s) funcionalmente relevante na RVO, a IHC foi utilizada com anticorpos validados para caspases e marcadores celulares. Os estudos prévios realizados em laboratório mostraram que a caspase-9 foi rapidamente ativada em um modelo de acidente vascular cerebral isquêmico e inibição da caspase-9 com um inibidor altamente específico protegido da disfunção neuronal e da morte12. Como a retina faz parte do sistema nervoso central (SNC), ela serve como um sistema modelo para consultar e investigar melhor o papel da caspase-9 em lesões neurovasculares13. Para este fim, o modelo de RVO em camundongo foi usado para estudar a localização e distribuição específicas da célula da caspase-9 e sua implicação na lesão neurovascular. A RVO é uma causa comum de cegueira em adultos em idade ativa que resulta de lesão vascular14. Verificou-se que a caspase-9 foi expressa de forma não apoptótica em células endoteliais, mas não em neurônios.
Como tecido, a retina tem a vantagem de ser visualizada como uma montagem plana, que permite a apreciação das redes vasculares, ou como seções transversais, que destacam as camadas neuronais da retina. A quantificação da expressão da proteína caspase em cortes transversais fornece contexto, em relação ao qual a caspase é potencialmente crítica na conectividade neuronal da retina e na função da visão, identificando a localização da(s) caspase(s) na retina. Após a identificação e validação, o direcionamento da caspase de interesse é alcançado usando a deleção específica de células induzíveis da caspase identificada. Para possíveis investigações terapêuticas, a relevância das caspases de interesse foi testada usando ferramentas específicas para inibir a caspase ativada. Para a caspase-9 uma célula persignificava inibidor altamente seletivo 7,15, Pen1-XBIR3 foi utilizada. Para este relato, foram utilizadas cepas C57BL/6J masculinas de 2 meses de idade e knockout endotelial induzível por tamoxifeno caspase-9 (iEC Casp9KO) com fundo C57BL/6J. Esses animais foram expostos ao modelo de camundongo de RVO e C57BL/6J foram tratados com o inibidor seletivo da caspase-9, Pen1-XBir3. A metodologia descrita pode ser aplicada a outros modelos de doença nos sistemas central e periférico 7,15.
Protocolo
Este protocolo segue a declaração da Associação de Pesquisa em Visão e Oftalmologia (ARVO) para o uso de animais em pesquisas oftálmicas e de visão. Experimentos com roedores foram aprovados e monitorados pelo Comitê Institucional de Cuidado e Uso de Animais (IACUC) da Universidade de Columbia.
1. Preparação do tecido retiniano e criossecção
- Eutanasiar os animais por meio de anestesia intraperitoneal (cetamina (80-100 mg/kg) e xilazina (5-10 mg/kg)), e perfundir os camundongos submetidos a RVO (ver8 para detalhes) com paraformaldeído a 4% (PFA) usando uma bomba peristáltica.
NOTA: Dedo do pé beliscar o animal para confirmar a profundidade da anestesia antes de prosseguir com a eutanásia e perfusão. Detalhes sobre a perfusão podem ser encontrados em16. - Colha os olhos por enucleação cuidadosa usando fórceps e coloque o globo em 1 mL de PFA a 4%. Deixe os olhos durante a noite a 4 °C. Lave os olhos três vezes por 10 min, adicionando 1 mL de 1x PBS e colocando-os no agitador.
- Mergulhe os olhos em 1 mL de sacarose a 30% por 3 dias, até que eles se depositem no fundo do tubo, indicando absorção da sacarose.
- Encha os olhos com um composto de temperatura de corte ideal usando uma seringa de 30 G, até que o olho tenha uma aparência arredondada (aproximadamente 50 μL).
- Incorpore os olhos em um criomuldo com composto de temperatura de corte ideal até que os olhos estejam cobertos e congelem a -80 °C até que estejam prontos para a criosecção.
- A seção incorporou os olhos a 20 μm em lâminas de vidro usando um criostato.
- Remova o bloco composto de temperatura de corte ideal do criomolde.
- Coloque-o no mandril do criostato adicionando o composto de temperatura de corte ideal e colocando o bloco no manuseio. Deixe-o dentro do criostato até congelar.
- Prossiga para cortar o bloco a 20 μm até que o tecido da retina seja visto.
NOTA: Isso pode ser confirmado com um microscópio de luz com ampliação de 30x (objetiva de 3x, oculares de 10x). Os tecidos podem ser distinguidos dos meios OCT por cor e forma. - Colete o tecido da retina em lâminas de microscópio em uma série de quatro seções por lâmina.
NOTA: Consulte a Figura 1A para sugerir a colocação de seções da retina.
- Rotule os slides com um ID que desidentifique o tratamento e o genótipo.
- Conservar as lâminas a -20 °C até à coloração.
2. Imuno-histoquímica
NOTA: Use tecido criopreservado fixo para imuno-histoquímica para manter a morfologia celular. Escolha seções que estejam no nível das imagens de tomografia de coerência óptica (OCT) adquiridas in vivo7. Use as duas primeiras séries de lâminas coletadas do criostato ou seções de 150 μm no tecido da retina.
- Coloque os slides em uma câmara de deslizamento escura e úmida.
- Permeabilização e bloqueio: Lave as seções transversais da retina com 300 μL de 1x PBS por 5 min para remover a OCT e descartar depois.
- Permeabilizar o tecido adicionando 300 μL de 1x PBS com Triton X-100 a 0,1% por 2 h à temperatura ambiente (RT) e descartar após.
- Bloquear o tecido adicionando 300 μL de tampão bloqueador (10% de soro de cabra normal (NGS), 1% de albumina sérica bovina (BSA) em 1x PBS, filtrado) e deixar durante a noite a 4 °C.
- Anticorpos primários: Diluem os anticorpos primários em tampão de bloqueio. Os anticorpos primários utilizados incluem anti-cl-caspase-9 à 1:800, anti-CD31 à 1:50 e anti-caspase-7-488 (anticorpo marcado directamente) à 1:150.
NOTA: Siga as recomendações do fabricante para a diluição adequada dos anticorpos primários.- Despeje o tampão de bloqueio das seções e aplique 100 μL do coquetel de anticorpos primários nas lâminas da retina.
- Incubar as secções transversais durante a noite a 4 °C.
- Lave as seções quatro vezes por 5 min com 300 μL de 1x PBS.
NOTA: Se as seções de tecido forem muito frágeis, as lavagens devem ser removidas usando ação capilar, aplicando um tecido no canto da lâmina para evitar o deslocamento das seções da retina. - Para evitar a marcação cruzada de anticorpos primários criados na mesma espécie hospedeira, complete a coloração com anticorpos secundários antes de aplicar os anticorpos diretamente marcados.
- Anticorpos secundários: Diluir os anticorpos secundários em tampão de bloqueio a uma concentração de 0,1%. Por exemplo, para detectar anti-cl-caspase-9, um anticorpo criado em coelho, use cabra-anti-coelho-568 secundário.
- Aplique 200 μL do coquetel de anticorpos secundários nas retinas.
- Incubar o tecido por 2 h no RT.
- Lave as seções quatro vezes por 5 min com 300 μL de 1x PBS.
- Coloração dos núcleos por 5 min com 300 μL de DAPI a uma diluição de 0,02%.
- Lave uma vez por 5 min com 300 μL de 1x PBS.
- Coloque uma tampa nas seções da retina usando 500 μL de meio fluoromount-G, que preserva o sinal fluorescente, e coloque cuidadosamente a tampa na parte superior da lâmina, evitando bolhas.
3. Imagem confocal
- Adquira imagens das seções coradas com microscopia confocal.
- Ligue o microscópio confocal.
- Coloque o slide no palco.
- Ajuste o foco para ver a seção da retina claramente.
NOTA: Tire pelo menos quatro imagens por seção e imagem quatro seções por retina. Consulte o esquema de imagem da retina para áreas de imagem sugeridas (Figura 1B, C).
- Imagem de caspase, coloração vascular e nuclear usando um microscópio confocal que possui aquisição de pilha Z, usando uma objetiva de 20x ou 40x.
NOTA: Os parâmetros de imagem e a configuração do software devem ser constantes para todas as imagens em um experimento. O objetivo de 20x fornece uma visão geral das camadas da retina, que são bem definidas pela coloração nuclear. A objetiva de 40x fornece mais detalhes celulares.- Defina os tempos apropriados de exposição e intensidade do laser por canal clicando em adquirir configurações.
- Defina a pilha Z para visualizar toda a seção clicando em Série Z e configure parâmetros para cima e para baixo para cobrir a profundidade do tecido.
- Salve as imagens seguindo o ID mascarado atribuído durante a criossecção.
4. Quantificação dos níveis de caspase
- Arraste arquivos de imagem de 405, 470, 555 e 640 canais para o console da FIJI.
- Clique em Imagem > Cores > Mesclar Canais.
- Atribua cores aos arquivos da seguinte maneira: vermelho a 555, verde a 470, cinza a 405, ciano a 640.
- Comprima a pilha Z clicando em Imagem > Pilha > Projeto Z.
- Clique em Tipo de projeção: intensidade máxima.
- Abra a Interface de Canais clicando em Imagem > Ferramenta de Canais de Cor.
- Abra a interface Brilho e Contraste .
- Selecione parâmetros por canal.
- Vá para Canais e selecione um canal.
- Coloque o cursor sobre a célula expressa caspase e anote o valor do pixel.
- Coloque o cursor sobre o plano de fundo e anote o valor do pixel.
- Parâmetros de teste
- Vá para a interface Brilho e Contraste.
- Clique em Selecionar.
- Conecte o valor mínimo exibido (valor de pixel anotado da célula expressa caspase).
- Conecte o valor máximo exibido (valor de pixel anotado do plano de fundo).
- Clique em Ok.
- Repita as etapas 4.8-4.9 para todos os canais.
- Teste os parâmetros escolhendo imagens aleatórias de tecido cego.
Observação : edite os parâmetros de brilho e contraste somente se o valor de plano de fundo não for adequado para outras imagens. - Uma vez que os parâmetros são definidos, abra os arquivos de imagem e comprima a pilha Z.
- Adicione os parâmetros de brilho e contraste para o canal de caspase e a isolectina, canal marcador vascular.
- Use a ferramenta de ponto para quantificar o número de áreas vasculares positivas usando a colocalização do marcador vascular com expressão de caspase como leitura de áreas positivas.
- Repita o passo 4.14, mas utilizando Hoechst como marcador de áreas neuronais positivas.
- Anote os valores em uma planilha por imagem.
- Média dos valores por seção.
- Média dos valores de seção - esta será a leitura por olho.
5. Confirmação genética da relevância da caspase de células endoteliais-9
- Utilizar retinas obtidas dos camundongos Casp9FL/FL-VECad-CreERT2 submetidos ao RVO7.
- Imunocorar as retinas para caspase-9 (a caspase eliminada), caspase-7 (uma caspase efetora a jusante), marcadores vasculares e DAPI, conforme descrito acima na secção 2.
- Fotografar e quantificar conforme descrito acima nas seções 3 e 4.
6. Visando a caspase-9 no RVO
- Obter olhos dos camundongos submetidos a RVO seguido da aplicação do inibidor de caspase-9 Pen1-XBir3 topicamente aos olhos como em7.
- Imunocorar as retinas para caspase-7 (uma caspase efetora a jusante), marcadores vasculares e DAPI, conforme descrito acima na secção 2.
- Fotografar e quantificar conforme descrito acima nas seções 3 e 4.
Resultados
O protocolo descrito permite ao usuário analisar e quantificar os níveis de caspase-9 no tecido da retina. Além disso, apresenta ferramentas para identificar, validar e direcionar especificamente a caspase-9 e os substratos a jusante. As etapas resumidas permitem a análise quantificável dos níveis de caspase e da especificidade celular em fotomicrografias fluorescentes. Todas as figuras mostram fotomicrografias representativas e quantificação dos níveis de caspase indicados na retina total, células endoteliais e neurônios em cortes transversais de retina P-RVO não lesados e de 1 dia. A secção transversal da retina permite a visualização dos núcleos da retina na camada ganglionar da retina (RGL), na camada nuclear interna (INL) e na camada nuclear externa (ONL) quando corada com Hoechst. Além disso, os vasos sanguíneos da retina são visíveis nas camadas plexiformes da retina ou entre o RGL e o INL, e entre o INL e o ONL. Devido à natureza histológica dos vasos sanguíneos, quando a retina é seccionada, os vasos sanguíneos aparecerão como desconectados e separados, suprindo as camadas plexiformes. A Figura 2 identifica a caspase-9 como P-RVO de 1 dia altamente regulada. A Figura 3 valida a relevância funcional da caspase-9 endotelial utilizando camundongos knockout de células endoteliais induzíveis. A Figura 4 mostra que o direcionamento da caspase-9 ativa bloqueia farmacologicamente a indução de um alvo a jusante da caspase-9-caspase-7. O protocolo identifica a localização celular das caspases e das camadas neuronais da retina nas quais as caspases são expressas.

Figura 1: Esquema de imagem da retina. (A) Colocação recomendada de cortes da retina na lâmina do microscópio. (B) Visão geral das áreas de imagem na retina. (C) Representação da visão da retina em 20x objetivo. Camadas da retina: RGL = camada ganglionar da retina, INL = camada nuclear interna, ONL = camada nuclear externa. Por favor, clique aqui para ver uma versão maior desta figura.
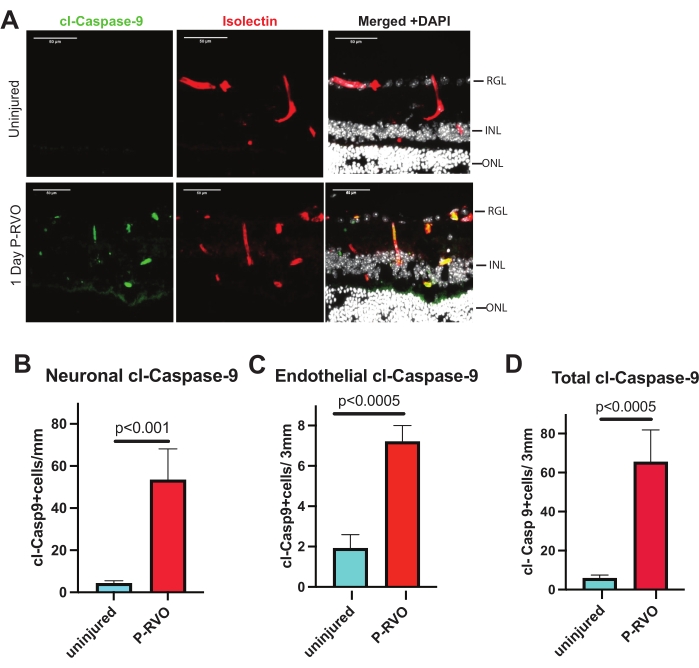
Figura 2: RVO induz caspase-9 em células endoteliais e neurônios. (A) Cortes transversais representativos da retina de P-RVO não lesionado e de 1 dia corado com cl-caspase-9 1:800 (verde), isolectina 1:200 (vermelho) e DAPI (branco). (B) Quantificação do número de neurônios com cl-caspase-9 (ver Tabela de Materiais para detalhes sobre os anticorpos). (C) Quantificação do número de células endoteliais com cl-caspase-9. (D) Número total de células que expressam cl-caspase-9. Não ferido, n = 6; P-RVO de 1 dia, n = 5. As barras de erro representam a média ± MEV; ANOVA unidirecional, teste de LSD de Fisher. Barra de escala = 50 μm. Clique aqui para ver uma versão maior desta figura.
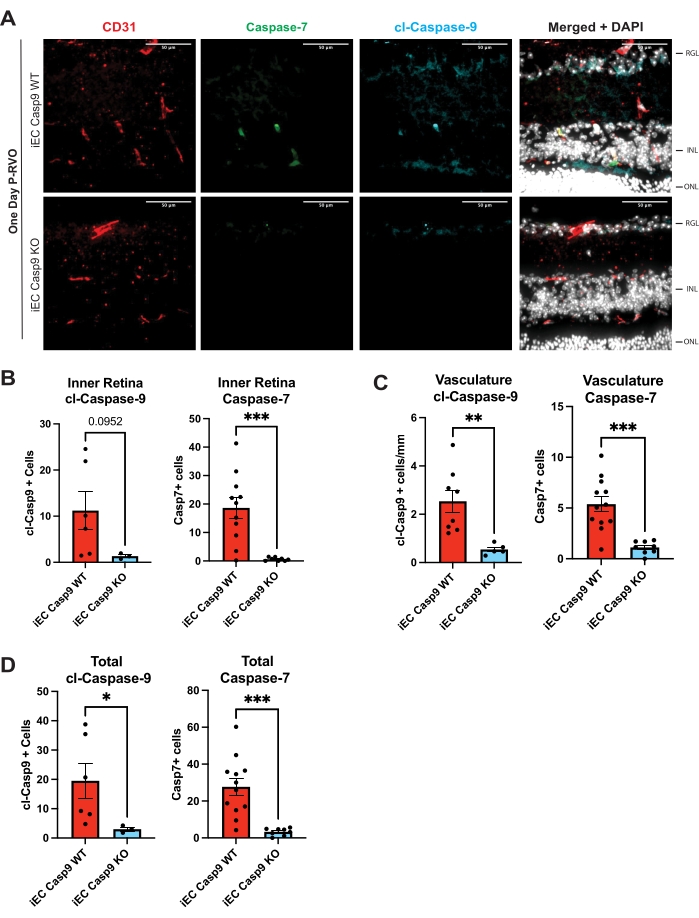
Figura 3: Deleção de células endoteliais de blocos endoteliais de caspase-9 RVO-indução de caspase-7. (A) Cortes transversais representativos da retina de camundongos iEC Casp9WT e iEC Casp9KO littermate de 1 dia P-RVO corados com caspase-7 (verde), cl-caspase-9 (azul), CD31, um marcador vascular (vermelho) e DAPI (branco). (B) Quantificação do número de células da retina interna com cl-caspase-9 e com caspase-7. (C) Quantificação do número de células endoteliais com cl-caspase-9 e com caspase-7. (D) Número total de células que expressam cl-caspase-9 ou caspase-7. iEC Casp9WT, n = 6-12; iEC Casp9KO, n = 3-8. As barras de erro representam a média ± MEV; ANOVA unidirecional, teste de LSD de Fisher. Barra de escala = 50 μm. Clique aqui para ver uma versão maior desta figura.

Figura 4: A inibição da atividade da caspase-9 inibe a expressão da caspase-7 P-RVO. (A) Cortes transversais representativos da retina de P-RVO não lesionados e de 1 dia tratados ou não tratados com Pen1-XBIR3 corado com caspase-7 (verde), isonectina (vermelho) e DAPI (branco). (B) Quantificação do número de células endoteliais com caspase-7. (C) Quantificação do número de leucócitos com caspase-7. (D) Quantificação do número de neurônios por camada neuronal com caspase-7. (E) Número total de células que expressam caspase-7. Caneta Salina Autônoma 1, n = 6; Pen1-XBIR3 não lesionado, n = 5; P-RVO Pen1 Saline de 1 dia, n = 5; P-RVO Pen1-XBIR3 de 1 dia, n = 3. As barras de erro representam a média ± MEV; ANOVA unidirecional, teste de LSD de Fisher. Abreviaturas: RGL = camada ganglionar da retina, INL = camada nuclear interna e ONL = camada nuclear externa. Barra de escala = 50 μm. Clique aqui para ver uma versão maior desta figura.
Discussão
As caspases são uma família de proteases com vários membros melhor estudada por seus papéis na morte celular e inflamação; no entanto, mais recentemente, uma variedade de funções de não-morte tem sido descoberta para alguns membros da família 4,5. Grande parte da nossa compreensão da função da caspase é derivada do trabalho em cultura de células e de dados inferenciais de doenças humanas. Embora seja apreciado que haja indução, ativação ou inativação aberrante de caspases na doença, tem sido um desafio determinar funcionalmente se as caspases estão impulsionando a patologia da doença. Muitas ferramentas utilizadas para avaliar caspases específicas detectam múltiplos membros da família, prejudicando a relevância funcional dos dados obtidos com esses reagentes17. Aqui fornecemos um protocolo para estudar caspases em tecidos complexos, usando a retina como exemplo. No sistema nervoso, a expressão da caspase é regulada negativamente no pré e pós-natal. Isso permite o uso de anticorpos específicos para testar alterações nos níveis de caspase em um modelo de doença.
Embora o foco do protocolo esteja no processamento e análise de imagens, o sucesso da técnica também depende da preparação cuidadosa do tecido, bem como da IHC e da imagem microscópica para garantir a consistência, validade e confiabilidade dos dados. Deve-se tomar cuidado para utilizar os mesmos parâmetros para criar imagens de um conjunto de dados inteiro. Imagens de baixa qualidade, baixo contraste e foco desfocado não fornecerão dados confiáveis. Ao seccionar e visualizar regiões P-RVO da retina, rasgos e dobramentos devem ser evitados, pois essas áreas podem resultar em artefatos. Áreas de danos diretos também devem ser evitadas. O investigador que realiza a imagem precisa ser cego para o tratamento do tecido. Para análise, recomenda-se que dois observadores independentes, cegos para o grupo de tratamento, realizem a análise. Além disso, os anticorpos primários de camundongos não devem ser usados em modelos de lesão de camundongos, pois os anticorpos secundários se ligam não especificamente à vasculatura. Uma alternativa é usar anticorpos primários diretamente conjugados.
Uma abordagem alternativa para a contagem de células é a quantificação da porcentagem da área de expressão. Isso pode ser usado quando a contagem celular não é possível (por exemplo, se a expressão da caspase estiver localizada em processos neuronais ou segmentos fotorreceptores). A retina central e periférica é afetada diferencialmente em vários modelos de lesão. O método pode ser adaptado para analisar especificamente diferentes regiões da retina. Se realizar BRVO, as seções devem ser selecionadas da parte lesada do olho. O protocolo também prevê a coloração de diferentes marcadores celulares para identificar onde a caspase é expressa.
As limitações do método incluem que ele não diferencia entre altos e baixos níveis de sinal de caspase em uma determinada célula. Além disso, o uso de uma coloração nuclear para identificar camadas neuronais é conveniente, mas não indica definitivamente a expressão neuronal (glia e leucócitos também estão presentes nessas camadas). Marcadores neuronais adicionais podem ser usados para validar a expressão neuronal. Há também uma variedade de anticorpos disponíveis para avaliar a expressão da caspase; estes foram melhor definidos para a caspase-9 humana, onde existem anticorpos para a caspase-9 de comprimento total/clivada (cl), a caspase-9 autoclivada e a caspase-3-cliva-9.
A intensidade média do sinal da IHC é frequentemente relatada como um método de quantificação. No entanto, o ruído de fundo ou a autofluorescência dos glóbulos vermelhos podem produzir resultados imprecisos. A quantificação específica da célula permite a determinação e discriminação de fundo, coloração não específica e autofluorescência.
Este protocolo pode ser usado para medir mudanças em todo o tecido na expressão de caspases individuais, mudanças na expressão em um tipo específico de célula, como uma célula endotelial, e alterações em tipos celulares específicos em locais específicos, como neurônios em diferentes camadas da retina. Essa flexibilidade permite que o experimentador questione como o estado da doença está alterando os níveis individuais de caspase. Os métodos existentes/alternativos utilizam a análise de western blotting para comparação semiquantitativa da sinalização da caspase, embora os métodos não forneçam a separação clara da localização celular que este protocolo alcança. Notavelmente, na Figura 3D, a inibição da caspase-9 é mais eficaz na redução da caspase-9 neuronal no INL e ONL, em comparação com o RGL. Este tipo de resolução é um desafio para alcançar por outros métodos. Além disso, quando um tecido inteiro é analisado bioquimicamente, os níveis de caspases que mudam podem ser muito baixos para pegar, uma vez que existem muitos tipos diferentes de células em um tecido complexo.
Os anticorpos, que devem ser validados pelo usuário, fornecem especificidade para a caspase sondada. As caspases podem atuar em cascatas (ou seja, iniciador ativando o efetor e, em seguida, levando ao resultado - morte, inflamação, sinalização celular). Este protocolo pode ser utilizado em amostras coletadas em diferentes momentos pós-dano; nos exemplos aqui apresentados, as amostras são coletadas em diferentes momentos pós-RVO. Em trabalhos publicados anteriormente, verificou-se que a caspase-9 foi aumentada dentro de 1 h pós-RVO7, o que levou a mais estudos de validação e direcionamento. Após a identificação da caspase-9 endotelial como potencial condutora da patologia do RVO, foi utilizado um camundongo com caspase-9KO de células endoteliais induzíveis para validar a caspase-9 endotelial. O uso de camundongos KO com caspase específica de células induzíveis proporciona outro nível de especificidade e evita a morte do desenvolvimento observada com a caspase-9KO constitutiva18. Também evita alterações compensatórias em outros membros da família que tenham demonstrado ocorrer em camundongos KO caspase constitutiva19. Além disso, o uso de camundongos KO de caspase induzíveis específicos de células permite a identificação do tipo de célula em que a caspase está regulando a patologia no tecido. O protocolo também fornece os passos para interrogar a eficácia de uma abordagem terapêutica, visando a caspase-9 ativa na RVO. Esta abordagem também pode ser aplicada a outros tecidos, incluindo o cérebro.
Divulgações
Os autores declaram os seguintes interesses concorrentes: C.M.T. tem os seguintes pedidos de patente US20200164026, US20190142915 e US20150165061. C.M.T. e S.S. têm um pedido de patente 20140024597 nos EUA. C.M.T., A.M.P. e M.I.A. têm um pedido de patente US2020058683. C.M.T. e Y.Y.J. têm um pedido de patente WO2018013519. M.I.A e C.M.T estão listados como inventores em um pedido de patente WO/2020/223212 pelos curadores da Universidade de Columbia, na cidade de Nova York. Os demais autores declaram não haver interesses concorrentes.
Agradecimentos
Este trabalho foi apoiado pela bolsa do National Science Foundation Graduate Research Fellowship Program (NSF-GRFP) DGE - 1644869 e pelo National Institute of Neurological Disorders and Stroke (NINDS) dos National Institutes of Health (NIH), número de prêmio F99NS124180 NIH NINDS Diversity Specialized F99 (para CKCO), o National Eye Institute (NEI) 5T32EY013933 (para AMP), o Instituto Nacional de Distúrbios Neurológicos e Acidente Vascular Cerebral (RO1 NS081333, R03 NS099920 para CMT), e o Departamento de Defesa do Exército / Força Aérea (DURIP para CMT).
Materiais
| Name | Company | Catalog Number | Comments |
| anti-Caspase-7 488 | Novus Biologicals | NB-56529AF488 | use at 1:150 |
| anti-cl-Caspase-9 | Cell Signaling | 9505-S | use at 1:800 |
| anti-CD31 | BD Pharmingen | 553370 | use at 1:50 |
| Confocal Spinning Disc Microscope | Biovision | ||
| FIJI 2.3.0 | open source | ||
| Fluormount G | Fisher | 50-187-88 | |
| Forcep | Roboz | RS-5015 | |
| iCasp9FL/FL X VECad-CreERT2 mice | lab generated | see Avrutsky 2020 | |
| Isolectin (594, 649) | Vector | DL-1207 | use at 1:200 |
| Ketamine Hydrochloride | Henry Schein | NDC: 11695-0702-1 | |
| Perfusion pump | Masterflex | ||
| Pen1-XBir3 | lab generated | see Avrutsky 2020 | |
| Prism 9.1 | GraphPad | ||
| Tissue-Tek O.C.T. | Fisher | 14-373-65 | |
| Vis-a-View 4.0 | Visitron Systems | ||
| Xylazine | Akorn | NDCL 59399-110-20 |
Referências
- Van Opdenbosch, N., Lamkanfi, M. Caspases in cell death, inflammation, and disease. Immunity. 50 (6), 1352-1364 (2019).
- Ramirez, M. L. G., Salvesen, G. S. A primer on caspase mechanisms. Seminars in Cell & Developmental Biology. 82, Academic Press. 79-85 (2018).
- Troy, C. M., Jean, Y. Y. Caspases: therapeutic targets in neurologic disease. Neurotherapeutics. 12 (1), 42-48 (2015).
- Avrutsky, M. I., Troy, C. M. Caspase-9: a multimodal therapeutic target with diverse cellular expression in human disease. Frontiers in Pharmacology. 12, 1728(2021).
- Fuchs, Y., Steller, H. Programmed cell death in animal development and disease. Cell. 147 (4), 742-758 (2011).
- Troy, C. M., Akpan, N., Jean, Y. Y. Regulation of caspases in the nervous system: implications for functions in health and disease. Progress in Molecular Biology and Translational Science. 99, 265-305 (2011).
- Avrutsky, M. I., et al. Endothelial activation of caspase-9 promotes neurovascular injury in retinal vein occlusion. Nature Communications. 11 (1), 3173(2020).
- Colon Ortiz, C., Potenski, A., Lawson, J. M., Smart, J., Troy, C. M. Optimization of the retinal vein occlusion mouse model to limit variability. Journal of Visualized Experiments. (174), e62980(2021).
- Tisch, N., et al. Caspase-8 modulates physiological and pathological angiogenesis during retina development. The Journal of Clinical Investigation. 129 (12), 5092-5107 (2019).
- Chi, W., et al. HMGB1 promotes the activation of NLRP3 and caspase-8 inflammasomes via NF-kappaB pathway in acute glaucoma. Journal of Neuroinflammation. 12, 137(2015).
- Thomas, C. N., et al. Caspase-2 mediates site-specific retinal ganglion cell death after blunt ocular injury. Investigative Ophthalmology & Visual Science. 59 (11), 4453-4462 (2018).
- Akpan, N., et al. Intranasal delivery of caspase-9 inhibitor reduces caspase-6-dependent axon/neuron loss and improves neurological function after stroke. Journal of Neuroscience. 31 (24), 8894-8904 (2011).
- London, A., Benhar, I., Schwartz, M. The retina as a window to the brain-from eye research to CNS disorders. Nature Reviews Neurology. 9 (1), 44-53 (2013).
- Song, P., Xu, Y., Zha, M., Zhang, Y., Rudan, I. Global epidemiology of retinal vein occlusion: a systematic review and meta-analysis of prevalence, incidence, and risk factors. Journal of Global Health. 9 (1), 010427(2019).
- Akpan, N., et al. Intranasal delivery of caspase-9 inhibitor reduces caspase-6-dependent axon/neuron loss and improves neurological function after stroke. The Journal of neuroscience. 31 (24), 8894-8904 (2011).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564(2012).
- McStay, G. P., Salvesen, G. S., Green, D. R. Overlapping cleavage motif selectivity of caspases: implications for analysis of apoptotic pathways. Cell Death & Differentiation. 15 (2), 322-331 (2007).
- Kuida, K., et al. Reduced apoptosis and cytochrome c-mediated caspase activation in mice lacking caspase 9. Cell. 94 (3), 325-337 (1998).
- Troy, C. M., et al. Death in the balance: alternative participation of the caspase-2 and -9 pathways in neuronal death induced by nerve growth factor deprivation. Journal of Neuroscience. 21 (14), 5007-5016 (2001).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados