Method Article
網膜組織における免疫染色カスパーゼ-9の定量
* これらの著者は同等に貢献しました
要約
ここでは、複雑な組織における機能的に関連するカスパーゼを同定、検証、標的化するための詳細な免疫組織化学プロトコルを示します。
要約
カスパーゼのファミリーは、細胞分化、軸索経路探索、増殖など、細胞死以外の多くの細胞経路を媒介することが知られています。細胞死プロテアーゼのファミリーの同定以来、発生、健康、および疾患状態における特定のファミリーメンバーの機能を特定および拡張するためのツールが検索されてきました。しかしながら、広く使用されている現在市販されているカスパーゼツールの多くは、標的カスパーゼに特異的ではない。このレポートでは、新しい阻害剤と免疫組織化学的読み出しによる遺伝的アプローチを使用して、神経系のカスパーゼ-9を同定、検証、および標的にするために使用したアプローチについて説明します。具体的には、網膜神経組織をモデルとして、カスパーゼの存在と機能を特定および検証しました。このアプローチは、細胞型特異的なアポトーシスおよび非アポトーシスカスパーゼ-9機能の調査を可能にし、関心のある他の複雑な組織およびカスパーゼに適用することができます。カスパーゼの機能を理解することは、細胞生物学における現在の知識を広げるのに役立ち、また、カスパーゼが疾患に関与しているため、潜在的な治療標的を特定するのにも有利です。
概要
カスパーゼは、疾患における発生細胞死、免疫応答、および異常な細胞死を調節するプロテアーゼのファミリーです1,2。カスパーゼファミリーのメンバーがさまざまな神経変性疾患に誘導されることはよく知られていますが、どのカスパーゼが疾患の病理を引き起こすかを理解することはより困難です3。このような研究には、個々のカスパーゼファミリーメンバーの機能を特定、特徴付け、および検証するためのツールが必要です。文献にはカスパーゼの多様な役割の証拠を提供する複数の研究があるため、関連する個々のカスパーゼを解析することは、機構と治療の両方の観点から重要です4,5。したがって、治療上の利益のために疾患のカスパーゼを標的にすることが目標である場合、関連する家族を特異的に標的とすることが重要です。組織内のカスパーゼレベルを検出する従来の技術には、ウェスタンブロッティング、酵素および蛍光測定アプローチが含まれます3,6。ただし、これらの測定値ではカスパーゼレベルの細胞特異的検出はできず、一部のシナリオでは、切断されたカスパーゼは従来のタンパク質分析測定では検出できないことがよくあります。カスパーゼは同じ組織内で異なるアポトーシスと非アポトーシスの役割を果たすことが知られている7ため、発生経路と疾患経路を正確に理解するには、細胞特異的なカスパーゼレベルの慎重な特性評価が必要です。
この研究は、神経血管低酸素虚血-網膜静脈閉塞(RVO)のモデルにおけるカスパーゼの活性化と機能を示しています7,8。網膜などの複雑な組織では、グリア細胞、ニューロン、血管系など、RVOで誘導される低酸素虚血の影響を受ける可能性のある複数の細胞型があります7。成体マウス網膜では、免疫組織化学(IHC)7によって測定されるように、健康な組織に明らかなカスパーゼの発現はほとんどありませんが、発生中9または網膜疾患のモデルではそうではありません10,11。IHCは、生物医学研究で確立された技術であり、疾患および病理学的標的の検証、空間的局在化による新しい役割の特定、およびタンパク質の定量を可能にしました。切断されたカスパーゼ産物がウェスタンブロットまたは蛍光分析によって検出できない場合、または明確なカスパーゼの特定の細胞位置または局在化によるカスパーゼシグナル伝達経路の調査では、IHCを使用する必要があります。
RVOに機能的に関連するカスパーゼを決定するために、IHCをカスパーゼおよび細胞マーカーの検証済み抗体とともに使用しました。研究室で実施された以前の研究では、カスパーゼ-9が虚血性脳卒中のモデルで急速に活性化され、神経機能障害と死から保護された高度に特異的な阻害剤によるカスパーゼ-9の阻害が示されました12。網膜は中枢神経系(CNS)の一部であるため、神経血管損傷におけるカスパーゼ-9の役割を照会し、さらに調査するためのモデルシステムとして機能します13。この目的のために、RVOのマウスモデルを使用して、カスパーゼ-9の細胞特異的な位置と分布、および神経血管損傷におけるその意味を研究しました。RVOは、血管損傷に起因する働く高齢者の失明の一般的な原因です14。カスパーゼ-9は内皮細胞では非アポトーシス的に発現するが、ニューロンでは発現しないことがわかった。
組織として、網膜は、血管網の鑑賞を可能にするフラットマウント、またはニューロン網膜層を強調する断面として視覚化されるという利点があります。断面におけるカスパーゼタンパク質発現の定量化は、網膜におけるカスパーゼの局在を特定することにより、網膜ニューロンの接続性と視覚機能においてどのカスパーゼが潜在的に重要であるかに関するコンテキストを提供します。同定および検証の後、目的のカスパーゼのターゲティングは、同定されたカスパーゼの誘導性細胞特異的欠失を用いて達成される。潜在的な治療上の問い合わせのために、関心のあるカスパーゼの関連性を、活性化されたカスパーゼを阻害するための特定のツールを使用してテストしました。カスパーゼ-9細胞パーサルインした高選択的阻害剤7,15については、Pen1-XBIR3を用いた。本報告では、生後2ヶ月の雄C57BL/6J株およびタモキシフェン誘導性内皮カスパーゼ-9ノックアウト(iEC Casp9KO)株を使用し、C57BL/6Jをバックグラウンドとした。これらの動物をRVOのマウスモデルに曝露し、C57BL/6Jをカスパーゼ-9選択的阻害剤Pen1-XBir3で治療した。記載された方法論は、中枢系および末梢系における疾患の他のモデルに適用することができる7、15。
プロトコル
このプロトコルは、眼科および視覚研究における動物の使用に関する視覚眼科研究協会(ARVO)の声明に従います。げっ歯類の実験は、コロンビア大学の施設動物管理使用委員会(IACUC)によって承認および監視されました。
1.網膜組織の調製と凍結切片
- 腹腔内麻酔(ケタミン(80-100 mg/kg)およびキシラジン(5-10 mg/kg))を投与して動物を安楽死させ、RVO(詳細は8 を参照)を施したマウスに蠕動ポンプを用いて4%パラホルムアルデヒド(PFA)を灌流する。
注:安楽死と灌流を進める前に、動物をつまんで麻酔の深さを確認してください。灌流に関する詳細は16にあります。 - 鉗子を使用して慎重に除核して目を収穫し、地球を1mLの4%PFAに入れます。4°Cで一晩放置します。 目を10分間3回洗い、1 mLの1x PBSを加えてシェーカーに入れます。
- 1mLの30%スクロースに3日間、チューブの底に落ち着くまで目を浸し、スクロースの吸収を示します。
- 目が丸みを帯びた外観(約50μL)になるまで、30 Gシリンジを使用して最適な切断温度コンパウンドで目を満たします。
- 目が覆われるまで、最適な切断温度コンパウンドを含むクライオモールドに目を埋め込み、凍結切開の準備ができるまで-80°Cで凍結します。
- 切片は、クライオスタットを使用してスライドガラス上に20μmで目を埋め込みました。
- クライオモールドから最適な切削温度のコンパウンドブロックを取り外します。
- 最適な切断温度コンパウンドを添加し、ブロックをチャックの上に置いて、クライオスタットチャックに置きます。凍結するまでクライオスタットの中に置いておきます。
- 網膜組織が見えるまで、ブロックを20μmで切断します。
注:これは、30倍の倍率(対物レンズ3倍、接眼レンズ10倍)の光学顕微鏡で確認できます。組織は、色と形状によってOCTメディアと区別できます。 - 網膜組織を顕微鏡スライドに、スライドごとに一連の4つのセクションに集めます。
注:網膜切片の推奨される配置については 、図1A を参照してください。
- スライドに、治療法と遺伝子型を識別できないIDを付けます。
- スライドは染色されるまで-20°Cで保存します。
2. 免疫組織化学
注:細胞形態を維持するために、免疫組織化学に固定凍結保存された組織を使用してください。 in vivo7で取得した光干渉断層撮影(OCT)画像のレベルにある切片を選択します。クライオスタットから採取した最初の2つの一連のスライド、または150μmの切片を網膜組織に使用します。
- スライドを暗くて湿気の多いスライドチャンバーに置きます。
- 透過処理とブロッキング:網膜断面を300 μLの1x PBSで5分間洗浄し、OCTを除去し、その後廃棄します。
- 300 μLの1x PBSを0.1%Triton X-100と共に室温(RT)で2時間添加して組織を透過処理し、その後廃棄します。
- 300 μLのブロッキングバッファー(10%正常ヤギ血清(NGS)、1%ウシ血清アルブミン(BSA)を1x PBSでろ過)を加えて組織をブロックし、4°Cで一晩放置します。
- 一次抗体:一次抗体をブロッキングバッファーで希釈します。使用される一次抗体には、1:800の抗cl-カスパーゼ-9、1:50の抗CD31、および1:150の抗カスパーゼ-7-488(直接標識抗体)が含まれます。
注:一次抗体の適切な希釈については、製造元の推奨に従ってください。- ブロッキングバッファーを切片から流し、100 μLの一次抗体カクテルを網膜スライドに塗布します。
- 断面を4°Cで一晩インキュベートします。
- 切片を300 μLの1x PBSで5分間4回洗浄します。
注意: 組織切片が非常に壊れやすい場合は、網膜切片がずれないように、スライドの角に組織を適用して毛細管現象を使用して洗浄液を除去する必要があります。 - 同じ宿主種で産生された一次抗体の交差標識を回避するには、直接標識抗体を適用する前に二次抗体による染色を完了してください。
- 二次抗体:二次抗体をブロッキングバッファーで0.1%の濃度で希釈します。例えば、ウサギで産生された抗体である抗cl-カスパーゼ-9を検出するには、ヤギ抗ウサギ-568二次を使用します。
- 200 μLの二次抗体カクテルを網膜に塗布します。
- RTで2時間組織をインキュベートします。
- 切片を300 μLの1x PBSで5分間4回洗浄します。
- 核を300 μLのDAPIで0.02%の希釈率で5分間染色します。
- 300 μLの1x PBSで5分間1回洗浄します。
- 蛍光シグナルを保存する500 μLのフルオロマウントG培地を使用して網膜切片にカバーガラスを置き、気泡を避けてスライドの上部にカバーガラスを慎重に置きます。
3. 共焦点イメージング
- 共焦点顕微鏡で染色切片の画像を取得します。
- 共焦点顕微鏡の電源を入れます。
- スライドをステージに置きます。
- 網膜セクションがはっきりと見えるようにフォーカスを調整します。
注:セクションごとに少なくとも4つの画像を撮り、網膜ごとに4つのセクションを画像化します。推奨されるイメージング領域については、網膜イメージングの概略図を参照してください(図1B、C)。
- カスパーゼ、血管、核の染色を、Zスタック取得が可能な共焦点顕微鏡で、20倍または40倍の対物レンズを使用して画像化します。
注意: イメージングパラメータとソフトウェア設定は、実験のすべてのイメージングで一定である必要があります。20倍対物レンズは、核染色によって明確に定義される網膜層の概要を提供します。40倍の対物レンズは、よりセルラーの詳細を提供します。- チャンネルごとに適切な露出とレーザー強度の時間を設定するには、[ 設定の取得]をクリックします。
- Zシリーズをクリックしてセクション全体を視覚化するように Z スタックを設定し、組織の深さをカバーするように上下のパラメータを設定します。
- 凍結切片中に割り当てられたマスクされたIDに従って画像を保存します。
4.カスパーゼレベルの定量化
- 405、470、555、および640チャンネルの画像ファイルをFIJIのコンソールにドラッグします。
- 「 画像>カラー」をクリックして>チャンネルを結合します。
- 赤を 555、緑を 470、灰色を 405、シアンを 640 に、ファイルに色を割り当てます。
- Z スタックを圧縮するには 、[Z プロジェクト>イメージ>スタック] をクリックします。
- [ 投影タイプ: 最大強度]をクリックします。
- をクリックしてチャンネルインターフェイスを開きます 画像>カラーチャンネルツール.
- 明るさとコントラストのインターフェースを開きます。
- チャンネルごとにパラメータを選択します。
- [チャンネル] に移動し、チャンネルを 1 つ選択します。
- カスパーゼ発現セルの上にカーソルを置き、ピクセル値に注釈を付けます。
- 背景の上にカーソルを置き、ピクセル値に注釈を付けます。
- テストパラメータ
- 明るさとコントラストのインターフェースに移動します。
- [ 選択] をクリックします。
- 表示される最小値(カスパーゼ発現セルの注釈付きピクセル値)を差し込みます。
- 最大表示値(背景の注釈付きピクセル値)を差し込みます。
- OK をクリックします。
- すべてのチャンネルに対して手順4.8〜4.9を繰り返します。
- 盲検組織からランダムな画像を選択してパラメータをテストします。
注意: 明るさとコントラストのパラメータは、背景値が他の画像に対して適切でない場合にのみ編集してください。 - パラメータを設定したら、画像ファイルを開き、Zスタックを圧縮します。
- カスパーゼチャネルとイソレクチン、血管マーカーチャネルの明るさとコントラストのパラメーターを追加します。
- ポイントツールを使用して、カスパーゼ発現を伴う血管マーカーの共局在を陽性領域の読み出しとして使用して、血管陽性領域の数を定量化します。
- 手順4.14を繰り返しますが、ニューロン陽性領域のマーカーとしてHoechstを使用します。
- 画像ごとにスプレッドシートの値に注釈を付けます。
- セクションごとに値を平均します。
- セクション値を平均します-これは目ごとの読み出しになります。
5.内皮細胞カスパーゼ-9の関連性の遺伝的確認
- RVO7に供したCasp9FL/FL-VECad-CreERT2マウスから得られた網膜を使用する。
- 上記のセクション2で説明したように、カスパーゼ-9(欠失したカスパーゼ)、カスパーゼ-7(下流のエフェクターカスパーゼ)、血管マーカー、およびDAPIの網膜を免疫染色します。
- 上記のセクション3および4で説明したように、画像化および定量化します。
6. RVOにおけるカスパーゼ-9の標的化
- RVOを施したマウスから、カスパーゼ-9阻害剤Pen1-XBir3を7と同様に眼に局所塗布して眼から眼を得る。
- 上記のセクション2で説明したように、カスパーゼ-7(下流エフェクターカスパーゼ)、血管マーカー、およびDAPIの網膜を免疫染色します。
- 上記のセクション3および4で説明したように、画像化および定量化します。
結果
記載されたプロトコルは、ユーザが網膜組織におけるカスパーゼ−9レベルを分析および定量化することを可能にする。さらに、カスパーゼ-9および下流の基質をさらに同定、検証、および特異的に標的とするためのツールを提示します。要約されたステップにより、蛍光顕微鏡写真におけるカスパーゼレベルと細胞特異性の定量化可能な分析が可能になります。すべての図は、代表的な顕微鏡写真と、損傷していない1日P-RVO網膜断面の全網膜、内皮細胞、およびニューロンにおける示されたカスパーゼレベルの定量を示しています。網膜断面は、ヘキストで染色した場合、網膜神経節層(RGL)、内顆粒層(INL)、および外顆粒層(ONL)の網膜核の視覚化を可能にします。さらに、網膜血管は、網膜網状層またはRGLとINLの間、およびINLとONLの間に見える。血管の組織学的性質のために、網膜が切片化されると、血管は切断されて分離しているように見え、網状層を供給します。 図2 は、カスパーゼ-9を高度に調節された1日P-RVOとして識別しています。 図3 は、誘導性内皮細胞ノックアウトマウスを用いて内皮カスパーゼ−9の機能的関連性を検証した。 図4 は、活性型カスパーゼ−9を標的とすることが、カスパーゼ−9−カスパーゼ−7の下流標的の誘導を薬理学的に遮断することを示す。このプロトコルは、カスパーゼの細胞局在およびカスパーゼが発現するニューロン網膜層を識別する。

図1:網膜イメージングスキーム 。 (A)顕微鏡スライドへの網膜切片の推奨配置。(B)網膜の画像領域の概要。(C)20倍対物レンズでの網膜視野の表現。網膜層:RGL =網膜神経節層、INL =内顆粒層、ONL =外顆粒層。 この図の拡大版を表示するには、ここをクリックしてください。
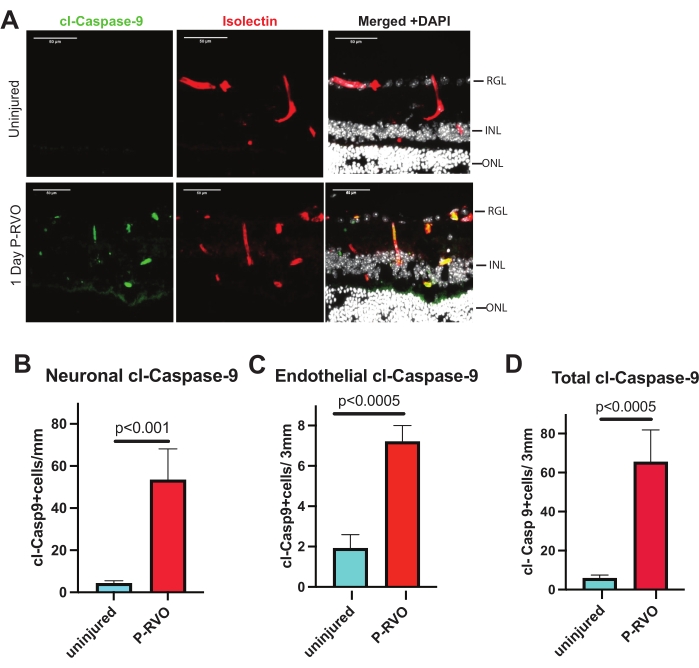
図2:RVOは内皮細胞およびニューロンにおいてカスパーゼ-9を誘導する。 (A)cl-カスパーゼ-9 1:800(緑)、イソレクチン1:200(赤)、およびDAPI(白)で染色された無傷および1日P-RVOの代表的な網膜断面。(B)cl-カスパーゼ-9によるニューロン数の定量(抗体の詳細については 、材料の表 を参照)。(C)cl-カスパーゼ-9による内皮細胞数の定量。(D)cl-カスパーゼ-9を発現する細胞の総数。無傷、n = 6;1日P-RVO、n = 5。エラーバーはSEM±平均値を表します。一方向分散分析、フィッシャーのLSDテスト。スケールバー = 50 μm。 この図の拡大版を表示するには、ここをクリックしてください。
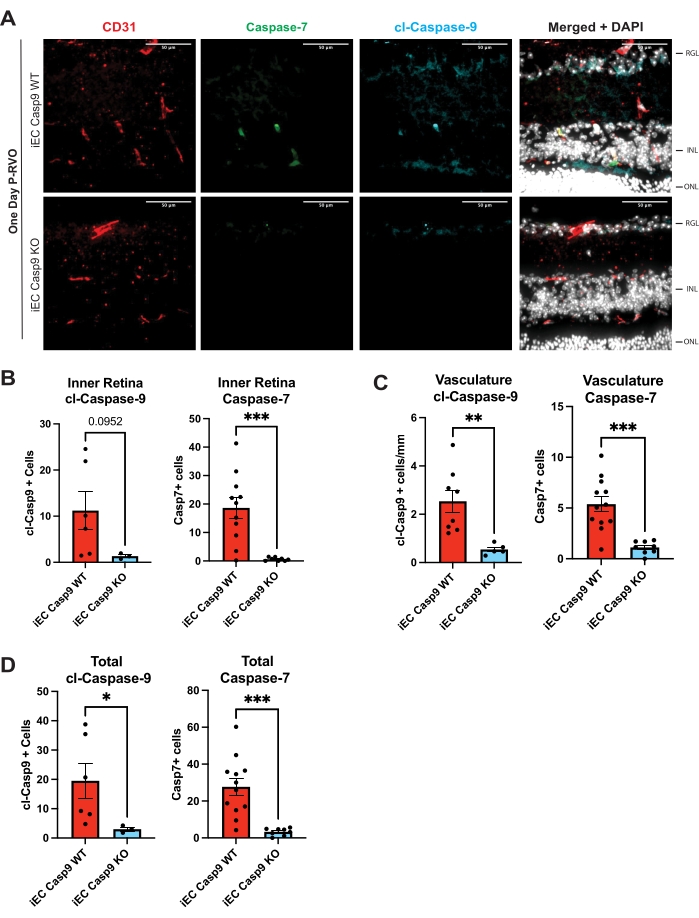
図3:内皮カスパーゼ-9の内皮細胞欠失は、カスパーゼ-7のRVO誘導をブロックします。 (A)カスパーゼ-7(緑)、cl-カスパーゼ-9(青)、CD31、血管マーカー(赤)、およびDAPI(白)で染色したiEC Casp9WTおよびiEC Casp9KO同腹仔マウスの代表的な網膜断面。(B)cl-カスパーゼ-9およびカスパーゼ-7による網膜内膜の細胞数の定量化。(C)cl-カスパーゼ-9およびカスパーゼ-7による内皮細胞の数の定量。(d)cl-カスパーゼ-9またはカスパーゼ-7を発現する細胞の総数。iEC Casp9WT, n = 6-12;iEC Casp9KO, n = 3-8.エラーバーはSEM±平均値を表します。一方向分散分析、フィッシャーのLSDテスト。スケールバー = 50 μm。 この図の拡大版を表示するには、ここをクリックしてください。

図4:カスパーゼ-9活性の阻害は、カスパーゼ-7発現P-RVOを阻害する。 (A)カスパーゼ-7(緑)、イソレクチン(赤)、およびDAPI(白)で染色されたPen1-XBIR3で治療または未治療の無傷および1日P-RVOからの代表的な網膜断面。(B)カスパーゼ-7による内皮細胞数の定量。(C)カスパーゼ-7による白血球数の定量。(D)カスパーゼ-7によるニューロン層あたりのニューロン数の定量化。(e)カスパーゼ7を発現する細胞の総数。無傷のPen1生理食塩水、n = 6;無傷のペン1-XBIR3、n = 5;1日P-RVOペン1生理食塩水、n = 5;1 日 P-RVO ペン1-XBIR3, n = 3.エラーバーはSEM±平均値を表します。一方向分散分析、フィッシャーのLSDテスト。略語:RGL =網膜神経節層、INL =内顆粒層、およびONL =外顆粒層。スケールバー = 50 μm。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
カスパーゼは、細胞死と炎症における役割について最もよく研究されているプロテアーゼの多員ファミリーです。しかし、最近では、一部の家族についてさまざまな非死亡機能が発見されています4,5。カスパーゼ機能に関する私たちの理解の多くは、細胞培養の研究とヒトの病気からの推論データに由来しています。疾患においてカスパーゼの異常な誘導、活性化、または不活性化があることは認識されているが、カスパーゼが疾患の病状を引き起こしているかどうかを機能的に決定することは困難であった。特定のカスパーゼを評価するために使用される多くのツールは、複数のファミリーメンバーを検出し、これらの試薬で得られたデータの機能的関連性を損なう17。ここでは、網膜を例に、複雑な組織のカスパーゼを研究するためのプロトコルを提供します。神経系では、カスパーゼ発現は出生前と出生後にダウンレギュレーションされます。これにより、疾患モデルにおけるカスパーゼレベルの変化をテストするための特異的抗体の使用が可能になります。
プロトコルの焦点は画像処理と分析にありますが、この技術の成功は、データの一貫性、妥当性、信頼性を確保するためのIHCと顕微鏡イメージングだけでなく、慎重な組織調製にも依存しています。データセット全体を画像化するために同じパラメータを使用するように注意する必要があります。低品質の画像、低コントラスト、ぼやけた焦点は、信頼できるデータを提供しません。網膜のP-RVO領域を切片化してイメージングする場合、これらの領域はアーチファクトを引き起こす可能性があるため、裂け目や折り畳みを避ける必要があります。直接的な損傷のある領域も避ける必要があります。イメージングを行う研究者は、組織の治療を盲検化する必要があります。分析のために、治療群を知らされていない2人の独立した観察者が分析を実行することをお勧めします。さらに、一次マウス抗体は血管系に非特異的に結合するため、マウス損傷モデルでは一次マウス抗体を使用しないでください。別の方法は、直接結合した一次抗体を使用することです。
細胞計数に対する別のアプローチは、発現面積の百分率の定量化である。これは、細胞計数が不可能な場合(例えば、カスパーゼ発現がニューロン突起または光受容体セグメントに局在している場合)に使用することができる。中枢網膜および末梢網膜は、さまざまな損傷モデルで異なる影響を受けます。この方法は、異なる網膜領域を特異的に分析するように適合させることができる。BRVOを実行する場合は、目の負傷した部分からセクションを選択する必要があります。このプロトコルは、カスパーゼが発現している場所を特定するために、さまざまな細胞マーカーの染色も提供します。
この方法の制限には、所与の細胞における高レベルのカスパーゼシグナルと低レベルのカスパーゼシグナルを区別しないことが含まれる。さらに、核染色を使用してニューロン層を特定することは便利ですが、ニューロンの発現を明確に示すものではありません(グリアと白血球もこれらの層に存在します)。追加のニューロンマーカーを使用して、ニューロン発現を検証することができます。カスパーゼ発現を評価するために利用できるさまざまな抗体もあります。これらは、全長/切断(CL)カスパーゼ-9、自己切断カスパーゼ-9、およびカスパーゼ-3切断カスパーゼ-9の抗体が存在するヒトカスパーゼ-9に対して最もよく定義されています。
IHCシグナルの平均強度は、定量化方法として頻繁に報告されています。ただし、バックグラウンドノイズや赤血球からの自己蛍光は、不正確な結果をもたらす可能性があります。細胞特異的定量により、バックグラウンド、非特異的染色、および自家蛍光の決定と識別が可能になります。
このプロトコルは、個々のカスパーゼの発現における組織全体の変化、内皮細胞などの特定の細胞型における発現の変化、および異なる網膜層のニューロンなどの特定の位置における特定の細胞型の変化を測定するために使用することができる。この柔軟性により、実験者は、疾患状態が個々のカスパーゼレベルをどのように変化させているかを照会することができます。既存/代替法では、カスパーゼシグナル伝達の半定量的比較にウェスタンブロッティング分析を使用しますが、この方法では、このプロトコルが達成する細胞局在の明確な分離は提供されません。特に、 図3Dにおいて、カスパーゼ-9阻害は、RGLと比較して、INLおよびONLにおけるニューロンカスパーゼ-9を減少させるのにより効果的である。この種の解決は、他の方法で達成することは困難です。さらに、組織全体を生化学的に分析する場合、複雑な組織にはさまざまな細胞タイプがあるため、変化するカスパーゼのレベルが低すぎて検出できない場合があります。
ユーザーが検証しなければならない抗体は、プローブされたカスパーゼに特異性を提供します。カスパーゼはカスケードで作用する可能性があります(すなわち、エフェクターを活性化し、その後、死、炎症、細胞シグナル伝達などの結果につながります)。このプロトコルは、損傷後のさまざまな時点で収集されたサンプルで使用できます。ここに示す例では、サンプルは RVO 後の異なるタイミングで収集されます。以前に発表された研究では、カスパーゼ-9がRVO7後1時間以内に増加したことがわかっており、さらなる検証と標的化研究につながります。内皮カスパーゼ-9をRVO病態の潜在的なドライバーとして特定した後、内皮カスパーゼ-9を検証するために誘導可能な内皮細胞カスパーゼ-9KOを有するマウスを使用した。誘導性細胞特異的カスパーゼKOマウスの使用は、別のレベルの特異性を提供し、構成的カスパーゼ-9KO18で見られる発生死を回避する。また、構成的カスパーゼKOマウス19において起こることが示されている他の家族メンバーにおける代償的変化を回避する。さらに、KOマウスの細胞特異的誘導性カスパーゼを用いることにより、カスパーゼが組織内の病態を調節している細胞型の同定が可能になる。このプロトコルは、RVOの活性カスパーゼ-9を標的とする治療アプローチの有効性を調べる手順も提供します。このアプローチは、脳を含む他の組織にも適用できます。
開示事項
著者らは、以下の競合する利益を宣言します:CMTは、以下の特許出願US20200164026、US20190142915、およびUS20150165061を持っています。CMTとS.S.は米国20140024597特許出願を行っています。C.M.T.、A.M.P.、およびM.I.A.は特許出願US2020058683を持っています。CMTとY.Y.J.は特許出願WO2018013519を持っています。M.I.AとC.M.Tは、ニューヨーク市のコロンビア大学の評議員会による特許出願WO/2020/223212に発明者としてリストされています。残りの著者は、競合する利益を宣言しません。
謝辞
この研究は、国立科学財団大学院研究フェローシッププログラム(NSF-GRFP)助成金DGE-1644869および国立衛生研究所(NIH)の国立神経障害および脳卒中研究所(NINDS)、賞番号F99NS124180 NIH NINDSダイバーシティスペシャライズドF99(CKCOへ)、国立眼科研究所(NEI)5T32EY013933(AMPへ)、国立神経障害および脳卒中研究所(RO1 NS081333、 R03 NS099920からCMT)、および国防総省の陸軍/空軍(DURIPからCMT)。
資料
| Name | Company | Catalog Number | Comments |
| anti-Caspase-7 488 | Novus Biologicals | NB-56529AF488 | use at 1:150 |
| anti-cl-Caspase-9 | Cell Signaling | 9505-S | use at 1:800 |
| anti-CD31 | BD Pharmingen | 553370 | use at 1:50 |
| Confocal Spinning Disc Microscope | Biovision | ||
| FIJI 2.3.0 | open source | ||
| Fluormount G | Fisher | 50-187-88 | |
| Forcep | Roboz | RS-5015 | |
| iCasp9FL/FL X VECad-CreERT2 mice | lab generated | see Avrutsky 2020 | |
| Isolectin (594, 649) | Vector | DL-1207 | use at 1:200 |
| Ketamine Hydrochloride | Henry Schein | NDC: 11695-0702-1 | |
| Perfusion pump | Masterflex | ||
| Pen1-XBir3 | lab generated | see Avrutsky 2020 | |
| Prism 9.1 | GraphPad | ||
| Tissue-Tek O.C.T. | Fisher | 14-373-65 | |
| Vis-a-View 4.0 | Visitron Systems | ||
| Xylazine | Akorn | NDCL 59399-110-20 |
参考文献
- Van Opdenbosch, N., Lamkanfi, M. Caspases in cell death, inflammation, and disease. Immunity. 50 (6), 1352-1364 (2019).
- Ramirez, M. L. G., Salvesen, G. S. A primer on caspase mechanisms. Seminars in Cell & Developmental Biology. 82, Academic Press. 79-85 (2018).
- Troy, C. M., Jean, Y. Y. Caspases: therapeutic targets in neurologic disease. Neurotherapeutics. 12 (1), 42-48 (2015).
- Avrutsky, M. I., Troy, C. M. Caspase-9: a multimodal therapeutic target with diverse cellular expression in human disease. Frontiers in Pharmacology. 12, 1728(2021).
- Fuchs, Y., Steller, H. Programmed cell death in animal development and disease. Cell. 147 (4), 742-758 (2011).
- Troy, C. M., Akpan, N., Jean, Y. Y. Regulation of caspases in the nervous system: implications for functions in health and disease. Progress in Molecular Biology and Translational Science. 99, 265-305 (2011).
- Avrutsky, M. I., et al. Endothelial activation of caspase-9 promotes neurovascular injury in retinal vein occlusion. Nature Communications. 11 (1), 3173(2020).
- Colon Ortiz, C., Potenski, A., Lawson, J. M., Smart, J., Troy, C. M. Optimization of the retinal vein occlusion mouse model to limit variability. Journal of Visualized Experiments. (174), e62980(2021).
- Tisch, N., et al. Caspase-8 modulates physiological and pathological angiogenesis during retina development. The Journal of Clinical Investigation. 129 (12), 5092-5107 (2019).
- Chi, W., et al. HMGB1 promotes the activation of NLRP3 and caspase-8 inflammasomes via NF-kappaB pathway in acute glaucoma. Journal of Neuroinflammation. 12, 137(2015).
- Thomas, C. N., et al. Caspase-2 mediates site-specific retinal ganglion cell death after blunt ocular injury. Investigative Ophthalmology & Visual Science. 59 (11), 4453-4462 (2018).
- Akpan, N., et al. Intranasal delivery of caspase-9 inhibitor reduces caspase-6-dependent axon/neuron loss and improves neurological function after stroke. Journal of Neuroscience. 31 (24), 8894-8904 (2011).
- London, A., Benhar, I., Schwartz, M. The retina as a window to the brain-from eye research to CNS disorders. Nature Reviews Neurology. 9 (1), 44-53 (2013).
- Song, P., Xu, Y., Zha, M., Zhang, Y., Rudan, I. Global epidemiology of retinal vein occlusion: a systematic review and meta-analysis of prevalence, incidence, and risk factors. Journal of Global Health. 9 (1), 010427(2019).
- Akpan, N., et al. Intranasal delivery of caspase-9 inhibitor reduces caspase-6-dependent axon/neuron loss and improves neurological function after stroke. The Journal of neuroscience. 31 (24), 8894-8904 (2011).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564(2012).
- McStay, G. P., Salvesen, G. S., Green, D. R. Overlapping cleavage motif selectivity of caspases: implications for analysis of apoptotic pathways. Cell Death & Differentiation. 15 (2), 322-331 (2007).
- Kuida, K., et al. Reduced apoptosis and cytochrome c-mediated caspase activation in mice lacking caspase 9. Cell. 94 (3), 325-337 (1998).
- Troy, C. M., et al. Death in the balance: alternative participation of the caspase-2 and -9 pathways in neuronal death induced by nerve growth factor deprivation. Journal of Neuroscience. 21 (14), 5007-5016 (2001).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved