Method Article
Количественная оценка иммуноокрашенной каспазы-9 в ткани сетчатки
* Эти авторы внесли равный вклад
В этой статье
Резюме
Здесь представлен подробный протокол иммуногистохимии для идентификации, проверки и нацеливания функционально значимых каспаз в сложных тканях.
Аннотация
Семейство каспаз, как известно, опосредует многие клеточные пути за пределами гибели клеток, включая дифференцировку клеток, аксональное поиск путей и пролиферацию. С момента идентификации семейства протеаз гибели клеток ведется поиск инструментов для выявления и расширения функции конкретных членов семьи в развитии, здоровье и болезненных состояниях. Тем не менее, многие из коммерчески доступных в настоящее время инструментов каспазы, которые широко используются, не являются специфическими для целевой каспазы. В этом отчете мы описываем подход, который мы использовали для идентификации, проверки и нацеливания каспазы-9 в нервной системе с использованием нового ингибитора и генетических подходов с иммуногистохимическими показаниями. В частности, мы использовали нейронную ткань сетчатки в качестве модели для идентификации и проверки наличия и функции каспаз. Этот подход позволяет исследовать специфические апоптотические и неапоптотические функции каспазы-9 клеточного типа и может быть применен к другим сложным тканям и каспазам, представляющим интерес. Понимание функций каспаз может помочь расширить современные знания в клеточной биологии, а также может быть полезным для выявления потенциальных терапевтических целей из-за их участия в заболевании.
Введение
Каспазы представляют собой семейство протеаз, которые регулируют гибель клеток развития, иммунные реакции и аберрантную гибель клеток при заболевании 1,2. Хотя хорошо известно, что члены семейства каспазы индуцируются при различных нейродегенеративных заболеваниях, понимание того, какая каспаза приводит к патологии заболевания, является более сложным3. Такие исследования требуют инструментов для выявления, характеристики и подтверждения функции отдельных членов семейства каспазы. Анализ соответствующих отдельных каспаз важен как с механистической, так и с терапевтической точки зрения, поскольку в литературе есть многочисленные исследования, свидетельствующие о различных ролях каспаз 4,5. Таким образом, если цель состоит в том, чтобы нацелиться на каспазу при заболевании для терапевтической пользы, крайне важно иметь конкретное нацеливание на соответствующего члена (членов) семьи. Традиционные методы определения уровней каспазы в тканях включают вестерн-блоттинг и ферментативный и флуорометрический подходы 3,6. Однако ни одна из этих мер не позволяет определить специфические для клеток уровни каспазы, и в некоторых сценариях расщепленные каспазы часто не могут быть обнаружены традиционными мерами анализа белка. Известно, что каспазы могут играть различные апоптотические и неапоптотические роли в одной и той же ткани7, поэтому для точного понимания путей развития и заболевания необходима тщательная характеристика клеточных специфических уровней каспазы.
Данное исследование показывает активацию и функцию каспазы в модели нейрососудистой гипоксии-ишемии - окклюзии вен сетчатки (RVO)7,8. В сложной ткани, такой как сетчатка, существует несколько типов клеток, которые могут быть затронуты гипоксией-ишемией, индуцированной в RVO, включая глиальные клетки, нейроны и сосудистую систему7. У взрослой мышиной сетчатки очень мало выраженности каспаз, проявляющихся в здоровой ткани, что измерено иммуногистохимией (IHC)7, но это не так во время развития9 или в моделях заболевания сетчатки10,11. IHC - это метод, который хорошо зарекомендовал себя в биомедицинских исследованиях и позволил валидировать заболевания и патологические цели, идентифицировать новые роли посредством пространственной локализации и количественной оценки белков. В тех случаях, когда расщепленные продукты каспазы не могут быть обнаружены с помощью вестерн-блоттинга или флуорометрического анализа, а также конкретного расположения клеток отдельных каспаз или опроса сигнальных путей каспазы через локализацию, следует использовать IHC.
Чтобы определить каспазу (каспазу), функционально значимую в RVO, IHC использовали с валидированными антителами к каспазам и клеточным маркерам. Предыдущие исследования, проведенные в лаборатории, показали, что каспаза-9 быстро активировалась в модели ишемического инсульта и ингибирования каспазы-9 высокоспецифичным ингибитором, защищенным от нейрональной дисфункции и смерти12. Поскольку сетчатка является частью центральной нервной системы (ЦНС), она служит модельной системой для запроса и дальнейшего изучения роли каспазы-9 в нейрососудистых повреждениях13. С этой целью мышиная модель RVO была использована для изучения клеточного специфического местоположения и распределения каспазы-9 и ее влияния на нейрососудистое повреждение. RVO является распространенной причиной слепоты у людей трудоспособного возраста, которая является результатом повреждения сосудов14. Было установлено, что каспаза-9 экспрессировалась неапоптотическим способом в эндотелиальных клетках, но не в нейронах.
Как ткань, сетчатка имеет преимущество в том, что она визуализируется либо как плоская гора, что позволяет оценить сосудистые сети, либо как поперечные сечения, которые выделяют нейронные слои сетчатки. Количественная оценка экспрессии белка каспазы в поперечных сечениях обеспечивает контекст, в отношении которого каспаза потенциально имеет решающее значение для нейронной связности сетчатки и функции зрения путем идентификации локализации каспазы (каспазы) в сетчатке. После идентификации и валидации нацеливание на интересующую каспазу достигается с использованием индуцируемой клеточной специфической делеции идентифицированной каспазы. Для потенциальных терапевтических исследований актуальность интересующих каспаз была проверена с использованием специальных инструментов для ингибирования активированной каспазы. Для каспазы-9 использовался клеточный проникающий высокоселективный ингибитор 7,15, Pen1-XBIR3. Для этого отчета были использованы 2-месячный мужской штамм C57BL/6J и тамоксифен-индуцируемый эндотелиальная каспаза-9 нокаут (iEC Casp9KO) с фоном C57BL/6J. Эти животные подвергались воздействию мышиной модели RVO, а C57BL/6J обрабатывали селективным ингибитором каспазы-9 Pen1-XBir3. Описанная методика может быть применена к другим моделям заболевания в центральной и периферической системах 7,15.
протокол
Этот протокол следует заявлению Ассоциации исследований в области зрения и офтальмологии (ARVO) для использования животных в офтальмологических и зрительных исследованиях. Эксперименты на грызунах были одобрены и контролировались Институциональным комитетом по уходу за животными и их использованию (IACUC) Колумбийского университета.
1. Подготовка ткани сетчатки и криосечение
- Усыпляют животных введением внутрибрюшинной анестезии (кетамин (80-100 мг/кг) и ксилазин (5-10 мг/кг)) и перфируют мышей, подвергшихся воздействию RVO (см.8 для деталей), 4% параформальдегидом (PFA) с помощью перистальтического насоса.
ПРИМЕЧАНИЕ: Ущипните животное, чтобы подтвердить глубину анестезии, прежде чем приступать к эвтаназии и перфузии. Подробности о перфузии можно найти в16. - Соберите глаза путем тщательной энуклеации с помощью щипцов и поместите глобус в 1 мл 4% PFA. Оставьте глаза на ночь при температуре 4 °C. Промыть глаза три раза в течение 10 мин, добавив 1 мл 1x PBS и поместив их в шейкер.
- Погружайте глаза в 1 мл 30% сахарозы на 3 дня, пока они не осядут на дно трубки, что указывает на всасывание сахарозы.
- Наполните глаза смесью оптимальной температуры резания с помощью шприца 30 Г до тех пор, пока глаз не станет округлым (примерно 50 мкл).
- Вставьте глаза в криомольд с оптимальной температурой резания до тех пор, пока глаза не будут закрыты, и замерзните при -80 °C до готовности к криосекции.
- Секция накладывала глаза на 20 мкм на стеклянные слайды с помощью криостата.
- Снимите блок оптимальной температуры резки с криомольда.
- Поместите его на криостатный патрон, добавив оптимальный компаунд температуры резки и поместив блок на патрон. Оставьте его внутри криостата, пока он не замерзнет.
- Продолжайте разрезать блок на 20 мкм до тех пор, пока не будет видна ткань сетчатки.
ПРИМЕЧАНИЕ: Это может быть подтверждено с помощью светового микроскопа с 30-кратным увеличением (3x объектив, 10x окуляры). Ткани можно отличить от СРЕДЫ OCT по цвету и форме. - Соберите ткань сетчатки в слайды микроскопа серией из четырех секций на слайд.
ПРИМЕЧАНИЕ: Предлагаемое размещение сечений сетчатки см. на рисунке 1А .
- Пометьте слайды идентификатором, который деидентифицирует лечение и генотип.
- Храните слайды при температуре -20 °C до окрашивания.
2. Иммуногистохимия
ПРИМЕЧАНИЕ: Используйте фиксированную криоконсервированную ткань для иммуногистохимии для поддержания морфологии клеток. Выбирайте участки, которые находятся на уровне изображений оптической когерентной томографии (ОКТ), полученных in vivo7. Используйте первые две серии слайдов, собранных из криостата или участков от 150 мкм в ткань сетчатки.
- Поместите горки в темную и влажную скользящую камеру.
- Пермеабилизация и блокировка: Промыть поперечные сечения сетчатки 300 мкл 1x PBS в течение 5 минут, чтобы удалить OCT и выбросить после.
- Пермеабилизируют ткань путем добавления 300 мкл 1x PBS с 0,1% Triton X-100 в течение 2 ч при комнатной температуре (RT) и выбрасывают после.
- Блокируйте ткань, добавляя 300 мкл блокирующего буфера (10% нормальной козьей сыворотки (NGS), 1% бычьего сывороточного альбумина (BSA) в 1x PBS, отфильтрованный) и оставьте на ночь при 4 °C.
- Первичные антитела: Разбавляют первичные антитела в блокирующем буфере. Первичные используемые антитела включают анти-cl-каспазу-9 в 1:800, анти-CD31 в 1:50 и антикаспазу-7-488 (прямо меченое антитело) в 1:150.
ПРИМЕЧАНИЕ: Следуйте рекомендациям производителя для соответствующего разведения первичных антител.- Вылейте блокирующий буфер с участков и нанесите 100 мкл коктейля первичных антител на слайды сетчатки.
- Инкубировать поперечные сечения в течение ночи при 4 °C.
- Промыть секции четыре раза в течение 5 мин с 300 мкл 1x PBS.
ПРИМЕЧАНИЕ: Если участки тканей очень хрупкие, промывки следует удалять с помощью капиллярного действия, прикладывая ткань к углу слайда, чтобы избежать смещения участков сетчатки. - Чтобы избежать перекрестной маркировки первичных антител, выращенных у одного и того же вида-хозяина, завершите окрашивание вторичными антителами перед применением непосредственно меченых антител.
- Вторичные антитела: Разбавляют вторичные антитела в блокирующем буфере в концентрации 0,1%. Например, для обнаружения анти-cl-каспазы-9, антитела, выращенного у кролика, используют козу-анти-кролик-568 вторичную.
- Нанесите 200 мкл коктейля вторичных антител на сетчатку.
- Инкубируют ткань в течение 2 ч при РТ.
- Промыть секции четыре раза в течение 5 мин с 300 мкл 1x PBS.
- Окрашивают ядра в течение 5 мин 300 мкл DAPI в разведении 0,02%.
- Мойте один раз в течение 5 мин с 300 мкл 1x PBS.
- Поместите крышку на участки сетчатки, используя 500 мкл среды fluoromount-G, которая сохраняет флуоресцентный сигнал, и осторожно поместите крышку на верхнюю часть слайда, избегая пузырьков.
3. Конфокальная визуализация
- Получение изображений окрашенных участков с помощью конфокальной микроскопии.
- Включите конфокальный микроскоп.
- Поместите слайд в рабочую область.
- Отрегулируйте фокус, чтобы четко видеть участок сетчатки.
ПРИМЕЧАНИЕ: Возьмите не менее четырех изображений на секцию и четыре секции на сетчатку. См. схему визуализации сетчатки для предлагаемых областей визуализации (рисунок 1B, C).
- Изображение каспазы, сосудистого и ядерного окрашивания с помощью конфокального микроскопа, который имеет Z-стек захвата, с использованием объектива 20x или 40x.
ПРИМЕЧАНИЕ: Параметры визуализации и настройка программного обеспечения должны быть постоянными для всех изображений в эксперименте. Цель 20x обеспечивает обзор слоев сетчатки, которые четко определены ядерным окрашиванием. Объектив 40x обеспечивает больше деталей сотовой связи.- Установите соответствующее время экспозиции и интенсивности лазера для каждого канала, щелкнув настройки получения.
- Установите Z-стек для визуализации всего раздела, щелкнув Z-серию , и установите параметры вверх и вниз, чтобы покрыть глубину ткани.
- Сохраните изображения в соответствии с маскированным идентификатором, назначенным во время криосекции.
4. Количественная оценка уровней каспазы
- Перетащите файлы изображений 405, 470, 555 и 640 каналов на консоль FIJI.
- Щелкните Изображение > Цвет > Объединить каналы.
- Назначьте цвета файлам следующим образом: красный — 555, зеленый — 470, серый — 405, голубой — 640.
- Сожмите Z-стек, щелкнув Image > Stack > Z Project.
- Щелкните Тип проекции: Максимальная интенсивность.
- Откройте интерфейс каналов, щелкнув Инструмент «Изображение > цветовые каналы».
- Откройте интерфейс яркости и контрастности .
- Выберите параметры для каждого канала.
- Перейдите в раздел Каналы и выберите один канал.
- Поместите курсор поверх ячейки, выраженной в каспазе, и аннотируйте значение пикселя.
- Поместите курсор поверх фона и аннотируйте значение пикселя.
- Параметры теста
- Перейдите к интерфейсу Яркость и контрастность.
- Нажмите кнопку Выбрать.
- Подключите минимальное отображаемое значение (аннотированное значение пикселя экспрессированной ячейки каспазы).
- Подключите максимальное отображаемое значение (аннотированное значение пикселя фона).
- Нажмите кнопку ОК.
- Повторите шаги 4.8–4.9 для всех каналов.
- Проверьте параметры, выбрав случайные изображения из слепой ткани.
ПРИМЕЧАНИЕ: Редактируйте параметры яркости и контрастности только в том случае, если значение фона недостаточно для других изображений. - После установки параметров откройте файлы изображений и сожмите Z-стек.
- Добавьте параметры яркости и контрастности для канала каспазы и изолектина, сосудистого маркерного канала.
- Используйте точечный инструмент для количественной оценки количества сосудистых положительных областей с использованием колокализации сосудистого маркера с экспрессией каспазы в качестве считывания положительных областей.
- Повторите шаг 4.14, но используя Hoechst в качестве маркера нейрональных положительных областей.
- Аннотирование значений в электронной таблице для каждого изображения.
- Усредните значения по разделам.
- Усредните значения разделов - это будет считывание на глаз.
5. Генетическое подтверждение актуальности эндотелиальной клеточной каспазы-9
- Используйте сетчатку, полученную от мышей Casp9FL/FL-VECad-CreERT2, которые подвергались воздействию RVO7.
- Иммуноувлажнение сетчатки для каспазы-9 (удаленная каспаза), каспазы-7 (нисходящая эффекторная каспаза), сосудистых маркеров и DAPI, как описано выше в разделе 2.
- Изображение и количественная оценка, как описано выше в разделах 3 и 4.
6. Нацеливание на каспазу-9 в РВО
- Получают глаза от мышей, подвергшихся воздействию RVO, с последующим применением ингибитора каспазы-9 Pen1-XBir3 местно к глазам, как в7.
- Иммуноувлажнение сетчатки для каспазы-7 (нисходящей эффекторной каспазы), сосудистых маркеров и DAPI, как описано выше в разделе 2.
- Изображение и количественная оценка, как описано выше в разделах 3 и 4.
Результаты
Описанный протокол позволяет пользователю анализировать и количественно оценивать уровни каспазы-9 в ткани сетчатки. Кроме того, в нем представлены инструменты для дальнейшей идентификации, проверки и, в частности, нацеливания на каспазу-9 и последующие субстраты. Обобщенные этапы позволяют количественно проанализировать уровни каспазы и клеточную специфичность в флуоресцентных микрофотографиях. Все рисунки показывают репрезентативные микрофотографии и количественную оценку указанных уровней каспазы в общей сетчатке, эндотелиальных клетках и нейронах в неповрежденных и 1-дневных поперечных сечениях сетчатки P-RVO. Поперечное сечение сетчатки позволяет визуализировать ядра сетчатки в ганглиозном слое сетчатки (RGL), внутреннем ядерном слое (INL) и внешнем ядерном слое (ONL) при окрашивании Hoechst. Кроме того, кровеносные сосуды сетчатки видны в плексиформных слоях сетчатки или между RGL и INL, а также между INL и ONL. Из-за гистологической природы кровеносных сосудов, когда сетчатка разрезается, кровеносные сосуды будут выглядеть как разъединенные и отдельные, снабжая плексиформные слои. На рисунке 2 каспаза-9 обозначена как строго регулируемая 1-дневная P-RVO. На рисунке 3 подтверждается функциональная значимость эндотелиальной каспазы-9 с помощью индуцируемых мышей с нокаутом эндотелиальных клеток. На рисунке 4 показано, что нацеливание на активную каспазу-9 фармакологически блокирует индукцию последующей мишени каспазы-9-каспазы-7. Протокол идентифицирует клеточную локализацию каспаз и нейронных слоев сетчатки, в которых экспрессируются каспазы.

Рисунок 1: Схема визуализации сетчатки. (А) Рекомендуется размещение срезов сетчатки в слайде микроскопа. (B) Обзор областей визуализации в сетчатке. (C) Представление вида сетчатки при цели 20x. Слои сетчатки: RGL = ганглиозный слой сетчатки, INL = внутренний ядерный слой, ONL = внешний ядерный слой. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
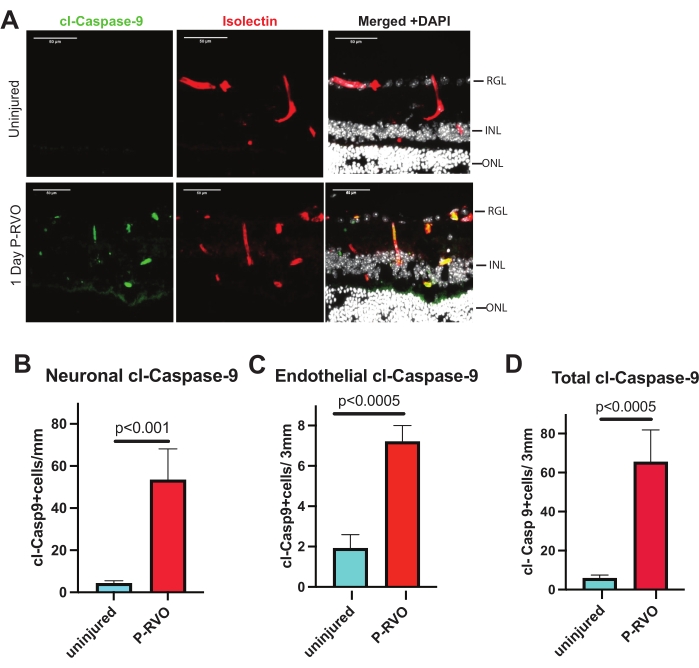
Рисунок 2: RVO индуцирует каспазу-9 в эндотелиальных клетках и нейронах. (A) Репрезентативные поперечные сечения сетчатки от неповрежденного и 1-дневного P-RVO окрашены cl-каспазой-9 1:800 (зеленый), изолектином 1:200 (красный) и DAPI (белый). (B) Количественная оценка числа нейронов с cl-каспазой-9 (см. Таблицу материалов для получения подробной информации об антителах). (C) Количественная оценка числа эндотелиальных клеток с cl-каспазой-9. (D) Общее количество клеток, экспрессирующих cl-каспазу-9. Неповрежденный, n = 6; 1-дневный P-RVO, n = 5. Полосы ошибок представляют среднее значение ± SEM; Односторонняя ANOVA, тест Фишера на ЛСД. Шкала = 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
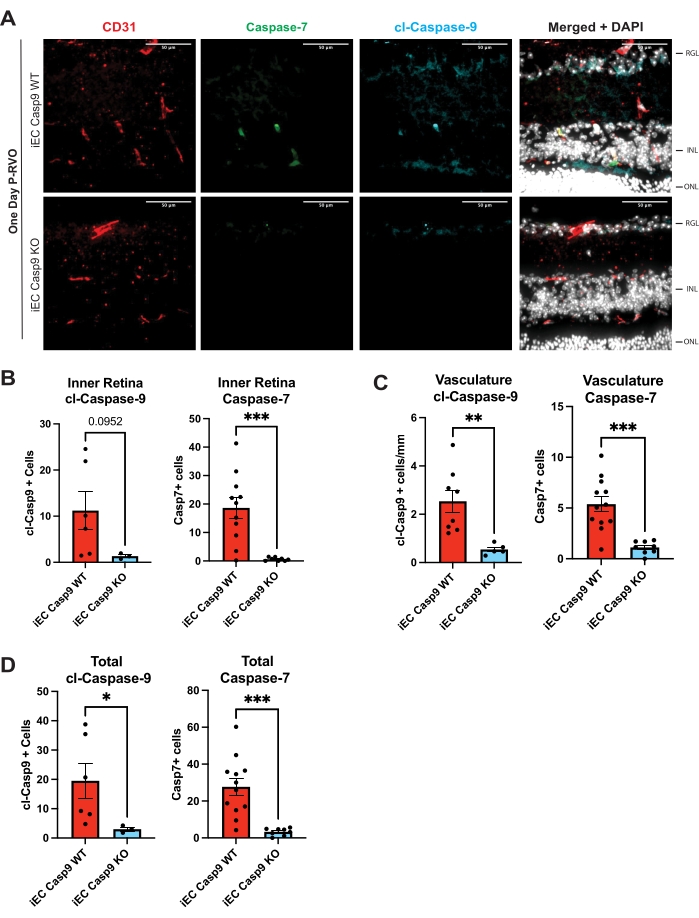
Рисунок 3: Эндотелиальная клеточная делеция эндотелиальной каспазы-9 блокирует RVO-индукцию каспазы-7. (A) Репрезентативные поперечные сечения сетчатки у iEC Casp9WT и iEC Casp9KO мышей-пометников 1-day P-RVO окрашены каспазой-7 (зеленый), cl-каспазой-9 (синий), CD31, сосудистым маркером (красный) и DAPI (белый). (B) Количественная оценка числа клеток во внутренней сетчатке с помощью cl-каспазы-9 и каспазы-7. (C) Количественная оценка числа эндотелиальных клеток с cl-каспазой-9 и с каспазой-7. (D) Общее число клеток, экспрессирующих cl-каспазу-9 или каспазу-7. iEC Casp9WT, n = 6-12; МЭК Касп9КО, n = 3-8. Полосы ошибок представляют среднее значение ± SEM; Односторонняя ANOVA, тест Фишера на ЛСД. Шкала = 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Ингибирование активности каспазы-9 ингибирует экспрессию каспазы-7 P-RVO. (A) Репрезентативные поперечные сечения сетчатки из неповрежденных и 1-дневные P-RVO, обработанные или необработанные Pen1-XBIR3, окрашенные каспазой-7 (зеленый), изолектином (красный) и DAPI (белый). (B) Количественная оценка числа эндотелиальных клеток с каспазой-7. (C) Количественная оценка количества лейкоцитов с каспазой-7. (D) Количественная оценка числа нейронов на нейронный слой с помощью каспазы-7. (E) Общее число клеток, экспрессирующих каспазу-7. Неповрежденный Pen1 Saline, n = 6; неповрежденный Pen1-XBIR3, n = 5; 1-дневный P-RVO Pen1 Saline, n = 5; 1-дневный P-RVO Pen1-XBIR3, n = 3. Полосы ошибок представляют среднее значение ± SEM; Односторонняя ANOVA, тест Фишера на ЛСД. Сокращения: RGL = ганглиозный слой сетчатки, INL = внутренний ядерный слой, и ONL = внешний ядерный слой. Шкала = 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Каспазы представляют собой многочленное семейство протеаз, наиболее изученных из-за их роли в гибели клеток и воспалении; однако в последнее время для некоторых членов семьи были выявлены различные функции, не связанные со смертью 4,5. Большая часть нашего понимания функции каспазы получена из работы в клеточной культуре и из выводных данных о заболеваниях человека. Хотя считается, что существует аберрантная индукция, активация или инактивация каспаз при заболевании, было сложно функционально определить, являются ли каспазы движущей патологией заболевания. Многие инструменты, используемые для оценки конкретных каспаз, обнаруживают несколько членов семьи, подрывая функциональную значимость данных, полученных с помощью этих реагентов17. Здесь мы приводим протокол для изучения каспаз в сложных тканях, используя в качестве примера сетчатку. В нервной системе экспрессия каспазы снижается до и послеродово. Это позволяет использовать специфические антитела для проверки изменений уровней каспазы в модели заболевания.
В то время как основное внимание в протоколе уделяется обработке и анализу изображений, успех метода также зависит от тщательной подготовки тканей, а также IHC и микроскопической визуализации для обеспечения согласованности, достоверности и надежности данных. Необходимо позаботиться об использовании одних и тех же параметров для изображения всего набора данных. Низкое качество изображений, низкая контрастность и размытая фокусировка не обеспечат надежных данных. При сечении и визуализации P-RVO областей сетчатки следует избегать разрывов и складок, поскольку эти области могут привести к артефактам. Следует также избегать областей прямого повреждения. Исследователь, выполняющий визуализацию, должен быть ослеплен к лечению ткани. Для анализа рекомендуется, чтобы два независимых наблюдателя, ослепленные группой лечения, выполнили анализ. Кроме того, первичные мышиные антитела не должны использоваться в моделях травм мышей, поскольку вторичные антитела неспецифично связываются с сосудистой системой. Альтернативой является использование непосредственно конъюгированных первичных антител.
Альтернативным подходом к подсчету клеток является количественная оценка процента площади экспрессии. Это может быть использовано, когда подсчет клеток невозможен (например, если экспрессия каспазы локализована в нейронных процессах или сегментах фоторецепторов). Центральная и периферическая сетчатка дифференцированно поражаются в различных моделях травм. Метод может быть адаптирован для специфического анализа различных областей сетчатки. Если выполняется БРВО, то участки следует выбирать из травмированного участка глаза. Протокол также предусматривает окрашивание различных клеточных маркеров для определения того, где экспрессируется каспаза.
Ограничения способа включают в себя то, что он не дифференцирует высокие и низкие уровни сигнала каспазы в данной клетке. Кроме того, использование ядерного пятна для идентификации нейронных слоев удобно, но не указывает окончательно на экспрессию нейронов (глия и лейкоциты также присутствуют в этих слоях). Дополнительные нейронные маркеры могут быть использованы для проверки экспрессии нейронов. Существует также множество антител, доступных для оценки экспрессии каспазы; они были лучше всего определены для человеческой каспазы-9, где есть антитела к полной длине / расщепленной (cl) каспазе-9, авторасщепленной каспазе-9 и каспазе-3-расщепленной каспазе-9.
Средняя интенсивность сигнала IHC часто сообщается в качестве метода количественной оценки. Однако фоновый шум или автофлуоресценция от красных кровяных клеток могут давать неточные результаты. Количественная оценка специфичных для клеток позволяет определять и различать фон, неспецифическое окрашивание и автофлуоресценцию.
Этот протокол может быть использован для измерения изменений в экспрессии отдельных каспаз в масштабах всей ткани, изменений в экспрессии в определенном типе клеток, таких как эндотелиальная клетка, и изменений в определенных типах клеток в определенных местах, таких как нейроны в различных слоях сетчатки. Эта гибкость позволяет экспериментатору задаваться вопросом, как болезненное состояние изменяет отдельные уровни каспазы. Существующие/альтернативные методы используют западный блоттинговый анализ для полуколичественного сравнения передачи сигналов каспазы, хотя методы не обеспечат четкого разделения клеточной локализации, которое дает этот протокол. Примечательно, что на рисунке 3D ингибирование каспазы-9 более эффективно при снижении нейрональной каспазы-9 в INL и ONL по сравнению с RGL. Такого рода решение трудно достичь другими методами. Кроме того, когда вся ткань анализируется биохимически, уровни каспаз, которые изменяются, могут быть слишком низкими, чтобы их можно было поднять, поскольку в сложной ткани существует много различных типов клеток.
Антитела, которые должны быть проверены пользователем, обеспечивают специфичность для исследуемой каспазы. Каспазы могут действовать каскадами (т.е. инициатор активирует эффектор и затем приводит к исходу – смерти, воспалению, клеточной сигнализации). Этот протокол может быть использован в образцах, собранных в разные моменты времени после повреждения; в примерах, представленных здесь, образцы собираются в разное время после RVO. В ранее опубликованной работе было обнаружено, что каспаза-9 была увеличена в течение 1 ч после RVO7, что привело к дальнейшим исследованиям валидации и таргетирования. После идентификации эндотелиальной каспазы-9 как потенциального драйвера патологии RVO была использована мышь с индуцируемой эндотелиальной клеточной каспазой-9KO для проверки эндотелиальной каспазы-9. Использование индуцируемой клеточной специфической каспазы мышей KO обеспечивает другой уровень специфичности и позволяет избежать смерти развития, наблюдаемой с конститутивной каспазой-9KO18. Он также позволяет избежать компенсаторных изменений у других членов семьи, которые, как было показано, происходят у конститутивных мышей CASPASE KO19. Более того, использование клеточно-специфических индуцируемых каспазных ко мышей позволяет идентифицировать тип клеток, в которых каспаза регулирует патологию в тканях. Протокол также предусматривает шаги для опроса об эффективности терапевтического подхода, нацеленного на активную каспазу-9 в RVO. Этот подход также может быть применен к другим тканям, включая мозг.
Раскрытие информации
Авторы заявляют о следующих конкурирующих интересах: C.M.T. имеет следующие патентные заявки US20200164026, US20190142915 и US20150165061. C.M.T. и S.S. имеют патентную заявку US 20140024597. C.M.T., A.M.P. и M.I.A. имеют патентную заявку US2020058683. C.M.T. и Y.Y.J. имеют патентную заявку WO2018013519. M.I.A и C.M.T перечислены в качестве изобретателей в патентной заявке WO/2020/223212 попечителями Колумбийского университета в городе Нью-Йорке. Остальные авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Эта работа была поддержана грантом DGE - 1644869 Национального научного фонда (NINDS) Национальных институтов здравоохранения (NIH), наградой No F99NS124180 NIH NINDS Diversity Specialized F99 (для CKCO), Национальным институтом глаз (NEI) 5T32EY013933 (для AMP), Национальным институтом неврологических расстройств и инсульта (RO1 NS081333, R03 NS099920 к CMT) и Министерство обороны армии / ВВС (DURIP к CMT).
Материалы
| Name | Company | Catalog Number | Comments |
| anti-Caspase-7 488 | Novus Biologicals | NB-56529AF488 | use at 1:150 |
| anti-cl-Caspase-9 | Cell Signaling | 9505-S | use at 1:800 |
| anti-CD31 | BD Pharmingen | 553370 | use at 1:50 |
| Confocal Spinning Disc Microscope | Biovision | ||
| FIJI 2.3.0 | open source | ||
| Fluormount G | Fisher | 50-187-88 | |
| Forcep | Roboz | RS-5015 | |
| iCasp9FL/FL X VECad-CreERT2 mice | lab generated | see Avrutsky 2020 | |
| Isolectin (594, 649) | Vector | DL-1207 | use at 1:200 |
| Ketamine Hydrochloride | Henry Schein | NDC: 11695-0702-1 | |
| Perfusion pump | Masterflex | ||
| Pen1-XBir3 | lab generated | see Avrutsky 2020 | |
| Prism 9.1 | GraphPad | ||
| Tissue-Tek O.C.T. | Fisher | 14-373-65 | |
| Vis-a-View 4.0 | Visitron Systems | ||
| Xylazine | Akorn | NDCL 59399-110-20 |
Ссылки
- Van Opdenbosch, N., Lamkanfi, M. Caspases in cell death, inflammation, and disease. Immunity. 50 (6), 1352-1364 (2019).
- Ramirez, M. L. G., Salvesen, G. S. A primer on caspase mechanisms. Seminars in Cell & Developmental Biology. 82, Academic Press. 79-85 (2018).
- Troy, C. M., Jean, Y. Y. Caspases: therapeutic targets in neurologic disease. Neurotherapeutics. 12 (1), 42-48 (2015).
- Avrutsky, M. I., Troy, C. M. Caspase-9: a multimodal therapeutic target with diverse cellular expression in human disease. Frontiers in Pharmacology. 12, 1728(2021).
- Fuchs, Y., Steller, H. Programmed cell death in animal development and disease. Cell. 147 (4), 742-758 (2011).
- Troy, C. M., Akpan, N., Jean, Y. Y. Regulation of caspases in the nervous system: implications for functions in health and disease. Progress in Molecular Biology and Translational Science. 99, 265-305 (2011).
- Avrutsky, M. I., et al. Endothelial activation of caspase-9 promotes neurovascular injury in retinal vein occlusion. Nature Communications. 11 (1), 3173(2020).
- Colon Ortiz, C., Potenski, A., Lawson, J. M., Smart, J., Troy, C. M. Optimization of the retinal vein occlusion mouse model to limit variability. Journal of Visualized Experiments. (174), e62980(2021).
- Tisch, N., et al. Caspase-8 modulates physiological and pathological angiogenesis during retina development. The Journal of Clinical Investigation. 129 (12), 5092-5107 (2019).
- Chi, W., et al. HMGB1 promotes the activation of NLRP3 and caspase-8 inflammasomes via NF-kappaB pathway in acute glaucoma. Journal of Neuroinflammation. 12, 137(2015).
- Thomas, C. N., et al. Caspase-2 mediates site-specific retinal ganglion cell death after blunt ocular injury. Investigative Ophthalmology & Visual Science. 59 (11), 4453-4462 (2018).
- Akpan, N., et al. Intranasal delivery of caspase-9 inhibitor reduces caspase-6-dependent axon/neuron loss and improves neurological function after stroke. Journal of Neuroscience. 31 (24), 8894-8904 (2011).
- London, A., Benhar, I., Schwartz, M. The retina as a window to the brain-from eye research to CNS disorders. Nature Reviews Neurology. 9 (1), 44-53 (2013).
- Song, P., Xu, Y., Zha, M., Zhang, Y., Rudan, I. Global epidemiology of retinal vein occlusion: a systematic review and meta-analysis of prevalence, incidence, and risk factors. Journal of Global Health. 9 (1), 010427(2019).
- Akpan, N., et al. Intranasal delivery of caspase-9 inhibitor reduces caspase-6-dependent axon/neuron loss and improves neurological function after stroke. The Journal of neuroscience. 31 (24), 8894-8904 (2011).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564(2012).
- McStay, G. P., Salvesen, G. S., Green, D. R. Overlapping cleavage motif selectivity of caspases: implications for analysis of apoptotic pathways. Cell Death & Differentiation. 15 (2), 322-331 (2007).
- Kuida, K., et al. Reduced apoptosis and cytochrome c-mediated caspase activation in mice lacking caspase 9. Cell. 94 (3), 325-337 (1998).
- Troy, C. M., et al. Death in the balance: alternative participation of the caspase-2 and -9 pathways in neuronal death induced by nerve growth factor deprivation. Journal of Neuroscience. 21 (14), 5007-5016 (2001).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены