Method Article
القياس الكمي لكاسباز-9 المناعي في أنسجة الشبكية
* These authors contributed equally
In This Article
Summary
يظهر هنا بروتوكول مفصل للكيمياء الهيستولوجية المناعية لتحديد الكاسباسات ذات الصلة وظيفيا في الأنسجة المعقدة والتحقق من صحتها واستهدافها.
Abstract
من المعروف أن عائلة الكاسباز تتوسط في العديد من المسارات الخلوية بعد موت الخلايا ، بما في ذلك تمايز الخلايا ، وإيجاد المسار المحوري ، والتكاثر. منذ تحديد عائلة بروتياز موت الخلايا ، كان هناك بحث عن أدوات لتحديد وتوسيع وظيفة أفراد الأسرة المحددين في حالات التنمية والصحة والمرض. ومع ذلك ، فإن العديد من أدوات caspase المتاحة تجاريا حاليا والمستخدمة على نطاق واسع ليست خاصة بالكاسباز المستهدف. في هذا التقرير ، نحدد النهج الذي استخدمناه لتحديد caspase-9 والتحقق من صحته واستهدافه في الجهاز العصبي باستخدام مثبط جديد ونهج وراثي مع قراءات كيميائية مناعية. على وجه التحديد ، استخدمنا الأنسجة العصبية في شبكية العين كنموذج لتحديد والتحقق من وجود ووظيفة الكاسباز. يتيح هذا النهج استجواب وظائف كاسباز-9 الخاصة بالخلايا المبرمج وغير المبرمج ويمكن تطبيقها على الأنسجة المعقدة الأخرى والكاسباز ذات الأهمية. يمكن أن يساعد فهم وظائف الكاسباز في توسيع المعرفة الحالية في بيولوجيا الخلية ، ويمكن أن يكون مفيدا أيضا لتحديد الأهداف العلاجية المحتملة بسبب تورطها في المرض.
Introduction
الكاسباز هي عائلة من البروتياز التي تنظم موت الخلايا النمائي ، والاستجابات المناعية ، وموت الخلايا الشاذة في المرض 1,2. في حين أنه من المعروف جيدا أن أفراد عائلة caspase يتم تحريضهم في مجموعة متنوعة من الأمراض التنكسية العصبية ، فإن فهم أي caspase يقود أمراض المرض هو أكثر صعوبة3. تتطلب مثل هذه الدراسات أدوات لتحديد وتوصيف والتحقق من صحة وظيفة أفراد عائلة الكاسباز الفردية. يعد تحليل الكاسباس الفردي ذي الصلة أمرا مهما من وجهة نظر ميكانيكية وعلاجية ، حيث تحتوي الأدبيات على دراسات متعددة تقدم أدلة على الأدوار المتنوعة للكاسباس 4,5. وبالتالي ، إذا كان الهدف هو استهداف كاسباز في مرض ما للحصول على فائدة علاجية ، فمن الأهمية بمكان أن يكون هناك استهداف محدد لفرد (أفراد) الأسرة المعنيين. تشمل التقنيات التقليدية للكشف عن مستويات الكاسباز في الأنسجة النشاف الغربي والنهج الأنزيمي والفلورومتري 3,6. ومع ذلك ، لا يسمح أي من هذه التدابير بالكشف عن مستويات الكاسباز الخاصة بالخلية ، وفي بعض السيناريوهات ، لا يمكن اكتشاف الكاسباز المشقوق في كثير من الأحيان من خلال تدابير تحليل البروتين التقليدية. من المعروف أن الكاسباز يمكن أن يلعب أدوارا مختلفة في موت الخلايا المبرمج وغير موت الخلايا المبرمج في نفس النسيج7 ، لذلك هناك حاجة إلى توصيف دقيق لمستويات الكاسباز الخاصة بالخلية من أجل فهم دقيق لمسارات النمو والمرض.
تظهر هذه الدراسة تنشيط الكاسباز ووظيفته في نموذج نقص الأكسجة الوعائية العصبية - نقص التروية - انسداد الوريد الشبكي (RVO)7,8. في الأنسجة المعقدة مثل شبكية العين ، هناك أنواع متعددة من الخلايا التي يمكن أن تتأثر بنقص الاكسكار الناجم عن نقص التروية الناجم عن RVO ، بما في ذلك الخلايا الدبقية والخلايا العصبية والأوعية الدموية7. في شبكية العين الفأر البالغ ، هناك القليل جدا من التعبير عن الكاسباس الواضح في الأنسجة السليمة ، كما تم قياسه بواسطة الكيمياء المناعية (IHC)7 ، ولكن هذا ليس هو الحال أثناء التطور9 أو في نماذج أمراض الشبكية10,11. IHC هي تقنية راسخة في البحوث الطبية الحيوية وسمحت بالتحقق من صحة الأمراض والأهداف المرضية ، وتحديد الأدوار الجديدة من خلال التوطين المكاني ، والقياس الكمي للبروتينات. في الحالات التي لا يمكن فيها اكتشاف منتجات الكاسباز المشقوقة عن طريق اللطخة الغربية أو التحليل الفلورومتري ، ولا موقع الخلية المحدد للكاسباس المتميز أو استجواب مسارات إشارات الكاسباز من خلال التوطين ، يجب استخدام IHC.
من أجل تحديد caspase (ق) ذات الصلة وظيفيا في RVO ، تم استخدام IHC مع الأجسام المضادة التي تم التحقق من صحتها للكاسباز والعلامات الخلوية. أظهرت الدراسات السابقة التي أجريت في المختبر أن caspase-9 تم تنشيطه بسرعة في نموذج للسكتة الدماغية الإقفارية وتثبيط caspase-9 مع مثبط محدد للغاية محمي من الخلل العصبي والموت12. نظرا لأن شبكية العين جزء من الجهاز العصبي المركزي (CNS) ، فهي بمثابة نظام نموذجي للاستعلام والتحقيق في دور caspase-9 في إصابات الأوعية الدموية العصبية13. تحقيقا لهذه الغاية ، تم استخدام نموذج الماوس من RVO لدراسة الموقع الخاص بالخلية وتوزيع caspase-9 وتأثيره في إصابة الأوعية الدموية العصبية. RVO هو سبب شائع للعمى لدى البالغين في سن العمل ينتج عن إصابة الأوعية الدموية14. وقد وجد أن caspase-9 تم التعبير عنه بطريقة غير موت الخلايا المبرمج في الخلايا البطانية ، ولكن ليس في الخلايا العصبية.
كنسيج ، تتمتع شبكية العين بميزة تصورها إما على أنها مسطحة ، مما يسمح بتقدير شبكات الأوعية الدموية ، أو كمقاطع عرضية ، مما يسلط الضوء على طبقات الشبكية العصبية. يوفر القياس الكمي لتعبير بروتين الكاسباز في المقاطع العرضية السياق ، فيما يتعلق بالكاسباز الذي يحتمل أن يكون حاسما في الاتصال العصبي للشبكية ووظيفة الرؤية من خلال تحديد توطين الكاسباز (الكاسباز) في شبكية العين. بعد التحديد والتحقق من الصحة ، يتم تحقيق استهداف caspase محل الاهتمام باستخدام حذف محدد للخلية المستحثة من caspase المحدد. بالنسبة للاستفسارات العلاجية المحتملة ، تم اختبار أهمية الكاسباز محل الاهتمام باستخدام أدوات محددة لتثبيط الكاسباز المنشط. بالنسبة ل caspase-9 ، كانت الخلية مثبطا انتقائيا للغاية 7,15 ، تم استخدام Pen1-XBIR3. بالنسبة لهذا التقرير ، تم استخدام سلالة C57BL / 6J البالغة من العمر شهرين وسلالة كاسباز 9 البطانية المستحثة بعقار تاموكسيفين (iEC Casp9KO) مع خلفية C57BL / 6J. تعرضت هذه الحيوانات لنموذج الفأر RVO وعولجت C57BL / 6J بمثبط كاسباز -9 الانتقائي ، Pen1-XBir3. يمكن تطبيق المنهجية الموصوفة على نماذج أخرى من المرض في الأنظمة المركزية والطرفية 7,15.
Protocol
يتبع هذا البروتوكول بيان جمعية أبحاث الرؤية وطب العيون (ARVO) لاستخدام الحيوانات في أبحاث العيون والرؤية. تمت الموافقة على تجارب القوارض ومراقبتها من قبل اللجنة المؤسسية لرعاية واستخدام الحيوانات (IACUC) بجامعة كولومبيا.
1. تحضير أنسجة الشبكية والتشريح بالتبريد
- القتل الرحيم للحيوانات عن طريق إعطاء التخدير داخل الصفاق (الكيتامين (80-100 ملغم / كغم) والزيلازين (5-10 ملغم / كغم)) ، وتخلل الفئران المعرضة ل RVO (انظر8 للحصول على التفاصيل) مع 4٪ بارافورمالدهيد (PFA) باستخدام مضخة تمعجية.
ملاحظة: قرصة اصبع القدم الحيوان لتأكيد عمق التخدير قبل الشروع في القتل الرحيم والتروية. يمكن العثور على تفاصيل حول التروية في16. - احصد العينين عن طريق الاستئصال الدقيق باستخدام الملقط وضع الكرة الأرضية في 1 مل من 4٪ PFA. اتركي العينين طوال الليل عند 4 درجات مئوية. اغسل العينين ثلاث مرات لمدة 10 دقائق ، مع إضافة 1 مل من 1x PBS ووضعها في شاكر.
- اغمر العينين في 1 مل من السكروز بنسبة 30٪ لمدة 3 أيام ، حتى تستقر في قاع الأنبوب ، مما يشير إلى امتصاص السكروز.
- املأ العينين بمركب درجة حرارة القطع الأمثل باستخدام حقنة 30 جم ، حتى يصبح للعين مظهر مستدير (حوالي 50 ميكرولتر).
- قم بتضمين العينين في cryomold مع مركب درجة حرارة القطع المثلى حتى يتم تغطية العينين وتجميدها عند -80 درجة مئوية حتى تصبح جاهزة للاستئصال بالتبريد.
- قسم غرست العينين في 20 ميكرومتر على شرائح زجاجية باستخدام cryostat.
- قم بإزالة الكتلة المركبة ذات درجة حرارة القطع المثلى من قالب التبريد.
- ضعه على ظرف التبريد عن طريق إضافة مركب درجة حرارة القطع المثلى ووضع الكتلة على تشاك. اتركه داخل cryostat حتى يتجمد.
- المضي قدما في قطع كتلة في 20 ميكرومتر حتى يتم رؤية أنسجة الشبكية.
ملاحظة: يمكن تأكيد ذلك باستخدام مجهر ضوئي بتكبير 30x (3x هدف ، 10x عدسات). يمكن تمييز الأنسجة عن وسائط OCT حسب اللون والشكل. - اجمع أنسجة الشبكية في شرائح مجهرية في سلسلة من أربعة أقسام لكل شريحة.
ملاحظة: انظر الشكل 1 أ للاطلاع على اقتراح وضع أقسام الشبكية.
- قم بتسمية الشرائح بمعرف يزيل تعريف العلاج والنمط الجيني.
- قم بتخزين الشرائح في درجة حرارة -20 درجة مئوية حتى تلطيخها.
2. الكيمياء الهيستولوجية المناعية
ملاحظة: استخدم الأنسجة الثابتة المحفوظة بالتبريد للكيمياء المناعية للحفاظ على مورفولوجيا الخلية. اختر الأقسام الموجودة على مستوى صور التصوير المقطعي للتماسك البصري (OCT) التي تم الحصول عليها في الجسم الحي7. استخدم أول سلسلتين من الشرائح التي تم جمعها من cryostat أو أقسام من 150 ميكرومتر إلى أنسجة الشبكية.
- ضع الشرائح في غرفة منزلقة مظلمة ورطبة.
- النفاذية والانسداد: اغسل المقاطع العرضية للشبكية ب 300 ميكرولتر من 1x PBS لمدة 5 دقائق لإزالة OCT والتخلص منها بعد ذلك.
- تغلغل الأنسجة عن طريق إضافة 300 ميكرولتر من 1x PBS مع 0.1٪ Triton X-100 لمدة 2 ساعة في درجة حرارة الغرفة (RT) وتجاهل بعد ذلك.
- سد الأنسجة عن طريق إضافة 300 ميكرولتر من المخزن المؤقت المانع (10٪ مصل الماعز الطبيعي (NGS) ، 1٪ ألبومين مصل البقر (BSA) في 1x PBS ، مصفى) واتركه طوال الليل عند 4 درجات مئوية.
- الأجسام المضادة الأولية: تمييع الأجسام المضادة الأولية في سد العازلة. تشمل الأجسام المضادة الأولية المستخدمة anti-cl-caspase-9 في 1: 800 ، و anti-CD31 في 1:50 ، و anti-caspase-7-488 (الجسم المضاد المسمى مباشرة) في 1: 150.
ملاحظة: اتبع توصية الشركة المصنعة للتخفيف المناسب للأجسام المضادة الأولية.- صب المخزن المؤقت المانع من الأقسام وقم بتطبيق 100 ميكرولتر من كوكتيل الأجسام المضادة الأساسي على شرائح الشبكية.
- احتضان المقاطع العرضية طوال الليل عند 4 درجات مئوية.
- اغسل الأقسام أربع مرات لمدة 5 دقائق باستخدام 300 ميكرولتر من 1x PBS.
ملاحظة: إذا كانت أقسام الأنسجة هشة للغاية ، فيجب إزالة الغسولات باستخدام عمل شعري عن طريق وضع منديل على زاوية الشريحة لتجنب إزاحة أقسام الشبكية. - لتجنب وضع العلامات المتقاطعة للأجسام المضادة الأولية التي أثيرت في نفس النوع المضيف ، أكمل التلوين بأجسام مضادة ثانوية قبل تطبيق الأجسام المضادة ذات العلامات المباشرة.
- الأجسام المضادة الثانوية: تمييع الأجسام المضادة الثانوية في منع العازلة بتركيز 0.1٪. على سبيل المثال ، للكشف عن anti-cl-caspase-9 ، وهو جسم مضاد نشأ في الأرانب ، استخدم الماعز المضاد للأرنب 568 الثانوي.
- ضع 200 ميكرولتر من كوكتيل الأجسام المضادة الثانوي على شبكية العين.
- احتضان الأنسجة لمدة 2 ساعة في RT.
- اغسل الأقسام أربع مرات لمدة 5 دقائق باستخدام 300 ميكرولتر من 1x PBS.
- تلطيخ النوى لمدة 5 دقائق مع 300 ميكرولتر من DAPI بتخفيف 0.02٪.
- اغسل مرة واحدة لمدة 5 دقائق مع 300 ميكرولتر من 1x PBS.
- ضع غطاء على أقسام الشبكية باستخدام 500 ميكرولتر من وسائط fluoromount-G ، والتي تحافظ على إشارة الفلورسنت ، وضع الغطاء بعناية في الجزء العلوي من الشريحة ، وتجنب الفقاعات.
3. التصوير البؤري
- الحصول على صور للأقسام الملطخة باستخدام الفحص المجهري متحد البؤر.
- قم بتشغيل المجهر متحد البؤر.
- ضع الشريحة على المسرح.
- اضبط التركيز لرؤية قسم الشبكية بوضوح.
ملاحظة: التقط أربع صور على الأقل لكل قسم وصور أربعة أقسام لكل شبكية عين. انظر مخطط تصوير الشبكية لمناطق التصوير المقترحة (الشكل 1 ب ، ج).
- صورة تلطيخ كاسباز والأوعية الدموية والنووية باستخدام مجهر متحد البؤر يحتوي على اكتساب Z-stack ، باستخدام هدف 20x أو 40x.
ملاحظة: يجب أن تكون معلمات التصوير وإعداد البرنامج ثابتة لجميع عمليات التصوير في التجربة. يوفر الهدف 20x نظرة عامة على طبقات الشبكية ، والتي يتم تحديدها جيدا بواسطة التلوين النووي. يوفر الهدف 40x المزيد من التفاصيل الخلوية.- قم بتعيين أوقات التعرض وشدة الليزر المناسبة لكل قناة بالنقر فوق إعدادات الاستحواذ.
- اضبط Z-stack لتصور القسم بأكمله بالنقر فوق Z-series وإعداد المعلمات لأعلى ولأسفل لتغطية عمق الأنسجة.
- احفظ الصور التي تتبع المعرف المقنع المعين أثناء التشريح بالتبريد.
4. القياس الكمي لمستويات الكاسباز
- اسحب ملفات الصور من 405 و470 و555 و640 قناة إلى وحدة تحكم فيجي.
- انقر فوق الصورة > اللون > دمج القنوات.
- قم بتعيين الألوان للملفات على النحو التالي: الأحمر إلى 555 ، والأخضر إلى 470 ، والرمادي إلى 405 ، والسماوي إلى 640.
- ضغط مكدس Z بالنقر فوق صورة > مكدس > مشروع Z.
- انقر فوق نوع العرض: أقصى كثافة.
- افتح واجهة القنوات بالنقر فوق الصورة > أداة قنوات الألوان.
- افتح واجهة السطوع والتباين .
- حدد المعلمات لكل قناة.
- انتقل إلى القنوات وحدد قناة واحدة.
- ضع المؤشر أعلى الخلية المعبر عنها caspase وقم بالتعليق على قيمة البكسل.
- ضع المؤشر أعلى الخلفية وقم بالتعليق على قيمة البكسل.
- معلمات الاختبار
- انتقل إلى واجهة السطوع والتباين.
- انقر على تحديد.
- قم بتوصيل الحد الأدنى للقيمة المعروضة (قيمة البكسل المشروحة للخلية المعبر عنها caspase).
- قم بتوصيل الحد الأقصى للقيمة المعروضة (قيمة البكسل المشروحة للخلفية).
- انقر فوق موافق.
- كرر الخطوات من 4.8 إلى 4.9 لجميع القنوات.
- اختبر المعلمات عن طريق اختيار صور عشوائية من الأنسجة العمياء.
ملاحظة: قم بتحرير معلمات السطوع والتباين فقط إذا كانت قيمة الخلفية غير كافية للصور الأخرى. - بمجرد تعيين المعلمات ، افتح ملفات الصور وضغط Z-stack.
- أضف معلمات السطوع والتباين لقناة caspase وقناة isolectin ، قناة علامة الأوعية الدموية.
- استخدم أداة النقطة لتحديد عدد المناطق الإيجابية الوعائية باستخدام التمركز المشترك لعلامة الأوعية الدموية مع تعبير caspase كقراءة للمناطق الإيجابية.
- كرر الخطوة 4.14 ولكن باستخدام Hoechst كعلامة للمناطق الإيجابية العصبية.
- أضف تعليقات توضيحية إلى القيم في جدول بيانات لكل صورة.
- متوسط القيم حسب القسم.
- متوسط قيم القسم - ستكون هذه هي القراءة لكل عين.
5. التأكيد الجيني لأهمية الخلية البطانية caspase-9
- استخدم شبكية العين التي تم الحصول عليها من الفئران Casp9FL / FL-VECad-CreERT2 التي تعرضت ل RVO7.
- Immunostain شبكية العين ل caspase-9 (caspase المحذوفة) ، caspase-7 (caspase المستجيب أسفل التيار) ، علامات الأوعية الدموية ، و DAPI كما هو موضح أعلاه في القسم 2.
- الصورة والتحديد الكمي كما هو موضح أعلاه في القسمين 3 و 4.
6. استهداف caspase-9 في RVO
- الحصول على عيون من الفئران المعرضة ل RVO متبوعا بتطبيق مثبط caspase-9 Pen1-XBir3 موضعيا على العيون كما في7.
- Immunostain شبكية العين ل caspase-7 (كاسباز المستجيب في مجرى النهر) ، وعلامات الأوعية الدموية ، و DAPI كما هو موضح أعلاه في القسم 2.
- الصورة والتحديد الكمي كما هو موضح أعلاه في القسمين 3 و 4.
النتائج
يسمح البروتوكول الموصوف للمستخدم بتحليل وقياس مستويات caspase-9 في أنسجة الشبكية. بالإضافة إلى ذلك ، فإنه يقدم أدوات لمزيد من تحديد والتحقق من صحة واستهداف ركائز caspase-9 والمصب. تسمح الخطوات الملخصة بتحليل قابل للقياس الكمي لمستويات الكاسباز والخصوصية الخلوية في الصور المجهرية الفلورية. تظهر جميع الأشكال الصور المجهرية التمثيلية والقياس الكمي لمستويات الكاسباز المشار إليها في إجمالي شبكية العين والخلايا البطانية والخلايا العصبية في المقاطع العرضية لشبكية العين P-RVO غير المصابة و 1 يوم. يسمح المقطع العرضي للشبكية بتصور نوى الشبكية في طبقة العقدة الشبكية (RGL) والطبقة النووية الداخلية (INL) والطبقة النووية الخارجية (ONL) عند تلطيخها ب Hoechst. بالإضافة إلى ذلك ، تظهر الأوعية الدموية في شبكية العين في طبقات الضفيرة الشبكية أو بين RGL و INL ، وبين INL و ONL. بسبب الطبيعة النسيجية للأوعية الدموية ، عندما يتم تقسيم شبكية العين ، ستظهر الأوعية الدموية منفصلة ومنفصلة ، مما يوفر طبقات الضفيرة. يحدد الشكل 2 caspase-9 على أنه P-RVO عالي التنظيم لمدة يوم واحد. يؤكد الشكل 3 الأهمية الوظيفية للكاسباز-9 البطاني باستخدام فئران خروج المغلوب للخلايا البطانية المحرضة. يوضح الشكل 4 أن استهداف caspase-9 النشط دوائيا يمنع تحريض هدف المصب من caspase-9-caspase-7. يحدد البروتوكول التوطين الخلوي للكاسباز وطبقات الشبكية العصبية التي يتم فيها التعبير عن الكاسباس.

الشكل 1: مخطط تصوير الشبكية. (أ) يوصى بوضع أقسام الشبكية في شريحة المجهر. (ب) نظرة عامة على مناطق التصوير في شبكية العين. (ج) تمثيل رؤية الشبكية عند هدف 20x. طبقات الشبكية: RGL = طبقة العقدة الشبكية ، INL = الطبقة النووية الداخلية ، ONL = الطبقة النووية الخارجية. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
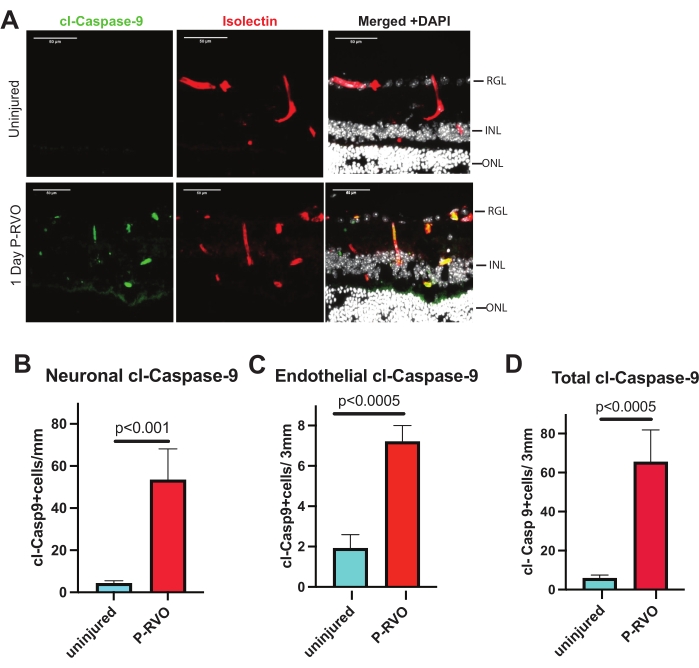
الشكل 2: يحفز RVO كاسباز-9 في الخلايا البطانية والخلايا العصبية. (أ) مقاطع عرضية شبكية تمثيلية من P-RVO غير مصاب ويوم واحد ملطخة ب cl-caspase-9 1: 800 (أخضر) ، إيزولكتين 1: 200 (أحمر) ، و DAPI (أبيض). (ب) القياس الكمي لعدد الخلايا العصبية باستخدام cl-caspase-9 (انظر جدول المواد للحصول على تفاصيل حول الأجسام المضادة). ج: القياس الكمي لعدد الخلايا البطانية باستخدام cl-caspase-9. د: إجمالي عدد البطاريات التي تعبر عن cl-caspase-9. غير مصاب ، ن = 6 ؛ 1 يوم P-RVO ، ن = 5. تمثل أشرطة الخطأ متوسط ± SEM ؛ ANOVA أحادي الاتجاه ، اختبار LSD فيشر. شريط المقياس = 50 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
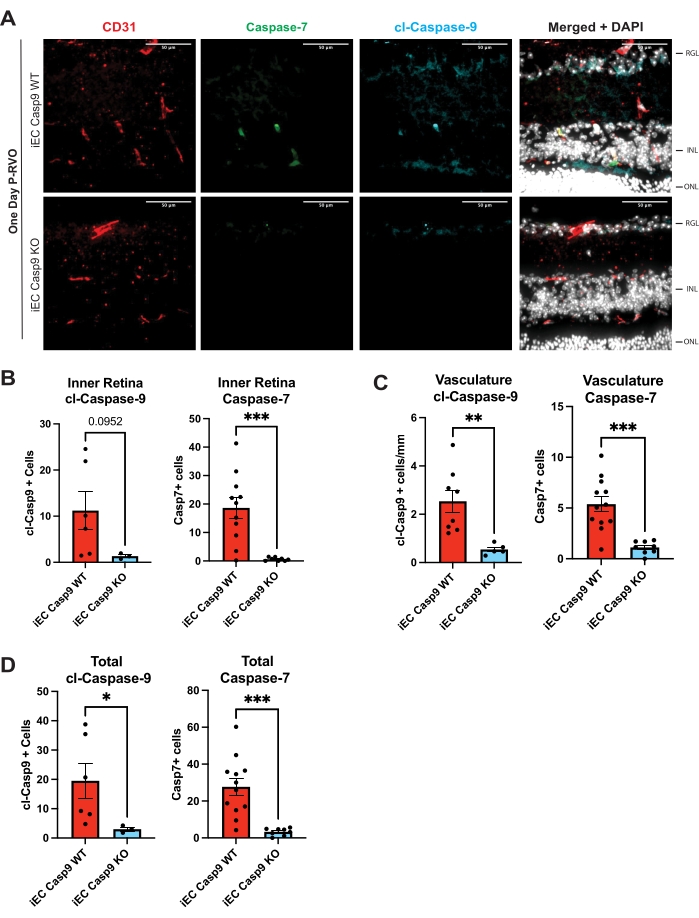
الشكل 3: حذف الخلايا البطانية للكاسباز-9 البطاني يمنع تحريض RVO للكاسباز-7. (أ) المقاطع العرضية التمثيلية للشبكية من فئران iEC Casp9WT و iEC Casp9KO ذات القمامة لمدة يوم واحد ملطخة ب caspase-7 (أخضر) ، cl-caspase-9 (أزرق) ، CD31 ، علامة وعائية (حمراء) ، و DAPI (أبيض). (ب) القياس الكمي لعدد الخلايا في الشبكية الداخلية باستخدام cl-caspase-9 و caspase-7. (ج) القياس الكمي لعدد الخلايا البطانية باستخدام cl-caspase-9 ومع caspase-7. د: إجمالي عدد الخلايا التي تعبر عن cl-caspase-9 أو caspase-7. iEC Casp9WT ، ن = 6-12 ؛ iEC Casp9KO ، ن = 3-8. تمثل أشرطة الخطأ متوسط ± SEM ؛ ANOVA أحادي الاتجاه ، اختبار LSD فيشر. شريط المقياس = 50 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 4: تثبيط نشاط كاسباز-9 يثبط تعبير كاسباز-7 P-RVO. (أ) مقاطع عرضية شبكية تمثيلية من P-RVO غير مصاب ويوم واحد معالج أو غير معالج ب Pen1-XBIR3 ملطخ بالكاسباز -7 (أخضر) ، إيزولكتين (أحمر) ، و DAPI (أبيض). ب: القياس الكمي لعدد الخلايا البطانية باستخدام الكاسباز-7. (ج) القياس الكمي لعدد كريات الدم البيضاء مع كاسباز-7. د: القياس الكمي لعدد الخلايا العصبية لكل طبقة عصبية باستخدام الكاسباز-7. ه: إجمالي عدد الخلايا التي تعبر عن الكاسباز-7. القلم غير المصاب 1 محلول ملحي ، ن = 6 ؛ قلم غير مصاب 1-XBIR3 ، ن = 5 ؛ يوم واحد P-RVO Pen1 محلول ملحي ، ن = 5 ؛ قلم P-RVO لمدة يوم واحد 1-XBIR3 ، ن = 3. تمثل أشرطة الخطأ متوسط ± SEM ؛ ANOVA أحادي الاتجاه ، اختبار LSD فيشر. الاختصارات: RGL = طبقة العقدة الشبكية ، INL = الطبقة النووية الداخلية ، و ONL = الطبقة النووية الخارجية. شريط المقياس = 50 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
Discussion
Caspases هي عائلة متعددة الأعضاء من البروتياز أفضل دراسة لدورها في موت الخلايا والالتهابات. ومع ذلك ، في الآونة الأخيرة تم الكشف عن مجموعة متنوعة من وظائف عدم الوفاة لبعض أفراد الأسرة 4,5. يستمد الكثير من فهمنا لوظيفة الكاسباز من العمل في زراعة الخلايا ومن البيانات الاستنتاجية من الأمراض البشرية. في حين أنه من المقدر أن هناك تحريضا شاذا أو تنشيطا أو تعطيلا للكاسباز في المرض ، فقد كان من الصعب تحديد ما إذا كانت الكاسباسات تقود أمراض الأمراض وظيفيا. تكتشف العديد من الأدوات المستخدمة لتقييم كاسباسات معينة العديد من أفراد الأسرة ، مما يقوض الأهمية الوظيفية للبيانات التي تم الحصول عليها باستخدام هذه الكواشف17. نقدم هنا بروتوكولا لدراسة الكاسباز في الأنسجة المعقدة ، باستخدام شبكية العين كمثال. في الجهاز العصبي ، يتم تنظيم تعبير الكاسباز قبل الولادة وبعدها. هذا يسمح باستخدام أجسام مضادة محددة لاختبار التغيرات في مستويات الكاسباز في نموذج المرض.
بينما ينصب تركيز البروتوكول على معالجة الصور وتحليلها ، يعتمد نجاح التقنية أيضا على التحضير الدقيق للأنسجة ، بالإضافة إلى IHC والتصوير المجهري لضمان اتساق البيانات وصلاحيتها وموثوقيتها. يجب توخي الحذر لاستخدام نفس المعلمات لتصوير مجموعة بيانات كاملة. لن توفر الصور ذات الجودة الرديئة والتباين المنخفض والتركيز الضبابي بيانات موثوقة. عند تقسيم وتصوير مناطق P-RVO في شبكية العين ، يجب تجنب التمزقات والطي لأن هذه المناطق قد تؤدي إلى قطع أثرية. وينبغي أيضا تجنب مناطق الضرر المباشر. يحتاج المحقق الذي يقوم بالتصوير إلى أن يعمى عن علاج الأنسجة. للتحليل ، يوصى بأن يقوم مراقبان مستقلان ، أعمى عن مجموعة العلاج ، بإجراء التحليل. بالإضافة إلى ذلك ، لا ينبغي استخدام الأجسام المضادة الأولية للفأر في نماذج إصابة الفئران لأن الأجسام المضادة الثانوية ترتبط بشكل غير محدد بالأوعية الدموية. البديل هو استخدام الأجسام المضادة الأولية المترافقة مباشرة.
نهج بديل لعد الخلايا هو تحديد النسبة المئوية لمنطقة التعبير. يمكن استخدام هذا عندما يكون عد الخلايا غير ممكن (على سبيل المثال ، إذا كان تعبير caspase موضعيا في العمليات العصبية أو شرائح المستقبلات الضوئية). تتأثر شبكية العين المركزية والمحيطية بشكل تفاضلي في نماذج الإصابات المختلفة. يمكن تكييف الطريقة لتحليل مناطق الشبكية المختلفة على وجه التحديد. في حالة إجراء BRVO ، يجب اختيار الأقسام من الجزء المصاب من العين. ينص البروتوكول أيضا على تلطيخ علامات الخلايا المختلفة لتحديد مكان التعبير عن caspase.
تشمل قيود الطريقة أنها لا تفرق بين المستويات العالية والمنخفضة من إشارة caspase في خلية معينة. بالإضافة إلى ذلك ، فإن استخدام صبغة نووية لتحديد الطبقات العصبية مناسب ولكنه لا يشير بشكل قاطع إلى التعبير العصبي (توجد الخلايا الدبقية والكريات البيض في هذه الطبقات أيضا). يمكن استخدام علامات عصبية إضافية للتحقق من صحة التعبير العصبي. هناك أيضا مجموعة متنوعة من الأجسام المضادة المتاحة لتقييم تعبير كاسباز. تم تعريفها بشكل أفضل ل caspase-9 البشري ، حيث توجد أجسام مضادة لكامل الطول / المشقوق (Cl) Caspase-9 ، و Caspase-9 المشقوق ، و Caspase-3-المشقوق Caspase-9.
كثيرا ما يتم الإبلاغ عن متوسط شدة إشارة IHC كطريقة تكميمية. ومع ذلك ، يمكن أن تؤدي ضوضاء الخلفية أو التألق الذاتي من خلايا الدم الحمراء إلى نتائج غير دقيقة. يسمح القياس الكمي الخاص بالخلية بتحديد وتمييز الخلفية ، والتلوين غير المحدد ، والتألق الذاتي.
يمكن استخدام هذا البروتوكول لقياس التغيرات على نطاق الأنسجة في التعبير عن الكاسباسات الفردية ، والتغيرات في التعبير في نوع معين من الخلايا ، مثل الخلية البطانية ، والتغيرات في أنواع معينة من الخلايا في مواقع محددة ، مثل الخلايا العصبية في طبقات الشبكية المختلفة. تسمح هذه المرونة للمجرب بالاستعلام عن كيفية تغيير حالة المرض لمستويات الكاسباز الفردية. تستخدم الطرق الحالية / البديلة تحليل النشاف الغربي للمقارنة شبه الكمية لإشارات الكاسباز ، على الرغم من أن الطرق لن توفر الفصل الواضح للتوطين الخلوي الذي يحققه هذا البروتوكول. والجدير بالذكر أنه في الشكل 3D ، يكون تثبيط caspase-9 أكثر فعالية في تقليل caspase-9 العصبي في INL و ONL ، مقارنة ب RGL. هذا النوع من القرار يمثل تحديا لتحقيقه بطرق أخرى. بالإضافة إلى ذلك ، عندما يتم تحليل نسيج كامل كيميائيا ، قد تكون مستويات الكاسباز التي تتغير منخفضة جدا بحيث لا يمكن التقاطها ، نظرا لوجود العديد من أنواع الخلايا المختلفة في الأنسجة المعقدة.
توفر الأجسام المضادة ، التي يجب التحقق من صحتها من قبل المستخدم ، خصوصية لفحص caspase. يمكن أن تعمل Caspases في شلالات (أي ، المستجيب المنشط البادئ ثم تؤدي إلى النتيجة - الموت ، الالتهاب ، إشارات الخلية). يمكن استخدام هذا البروتوكول في العينات التي تم جمعها في نقاط زمنية مختلفة بعد الضرر. في الأمثلة المعروضة هنا ، يتم جمع العينات في أوقات مختلفة بعد RVO. في العمل المنشور سابقا ، وجد أن caspase-9 قد زاد في غضون 1 ساعة بعد RVO7 ، مما أدى إلى مزيد من دراسات التحقق والاستهداف. بعد تحديد caspase-9 البطاني كمحرك محتمل لأمراض RVO ، تم استخدام فأر به خلية بطانية مستحثة caspase-9KO للتحقق من صحة caspase-9 البطانية. يوفر استخدام فئران caspase KO الخاصة بالخلايا المستحثة مستوى آخر من الخصوصية ويتجنب الموت التنموي الذي شوهد مع caspase-9KO18 التأسيسي. كما أنه يتجنب التغييرات التعويضية في أفراد الأسرة الآخرين التي ثبت حدوثها في فئران caspase KOالتأسيسية 19. علاوة على ذلك ، فإن استخدام فئران caspase KO المحرضة الخاصة بالخلية يسمح بتحديد نوع الخلية التي ينظم فيها الكاسباز علم الأمراض في الأنسجة. يوفر البروتوكول أيضا خطوات لاستجواب فعالية النهج العلاجي ، الذي يستهدف caspase-9 النشط في RVO. يمكن أيضا تطبيق هذا النهج على الأنسجة الأخرى ، بما في ذلك الدماغ.
Disclosures
يعلن المؤلفون عن المصالح المتنافسة التالية: لدى C.M.T. طلبات براءات الاختراع التالية US20200164026 و US20190142915 و US20150165061. C.M.T. و S.S. لديهما طلب براءة اختراع 20140024597 الولايات المتحدة. C.M.T. ، A.M.P. ، و M.I.A. لديها طلب براءة اختراع US2020058683. C.M.T. و Y.Y.J. لديهما طلب براءة اختراع WO2018013519. تم إدراج M.I.A و C.M.T كمخترعين في طلب براءة WO/2020/223212 المقدم من أمناء جامعة كولومبيا في مدينة نيويورك. يعلن المؤلفون الباقون عدم وجود مصالح متنافسة.
Acknowledgements
تم دعم هذا العمل من خلال منحة برنامج زمالة أبحاث الخريجين التابع لمؤسسة العلوم الوطنية (NSF-GRFP) DGE - 1644869 والمعهد الوطني للاضطرابات العصبية والسكتة الدماغية (NINDS) التابع للمعاهد الوطنية للصحة (NIH) ، رقم الجائزة F99NS124180 NIH NINDS Diversity Specialized F99 (إلى CKCO) ، المعهد الوطني للعيون (NEI) 5T32EY013933 (إلى AMP) ، المعهد الوطني للاضطرابات العصبية والسكتة الدماغية (RO1 NS081333 ، R03 NS099920 إلى CMT) ، ووزارة الدفاع الجيش / القوات الجوية (DURIP إلى CMT).
Materials
| Name | Company | Catalog Number | Comments |
| anti-Caspase-7 488 | Novus Biologicals | NB-56529AF488 | use at 1:150 |
| anti-cl-Caspase-9 | Cell Signaling | 9505-S | use at 1:800 |
| anti-CD31 | BD Pharmingen | 553370 | use at 1:50 |
| Confocal Spinning Disc Microscope | Biovision | ||
| FIJI 2.3.0 | open source | ||
| Fluormount G | Fisher | 50-187-88 | |
| Forcep | Roboz | RS-5015 | |
| iCasp9FL/FL X VECad-CreERT2 mice | lab generated | see Avrutsky 2020 | |
| Isolectin (594, 649) | Vector | DL-1207 | use at 1:200 |
| Ketamine Hydrochloride | Henry Schein | NDC: 11695-0702-1 | |
| Perfusion pump | Masterflex | ||
| Pen1-XBir3 | lab generated | see Avrutsky 2020 | |
| Prism 9.1 | GraphPad | ||
| Tissue-Tek O.C.T. | Fisher | 14-373-65 | |
| Vis-a-View 4.0 | Visitron Systems | ||
| Xylazine | Akorn | NDCL 59399-110-20 |
References
- Van Opdenbosch, N., Lamkanfi, M. Caspases in cell death, inflammation, and disease. Immunity. 50 (6), 1352-1364 (2019).
- Ramirez, M. L. G., Salvesen, G. S. A primer on caspase mechanisms. Seminars in Cell & Developmental Biology. 82, Academic Press. 79-85 (2018).
- Troy, C. M., Jean, Y. Y. Caspases: therapeutic targets in neurologic disease. Neurotherapeutics. 12 (1), 42-48 (2015).
- Avrutsky, M. I., Troy, C. M. Caspase-9: a multimodal therapeutic target with diverse cellular expression in human disease. Frontiers in Pharmacology. 12, 1728(2021).
- Fuchs, Y., Steller, H. Programmed cell death in animal development and disease. Cell. 147 (4), 742-758 (2011).
- Troy, C. M., Akpan, N., Jean, Y. Y. Regulation of caspases in the nervous system: implications for functions in health and disease. Progress in Molecular Biology and Translational Science. 99, 265-305 (2011).
- Avrutsky, M. I., et al. Endothelial activation of caspase-9 promotes neurovascular injury in retinal vein occlusion. Nature Communications. 11 (1), 3173(2020).
- Colon Ortiz, C., Potenski, A., Lawson, J. M., Smart, J., Troy, C. M. Optimization of the retinal vein occlusion mouse model to limit variability. Journal of Visualized Experiments. (174), e62980(2021).
- Tisch, N., et al. Caspase-8 modulates physiological and pathological angiogenesis during retina development. The Journal of Clinical Investigation. 129 (12), 5092-5107 (2019).
- Chi, W., et al. HMGB1 promotes the activation of NLRP3 and caspase-8 inflammasomes via NF-kappaB pathway in acute glaucoma. Journal of Neuroinflammation. 12, 137(2015).
- Thomas, C. N., et al. Caspase-2 mediates site-specific retinal ganglion cell death after blunt ocular injury. Investigative Ophthalmology & Visual Science. 59 (11), 4453-4462 (2018).
- Akpan, N., et al. Intranasal delivery of caspase-9 inhibitor reduces caspase-6-dependent axon/neuron loss and improves neurological function after stroke. Journal of Neuroscience. 31 (24), 8894-8904 (2011).
- London, A., Benhar, I., Schwartz, M. The retina as a window to the brain-from eye research to CNS disorders. Nature Reviews Neurology. 9 (1), 44-53 (2013).
- Song, P., Xu, Y., Zha, M., Zhang, Y., Rudan, I. Global epidemiology of retinal vein occlusion: a systematic review and meta-analysis of prevalence, incidence, and risk factors. Journal of Global Health. 9 (1), 010427(2019).
- Akpan, N., et al. Intranasal delivery of caspase-9 inhibitor reduces caspase-6-dependent axon/neuron loss and improves neurological function after stroke. The Journal of neuroscience. 31 (24), 8894-8904 (2011).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564(2012).
- McStay, G. P., Salvesen, G. S., Green, D. R. Overlapping cleavage motif selectivity of caspases: implications for analysis of apoptotic pathways. Cell Death & Differentiation. 15 (2), 322-331 (2007).
- Kuida, K., et al. Reduced apoptosis and cytochrome c-mediated caspase activation in mice lacking caspase 9. Cell. 94 (3), 325-337 (1998).
- Troy, C. M., et al. Death in the balance: alternative participation of the caspase-2 and -9 pathways in neuronal death induced by nerve growth factor deprivation. Journal of Neuroscience. 21 (14), 5007-5016 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved