Method Article
Kanser Hücrelerinin İç Karotis Arter Enjeksiyonu ile Beyin Metastazının Modellenmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Beyin metastazı kanser hastalarında ciddi morbidite ve mortalite nedenidir. Çoğu beyin metastazı fare modeli, mortalite ve terapötik müdahale sonuçlarının kafa karıştırıcı analizini karıştıran sistemik metastazlar ile karmaşıktır. Burada, minimal sistemik tümörlerle tutarlı intrakraniyal tümörler üreten kanser hücrelerinin internal karotis enjeksiyonu için bir protokol sunulmaktadır.
Özet
Beyin metastazı kanser hastalarında ciddi morbidite ve mortalite nedenidir. Karmaşık nöral mikroçevre ve stromal hücre etkileşimi gibi metastatik hastalıkların kritik yönleri, in vitro tahlillerle tamamen çoğaltılamaz; Bu nedenle, hayvan modelleri, terapötik müdahalenin etkilerini araştırmak ve anlamak için kritik öneme sahiptir. Bununla birlikte, çoğu beyin tümörü ksenografting yöntemi, zaman dilimi ve tümör yükü açısından tutarlı bir şekilde beyin metastazı üretmez. Kanser hücrelerinin intrakardiyak enjeksiyonu ile oluşturulan beyin metastazı modelleri, istenmeyen ekstrakraniyal tümör yüküne neden olabilir ve beyin dışı metastatik morbidite ve mortaliteye yol açabilir. Kanser hücrelerinin intrakraniyal enjeksiyonu ekstrakraniyal tümör oluşumunu sınırlayabilse de, enjekte edilen hücrelerin enjeksiyon bölgesinde sıklıkla tekil bir tümör kütlesi oluşturması, yüksek leptomeningeal tutulum ve iğne penetrasyonu sırasında beyin vaskülatüründe hasar görmesi gibi çeşitli uyarıları vardır. Bu protokol, internal karotis arter enjeksiyonu ile üretilen beyin metastazının bir fare modelini tanımlar. Bu yöntem, diğer organların tutulumu olmadan sürekli olarak intrakraniyal tümörler üreterek beyin metastazı için terapötik ajanların değerlendirilmesini sağlar.
Giriş
Beyin metastazı çok kötü prognozile ilişkili yaygın bir malignitedir 1,2. Beyin metastazı hastalarında bakım standardı, hastaların genel sağlık durumuna, ekstrakraniyal hastalık yüküne, beyindeki tümörlerin sayısı ve konumuna bağlı olarak beyin cerrahisi, tüm beyin radyoterapisi ve/veya stereotaktik radyocerrahiden oluşan multimodaldir 3,4. Üç intrakraniyal lezyonu olan hastalar cerrahi rezeksiyon veya stereotaktik radyocerrahi için uygundur, oysa cerrahiye bağlı enfeksiyon ve ödem riskinden kaçınmak için çoklu lezyonları olan hastalar için tüm beyin radyasyon tedavisi önerilmektedir5. Bununla birlikte, tüm beyin radyoterapisi radyosensitif beyin yapılarına zarar verebilir ve düşük yaşam kalitesine katkıdabulunabilir 6.
Sistemik tedavi, multipl lezyonlu hastaların tedavisinde non-invaziv alternatif ve mantıklı bir yaklaşımdır7. Bununla birlikte, sistemik tedavilerin zayıf etkinliğe sahip olduğu uzun süredir devam eden fikir nedeniyle daha az düşünülmektedir, çünkü sitotoksik ilaçların kan dolaşımı yoluyla pasif olarak verilmesi, güvenli olmayan toksisite riski olmadan beyinde terapötik seviyelere ulaşamaz8. Bu paradigma, yakın zamanda ABD Gıda ve İlaç İdaresi (FDA) onaylı sistemik tedavi (metastatik HER2 + meme kanseri beyin metastazı için endike trastuzumab ve kapesitabin içeren tucatinib) 9,10,11,12 ve beyin metastazı hastaları için sistemik tedavi seçeneklerinin dikkate alınmasını içerecek şekilde tedavi kılavuzlarındaki güncelleme 13,14 ile değişmeye başlamaktadır.
Bu bağlamda, moleküler hedefli tedavi, immünoterapi ve hedefli nano ilaç taşıyıcısı gibi alternatif ilaç dağıtım sistemleri alanındaki gelişmeler, beyin metastazı tedavisinin zorluklarının potansiyel olarak üstesinden gelebilir15,16,17,18. Ek olarak, beyin-tümör bariyerinin geçirgenleştirilmesi yoluyla ilaç dağıtımını iyileştirmeye yönelik kimyasal ve mekanik yaklaşımlar da araştırılmaktadır19,20. Bu tür yaklaşımları amaca uygun olacak şekilde incelemek ve optimize etmek için, sadece beyin metastazının karmaşık fizyolojisini yansıtmakla kalmayıp aynı zamanda intrakraniyal ilaç yanıtının objektif analizine de izin veren preklinik modellerin kullanılması çok önemlidir.
Genel olarak, in vivo beyin metastazını modellemeye yönelik mevcut yaklaşımlar, farelerde kanser hücrelerinin intrakardiyak (sol ventrikül), intravenöz (genellikle kuyruk damarı), intrakraniyal veya intrakarotis (ortak karotis arter) enjeksiyonunu içerir 21,22,23,24,25,26,27 . Tümör engraftman stratejilerinin yanı sıra, tümör baskılayıcı genlerin çıkarılması veya onkogenlerin aktivasyonu ile tümör oluşumunun tetiklendiği genetik olarak tasarlanmış fare modelleri, tümör modellemesi için yararlıdır. Bununla birlikte, sadece birkaç genetiği değiştirilmiş fare modelinin ikincil tümörler ürettiği ve hatta daha azının güvenilir bir şekilde beyin metastazı ürettiği bildirilmiştir28,29,30.
İntrakardiyak (sol ventrikül) ve intravenöz (genellikle kuyruk veni) enjeksiyon gibi engraftman yöntemleri kanserin sistemik yayılımını taklit eder. Bu modeller tipik olarak, dolaşımdaki "ilk geçişleri" sırasında çoğu tümör hücresini yakalayan kılcal yatağa bağlı olarak birden fazla organda (örneğin, beyin, akciğerler, karaciğer, böbrekler, dalak) lezyonlar üretir31. Bununla birlikte, tutarsız beyin aşılama oranları, istenen istatistiksel güç için örneklem büyüklüğüne ulaşmak için daha fazla hayvan gerektirecektir. Bu intrakardiyak ve intravenöz enjeksiyon yöntemleriyle sonunda beyinde yerleşen tümör hücrelerinin sayısı değişkendir. Bu nedenle, beyin metastazı tümör yükü hayvanlar arasında değişebilir ve ilerlemedeki fark, deneysel zaman çizelgesini standartlaştırmayı ve sonuçların yorumlanmasını zorlaştırabilir. Ekstrakraniyal tümör yükü, beyin dışı metastaz mortalitesine yol açabilir ve bu da bu modelleri intrakraniyal etkinliği değerlendirmek için uygun hale getirmez. Ekstrakraniyal oluşumu azaltmak için yapay klonal seleksiyon süreçleri kullanılarak beyin-tropik hücre hatları oluşturulmuştur, ancak alım oranları tutarsızdır ve klonal seçim süreci normalde insan tümörlerinde bulunan heterojenliği azaltabilir32.
İntrakraniyal ve intrakarotis enjeksiyonu gibi beyne özgü engraftasyon yöntemleri, daha tutarlı ve verimli beyin metastazı modellemesine izin verir. İntrakraniyal yöntem33'te, kanser hücreleri tipik olarak frontal serebral kortekse enjekte edilir, bu da düşük sistemik tutulum ile hızlı ve tekrarlanabilir tümör büyümesi üretir. Prosedür düşük mortalite33 ile iyi tolere edilirken, uyarılar, beyindeki hücrelerin (lokalize) bir bolusunu hızla tanıtan ve erken beyin metastazı patogenezini modellemeyen nispeten kaba bir yaklaşım olmasıdır. İğne beyin dokusu vaskülatürüne zarar verir ve bu da lokalize inflamasyona neden olur 5,34. Deneyimlere göre, iğnenin çıkarılması sırasında tümör hücresi enjekte edilmesinin reflüye eğilimi vardır ve bu da leptomeningeal tutuluma yol açmaktadır. Alternatif olarak, intrakarotis yöntemi, hücreleri karşılaşılacak ilk kılcal yatak olarak beyin mikrovaskülatürü ile ortak karotis artere teslim eder, dolaşımda sağkalımı modeller, ekstravazasyon ve kolonizasyon24. Diğerleri25 ile aynı fikirde, bu yöntemle ilgili deneyimlerimiz, kanser hücrelerinin dış karotis arter yoluyla bu dokulardaki kılcal yataklara kasıtsız olarak verilmesine bağlı olarak yüz tümörlerine neden olabileceğini bulmuştur (yayınlanmamış veriler). Fasiyal tümörleri, yaygın karotis arter enjeksiyonundan önce eksternal karotis arteri bağlayarak önlemek mümkündür (Şekil 1). Makalenin geri kalanında, bu yöntem 'internal karotis arter enjeksiyonu' olarak adlandırılmaktadır. Deneyimlere göre, internal karotis arter enjeksiyon yöntemi sürekli olarak çok az sistemik olayla beyin metastazı üretir ve farklı primer kanserlerin (örneğin, melanom, meme ve akciğer kanserleri) beyin metastaz modellerinin üretilmesinde başarılı olmuştur (Şekil 1). Dezavantajları, teknik olarak zorlu, zaman alıcı, invaziv olması ve hücre sayılarının dikkatli bir şekilde optimize edilmesini ve bir izleme zaman çizelgesini gerektirmesidir. Özetle, hem intrakraniyal hem de internal karotis arter enjeksiyon yöntemleri, beyin tümörü ile ilişkili sağkalım yararı üzerindeki terapötik etkiyi değerlendirmek için uygun fare modelleri üretmektedir.
Bu protokol, neredeyse hiç sistemik tutulumu olmayan ve bu nedenle ilaç dağılımının klinik öncesi değerlendirmesi ve deneysel terapötiklerin etkinliği için uygun olan beyin metastazının bir fare modelini üretmek için internal karotis arter enjeksiyon yöntemini tanımlamaktadır.

Şekil 1: Beyin metastazı için internal karotis arter enjeksiyon protokolünün şematik gösterimi. Eksternal karotis arter ligasyonu ile internal karotis arter enjeksiyonu, çeşitli primer kanserlerden güvenilir bir şekilde beyin metastazı modeli üretebilir. Bu protokolde, karotis arter üzerine üç ligatür yerleştirilir (şekilde L1-L3 olarak belirtilmiştir). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Protokol
Tüm çalışmalar, Queensland Üniversitesi Hayvan Etik Komitesi (UQCCR / 186/19) ve Bilim Amaçlı Hayvanların Bakımı ve Kullanımı için Avustralya Yasası yönergeleri çerçevesinde yürütülmüştür.
1. Enjeksiyon için kanser hücrelerinin hazırlanması
NOT: Bu çalışmada insan meme kanseri hücre hattı BT-474 (BT474) kullanılmıştır. BT474, %10 fetal sığır serumu ve %1 insülin ile desteklenmiş RPMI 1640 ortamından oluşan tam büyüme ortamında kültürlendi. Hücreler, hava atmosferinde% 5 karbondioksit ile 37 ° C'de bir inkübatörde tutuldu. Uydu tandem ile hücre hattını doğrulayıntest 35 tekrarlar, varsa muhabir proteininin (örneğin, lusiferaz) ekspresyonunu onaylayın ve mikoplazma enfeksiyonunu kontrol edin.
- Tohum BT474 kanser hücreleri, enjeksiyondan önce% 70 -% 80 akıcılığa kadar, 10 mL tam büyüme ortamı ve kültürü (% 5 CO 2 ile 37 ° C'de) kullanarak bir T75 şişesine2.0 x 106 hücrelik bir tohumlama yoğunluğunda.
- Enjeksiyon gününde, büyüme ortamını atın ve hücre tek katmanını fosfat tamponlu salin (PBS) ile iki kez yıkayın.
- 5 mL önceden ısıtılmış hücre kültürü ayrışma reaktifi ekleyin ( bakınız Malzeme Tablosu) ve 37 ° C'de 5 dakika boyunca veya hücreler ayrılana kadar inkübe edin. 5 dakika sonra, hücre ayrılmasına yardımcı olmak için şişeye hafifçe dokunun.
- Dissosiyasyon reaktif aktivitesini söndürmek için% 10 fetal sığır serumu içeren 5 mL tam büyüme ortamı ekleyin.
- Hücre kümelerini azaltmak için pipetleme yaparak hücreleri nazikçe yeniden askıya alın.
- Hücre süspansiyonunu 50 mL'lik bir tüpe aktarın ve oda sıcaklığında 3 dakika boyunca 180 x g'de santrifüj yapın.
- Süpernatantı boşaltın ve hücre kümelenmesini en aza indirmek için hücre peletini kalsiyum ve magnezyum olmadan 10 mL Hank'in Dengeli Tuz Çözeltisi (HBSS) içinde yeniden askıya alın.
- Hücre süspansiyonunu oda sıcaklığında 3 dakika boyunca 180 x g'de santrifüj yapın.
- Artık serum/ayrışma reaktifini çıkarmak ve hücre peletini 3 mL HBSS'de yeniden askıya almak için süpernatantı boşaltın.
- Yeni bir 50 mL konik tüp üzerine 100 μm'lik bir hücre süzgeci yerleştirin ve hücre kümelerini çıkarmak için hücre süspansiyonunu geçirin.
NOT: Kan damarı tıkanıklığını ve enjeksiyonda felç riskini en aza indirmek için tek hücreli bir süspansiyon gereklidir. - Trypan Blue dışlamasını ve standart yöntemlerle bir hemositometreyi kullanarak canlı hücrelerin sayısını hesaplayın.
- Hücre süspansiyonunu HBSS ile 2.5 x 106 hücre / mL'lik bir hücre konsantrasyonuna seyreltin.
- Tüpü buz üzerinde yatay tutun ve kümelenmeyi en aza indirmek için tüpü periyodik olarak hafifçe sallayın. Hücre süspansiyonu maksimum 6 saat boyunca buz üzerinde saklanabilir.
NOT: Sallama manuel olarak yapıldı, ancak bu düşük devirde bir çalkalayıcı kullanılarak da yapılabilir.
2. Farenin prosedür için hazırlanması
NOT: Bu çalışmada 4-5 haftalık dişi NOD scid fareleri kullanıldı. İşlemden sonra beslenmeyi teşvik etmek için prosedürden 3 gün önce farelere yumuşak diyet kurtarma gıdaları (örneğin, diyet jeli, hidrojel, püresi fare chow) ekleyin.
- Otoklav cerrahi aletleri. Cerrahi alanı ve ekipmanı yüzey dezenfektanı ile püskürtün ve silin, ardından% 70 etanol ile silin.
- Hipotermiyi önlemek için cerrahi tahtanın altına bir hayvan ısı paspası yerleştirin. Bunu ameliyattan 30 dakika önce açın. Cerrahi tahtayı yüzey dezenfektanı ve ardından% 70 etanol ile püskürtün ve silin.
- İyileşme için temiz bir hayvan barınağı kafesi ve sıcak bir ısıtma yastığı hazırlayın.
- Temiz kişisel koruyucu ekipman (önlük, maske, saç filesi ve eldivenler) giyin. Temiz muayene eldivenleri ve 'sadece alet uçları' tekniği kullanarak prosedür boyunca steriliteyi koruyun.
- Fare pedal refleksini kaybedene kadar 2 L/dak oksijen akışına sahip %5 izofluran kullanarak fareyi anestezik bir odacıkla uyuşturun.
- Hayvanı odadan çıkarın ve kalan cerrahi prosedür için 2 L / dak'lık bir oksijen akışında% 2 izofluran veren bir burun konisine yerleştirin.
- Tanımlama için kulak delme faresi ve kürkü boyun bölgesinden tıraş etmek için elektrikli makaslar kullanın. Fazla saçları bant kullanarak maruz kalan ciltten temizleyin.
- Gerekli anestezik ve analjezik ilaç dozlarını hesaplamak için fareyi tartın. Buprenorfin ve meloksikamı subkutan enjeksiyon yoluyla sırasıyla 50 μg / kg ve 1 mg / kg'da uygulayın.
- Fareyi sıcak bir ameliyat tahtasına aktarın ve burun konisini bantla sabitleyin.
- Kurumayı önlemek için gözlere oküler kayganlaştırıcı uygulayın.
- Önce ameliyat tahtasına bantlanmış iplik kullanarak üst kesici dişleri bağlayarak fareyi nazikçe sabitleyin, ardından ön ve arka bacakları bantlayın. Bu adım vücudu uzatır ve işlem sırasında boynu düz tutar.
- Ameliyat öncesi cilt hazırlığını aşağıda açıklandığı gibi gerçekleştirin.
- Cilt mikroflorası yükünü azaltmak ve gevşek saçları çıkarmak için boynu topikal antiseptik (povidon-iyot) ile silin. Cildin merkezinden temizleyin, kesi yerinin yeniden kirlenmesini önlemek için dışa doğru çalışın. İşlemi% 70 etanol kullanarak tekrarlayın. Dezenfeksiyon için üç alternatif iyot ve etanol turu gerçekleştirin.
- Hayvanın üzerine cerrahi bir örtü koyun. Bu, bir parça steril kağıt havlu veya otoklav torbasından kesilir ve şekillendirilir.
- Cerrahi aletler için steril kağıt havlular veya otoklav torbalar yerleştirin.
- Prosedüre devam etmeden önce yeterli anesteziyi sağlamak için 'Çimdik testi' ile refleksi kontrol edin.
3. Dahili karotis enjeksiyonu
NOT: Bu deneyde, enjeksiyon prosedürünü kolaylaştırmak için 31 G infüzyon kanülü ve ayakla aktive edilen şırınga sürücüsü kurulumu kullanılmıştır (Ek Şekil 1). Bu kurulum isteğe bağlıdır ve kullanıcı 31 G insülin şırıngası kullanabilir ve 3.11 ve 3.12 adımlarını atlayabilir. İnfüzyon kanülünü hazırlamak için, iğne kısmını iki çift dikiş kelepçesi kullanarak 31 G'lik bir iğnenin şırınga montaj kısmından çekin ve ayırın. Daha sonra, iğne kısmını yaklaşık 10 cm uzunluğunda ince bir infüzyon tüpünün bir ucuna takın.
- Diseksiyon mikroskobunu farenin üzerine yerleştirin.
- Makas kullanarak, çenenin 5 mm altından torasik girişe kadar boyun bölgesindeki orta hat boyunca dikey 15 mm'lik bir kesi yapın.
- İki çift açılı forseps kullanarak, cildi ve altta yatan tükürük bezlerini ayırın ve trakeayı açıkta tutmak için retraktörler uygulayın. Bir sonraki adım, trakeaya paralel uzanan karotis kılıfı ortaya çıkaracaktır.
- İki çift ince açılı forseps kullanarak, sağ karotis kılıfını ortaya çıkarmak için trakeaya bitişik kas ve yağ dokusunu açıkça diseke edin. Karotis kılıfı, ortak karotis arter, ven ve vagus sinirini kaplayan fibröz tabakadır ve bu demet parlak kırmızı ortak karotis arter tarafından görselleştirilebilir. Bu çalışmada enjeksiyon sağ karotis artere yapıldı.
- Ortak karotis arter kaudalinin bir segmentini, çevreleyen fasyanın karotis bifurkasyonuna temizleyin ve vagus siniri ve damarlarından ayırın.
- Karotis bifurkasyonunu (dış ve iç karotis arterleri birleştiren kavşak) çevreleyen sinirlerden ve fasyadan izole edin ve temizleyin. İnce forsepsleri dış karotis arterin altına yerleştirin ve arterin altına ipek bir sütür (5-0 kalınlıkta) geçirin. Dikişi düğümleyin ve sıkın ve fazla çizgiyi kesin.
NOT: Bu ligatür (L1), enjekte edilen maddenin eksternal karotis arterden geçmesini önleyecektir. - İnce forsepsleri ortak karotis arterin altına yerleştirin ve arterin altına ipek bir sütür (5-0 kalınlıkta) geçirin. Bir düğüm bağlayın ve sütürü önerilen enjeksiyon bölgesine yakın bir konumda sıkın. Fazla dikişi yaklaşık 10 mm çizgi bırakarak kesin.
NOT: Bu ikinci ligatür (L2), enjeksiyondan sonra kan akışını ve kanamayı kısıtlayacaktır. Ayrıca enjeksiyon sırasında karotis arteri konumlandırmak ve tutmak için kullanılır. - Yaklaşık 10 mm x 5 mm boyutlarında (otoklavlanmış) düşük tiftikli tek kullanımlık sileceklerden oluşan bir şeridi kesin ve nemlendirin (Malzeme Tablosuna bakınız). Şeridi 4 mm x 5 mm, 2-3 mm kalınlığında katlayın ve önerilen enjeksiyon bölgesinde karotis arterin altına yerleştirin. Bu, enjeksiyon sırasında damarı destekleyecektir.
- Önerilen enjeksiyon bölgesine ortak karotis arter rostralinde, gevşek bir düğüm ile üçüncü bir ligasyon (L3) yerleştirin. Bu sadece enjeksiyondan sonra sıkılır (adım 3.16'da).
- Hücre süspansiyonunu nazikçe çalkalayın ve 200 μL hücre süspansiyonunu bir insülin şırıngasına (31 G iğne ile) çekin.
- Şırıngayı, etkinleştirici bir ayak pedalına bağlı şırınga sürücüsüne yükleyin.
- Şırıngaya 31 G iğneli ince bir kanül takın ve hattı astarlayın.
- Karotis arterin iyi konumlandırılmış ve basınçlı olup olmadığını kontrol edin.
- Biri ilk ligatürün ucuna hafifçe gerilen ve diğeri 31 G iğnesini tutan iki ince açılı forseps kullanarak, iğneyi yavaşça delmemeye dikkat ederek kan damarının lümenine eğimli olarak yerleştirin.
- 10 μL / s'de ortak karotis arterine yavaşça 100 μL hücre süspansiyonu (adım 1.13'ten itibaren) enjekte edin. Bu, kan damarına 2.5 x 105 hücre verecektir. Başarılı enjeksiyon, karotis kan damarından kanın temizlenmesiyle görselleştirilir.
- Geri akışı ve kanamayı önlemek için iğneyi geri çektikten hemen sonra gevşek bağı (L3) (adım 3.9'dan itibaren) yavaşça kaldırın ve sıkın. Fazla dikişi kesin.
NOT: İğnenin çekilmesinden sonra az miktarda kan fışkırdığını gözlemlemek normaldir. Bununla birlikte, üçüncü ligatür sıkıldıktan sonra herhangi bir aktif kanama olmamalıdır. - Nemlendirilmiş düşük tiftikli tek kullanımlık sileceklerin parçasını çıkarın.
- Bir P200 pipet kullanarak, cerrahi boşluğu 150-200 μL steril su veya salin ile iki kez durulayın.
- Kanama olup olmadığını tekrar kontrol edin ve ardından retraktörleri çıkarın.
- Yumuşak dokuyu, tükürük bezlerini ve cildi karotis arter ve trakea üzerinde yeniden konumlandırın.
- Kesinin cilt tabakasını bir dikiş iğnesi tutucusu, forseps ve emilebilir veya emilemeyen 6/0 monofilament sütür kullanarak sürekli bir düzende kapatın.
- Kanül iğnesi şırıngasını atın ve bir sonraki fare için yeni bir kurulum hazırlayın. Yeni bir şırınga kullanmak, her fareye enjekte edilen hücre sayısının tutarlı olmasını sağlayacaktır.
NOT: Prosedürün temsili anlık görüntüleri Ek Şekil 2'de yer almaktadır. Damar iğne tarafından delinir veya yırtılırsa, enjekte veya kanama sızıntısı ile gösterilirse, prosedür başarısız sayılır. Bunu takiben, iğne geri çekilmeli ve daha fazla kanamayı önlemek için üçüncü ligatür derhal sıkılmalıdır. Dikişin sıkılmasından sonra kanama devam ederse, hayvan pentobarbital ile ötenazi yapılmalıdır.
4. Enjeksiyon sonrası iyileşme
- Cerrahi sonrası ağrı kesici olarak deri altı enjeksiyon yoluyla buprenorfin (50 μg / kg) ve meloksikam (1 mg / kg) enjekte edin.
- Anesteziden kurtulmak için hayvanı sıcak ve temiz bir kafese taşıyın. Bir hayvanın uyandıktan sonra bastırılmış aktiviteye (toplanmış ve aktif olmayan veya yavaşça hareket eden) sahip olması normaldir.
- 30-45 dakika sonra, fareleri uzun süreli bir tutma tesisine aktarın.
- Farelere ameliyat sonrası en az bir hafta boyunca yumuşak bir diyet (diyet jeli, hidrojel, püre) sağlayın ve yara bölgesi çevresinde inme, enfeksiyon, kanama belirtileri için özel dikkat göstererek günlük fiziksel durumu kontrol edin.
- Ameliyattan iki gün sonra, hayvanın aktivitesinin azalması, hafif karıştırılmış kürkü ve ameliyat öncesi vücut ağırlığının% 15'ini kaybetmesi tipiktir. Ağrıyı yönetmek ve iyileşmeye yardımcı olmak için ameliyat sonrası 2-3 gün boyunca günlük analjezik (meloksikam) uygulayın.
- 3. günden itibaren, hayvanlar aktivitelerini yeniden kazanmış, beslenme ve tımar sıklığında artmış ve kilo almış olmalıdır. Ameliyattan 4 gün sonra intraperitoneal enjeksiyon yoluyla 200 mg / kg'da sodyum pentobarbital enjekte ederek kalıcı fiziksel durum açıkları (ağrı, toplanmış, inaktif, kilo kaybı) olan hayvanları ötenazileştirin.
- Tümör engraftmanı ve progresyonu, biyolüminesan görüntüleme, MRG veya PET/MRG gibi anestezi ve tercih edilen görüntüleme yöntemleri kullanılarak izlenebilir. Bu tür bir görüntülemeyi üstlenme gerekliliği ve yeteneği, doğası gereği üstlenildiği bireysel proje amaçlarına ve tesisine bağlı olacaktır ve kullanılan hücre hatlarını etiketleyen muhabirin türüne bağlı olarak, ilgili radyokimya ve nükleer görüntüleme tesislerinin erişilebilirliği36,37
NOT: Bazı hayvanlar başarılı bir prosedüre rağmen iyi yanıt vermeyebilir ve felç geçirebilir. İşlemden sonra, herhangi bir nörolojik sıkıntı belirtisi gösteren hayvanlar (başını çevirmek ve bir tarafa çekmek, daire davranışı, yuvarlanma, çarpma, motor fonksiyon kaybı) derhal ötenazi yapılmalıdır.
Sonuçlar
Eksternal karotis arter ligasyonu ile veya eksternal karotis arter ligasyonu olmadan yaygın karotis arter enjeksiyonunun karşılaştırılması
Kanser hücreleri, ilk önce eksternal karotis arter24'ü bağlamadan ortak karotis arter yoluyla enjekte edildiğinde, aşılanmış farelerin% 77.8'inde (n = 7/9 hayvanlar) yüz tümörleri bulundu. Fasiyal tümörün bir örneği Ek Şekil 3'te gösterilmiştir. Bu protokolde açıklanan yöntem, eksternal karotis arteri ortak karotis arterden önce bağlayarak istenmeyen fasiyal metastazı önler.
İki yöntemi karşılaştırmak için, lektin, eksternal karotis arter ligasyonu olan veya olmayan itlaf edilen farelerin ortak karotis arterine enjekte edildi. Daha sonra, yüz dokusu ve beyin floresan mikroskop altında sabitlendi, işlendi ve gözlemlendi. Dış karotis arter bağlandığında yanak dokularında immünofloresan analizinde lektinde azalma gözlendi (Şekil 2A-B). Sonuçlar ayrıca, eksternal karotis arter ligasyonunun beyin doğumunu etkilemediğini göstermektedir, çünkü lektin, eksternal karotis arter ligasyonu ile ortak karotis arter enjeksiyonu yapılan farelerin beyin dokusunda gözlenebilir (Şekil 2C-D). Bu nedenle, bu ek adım, kanser hücrelerinin iç karotis arter yoluyla beyne verilmesini yüz dokusuna minimum tohumlama ile yönlendirebilir.

Şekil 2: Eksternal karotis arter ligasyonu ile birlikte ve eksternal arter ligasyonu olmadan intrakarotis greft verilmesi. Lektinli (yeşil) farelerin sağ yanak kasının (A,B) ve beyinlerinin (C,D) floresan görüntülenmesi, (A,C) ile veya (B,D) eksternal karotis ligasyonu olmadan ortak karotis artere iletilir. Yanak ve beyin 20x ve 5x büyütmede görüntülendi ve ölçek çubukları sırasıyla 50 ve 200 μm'yi temsil etti. Çekirdekler (mavi) DAPI ile boyandı. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Biyolüminesan izleme
Bu çalışmada, lusiferazı eksprese etmek için genetik olarak modifiye edilmiş bir HER2 amplifikatörlü meme kanseri hücre hattı olan BT474, lusiferin uygulayarak ve in vivo biyolüminesan görüntüleme yaparak tümör ilerlemesinin haftalık olarak izlenmesini sağlamak için kullanılmıştır. Bu BT474 beyin metastazı modelinde, biyolüminesan sinyaller internal karotis enjeksiyonu sonrası 5. haftadan itibaren gözlemlenebilir ve zamanla yoğunluğu giderek artmıştır (Şekil 3).
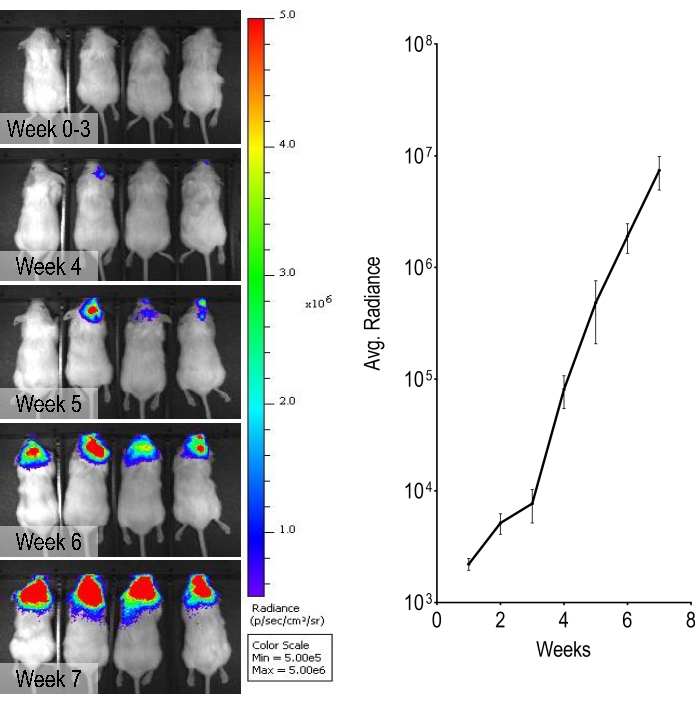
Şekil 3: Biyolüminesan monitörizasyonu ve biyolüminesans sinyalinin nicelleştirilmesi. 0. haftadan 7. haftaya kadar olan temsili haftalık biyolüminesan görüntüler, kafadan kaynaklanan yoğunluğun arttığını göstermektedir. Grafik, farelerde biyolüminesan sinyallerin miktarını göstermektedir. Veriler, standart hata ± anlamına gelir (n = 4). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Manyetik rezonans görüntüleme (MRG)
Beyin metastazı hayvan modeli, intrakraniyal tümör progresyonunu değerlendirmek için 2, 5 ve 8. haftalarda T2 ağırlıklı MRG kullanılarak görüntülendi. 5. haftadan 8. haftaya kadar, heterojen sinyal yoğunluğuna sahip bir bölge gözlenebilir, bu da muhtemelen bozulmuş tümör vaskülatürünün, kompleks sıvı perfüzyonuna sahip bir intrakraniyal tümörü gösterir (Şekil 4A). Beyin metastazı modelindeki kan-beyin bariyeri bozulur ve klinik beyin metastazınınkine benzer. Bu, gadolinyum kontrast artışı ve ardından T1 ağırlıklı MRG sekansı kullanılarak değerlendirildi. Tümör bölgesindeki gadolinyum konsantrasyonu, kan dolaşımından tümör dokusuna sızdıkça artar. Bu, T1 gevşeme süresinin kısalmasını temsil eden karanlık bölge ile gösterilmiştir (Şekil 4B). Elde edilen veriler, ilaç erişimini kan-beyin-bariyer geçirgenliği ile ilişkilendirmek için kullanılabilir. Ek olarak, intrakraniyal tümör hacmi ve yüzey alanı, 3D Dilimleyici görüntü analiz yazılımı kullanılarak volümetrik segmentasyon yapılarak elde edilebilir (Şekil 4C). Bu, beyin tümörü büyümesini izlemek için zamana karşı bir grafikte çizilebilir.

Şekil 4: Manyetik rezonans görüntüleme kullanılarak beyin metastazı hayvan modelinin karakterizasyonu . (A) Modelin T2 ağırlıklı enine, koronal ve sagital taramaları 1, 5 ve 8. haftalarda. 5. haftada, 8. haftada hiperintens ve heterojen bir bölgeye ilerleyen sagital görünümde (kırmızı ok) soluk yamalı bir alan görülebilir. (B) Gadolinyum kontrast arttırıcı (CE) ajanın enjeksiyonundan önce ve sonra bir beyin tümörü (kırmızı bölge) gösteren dinamik kontrastlı T1 ağırlıklı MRG. Karanlık bölgeler gadolinyum sızıntısını ve alımını gösterir. (C) Koronal, transvers ve sagital düzlemlerde görselleştirilen tümör, intrakraniyal tümör hacmini elde etmek için 3D Dilimleyici görüntü analiz yazılımı kullanılarak açıklanmış ve bölümlere ayrılmıştır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Nanotıbbın biyodağılımını belirlemek için PET/MR görüntüleme
Bozulmuş kan-beyin bariyeri ve sızdıran tümör vaskülatürünün kombinasyonu, gelişmiş geçirgenlik ve retansiyon etkisi36,37 yoluyla nano ölçekli terapötiklerin pasif alımını ve birikimini kolaylaştırır. BT474 beyin metastazı modeli HER2'yi aşırı eksprese ettiğinden, pozitron emisyon tomografisi / manyetik rezonans (PET / MR) görüntülemesi kullanılarak zirkonyum-89 etiketli HER2 hedefli bir nanoilacın beyin alımı gerçekleştirildi (Şekil 5). BT474 BM farelerinin bir kohortunda, tümör bölgesinde tespit edilen nanotıp, dahil olmayan beyin bölgelerindekinden daha yüksekti ve beyin metastazlarında nanotıp birikimini doğruladı.

Şekil 5: BT474 beyin metastazı farelerinde HER2 hedefli nanotıp (89 Zr-HER2-NM) etiketli zirkonyum-89'un temsili PET/MR görüntüsü. (A) Soldaki görüntü, beyin tümörünü (kırmızı bölge) ve dahil olmayan beyni (mavi bölge) gösteren T2 ağırlıklı MRG'yi (koronal görünüm) göstermektedir. İki bitişik görüntü, PET bindirmesi ile üst üste bindirilmiş MRI görüntülerini (koronal ve enine görünüm) göstermektedir. Renklendirilmiş PET kaplaması, tümör bölgesinin, dahil olmayan bölgelere (mavi / yeşil) kıyasla nanotıbbın (beyaz, kırmızı, sarı) daha yüksek alımına sahip olduğunu göstermektedir. (B) Grafik, PET sinyal yoğunluğundaki artışı ve nanotıp alımındaki artışı (gram başına enjekte edilen doz, ID / g) beyin tümörlerinde dahil olmayan beyne göre göstermektedir (n = 12). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
BM modellerinin hayatta kalması ve fiziksel durumu
BT474 beyin metastazı modeli, enjeksiyondan sonra ortalama 9 hafta hayatta kaldı (Şekil 6). Beyin metastazları ilerledikçe, hayvanlar% 20'ye kadar vücut ağırlığını kaybetmeye başladı ve bu da ötenazi gerektirdi (6-9. Hafta arasında). Geç evre beyin metastazlarında, ortak sunumlar arasında karıştırılmış kürk ve şişkin ve kubbeli kafataları bulunur. Hayvanlar genellikle inaktifti, toplanmıştı ve motor becerilerde ve güçte fonksiyonel eksiklikler gösterdi.

Resim 6: BT474 beyin metastazı fare modelinin Kaplan Meier eğrisi. Ortalama sağkalım enjeksiyondan 9 hafta sonraydı (n = 18). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Histoloji
Ötanazi sonrasında, beyin histolojisi mimarisini korumak için hayvanlar% 4'lük bir paraformaldehit çözeltisi ile perfüze edildi40. Daha sonra, beyinler ve diğer organlar hematoksilin ve eozin (H & E) ile işlendi, bölümlere ayrıldı ve boyandı. Bu beyin metastazı modelinde, tümörler karotis enjeksiyonunun yan tarafıyla eşleşen tek taraflı olarak yerleştirilmiştir (Şekil 7A). BT474 tümörleri çoğunlukla serebral yarımkürenin neredeyse yarısını tutan katı soliter kitleler olarak ortaya çıkmıştır (Şekil 7B). Boş alan cepleri sıklıkla gözlendi ve nekrotik hücrelerden oluşuyordu (Şekil 7C). Bazı hayvanlarda daha küçük çıkıntılar da mevcuttu (Şekil 7E). İmmünohistokimya boyaması, BT474 beyin metastazlarının güçlü HER2 ve HER3'ü eksprese ettiğini ve bu modelin HER2 ve HER3 hedefli tedaviler için uygun olduğunu düşündürmektedir (Şekil 7F).

Şekil 7: BT474 beyin metastazı modelinin beyin histolojisi. (A) BT474 BM farenin temsili beyin bölümü; renkli kutular genişletilmiş ilgi alanlarını işaretledi. Ölçek çubuğu = 2 mm. (B) Epiteloid hücre kütlesinden oluşan solid tümör. (C) Bir boşluk içindeki nekrotik hücreler. (D) Tümör-beyin arayüzü (E) Mikrometastaz olarak bilinen küçük büyümeler. (B-E Ölçek çubuğu = 200 μm). (F) HER2 ve HER3 pozitifliğini gösteren immünohistokimya görüntüleri ve eşleşen hematoksilin ve eozin (H&E). Ölçek çubuğu = 100 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Sistemik tutulum
Diğer organlardan doku kesitlerinde tümör saptanmadı (Şekil 8). Bu bulgu, biyolüminesansın sadece hayvanların kafalarından tespit edildiği biyolüminesan verilerle aynı fikirdedir. Birlikte, sonuçlar bu modelin saptanabilir sistemik tümörlerle ilişkili olmadığını göstermiştir.

Şekil 8: Diğer organların histolojisi. Taranan organlarda belirgin bir tümör tutulumu yoktu: kemik, karaciğer, böbrek, pankreas, akciğer, kalp, dalak, bağırsak ve yumurtalık. Ölçek çubuğu = 100 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: Dahili karotis arter enjeksiyonu için kanül-şırınga. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Şekil 2: İç karotis arter enjeksiyon sürecinin anlık görüntüleri. Resim açıklaması Ek Tablo 1'de verilmiştir. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Şekil 3: T2 ağırlıklı MRG, sağ yüz dokusunda büyük bir kas içi tümör gösterir (kırmızı ana hatlarıyla). H & E boyalı doku bölümü, yoğun bir şekilde paketlenmiş tümör hücrelerini ortaya çıkarır. Ölçek çubuğu = 2 mm (ortada) ve 100 μm (sağda). Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Tablo 1: Ek Şekil 2'de internal karotis arter enjeksiyonunun adım adım açıklaması. Bu Dosyayı indirmek için lütfen tıklayınız.
Tartışmalar
Beyin metastazı, kanser hücrelerinin birincil bölgelerinden beyne yayılmasının karmaşık bir sürecidir. Bu çok adımlı sürecin belirli aşamalarını yansıtan farklı hayvan modelleri mevcuttur ve klinik öncesi metastaz çalışmalarının tasarlanmasında fizyolojik ve pratik hususlar vardır41,42. Beyin metastazı tedavisinde nanotıp kullanımını araştıran yayınlanmış çalışmaların çoğunda intrakardiyak 43,44 ve intrakraniyal 45,46,47,48,49 modelleri kullanılmıştır. Kanser hücrelerinin karotis arter yoluyla aşılanması, metastatik süreci ve beyin metastazı patobiyolojisini daha iyi özetleyebilir.
Bununla birlikte, deneyimlere göre, yaygın karotis enjeksiyon tekniği, erken zaman noktalarında önemli yüz tümörleri ile başvuran birkaç hayvanla sonuçlanmıştır. Hem aktif beyin hem de yüz tümörü olan hayvanlarda, yüz tümörlerinin beyin tümörlerinden daha hızlı büyüdüğü gözlenmiştir. Bu, tümör büyümesini destekleyen daha vaskülarize mikro ortamdan kaynaklanıyor olabilir (Ek Şekil 3).
Ortak karotis arter, sırasıyla dış ve karotis arterler aracılığıyla yüz bölgesine ve beyne kan sağlar. Bu nedenle, diğerleri25 ile aynı fikirde, kanser hücrelerinin ortak karotis arter yoluyla enjekte edilmesi, her iki bölgede de tohumlamaya yol açacaktır. Fasiyal tümörleri, yaygın karotis arter enjeksiyonundan önce eksternal karotis arteri bağlayarak önlemek mümkündür.
Burada açıklanan internal karotis arter enjeksiyon yöntemi, kanser hücrelerini beyni besleyen birincil kan damarına sokarak beyin metastazını simüle eder. Bu model, dolaşımdaki kanser hücrelerinin beynin vasküler yatağında barınmasını özetleyerek, transmigrasyonlarına ve metastatik beyin büyümesinin oluşumuna izin verir. Sonuçlar, karotis arter enjeksiyonunun, kanserin intrakardiyak enjeksiyon gibi yöntemlerle ilişkili diğer organlara tohumlanmasını sınırladığını göstermektedir.
Protokol için dikkat edilmesi gereken bazı kritik noktalar ve sorun giderme bilgileri vardır. İlk olarak, hücre kümeleri kafa içi kan damarlarını tıkayabilir ve inmeyi tetikleyebilir. Bu, kümesiz bir hücre süspansiyonu sağlamak için hücre süspansiyonunu bir hücre süzgecinden geçirerek hafifletilebilir. Daha sonra, beyne aşırı sıvı enjekte etmek enflamatuar ödem ile sonuçlanabilir ve vasküler lateralizasyonu engelleyebilir. Bu, 100 μL'den daha az enjeksiyon hacmi kullanılarak önlenebilir. yıpranmış uçları olan bir sütür kullanmak ve fasya veya fibroyağlı dokunun varlığı, eksternal karotis arter etrafındaki sütür döngüsünü engelleyebilir. Forseps ile arter boyunca hafif bir silme hareketi uygulayarak öncelikle fasya veya fibroyağ dokusunun temizlenmesi ve dikişin ucunu keserek yıpranma uçlarının çıkarılması önerilir. Son olarak, kanser hücre hatları benzersiz büyüme oranlarına sahiptir ve bu nedenle, enjeksiyon için hücre konsantrasyonunu optimize etmek önemlidir. Deneyimlere göre, sırasıyla agresif insan kanseri hücre hatları NCI-H1975 ve A2058'i içeren akciğer ve melanom beyin metastazı modellerinde, hızlı hastalık ilerlemesini önlemek için daha az hücre (100 μL'de 1 x 105 hücre) enjekte edildi.
Bu protokoldeki en zorlu adım, karotis artere iğne sokulması ve hücrelerin enjekte edilmesidir. Sterilite için hayvan başına yeni bir iğne kullanılması önerilir, çünkü künt iğnelerin kullanılması kan damarlarının delinmesi veya yırtılması riskini artırır. Ayrıca, enjeksiyon sırasında enjekte edilen ve titreyen iğnenin ilk atılımını azaltmak için prosedür için bir şırınga sürücüsü kullanılması önerilir. Şırınga sürücüsü ayrıca enjeksiyon hızını fizyolojik kan akış hızıyla eşleştirmek için ek bir avantaja sahiptir.
Bu protokol sınırlama olmaksızın değildir. Prosedür teknik olarak zordur ve başarılı bir prosedürden geçmesine rağmen hayvanların lateralizasyon başarısızlığından inmeye yenik düşme riski vardır. Deneyimlerimize göre, inme oranı% 11.4'tür (n = 21/168 hayvan). Bu nedenle, başlangıç örneklem büyüklüğü, felçten ölecek bu hayvanları hesaba katmalıdır. Bu yöntem kanser hücrelerini doğrudan beyne doğru ilettiğinden, sistemik tümör yükünü azaltmıştır ve bu nedenle sistemik yayılımı incelemek için ideal değildir.
Özetle, protokol ilaç taraması için uygun beyin metastazı fare modelinin üretilmesine ve ilaçların terapötik profilinin değerlendirilmesine olanak sağlayacaktır.
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan ederler. Fon verenlerin çalışmanın tasarımında hiçbir rolü yoktu; verilerin toplanmasında, analizinde veya yorumlanmasında; Makalenin yazımında veya makalenin yayınlanması kararında.
Teşekkürler
Bu araştırma, Avustralya Ulusal Sağlık ve Tıbbi Araştırma Konseyi (NHMRC), hibe numarası APP1162560 tarafından finanse edilmiştir. ML, bir UQ lisansüstü araştırma bursu ile finanse edildi. Hayvancılığa ve hayvanların in vivo görüntülenmesine yardımcı olan herkese teşekkür ederiz. Royal Brisbane ve Kadın Hastanesi'ne bu çalışma için zirkonyum alikotları bağışladıkları için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 100µm cell strainer | Corning | CLS431752 | |
| 30G Microlance needle | BD | 23748 | |
| 31G Ultra-Fine II insulin syringe | BD | 326103 | |
| Angled forceps | Proscitech | T67A-SS | Fine pointed, angled without serrations, 18mm tip, length 128 mm |
| Animal heat mat | |||
| Antibiotic and antimycotic | ThermoFisher Scientific | 15240062 | |
| Autoclave bags | |||
| BT-474 (HTB-20) breast cancer cell line | ATCC | HTB-20 | |
| Buprenorphine (TEMGESIC) | |||
| Countess cell counter | ThermoFisher Scientific | C10227 | |
| Diet-76A | ClearH2O | 72-07-5022 | |
| Dissection microscope | |||
| Ear puncher | |||
| Electric clippers | |||
| Fine angled forceps | Proscitech | DEF11063-07 | Angled 45°, Tip smooth, Tip width: 0.4 mm, Tip dimension: 0.4 x 0.3 mm, length 9cm |
| Fine tubing for cannula, Tubing OD (in) 1/32, Tubing ID (in) 1/100in | Cole Parmer | EW-06419-00 | |
| Foetal bovine serum | ThermoFisher Scientific | 26140079 | |
| Hank's Balanced Salt Solution without calcium and magnesium | ThermoFisher Scientific | 14170120 | |
| Hydrogel | ClearH2O | 70-01-5022 | |
| Isoflurane | |||
| Kimwipes Low lint disposable wipers | Kimberly Clark- Kimwipes | Z188964 | |
| Mashed mouse chow | |||
| Meloxicam (METACAM) | |||
| Nose cone | Fashioned out of a microfuge tube | ||
| PAA ocular lubricant (Carbomer 2mg/g) | Bausch and lomb | ||
| Povidone-iodine solution | Betadine | 2505692 | |
| PPE (glove, mask, gown, hairnet) | |||
| Retractors | Kent Scientific | SURGI-5001 | |
| RPMI 1640 Media | ThermoFisher Scientific | 11875093 | |
| Silk suture 13mm 5-0, P3, 45cm | Ethicon | JJ-640G | |
| Sterile normal saline | ThermoFisher Scientific | TM4469 | |
| Sticky tape | |||
| Surgical board | A chopping board wrapped with autoclavable bag. | ||
| Surgical scissors | Proscitech | T104 | Tip Dimensions (LxD): 38x7mm, Length 115mm |
| Suture forcep/ Curved Brophy forceps | Proscitech | T113C | Curved, Rounded narrow 2 mm tip, with serrations, length 165 mm |
| Suture needle holder (Olsen Hegar needle holder) | Proscitech | TC1322-180 | length 190 mm, ratchet clamp |
| Syringe driver with foot pedal/ UMP3 Ultra micro pump | World Precision Instruments | UMP3-3 | |
| T75 tissue culture flask | ThermoFisher Scientific | 156499 | |
| Thread | |||
| Trigene II surface disinfectant | Ceva | ||
| Trypan Blue and Cell Counting Chamber Slides | ThermoFisher Scientific | C10228 | |
| TrypLE Express dissociating medium | ThermoFisher Scientific | 12605010 |
Referanslar
- Nayak, L., Lee, E. Q., Wen, P. Y. Epidemiology of brain metastases. Current Oncology Reports. 14 (1), 48-54 (2012).
- Australian Institute of Health and Welfare. Cancer in Australia. , Canberra: AIHW. (2017).
- Maher, E. A., Mietz, J., Arteaga, C. L., DePinho, R. A., Mohla, S. Brain metastasis: opportunities in basic and translational research. Cancer Research. 69 (15), 6015-6020 (2009).
- Lin, N. U. Breast cancer brain metastases: new directions in systemic therapy. Ecancermedicalscience. 7, (2013).
- Zimmer, A. S., Van Swearingen, A. E. D., Anders, C. K. HER2-positive breast cancer brain metastasis: A new and exciting landscape. Cancer Reports. 5 (4), (2020).
- Brown, P. D., et al. Postoperative stereotactic radiosurgery compared with whole brain radiotherapy for resected metastatic brain disease (NCCTG N107C/CEC·3): a multicentre, randomised, controlled, phase 3 trial. Lancet Oncology. 18 (8), 1049-1060 (2017).
- Murrell, J., Board, R. The use of systemic therapies for the treatment of brain metastases in metastatic melanoma: Opportunities and unanswered questions. Cancer Treatment Reviews. 39 (8), 833-838 (2013).
- Stemmler, H. J., et al. Ratio of trastuzumab levels in serum and cerebrospinal fluid is altered in HER2-positive breast cancer patients with brain metastases and impairment of blood-brain barrier. Anticancer Drugs. 18 (1), 23-28 (2007).
- Venur, V. A., Leone, J. P. Targeted therapies for brain metastases from breast cancer. International Journal of Molecular Sciences. 17 (9), 1543(2016).
- Murthy, R., et al. Tucatinib with capecitabine and trastuzumab in advanced HER2-positive metastatic breast cancer with and without brain metastases: a non-randomised, open-label, phase 1b study. The Lancet Oncology. 19 (7), 880-888 (2018).
- Murthy, R. K., et al. trastuzumab, and capecitabine for HER2-positive metastatic breast cancer. New England Journal of Medicine. 382 (7), 597-609 (2019).
- Shah, M., et al. FDA approval summary: Tucatinib for the treatment of patients with advanced or metastatic HER2-positive breast cancer. Clinical Cancer Research. 27 (5), 1220-1226 (2021).
- Vogelbaum, M. A., et al. Treatment for brain metastases: ASCO-SNO-ASTRO guideline. Journal of Clinical Oncology. 40 (5), 492-516 (2021).
- Ramakrishna, N., et al. Management of advanced human epidermal growth factor receptor 2-positive breast cancer and brain metastases: ASCO guideline update. Journal of Clinical Oncology. 10, (2022).
- Li, J., et al. A multifunctional polymeric nanotheranostic system delivers doxorubicin and imaging agents across the blood-brain barrier targeting brain metastases of breast cancer. ACS Nano. 8 (10), 9925-9940 (2014).
- Mittapalli, R. K., et al. Paclitaxel-hyaluronic nanoconjugates prolong overall survival in a preclinical brain metastases of breast cancer model. Molecular Cancer Therapeutics. 12 (11), 2389-2399 (2013).
- Hamilton, A. M., et al. Nanoparticles coated with the tumor-penetrating peptide iRGD reduce experimental breast cancer metastasis in the brain. Journal of Molecular Medicine. 93 (9), 991-1001 (2015).
- Patil, R., et al. MRI virtual biopsy and treatment of brain metastatic tumors with targeted nanobioconjugates: nanoclinic in the brain. ACS Nano. 9 (5), 5594-5608 (2015).
- Brighi, C., et al. MR-guided focused ultrasound increases antibody delivery to non-enhancing high-grade glioma. Neuro-Oncology Advances. 2 (1), (2020).
- Inamura, T., Black, K. L. Bradykinin selectively opens blood-tumor barrier in experimental brain tumors. Journal of Cerebral Blood Flow & Metabolism. 14 (5), 862-870 (1994).
- Priego, N., et al. Abstract 2746: Stat3 labels a subpopulation of reactive astrocytes required for brain metastasis. Cancer Research. 79, 2746(2019).
- Wyatt, E. A., Davis, M. E. Method of establishing breast cancer brain metastases affects brain uptake and efficacy of targeted, therapeutic nanoparticles. Bioengineering & Translational Medicine. 4 (1), 30-37 (2018).
- Nakayama, J., et al. The in vivo selection method in breast cancer metastasis. International Journal of Molecular Sciences. 22 (4), 1886(2021).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid cancer cell injection to produce mouse models of brain metastasis. Journal of Visualized Experiments. 120, 55085(2017).
- Liu, Z., et al. Improving orthotopic mouse models of patient-derived breast cancer brain metastases by a modified intracarotid injection method. Scientific Reports. 9 (1), 622(2019).
- Bos, P. D., et al. Genes that mediate breast cancer metastasis to the brain. Nature. 459, 1005-1009 (2009).
- Hu, X., Villodre, E. S., Woodward, W. A., Debeb, B. G. Modeling brain metastasis via tail-vein injection of inflammatory breast cancer cells. Journal of Visualized Experiments. 168, (2021).
- Cho, J. H., et al. AKT1 activation promotes development of melanoma metastases. Cell Reports. 13 (5), 898-905 (2015).
- Meuwissen, R., et al. Induction of small cell lung cancer by somatic inactivation of both Trp53 and Rb1 in a conditional mouse model. Cancer Cell. 4 (3), 181-189 (2003).
- Kato, M., et al. Transgenic mouse model for skin malignant melanoma. Oncogene. 17 (14), 1885-1888 (1998).
- Khanna, C., Hunter, K. Modeling metastasis in vivo. Carcinogenesis. 26 (3), 513-523 (2005).
- Sulaiman, A., Wang, L. Bridging the divide: preclinical research discrepancies between triple-negative breast cancer cell lines and patient tumors. Oncotarget. 8 (68), 113269-113281 (2017).
- Pierce, A. M., Keating, A. K. Creating anatomically accurate and reproducible intracranial xenografts of human brain tumors. Journal of Visualized Experiments. 91, 52017(2014).
- Geisler, J. A., et al. Modeling brain metastases through intracranial injection and magnetic resonance imaging. Journal of Visualized Experiments. 160, (2020).
- Reid, Y., Storts, D., Riss, T., Minor, L., et al. in Assay Guidance Manual. eds Markossian, S. et al.) Eli Lilly & Company and the National Center for Advancing Translational Sciences. , (2004).
- Janowicz, P. W., et al. Understanding nanomedicine treatment in an aggressive spontaneous brain cancer model at the stage of early blood brain barrier disruption. Biomaterials. , 283(2022).
- Houston, Z. H., et al. Understanding the Uptake of Nanomedicines at Different Stages of Brain Cancer Using a Modular Nanocarrier Platform and Precision Bispecific Antibodies. ACS Cent Sci. 6 (5), 727-738 (2020).
- Matsumura, Y., Maeda, H. A new concept for macromolecular therapeutics in cancer chemotherapy: mechanism of tumoritropic accumulation of proteins and the antitumor agent smancs. Cancer Research. 46, 6387-6392 (1986).
- Clemons, T. D., et al. Distinction between active and passive targeting of nanoparticles dictate their overall therapeutic efficacy. Langmuir. 34 (50), 15343-15349 (2018).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. Bio-Protocol. 11 (5), (2021).
- Masmudi-Martín, M., et al. Brain metastasis models: What should we aim to achieve better treatments. Advanced Drug Delivery Reviews. 169 (20), 79-99 (2021).
- Carney, C. P., et al. Harnessing nanomedicine for enhanced immunotherapy for breast cancer brain metastases. Drug Delivery and Translational Research. 11 (6), 2344-2370 (2021).
- Hamilton, A. M., et al. Nanoparticles coated with the tumor-penetrating peptide iRGD reduce experimental breast cancer metastasis in the brain. Journal of Molecular Medicine. 93 (9), Berlin, Germany. 991-1001 (2015).
- Bao, Y., et al. Synergistic chemotherapy for breast cancer and breast cancer brain metastases via paclitaxel-loaded oleanolic acid nanoparticles. Molecular Pharmaceutics. 17 (4), 1343-1351 (2020).
- Kotb, S., et al. Gadolinium-based nanoparticles and radiation therapy for multiple brain melanoma metastases: Proof of concept before phase I trial. Theranostics. 6 (3), 418-427 (2016).
- Zhang, T., et al. Multitargeted nanoparticles deliver synergistic drugs across the blood-brain barrier to brain metastases of triple negative breast cancer cells and tumor-associated macrophages. Advanced Healthcare Materials. 8 (18), 1900543(2019).
- He, C., et al. Blood-brain barrier-penetrating amphiphilic polymer nanoparticles deliver docetaxel for the treatment of brain metastases of triple negative breast cancer. Journal of Controlled Release. 246, 98-109 (2017).
- Wang, X., et al. Enhanced anti-brain metastasis from non-small cell lung cancer of osimertinib and doxorubicin co-delivery targeted nanocarrier. International Journal of Nanomedicine. 15, 5491-5501 (2020).
- Gries, M., et al. Multiscale selectivity and in vivo biodistribution of NRP-1-targeted theranostic AGuIX nanoparticles for PDT of glioblastoma. International Journal of Nanomedicine. 15, 8739-8758 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır