Method Article
Modellierung der Hirnmetastasierung durch Injektion von Krebszellen in die innere Halsschlagader
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hirnmetastasen sind eine Ursache für schwere Morbidität und Mortalität bei Krebspatienten. Die meisten Hirnmetastasen-Mausmodelle werden durch systemische Metastasen kompliziert, die die Analyse der Mortalität und der therapeutischen Interventionsergebnisse verwirren. Hier wird ein Protokoll für die interne Karotisinjektion von Krebszellen vorgestellt, das konsistente intrakranielle Tumoren mit minimalen systemischen Tumoren erzeugt.
Zusammenfassung
Hirnmetastasen sind eine Ursache für schwere Morbidität und Mortalität bei Krebspatienten. Kritische Aspekte metastasierender Erkrankungen, wie die komplexe neuronale Mikroumgebung und die Stromazellinteraktion, können mit In-vitro-Assays nicht vollständig repliziert werden. Daher sind Tiermodelle entscheidend für die Untersuchung und das Verständnis der Auswirkungen therapeutischer Interventionen. Die meisten Xenografting-Methoden für Hirntumore erzeugen jedoch keine konsistenten Hirnmetastasen in Bezug auf den Zeitrahmen und die Tumorlast. Hirnmetastasenmodelle, die durch intrakardiale Injektion von Krebszellen generiert werden, können zu einer unbeabsichtigten extrakraniellen Tumorlast führen und zu nicht-hirnmetastasierender Morbidität und Mortalität führen. Obwohl die intrakranielle Injektion von Krebszellen die extrakranielle Tumorbildung einschränken kann, hat sie mehrere Vorbehalte, wie die injizierten Zellen bilden häufig eine einzelne Tumormasse an der Injektionsstelle, eine hohe leptomeningeale Beteiligung und eine Schädigung des Hirngefäßsystems während der Nadelpenetration. Dieses Protokoll beschreibt ein Mausmodell der Hirnmetastasierung, die durch Injektion der inneren Halsschlagader erzeugt wird. Diese Methode erzeugt intrakranielle Tumoren konsequent ohne Beteiligung anderer Organe, was die Beurteilung von Therapeutika für Hirnmetastasen ermöglicht.
Einleitung
Hirnmetastasen sind eine weit verbreitete Malignität, die mit einer sehr schlechten Prognose einhergeht 1,2. Der Behandlungsstandard für Patienten mit Hirnmetastasen ist multimodal und besteht aus Neurochirurgie, Ganzhirnstrahlentherapie und/oder stereotaktischer Radiochirurgie, abhängig vom allgemeinen Gesundheitszustand der Patienten, der extrakraniellen Krankheitslast und der Anzahl und Lage der Tumoren im Gehirn 3,4. Patienten mit bis zu drei intrakraniellen Läsionen kommen für eine chirurgische Resektion oder stereotaktische Radiochirurgie in Frage, während eine Ganzhirnstrahlentherapie für Patienten mit mehreren Läsionen empfohlen wird, um das Risiko einer chirurgischen Infektion und eines Ödems zu vermeiden5. Die Ganzhirn-Strahlentherapie kann jedoch strahlenempfindliche Hirnstrukturen schädigen und zu einer schlechten Lebensqualität beitragen6.
Die systemische Therapie ist ein nicht-invasiver alternativer und logischer Ansatz zur Behandlung von Patienten mit multiplen Läsionen7. Es wird jedoch aufgrund der seit langem bestehenden Vorstellung, dass systemische Therapien eine schlechte Wirksamkeit haben, weniger berücksichtigt, da die passive Verabreichung von Zytostatika über den Blutkreislauf keine therapeutischen Werte im Gehirn ohne das Risiko einer unsicheren Toxizität erreichen kann8. Dieses Paradigma beginnt sich mit der kürzlich von der US-amerikanischen Food and Drug Administration (FDA) zugelassenen systemischen Therapie (Tucatinib mit Trastuzumab und Capecitabin indiziert für metastasierende HER2+-Brustkrebs-Hirnmetastasen)9,10,11,12 und der Aktualisierung der Behandlungsleitlinien zu ändern, um systemische Therapieoptionen für Hirnmetastasenpatientinnen einzubeziehen13,14.
In diesem Zusammenhang können Entwicklungen auf dem Gebiet der molekularen zielgerichteten Therapie, Immuntherapie und alternativer Wirkstoffabgabesysteme, wie z. B. eines gezielten Nano-Wirkstoffträgers, möglicherweise die Herausforderungen der Behandlung von Hirnmetastasen überwinden15,16,17,18. Darüber hinaus werden chemische und mechanische Ansätze zur Verbesserung der Wirkstoffabgabe durch Permeabilisierung der Hirntumorschranke untersucht19,20. Um solche Ansätze zu untersuchen und zu optimieren, ist es entscheidend, präklinische Modelle zu verwenden, die nicht nur die komplexe Physiologie der Hirnmetastasierung widerspiegeln, sondern auch eine objektive Analyse der intrakraniellen Arzneimittelreaktion ermöglichen.
Im Großen und Ganzen umfassen die aktuellen Ansätze zur Modellierung der Hirnmetastasierung in vivo die intrakardiale (linke Ventrikel), intravenöse (normalerweise Schwanzvene), intrakranielle oder intracarotis (gemeinsame Halsschlagader) Injektion von Krebszellen bei Mäusen 21,22,23,24,25,26,27 . Neben Tumortransplantationsstrategien sind gentechnisch veränderte Mausmodelle, bei denen die Tumorbildung durch die Entfernung von Tumorsuppressorgenen oder die Aktivierung von Onkogenen ausgelöst wird, für die Tumormodellierung nützlich. Es wird jedoch nur berichtet, dass nur wenige gentechnisch veränderte Mausmodelle sekundäre Tumore produzieren und noch weniger, die zuverlässig Hirnmetastasen produzieren28,29,30.
Engraftment-Methoden wie intrakardiale (linker Ventrikel) und intravenöse (meist Schwanzvene) Injektion ahmen die systemische Verbreitung von Krebs nach. Diese Modelle erzeugen typischerweise Läsionen in mehreren Organen (z. B. Gehirn, Lunge, Leber, Nieren, Milz), abhängig vom Kapillarbett, das die meisten Tumorzellen während ihres Kreislaufdurchgangs einfängt31. Inkonsistente Raten der Hirntransplantation erfordern jedoch mehr Tiere, um die Stichprobengröße für die gewünschte statistische Aussagekraft zu erreichen. Die Anzahl der Tumorzellen, die sich schließlich über diese intrakardialen und intravenösen Injektionsverfahren im Gehirn etablieren, ist variabel. Daher kann die Tumorlast der Hirnmetastasierung zwischen den Tieren variieren, und der Unterschied in der Progression kann die Standardisierung des experimentellen Zeitplans und die Interpretation der Ergebnisse zu einer Herausforderung machen. Die extrakranielle Tumorlast kann zu einer Mortalität ohne Hirnmetastasen führen, wodurch diese Modelle für die Bewertung der intrakraniellen Wirksamkeit ungeeignet sind. Gehirntropische Zelllinien wurden unter Verwendung künstlicher klonaler Selektionsprozesse etabliert, um die extrakranielle Etablierung zu reduzieren, aber die Aufnahmeraten waren inkonsistent, und der klonale Selektionsprozess kann die Heterogenität reduzieren, die normalerweise in menschlichen Tumoren gefunden wird32.
Gehirnspezifische Engraftment-Methoden wie die intrakranielle und intrakarotis-Injektion ermöglichen eine konsistentere und effizientere Hirnmetastasenmodellierung. Bei der intrakraniellen Methode33 werden typischerweise Krebszellen in die frontale Großhirnrinde injiziert, wodurch ein schnelles und reproduzierbares Tumorwachstum mit geringer systemischer Beteiligung erzeugt wird. Während das Verfahren bei niedriger Mortalität gut vertragen wird33, besteht der Vorbehalt darin, dass es sich um einen relativ groben Ansatz handelt, der schnell einen (lokalisierten) Bolus von Zellen im Gehirn einführt und keine frühe Hirnmetastasenpathogenese modelliert. Die Nadel schädigt das Gefäßsystem des Hirngewebes, was dann eine lokalisierte Entzündung verursacht 5,34. Erfahrungsgemäß besteht die Tendenz, dass Tumorzellen während der Entfernung der Nadel zum Reflux injizieren, was zu einer leptomeningealen Beteiligung führt. Alternativ bringt die intracarotis Methode Zellen in die gemeinsame Halsschlagader mit der Mikrovaskulatur des Gehirns als erstes Kapillarbett, das angetroffen wird, wodurch das Überleben im Kreislauf, die Extravasation und die Kolonisation modelliertwerden 24. In Übereinstimmung mit anderen25 ergab unsere Erfahrung mit dieser Methode, dass es aufgrund der unbeabsichtigten Abgabe von Krebszellen über die äußere Halsschlagader zu Kapillarbetten in diesen Geweben zu Gesichtstumoren kommen kann (unveröffentlichte Daten). Es ist möglich, Gesichtstumoren vorzubeugen, indem zuerst die äußere Halsschlagader vor der gemeinsamen Injektion der Halsschlagader ligiert wird (Abbildung 1). Im Rest des Artikels wird diese Methode als "Injektion der inneren Halsschlagader" bezeichnet. Erfahrungsgemäß erzeugt die Injektionsmethode der inneren Halsschlagader konsequent Hirnmetastasen mit sehr wenigen systemischen Ereignissen und war erfolgreich bei der Erzeugung von Hirnmetastasenmodellen verschiedener primärer Krebsarten (z. B. Melanom-, Brust- und Lungenkrebs) (Abbildung 1). Die Nachteile sind, dass es technisch anspruchsvoll, zeitaufwendig, invasiv ist und eine sorgfältige Optimierung der Zellzahlen und einen Überwachungszeitplan erfordert. Zusammenfassend lässt sich sagen, dass sowohl die intrakraniellen als auch die internen Karotis-Injektionsmethoden Mausmodelle hervorbringen, die sich für die Bewertung der therapeutischen Auswirkungen auf den Überlebensvorteil von Hirntumoren eignen.
Dieses Protokoll beschreibt die interne Karotis-Injektionsmethode, um ein Mausmodell der Hirnmetastasierung fast ohne systemische Beteiligung zu erstellen und daher für die präklinische Bewertung der Arzneimittelverteilung und Wirksamkeit experimenteller Therapeutika geeignet zu sein.

Abbildung 1: Schematische Darstellung des Injektionsprotokolls für die interne Halsschlagader für Hirnmetastasen. Die Injektion der internen Halsschlagader mit einer Ligatur der äußeren Halsschlagader kann zuverlässig ein Hirnmetastasenmodell aus verschiedenen primären Krebsarten erzeugen. In diesem Protokoll werden drei Ligaturen auf die Halsschlagader gelegt (in der Abbildung als L1-L3 annotiert). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Protokoll
Alle Studien wurden innerhalb der Richtlinien des Animal Ethics Committee der University of Queensland (UQCCR/186/19) und des Australian Code for the Care and Use of Animals for Science Purpose durchgeführt.
1. Vorbereitung von Krebszellen für die Injektion
HINWEIS: In dieser Studie wurde die menschliche Brustkrebszelllinie BT-474 (BT474) verwendet. BT474 wurde in einem vollständigen Wachstumsmedium kultiviert, das RPMI 1640-Medium umfasste, ergänzt mit 10% fetalem Rinderserum und 1% Insulin. Die Zellen wurden in einem Inkubator bei 37 °C mit 5% Kohlendioxid in der Luftatmosphäre gehalten. Authentifizierung der Zelllinie durch Satelliten-Tandem-Wiederholungstest35, Bestätigung der Expression des Reporterproteins (z. B. Luciferase), falls vorhanden, und Überprüfung auf Mykoplasmeninfektion.
- Samen von BT474-Krebszellen mit einer Aussaatdichte von 2,0 x 106 Zellen in einen T75-Kolben unter Verwendung von 10 ml komplettem Wachstumsmedium und Kultur (bei 37 °C mit 5%CO2) auf 70%-80% Konfluenz vor der Injektion.
- Verwerfen Sie am Tag der Injektion das Wachstumsmedium und waschen Sie die Zelleinschicht zweimal mit phosphatgepufferter Kochsalzlösung (PBS).
- Fügen Sie 5 ml vorgewärmtes Zellkultur-Dissoziationsreagenz hinzu (siehe Materialtabelle) und inkubieren Sie bei 37 °C für 5 min oder bis sich die Zellen gelöst haben. Nach 5 Minuten vorsichtig auf den Kolben klopfen, um die Zellablösung zu unterstützen.
- Fügen Sie 5 ml komplettes Wachstumsmedium hinzu, das 10% fötales Rinderserum enthält, um die Dissoziationsreagenzaktivität zu löschen.
- Resuspendieren Sie die Zellen vorsichtig durch Pipettieren, um Zellklumpen zu reduzieren.
- Die Zellsuspension in ein 50 ml Röhrchen geben und bei 180 x g 3 min bei Raumtemperatur zentrifugieren.
- Dekantieren Sie den Überstand und resuspendieren Sie das Zellpellet in 10 ml Hank's Balanced Salt Solution (HBSS) ohne Kalzium und Magnesium, um die Zellverklumpung zu minimieren.
- Zentrifugieren Sie die Zellsuspension bei 180 x g für 3 min bei Raumtemperatur.
- Dekantieren Sie den Überstand, um das restliche Serum-/Dissoziationsreagenz zu entfernen und das Zellpellet in 3 ml HBSS zu resuspendieren.
- Legen Sie ein 100-μm-Zellsieb auf ein frisches 50-ml-konisches Röhrchen und führen Sie die Zellsuspension durch, um Zellklumpen zu entfernen.
HINWEIS: Eine Einzelzellsuspension ist unerlässlich, um den Blutgefäßverschluss und das Risiko eines Schlaganfalls bei der Injektion zu minimieren. - Berechnen Sie die Anzahl der lebensfähigen Zellen mit Trypan Blue Ausschluss und einem Hämozytometer mit Standardmethoden.
- Die Zellsuspension wird mit HBSS auf eine Zellkonzentration von 2,5 x 106 Zellen/ml verdünnt.
- Halten Sie das Rohr waagerecht auf Eis und schaukeln Sie das Rohr regelmäßig vorsichtig, um ein Verklumpen zu minimieren. Die Zellsuspension kann maximal 6 h auf Eis gelagert werden.
HINWEIS: Das Schaukeln wurde manuell durchgeführt, aber dies kann auch mit einem Shaker bei niedriger Drehzahl erfolgen.
2. Vorbereitung der Maus auf das Verfahren
HINWEIS: In dieser Studie wurden 4-5 Wochen alte, weibliche NOD scid Mäuse verwendet. Führen Sie Mäusen 3 Tage vor dem Eingriff weiches Diät-Erholungsfutter (z. B. Diätgel, Hydrogel, püriertes Mausfutter) ein, um die Fütterung nach dem Eingriff zu fördern.
- Autoklavische chirurgische Instrumente. Besprühen und wischen Sie den Operationsbereich und die Ausrüstung mit Flächendesinfektionsmittel ab, gefolgt von 70% Ethanol.
- Legen Sie eine Tierwärmematte unter das Operationsbrett, um Unterkühlung zu verhindern. Schalten Sie dies 30 Minuten vor der Operation ein. Besprühen und wischen Sie das OP-Board mit Flächendesinfektionsmittel gefolgt von 70% Ethanol ab.
- Bereiten Sie einen sauberen Tierstallkäfig und ein warmes Heizkissen für die Erholung vor.
- Ziehen Sie saubere persönliche Schutzausrüstung an (Kittel, Maske, Haarnetz und Handschuhe). Bewahren Sie die Sterilität während des gesamten Verfahrens aufrecht, indem Sie saubere Untersuchungshandschuhe und eine Technik "nur Instrumentenspitzen" verwenden.
- Betäuben Sie die Maus mit einer Anästhesiekammer unter Verwendung von 5% Isofluran mit einem Sauerstofffluss von 2 l / min, bis die Maus den Pedalreflex verliert.
- Nehmen Sie das Tier aus der Kammer und legen Sie es in einen Nasenkegel, der 2% Isofluran bei einem Sauerstofffluss von 2 l / min für den verbleibenden chirurgischen Eingriff liefert.
- Ear Punch Maus zur Identifizierung und verwenden Sie elektrische Haarschneider, um das Fell aus dem Halsbereich zu rasieren. Reinigen Sie überschüssiges Haar von exponierter Haut mit Klebeband.
- Wiegen Sie die Maus, um die erforderlichen Anästhetika- und Analgetikadosen zu berechnen. Buprenorphin und Meloxicam in einer Dosierung von 50 μg/kg bzw. 1 mg/kg als subkutane Injektion verabreichen.
- Legen Sie die Maus auf ein warmes OP-Brett und sichern Sie den Nasenkonus mit Klebeband.
- Tragen Sie Augengleitmittel auf die Augen auf, um ein Austrocknen zu verhindern.
- Sichern Sie die Maus vorsichtig, indem Sie zuerst die oberen Schneidezähne mit einem Faden einhaken, der auf das OP-Board geklebt ist, gefolgt von einem Kleben der Vorder- und Hinterbeine. Dieser Schritt verlängert den Körper und hält den Hals während des Eingriffs gerade.
- Führen Sie die präoperative Hautvorbereitung wie unten beschrieben durch.
- Wischen Sie den Hals mit einem topischen Antiseptikum (Povidon-Jod) ab, um die Belastung der Hautflora zu reduzieren und loses Haar zu entfernen. Reinigen Sie von der Mitte der Haut und arbeiten Sie nach außen, um eine Rekontamination der Inzisionsstelle zu verhindern. Wiederholen Sie den Vorgang mit 70% Ethanol. Führen Sie drei abwechselnde Runden Jod und Ethanol zur Desinfektion durch.
- Legen Sie einen chirurgischen Vorhang über das Tier. Dieser wird aus einem Stück sterilem Papiertuch oder Autoklavenbeutel geschnitten und gefertigt.
- Legen Sie sterile Papierhandtücher oder Autoklavenbeutel für chirurgische Instrumente aus.
- Überprüfen Sie den Reflex mit dem "Pinch-Test", um eine ausreichende Anästhesie sicherzustellen, bevor Sie mit dem Verfahren fortfahren.
3. Interne Karotisinjektion
HINWEIS: In diesem Experiment wurde eine 31-G-Infusionskanüle und ein fußaktivierter Spritzentreiber-Setup verwendet, um den Injektionsvorgang zu erleichtern (ergänzende Abbildung 1). Dieses Setup ist optional und der Benutzer kann eine 31 G Insulinspritze verwenden und die Schritte 3.11 und 3.12 überspringen. Um die Infusionskanüle vorzubereiten, ziehen und trennen Sie den Nadelteil mit zwei Paaren Nahtklemmen vom Spritzenpassteil einer 31-G-Nadel. Als nächstes befestigen Sie den Nadelteil an einem Ende eines feinen Infusionsschlauchs von etwa 10 cm Länge.
- Positionieren Sie das Dissektionsmikroskop über der Maus.
- Machen Sie mit einer Schere einen vertikalen 15 mm langen Schnitt entlang der Mittellinie im Halsbereich, beginnend von 5 mm unterhalb des Kiefers bis zum Brusteinlass.
- Verwenden Sie zwei Paare abgewinkelter Pinzetten, teilen Sie die Haut und die darunter liegenden Speicheldrüsen und tragen Sie Retraktoren auf, um die Luftröhre freizulegen. Im nächsten Schritt wird die Halsschlagader freigelegt, die parallel zur Luftröhre liegt.
- Mit zwei Paar fein abgewinkelter Pinzetten das Muskel- und Fettgewebe neben der Luftröhre stumpf sezieren, um die rechte Halsschlagader freizulegen. Die Karotisscheide ist die fibröse Schicht, die die gemeinsame Halsschlagader, die Vene und den Vagusnerv bedeckt, und dieses Bündel kann durch die leuchtend rote gemeinsame Halsschlagader sichtbar gemacht werden. In dieser Studie wurde die Injektion an der rechten Halsschlagader durchgeführt.
- Reinigen Sie ein Segment der Arteria carotis caudal zur Karotisbifurkation der umgebenden Faszie und trennen Sie es vom Vagusnerv und den Venen.
- Isolieren und entfernen Sie die Karotisbifurkation (die Verbindung, die die äußeren und inneren Halsschlagadern verbindet) von den umgebenden Nerven und Faszie. Positionieren Sie die feine Pinzette unter der äußeren Halsschlagader und führen Sie eine Seidennaht (5-0 Dicke) unter die Arterie. Knoten und straffen Sie die Naht und schneiden Sie überschüssige Linie.
HINWEIS: Diese Ligatur (L1) verhindert, dass die Injektion durch die äußere Halsschlagader transportiert wird. - Positionieren Sie die feine Pinzette unter der Arteria carotis und führen Sie eine Seidennaht (5-0 Dicke) unter die Arterie. Binden Sie einen Knoten und ziehen Sie die Naht an einer Position in der Nähe der vorgeschlagenen Injektionsstelle fest. Schneiden Sie die überschüssige Naht ab und hinterlassen Sie etwa 10 mm Linie.
HINWEIS: Diese zweite Ligatur (L2) schränkt den Blutfluss und die Blutung nach der Injektion ein. Es wird auch verwendet, um die Halsschlagader während der Injektion zu positionieren und zu halten. - Schneiden und befeuchten Sie einen Streifen (autoklavierter) Einweg-Einwegwischer (siehe Materialtabelle) ca. 10 mm x 5 mm. Falten Sie den Streifen in 4 mm x 5 mm, 2-3 mm dick, und legen Sie ihn unter die Halsschlagader an der vorgeschlagenen Injektionsstelle. Dies stützt das Gefäß während der Injektion.
- Legen Sie auf der gemeinsamen Halsschlagader rostral zur vorgeschlagenen Injektionsstelle eine dritte Ligatur (L3) mit einem losen Knoten. Diese wird erst nach der Injektion (in Schritt 3.16) gestrafft.
- Rühren Sie die Zellsuspension vorsichtig an und ziehen Sie 200 μL Zellsuspension in eine Insulinspritze (mit 31 G Nadel).
- Legen Sie die Spritze in den Spritzentreiber, der mit einem aktivierenden Fußpedal verbunden ist.
- Befestigen Sie eine feine Kanüle mit einer 31 G Nadel an der Spritze und bereiten Sie die Leine vor.
- Überprüfen Sie, ob die Halsschlagader gut positioniert und unter Druck steht.
- Mit zwei fein abgewinkelten Pinzetten, von denen eine sanft auf das Ende der ersten Ligatur gespannt wird und die andere die 31-G-Nadel hält, führen Sie die Nadel langsam mit Abschrägung in das Lumen des Blutgefäßes ein und achten Sie darauf, sie nicht zu punktieren.
- Langsam 100 μL Zellsuspension (ab Schritt 1.13) mit 10 μL/s in die Arteria carotis communis injizieren. Dadurch werden 2,5 x 105 Zellen in das Blutgefäß abgegeben. Die erfolgreiche Injektion wird durch die Reinigung von Blut aus dem Halsschlagadergefäß visualisiert.
- Heben und straffen Sie die lockere Ligatur (L3) (ab Schritt 3.9) unmittelbar nach dem Ziehen der Nadel, um Rückfluss und Blutungen zu vermeiden. Überschüssige Naht trimmen.
HINWEIS: Es ist normal, eine kleine Menge Blut zu beobachten, die nach dem Herausziehen der Nadel spritzt. Nach der Straffung der dritten Ligatur darf es jedoch zu keiner aktiven Blutung kommen. - Entfernen Sie das Stück angefeuchtete, flusenarme Einwegwischer.
- Spülen Sie den Operationshohlraum mit einer P200-Pipette zweimal mit 150-200 μl sterilem Wasser oder Kochsalzlösung aus.
- Überprüfen Sie erneut auf Blutungen und entfernen Sie dann die Retraktoren.
- Positionieren Sie das Weichgewebe, die Speicheldrüsen und die Haut über der Halsschlagader und der Luftröhre.
- Verschließen Sie die Hautschicht des Einschnitts mit einem Nahtnadelhalter, einer Pinzette und einer resorbierbaren oder nicht resorbierbaren 6/0-Monofilamentnaht in einem kontinuierlichen Muster.
- Entsorgen Sie die Kanülennadelspritze und bereiten Sie ein neues Setup für die nächste Maus vor. Durch die Verwendung einer neuen Spritze wird sichergestellt, dass die Anzahl der in jede Maus injizierten Zellen konstant ist.
ANMERKUNG: Repräsentative Momentaufnahmen des Verfahrens finden Sie in der ergänzenden Abbildung 2. Wenn das Gefäß durch die Nadel punktiert oder gerissen wird, was durch das Auslaufen von Injektion oder Blutung angezeigt wird, gilt das Verfahren als erfolglos. Danach muss die Nadel zurückgezogen und die dritte Ligatur sofort gestrafft werden, um weitere Blutungen zu verhindern. Wenn die Blutung nach dem Anziehen der Naht anhaltend ist, muss das Tier mit Pentobarbital eingeschläfert werden.
4. Erholung nach der Injektion
- Injizieren Sie Buprenorphin (50 μg/kg) und Meloxicam (1 mg/kg) als subkutane Injektion zur postoperativen Schmerzlinderung.
- Bringen Sie das Tier in einen warmen und sauberen Käfig, um sich von der Narkose zu erholen. Es ist normal, dass ein Tier nach dem Aufwachen eine gedämpfte Aktivität hat (zusammengekauert und inaktiv oder sich langsam bewegend).
- Nach 30-45 Minuten die Mäuse in eine Langzeithalteeinrichtung überführen.
- Versorgen Sie Mäuse mindestens eine Woche nach der Operation mit einer weichen Diät (Diätgel, Hydrogel, Brei) und überprüfen Sie den körperlichen Zustand täglich mit besonderem Augenmerk auf Anzeichen von Schlaganfall, Infektion und Blutungen an der Wundstelle.
- Zwei Tage nach der Operation ist es typisch, dass das Tier eine reduzierte Aktivität hat, leicht zerzaustes Fell hat und 15% des präoperativen Körpergewichts verloren hat. Verabreichen Sie Analgetikum (Meloxicam) täglich für 2-3 Tage nach der Operation, um Schmerzen zu lindern und die Genesung zu unterstützen.
- Ab Tag 3 müssen die Tiere wieder aktiv sein, die Fütterungs- und Pflegehäufigkeit erhöht und wieder an Gewicht zugenommen haben. Euthanasieren Sie Tiere mit anhaltenden körperlichen Defiziten (Schmerzen, zusammengekauert, inaktiv, Gewichtsverlust) nach 4 Tagen nach der Operation durch Injektion von Natriumpentobarbital in 200 mg/kg intraperitoneale Injektion.
- Tumortransplantation und -progression können mit Anästhesie und Bildgebungsmodalität Ihrer Wahl wie Biolumineszenz-Bildgebung, MRT oder PET / MRT überwacht werden. Der Bedarf und die Fähigkeit zur Durchführung einer solchen Bildgebung hängt untrennbar von den individuellen Projektzielen und der Einrichtung ab, in der sie durchgeführt werden, und abhängig von der Art der Reportermarkierung, der verwendeten Zelllinien, der Zugänglichkeit relevanter radiochemischer und nuklearer Bildgebungseinrichtungen36,37
HINWEIS: Einige Tiere reagieren möglicherweise nicht gut und erleiden trotz eines erfolgreichen Eingriffs einen Schlaganfall. Nach dem Eingriff müssen Tiere, die Symptome einer neurologischen Belastung aufweisen (Kopf drehen und zur Seite ziehen, kreisendes Verhalten, Rollen, Schlagen, Verlust der motorischen Funktion), sofort eingeschläfert werden.
Ergebnisse
Vergleich der Injektion der Halsschlagader mit oder ohne Ligatur der Arteria carotis extern
Wenn Krebszellen über die gemeinsame Halsschlagader injiziert wurden, ohne vorher die äußere Halsschlagader zu ligieren24, wurden bei 77,8% der transplantierten Mäuse Gesichtstumoren gefunden (n = 7/9 Tiere). Ein Beispiel für einen Gesichtstumor ist in der ergänzenden Abbildung 3 dargestellt. Die in diesem Protokoll beschriebene Methode verhindert unbeabsichtigte Gesichtsmetastasen, indem die äußere Halsschlagader vor der gemeinsamen Halsschlagader ligiert wird.
Um die beiden Methoden zu vergleichen, wurde Lektin in die gemeinsame Halsschlagader von gekeulten Mäusen mit oder ohne Ligatur der äußeren Halsschlagader injiziert. Dann wurden das Gesichtsgewebe und das Gehirn fixiert, bearbeitet und unter dem Fluoreszenzmikroskop beobachtet. Eine Reduktion des Lektins wurde bei der Immunfluoreszenzanalyse im Wangengewebe beobachtet, wenn die äußere Halsschlagader ligiert war (Abbildung 2A-B). Die Ergebnisse zeigen auch, dass die Ligatur der äußeren Halsschlagader keinen Einfluss auf die Hirnabgabe hatte, da Lektin im Hirngewebe von Mäusen beobachtet werden kann, die einer gemeinsamen Karotis-Arterieninjektion mit externer Karotis-Arterien-Ligatur unterzogen wurden (Abbildung 2C-D). Daher kann dieser zusätzliche Schritt die Abgabe von Krebszellen über die innere Halsschlagader in das Gehirn mit minimaler Aussaat auf das Gesichtsgewebe lenken.

Abbildung 2: Intracarotis transplantat delivery mit und ohne externe Karotisarterieligatur. Fluoreszierende Bildgebung des rechten Wangenmuskels (A,B) und des Gehirns (C,D) von Mäusen mit Lektin (grün), das in die gemeinsame Halsschlagader abgegeben wird, entweder mit (A,C) oder ohne (B,D) externe Carotisligatur. Wange und Gehirn wurden mit 20-facher und 5-facher Vergrößerung abgebildet und Maßstabsbalken repräsentieren 50 bzw. 200 μm. Kerne (blau) wurden mit DAPI gefärbt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Biolumineszenz-Monitoring
Eine HER2-amplifizierte Brustkrebszelllinie, BT474, die genetisch verändert wurde, um Luciferase zu exprimieren, wurde in dieser Studie verwendet, um eine wöchentliche Überwachung der Tumorprogression durch Verabreichung von Luciferin und Durchführung von In-vivo-Biolumineszenz-Bildgebung zu ermöglichen. In diesem BT474-Hirnmetastasenmodell können biolumineszierende Signale ab Woche 5 nach interner Karotisinjektion beobachtet werden und nahmen im Laufe der Zeit progressiv an Intensität zu (Abbildung 3).
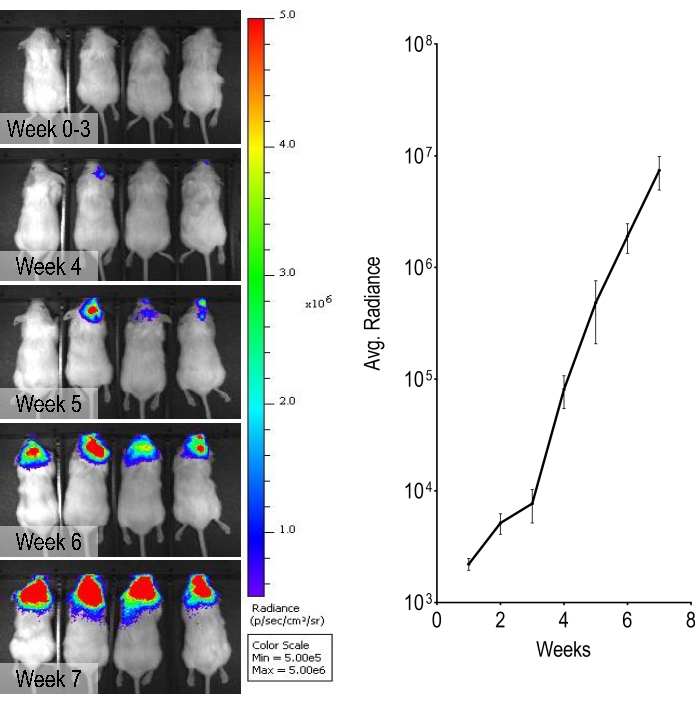
Abbildung 3: Biolumineszenzüberwachung und Quantifizierung des Biolumineszenzsignals. Repräsentative wöchentliche biolumineszierende Bilder von Woche 0 bis Woche 7, die eine zunehmende Intensität zeigen, die vom Kopf ausgeht. Die Grafik zeigt die Quantifizierung von biolumineszierenden Signalen bei Mäusen. Daten sind Mittelwerte ± Standardfehler (n = 4). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Magnetresonanztomographie (MRT)
Das Hirnmetastasen-Tiermodell wurde mit T2-gewichteter MRT in Woche 2, 5 und 8 abgebildet, um die intrakranielle Tumorprogression zu beurteilen. Von Woche 5 bis Woche 8 kann eine Region mit heterogener Signalintensität beobachtet werden, die auf einen intrakraniellen Tumor mit komplexer Flüssigkeitsperfusion hinweist, vermutlich von einem gestörten Tumorgefäßsystem (Abbildung 4A). Die Blut-Hirn-Schranke im Hirnmetastasenmodell ist gestört und ähnelt der klinischen Hirnmetastasierung. Dies wurde mittels Gadoliniumkontrastverstärkung und anschließender T1-gewichteter MRT-Sequenz ausgewertet. Die Gadoliniumkonzentration innerhalb der Tumorregion steigt an, wenn es aus dem Blutkreislauf in das Tumorgewebe austritt. Dies wird durch den abgedunkelten Bereich veranschaulicht, der die Verkürzung der T1-Relaxationszeit darstellt (Abbildung 4B). Die gewonnenen Daten können verwendet werden, um den Zugang zu Medikamenten mit der Permeabilität der Blut-Hirn-Schranke zu korrelieren. Darüber hinaus können intrakranielles Tumorvolumen und -oberfläche durch volumetrische Segmentierung mit der Bildanalysesoftware 3D Slicer abgeleitet werden (Abbildung 4C). Dies kann in einem Diagramm gegen die Zeit dargestellt werden, um das Wachstum von Hirntumoren zu verfolgen.

Abbildung 4: Charakterisierung des Tiermodells für Hirnmetastasen mittels Magnetresonanztomographie . (A) T2-gewichtete transversale, koronale und sagittale Scans des Modells in den Wochen 1, 5 und 8. In Woche 5 ist auf der sagittalen Ansicht (roter Pfeil) ein schwacher fleckiger Bereich zu sehen, der sich in Woche 8 zu einer hyperintensiven und heterogenen Region entwickelte. (B) Dynamische, kontrastverstärkte T1-gewichtete MRT, die einen Hirntumor (Region in rot) vor und nach der Injektion von Gadoliniumkontrastverstärkungsmittel (CE) zeigt. Dunkle Regionen weisen auf Gadoliniumleckage und -aufnahme hin. (C) Der auf der koronalen, transversalen und sagittalen Ebene visualisierte Tumor wurde mit der 3D Slicer-Bildanalysesoftware annotiert und segmentiert, um das intrakranielle Tumorvolumen abzuleiten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
PET/MR-Bildgebung zur Bestimmung der Bioverteilung der Nanomedizin
Die Kombination von gestörter Blut-Hirn-Schranke und dem undichten Tumorgefäßsystem erleichtert die passive Aufnahme und Akkumulation von nanoskaligen Therapeutika durch erhöhte Permeabilität und Retentionseffekt36,37. Da das BT474-Hirnmetastasenmodell HER2 überexprimiert, wurde eine Gehirnaufnahme einer Zirkonium-89-markierten HER2-zielgerichteten Nanomedizin mittels Positronen-Emissions-Tomographie/Magnetresonanztomographie (PET/MR) durchgeführt (Abbildung 5). In einer Kohorte von BT474 BM-Mäusen war die in der Tumorregion nachgewiesene Nanomedizin höher als die in unbeteiligten Hirnregionen, was die Akkumulation von Nanomedizin in Hirnmetastasen bestätigt.

Abbildung 5: Repräsentatives PET/MR-Bild von Zirkonium-89-markierter HER2-Targeting-Nanomedizin (89Zr-HER2-NM) in BT474-Hirnmetastasenmäusen. (A) Das linke Bild zeigt eine MRT mit T2-Gewicht (koronale Ansicht) mit Hirntumor (rote Region) und unbeteiligtem Gehirn (blaue Region). Die beiden nebeneinander liegenden Bilder zeigen MRT-Bilder (koronale und transversale Ansicht), überlagert mit PET-Overlay. Das eingefärbte PET-Overlay zeigt, dass die Tumorregion eine höhere Aufnahme der Nanomedizin (weiß, rot, gelb) aufweist als die unbeteiligten Regionen (blau/grün). (B) Die Grafik veranschaulicht die Zunahme der PET-Signalintensität und -aufnahme von Nanomedizin (injizierte Dosis pro Gramm, ID/g) bei Hirntumoren relativ zum unbeteiligten Gehirn (n = 12). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Überleben und physischer Zustand von BM-Modellen
Das BT474-Hirnmetastasenmodell überlebte im Median 9 Wochen nach der Injektion (Abbildung 6). Als die Hirnmetastasen fortschritten, begannen die Tiere bis zu 20% Körpergewicht zu verlieren, was dann Euthanasie erforderte (zwischen Woche 6-9). Bei Hirnmetastasen im Spätstadium umfassen die üblichen Präsentationen zerzaustes Fell und vorgewölbte und gewölbte Schädel. Die Tiere waren oft inaktiv, zusammengekauert und zeigten funktionelle Defizite in motorischen Fähigkeiten und Kraft.

Abbildung 6: Kaplan-Meier-Kurve des BT474-Mausmodells für Hirnmetastasen. Das mediane Überleben betrug 9 Wochen nach der Injektion (n = 18). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Histologie
Nach der Euthanasie wurden die Tiere mit einer 4%igen Paraformaldehydlösung perfundiert, um die Hirnhistologie-Architekturzu erhalten 40. Anschließend wurden die Gehirne und andere Organe bearbeitet, geschnitten und mit Hämatoxylin und Eosin (H&E) gefärbt. In diesem Hirnmetastasenmodell wurden die Tumoren einseitig lokalisiert, passend zur Seite der Karotisinjektion (Abbildung 7A). Die BT474-Tumoren traten meist als feste solitäre Massen auf, die in einigen Fällen fast die Hälfte der Gehirnhälfte betrafen (Abbildung 7B). Taschen mit leeren Räumen wurden häufig beobachtet und bestanden aus nekrotischen Zellen (Abbildung 7C). Kleinere Auswüchse waren auch bei einigen Tieren vorhanden (Abbildung 7E). Die immunhistochemische Färbung zeigt, dass BT474-Hirnmetastasen starke HER2- und HER3-Metastasen exprimieren, was darauf hindeutet, dass dieses Modell für HER2- und HER3-zielgerichtete Therapien geeignet ist (Abbildung 7F).

Abbildung 7: Hirnhistologie des BT474-Hirnmetastasenmodells. (A) Repräsentativer Hirnschnitt einer BT474 BM-Maus; Farbige Kästchen markierten vergrößerte Bereiche von Interesse. Maßstabsbalken = 2 mm. (B) Solider Tumor mit einer Masse von Epitheloidzellen. (C) nekrotische Zellen innerhalb eines Raumes. (D) Tumor-Hirn-Schnittstelle (E) Kleine Auswüchse, die als Mikrometastasen bekannt sind. (B-E Maßstabsbalken = 200 μm). (F) Immunhistochemische Bilder, die HER2- und HER3-Positivität und übereinstimmendes Hämatoxylin und Eosin (H&E) zeigen. Maßstabsbalken = 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Systemische Beteiligung
In Gewebeschnitten anderer Organe wurden keine Tumoren beobachtet (Abbildung 8). Dieser Befund stimmt mit den Biolumineszenzdaten überein, bei denen Biolumineszenz nur von den Köpfen der Tiere nachgewiesen wurde. Zusammen zeigten die Ergebnisse, dass dieses Modell mit keinen nachweisbaren systemischen Tumoren assoziiert ist.

Abbildung 8: Histologie anderer Organe. Es gab keine offensichtliche Tumorbeteiligung in den untersuchten Organen: Knochen, Leber, Niere, Bauchspeicheldrüse, Lunge, Herz, Milz, Darm und Eierstock. Maßstabsbalken = 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergänzende Abbildung 1: Kanülenspritze zur Injektion der inneren Halsschlagader. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 2: Schnappschüsse des Injektionsprozesses der inneren Halsschlagader. Die Bildbeschreibung ist in der Zusatztabelle 1 enthalten. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 3: T2-gewichtete MRT mit einem großen intramuskulären Tumor im rechten Gesichtsgewebe (rot umrandet). H&E-gefärbter Gewebeschnitt zeigt dicht gepackte Tumorzellen. Maßstabsbalken = 2 mm (Mitte) und 100 μm (rechts). Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Tabelle 1: Schrittweise Beschreibung der Injektion der inneren Halsschlagader in der ergänzenden Abbildung 2. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Hirnmetastasierung ist ein komplexer Prozess von Krebszellen, die sich von ihrem primären Ort zum Gehirn ausbreiten. Es stehen verschiedene Tiermodelle zur Verfügung, die bestimmte Stadien dieses mehrstufigen Prozesses widerspiegeln, und es gibt physiologische und praktische Überlegungen zur Gestaltung präklinischer Metastasenstudien41,42. Die meisten veröffentlichten Studien, die den Einsatz von Nanomedizin zur Behandlung von Hirnmetastasen untersuchen, haben intrakardiale43,44 und intrakranielle 45,46,47,48,49-Modelle verwendet. Die Transplantation von Krebszellen über die Halsschlagader kann den metastatischen Prozess und die Pathobiologie der Hirnmetastasen besser rekapitulieren.
Erfahrungsgemäß führte die übliche Carotis-Injektionstechnik jedoch dazu, dass mehrere Tiere zu frühen Zeitpunkten signifikante Gesichtstumoren aufwiesen. Bei Tieren mit aktiven Hirn- und Gesichtstumoren wurde beobachtet, dass Gesichtstumoren schneller an Größe zunahmen als die Hirntumoren. Dies kann auf die stärker vaskularisierte Mikroumgebung zurückzuführen sein, die das Tumorwachstum unterstützt (ergänzende Abbildung 3).
Die gemeinsame Halsschlagader versorgt die Gesichtsregion und das Gehirn über die äußeren bzw. Halsschlagadern mit Blut. In Übereinstimmung mit anderen25 würde daher die Injektion von Krebszellen über die gemeinsame Halsschlagader zu einer Aussaat in beiden Regionen führen. Es ist möglich, Gesichtstumoren zu verhindern, indem zuerst die äußere Halsschlagader vor der Injektion der gemeinsamen Halsschlagader ligiert wird.
Die hier beschriebene Injektionsmethode der inneren Halsschlagader simuliert Hirnmetastasen, indem die Krebszellen in das primäre Blutgefäß eingeführt werden, das das Gehirn versorgt. Dieses Modell rekapituliert die Unterbringung zirkulierender Krebszellen im Gefäßbett des Gehirns, was ihre Transmigration und Bildung von metastasiertem Hirnwachstum ermöglicht. Die Ergebnisse zeigen, dass die Injektion der Halsschlagader die Aussaat von Krebs auf andere Organe beschränkt, die mit Methoden wie der intrakardialen Injektion assoziiert sind.
Es gibt einige wichtige Überlegungen und Informationen zur Problembehandlung für das Protokoll. Erstens können Zellklumpen intrakranielle Blutgefäße verschließen und einen Schlaganfall auslösen. Dies kann gemildert werden, indem die Zellsuspension durch ein Zellsieb geleitet wird, um eine klumpenfreie Zellsuspension zu gewährleisten. Dann kann die Injektion überschüssiger Flüssigkeit in das Gehirn zu entzündlichen Ödemen führen und die vaskuläre Lateralisierung behindern. Dies kann vermieden werden, indem ein Injektionsvolumen von weniger als 100 μL verwendet wird. Die Verwendung einer Naht mit ausgefransten Enden und das Vorhandensein von Faszien oder Fibrofettgewebe kann die Nahtschleife um die äußere Halsschlagader behindern. Es wird empfohlen, zuerst Faszien oder Fibrofettgewebe durch eine sanfte Wischbewegung entlang der Arterie mit der Pinzette zu reinigen und ausgefranste Enden durch Schneiden des Endes der Naht zu entfernen. Schließlich haben Krebszelllinien einzigartige Wachstumsraten, und daher ist es wichtig, die Zellkonzentration für die Injektion zu optimieren. Erfahrungsgemäß wurden in Lungen- und Melanom-Hirnmetastasenmodellen, an denen die aggressiven menschlichen Krebszelllinien NCI-H1975 bzw. A2058 beteiligt waren, weniger Zellen (1 x 105 Zellen in 100 μL) injiziert, um ein schnelles Fortschreiten der Erkrankung zu verhindern.
Der schwierigste Schritt in diesem Protokoll ist das Einführen der Nadel in die Halsschlagader und die Injektion von Zellen. Es wird empfohlen, eine neue Nadel pro Tier für Sterilität zu verwenden, da die Verwendung von stumpfen Nadeln das Risiko erhöht, Blutgefäße zu punktieren oder zu reißen. Es wird auch empfohlen, einen Spritzentreiber für das Verfahren zu verwenden, um den anfänglichen Injektionsschub und die wackelige Nadel während der Injektion zu reduzieren. Der Spritzentreiber hat auch den zusätzlichen Vorteil, dass die Injektionsrate an die physiologische Blutflussrate angepasst wird.
Dieses Protokoll ist nicht ohne Einschränkungen. Das Verfahren ist technisch anspruchsvoll und es besteht die Gefahr, dass Tiere trotz eines erfolgreichen Eingriffs einem Schlaganfall durch Lateralisationsversagen erliegen. Erfahrungsgemäß liegt die Schlaganfallrate bei 11,4% (n = 21/168 Tiere). Daher sollte die anfängliche Stichprobengröße diese Tiere berücksichtigen, die an Schlaganfall sterben werden. Da diese Methode Krebszellen direkt in Richtung Gehirn liefert, hat sie die systemische Tumorlast reduziert und ist daher nicht ideal für die Untersuchung der systemischen Ausbreitung.
Zusammenfassend lässt sich sagen, dass das Protokoll die Generierung eines Mausmodells für Hirnmetastasen ermöglicht, das für das Drogenscreening und die Bewertung des therapeutischen Profils von Medikamenten geeignet ist.
Offenlegungen
Die Autoren erklären keine Interessenkonflikte. Die Geldgeber spielten keine Rolle bei der Gestaltung der Studie; bei der Erhebung, Analyse oder Interpretation von Daten; beim Schreiben des Manuskripts oder bei der Entscheidung, das Papier zu veröffentlichen.
Danksagungen
Diese Forschung wurde vom Australian National Health and Medical Research Council (NHMRC), Fördernummer APP1162560, finanziert. ML wurde durch ein UQ-Postgraduierten-Forschungsstipendium finanziert. Wir möchten uns bei allen bedanken, die bei der Tierhaltung und in vivo Bildgebung der Tiere geholfen haben. Wir danken dem Royal Brisbane and Women's Hospital für die Spende von Zirkonium-Aliquots für diese Studie.
Materialien
| Name | Company | Catalog Number | Comments |
| 100µm cell strainer | Corning | CLS431752 | |
| 30G Microlance needle | BD | 23748 | |
| 31G Ultra-Fine II insulin syringe | BD | 326103 | |
| Angled forceps | Proscitech | T67A-SS | Fine pointed, angled without serrations, 18mm tip, length 128 mm |
| Animal heat mat | |||
| Antibiotic and antimycotic | ThermoFisher Scientific | 15240062 | |
| Autoclave bags | |||
| BT-474 (HTB-20) breast cancer cell line | ATCC | HTB-20 | |
| Buprenorphine (TEMGESIC) | |||
| Countess cell counter | ThermoFisher Scientific | C10227 | |
| Diet-76A | ClearH2O | 72-07-5022 | |
| Dissection microscope | |||
| Ear puncher | |||
| Electric clippers | |||
| Fine angled forceps | Proscitech | DEF11063-07 | Angled 45°, Tip smooth, Tip width: 0.4 mm, Tip dimension: 0.4 x 0.3 mm, length 9cm |
| Fine tubing for cannula, Tubing OD (in) 1/32, Tubing ID (in) 1/100in | Cole Parmer | EW-06419-00 | |
| Foetal bovine serum | ThermoFisher Scientific | 26140079 | |
| Hank's Balanced Salt Solution without calcium and magnesium | ThermoFisher Scientific | 14170120 | |
| Hydrogel | ClearH2O | 70-01-5022 | |
| Isoflurane | |||
| Kimwipes Low lint disposable wipers | Kimberly Clark- Kimwipes | Z188964 | |
| Mashed mouse chow | |||
| Meloxicam (METACAM) | |||
| Nose cone | Fashioned out of a microfuge tube | ||
| PAA ocular lubricant (Carbomer 2mg/g) | Bausch and lomb | ||
| Povidone-iodine solution | Betadine | 2505692 | |
| PPE (glove, mask, gown, hairnet) | |||
| Retractors | Kent Scientific | SURGI-5001 | |
| RPMI 1640 Media | ThermoFisher Scientific | 11875093 | |
| Silk suture 13mm 5-0, P3, 45cm | Ethicon | JJ-640G | |
| Sterile normal saline | ThermoFisher Scientific | TM4469 | |
| Sticky tape | |||
| Surgical board | A chopping board wrapped with autoclavable bag. | ||
| Surgical scissors | Proscitech | T104 | Tip Dimensions (LxD): 38x7mm, Length 115mm |
| Suture forcep/ Curved Brophy forceps | Proscitech | T113C | Curved, Rounded narrow 2 mm tip, with serrations, length 165 mm |
| Suture needle holder (Olsen Hegar needle holder) | Proscitech | TC1322-180 | length 190 mm, ratchet clamp |
| Syringe driver with foot pedal/ UMP3 Ultra micro pump | World Precision Instruments | UMP3-3 | |
| T75 tissue culture flask | ThermoFisher Scientific | 156499 | |
| Thread | |||
| Trigene II surface disinfectant | Ceva | ||
| Trypan Blue and Cell Counting Chamber Slides | ThermoFisher Scientific | C10228 | |
| TrypLE Express dissociating medium | ThermoFisher Scientific | 12605010 |
Referenzen
- Nayak, L., Lee, E. Q., Wen, P. Y. Epidemiology of brain metastases. Current Oncology Reports. 14 (1), 48-54 (2012).
- Australian Institute of Health and Welfare. Cancer in Australia. , Canberra: AIHW. (2017).
- Maher, E. A., Mietz, J., Arteaga, C. L., DePinho, R. A., Mohla, S. Brain metastasis: opportunities in basic and translational research. Cancer Research. 69 (15), 6015-6020 (2009).
- Lin, N. U. Breast cancer brain metastases: new directions in systemic therapy. Ecancermedicalscience. 7, (2013).
- Zimmer, A. S., Van Swearingen, A. E. D., Anders, C. K. HER2-positive breast cancer brain metastasis: A new and exciting landscape. Cancer Reports. 5 (4), (2020).
- Brown, P. D., et al. Postoperative stereotactic radiosurgery compared with whole brain radiotherapy for resected metastatic brain disease (NCCTG N107C/CEC·3): a multicentre, randomised, controlled, phase 3 trial. Lancet Oncology. 18 (8), 1049-1060 (2017).
- Murrell, J., Board, R. The use of systemic therapies for the treatment of brain metastases in metastatic melanoma: Opportunities and unanswered questions. Cancer Treatment Reviews. 39 (8), 833-838 (2013).
- Stemmler, H. J., et al. Ratio of trastuzumab levels in serum and cerebrospinal fluid is altered in HER2-positive breast cancer patients with brain metastases and impairment of blood-brain barrier. Anticancer Drugs. 18 (1), 23-28 (2007).
- Venur, V. A., Leone, J. P. Targeted therapies for brain metastases from breast cancer. International Journal of Molecular Sciences. 17 (9), 1543(2016).
- Murthy, R., et al. Tucatinib with capecitabine and trastuzumab in advanced HER2-positive metastatic breast cancer with and without brain metastases: a non-randomised, open-label, phase 1b study. The Lancet Oncology. 19 (7), 880-888 (2018).
- Murthy, R. K., et al. trastuzumab, and capecitabine for HER2-positive metastatic breast cancer. New England Journal of Medicine. 382 (7), 597-609 (2019).
- Shah, M., et al. FDA approval summary: Tucatinib for the treatment of patients with advanced or metastatic HER2-positive breast cancer. Clinical Cancer Research. 27 (5), 1220-1226 (2021).
- Vogelbaum, M. A., et al. Treatment for brain metastases: ASCO-SNO-ASTRO guideline. Journal of Clinical Oncology. 40 (5), 492-516 (2021).
- Ramakrishna, N., et al. Management of advanced human epidermal growth factor receptor 2-positive breast cancer and brain metastases: ASCO guideline update. Journal of Clinical Oncology. 10, (2022).
- Li, J., et al. A multifunctional polymeric nanotheranostic system delivers doxorubicin and imaging agents across the blood-brain barrier targeting brain metastases of breast cancer. ACS Nano. 8 (10), 9925-9940 (2014).
- Mittapalli, R. K., et al. Paclitaxel-hyaluronic nanoconjugates prolong overall survival in a preclinical brain metastases of breast cancer model. Molecular Cancer Therapeutics. 12 (11), 2389-2399 (2013).
- Hamilton, A. M., et al. Nanoparticles coated with the tumor-penetrating peptide iRGD reduce experimental breast cancer metastasis in the brain. Journal of Molecular Medicine. 93 (9), 991-1001 (2015).
- Patil, R., et al. MRI virtual biopsy and treatment of brain metastatic tumors with targeted nanobioconjugates: nanoclinic in the brain. ACS Nano. 9 (5), 5594-5608 (2015).
- Brighi, C., et al. MR-guided focused ultrasound increases antibody delivery to non-enhancing high-grade glioma. Neuro-Oncology Advances. 2 (1), (2020).
- Inamura, T., Black, K. L. Bradykinin selectively opens blood-tumor barrier in experimental brain tumors. Journal of Cerebral Blood Flow & Metabolism. 14 (5), 862-870 (1994).
- Priego, N., et al. Abstract 2746: Stat3 labels a subpopulation of reactive astrocytes required for brain metastasis. Cancer Research. 79, 2746(2019).
- Wyatt, E. A., Davis, M. E. Method of establishing breast cancer brain metastases affects brain uptake and efficacy of targeted, therapeutic nanoparticles. Bioengineering & Translational Medicine. 4 (1), 30-37 (2018).
- Nakayama, J., et al. The in vivo selection method in breast cancer metastasis. International Journal of Molecular Sciences. 22 (4), 1886(2021).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid cancer cell injection to produce mouse models of brain metastasis. Journal of Visualized Experiments. 120, 55085(2017).
- Liu, Z., et al. Improving orthotopic mouse models of patient-derived breast cancer brain metastases by a modified intracarotid injection method. Scientific Reports. 9 (1), 622(2019).
- Bos, P. D., et al. Genes that mediate breast cancer metastasis to the brain. Nature. 459, 1005-1009 (2009).
- Hu, X., Villodre, E. S., Woodward, W. A., Debeb, B. G. Modeling brain metastasis via tail-vein injection of inflammatory breast cancer cells. Journal of Visualized Experiments. 168, (2021).
- Cho, J. H., et al. AKT1 activation promotes development of melanoma metastases. Cell Reports. 13 (5), 898-905 (2015).
- Meuwissen, R., et al. Induction of small cell lung cancer by somatic inactivation of both Trp53 and Rb1 in a conditional mouse model. Cancer Cell. 4 (3), 181-189 (2003).
- Kato, M., et al. Transgenic mouse model for skin malignant melanoma. Oncogene. 17 (14), 1885-1888 (1998).
- Khanna, C., Hunter, K. Modeling metastasis in vivo. Carcinogenesis. 26 (3), 513-523 (2005).
- Sulaiman, A., Wang, L. Bridging the divide: preclinical research discrepancies between triple-negative breast cancer cell lines and patient tumors. Oncotarget. 8 (68), 113269-113281 (2017).
- Pierce, A. M., Keating, A. K. Creating anatomically accurate and reproducible intracranial xenografts of human brain tumors. Journal of Visualized Experiments. 91, 52017(2014).
- Geisler, J. A., et al. Modeling brain metastases through intracranial injection and magnetic resonance imaging. Journal of Visualized Experiments. 160, (2020).
- Reid, Y., Storts, D., Riss, T., Minor, L., et al. in Assay Guidance Manual. eds Markossian, S. et al.) Eli Lilly & Company and the National Center for Advancing Translational Sciences. , (2004).
- Janowicz, P. W., et al. Understanding nanomedicine treatment in an aggressive spontaneous brain cancer model at the stage of early blood brain barrier disruption. Biomaterials. , 283(2022).
- Houston, Z. H., et al. Understanding the Uptake of Nanomedicines at Different Stages of Brain Cancer Using a Modular Nanocarrier Platform and Precision Bispecific Antibodies. ACS Cent Sci. 6 (5), 727-738 (2020).
- Matsumura, Y., Maeda, H. A new concept for macromolecular therapeutics in cancer chemotherapy: mechanism of tumoritropic accumulation of proteins and the antitumor agent smancs. Cancer Research. 46, 6387-6392 (1986).
- Clemons, T. D., et al. Distinction between active and passive targeting of nanoparticles dictate their overall therapeutic efficacy. Langmuir. 34 (50), 15343-15349 (2018).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. Bio-Protocol. 11 (5), (2021).
- Masmudi-Martín, M., et al. Brain metastasis models: What should we aim to achieve better treatments. Advanced Drug Delivery Reviews. 169 (20), 79-99 (2021).
- Carney, C. P., et al. Harnessing nanomedicine for enhanced immunotherapy for breast cancer brain metastases. Drug Delivery and Translational Research. 11 (6), 2344-2370 (2021).
- Hamilton, A. M., et al. Nanoparticles coated with the tumor-penetrating peptide iRGD reduce experimental breast cancer metastasis in the brain. Journal of Molecular Medicine. 93 (9), Berlin, Germany. 991-1001 (2015).
- Bao, Y., et al. Synergistic chemotherapy for breast cancer and breast cancer brain metastases via paclitaxel-loaded oleanolic acid nanoparticles. Molecular Pharmaceutics. 17 (4), 1343-1351 (2020).
- Kotb, S., et al. Gadolinium-based nanoparticles and radiation therapy for multiple brain melanoma metastases: Proof of concept before phase I trial. Theranostics. 6 (3), 418-427 (2016).
- Zhang, T., et al. Multitargeted nanoparticles deliver synergistic drugs across the blood-brain barrier to brain metastases of triple negative breast cancer cells and tumor-associated macrophages. Advanced Healthcare Materials. 8 (18), 1900543(2019).
- He, C., et al. Blood-brain barrier-penetrating amphiphilic polymer nanoparticles deliver docetaxel for the treatment of brain metastases of triple negative breast cancer. Journal of Controlled Release. 246, 98-109 (2017).
- Wang, X., et al. Enhanced anti-brain metastasis from non-small cell lung cancer of osimertinib and doxorubicin co-delivery targeted nanocarrier. International Journal of Nanomedicine. 15, 5491-5501 (2020).
- Gries, M., et al. Multiscale selectivity and in vivo biodistribution of NRP-1-targeted theranostic AGuIX nanoparticles for PDT of glioblastoma. International Journal of Nanomedicine. 15, 8739-8758 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten