Method Article
がん細胞の内頸動脈注射による脳転移のモデル化
* これらの著者は同等に貢献しました
要約
脳転移は、癌患者の重度の罹患率と死亡率の原因です。ほとんどの脳転移マウスモデルは、死亡率および治療介入結果の交絡分析を混乱させる全身性転移によって複雑になります。ここに提示されるのは、最小限の全身腫瘍で一貫した頭蓋内腫瘍を生成する癌細胞の内部頸動脈注射のためのプロトコルです。
要約
脳転移は、癌患者の重度の罹患率と死亡率の原因です。複雑な神経微小環境や間質細胞相互作用などの転移性疾患の重要な側面は、 in vitro アッセイでは完全に再現できません。したがって、動物モデルは、治療的介入の効果を調査および理解するために重要です。しかし、ほとんどの脳腫瘍異種移植法は、時間枠と腫瘍量の点で一貫して脳転移を引き起こしません。がん細胞の心臓内注射によって生成された脳転移モデルは、意図しない頭蓋外腫瘍の負担をもたらし、非脳転移性の罹患率と死亡率につながる可能性があります。がん細胞の頭蓋内注射は頭蓋外腫瘍の形成を制限する可能性がありますが、注入された細胞が注射部位で特異な腫瘍塊を頻繁に形成する、軟髄膜の関与が高い、針刺し中の脳血管系の損傷など、いくつかの注意点があります。このプロトコルは、内頸動脈注射によって生成された脳転移のマウスモデルを記載する。この方法は、他の臓器を介さずに一貫して頭蓋内腫瘍を作製し、脳転移の治療薬の評価を可能にします。
概要
脳転移は、非常に予後不良に関連する一般的な悪性腫瘍です1,2。脳転移患者の標準治療はマルチモーダルであり、患者の一般的な健康状態、頭蓋外疾患の負担、および脳内の腫瘍の数と位置に応じて、脳神経外科、全脳放射線療法、および/または定位放射線手術で構成されます3,4。最大3つの頭蓋内病変を有する患者は外科的切除または定位放射線手術の対象となりますが、手術関連の感染および浮腫のリスクを回避するために、複数の病変を有する患者には全脳放射線療法が推奨されます5。しかし、全脳放射線療法は放射線感受性の脳構造に損傷を与え、生活の質の低下に寄与する可能性があります6。
全身療法は、複数の病変を持つ患者を治療するための非侵襲的な代替的かつ論理的なアプローチです7。しかし、血流を介した細胞傷害性薬物の受動的送達は安全でない毒性のリスクなしに脳内で治療レベルを達成できないため、全身療法の有効性が低いという長年の考えのために、あまり考慮されていません8。このパラダイムは、最近米国食品医薬品局(FDA)が承認した全身療法(転移性HER2+乳がん脳転移に適応されるトラスツズマブとカペシタビンを含むツカチニブ)9,10,11,12、および脳転移患者に対する全身療法オプションの検討を含む治療ガイドラインの更新によって変化し始めています13,14。
これに関連して、分子標的療法、免疫療法、および標的ナノ薬物キャリアなどの代替薬物送達システムの分野における開発は、脳転移治療の課題を潜在的に克服することができる15、16、17、18。さらに、脳腫瘍関門の透過処理を介して薬物送達を改善するための化学的および機械的アプローチも調査されています19,20。このようなアプローチを研究し、目的に合わせて最適化するには、脳転移の複雑な生理機能を反映するだけでなく、頭蓋内薬物反応の客観的な分析を可能にする前臨床モデルを使用することが重要です。
大まかに言えば、in vivoで脳転移をモデル化するための現在のアプローチには、マウスにおける癌細胞の心臓内(左心室)、静脈内(通常は尾静脈)、頭蓋内、または頸動脈内(総頸動脈)注射が含まれます21、22、23、24、25、26、27.腫瘍生着戦略とは別に、腫瘍抑制遺伝子の除去または癌遺伝子の活性化によって腫瘍形成が引き起こされる遺伝子改変マウスモデルは、腫瘍モデリングに有用である。しかし、二次腫瘍を産生することが報告されている遺伝子操作されたマウスモデルはごくわずかであり、脳転移を確実に産生するマウスモデルはさらに少ない28,29,30。
心臓内(左心室)および静脈内(通常は尾静脈)注射などの生着法は、癌の全身播種を模倣する。これらのモデルは通常、循環器系の「初回通過」中にほとんどの腫瘍細胞をトラップする毛細血管床に応じて、複数の臓器(脳、肺、肝臓、腎臓、脾臓など)に病変を引き起こします31。ただし、脳の生着率が一貫していない場合は、目的の統計的検出力のサンプルサイズを達成するために、より多くの動物が必要になります。これらの心臓内および静脈内注射法 によって 最終的に脳内に定着する腫瘍細胞の数はさまざまです。したがって、脳転移腫瘍の負荷は動物によって異なる可能性があり、進行の違いにより、実験のタイムラインと結果の解釈を標準化することが困難になる可能性があります。頭蓋外腫瘍の量は、脳以外の転移死亡率につながる可能性があり、これらのモデルは頭蓋内の有効性を評価するのに適していません。脳向性細胞株は、頭蓋外樹立を減少させるために人工クローン選択プロセスを用いて確立されているが、テイク率は一貫しておらず、クローン選択プロセスはヒト腫瘍に通常見られる不均一性を減少させることができる32。
頭蓋内および頸動脈内注射などの脳特異的生着法により、より一貫性のある効率的な脳転移モデリングが可能になります。頭蓋内法33では、癌細胞は典型的には前頭大脳皮質に注入され、これは低い全身的関与で迅速かつ再現性のある腫瘍伸長を生成する。この手順は死亡率が低く忍容性が高いが33、注意点は、脳内に細胞の(局所化された)ボーラスを迅速に導入し、早期脳転移の病因をモデル化しない比較的粗雑なアプローチであるということです。針は脳組織血管系を損傷し、それが局所的な炎症を引き起こします5,34。経験から、腫瘍細胞注入物は針の除去中に逆流する傾向があり、軟髄膜の関与につながります。あるいは、頸動脈内法は、脳微小血管系を最初に遭遇する毛細血管床として、循環、血管外漏出、およびコロニー形成における生存をモデル化して、細胞を総頸動脈に送達する24。他の25と一致して、この方法に関する私たちの経験は、外頸動脈を介してこれらの組織の毛細血管床に癌細胞が意図せずに送達されるため、顔面腫瘍を引き起こす可能性があることがわかりました(未発表データ)。総頚動脈注射の前に外頚動脈を結紮することで顔面腫瘍を予防することができます(図1)。記事の残りの部分では、この方法は「内頸動脈注射」と呼ばれます。経験から、内頸動脈注入法は、全身事象が非常に少ない脳転移を一貫して生成し、異なる原発癌(黒色腫、乳癌、肺癌など)の脳転移モデルを生成することに成功しています(図1)。欠点は、技術的に困難で、時間がかかり、侵襲的であり、細胞数とモニタリングタイムラインの慎重な最適化が必要であることです。要約すると、頭蓋内および内頸動脈注射法の両方が、脳腫瘍関連の生存利益に対する治療的影響を評価するのに適したマウスモデルを生成する。
このプロトコルは、全身的な関与がほとんどない脳転移のマウスモデルを作成するための内頸動脈注射法を説明しているため、薬物分布の前臨床評価と実験的治療法の有効性に適しています。

図1:脳転移のための内頸動脈注射プロトコルの概略図。 外頸動脈結紮を伴う内頚動脈注射は、様々な原発癌由来の脳転移モデルを確実に作製することができる。このプロトコルでは、3つの結紮糸が頸動脈に配置されています(図ではL1-L3と注釈されています)。この図の拡大版を表示するには、ここをクリックしてください。
プロトコル
すべての研究は、クイーンズランド大学の動物倫理委員会(UQCCR/186/19)のガイドライン、および科学目的での動物の世話と使用に関するオーストラリアのコードの範囲内で実施されました。
1.注射用癌細胞の調製
注:この研究では、ヒト乳がん細胞株BT-474(BT474)を使用しました。BT474を、10%ウシ胎児血清および1%インスリンを添加したRPMI 1640培地を含む完全増殖培地中で培養した。細胞を空気雰囲気中で5%二酸化炭素を用いて37°Cのインキュベーター内に維持した。サテライトタンデムリピート試験35により細胞株を認証し、レポータータンパク質(例えば、ルシフェラーゼ)の発現(例えば、ルシフェラーゼ)があれば確認し、マイコプラズマ感染の有無を調べる。
- 注射前に、10 mLの完全増殖培地および培養液(37°Cで5%CO2)を使用して、BT474癌細胞を2.0 x 106細胞の播種密度でT75フラスコに播種します。
- 注射当日、増殖培地を廃棄し、細胞単層をリン酸緩衝生理食塩水(PBS)で2回洗浄する。
- 5 mLの予温した細胞培養解離試薬( 材料の表を参照)を加え、37°Cで5分間、または細胞が剥離するまでインキュベートします。5分後、フラスコを軽くたたいて細胞の剥離を助けます。
- 10%ウシ胎児血清を含む5 mLの完全増殖培地を添加して、解離試薬活性を消光します。
- ピペッティングによって細胞を穏やかに再懸濁し、細胞の塊を減らします。
- 細胞懸濁液を50 mLチューブに移し、室温で180 x g で3分間遠心分離します。
- 上清をデカントし、細胞ペレットをカルシウムとマグネシウムを含まない10 mLのハンクスバランスソルト溶液(HBSS)に再懸濁して、細胞の凝集を最小限に抑えます。
- 細胞懸濁液を180 x g で室温で3分間遠心分離します。
- 上清をデカントして残留血清/解離試薬を除去し、細胞ペレットを3 mLのHBSSに再懸濁します。
- 100 μmのセルストレーナーを新しい50 mLコニカルチューブに置き、細胞懸濁液を通過させて細胞塊を取り除きます。
注:単一細胞懸濁液は、血管の閉塞と注射時の脳卒中のリスクを最小限に抑えるために不可欠です。 - トリパンブルー除外と標準的な方法で血球計算盤を使用して、生細胞の数を計算します。
- 細胞懸濁液をHBSSで2.5 x 106 細胞/mLの細胞濃度に希釈します。
- チューブを氷上で水平に保ち、凝集を最小限に抑えるために定期的にチューブを静かに揺り動かします。細胞懸濁液は、氷上で最大6時間保存することができる。
注:ロッキングは手動で行われましたが、これは低回転数のシェーカーを使用して行うこともできます。
2.手順のためのマウスの準備
注:この研究では、4〜5週齢の雌のNODシッドマウスを使用しました。手順の3日前にソフトダイエット回復食品(ダイエットジェル、ヒドロゲル、マッシュマウスチャウチャウなど)をマウスに導入して、手順後の摂食を促します。
- オートクレーブ手術器具。手術部位と機器に表面消毒剤をスプレーして拭き取り、続いて70%エタノールをスプレーします。
- 低体温症を防ぐために、手術用ボードの下に動物のヒートマットを置きます。手術の30分前にこれをオンにします。手術用ボードに表面消毒剤をスプレーして拭き取り、続いて70%エタノールをスプレーします。
- 回復のために清潔な動物飼育ケージと暖かい加熱パッドを準備します。
- 清潔な個人用保護具(ガウン、マスク、ヘアネット、手袋)を着用してください。清潔な試験用手袋と「器具のヒントのみ」のテクニックを使用して、手順全体を通して無菌性を維持します。
- マウスがペダル反射を失うまで、2 L / minの酸素流量で5%イソフルランを使用して麻酔チャンバーでマウスを麻酔します。.
- 動物をチャンバーから取り出し、残りの外科的処置のために2 L / minの酸素流で2%イソフルランを供給するノーズコーンに入れます。
- 識別のためのイヤーパンチマウスと首の領域から毛皮を剃るために電気バリカンを使用します。テープを使用して露出した皮膚から余分な髪をきれいにします。
- 必要な麻酔薬および鎮痛薬の投与量を計算するためにマウスを体重測定する。ブプレノルフィンとメロキシカムをそれぞれ50μg / kgと1mg / kgで皮下注射で投与します。.
- マウスを暖かい手術用ボードに移し、ノーズコーンをテープで固定します。
- 乾燥を防ぐために眼の潤滑剤を目に塗ります。
- 最初に外科用ボードにテープで留めた糸を使用して上顎切歯を引っ掛け、次に前足と後脚をテープで留めて、マウスを優しく固定します。このステップは、体を伸ばし、手術中に首をまっすぐに保ちます。
- 下記の術前の皮膚調製を行う。
- 局所消毒剤(ポビドンヨード)で首を拭いて、皮膚の微生物叢の負荷を減らし、抜け毛を取り除きます。皮膚の中心からきれいにし、切開部位の再汚染を防ぐために外側に働きます。70%エタノールを使用してこのプロセスを繰り返します。消毒のためにヨウ素とエタノールを交互に3回行います。
- 動物の上に外科用ドレープを置きます。これは、滅菌ペーパータオルまたはオートクレーブバッグから切り取られ、作られます。
- 手術器具用の滅菌ペーパータオルまたはオートクレーブバッグをレイアウトします。
- 手順を続行する前に、十分な麻酔を確保するために、「ピンチテスト」 で 反射を確認してください。
3.内頸動脈注射
注:この実験では、注射手順を容易にするために、31 Gの輸液カニューレと足で作動するシリンジドライバーのセットアップを利用しました(補足図1)。この設定はオプションであり、ユーザーは31 Gインスリン注射器を使用して、手順3.11および3.12をスキップできます。輸液カニューレを調製するには、2対の縫合クランプを使用して、31G針のシリンジフィッティング部分から針部分を引っ張り、分離します。次に、長さ約10cmの細い輸液チューブの一端に針部分を取り付けます。
- 解剖顕微鏡をマウスの上に置きます。
- はさみを使用して、顎の下5 mmから胸部入口まで、首の領域の正中線に沿って垂直に15 mmの切開を行います。
- 2対の角度の付いた鉗子を使用して、皮膚とその下にある唾液腺を分け、気管を露出させ続けるために開創器を適用します。次のステップでは、気管と平行にある頸動脈鞘を露出させます。
- 2対の細かい角度の鉗子を使用して、気管に隣接する筋肉と脂肪組織を鈍く解剖し、右頸動脈鞘を露出させます。頸動脈鞘は、総頸動脈、静脈、迷走神経を覆う線維層であり、この束は真っ赤な総頸動脈によって視覚化できます。本研究では右頸動脈に注射を行った。
- 周囲の筋膜の頸動脈分岐部までの総頸動脈の尾部の一部を取り除き、迷走神経および静脈から分離します。
- 頸動脈分岐部(外頸動脈と内頸動脈を結合する接合部)を周囲の神経や筋膜から隔離して取り除きます。細かい鉗子を外頸動脈の下に配置し、動脈の下に絹縫合糸(厚さ5-0)を通過させます。縫合糸を結びつけて締め、余分な線を切ります。
注:この結紮糸(L1)は、注射液が外頸動脈を通過するのを防ぎます。 - 総頸動脈の下に細かい鉗子を配置し、動脈の下に絹縫合糸(5-0の厚さ)を通過させます。結び目を結び、提案された注射部位の近位位置で縫合糸を締めます。余分な縫合糸を切断し、約10 mmの線を残します。
注:この2番目の結紮糸(L2)は、注射後の血流と出血を制限します。また、注射中に頸動脈を配置して保持するためにも使用されます。 - 約10 mm x 5 mmの(オートクレーブ処理された)低糸くずの使い捨てワイパー( 材料の表を参照)のストリップをカットして湿らせます。ストリップを4 mm x 5 mm、厚さ2〜3 mmに折り、注射予定部位の頸動脈の下に置きます。これは注入中に血管を支えます。
- 提案された注射部位への総頸動脈吻側に、緩い結び目で3番目の結紮(L3)を配置します。これは注射後(ステップ3.16)にのみ締め付けられます。
- 細胞懸濁液を穏やかに攪拌し、200 μLの細胞懸濁液をインスリン注射器(31 G針付き)に引き込みます。
- 作動するフットペダルに接続されているシリンジドライバーにシリンジをロードします。
- 31 Gの針が付いた細かいカニューレをシリンジに取り付け、ラインを下塗りします。
- 頸動脈が適切に配置され、加圧されているかどうかを確認します。
- 2つの細かい角度の鉗子を使用して、1つは最初の結紮糸の端にそっと引っ張り、もう1つは31 Gの針を保持し、穴を開けないように注意しながら、ベベルアップで針を血管の内腔にゆっくりと挿入します。
- 100 μLの細胞懸濁液(ステップ1.13から)を10 μL/sで総頸動脈にゆっくりと注入します。これにより、2.5 x 105 細胞が血管に送達されます。注射の成功は、頸動脈血管からの血液の除去 によって 視覚化されます。
- 針を抜いた直後に緩い結紮糸(L3)をそっと持ち上げて締めます(手順3.9から)逆流と出血を防ぎます。余分な縫合糸をトリミングします。
注意: 針の離脱後に少量の血液が噴出するのを観察するのは正常です。ただし、3番目の結紮糸を締めた後、活発な出血があってはなりません。 - 湿らせた糸くずの少ない使い捨てワイパーを取り除きます。
- P200ピペットを使用して、150〜200μLの滅菌水または生理食塩水で手術腔を2回すすぎます。
- 出血がないかもう一度確認してから、開創器を取り外します。
- 軟部組織、唾液腺、および皮膚を頸動脈と気管の上に再配置します。
- 縫合針ホルダー、鉗子、および吸収性または非吸収性の6/0モノフィラメント縫合糸を連続パターンで使用して、切開部の皮膚層を閉じます。
- カニューレ針シリンジを廃棄し、次のマウス用の新しいセットアップを準備します。新しい注射器を使用すると、各マウスに注入される細胞の数が一定になります。
メモ: この手順の代表的なスナップショットを 補足図 2 に示します。注射液の漏れまたは出血によって示される、血管が針によって穿刺または引き裂かれた場合、手順は失敗したと見なされます。これに続いて、針を抜く必要があり、それ以上の出血を防ぐために3番目の結紮糸をすぐに締める必要があります。縫合糸の締め付け後に出血が持続する場合は、動物をペントバルビタールで安楽死させる必要があります。
4.注射後の回復
- 術後の痛みの緩和として、ブプレノルフィン(50 μg / kg)とメロキシカム(1 mg / kg)を皮下注射 で 注射します。.
- 麻酔から回復するために動物を暖かく清潔なケージに移動します。動物が目覚めた後、活動が抑制される(群がって活動していない、またはゆっくりと動き回っている)のは正常です。
- 30〜45分後、マウスを長期保持施設に移す。
- 術後少なくとも1週間はマウスにソフトダイエット(ダイエットジェル、ハイドロゲル、マッシュ)を与え、脳卒中、感染、創傷部位周辺の出血の兆候に特に注意を払いながら毎日体調をチェックします。
- 手術の2日後、動物の活動が低下し、毛皮が軽度に波立たせられ、術前の体重が15%減少するのが一般的です。痛みを管理し、回復を助けるために、手術後2〜3日間毎日鎮痛薬(メロキシカム)を投与します。.
- 3日目以降、動物は活動を取り戻し、給餌とグルーミングの頻度を増やし、体重を取り戻したに違いありません。腹腔内注射 を介して ペントバルビタールナトリウムを200 mg / kgで注射することにより、術後4日後に持続的な体調障害(痛み、群がり、不活性、体重減少)のある動物を安楽死させます。.
- 腫瘍の生着と進行は、生物発光イメージング、MRIまたはPET / MRIなどの選択した麻酔およびイメージングモダリティを使用して監視できます。このようなイメージングを実施するための要件と能力は、本質的に個々のプロジェクトの目的とそれが実施される施設に依存し、使用される細胞株のレポータータグの種類に応じて、関連する放射化学および核イメージング施設へのアクセス可能性に依存します36,37
注:一部の動物は、手順が成功したにもかかわらず、うまく反応せず、脳卒中を経験する場合があります。処置後、神経学的苦痛の症状(頭を回して片側に引っ張る、旋回行動、転がる、スラッシングする、運動機能の喪失)を示す動物は直ちに安楽死させなければなりません。
結果
外頸動脈結紮の有無にかかわらず一般的な頸動脈注射を比較する
外頚動脈24を最初に結紮することなく、総頸動脈を介して癌細胞を注入すると、移植マウスの77.8%(n=7/9匹)に顔面腫瘍が認められた。顔面腫瘍の例を補足図3に示します。このプロトコルに記載される方法は、総頸動脈の前に外頸動脈を結紮することによって意図しない顔面転移を防止する。
2つの方法を比較するために、外頸動脈結紮の有無にかかわらず、淘汰されたマウスの共通頸動脈にレクチンを注射した。次に、顔面組織と脳を固定し、処理し、蛍光顕微鏡で観察しました。外頸動脈を結紮した場合の頬組織における免疫蛍光解析でレクチンの減少が観察された(図2A-B)。結果はまた、外頸動脈結紮を伴う総頸動脈注射を受けたマウスの脳組織にレクチンが観察されるため、外頸動脈結紮が脳送達に影響を与えなかったことを示しています(図2C-D)。したがって、この追加のステップは、顔面組織への最小限の播種で、内頸動脈を介して脳への癌細胞の送達を指示することができる。

図2:外頸動脈結紮の有無にかかわらず頸動脈内移植片送達。レクチン(緑色)を総頸動脈に送達したマウスの右頬筋(A,B)および脳(C,D)の蛍光イメージング(A,C)または外頸動脈結紮の有無(B,D)のいずれか。頬と脳は20倍と5倍の倍率で画像化され、スケールバーはそれぞれ50μmと200μmを表します。核(青色)をDAPIで染色した。この図の拡大版を表示するには、ここをクリックしてください。
生物発光モニタリング
この研究では、ルシフェラーゼを発現するように遺伝子改変されたHER2増幅乳がん細胞株BT474を使用して、ルシフェリンを投与し、 in vivo 生物発光イメージングを行うことにより、腫瘍の進行を毎週モニタリングできるようにしました。このBT474脳転移モデルでは、内頸動脈注射後5週目から生物発光シグナルが観察され、時間の経過とともに強度が徐々に増加しました(図3)。
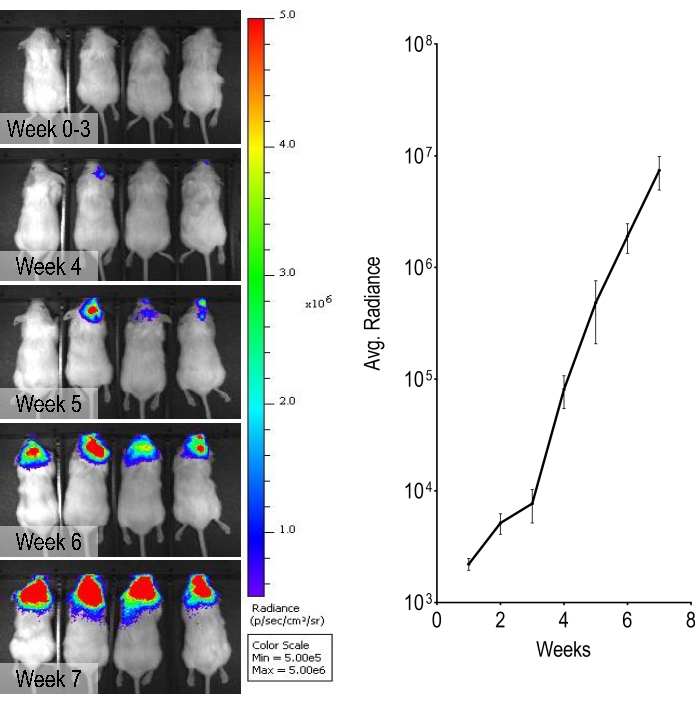
図3:生物発光シグナルの生物発光モニタリングと定量化。 0週目から7週目までの代表的な毎週の生物発光画像は、頭部に由来する強度の増加を示しています。グラフは、マウスにおける生物発光シグナルの定量化を示す。データは標準誤差(n = 4)±手段です。この図の拡大版を表示するには、ここをクリックしてください。
磁気共鳴画像法(MRI)
脳転移動物モデルを、頭蓋内腫瘍の進行を評価するために、2、5、および8週目にT2強調MRIを使用して画像化しました。5週目から8週目にかけて、不均一なシグナル強度の領域が観察され、おそらく腫瘍血管系の破壊による複雑な体液灌流を伴う頭蓋内腫瘍を示します(図4A)。脳転移モデルの血液脳関門は破壊され、臨床的脳転移のそれに似ています。これは、ガドリニウムコントラスト強調とそれに続くT1強調MRIシーケンスを使用して評価されました。腫瘍領域内のガドリニウム濃度は、血液循環から腫瘍組織に漏れるにつれて増加します。これは、T1緩和時間の短縮を表す暗い領域によって示される(図4B)。得られたデータは、薬物アクセスを血液脳関門透過性と相関させるために使用することができる。さらに、頭蓋内腫瘍の体積と表面積は、3D Slicer画像解析ソフトウェアを使用して体積セグメンテーションを実行することによって導き出すことができます(図4C)。これは、脳腫瘍の成長を追跡するために時間に対してグラフにプロットすることができます。

図4:磁気共鳴画像法を用いた脳転移動物モデルの特性評価 。 (A)1、5、および8週目のモデルのT2強調横方向、冠状、および矢状スキャン。5週目には、矢状視野(赤い矢印)にかすかな斑状の領域が見られ、8週目までに超高強度で不均一な領域に進行しました。(B)ガドリニウム造影剤(CE)剤の注射前後における脳腫瘍(赤色の領域)を示す動的造影T1強調MRI。暗い領域は、ガドリニウムの漏出と取り込みを示します。(C)冠状面、横方向、矢状面で視覚化された腫瘍に注釈を付け、3D Slicer画像解析ソフトウェアを使用してセグメント化し、頭蓋内腫瘍体積を導き出しました。 この図の拡大版を表示するには、ここをクリックしてください。
ナノメディシンの生体分布を決定するためのPET / MRイメージング
破壊された血液脳関門と漏出性腫瘍血管系の組み合わせは、透過性と保持効果の向上を介して、ナノスケールの治療薬の受動的な取り込みと蓄積を促進します36,37。BT474脳転移モデルがHER2を過剰発現したため、陽電子放出断層撮影/磁気共鳴(PET/MR)イメージングを用いたジルコニウム89標識HER2標的ナノメディシンの脳内取り込みを行いました(図5)。BT474 BMマウスのコホートでは、腫瘍領域内で検出されたナノメディシンは、関与していない脳領域内のナノメディシンよりも高く、脳転移におけるナノメディシンの蓄積が確認されました。

図5:BT474脳転移マウスにおけるジルコニウム-89標識HER2標的ナノメディシン(89Zr-HER2-NM)の代表的なPET / MR 画像。 (A)左の画像は、脳腫瘍(赤色領域)と関与していない脳(青色領域)を示すT2ウェイトMRI(コロナ図)を示しています。隣接する2つの画像は、PETオーバーレイを重ね合わせたMRI画像(コロナ図と横図)を示しています。色付けされたPETオーバーレイは、腫瘍領域が関与していない領域(青/緑)と比較してナノメディシン(白、赤、黄)の取り込みが高いことを示しています。(B)グラフは、関与していない脳(n = 12)と比較した脳腫瘍におけるPETシグナル強度とナノメディシンの取り込みの増加を示しています(グラムあたりの注射用量、ID / g)。 この図の拡大版を表示するには、ここをクリックしてください。
BMモデルの生存と身体状態
BT474脳転移モデルは、注射後9週間の中央値を生存しました(図6)。脳転移が進行するにつれて、動物は最大20%の体重を失い始め、安楽死が必要になりました(6〜9週の間)。後期の脳転移では、一般的な症状には、波立たせられた毛皮と膨らんだドーム型の頭蓋骨が含まれます。動物はしばしば活動しておらず、群がり、運動能力と筋力の機能的欠陥を示しました。

図6:BT474脳転移マウスモデルのカプランマイヤー曲線。 生存期間中央値は注射後9週であった(n = 18)。 この図の拡大版を表示するには、ここをクリックしてください。
組織学
安楽死後、動物を4%パラホルムアルデヒド溶液で灌流して、脳組織学アーキテクチャを保存しました40。続いて、脳および他の器官を処理、切片化し、ヘマトキシリンおよびエオジン(H&E)で染色した。この脳転移モデルでは、腫瘍は一方的に位置し、頸動脈注射の側と一致した(図7A)。BT474腫瘍は、ほとんどが固形の孤立性腫瘤として現れ、場合によっては大脳半球のほぼ半分が関与していました(図7B)。空きスペースのポケットが頻繁に観察され、壊死細胞で構成されていました(図7C)。一部の動物では、より小さな成長も存在しました(図7E)。免疫組織化学染色により、BT474脳転移は強いHER2およびHER3を発現することが示され、このモデルがHER2およびHER3標的療法に適していることが示唆されました(図7F)。

図7:BT474脳転移モデルの脳組織像。 (A)BT474 BMマウスの代表的な脳切片;色付きのボックスは、拡大された関心領域をマークしました。スケールバー=2mm。 (B)類上皮細胞の塊を含む固形腫瘍。(C)空間内の壊死細胞。(D)腫瘍-脳界面(E)微小転移として知られる小さな成長。(B-Eスケールバー= 200μm)。(F)HER2およびHER3陽性を示し、ヘマトキシリンおよびエオシン(H&E)と一致した免疫組織化学画像。スケールバー = 100 μm。 この図の拡大版を表示するには、ここをクリックしてください。
体系的な関与
他の臓器の組織切片に腫瘍は観察されませんでした(図8)。この発見は、生物発光が動物の頭部からのみ検出された生物発光データと一致する。まとめると、結果は、このモデルが検出可能な全身性腫瘍と関連していないことを示しました。

図8:他の臓器の組織学。 スクリーニングされた臓器(骨、肝臓、腎臓、膵臓、肺、心臓、脾臓、腸、卵巣)に明らかな腫瘍の関与はありませんでした。スケールバー = 100 μm。 この図の拡大版を表示するには、ここをクリックしてください。
補足図1:内頸動脈注射用のカニューレ注射器。このファイルをダウンロードするには、ここをクリックしてください。
補足図2:内頸動脈注入プロセスのスナップショット。 画像の説明は 、補足表1に記載されています。 このファイルをダウンロードするには、ここをクリックしてください。
補足図3: 右顔面組織に大きな筋肉内腫瘍を示すT2強調MRI (赤で輪郭が描かれている)。H&E染色された組織切片は、密集した腫瘍細胞を明らかにする。スケールバー= 2 mm(中央)および100 μm(右)。 このファイルをダウンロードするには、ここをクリックしてください。
補足表1:補足図2の内頸動脈注射の段階的な説明。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
脳転移は、がん細胞が原発部位から脳に広がる複雑なプロセスです。この多段階プロセスの特定の段階を反映したさまざまな動物モデルが利用可能であり、前臨床転移研究を設計するための生理学的および実用的な考慮事項があります41,42。脳転移治療のためのナノメディシンの使用を調査したほとんどの発表された研究は、心臓内43,44および頭蓋内45,46,47,48,49モデルを使用しています。頸動脈を介して癌細胞を移植することは、転移過程および脳転移病理生物学をよりよく再現する可能性がある。
しかし、経験から、一般的な頸動脈注射技術により、いくつかの動物が早い時点で重大な顔面腫瘍を呈しました。活動性の脳腫瘍と顔面腫瘍の両方を有する動物では、顔面腫瘍は脳腫瘍よりも急速に拡大することが観察された。これは、腫瘍の成長をサポートするより血管新生した微小環境が原因である可能性があります(補足図3)。
総頸動脈は、それぞれ外動脈と頸動脈 を介して 顔面領域と脳に血液を供給します。したがって、他の人25と一致して、総頸動脈 を介して 癌細胞を注入することは、両方の領域に播種することにつながります。総頚動脈注射の前にまず外頸動脈を結紮することで顔面腫瘍を予防することができる。
ここで説明する内頸動脈注入法は、脳に供給する一次血管にがん細胞を導入することで脳転移を模擬するものです。このモデルは、脳の血管床における循環癌細胞の倒伏を再現し、それらの移動と転移性脳の成長の形成を可能にします。結果は、頸動脈注射が心臓内注射などの方法に関連する他の臓器への癌の播種を制限することを示しています。
プロトコルには、いくつかの重要な考慮事項とトラブルシューティング情報があります。まず、細胞塊は頭蓋内血管を閉塞し、脳卒中を引き起こす可能性があります。これは、細胞懸濁液をセルストレーナーに通して、凝集塊のない細胞懸濁液を確保することで軽減できます。次に、過剰な水分を脳に注入すると、炎症性浮腫を引き起こし、血管の側性化を妨げる可能性があります。これは、100μL未満の注入量を使用することで回避できます。 端部が擦り切れ、筋膜または線維脂肪組織が存在する縫合糸を使用すると、外頸動脈周辺の縫合糸のループが妨げられる可能性があります。最初に鉗子で動脈に沿って穏やかな拭き取り動作を適用して筋膜または線維脂肪組織を取り除き、縫合糸の端を切断することによってほつれの端を取り除くことをお勧めします。最後に、がん細胞株は独自の増殖速度を持っているため、注射用の細胞濃度を最適化することが不可欠です。経験から、攻撃的なヒト癌細胞株NCI-H1975およびA2058をそれぞれ関与させた肺および黒色腫脳転移モデルでは、急速な疾患進行を防ぐために、より少ない細胞(100μL中に1 x 105 細胞)を注射した。
このプロトコルで最も困難なステップは、頸動脈への針の挿入と細胞の注入です。鈍い針を使用すると血管に穴を開けたり裂いたりするリスクが高まるため、無菌のために動物ごとに新しい針を使用することをお勧めします。また、注射中の注射液や不安定な針の初期噴出を減らすために、手順にシリンジドライバーを使用することをお勧めします。シリンジドライバーには、注入速度を生理学的血流速度に一致させるという追加の利点もあります。
このプロトコルには制限がないわけではありません。この手順は技術的に要求が厳しく、手順が成功したにもかかわらず、動物が側方化の失敗から脳卒中に屈するリスクがあります。私たちの経験から、脳卒中の割合は11.4%(n = 21/168匹)です。したがって、開始サンプルサイズは、脳卒中で死亡するこれらの動物を考慮する必要があります。この方法は癌細胞を直接脳に送達するため、全身の腫瘍量が減少し、全身の広がりを研究するのには理想的ではありません。
要約すると、このプロトコルは、薬物スクリーニングおよび薬物の治療プロファイルの評価に適した脳転移マウスモデルの生成を可能にするであろう。
開示事項
著者は利益相反を宣言しません。資金提供者は研究のデザインに何の役割も果たさなかった。データの収集、分析、または解釈。原稿の執筆、または論文の出版の決定において。
謝辞
この研究は、オーストラリア国立保健医療研究評議会(NHMRC)、助成金番号APP1162560によって資金提供されました。MLは、UQ大学院研究奨学金によって資金提供されました。畜産と動物の 生体内 イメージングにご協力いただいた皆様に感謝いたします。この研究のためにジルコニウムのアリコートを寄付してくれたロイヤルブリスベンアンドウィメンズ病院に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 100µm cell strainer | Corning | CLS431752 | |
| 30G Microlance needle | BD | 23748 | |
| 31G Ultra-Fine II insulin syringe | BD | 326103 | |
| Angled forceps | Proscitech | T67A-SS | Fine pointed, angled without serrations, 18mm tip, length 128 mm |
| Animal heat mat | |||
| Antibiotic and antimycotic | ThermoFisher Scientific | 15240062 | |
| Autoclave bags | |||
| BT-474 (HTB-20) breast cancer cell line | ATCC | HTB-20 | |
| Buprenorphine (TEMGESIC) | |||
| Countess cell counter | ThermoFisher Scientific | C10227 | |
| Diet-76A | ClearH2O | 72-07-5022 | |
| Dissection microscope | |||
| Ear puncher | |||
| Electric clippers | |||
| Fine angled forceps | Proscitech | DEF11063-07 | Angled 45°, Tip smooth, Tip width: 0.4 mm, Tip dimension: 0.4 x 0.3 mm, length 9cm |
| Fine tubing for cannula, Tubing OD (in) 1/32, Tubing ID (in) 1/100in | Cole Parmer | EW-06419-00 | |
| Foetal bovine serum | ThermoFisher Scientific | 26140079 | |
| Hank's Balanced Salt Solution without calcium and magnesium | ThermoFisher Scientific | 14170120 | |
| Hydrogel | ClearH2O | 70-01-5022 | |
| Isoflurane | |||
| Kimwipes Low lint disposable wipers | Kimberly Clark- Kimwipes | Z188964 | |
| Mashed mouse chow | |||
| Meloxicam (METACAM) | |||
| Nose cone | Fashioned out of a microfuge tube | ||
| PAA ocular lubricant (Carbomer 2mg/g) | Bausch and lomb | ||
| Povidone-iodine solution | Betadine | 2505692 | |
| PPE (glove, mask, gown, hairnet) | |||
| Retractors | Kent Scientific | SURGI-5001 | |
| RPMI 1640 Media | ThermoFisher Scientific | 11875093 | |
| Silk suture 13mm 5-0, P3, 45cm | Ethicon | JJ-640G | |
| Sterile normal saline | ThermoFisher Scientific | TM4469 | |
| Sticky tape | |||
| Surgical board | A chopping board wrapped with autoclavable bag. | ||
| Surgical scissors | Proscitech | T104 | Tip Dimensions (LxD): 38x7mm, Length 115mm |
| Suture forcep/ Curved Brophy forceps | Proscitech | T113C | Curved, Rounded narrow 2 mm tip, with serrations, length 165 mm |
| Suture needle holder (Olsen Hegar needle holder) | Proscitech | TC1322-180 | length 190 mm, ratchet clamp |
| Syringe driver with foot pedal/ UMP3 Ultra micro pump | World Precision Instruments | UMP3-3 | |
| T75 tissue culture flask | ThermoFisher Scientific | 156499 | |
| Thread | |||
| Trigene II surface disinfectant | Ceva | ||
| Trypan Blue and Cell Counting Chamber Slides | ThermoFisher Scientific | C10228 | |
| TrypLE Express dissociating medium | ThermoFisher Scientific | 12605010 |
参考文献
- Nayak, L., Lee, E. Q., Wen, P. Y. Epidemiology of brain metastases. Current Oncology Reports. 14 (1), 48-54 (2012).
- Australian Institute of Health and Welfare. Cancer in Australia. , Canberra: AIHW. (2017).
- Maher, E. A., Mietz, J., Arteaga, C. L., DePinho, R. A., Mohla, S. Brain metastasis: opportunities in basic and translational research. Cancer Research. 69 (15), 6015-6020 (2009).
- Lin, N. U. Breast cancer brain metastases: new directions in systemic therapy. Ecancermedicalscience. 7, (2013).
- Zimmer, A. S., Van Swearingen, A. E. D., Anders, C. K. HER2-positive breast cancer brain metastasis: A new and exciting landscape. Cancer Reports. 5 (4), (2020).
- Brown, P. D., et al. Postoperative stereotactic radiosurgery compared with whole brain radiotherapy for resected metastatic brain disease (NCCTG N107C/CEC·3): a multicentre, randomised, controlled, phase 3 trial. Lancet Oncology. 18 (8), 1049-1060 (2017).
- Murrell, J., Board, R. The use of systemic therapies for the treatment of brain metastases in metastatic melanoma: Opportunities and unanswered questions. Cancer Treatment Reviews. 39 (8), 833-838 (2013).
- Stemmler, H. J., et al. Ratio of trastuzumab levels in serum and cerebrospinal fluid is altered in HER2-positive breast cancer patients with brain metastases and impairment of blood-brain barrier. Anticancer Drugs. 18 (1), 23-28 (2007).
- Venur, V. A., Leone, J. P. Targeted therapies for brain metastases from breast cancer. International Journal of Molecular Sciences. 17 (9), 1543(2016).
- Murthy, R., et al. Tucatinib with capecitabine and trastuzumab in advanced HER2-positive metastatic breast cancer with and without brain metastases: a non-randomised, open-label, phase 1b study. The Lancet Oncology. 19 (7), 880-888 (2018).
- Murthy, R. K., et al. trastuzumab, and capecitabine for HER2-positive metastatic breast cancer. New England Journal of Medicine. 382 (7), 597-609 (2019).
- Shah, M., et al. FDA approval summary: Tucatinib for the treatment of patients with advanced or metastatic HER2-positive breast cancer. Clinical Cancer Research. 27 (5), 1220-1226 (2021).
- Vogelbaum, M. A., et al. Treatment for brain metastases: ASCO-SNO-ASTRO guideline. Journal of Clinical Oncology. 40 (5), 492-516 (2021).
- Ramakrishna, N., et al. Management of advanced human epidermal growth factor receptor 2-positive breast cancer and brain metastases: ASCO guideline update. Journal of Clinical Oncology. 10, (2022).
- Li, J., et al. A multifunctional polymeric nanotheranostic system delivers doxorubicin and imaging agents across the blood-brain barrier targeting brain metastases of breast cancer. ACS Nano. 8 (10), 9925-9940 (2014).
- Mittapalli, R. K., et al. Paclitaxel-hyaluronic nanoconjugates prolong overall survival in a preclinical brain metastases of breast cancer model. Molecular Cancer Therapeutics. 12 (11), 2389-2399 (2013).
- Hamilton, A. M., et al. Nanoparticles coated with the tumor-penetrating peptide iRGD reduce experimental breast cancer metastasis in the brain. Journal of Molecular Medicine. 93 (9), 991-1001 (2015).
- Patil, R., et al. MRI virtual biopsy and treatment of brain metastatic tumors with targeted nanobioconjugates: nanoclinic in the brain. ACS Nano. 9 (5), 5594-5608 (2015).
- Brighi, C., et al. MR-guided focused ultrasound increases antibody delivery to non-enhancing high-grade glioma. Neuro-Oncology Advances. 2 (1), (2020).
- Inamura, T., Black, K. L. Bradykinin selectively opens blood-tumor barrier in experimental brain tumors. Journal of Cerebral Blood Flow & Metabolism. 14 (5), 862-870 (1994).
- Priego, N., et al. Abstract 2746: Stat3 labels a subpopulation of reactive astrocytes required for brain metastasis. Cancer Research. 79, 2746(2019).
- Wyatt, E. A., Davis, M. E. Method of establishing breast cancer brain metastases affects brain uptake and efficacy of targeted, therapeutic nanoparticles. Bioengineering & Translational Medicine. 4 (1), 30-37 (2018).
- Nakayama, J., et al. The in vivo selection method in breast cancer metastasis. International Journal of Molecular Sciences. 22 (4), 1886(2021).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid cancer cell injection to produce mouse models of brain metastasis. Journal of Visualized Experiments. 120, 55085(2017).
- Liu, Z., et al. Improving orthotopic mouse models of patient-derived breast cancer brain metastases by a modified intracarotid injection method. Scientific Reports. 9 (1), 622(2019).
- Bos, P. D., et al. Genes that mediate breast cancer metastasis to the brain. Nature. 459, 1005-1009 (2009).
- Hu, X., Villodre, E. S., Woodward, W. A., Debeb, B. G. Modeling brain metastasis via tail-vein injection of inflammatory breast cancer cells. Journal of Visualized Experiments. 168, (2021).
- Cho, J. H., et al. AKT1 activation promotes development of melanoma metastases. Cell Reports. 13 (5), 898-905 (2015).
- Meuwissen, R., et al. Induction of small cell lung cancer by somatic inactivation of both Trp53 and Rb1 in a conditional mouse model. Cancer Cell. 4 (3), 181-189 (2003).
- Kato, M., et al. Transgenic mouse model for skin malignant melanoma. Oncogene. 17 (14), 1885-1888 (1998).
- Khanna, C., Hunter, K. Modeling metastasis in vivo. Carcinogenesis. 26 (3), 513-523 (2005).
- Sulaiman, A., Wang, L. Bridging the divide: preclinical research discrepancies between triple-negative breast cancer cell lines and patient tumors. Oncotarget. 8 (68), 113269-113281 (2017).
- Pierce, A. M., Keating, A. K. Creating anatomically accurate and reproducible intracranial xenografts of human brain tumors. Journal of Visualized Experiments. 91, 52017(2014).
- Geisler, J. A., et al. Modeling brain metastases through intracranial injection and magnetic resonance imaging. Journal of Visualized Experiments. 160, (2020).
- Reid, Y., Storts, D., Riss, T., Minor, L., et al. in Assay Guidance Manual. eds Markossian, S. et al.) Eli Lilly & Company and the National Center for Advancing Translational Sciences. , (2004).
- Janowicz, P. W., et al. Understanding nanomedicine treatment in an aggressive spontaneous brain cancer model at the stage of early blood brain barrier disruption. Biomaterials. , 283(2022).
- Houston, Z. H., et al. Understanding the Uptake of Nanomedicines at Different Stages of Brain Cancer Using a Modular Nanocarrier Platform and Precision Bispecific Antibodies. ACS Cent Sci. 6 (5), 727-738 (2020).
- Matsumura, Y., Maeda, H. A new concept for macromolecular therapeutics in cancer chemotherapy: mechanism of tumoritropic accumulation of proteins and the antitumor agent smancs. Cancer Research. 46, 6387-6392 (1986).
- Clemons, T. D., et al. Distinction between active and passive targeting of nanoparticles dictate their overall therapeutic efficacy. Langmuir. 34 (50), 15343-15349 (2018).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. Bio-Protocol. 11 (5), (2021).
- Masmudi-Martín, M., et al. Brain metastasis models: What should we aim to achieve better treatments. Advanced Drug Delivery Reviews. 169 (20), 79-99 (2021).
- Carney, C. P., et al. Harnessing nanomedicine for enhanced immunotherapy for breast cancer brain metastases. Drug Delivery and Translational Research. 11 (6), 2344-2370 (2021).
- Hamilton, A. M., et al. Nanoparticles coated with the tumor-penetrating peptide iRGD reduce experimental breast cancer metastasis in the brain. Journal of Molecular Medicine. 93 (9), Berlin, Germany. 991-1001 (2015).
- Bao, Y., et al. Synergistic chemotherapy for breast cancer and breast cancer brain metastases via paclitaxel-loaded oleanolic acid nanoparticles. Molecular Pharmaceutics. 17 (4), 1343-1351 (2020).
- Kotb, S., et al. Gadolinium-based nanoparticles and radiation therapy for multiple brain melanoma metastases: Proof of concept before phase I trial. Theranostics. 6 (3), 418-427 (2016).
- Zhang, T., et al. Multitargeted nanoparticles deliver synergistic drugs across the blood-brain barrier to brain metastases of triple negative breast cancer cells and tumor-associated macrophages. Advanced Healthcare Materials. 8 (18), 1900543(2019).
- He, C., et al. Blood-brain barrier-penetrating amphiphilic polymer nanoparticles deliver docetaxel for the treatment of brain metastases of triple negative breast cancer. Journal of Controlled Release. 246, 98-109 (2017).
- Wang, X., et al. Enhanced anti-brain metastasis from non-small cell lung cancer of osimertinib and doxorubicin co-delivery targeted nanocarrier. International Journal of Nanomedicine. 15, 5491-5501 (2020).
- Gries, M., et al. Multiscale selectivity and in vivo biodistribution of NRP-1-targeted theranostic AGuIX nanoparticles for PDT of glioblastoma. International Journal of Nanomedicine. 15, 8739-8758 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved