Method Article
Modellazione delle metastasi cerebrali mediante iniezione interna di cellule tumorali nell'arteria carotide
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Le metastasi cerebrali sono una causa di grave morbilità e mortalità nei pazienti oncologici. La maggior parte dei modelli murini di metastasi cerebrali sono complicati da metastasi sistemiche che confondono l'analisi della mortalità e dei risultati dell'intervento terapeutico. Presentato qui è un protocollo per l'iniezione carotidea interna di cellule tumorali che produce tumori intracranici coerenti con tumori sistemici minimi.
Abstract
Le metastasi cerebrali sono una causa di grave morbilità e mortalità nei pazienti oncologici. Gli aspetti critici delle malattie metastatiche, come il complesso microambiente neurale e l'interazione delle cellule stromali, non possono essere completamente replicati con saggi in vitro ; Pertanto, i modelli animali sono fondamentali per studiare e comprendere gli effetti dell'intervento terapeutico. Tuttavia, la maggior parte dei metodi di xenotrapianto di tumori cerebrali non produce metastasi cerebrali in modo coerente in termini di lasso di tempo e carico tumorale. I modelli di metastasi cerebrali generati dall'iniezione intracardiaca di cellule tumorali possono provocare un carico tumorale extracranico non intenzionale e portare a morbilità e mortalità metastatiche non cerebrali. Sebbene l'iniezione intracranica di cellule tumorali possa limitare la formazione di tumori extracranici, ha diversi avvertimenti, come le cellule iniettate spesso formano una singola massa tumorale nel sito di iniezione, un elevato coinvolgimento leptomeningeo e danni alla vascolarizzazione cerebrale durante la penetrazione dell'ago. Questo protocollo descrive un modello murino di metastasi cerebrali generate dall'iniezione interna dell'arteria carotide. Questo metodo produce tumori intracranici in modo coerente senza il coinvolgimento di altri organi, consentendo la valutazione di agenti terapeutici per le metastasi cerebrali.
Introduzione
Le metastasi cerebrali sono un tumore maligno prevalente associato a una prognosi molto sfavorevole 1,2. Lo standard di cura per i pazienti sottoposti a metastasi cerebrali è multimodale, costituito da neurochirurgia, radioterapia cerebrale completa e/o radiochirurgia stereotassica a seconda dello stato di salute generale dei pazienti, del carico di malattia extracranica e del numero e della posizione dei tumori nel cervello 3,4. I pazienti con un massimo di tre lesioni intracraniche sono eleggibili per la resezione chirurgica o la radiochirurgia stereotassica, mentre la radioterapia dell'intero cervello è raccomandata per i pazienti con lesioni multiple per evitare il rischio di infezione correlata alla chirurgia ed edema5. Tuttavia, la radioterapia dell'intero cervello può infliggere danni alle strutture cerebrali radiosensibili, contribuendo alla scarsa qualità della vita6.
La terapia sistemica è un approccio logico alternativo e non invasivo per il trattamento di pazienti con lesioni multiple7. Tuttavia, è meno considerato a causa della nozione di lunga data che le terapie sistemiche hanno scarsa efficacia perché la somministrazione passiva di farmaci citotossici attraverso il flusso sanguigno non può raggiungere livelli terapeutici nel cervello senza il rischio di tossicità pericolosa8. Questo paradigma sta iniziando a cambiare con la terapia sistemica recentemente approvata dalla Food and Drug Administration (FDA) degli Stati Uniti (tucatinib con trastuzumab e capecitabina indicato per metastasi cerebrali del carcinoma mammario HER2+)9,10,11,12 e l'aggiornamento delle linee guida per il trattamento per includere la considerazione delle opzioni di terapia sistemica per i pazienti con metastasi cerebrali13,14.
In questo contesto, gli sviluppi nel campo della terapia molecolare mirata, dell'immunoterapia e dei sistemi alternativi di somministrazione di farmaci, come un vettore di nanofarmaci mirato, possono potenzialmente superare le sfide del trattamento delle metastasi cerebrali15,16,17,18. Inoltre, sono in fase di studio anche approcci chimici e meccanici per migliorare la somministrazione di farmaci attraverso la permeabilizzazione della barriera cervello-tumore19,20. Per studiare e ottimizzare tali approcci in modo che siano adatti allo scopo, è fondamentale utilizzare modelli preclinici che non solo rispecchino la complessa fisiologia delle metastasi cerebrali, ma consentano anche un'analisi obiettiva della risposta intracranica ai farmaci.
In generale, gli attuali approcci per modellare le metastasi cerebrali in vivo coinvolgono l'iniezione intracardiaca (ventricolo sinistro), endovenosa (di solito vena della coda), intracranica o intracarotidea (arteria carotide comune) di cellule tumorali nei topi 21,22,23,24,25,26,27 . Oltre alle strategie di attecchimento tumorale, i modelli murini geneticamente modificati in cui la formazione del tumore è innescata dalla rimozione dei geni oncosoppressori o dall'attivazione di oncogeni sono utili per la modellazione del tumore. Tuttavia, solo pochi modelli murini geneticamente modificati sono segnalati per produrre tumori secondari e ancora meno che producono in modo affidabile metastasi cerebrali28,29,30.
I metodi di attecchimento come l'iniezione intracardiaca (ventricolo sinistro) e endovenosa (di solito vena della coda) imitano la diffusione sistemica del cancro. Questi modelli producono tipicamente lesioni in più organi (ad esempio, cervello, polmoni, fegato, reni, milza) a seconda del letto capillare che intrappola la maggior parte delle cellule tumorali durante il loro "primo passaggio" circolatorio31. Tuttavia, tassi incoerenti di attecchimento cerebrale richiederanno più animali per raggiungere la dimensione del campione per la potenza statistica desiderata. Il numero di cellule tumorali che alla fine si stabiliscono nel cervello attraverso questi metodi di iniezione intracardiaca e endovenosa è variabile. Quindi, il carico tumorale delle metastasi cerebrali può variare tra gli animali e la differenza di progressione può rendere difficile standardizzare la tempistica sperimentale e l'interpretazione dei risultati. Il carico tumorale extracranico può portare alla mortalità per metastasi non cerebrali, rendendo questi modelli inadatti per valutare l'efficacia intracranica. Le linee cellulari cervello-tropico sono state stabilite utilizzando processi artificiali di selezione clonale per ridurre l'insediamento extracranico, ma i tassi di assunzione sono stati incoerenti e il processo di selezione clonale può ridurre l'eterogeneità normalmente riscontrata nei tumori umani32.
I metodi di attecchimento specifici del cervello come l'iniezione intracranica e intracarotidea consentono una modellazione delle metastasi cerebrali più coerente ed efficiente. Nel metodo intracranico33, le cellule tumorali vengono tipicamente iniettate nella corteccia cerebrale frontale, che genera una crescita tumorale rapida e riproducibile con un basso coinvolgimento sistemico. Mentre la procedura è ben tollerata con bassa mortalità33, le avvertenze sono che si tratta di un approccio relativamente grezzo che introduce rapidamente un bolo (localizzato) di cellule nel cervello e non modella la patogenesi precoce delle metastasi cerebrali. L'ago danneggia la vascolarizzazione del tessuto cerebrale, che quindi causa infiammazione localizzata 5,34. Dall'esperienza, c'è una tendenza per l'iniezione di cellule tumorali al reflusso durante la rimozione dell'ago, portando al coinvolgimento leptomeningeo. In alternativa, il metodo intracarotideo trasporta le cellule nell'arteria carotide comune con microvascolarizzazione cerebrale come primo letto capillare da incontrare, modellando la sopravvivenza in circolazione, stravaso e colonizzazione24. In accordo con altri25, la nostra esperienza con questo metodo ha scoperto che può provocare tumori facciali a causa della consegna involontaria di cellule tumorali attraverso l'arteria carotide esterna ai letti capillari in questi tessuti (dati non pubblicati). È possibile prevenire i tumori facciali legando prima l'arteria carotide esterna prima dell'iniezione comune dell'arteria carotide (Figura 1). Nel resto dell'articolo, questo metodo è indicato come "iniezione interna di arteria carotide". Per esperienza, il metodo di iniezione dell'arteria carotidea interna genera costantemente metastasi cerebrali con pochissimi eventi sistemici e ha avuto successo nel generare modelli di metastasi cerebrali di diversi tumori primari (ad esempio, melanoma, mammella e tumori polmonari) (Figura 1). Gli svantaggi sono che è tecnicamente impegnativo, richiede tempo, invasivo e richiede un'attenta ottimizzazione del numero di celle e una tempistica di monitoraggio. In sintesi, entrambi i metodi di iniezione intracranica e interna dell'arteria carotide producono modelli murini adatti a valutare l'impatto terapeutico sul beneficio di sopravvivenza correlato al tumore cerebrale.
Questo protocollo descrive il metodo di iniezione dell'arteria carotide interna per produrre un modello murino di metastasi cerebrali con quasi nessun coinvolgimento sistemico e quindi adatto per la valutazione preclinica della distribuzione dei farmaci e dell'efficacia delle terapie sperimentali.

Figura 1: Rappresentazione schematica del protocollo di iniezione dell'arteria carotide interna per le metastasi cerebrali. L'iniezione interna dell'arteria carotide con legatura esterna dell'arteria carotide può produrre in modo affidabile un modello di metastasi cerebrale da vari tumori primari. In questo protocollo, tre legature sono posizionate sull'arteria carotide (annotate come L1-L3 nella figura). Fare clic qui per visualizzare una versione ingrandita di questa figura.
Protocollo
Tutti gli studi sono stati condotti all'interno delle linee guida del Comitato etico animale dell'Università del Queensland (UQCCR / 186 / 19) e del Codice australiano per la cura e l'uso degli animali per scopi scientifici.
1. Preparazione di cellule tumorali per iniezione
NOTA: In questo studio, è stata utilizzata la linea cellulare di cancro al seno umano, BT-474 (BT474). BT474 è stato coltivato in un terreno di coltura completo comprendente RPMI 1640 terreno integrato con il 10% di siero bovino fetale e l'1% di insulina. Le celle sono state mantenute in un incubatore a 37 ° C con il 5% di anidride carbonica nell'atmosfera dell'aria. Autenticare la linea cellulare tramite tandem satellitare ripete il test35, confermare l'espressione della proteina reporter (ad esempio, luciferasi) se presente, e verificare l'infezione da micoplasma.
- Seminare cellule tumorali BT474 ad una densità di semina di 2,0 x 106 cellule in un matraccio T75 utilizzando 10 ml di terreno di coltura e coltura di crescita completi (a 37 °C con 5% di CO2) fino al 70%-80% di confluenza prima dell'iniezione.
- Il giorno dell'iniezione, scartare i terreni di crescita e lavare il monostrato cellulare con soluzione salina tamponata fosfato (PBS) due volte.
- Aggiungere 5 mL di reagente di dissociazione per colture cellulari preriscaldato (vedere Tabella dei materiali) e incubare a 37 °C per 5 minuti o fino a quando le cellule non si sono staccate. Dopo 5 minuti, picchiettare delicatamente il pallone per favorire il distacco della cellula.
- Aggiungere 5 ml di terreno di coltura completo contenente il 10% di siero fetale bovino per estinguere l'attività del reagente di dissociazione.
- Risospendere delicatamente le cellule mediante pipettaggio per ridurre i grumi cellulari.
- Trasferire la sospensione cellulare in un tubo da 50 mL e centrifugare a 180 x g per 3 minuti a temperatura ambiente.
- Decantare il surnatante e risospendere il pellet cellulare in 10 ml di soluzione salina bilanciata di Hank (HBSS) senza calcio e magnesio per ridurre al minimo l'aggregazione cellulare.
- Centrifugare la sospensione cellulare a 180 x g per 3 minuti a temperatura ambiente.
- Decantare il surnatante per rimuovere il siero residuo/reagente di dissociazione e risospendere il pellet cellulare in 3 mL di HBSS.
- Posizionare un filtro cellulare da 100 μm su un tubo conico fresco da 50 mL e passare la sospensione cellulare per rimuovere i grumi cellulari.
NOTA: Una sospensione a singola cellula è essenziale per ridurre al minimo l'occlusione dei vasi sanguigni e il rischio di ictus durante l'iniezione. - Calcola il numero di cellule vitali utilizzando l'esclusione di Trypan Blue e un emocitometro con metodi standard.
- Diluire la sospensione cellulare con HBSS ad una concentrazione cellulare di 2,5 x 106 cellule/ml.
- Tenere il tubo orizzontale sul ghiaccio e scuotere delicatamente il tubo periodicamente per ridurre al minimo l'aggregazione. La sospensione cellulare può essere conservata su ghiaccio per un massimo di 6 ore.
NOTA: il dondolio è stato fatto manualmente, ma questo può anche essere fatto usando uno shaker a basso numero di giri.
2. Preparazione del mouse per la procedura
NOTA: In questo studio, sono stati utilizzati topi scid NOD di 4-5 settimane. Introdurre alimenti di recupero a dieta morbida (ad esempio, gel dietetico, idrogel, purè di topo) ai topi 3 giorni prima della procedura per incoraggiare l'alimentazione dopo la procedura.
- Strumenti chirurgici per autoclave. Spruzzare e pulire l'area chirurgica e l'apparecchiatura con disinfettante per superfici, seguito da etanolo al 70%.
- Posizionare un tappetino termico animale sotto la scheda chirurgica per prevenire l'ipotermia. Accendere questo 30 minuti prima dell'intervento chirurgico. Spruzzare e pulire la tavola chirurgica con disinfettante per superfici seguito da etanolo al 70%.
- Preparare una gabbia pulita per gli animali e una piastra riscaldante calda per il recupero.
- Indossare dispositivi di protezione individuale puliti (camice, maschera, retina per capelli e guanti). Mantenere la sterilità durante tutta la procedura utilizzando guanti da esame puliti e una tecnica "solo suggerimenti per strumenti".
- Anestetizzare il mouse con una camera anestetica utilizzando isoflurano al 5% con un flusso di ossigeno di 2 L/min fino a quando il mouse perde il riflesso del pedale.
- Estrarre l'animale dalla camera e metterlo in un cono nasale che eroga isoflurano al 2% con un flusso di ossigeno di 2 L/min per la procedura chirurgica rimanente.
- Mouse con pugno all'orecchio per l'identificazione e utilizzare tagliacapelli elettrici per radere la pelliccia dalla regione del collo. Pulire i peli in eccesso dalla pelle esposta usando del nastro adesivo.
- Pesare il mouse per calcolare le dosi di farmaci anestetici e analgesici richiesti. Somministrare buprenorfina e meloxicam rispettivamente a 50 μg/kg e 1 mg/kg tramite iniezione sottocutanea.
- Trasferire il mouse su una tavola chirurgica calda e fissare il cono del naso con del nastro adesivo.
- Applicare lubrificante oculare sugli occhi per prevenire l'essiccazione.
- Fissare delicatamente il mouse agganciando prima i denti incisivi superiori usando un filo fissato alla scheda chirurgica, quindi nastrando le zampe anteriori e posteriori. Questo passaggio estende il corpo e mantiene il collo dritto durante la procedura.
- Eseguire la preparazione preoperatoria della pelle come descritto di seguito.
- Pulire il collo con antisettico topico (povidone-iodio) per ridurre il carico della microflora cutanea e rimuovere i peli sciolti. Pulire dal centro della pelle, lavorando verso l'esterno per prevenire la ricontaminazione del sito di incisione. Ripetere il processo utilizzando etanolo al 70%. Eseguire tre cicli alternati di iodio ed etanolo per la disinfezione.
- Posare un drappo chirurgico sull'animale. Questo è tagliato e modellato da un pezzo di carta assorbente sterile o sacchetto per autoclave.
- Stendere asciugamani di carta sterili o sacchetti per autoclave per strumenti chirurgici.
- Verificare la presenza di riflessi tramite "Pinch test" per garantire un'anestesia sufficiente prima di continuare con la procedura.
3. Iniezione carotidea interna
NOTA: In questo esperimento, è stata utilizzata una cannula per infusione da 31 G e una configurazione del driver della siringa attivata dal piede per facilitare la procedura di iniezione (Figura supplementare 1). Questa configurazione è facoltativa e l'utente può utilizzare una siringa da insulina da 31 G e saltare i passaggi 3.11 e 3.12. Per preparare la cannula per infusione, tirare e separare la porzione dell'ago dalla porzione di montaggio della siringa di un ago da 31 G usando due paia di morsetti di sutura. Quindi, attaccare la porzione di ago a un'estremità di un tubo per infusione fine di circa 10 cm di lunghezza.
- Posizionare il microscopio da dissezione sul mouse.
- Usando le forbici, praticare un'incisione verticale di 15 mm lungo la linea mediana nella regione del collo partendo da 5 mm sotto la mascella fino all'ingresso toracico.
- Utilizzando due paia di pinze angolate, separare la pelle e le ghiandole salivari sottostanti e applicare divaricatori per mantenere esposta la trachea. Il prossimo passo esporrà la guaina carotidea che si trova parallela alla trachea.
- Utilizzando due paia di pinze ad angolo sottile, sezionare senza mezzi termini il muscolo e il tessuto adiposo adiacente alla trachea per esporre la guaina carotide destra. La guaina carotidea è lo strato fibroso che copre l'arteria carotide comune, la vena e il nervo vago, e questo fascio può essere visualizzato dall'arteria carotide comune rosso vivo. In questo studio, l'iniezione è stata eseguita sull'arteria carotide destra.
- Cancellare un segmento dell'arteria carotide comune caudale alla biforcazione carotidea della fascia circostante e separarlo dal nervo vago e dalle vene.
- Isolare e cancellare la biforcazione carotidea (la giunzione che unisce le arterie carotidi esterne e interne) dai nervi e dalla fascia circostanti. Posizionare una pinza fine sotto l'arteria carotide esterna e passare una sutura di seta (spessore 5-0) sotto l'arteria. Annodare e stringere la sutura e tagliare la linea in eccesso.
NOTA: Questa legatura (L1) impedirà all'iniezione di transitare attraverso l'arteria carotide esterna. - Posizionare una pinza fine sotto l'arteria carotide comune e passare una sutura di seta (spessore 5-0) sotto l'arteria. Legare un nodo e stringere la sutura in una posizione prossimale al sito di iniezione proposto. Tagliare la sutura in eccesso lasciando circa 10 mm di linea.
NOTA: Questa seconda legatura (L2) limiterà il flusso sanguigno e il sanguinamento dopo l'iniezione. Viene anche usato per posizionare e trattenere l'arteria carotide durante l'iniezione. - Tagliare e inumidire una striscia di tergicristalli monouso (autoclavati) (vedi Tabella dei materiali) di circa 10 mm x 5 mm. Piegare la striscia in 4 mm x 5 mm, 2-3 mm di spessore, e posizionarla sotto l'arteria carotide nel sito di iniezione proposto. Questo sosterrà la nave durante l'iniezione.
- Sul rostrale comune dell'arteria carotide al sito di iniezione proposto, posizionare una terza legatura (L3) con un nodo allentato. Questo viene stretto solo dopo l'iniezione (al punto 3.16).
- Agitare delicatamente la sospensione cellulare e aspirare 200 μL di sospensione cellulare in una siringa da insulina (con ago da 31 G).
- Caricare la siringa nel driver della siringa collegato a un pedale attivante.
- Attaccare una cannula fine con un ago da 31 G alla siringa e innescare la linea.
- Controllare se l'arteria carotide è ben posizionata e pressurizzata.
- Utilizzando due pinze ad angolo sottile, una delicatamente tesa sull'estremità della prima legatura e l'altra che tiene l'ago da 31 G, inserire lentamente l'ago con smussatura nel lume del vaso sanguigno facendo attenzione a non perforarlo.
- Iniettare lentamente 100 μL di sospensione cellulare (dal punto 1.13) nell'arteria carotide comune a 10 μL/s. Questo fornirà 2,5 x 105 cellule nel vaso sanguigno. L'iniezione di successo viene visualizzata tramite la pulizia del sangue dal vaso sanguigno carotideo.
- Sollevare delicatamente e stringere la legatura sciolta (L3) (dal punto 3.9) immediatamente dopo aver ritirato l'ago per evitare il riflusso e il sanguinamento. Tagliare la sutura in eccesso.
NOTA: È normale osservare una piccola quantità di sangue che sgorga dopo il ritiro dell'ago. Tuttavia, non ci deve essere alcun sanguinamento attivo dopo che la terza legatura è stata stretta. - Rimuovere il pezzo di tergicristalli monouso a basso contenuto di lanugine inumiditi.
- Utilizzando una pipetta P200, sciacquare la cavità chirurgica due volte con 150-200 μL di acqua sterile o soluzione salina.
- Controllare nuovamente il sanguinamento, quindi rimuovere i divaricatori.
- Riposizionare i tessuti molli, le ghiandole salivari e la pelle sopra l'arteria carotide e la trachea.
- Chiudere lo strato cutaneo dell'incisione utilizzando un supporto per ago da sutura, una pinza e una sutura monofilamento 6/0 assorbibile o non assorbibile in uno schema continuo.
- Eliminare la siringa ad ago della cannula e preparare una nuova configurazione per il mouse successivo. L'uso di una nuova siringa assicurerà che il numero di cellule iniettate in ciascun topo sia coerente.
NOTA: le istantanee rappresentative della procedura sono riportate nella figura supplementare 2. Se la nave viene perforata o strappata dall'ago, indicata dalla perdita di iniettare o sanguinamento, la procedura è considerata infruttuosa. Successivamente, l'ago deve essere ritirato e la terza legatura deve essere immediatamente serrata per evitare ulteriori sanguinamenti. Se il sanguinamento è persistente dopo il serraggio della sutura, l'animale deve essere eutanasia con pentobarbital.
4. Recupero post-iniezione
- Iniettare buprenorfina (50 μg/kg) e meloxicam (1 mg/kg) tramite iniezione sottocutanea come sollievo dal dolore post-chirurgico.
- Spostare l'animale in una gabbia calda e pulita per riprendersi dall'anestesia. È normale che un animale abbia un'attività sottomessa (rannicchiato e inattivo o che si muove lentamente) dopo il risveglio.
- Dopo 30-45 minuti, trasferire i topi in una struttura di detenzione a lungo termine.
- Fornire ai topi una dieta morbida (gel dietetico, idrogel, poltiglia) per almeno una settimana dopo l'intervento chirurgico e controllare quotidianamente lo stato fisico con particolare attenzione ai segni di ictus, infezione, sanguinamento intorno al sito della ferita.
- Due giorni dopo l'intervento, è tipico che l'animale abbia un'attività ridotta, una leggera pelliccia arruffata e abbia perso il 15% del peso corporeo preoperatorio. Somministrare analgesico (meloxicam) ogni giorno per 2-3 giorni post-intervento chirurgico per gestire il dolore e aiutare il recupero.
- Dal giorno 3 in poi, gli animali devono aver riacquistato attività, aumentato la frequenza di alimentazione e toelettatura e riacquistato peso. Eutanasia degli animali con deficit di condizione fisica persistente (dolore, rannicchiamento, inattività, perdita di peso) dopo 4 giorni dall'intervento iniettando pentobarbital di sodio a 200 mg/kg tramite iniezione intraperitoneale.
- L'attecchimento e la progressione del tumore possono essere monitorati utilizzando l'anestesia e la modalità di imaging di scelta come l'imaging bioluminescente, la risonanza magnetica o la PET / MRI. Il requisito e la capacità di effettuare tale imaging dipenderanno intrinsecamente dagli obiettivi del progetto individuale e dalla struttura all'interno della quale viene intrapresa e, a seconda del tipo di tag del reporter, delle linee cellulari utilizzate, dell'accessibilità delle pertinenti strutture di radiochimica e di imaging nucleare36,37
NOTA: Alcuni animali potrebbero non rispondere bene e sperimentare un ictus nonostante una procedura di successo. Dopo la procedura, gli animali che presentano sintomi di sofferenza neurologica (girare la testa e tirare da un lato, comportamento circolare, rotolare, colpire, perdita della funzione motoria) devono essere immediatamente eutanasiati.
Risultati
Confronto tra l'iniezione dell'arteria carotide comune con o senza legatura esterna dell'arteria carotide
Quando le cellule tumorali sono state iniettate attraverso l'arteria carotide comune senza prima legare l'arteria carotide esterna24, i tumori facciali sono stati trovati nel 77,8% dei topi trapiantati (n = 7/9 animali). Un esempio di tumore facciale è illustrato nella Figura supplementare 3. Il metodo descritto in questo protocollo previene le metastasi facciali non intenzionali legando l'arteria carotide esterna prima dell'arteria carotide comune.
Per confrontare i due metodi, la lectina è stata iniettata nell'arteria carotide comune di topi abbattuti con o senza legatura esterna dell'arteria carotide. Quindi, il tessuto facciale e il cervello sono stati fissati, elaborati e osservati al microscopio fluorescente. Una riduzione della lectina è stata osservata all'analisi di immunofluorescenza nei tessuti delle guance quando l'arteria carotide esterna era legata (Figura 2A-B). I risultati mostrano anche che la legatura esterna dell'arteria carotide non ha avuto alcun impatto sulla consegna del cervello perché la lectina può essere osservata nel tessuto cerebrale dei topi sottoposti a iniezione di arteria carotide comune con legatura esterna dell'arteria carotide (Figura 2C-D). Pertanto, questo ulteriore passaggio può dirigere la consegna delle cellule tumorali attraverso l'arteria carotide interna nel cervello con una semina minima al tessuto facciale.

Figura 2: Consegna dell'innesto intracarotideo con e senza legatura esterna dell'arteria carotidea. Imaging fluorescente del muscolo della guancia destra (A, B) e del cervello (C, D) di topi con lectina (verde) consegnata nell'arteria carotide comune, con (A, C) o senza legatura carotide esterna (B, D). La guancia e il cervello sono stati ripresi con un ingrandimento 20x e 5x e le barre della scala rappresentano rispettivamente 50 e 200 μm. I nuclei (blu) sono stati colorati con DAPI. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Monitoraggio bioluminescente
Una linea cellulare di carcinoma mammario amplificata da HER2, BT474, che è stata geneticamente modificata per esprimere la luciferasi, è stata utilizzata in questo studio per consentire il monitoraggio settimanale della progressione tumorale somministrando luciferina ed eseguendo l'imaging bioluminescente in vivo . In questo modello di metastasi cerebrali BT474, i segnali bioluminescenti possono essere osservati dalla settimana 5 dopo l'iniezione carotidea interna e progressivamente sono cresciuti di intensità nel tempo (Figura 3).
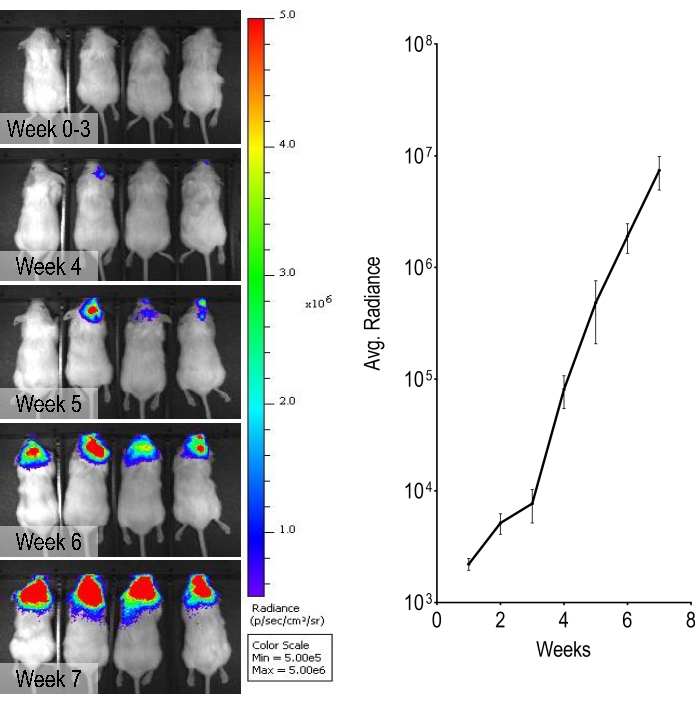
Figura 3: Monitoraggio bioluminescente e quantificazione del segnale di bioluminescenza. Immagini bioluminescenti settimanali rappresentative dalla settimana 0 alla settimana 7 che mostrano un'intensità crescente proveniente dalla testa. Il grafico mostra la quantificazione dei segnali bioluminescenti nei topi. I dati sono mezzi ± errore standard (n = 4). Fare clic qui per visualizzare una versione ingrandita di questa figura.
Risonanza magnetica (MRI)
Il modello animale di metastasi cerebrali è stato ripreso utilizzando la risonanza magnetica pesata in T2 alle settimane 2, 5 e 8 per valutare la progressione del tumore intracranico. Dalla settimana 5 alla settimana 8, può essere osservata una regione con intensità di segnale eterogenea, che indica un tumore intracranico con perfusione fluida complessa, presumibilmente da vascolarizzazione tumorale interrotta (Figura 4A). La barriera emato-encefalica nel modello di metastasi cerebrali è interrotta e assomiglia a quella delle metastasi cerebrali cliniche. Questo è stato valutato utilizzando il miglioramento del contrasto di gadolinio seguito da una sequenza MRI pesata in T1. La concentrazione di gadolinio all'interno della regione tumorale aumenta man mano che fuoriesce dalla circolazione sanguigna nel tessuto tumorale. Ciò è illustrato dalla regione oscurata che rappresenta l'accorciamento del tempo di rilassamento T1 (Figura 4B). I dati ottenuti possono essere utilizzati per correlare l'accesso ai farmaci alla permeabilità della barriera emato-encefalica. Inoltre, il volume e l'area superficiale del tumore intracranico possono essere ricavati eseguendo la segmentazione volumetrica utilizzando il software di analisi delle immagini 3D Slicer (Figura 4C). Questo può essere tracciato su un grafico contro il tempo per tracciare la crescita del tumore al cervello.

Figura 4: Caratterizzazione del modello animale di metastasi cerebrali mediante risonanza magnetica . (A) Scansioni trasversali, coronali e sagittali pesate in T2 del modello alle settimane 1, 5 e 8. Alla settimana 5, una debole area irregolare può essere vista sulla vista sagittale (freccia rossa), che è progredita in una regione iperintensa ed eterogenea entro la settimana 8. (B) Risonanza magnetica dinamica pesata con mezzo di contrasto T1 che mostra un tumore cerebrale (regione in rosso) prima e dopo l'iniezione di gadolinio con agente di potenziamento del contrasto (CE). Le regioni scure indicano la perdita e l'assorbimento del gadolinio. (C) Il tumore visualizzato sui piani coronale, trasversale e sagittale è stato annotato e segmentato utilizzando il software di analisi delle immagini 3D Slicer per derivare il volume del tumore intracranico. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Imaging PET/RM per determinare la biodistribuzione della nanomedicina
La combinazione di barriera emato-encefalica interrotta e vascolarizzazione tumorale permeabile facilita l'assorbimento passivo e l'accumulo di terapie su scala nanometrica, attraverso una maggiore permeabilità ed effetto di ritenzione36,37. Poiché il modello di metastasi cerebrali BT474 sovraesprime HER2, è stato eseguito l'assorbimento cerebrale di una nanomedicina marcata con zirconio-89 HER2 utilizzando la tomografia ad emissione di positroni / risonanza magnetica (PET / MR) (Figura 5). In una coorte di topi BM BT474, la nanomedicina rilevata all'interno della regione tumorale era superiore a quella nelle regioni cerebrali non coinvolte, confermando l'accumulo di nanomedicina nelle metastasi cerebrali.

Figura 5: Immagine rappresentativa PET/RM di nanomedicina marcata con zirconio-89 mirata a HER2 (89Zr-HER2-NM) in topi con metastasi cerebrali BT474. (A) L'immagine a sinistra raffigura la risonanza magnetica di peso T2 (vista coronale) che mostra il tumore cerebrale (regione rossa) e il cervello non coinvolto (regione blu). Le due immagini adiacenti raffigurano immagini MRI (vista coronale e trasversale) sovrapposte con sovrapposizione PET. La sovrapposizione di PET colorata mostra che la regione tumorale ha un maggiore assorbimento della nanomedicina (bianco, rosso, giallo) rispetto alle regioni non coinvolte (blu / verde). (B) Il grafico illustra l'aumento dell'intensità del segnale PET e l'assorbimento della nanomedicina (dose iniettata per grammo, ID/g) nei tumori cerebrali rispetto al cervello non coinvolto (n = 12). Fare clic qui per visualizzare una versione ingrandita di questa figura.
Sopravvivenza e stato fisico dei modelli di BM
Il modello di metastasi cerebrali BT474 è sopravvissuto a una mediana di 9 settimane dopo l'iniezione (Figura 6). Con il progredire delle metastasi cerebrali, gli animali hanno iniziato a perdere fino al 20% del peso corporeo, che ha quindi richiesto l'eutanasia (tra la settimana 6-9). Nelle metastasi cerebrali in fase avanzata, le presentazioni comuni includono pelliccia arruffata e crani sporgenti e bombati. Gli animali erano spesso inattivi, rannicchiati e mostravano deficit funzionali nelle capacità motorie e nella forza.

Figura 6: Curva di Kaplan Meier del modello murino di metastasi cerebrali BT474. La sopravvivenza mediana è stata di 9 settimane dopo l'iniezione (n = 18). Fare clic qui per visualizzare una versione ingrandita di questa figura.
Istologia
Dopo l'eutanasia, gli animali sono stati perfusi con una soluzione di paraformaldeide al 4% per preservare l'architettura istologica cerebrale40. Successivamente, il cervello e altri organi sono stati elaborati, sezionati e colorati con ematossilina ed eosina (H & E). In questo modello di metastasi cerebrale, i tumori sono stati localizzati unilateralmente, corrispondendo al lato dell'iniezione carotidea (Figura 7A). I tumori BT474 apparivano per lo più come masse solide solitarie, in alcuni casi coinvolgendo quasi la metà dell'emisfero cerebrale (Figura 7B). Sacche di spazi vuoti sono state osservate frequentemente e consistevano in cellule necrotiche (Figura 7C). Escrescenze più piccole erano presenti anche in alcuni animali (Figura 7E). La colorazione immunoistochimica mostra che le metastasi cerebrali BT474 esprimono forti HER2 e HER3, suggerendo che questo modello è adatto per terapie mirate a HER2 e HER3 (Figura 7F).

Figura 7: Istologia cerebrale del modello di metastasi cerebrale BT474. (A) Sezione cerebrale rappresentativa di un topo BM BT474; Le caselle colorate contrassegnavano le regioni di interesse allargate. Barra della scala = 2 mm. (B) Tumore solido comprendente una massa di cellule epitelioidi. (C) Cellule necrotiche all'interno di uno spazio. (D) Interfaccia tumore-cervello (E) Piccole escrescenze note come micrometastasi. (Barra della scala B-E = 200 μm). (F) Immagini immunoistochimiche che mostrano la positività a HER2 e HER3 e l'ematossilina ed eosina (H&E) corrispondenti. Barra di scala = 100 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Coinvolgimento sistemico
Non sono stati osservati tumori in sezioni di tessuto di altri organi (Figura 8). Questa scoperta concorda con i dati bioluminescenti, in cui la bioluminescenza è stata rilevata solo dalle teste degli animali. Insieme, i risultati hanno mostrato che questo modello è associato a nessun tumore sistemico rilevabile.

Figura 8: Istologia di altri organi. Non c'era alcun coinvolgimento evidente del tumore negli organi sottoposti a screening: ossa, fegato, reni, pancreas, polmone, cuore, milza, intestino e ovaio. Barra di scala = 100 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Figura supplementare 1: Cannula-siringa per iniezione interna dell'arteria carotidea. Clicca qui per scaricare questo file.
Figura supplementare 2: Istantanee del processo di iniezione dell'arteria carotide interna. La descrizione dell'immagine è fornita nella tabella supplementare 1. Clicca qui per scaricare questo file.
Figura supplementare 3: Risonanza magnetica pesata in T2 che mostra un grande tumore intramuscolare nel tessuto facciale destro (delineato in rosso). La sezione di tessuto colorata con H & E rivela cellule tumorali densamente imballate. Barra della scala = 2 mm (al centro) e 100 μm (a destra). Clicca qui per scaricare questo file.
Tabella supplementare 1: Descrizione passo-passo dell'iniezione dell'arteria carotide interna nella Figura supplementare 2. Clicca qui per scaricare questo file.
Discussione
Le metastasi cerebrali sono un processo complesso di cellule tumorali che si diffondono dal loro sito primario al cervello. Sono disponibili diversi modelli animali che rispecchiano alcune fasi di questo processo a più fasi e ci sono considerazioni fisiologiche e pratiche per la progettazione di studi preclinici sulle metastasi41,42. La maggior parte degli studi pubblicati che studiano l'uso della nanomedicina per il trattamento delle metastasi cerebrali hanno utilizzato modelli intracardiaci43,44 e intracranici 45,46,47,48,49. L'innesto di cellule tumorali attraverso l'arteria carotide può ricapitolare meglio il processo metastatico e la patobiologia delle metastasi cerebrali.
Tuttavia, per esperienza, la comune tecnica di iniezione carotidea ha portato a diversi animali che hanno presentato tumori facciali significativi nei primi punti temporali. Negli animali con entrambi i tumori cerebrali e facciali attivi, i tumori facciali sono stati osservati per crescere più rapidamente in dimensioni rispetto ai tumori cerebrali. Ciò può essere dovuto al microambiente più vascolarizzato che supporta la crescita tumorale (Figura supplementare 3).
L'arteria carotide comune fornisce sangue alla regione facciale e al cervello attraverso le arterie esterne e carotidi, rispettivamente. Quindi, in accordo con altri25, l'iniezione di cellule tumorali attraverso l'arteria carotide comune porterebbe alla semina in entrambe le regioni. È possibile prevenire i tumori facciali legando prima l'arteria carotide esterna prima della comune iniezione di arteria carotide.
Il metodo di iniezione dell'arteria carotide interna qui descritto simula le metastasi cerebrali introducendo le cellule tumorali nel vaso sanguigno primario che fornisce il cervello. Questo modello ricapitola l'alloggiamento delle cellule tumorali circolanti nel letto vascolare del cervello, consentendo la loro trasmigrazione e formazione di escrescenza cerebrale metastatica. I risultati mostrano che l'iniezione dell'arteria carotidea limita la semina del cancro ad altri organi associati a metodi come l'iniezione intracardiaca.
Esistono alcune considerazioni critiche e informazioni sulla risoluzione dei problemi per il protocollo. In primo luogo, i grumi di cellule possono occludere i vasi sanguigni intracranici e innescare un ictus. Questo può essere mitigato facendo passare la sospensione cellulare attraverso un filtro cellulare per garantire una sospensione cellulare priva di grumi. Quindi, l'iniezione di liquidi in eccesso nel cervello può provocare edema infiammatorio e ostacolare la lateralizzazione vascolare. Ciò può essere evitato utilizzando un volume di iniezione inferiore a 100 μL. L'uso di una sutura con estremità sfilacciate e la presenza di fascia o tessuto fibrograsso può impedire il ciclo di sutura intorno all'arteria carotide esterna. Si raccomanda di eliminare prima la fascia o il tessuto fibrograsso applicando un delicato movimento di pulizia lungo l'arteria con la pinza e rimuovere le estremità sfilacciate tagliando l'estremità della sutura. Infine, le linee cellulari tumorali hanno tassi di crescita unici e, quindi, è essenziale ottimizzare la concentrazione cellulare per l'iniezione. Dall'esperienza, nei modelli di metastasi cerebrali del polmone e del melanoma che hanno coinvolto rispettivamente le linee cellulari tumorali umane aggressive NCI-H1975 e A2058, sono state iniettate meno cellule (1 x 105 cellule in 100 μL) per prevenire una rapida progressione della malattia.
Il passo più impegnativo in questo protocollo è l'inserimento dell'ago nell'arteria carotide e l'iniezione di cellule. Si raccomanda di utilizzare un nuovo ago per animale per la sterilità perché l'uso di aghi smussati aumenta il rischio di perforare o strappare i vasi sanguigni. Si raccomanda inoltre di utilizzare un driver per siringa per la procedura per ridurre lo scatto iniziale di iniettare e l'ago traballante durante l'iniezione. Il driver della siringa ha anche l'ulteriore vantaggio di abbinare la velocità di iniezione alla velocità del flusso sanguigno fisiologico.
Questo protocollo non è privo di limitazioni. La procedura è tecnicamente impegnativa e c'è il rischio che gli animali soccombano all'ictus dal fallimento della lateralizzazione nonostante abbiano subito una procedura di successo. Dalla nostra esperienza, il tasso di ictus è dell'11,4% (n = 21/168 animali). Quindi, la dimensione del campione iniziale dovrebbe tenere conto di questi animali che moriranno per ictus. Poiché questo metodo trasporta le cellule tumorali direttamente verso il cervello, ha ridotto il carico tumorale sistemico e quindi non è l'ideale per studiare la diffusione sistemica.
In sintesi, il protocollo consentirà la generazione di metastasi cerebrali modello murino adatto allo screening dei farmaci e alla valutazione del profilo terapeutico dei farmaci.
Divulgazioni
Gli autori non dichiarano conflitti di interesse. I finanziatori non hanno avuto alcun ruolo nella progettazione dello studio; nella raccolta, analisi o interpretazione dei dati; nella stesura del manoscritto, o nella decisione di pubblicare l'articolo.
Riconoscimenti
Questa ricerca è stata finanziata dall'Australian National Health and Medical Research Council (NHMRC), numero di sovvenzione APP1162560. ML è stato finanziato da una borsa di studio di ricerca post-laurea UQ. Vorremmo ringraziare tutti coloro che hanno contribuito con la zootecnia e l'imaging in vivo degli animali. Ringraziamo il Royal Brisbane and Women's Hospital per aver donato aliquote di zirconio per questo studio.
Materiali
| Name | Company | Catalog Number | Comments |
| 100µm cell strainer | Corning | CLS431752 | |
| 30G Microlance needle | BD | 23748 | |
| 31G Ultra-Fine II insulin syringe | BD | 326103 | |
| Angled forceps | Proscitech | T67A-SS | Fine pointed, angled without serrations, 18mm tip, length 128 mm |
| Animal heat mat | |||
| Antibiotic and antimycotic | ThermoFisher Scientific | 15240062 | |
| Autoclave bags | |||
| BT-474 (HTB-20) breast cancer cell line | ATCC | HTB-20 | |
| Buprenorphine (TEMGESIC) | |||
| Countess cell counter | ThermoFisher Scientific | C10227 | |
| Diet-76A | ClearH2O | 72-07-5022 | |
| Dissection microscope | |||
| Ear puncher | |||
| Electric clippers | |||
| Fine angled forceps | Proscitech | DEF11063-07 | Angled 45°, Tip smooth, Tip width: 0.4 mm, Tip dimension: 0.4 x 0.3 mm, length 9cm |
| Fine tubing for cannula, Tubing OD (in) 1/32, Tubing ID (in) 1/100in | Cole Parmer | EW-06419-00 | |
| Foetal bovine serum | ThermoFisher Scientific | 26140079 | |
| Hank's Balanced Salt Solution without calcium and magnesium | ThermoFisher Scientific | 14170120 | |
| Hydrogel | ClearH2O | 70-01-5022 | |
| Isoflurane | |||
| Kimwipes Low lint disposable wipers | Kimberly Clark- Kimwipes | Z188964 | |
| Mashed mouse chow | |||
| Meloxicam (METACAM) | |||
| Nose cone | Fashioned out of a microfuge tube | ||
| PAA ocular lubricant (Carbomer 2mg/g) | Bausch and lomb | ||
| Povidone-iodine solution | Betadine | 2505692 | |
| PPE (glove, mask, gown, hairnet) | |||
| Retractors | Kent Scientific | SURGI-5001 | |
| RPMI 1640 Media | ThermoFisher Scientific | 11875093 | |
| Silk suture 13mm 5-0, P3, 45cm | Ethicon | JJ-640G | |
| Sterile normal saline | ThermoFisher Scientific | TM4469 | |
| Sticky tape | |||
| Surgical board | A chopping board wrapped with autoclavable bag. | ||
| Surgical scissors | Proscitech | T104 | Tip Dimensions (LxD): 38x7mm, Length 115mm |
| Suture forcep/ Curved Brophy forceps | Proscitech | T113C | Curved, Rounded narrow 2 mm tip, with serrations, length 165 mm |
| Suture needle holder (Olsen Hegar needle holder) | Proscitech | TC1322-180 | length 190 mm, ratchet clamp |
| Syringe driver with foot pedal/ UMP3 Ultra micro pump | World Precision Instruments | UMP3-3 | |
| T75 tissue culture flask | ThermoFisher Scientific | 156499 | |
| Thread | |||
| Trigene II surface disinfectant | Ceva | ||
| Trypan Blue and Cell Counting Chamber Slides | ThermoFisher Scientific | C10228 | |
| TrypLE Express dissociating medium | ThermoFisher Scientific | 12605010 |
Riferimenti
- Nayak, L., Lee, E. Q., Wen, P. Y. Epidemiology of brain metastases. Current Oncology Reports. 14 (1), 48-54 (2012).
- Australian Institute of Health and Welfare. Cancer in Australia. , Canberra: AIHW. (2017).
- Maher, E. A., Mietz, J., Arteaga, C. L., DePinho, R. A., Mohla, S. Brain metastasis: opportunities in basic and translational research. Cancer Research. 69 (15), 6015-6020 (2009).
- Lin, N. U. Breast cancer brain metastases: new directions in systemic therapy. Ecancermedicalscience. 7, (2013).
- Zimmer, A. S., Van Swearingen, A. E. D., Anders, C. K. HER2-positive breast cancer brain metastasis: A new and exciting landscape. Cancer Reports. 5 (4), (2020).
- Brown, P. D., et al. Postoperative stereotactic radiosurgery compared with whole brain radiotherapy for resected metastatic brain disease (NCCTG N107C/CEC·3): a multicentre, randomised, controlled, phase 3 trial. Lancet Oncology. 18 (8), 1049-1060 (2017).
- Murrell, J., Board, R. The use of systemic therapies for the treatment of brain metastases in metastatic melanoma: Opportunities and unanswered questions. Cancer Treatment Reviews. 39 (8), 833-838 (2013).
- Stemmler, H. J., et al. Ratio of trastuzumab levels in serum and cerebrospinal fluid is altered in HER2-positive breast cancer patients with brain metastases and impairment of blood-brain barrier. Anticancer Drugs. 18 (1), 23-28 (2007).
- Venur, V. A., Leone, J. P. Targeted therapies for brain metastases from breast cancer. International Journal of Molecular Sciences. 17 (9), 1543(2016).
- Murthy, R., et al. Tucatinib with capecitabine and trastuzumab in advanced HER2-positive metastatic breast cancer with and without brain metastases: a non-randomised, open-label, phase 1b study. The Lancet Oncology. 19 (7), 880-888 (2018).
- Murthy, R. K., et al. trastuzumab, and capecitabine for HER2-positive metastatic breast cancer. New England Journal of Medicine. 382 (7), 597-609 (2019).
- Shah, M., et al. FDA approval summary: Tucatinib for the treatment of patients with advanced or metastatic HER2-positive breast cancer. Clinical Cancer Research. 27 (5), 1220-1226 (2021).
- Vogelbaum, M. A., et al. Treatment for brain metastases: ASCO-SNO-ASTRO guideline. Journal of Clinical Oncology. 40 (5), 492-516 (2021).
- Ramakrishna, N., et al. Management of advanced human epidermal growth factor receptor 2-positive breast cancer and brain metastases: ASCO guideline update. Journal of Clinical Oncology. 10, (2022).
- Li, J., et al. A multifunctional polymeric nanotheranostic system delivers doxorubicin and imaging agents across the blood-brain barrier targeting brain metastases of breast cancer. ACS Nano. 8 (10), 9925-9940 (2014).
- Mittapalli, R. K., et al. Paclitaxel-hyaluronic nanoconjugates prolong overall survival in a preclinical brain metastases of breast cancer model. Molecular Cancer Therapeutics. 12 (11), 2389-2399 (2013).
- Hamilton, A. M., et al. Nanoparticles coated with the tumor-penetrating peptide iRGD reduce experimental breast cancer metastasis in the brain. Journal of Molecular Medicine. 93 (9), 991-1001 (2015).
- Patil, R., et al. MRI virtual biopsy and treatment of brain metastatic tumors with targeted nanobioconjugates: nanoclinic in the brain. ACS Nano. 9 (5), 5594-5608 (2015).
- Brighi, C., et al. MR-guided focused ultrasound increases antibody delivery to non-enhancing high-grade glioma. Neuro-Oncology Advances. 2 (1), (2020).
- Inamura, T., Black, K. L. Bradykinin selectively opens blood-tumor barrier in experimental brain tumors. Journal of Cerebral Blood Flow & Metabolism. 14 (5), 862-870 (1994).
- Priego, N., et al. Abstract 2746: Stat3 labels a subpopulation of reactive astrocytes required for brain metastasis. Cancer Research. 79, 2746(2019).
- Wyatt, E. A., Davis, M. E. Method of establishing breast cancer brain metastases affects brain uptake and efficacy of targeted, therapeutic nanoparticles. Bioengineering & Translational Medicine. 4 (1), 30-37 (2018).
- Nakayama, J., et al. The in vivo selection method in breast cancer metastasis. International Journal of Molecular Sciences. 22 (4), 1886(2021).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid cancer cell injection to produce mouse models of brain metastasis. Journal of Visualized Experiments. 120, 55085(2017).
- Liu, Z., et al. Improving orthotopic mouse models of patient-derived breast cancer brain metastases by a modified intracarotid injection method. Scientific Reports. 9 (1), 622(2019).
- Bos, P. D., et al. Genes that mediate breast cancer metastasis to the brain. Nature. 459, 1005-1009 (2009).
- Hu, X., Villodre, E. S., Woodward, W. A., Debeb, B. G. Modeling brain metastasis via tail-vein injection of inflammatory breast cancer cells. Journal of Visualized Experiments. 168, (2021).
- Cho, J. H., et al. AKT1 activation promotes development of melanoma metastases. Cell Reports. 13 (5), 898-905 (2015).
- Meuwissen, R., et al. Induction of small cell lung cancer by somatic inactivation of both Trp53 and Rb1 in a conditional mouse model. Cancer Cell. 4 (3), 181-189 (2003).
- Kato, M., et al. Transgenic mouse model for skin malignant melanoma. Oncogene. 17 (14), 1885-1888 (1998).
- Khanna, C., Hunter, K. Modeling metastasis in vivo. Carcinogenesis. 26 (3), 513-523 (2005).
- Sulaiman, A., Wang, L. Bridging the divide: preclinical research discrepancies between triple-negative breast cancer cell lines and patient tumors. Oncotarget. 8 (68), 113269-113281 (2017).
- Pierce, A. M., Keating, A. K. Creating anatomically accurate and reproducible intracranial xenografts of human brain tumors. Journal of Visualized Experiments. 91, 52017(2014).
- Geisler, J. A., et al. Modeling brain metastases through intracranial injection and magnetic resonance imaging. Journal of Visualized Experiments. 160, (2020).
- Reid, Y., Storts, D., Riss, T., Minor, L., et al. in Assay Guidance Manual. eds Markossian, S. et al.) Eli Lilly & Company and the National Center for Advancing Translational Sciences. , (2004).
- Janowicz, P. W., et al. Understanding nanomedicine treatment in an aggressive spontaneous brain cancer model at the stage of early blood brain barrier disruption. Biomaterials. , 283(2022).
- Houston, Z. H., et al. Understanding the Uptake of Nanomedicines at Different Stages of Brain Cancer Using a Modular Nanocarrier Platform and Precision Bispecific Antibodies. ACS Cent Sci. 6 (5), 727-738 (2020).
- Matsumura, Y., Maeda, H. A new concept for macromolecular therapeutics in cancer chemotherapy: mechanism of tumoritropic accumulation of proteins and the antitumor agent smancs. Cancer Research. 46, 6387-6392 (1986).
- Clemons, T. D., et al. Distinction between active and passive targeting of nanoparticles dictate their overall therapeutic efficacy. Langmuir. 34 (50), 15343-15349 (2018).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. Bio-Protocol. 11 (5), (2021).
- Masmudi-Martín, M., et al. Brain metastasis models: What should we aim to achieve better treatments. Advanced Drug Delivery Reviews. 169 (20), 79-99 (2021).
- Carney, C. P., et al. Harnessing nanomedicine for enhanced immunotherapy for breast cancer brain metastases. Drug Delivery and Translational Research. 11 (6), 2344-2370 (2021).
- Hamilton, A. M., et al. Nanoparticles coated with the tumor-penetrating peptide iRGD reduce experimental breast cancer metastasis in the brain. Journal of Molecular Medicine. 93 (9), Berlin, Germany. 991-1001 (2015).
- Bao, Y., et al. Synergistic chemotherapy for breast cancer and breast cancer brain metastases via paclitaxel-loaded oleanolic acid nanoparticles. Molecular Pharmaceutics. 17 (4), 1343-1351 (2020).
- Kotb, S., et al. Gadolinium-based nanoparticles and radiation therapy for multiple brain melanoma metastases: Proof of concept before phase I trial. Theranostics. 6 (3), 418-427 (2016).
- Zhang, T., et al. Multitargeted nanoparticles deliver synergistic drugs across the blood-brain barrier to brain metastases of triple negative breast cancer cells and tumor-associated macrophages. Advanced Healthcare Materials. 8 (18), 1900543(2019).
- He, C., et al. Blood-brain barrier-penetrating amphiphilic polymer nanoparticles deliver docetaxel for the treatment of brain metastases of triple negative breast cancer. Journal of Controlled Release. 246, 98-109 (2017).
- Wang, X., et al. Enhanced anti-brain metastasis from non-small cell lung cancer of osimertinib and doxorubicin co-delivery targeted nanocarrier. International Journal of Nanomedicine. 15, 5491-5501 (2020).
- Gries, M., et al. Multiscale selectivity and in vivo biodistribution of NRP-1-targeted theranostic AGuIX nanoparticles for PDT of glioblastoma. International Journal of Nanomedicine. 15, 8739-8758 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon