Method Article
Yetişkin Afrika Turkuaz Killifish'in Beyin Dokusundan Çekirdeklerin Nazik İzolasyonu, Yaşlanma Araştırmaları için Doğal Kısa Ömürlü Bir Model
Bu Makalede
Özet
Burada, kısa ömürlü omurgalı model Nothobranchius furzeri'nin beyinlerinden çekirdekleri izole etmek için tek çekirdekli RNA dizilimi veya dizileme ile transpozaz erişimli kromatin için tek çekirdekli tahlil (ATAC-seq) gibi aşağı akış uygulamaları için bir protokol sunuyoruz.
Özet
Omurgalı sistemlerinde tek hücreli çözünürlükte beyin yaşlanmasını incelemek, maliyet, zaman ve teknik kısıtlamalar nedeniyle zor olmaya devam etmektedir. Burada, doğal olarak kısa ömürlü omurgalı Afrika turkuaz killifish Nothobranchius furzeri'nin beyinlerinden tek çekirdekli RNA dizileme (snRNA-seq) kütüphaneleri oluşturmak için bir protokol gösteriyoruz. Afrika turkuaz killifish, 4-6 aylık bir ömre sahiptir ve uygun maliyetli bir şekilde barındırılabilir, böylece omurgalı beyin yaşlanmasını incelemek için maliyet ve zaman engellerini azaltır. Bununla birlikte, genç ve yaşlı balıkların beyninden aşağı akış tek hücreli deneyler için yeterli kalitede çekirdekleri izole etmek için özel protokollere ihtiyaç vardır. Burada, yüksek kaliteli tek çekirdekli omik kütüphanelerin oluşturulmasında kritik bir adım olan yetişkin Afrika turkuaz killifish'in beyninden yüksek kaliteli çekirdeklerin izolasyonu için ampirik olarak optimize edilmiş bir protokol gösteriyoruz. Ayrıca, kirletici arka plan RNA'sını azaltma adımlarının, hücre tiplerini açıkça ayırt etmek için önemli olduğunu gösteriyoruz. Özetle, bu protokol geleneksel olmayan omurgalı model organizmalarda beyin yaşlanmasını incelemenin fizibilitesini göstermektedir.
Giriş
Omurgalı beyin yaşlanmasının mekanizmalarını anlamak, Alzheimer ve demans 1 gibi yaşa bağlı nörodejeneratif hastalıkların ele alınmasında kritik önemesahiptir. Afrika turkuaz killifish (Nothobranchus furzeri), esaret altında yetiştirilebilecek en kısa ömürlü omurgalıdır ve kısa ömrü ve yaşa bağlı bilişsel bozukluğu nedeniyle, mükemmel bir beyin yaşlanma modelidir 2,3,4,5. Son zamanlarda, tek çekirdekli RNA-seq (snRNA-seq) ve dizileme ile transpozaz erişimli kromatin için tek çekirdek testi (snATAC-seq) gibi tek hücreli "omik" teknolojilerinin ortaya çıkması, araştırmacıların yaşlanan beyni benzeri görülmemiş bir çözünürlükte sorgulamalarına izin vermiştir 6,7,8. Bu yöntemler çekirdek izolasyonuna dayanır, çünkü nöronlar gibi beyin hücrelerinin iyileşmesi genellikle 6,7,8,9,10'u izole etmek için çok zordur. Bununla birlikte, yayınlanan çekirdek izolasyon protokollerinin çoğu, memeli model organizmalar11,12,13,14,15 için optimize edilmiştir. Bu nedenle, şu anda yaşlanma araştırması2 alanında gelecek vaat eden yeni bir model organizma olarak killifish'teki beyin çekirdeklerini izole etmek için karşılanmamış bir ihtiyaç olduğundan, bu protokolün amacı, yüksek kaliteli çekirdekleri donmuş beyin killifish dokusundan izole etmek için bir yöntem oluşturmaktır.
Burada, yüksek kaliteli çekirdekleri killifish beyinlerinden izole etmek için yaygın olarak bulunan malzemeleri kullanan akıcı ve sağlam bir iş akışı oluşturulmuştur. Bu protokol, Afrika turkuaz killifish'in düşük miyelin içerikli beyinlerine, donmuş dokunun kırılganlığına ve dizileme ile ilgili uygulamalar için ortam enkaz içeriğini azaltma ihtiyacına uyum sağlamak için fare beyinleri için 10x Genomik protokolünden değiştirildi16. Gerçekten de, memeli beyin dokusu17,18 için daha önce optimize edilmiş protokoller, dondurulmuş killifish beyinlerinde kullanıldığında düşük çekirdek kalitesine (yani aşırı liziz) ve / veya yüksek enkaz içeriğine yol açarak, mikroakışkanlar kullanan tek çekirdekli RNA-seq önerilerine göre snRNA-seq ile kullanım için uygun değildir (Ek Şekil 1).
Çekirdek izolasyonuna ek olarak, mikroskopi ve akış sitometrisi ile çekirdek kalitesinin ve veriminin nasıl değerlendirileceğini gösteriyoruz. Bu makalede, hem en iyi hem de en uygun olmayan sonuçlara örnekler sağlanmakta ve sorun giderme anlatılmaktadır. Bu protokol, dondurulmuş killifish beyinleri için tasarlanmış ve optimize edilmiştir, ancak taze disseke edilmiş killifish örneklerinde büyük değişiklikler yapılmadan da kullanılabilir. Bu yöntem kullanılarak izole edilen Killifish beyin çekirdekleri, aşağı akış uygulaması olarak tek çekirdekli RNA-seq'te (snRNA-seq) kullanım için optimize edilmiştir, ancak snATAC-seq ve bulk ATAC-seq'te kullanım için de uygun olmalıdır.
Protokol
Hayvan bakımı ve hayvan deneyleri, Güney Kaliforniya Üniversitesi IACUC uyarınca onaylanmış protokoller #21215 uyarınca gerçekleştirilmiştir. Bu protokolü kullanan herhangi bir çalışma için, omurgalı hayvanlar üzerinde herhangi bir araştırma çalışmasına başlamadan önce kurumun IACUC'sinden onay almak gerekir.
NOT: Flaşla dondurulmuş beyin dokusundan (3. adımdan başlayarak) başlayan protokol boyunca tam bir çalışma, altı örnek için ~ 2,5 saat sürmelidir (Şekil 1).
1. Killifish beyinlerini disseke edin
- Sistem suyunda 1.5 g / L metanosülfonat / trikain (MS-222) çözeltisi kullanarak killifish'i insani olarak ötenazi yapın.
- Tüm vücut ve solungaç hareketi durduktan sonra killifish'in kafasını hızla kesmek için keskin makas kullanın.
- Kafası kesilmiş kafayı daha önce tarif edildiği gibi temiz bir Petri kabı üzerinde inceleyin19.
- Çanağı diseksiyon mikroskobunun altına yerleştirin (8x-35x büyütme aralığı kullanarak). Kafayı, dallanma ışınları odakta olacak şekilde çevirin
- Makas kullanarak, daliostegal ışınları ve kafatası ortaya çıkacak şekilde dentary'yi kesin.
- Forseps kullanarak, kafatasının her iki tarafındaki daliostegal ışınları tutun. Kalan doku parçalarını kafatasından çıkarmak için başka bir çift forseps kullanın. Beyni ve gözleri birbirine bağlayan V şeklindeki optik kiazm görünür hale gelmelidir.
- Her iki gözü de beyinden ayırmak için makas kullanarak optik kiazmı kesin. Kafatasını nazikçe serbest bırakmak için forseps kullanın.
- Kafatasını ters çevirin ve kası kafatasının dorsal tarafından kazımak için forseps kullanın.
- Kafatasını yerinde tutmak için bir çift forseps ve kafatasının kemiklerini nazikçe çıkarmak için başka bir çift forseps kullanın ve beyni ortaya çıkarın.
- Beyin beyaz ve yumuşak görünür. Görünür olduktan sonra, tüm kafatası kemiklerinin çıkarılması gerekli değildir. Beyni temiz forseps ile nazikçe kaldırıp kazıyarak çıkarın.
- Flaş, beyni kuru buz üzerinde depolanan bir mikrosantrifüj tüpüne yerleştirerek dondurur.
NOT: Dondurulmuş beyin dokusu, kütüphane üretimi için işlenirken parti etkilerini sınırlamak için birlikte işlenecek tüm numuneler toplanana kadar -80 ° C'de saklanabilir. -80 ° C'de depolanan örnekler süresiz olarak saklanamazken, bu protokol, kalitede kayda değer bir düşüş olmadan 12 aya kadar saklanan killifish beyinlerinde başarıyla gerçekleştirilmiştir.
2. Taze tamponlar hazırlayın
- Çekirdek yıkama tamponu hazırlayın (1x PBS'de% 2 sığır serum albümini [BSA], fosfat tamponlu salin pH 7.4 ve 0.2 U / μL RNaz inhibitörü) ve buz üzerinde saklayın. Sekiz numuneye kadar 250 mL çekirdek yıkama tamponu hazırlayın. 250 mL için, 50 mL% 10 BSA stok çözeltisi, 25 mL 10x PBS stok çözeltisi, 40 U/μL RNaz inhibitörü stoğunun 1,25 mL'sini kullanın ve ardından RNAse-free ddH 2 O ile hacmi250mL'ye getirin.
- Çekirdek lizis tamponunu (10 mM Tris-HCl pH 7.4, 10 mM NaCl, 3 mM MgCl 2, %0.01875 v/v NP-40 ve0.2 U/μL RNaz inhibitörü) hazırlayın ve buz üzerinde saklayın. Sekiz numuneye kadar 10 mL çekirdek lizis tamponu hazırlayın. 10 mL için, 100 μL 1 M Tris-HCl pH 7.4 stok çözeltisi, 20 μL 5 M NaCl stok çözeltisi, 30 μL 1 M MgCl 2 stok çözeltisi, %10 NP-40 stok çözeltisinin 18.75 μL'si, 40 U/μL RNaz inhibitörü stoğunun 50 μL'sini kullanın ve ardından RNAse-free ddH2 O ile hacmi 10 mL'ye getirin.
3. Çekirdekleri izole edin
- Dondurulmuş numuneler kullanıyorsanız, 10 dakika boyunca buz üzerinde çözün. Yeni disseke edilmiş beyinler kullanıyorsanız, doğrudan adım 3.2'ye geçin.
NOT: Bu protokol tek beyinler üzerinde çalışabilmesine rağmen, genç balıklardan (5-6 haftalık) elde edilen daha küçük örnekler daha düşük bir verime sahip olacaktır. Balığın yaşına ve cinsiyetine bakılmaksızın iki beynin tek bir örnek olarak işlenmesiyle her zaman yeterli verim elde edilebilir (Tablo 1). Bu protokol, hem GRZ hem de ZMZ1001 suşlarından hayvanlar da dahil olmak üzere 5-26 haftalık balıklardan yüksek kaliteli çekirdekleri başarıyla izole etmiştir. Bu protokolün diğer suşlara uygulanmasında beklenen herhangi bir sorun yoktur. - Beyni 2 mL'lik bir Sıçrama homojenizatöründe 1 mL buz gibi soğuk çekirdek lizis tamponunda zıplatın. Homojenizatörü buz üzerinde tutun ve numuneyi lize ederken kabarcık oluşturmaktan kaçının. Döngü başına 180° büküm ile yaklaşık 0,5 s/aşağı vuruş ve 0,5 s/yukarı vuruş hızında sıçrama. Gevşek havaneyi kullanarak 15 vuruş boyunca veya ek vuruşlara ihtiyaç duyulursa doku/lizis tamponu karışımı homojen görünene kadar zıplayın.
NOT: Sıçrama homojenizatörleri yıkanmalı, damıtılmış su ile durulanmalı ve kullanımlar arasında standart kuru otoklav sterilizasyon döngüleri ile sterilize edilmelidir.- Her 10 vuruşta bir, 30 s ila 1 dakika, küçük molalarla 30 vuruş için sıkı havaneyi kullanarak zıplayın. Döngü başına 180° büküm ile yaklaşık 0,5 s/aşağı vuruş ve 0,5 s/yukarı vuruş hızında sıçrama. Numuneyi 2 dakika boyunca Dounce homojenizatöründe buz üzerinde bekletin.
NOT: Bu inkübasyon süresi yeterli lizis sağlar, ancak nükleer aşırı liziz gözlenirse kısaltılmalıdır.
- Her 10 vuruşta bir, 30 s ila 1 dakika, küçük molalarla 30 vuruş için sıkı havaneyi kullanarak zıplayın. Döngü başına 180° büküm ile yaklaşık 0,5 s/aşağı vuruş ve 0,5 s/yukarı vuruş hızında sıçrama. Numuneyi 2 dakika boyunca Dounce homojenizatöründe buz üzerinde bekletin.
- Numuneyi 70 μm'lik bir hücre filtresinden %5 BSA ile önceden kaplanmış 15 mL'lik konik bir tüpe süzün.
- Adım 3.3'ten itibaren yıkama tamponunu 70 μm hücre filtresi üzerine pipetleyerek numuneye 4 mL çekirdek yıkama tamponu ekleyin ve beş kez ters çevirerek nazikçe karıştırın.
NOT: Bu, filtre üzerinde sıkışmış olabilecek çekirdeklerin geri kazanılmasını sağlar ve verimi artırır. - 10 dakika boyunca 500 x g, 4 °C'de sallanan bir kova rotoru kullanarak santrifüj. Süpernatantı yavaşça bir sıvı atık haznesine dökerek atın. Numuneyi dik konuma getirin ve kalan yıkama tamponunu P1000 pipet kullanarak çıkarın.
NOT: Çekirdek peletinin, bir numunedeki iki beyinden başlarken görünür olması muhtemeldir. Bununla birlikte, genç hayvanlardan (5-6 haftalık) tek beyinleri işlerken, daha düşük bir verim beklenir, ve peletler her zaman görünmeyebilir. Bu durumda, peletin tüpün dibindeki konumu varsayılırken süpernatant dikkatlice çıkarılmalıdır. - Geniş delikli P1000 pipet ucu ile çekirdekleri 1 mL çekirdek yıkama tamponunda derhal yeniden askıya alın.
- 4 mL çekirdek yıkama tamponu ekleyerek numuneyi 5 mL'ye getirin ve beş kez ters çevirerek hafifçe karıştırın. 10 dakika boyunca 500 x g, 4 ° C'de sallanan bir kova rotoru kullanarak santrifüj yapın ve süpernatanı atın.
- Çekirdekleri geniş delikli pipet ucu ile 1 mL çekirdek yıkama tamponunda yeniden askıya alın ve bir akış sitometrisi (FACS) tüpüne aktarın.
- 300 μL döküntü giderme çözeltisi (Malzeme Tablosu) ekleyin ve karışım homojen olana kadar geniş bir delik ucu ile pipetleme yaparak iyice karıştırın.
- Adım 3.9'da hazırlanan çekirdek çözeltisinin üzerine 1 mL çekirdek yıkama tamponunu bir P1000 pipet kullanılarak ve tüpü hafif bir açıyla tutarak yavaşça yerleştirin (Ek Şekil 2). Enkaz giderme çözeltisi fraksiyonu ve çekirdek yıkama tampon fraksiyonu, doğru şekilde katmanlandırılmışsa net bir arayüz oluşturmalıdır.
- 10 dakika boyunca 3000 x g, 4 °C'de sallanan bir kova rotorunda santrifüj. P1000 pipet kullanarak üstteki iki fazı tamamen atın.
NOT: Şeffaf FACS tüpü, santrifüjlemeyi takip eden üç ayrı fazın (üst, interfaz, alt) görselleştirilmesine izin verecektir. Maksimum enkaz kaldırmayı kolaylaştırmak için, üst iki fazın çıkarılmasında muhafazakardan daha agresif olunması tavsiye edilir (yani, alt fazın az bir miktarının çıkarılması, üst fazlardan herhangi birinin taşınmasına tercih edilir; Ek Şekil 2). Ek olarak, fazlar arası katman görselleştirmek için çok ince olabilir. Bu durumda, fazlar arası katmanı içeren üst (görünür) katmanı çıkarın. Tutulan alt katman ~1 mL toplam hacim içermelidir. - Alt katmanı, %5 BSA ile önceden kaplanmış 15 mL'lik konik bir boruya aktarın.
- Konik tüpte, çekirdek yıkama tamponu ile hacmi 15 mL'ye getirin ve karıştırmak için üç kez ters çevirin.
- 10 dakika boyunca 1000 x g, 4 °C'de sallanan bir kova rotorunda santrifüj. Süpernatantı dikkatlice çıkarın.
- Geniş delikli pipet ucu kullanarak 150 μL çekirdek yıkama tamponunda derhal yeniden askıya alın.
- ~300 μL'ye ayarlanmış standart bir delikli pipet ucuna geçin. Tüm numuneyi alın ve ardından pipet ucunun ucuna 40 μm'lik bir uç filtresi takın ve numuneyi dışarı atmamaya dikkat edin.
NOT: Uçtaki filtreler, çıkış yönündeki uygulamalar için yeterli çekirdek konsantrasyonunu korumak üzere gerekli olan daha küçük hacimler elde etmek için gereklidir. Örneğin, mikroakışkanlar kullanan snRNA-seq için, optimal aralık 700-1200 çekirdek / μL18 olmasına rağmen, minimum >300 çekirdek / μL konsantrasyonu önerilir. Daha yüksek çekirdek konsantrasyonları da gerekirse kolayca seyreltilebilir. - Numuneyi filtreden düşük DNA bağlayıcı 1,5 mL mikrosantrifüj tüpüne zorla dışarı atarak numuneyi filtreleyin. Son elüsyon hacmi 120-150 μL olmalıdır.
NOT: Bazı köpüklenmeler filtrasyondan kaynaklanabilir. Bu, çekirdek kalitesini etkilemiyor gibi görünmektedir.
4. Mikroskopi ile çekirdek kalitesini değerlendirin
- Ayrı bir mikrosantrifüj tüpünde, filtrelenmiş numunenin 10 μL'sini, nazik pipetleme ile 10 μL% 0.4 tripan mavisi çözeltisi ile karıştırın. Numuneler uzun inkübasyon süresi gerektirmez ve tripan mavisi çözelti ile karıştırıldıktan hemen sonra görselleştirmeye hazırdır.
- Lekeli çekirdeklerin 10 μL'sini bir sayma odası slaytının bir odasına koyun.
NOT: Alternatif olarak, lekeli çekirdek örneğinin 10 μL'sini bir hemositometre veya mikroskopi sürgüsüne koyun ve bir kapak kayması ile örtün. - Çekirdek kalitesini ışık mikroskobu ile değerlendirin.
NOT: Daha düşük büyütmeler yalnızca çekirdekleri yakınlaştırmak için kullanılmalıdır, çünkü çekirdek kusurları yalnızca daha yüksek büyütmelerde (yani, 60x veya daha yüksek) görsel olarak görünür olacaktır. Bu adım, çekirdek hazırlamanın başarısını değerlendirmek için hızlı bir şekilde yapılabilir ve görsel incelemenin ötesinde ikincil analiz gerektirmez. Yüksek kaliteli, sağlam çekirdekler keskin bir şekilde tanımlanmış bir sınır20'ye sahip olacaktır (Şekil 2A). Düşük kaliteli çekirdekler nükleer membranları bozmuş, nükleer membranın yakınında potansiyel nükleik asit sızıntısının göstergesi olan yamalı tripan mavisi lekelenmesi ve / veya ağartma kanıtı20 (Şekil 2B). Sağlıklı çekirdeklerin çapının 10-15 μm olması beklenir.
5. Akış sitometrisi ile singlet çekirdeklerini, kalıntılarını ve çarpan oranını ölçün
NOT: Akış sitometresi yazılımının özel terminolojisi ve arayüzü, makinenin markasına bağlı olarak farklılık gösterebilir, ancak bu adımlar gerekirse diğer sistemlere kolayca uyarlanmalıdır.
- Bir FACS tüpünde, filtrelenmiş çekirdek örneğinin 10 μL'sini, 1:10 seyreltme için akış sitometrisi için önerilen tamponun 90 μL'sinde yeniden askıya alın. Bu amaçla bu çalışmada 0.22 μm filtrelenmiş sterilize PBS, pH 7.2, 2 mM EDTA ve %0.5 BSA kullanılmıştır.
NOT: Bu seyreltme çoğu çekirdek hazırlığı için işe yarasa da, daha düşük verimli bir numune (yani, seyreltilmiş numunede <30 nüklei/μL) durumunda kalite değerlendirmesi için yeterli çekirdeği örneklemek için daha düşük bir seyreltme (örneğin, 1:5) gerekebilir. - Numuneleri propidium iyodür (PI) ile 1 μg / mL'lik bir son konsantrasyonda sabitleyin. Kuluçka süresi gerekmez ve çekirdekler hemen analiz edilebilir.
NOT: Alternatif olarak, numuneleri 0,1 μg/mL DAPI nihai konsantrasyonu ile lekeleyin. DAPI'nin PI'den farklı bir floresan kanalında okunması gerektiğini unutmayın (Vioblue-A V1-A kanalı; 405 nm'de uyarma, 450/50 nm'de emisyon). - Bir akış sitometresindeki numuneleri aşağıdaki gibi analiz edin:
- Çalışma alanı ayarlama:Set up a workspace:
- Akış sitometresini Edinme modunda tutun. Dosya'ya tıklayın, ardından açılır menüden Yeni Çalışma Alanı'nı seçin. Sol paneldeki Deneme sekmesinin altında, ilgili alanlara Proje Adı ve Örnek Kimliği girin.
- Sol üst araç çubuğunda, Yeni Analiz Penceresi düğmesine (dağılım grafiği simgesi) tıklayın. Açılır menüden üç çizim (Grafik 4t) içeren kutuyu tıklayın. Ekranda üç arsa görünecektir. Sol üst araç çubuğundaki Analiz Modu düğmesine (Bir simge) tıklayın, böylece gri ve turuncu değildir.
- Analiz grafiklerini ayarlayın:
- Üç grafiğin eksenlerini, sırasıyla X ekseni ve Y ekseni olarak sıralanmış olarak aşağıdaki gibi değiştirin:
Grafik 1: X ekseni: FSC-A, Y ekseni: SSC-A
Grafik 2: X ekseni: HDR-T, Y ekseni: SSC-A
Grafik 3: X ekseni: PerCP-Vio700-A B3-A, Y ekseni: SSC-A - Eksen etiketine tıklayarak ve açılır menüden istediğiniz kanalı seçerek eksenleri değiştirin.
- Her grafiğin sağ üst köşesinin yanında görünen kare gri "i" simgesini tıklatarak grafikleri yoğunluk renk kodlu olacak şekilde ayarlayın. Solda bir düğme paneli bulunan bir Özellikler penceresi açılır. Özellikler penceresinde, Scatterplot simgesine tıklayın (panelin solundaki üstten ikinci). Tamam'a tıklayın.
NOT: PerCP-Vio700-A B3-A floresan kanalı, 488 nm'de bir uyarıma ve 650-730 nm aralığında bir emisyona karşılık gelir.
- Üç grafiğin eksenlerini, sırasıyla X ekseni ve Y ekseni olarak sıralanmış olarak aşağıdaki gibi değiştirin:
- Cihaz ayarlarını yapın:
- Sol paneldeki Kanallar sekmesini tıklayın. Tüm kanalların bir listesi sağda üç kutu ile görünecektir. B3, FSC-A ve SSC-A'yı Hlog olarak ayarlayın, sağdaki ilgili ilk kutularındaki aşağı oku tıklayın ve açılır menüden Hlog'u seçin. SSC'nin voltajını 640 V'a, FSC'yi 300 V'a ve B3'ü 480 V'a ayarlayarak bu sayıları sağdaki ilgili orta kutularına yazıp Enter tuşuna basın. Sağdaki üçüncü kutunun, yazmak için dönüşümlü olarak kullanılabilen bir geçiş olduğunu unutmayın.
- Tetikleyici üstbilgisinin altında, aşağı oku tıklatıp, soldaki açılır menüden seçip sağdaki kutuya sayıyı yazıp Enter tuşuna basarak FSC tetikleyicisini 4 ve SSC ve B3 tetikleyicisini 0 olarak ayarlayın. Sağ tarafta, yazmaya alternatif olarak kullanılabilecek bir geçiş kutusu olduğunu unutmayın.
NOT: PMT voltajlarının her bir akış sitometri makinesi için optimize edilmesi gerekir, ancak çekirdekler için tetikleyici, hücreler için tipik olarak kullanılandan daha düşük olmalıdır. Ayrıca, eksen ölçeği h-log olarak ayarlanmalıdır.
- Örnek Birim metin kutusuna 100 μL ve akış yazılımı penceresinin sol tarafındaki Alım Birimi metin kutusuna 50 μL yazın. Bu adımda çekirdeklerin lize edilmesini önlemek için Mix Sample parametresinin Mix Gentle olarak ayarlandığını doğrulayın. Akışı başlatmak için sağ alt köşedeki daire içindeki üçgene (Oynat simgesi) basın.
- Akış kalitesini doğrulama:
- Numunedeki hava kabarcıklarını veya kümeleri kontrol etmek için HDR-T'ye karşı yan saçılma alanı (SSC-A) kullanın. Bu grafiğin noktaların düzgün bir sürekliliği olduğundan emin olun. Hava kabarcıkları veya kümeleri, SSC-A'ya karşı HDR-T grafiğinde boş bölgelerle sonuçlanır.
- Kullanılan voltajların numune için doğru olduğunu doğrulamak için yan saçılma (SSC-A) ve ileri saçılma (FSC-A) grafiğini kontrol edin.
NOT: Hücrelerden farklı olarak, çekirdekler bir yan saçılma ve ileri saçılma grafiğindeki enkazdan tam olarak çözülmeyecektir. Bununla birlikte, arka planda enkaz karşılık gelen daha düşük bir olay yoğunluğu (daha soğuk renkli) ile çekirdeğe karşılık gelen arsanın ortasına doğru yüksek yoğunluklu bir olay kümesi olmalıdır.
- Çekirdek sayısını ve kalitesini analiz edin:
- Genişletilmiş bir görünüm için SSC-A ve PerCp-Vio-700A grafiğini çift tıklatın. Bir kadran kapısı seçmek için sol üst araç çubuğundaki dikey çizgilere (Quadrant) sahip düğmeyi tıklayın. Ardından, SSC-A ve PerCp-Vio-700A grafiğinde herhangi bir yeri tıklattığınızda grafiğin içinde kadranlar görünür.
- Çeyrek bölme çizgilerinde herhangi bir yeri tıklatın ve çeyrek yerleşimini değiştirmek için imleci kaydırın. Kadranları sol üst kadran en sol popülasyonu (enkaz) içerecek ve sağ üst kadran birkaç gözyaşı damlası şeklinde küme (çekirdek) içerecek şekilde yerleştirin (kapı kurulumu için Şekil 3'e ve enkaz kaldırma adımı içeren veya içermeyen hazırlıklarla tipik sonuçlar için Akış sonuçları örneklerine bakın).
- Enkaz ve çekirdek sayımları:
- Özellikler penceresini açmak için grafiğin sağ üst köşesindeki kare gri "i" simgesine tıklayın. Bölge İşlevleri sekmesine tıklayın; çizim bölgelerinin ve fonksiyonlarının listeleri görünecektir.
- Bölgeler listesinin altında, üst öğenin yanında, tüm grafiğin seçili olduğunu belirten yeşil bir onay işareti olduğundan emin olun. İşlevler listesinin altında, yeşil bir onay işareti oluşturmak için Count/μL'ye tıklayın. Tamam'a tıkladığınızda her çeyrekte bir sayım/μL metriği görünecektir.
- Ham sayıları ve yüzdeleri görüntülemek için, isterseniz Bölge İşlevleri sekmesinden Sayı ve %-T tuşlarını seçin. Sol üst ve sağ kadranlardaki sayımlar / μL, sırasıyla enkaz ve çekirdek verimine karşılık gelir.
- Singlet sayımları:
- Sağ üst çeyreğin alt kısmındaki en soldaki gözyaşı damlası şeklindeki küme singletları temsil eder. Sol üst araç çubuğundaki çokgen düğmesini (Poligon) tıklatarak bu popülasyonun etrafına çokgen bir kapı çizin.
- Tek bir kez tıklayın, çizime başlamak için fareyi kaydırın ve kapının doğrusal bir bölümünü bitirmek ve bir sonrakine başlamak için tekrar tıklayın. Kapıyı bitirmek için çift tıklayın. Kapının kenarlığını tıklatın ve kapıyı yeniden konumlandırmak için fareyi kaydırın.
- Şekli değiştirmek için kapının köşelerini tıklatın. Kapılı popülasyonun (singlet) sayımları/μL'si görünecektir. Bu, ilk seyreltme ile çekirdek hazırlığının konsantrasyonudur.
NOT: İleriye doğru saçılma alanı ile yükseklik 1:1 doğrusal ilişkisi, akan hücreler sırasında singlet hızını belirlemek için yaygın olarak kullanılır, çekirdekler için geçerli değildir ve göz ardı edilebilir.
- Seyreltilmiş çekirdek hazırlığının konsantrasyonunu ve seyreltme faktörünü kullanarak, ilk hazırlığın konsantrasyonunu geri hesaplayın (örneğin, 1:10'luk bir seyreltme için, gözlemlenen konsantrasyonu 10 ile çarpın). >300 çekirdek/μL konsantrasyonları snRNA-sek için uygundur.
- Çalışma alanı ayarlama:Set up a workspace:
Sonuçlar
Burada açıklanan killifish beyin çekirdeği izolasyon protokolü, özellikle killifish için optimize edilmiştir ve Şekil 1'de özetlenmiştir. Çekirdek ekstraksiyonuna ek olarak, protokol izole edilmiş çekirdeklerin kalitesini ve miktarını değerlendirmek için farklı yöntemleri detaylandırır. Şekil 2, ışık mikroskobu ile değerlendirilen hem sağlıklı (Şekil 2A) hem de sağlıksız (Şekil 2B) çekirdek örneklerini göstermektedir. Aşağı akış analizi için uygun sağlıklı çekirdekler (Şekil 2A), sağlam membranlara sahip singlet çekirdekler olarak bulunur. Şekil 2B'de gösterildiği gibi, bu protokolün (ve diğer çekirdek izolasyon protokollerinin) en yaygın arıza modu, hasarlı nükleer membranlarla karakterize edilen aşırı çekirdekli çekirdeklerin üretilmesidir. Bu genellikle çekirdeklerin kümelenmesine yol açar ve nükleik asitlerin yırtılmış çekirdeklerden sızması nedeniyle aşağı akış uygulamalarında arka plan sinyallerine katkıda bulunabilir. Aşırı kümelenme gözlenirse, sıçrama adımları sırasında daha nazik olmanızı ve / veya lizis tamponunda inkübasyon sürelerini azaltmanızı öneririz.
Bu protokol, izole edilmiş çekirdeklerin sayısını ölçmek ve bir numunedeki çoklu çekirdeğin göreceli oranını belirlemek için akış sitometrisini kullanır. Ek olarak, akış sitometrisi, kirletici kalıntıların, sıklıkla yırtılmış çekirdek fragmanlarının ve çekirdek örneğindeki aşağı akış tahlillerini zararlı bir şekilde etkileyebilecek diğer hücresel kalıntıların göreceli içeriğini değerlendirmek için kullanılabilir. Temsili akış verileri Şekil 3'te görülebilir. Yüksek kaliteli bir çekirdek izolasyon prosedürü şunları üretecektir: 1) küçük bir enkaz fraksiyonu ve 2) singlet'a karşı multiplet çekirdeklerin yüksek bir fraksiyonu (çekirdek fraksiyonunun >% 80'i). Nükleik asitleri boyayan PI boyamanın kullanılması, singlet çekirdeklerinin enkaz ve multiplet çekirdeklerden ayrılmasını sağlar. Şekil 3A , enkaz tarafından kontamine olmuş bir hazırlık örneğidir, oysa Şekil 3B , yüksek kaliteli bir deneyin bir örneğidir.
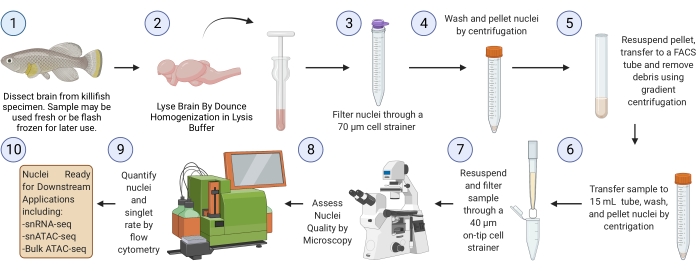
Şekil 1: Killifish beyin çekirdeği izolasyon iş akışı. Dondurulmuş veya taze killifish beyinlerinden çekirdek izolasyonu için deneysel iş akışı. İzole edildikten ve değerlendirildikten sonra, çekirdekler çeşitli aşağı akış "omik" analizleri için kullanılabilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
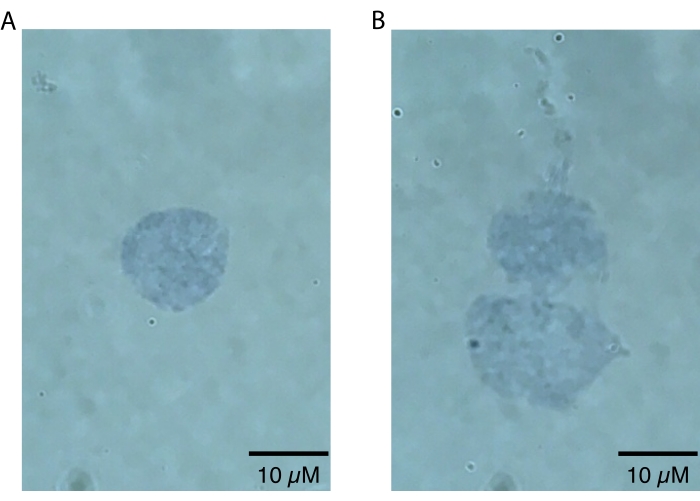
Şekil 2: Mikroskopi ile çekirdek kalitesinin değerlendirilmesi. Çekirdekler% 0.4 Tripan Mavisi çözeltisinde 1: 1 karıştırıldı ve 60x'te parlak alan görüntüleme ile bir Echo Revolve mikroskobunda görselleştirildi. (A) Yüksek kaliteli bir çekirdek örneği. Çekirdek bir singlet olarak bulunur ve nükleer membran sağlamdır. (B) Düşük kaliteli çekirdeklere bir örnek. Nükleer membranlar hasar görür ve çekirdekler, muhtemelen en üstteki çekirdeğin üstünden sızan yapışkan DNA'nın sızıntısı nedeniyle bir çifte kümelenir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
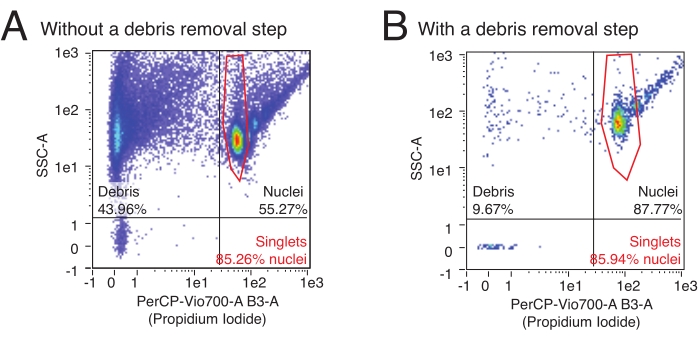
Şekil 3: Akım sitometrisi ile çekirdek nicelleştirme ve saflık değerlendirmesi. Çekirdek örnekleri PI'nin 1:100 seyreltilmesi ile boyandı ve bir akış sitometresinde çalıştırıldı. Çekirdekler, (A,B)'nin sağ üst çeyreğinde tekli ve çarpan formlarda bulunur ve en düşük olay bulutu olarak tekiller ve ardından artan sırayla çiftler, üçüzler vb. bulunur. Enkaz, en soldaki iki kadrandaki olaylarla işaretlenmiştir. (A) Enkaz kaldırma adımının atlandığı ve enkazın olayların %>40'ını oluşturduğu düşük kaliteli çekirdek hazırlığına bir örnek. (B) Dahil edilen enkaz kaldırma adımıyla birlikte yüksek kaliteli çekirdek numunesi örneği. Bu örnekte, enkaz, akış sitometresi tarafından kaydedilen tüm olayların% <10'unu oluşturur. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
| Örnek türü (2 Beyin) | Ortalama Verim (4 bağımsız hazırlık) |
| 5 Haftalık Erkek Beyinleri | 3,59 ± 1,76 x 105 |
| 10 Haftalık Erkek Beyinleri | 6,41 ± 1,33 x 105 |
| 15 Haftalık Erkek Beyinleri | 14,59 ± 2,05 x 105 |
| 5 Haftalık Kadın Beyinleri | 2,54 ± 0,75 x 105 |
| 10 Haftalık Kadın Beyinleri | 4,66 ± 1,29 x 105 |
| 15 Haftalık Kadın Beyinleri | 7,95 ± 3,51 x 105 |
Tablo 1: Afrika turkuaz killifish'in iki beyninden cinsiyet ve yaş boyunca ortalama beklenen verim. 105 çekirdek olarak ifade edilen ortalama verimler, her kategorideki dört bağımsız çekirdek preparatı üzerindeki ortalamanın standart hatasını ±.
Ek Şekil 1: Standart protokoller ve dondurulmuş killifish beyinleri üzerindeki optimize edilmiş protokolümüz kullanılarak çekirdek izolasyon kalitesinin karşılaştırılması. (A) Mikroskopi ile çekirdek kalitesi değerlendirmesi. Çekirdekler% 0.4 Tripan Mavisi çözeltisinde 1: 1 karıştırıldı ve 60x'te parlak alan görüntüleme ile mikroskopta görselleştirildi. (B) Akım sitometrisi ile çekirdekler ve enkaz yükü nicelleştirmesi. Çekirdek örnekleri PI'nin 1:100 seyreltilmesi ile boyandı ve bir akış sitometresinde çalıştırıldı. (C) Kalite değerlendirme metriklerinin mikroskopi ve akış sitometrisi ile farklı kıyaslama protokolleri ile özeti. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Şekil 2: Enkaz kaldırma adımlarının şematik gösterimi. (A) Enkaz kaldırma katmanlama ön santrifüjleme şeması. (B) Santrifüjlemeden sonra süpernatant giderim şeması. Bu Dosyayı indirmek için lütfen tıklayınız.
Tartışmalar
Burada sunulan protokol, killifish beyinlerinden yüksek kaliteli çekirdekleri yeniden üretmek için kullanılabilir. Bu protokolün killifish beyni için özel olarak tasarlanması gerekiyordu, çünkü killifish beyinlerine uygulanan tipik memeli tabanlı beyin çekirdeği izolasyon protokolleri sürekli olarak elimizde düşük çekirdek kalitesine neden oldu. Bunun, killifish beyninin memeli meslektaşlarına kıyasla daha düşük göreceli miyelin içeriğinden kaynaklandığından şüpheleniyoruz, bu da memeli beyin hücresi lizisi için gerekli olan sert koşullara yanıt olarak lize olacak ve kümelenecektir. Bu protokol, omurgalı beyin yaşlanmasının maliyet ve zaman etkin bir modelinde tek hücre düzeyinde beyin yaşlanmasının araştırılmasını kolaylaştırdığı için yaşlanma ve killifish alanlarında bir ilerlemedir.
Bu protokol taze veya dondurulmuş numuneler için sağlamdır, ancak taze veya dondurulmuş doku kullanırken aşağı akış uygulamaları dikkate alınmalıdır. Dondurulmuş doku, numuneler toplanırken aylarca toplanıp saklanabildiği için genellikle uygundur. Bu tür numuneler snRNA-seq gibi uygulamalar için güvenle kullanılabilir. Bununla birlikte, numunelerin dondurulması nükleer yapıyı ve dolayısıyla ATAC-seq21 ile kromatin manzarasını doğru bir şekilde ölçme yeteneğini bozabilir. Bu nedenle, toplu ATAC-seq veya snATAC-seq gibi aşağı akış uygulamaları için, donmuş beyinler yerine taze disseke edilmiş beyinlerin kullanılması önerilir. Ek olarak, beyin homojenizasyonundan sonraki tüm adımlar paralel olarak gerçekleştirilebildiğinden, bu protokol makul bir zaman diliminde birden fazla numunenin çalıştırılmasına uygundur, böylece buz üzerinde uzun süreli inkübasyonun neden olduğu RNA bozulmasını sınırlar.
Ayrıca, çekirdek ekstraksiyonu yapıldıktan sonra tamponların taze (saatler içinde) hazırlanması zorunludur. BSA'nın yanı sıra deterjanların da protokole başlamadan hemen önce tamponlara eklenmesi gerektiğini bulduk. Sadece tuz (PBS, NaCl, vb.) içeren tamponlar konsantre olarak yapılabilir, filtre sterilize edilebilir (0,22 μm) ve oda sıcaklığında süresiz olarak saklanabilir. BSA stok çözeltileri, çekirdek ekstraksiyonundan sonraki günler içinde (bir tozdan hazırlanmışsa) 4 ° C'de hazırlanabilir, sterilize edilebilir ve saklanabilir, ancak protokolü üstlenmeden hemen önce bu protokolde kullanılan tamponlara her zaman eklenmelidir. Ancak BSA çözümlerinin protokol gününde hazırlanmasını öneririz. Üçüncü bir taraftan önceden hazırlanmış BSA çözeltileri kullanılıyorsa, taze, açılmamış şişelerin kullanılması tavsiye edilir. Taze BSA kullanımı genellikle çekirdek hazırlıklarında daha düşük enkaz içeriğine yol açar.
Taze veya dondurulmuş numuneler girdi olarak kullanılsa da, çekirdek izolasyonunu takiben çekirdek kalitesini değerlendirmek önemlidir. Bu protokol aşırı lizi önlemek için özel olarak tasarlanmış olsa da, çekirdek kalitesi kaybının en yaygın nedeni budur. Aşırı lizis, lizis tamponunda çok fazla zaman harcanmasından, standart bir delikli pipet ucuyla aşırı pipetleme gibi çekirdeklerin aşırı kaba işlenmesinden veya çekirdek izolasyonu ile aşağı akış uygulamaları arasında (>1 saat) aşırı miktarda zaman harcanmasından kaynaklanabilir. Aşırı lize edilmiş çekirdekler genellikle DNA'yı sızdıran ve kümelenmeye neden olan hasarlı nükleer çevrelere sahip olacaktır (Şekil 2B). Bu, artan sayıda multiplete yol açacak ve aşağı akış uygulamalarına, özellikle snRNA-seq'e müdahale edecek arka plan nükleik asitlerine katkıda bulunacaktır. Her iki nitelik de çekirdek izolasyonunu takiben mikroskopi ile değerlendirilebilir. Aşırı nükleer kümelenme gözlenirse, aşırı lizis olasılığını azaltmak için lizis adımı inkübasyonunu kısaltmaya çalışmanızı öneririz. Çekirdek singlet'larını arttırmak için alternatif bir yöntem olarak, floresan destekli hücre sıralama (FACS), bu protokolün aşağı akış yönündeki tekletleri zenginleştirmek için kullanılabilir. Bununla birlikte, donmuş dokudan zaten kırılgan çekirdeklerle çalışırken, ayıklama sırasında meydana gelen kesme stresinin nükleer kopmanın artmasına ve dolayısıyla ortam RNA / DNA'sının artmasına neden olabileceğini not ediyoruz. Ek olarak, birden fazla numuneyi işlerken çekirdekler için bir FACS verim sıralaması çalıştırmak için gereken sürenin, diğer numuneler sıralanırken tüm çekirdek numunelerinin saatlerce buz üzerinde kalmasını gerektireceğini not ediyoruz. Bu nedenle, FACS yaklaşımına paralel olarak birden fazla numuneyi işlerken artan bekleme süreleri, genel olarak azalmış çekirdek kalitesine yol açabilir ve RNA bozulma riskini artırabilir. Bu nedenle, eğer FACS azaltılmış çift oran için isteniyorsa, verim sıralamasından sonra enkaz içeriğinin tekrar kontrol edilmesini ve potansiyel bir uyarı olarak tek hücreli RNA-seq uygulamaları için olası düşük RNA kalitesinin dikkate alınmasını öneririz.
Çekirdek sayılarının ve singlet oranının doğru bir tahmini, neredeyse tüm aşağı akış "omik" uygulamaları için gereklidir ve son derece önemlidir. Çekirdekleri boyutlarına göre kolayca geçit ve sayma yeteneği nedeniyle, akış sitometrisi, değerlendirdiğimiz çekirdekleri saymanın en doğru yöntemidir. Alternatif olarak, Invitrogen'in Kontes 2 FL Otomatik Hücre Sayacı veya DeNovix CellDrop Otomatik Hücre Sayacı gibi hücre sayaçlarını kullanarak çekirdekleri ölçebilir. Not etmek gerekirse, Invitrogen'in Kontes 2 FL Otomatik Hücre Sayacı ve çok daha az ölçüde DeNovix, enkazı çekirdek olarak sayarak çekirdek sayılarını abartma eğilimindedir, bu da manuel boyut geçidinin gerekli olabileceği anlamına gelir. Ayrıca, akış sitometresi, çekirdeğin saflığını kolayca değerlendirmesini sağlar. Tekli çekirdeklerin multiplet çekirdeklere karşı göreceli oranını, mikroskopi ile zor olan nicel bir şekilde ayırt edebilir. Bu, snRNA-seq ve snATAC-seq için hayati öneme sahiptir, çünkü bu protokoller, aşağı akış analizlerinin dışında tutulması gereken çoklu numune fazlalığından muzdarip olacaktır. Çokluklara ek olarak, "enkaz" ın (parçalanmış çekirdekler, hücresel enkaz) göreceli oranı, akış sitometrisi ile ölçülebilir ve nispeten düşük olmalıdır, çünkü bu malzeme genellikle bir arka plan sinyaline katkıda bulunabilecek ve tek çekirdek "omik" verilerini bozabilecek kirletici nükleik asitler içerir.
Daha önce tarif edilen çekirdek izolasyon protokollerinde olduğu gibi, orijinal dokudaki hücre tiplerinin oranları, çekirdek hazırlığı19'da sadık bir şekilde özetlenmeyebilir ve bu nedenle dikkatle yorumlanmalıdır. Tüm teleostlar gibi, Afrika turkuaz killifish, çekirdek hazırlığında da temsil edilmesi beklenen çekirdekli eritrositlere sahiptir. Bu çekirdekler, snRNA-seq ve snATAC-seq veri kümelerinde, hemoglobin genlerinin daha yüksek ekspresyonu/erişilebilirliği ile tanımlanabilir ve istenirse hesaplamalı olarak dışlanabilir.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Bazı paneller BioRender.com ile oluşturuldu. Laboratuvarımızdaki bu çalışma, B.T.'ye NIA T32 AG052374 Doktora Sonrası Eğitim Bursu, Simons Yaşlanma Beyinde Plastisite için Simons İşbirliği'nin bir parçası olarak Simons Vakfı'ndan bir hibe, Navigage Vakfı'ndan bir pilot hibe ve B.A.B.'ye Hanson-Thorell Ailesi ödülü ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.4% Trypan Blue solution | Gibco | 15250061 | |
| 10x PBS | Bioland | PBS01-03 | |
| 15 mL Conicle Centrifuge Tube | VWR | 89039-664 | |
| 2 mL Tissue Grinder | Kimble | 885300-0002 | Dounce Homogenizer |
| 5 mL Polystyrene Round-Bottom Tube | Falcon | 352054 | |
| 5M Sodium Chloride, Molecular Biology Grade | Promega | V4221 | |
| autoMACS Rinsing Solution | Miltenyi Biotec | 130-091-222 | This corresponds to 1x PBS pH 7.2, 2 mM EDTA (used for flow cytometry) |
| Debris Removal Solution | Miltenyi Biotec | 130-109-398 | |
| DNA LoBInd Tube | Eppendorf | 22431021 | |
| Echo Revolve microscope (fitted with 60x objective) | Echo | NA | No catalog number; Used to visually inspect nuclei. |
| Falcon Round-Bottom Polystyrene Tubes, 5 mL | Falcon | 352052 | FACS tube |
| FLOWMI Cell Strainers, 40 μM | SP Bel-Art | 136800040 | Referred to as on-tip filters in Protocol |
| Hydrochloric Acid | Sigma-Aldrich | 258146-500 mL | Used to lower TRIS pH from 8.0 to 7.4 |
| Leica EZ4 dissecting scope | Leica | NA | No catalog number |
| MACS BSA stock solution | Miltenyi Biotec | 130091376 | |
| MACS SmartStrainers (70 μM) | Miltenyi Biotec | 130-110-916 | |
| MACSQuant Analyzer 10 Flow Cytometer | Miltenyi Biotec | NA | No catalog number |
| Magnesium Chloride, Hexahydrate, Molecular Biology Grade (Powder) | Millipore | 442611 | |
| Megafuge 16R Centrifuge | ThermoScientific | 75003629 | |
| Micro Cover Glass | VWR | 48393081 | |
| Micro Slides Superfrost Plus | VWR | 48311-703 | |
| Nonidet P-40 Substitute | Roche | (Roche) 11332473001/ Catalog: 983739 P Code: -102368106 (Sigma Aldrich) | |
| NP-40 Surfact-Amps Detergent Solution | ThermoFisher | 85124 | |
| Nuclease-Free HyPure Molecular Biology Grade Water | HyClone | SH30538.02 | |
| NxGen RNase Inhibitor (50,000 U) | Lucigen | 30281-2 | |
| Propidium Iodide solution | MBL | FP00010020 | |
| PureBlu DAPI Nuclear Staining Dye | Biorad | 1351303 | |
| TipOne RPT Pipette Tips (Ultra low retention, filtered) in 10 µL, 20 µL, 200 µL, and 1000 µL sizes | USA Scientific | #1181-3810; #1180-1810; #1180-8810; #1182-1830 | |
| Tricaine-S (MS 222) | Syndel | Tricaine10G | Syndel is an FDA-approved provider for pharmaceutical grade Tricaine |
| TRIS, 1 M, pH 8.0 | VWR | E199-500 mL | |
| Wide Bore Pipet Tips | Axygen | T-1005-WB-C |
Referanslar
- Yankner, B. A., Lu, T., Loerch, P. The aging brain. Annual Review of Pathology. 3 (1), 41-66 (2008).
- Hu, C. K., Brunet, A. The African turquoise killifish: A research organism to study vertebrate aging and diapause. Aging Cell. 17 (3), 12757 (2018).
- McKay, A., et al. An automated feeding system for the African killifish reveals effects of dietary restriction on lifespan and allows scalable assessment of associative learning. bioRxiv. , (2021).
- Valenzano, D. R., Terzibasi, E., Cattaneo, A., Domenici, L., Cellerino, A. Temperature affects longevity and age-related locomotor and cognitive decay in the short-lived fish Nothobranchius furzeri. Aging Cell. 5 (3), 275-278 (2006).
- Vanhunsel, S., et al. The killifish visual system as an in vivo model to study brain aging and rejuvenation. NPJ Aging and Mechanisms of Disease. 7 (1), 22 (2021).
- Armand, E. J., Li, J., Xie, F., Luo, C., Mukamel, E. A. Single-cell sequencing of brain cell transcriptomes and epigenomes. Neuron. 109 (1), 11-26 (2021).
- Bakken, T. E., et al. Single-nucleus and single-cell transcriptomes compared in matched cortical cell types. PLoS One. 13 (12), 0209648 (2018).
- Ziffra, R. S., et al. Single-cell epigenomics reveals mechanisms of human cortical development. Nature. 598 (7879), 205-213 (2021).
- Grindberg, R. V., et al. RNA-sequencing from single nuclei. Proceedings of the National Academy of Sciences. 110 (49), 19802-19807 (2013).
- Kalish, B. T., et al. Single-nucleus RNA sequencing of mouse auditory cortex reveals critical period triggers and brakes. Proceedings of the National Academy of Sciences. 117 (21), 11744-11752 (2020).
- Slyper, M., et al. A single-cell and single-nucleus RNA-Seq toolbox for fresh and frozen human tumors. Nature Medicine. 26 (5), 792-802 (2020).
- Ayhan, F., Douglas, C., Lega, B. C., Konopka, G. Nuclei isolation from surgically resected human hippocampus. STAR Protocols. 2 (4), 100844 (2021).
- Gaublomme, J. T., et al. Nuclei multiplexing with barcoded antibodies for single-nucleus genomics. Nature Communications. 10 (1), 2907 (2019).
- Narayanan, A., et al. Nuclei isolation from fresh frozen brain tumors for single-nucleus RNA-seq and ATAC-seq. Journal of Visualized Experiments. (162), e61542 (2020).
- Saunders, A., et al. Molecular diversity and specializations among the cells of the adult mouse brain. Cell. 174 (4), 1015-1030 (2018).
- . Isolation of Nuclei for Single Cell RNA Sequencing & Tissues for Single Cell RNA Sequencing Available from: https://support.10xgenomics.com/permalink/1dlB6Z91VqClgUmSC2OM8k (2021)
- Martin, C., et al. Frozen tissue nuclei extraction (for 10xV3 snSEQ) V.2. protocols.io. , (2020).
- Nuclei Isolation from Adult Mouse Brain Tissue for Single Cell RNA Sequencing. 10xGenomics Available from: https://www.10xgenomics.com/support/single-cell-gene-expression/documentation/steps/sample-prep/nuclei-isolation-from-adult-mouse-brain-tissue-for-single-cell-ma-sequencing (2022)
- Denisenko, E., et al. Systematic assessment of tissue dissociation and storage biases in single-cell and single-nucleus RNA-seq workflows. Genome Biology. 21 (1), 130 (2020).
- What are the best practices for working with nuclei samples for 3' single-cell gene expression. 10xGenomics Available from: https://kb.10xgenomics.com/hc/en-us/articles/360050780051-What-are-the-best-practices-for-working-with-nuclei-samples-for-3-single-cell-gene-expression (2022)
- Rocks, D., et al. Cell type-specific chromatin accessibility analysis in the mouse and human brain. Epigenetics. 17 (2), 202-219 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır