Method Article
成体のアフリカターコイズメダカの脳組織からの核の穏やかな分離、老化研究のための自然に短命なモデル
要約
ここでは、短寿命脊椎動物モデル Nothobranchius furzeri の脳から核を単離するためのプロトコルを提示し、単核RNAシーケンシングやトランスポザーゼアクセス可能なクロマチンシーケンシング(ATAC-seq)の単核アッセイなどのダウンストリームアプリケーションを提供します。
要約
脊椎動物システムにおける単一細胞分解能での脳の老化の研究は、コスト、時間、および技術的な制約のために依然として困難です。ここでは、自然に短命の脊椎動物アフリカターコイズメダカ Nothobranchius furzeriの脳から単核RNAシーケンシング(snRNA-seq)ライブラリを生成するプロトコルを示します。アフリカターコイズメダカの寿命は4〜6か月で、費用対効果の高い方法で飼育できるため、脊椎動物の脳の老化を研究するためのコストと時間の障壁が軽減されます。ただし、下流の単一細胞実験に十分な品質の核を若齢魚と高齢魚の脳から単離するには、調整されたプロトコルが必要です。ここでは、高品質の単一核オミックライブラリの生成における重要なステップである、成体のアフリカターコイズメダカの脳から高品質の核を分離するための経験的に最適化されたプロトコルを示します。さらに、細胞型を明確に区別するためには、汚染されたバックグラウンドRNAを減らすためのステップが重要であることを示しています。要約すると、このプロトコルは、非伝統的な脊椎動物モデル生物における脳の老化を研究することの実現可能性を示しています。
概要
脊椎動物の脳の老化のメカニズムを理解することは、アルツハイマー病や認知症などの加齢に伴う神経変性疾患に対処するために重要です1。アフリカターコイズメダカ(Nothobranchus furzeri)は、飼育下で繁殖できる最短寿命の脊椎動物であり、その短い寿命と加齢に伴う認知障害のために、優れた脳老化モデルです2,3,4,5。最近、単一核RNA-seq(snRNA-seq)やトランスポザーゼアクセス可能なシーケンシング付きクロマチンの単一核アッセイ(snATAC-seq)などの単一細胞「オミクス」技術の出現により、研究者は前例のない解像度で老化した脳を調査できるようになりました6,7,8。これらの方法は、ニューロンなどの脳細胞の回収がしばしば単離するには難しすぎるため、核の分離に依存しています6,7,8,9,10。しかしながら、ほとんどの公開された核単離プロトコルは、哺乳動物モデル生物11、12、13、14、15に対して最適化されている。このように、現在、老化研究2の分野において、メダカの脳核を新進気鋭のモデル生物として単離する必要が生じており、凍結した脳メダカ組織から高品質の核を単離する方法を確立することを目標としています。
ここでは、一般的に入手可能な材料を使用してメダカの脳から高品質の核を分離する、合理化された堅牢なワークフローが確立されています。このプロトコルは、アフリカターコイズメダカのミエリン含有量の低い脳、凍結組織の脆弱性、およびシーケンシング関連のアプリケーションのための周囲の破片含有量を減らす必要性に対応するために、マウス脳用の10x Genomicsプロトコルから変更されました16。実際、哺乳類の脳組織用に以前に最適化されたプロトコル17,18は、凍結メダカの脳に使用すると、核の質の低下(すなわち、過剰溶解)および/または高い破片含有量をもたらし、マイクロフルイディクスを使用した単一核RNA-seqの推奨に従ってsnRNA-seqでの使用には適していません(補足図1)。
核の単離に加えて、顕微鏡とフローサイトメトリーによって核の品質と収量を評価する方法を示します。この記事では、最適な結果と最適でない結果の両方の例を示し、トラブルシューティングについて説明します。このプロトコルは、冷凍メダカの脳用に設計および最適化されていますが、解剖したばかりのメダカのサンプルに大きな変更を加えることなく使用することもできます。この方法を使用して単離されたメダカの脳核は、ダウンストリームアプリケーションとして単一核RNA-seq(snRNA-seq)での使用に最適化されていますが、snATAC-seqおよびバルクATAC-seqでの使用にも適しているはずです。
プロトコル
動物の世話と動物実験は、承認されたプロトコル#21215の下で南カリフォルニア大学IACUCに従って実施されました。このプロトコルを使用する作業については、脊椎動物の研究作業を開始する前に、機関のIACUCから承認を得る必要があります。
注:瞬間凍結した脳組織からプロトコルを完全に実行する(ステップ3から開始)には、6つのサンプルで~2.5時間かかります(図1)。
1.メダカの脳を解剖する
- システム水中のメタノスルホン酸/トリカイン(MS-222)の1.5 g / Lの溶液を使用してメダカを人道的に安楽死させます。
- 鋭いはさみを使用して、すべての体とえらの動きが停止した後、メダカをすばやく斬首します。
- 前述のように、斬首された頭をきれいなペトリ皿で解剖します19。
- 皿を解剖顕微鏡の下に置きます(8x〜35倍の倍率範囲を使用)。分岐ステガル光線が焦点が合うように頭を回します
- はさみを使用して、枝茎光線と頭蓋骨が見えるように歯列を切ります。
- 鉗子を使用して、頭蓋骨の両側にある枝茎光線を押し続けます。別の鉗子を使用して、頭蓋骨から残っている組織片を取り除きます。脳と目をつなぐV字型の視交叉が見えるようになるはずです。
- ハサミを使って視交叉を切り、両目を脳から切り離します。鉗子を使用して頭蓋骨をそっと解放します。
- 頭蓋骨をひっくり返し、鉗子を使用して頭蓋骨の背側から筋肉をこすります。
- 1対の鉗子を使用して頭蓋骨を所定の位置に保持し、別の鉗子を使用して頭蓋骨の骨をそっと取り除き、脳を明らかにします。
- 脳は白くて柔らかく見えます。一度見えると、すべての頭蓋骨を取り除く必要はありません。軽く持ち上げてこすることによって、きれいな鉗子で脳を取り除きます。
- ドライアイスに保管した微量遠心チューブに入れて脳を瞬間凍結します。
注:凍結した脳組織は、ライブラリ生成のために処理する際のバッチ効果を制限するために、一緒に処理されるすべてのサンプルが収集されるまで-80°Cで保存できます。-80°Cで保存されたサンプルは無期限に保存することはできませんが、このプロトコルは、最大12か月間保存されたメダカの脳に対して正常に実行されており、品質に顕著な低下はありません。
2.新しいバッファーを準備します
- 核洗浄バッファー(1x PBS中の2%ウシ血清アルブミン[BSA]、リン酸緩衝生理食塩水pH 7.4、および0.2 U/μL RNase阻害剤)を調製し、氷上に保存します。最大8サンプル用の250 mLの核洗浄バッファーを調製します。250 mLの場合、50 mLの10%BSAストック溶液、25 mLの10x PBSストック溶液、1.25 mLの40 U/μL RNase阻害剤ストックを使用し、RNAseフリーのddH2Oで容量を250 mLにします。
- 核溶解バッファー(10 mM Tris-HCl pH 7.4、10 mM NaCl、3 mM MgCl 2、0.01875% v/v NP-40、および0.2 U/μL RNase阻害剤)を調製し、氷上に保存します。最大 8 サンプル用の 10 mL の核溶解バッファーを調製します。10 mLの場合、1 M Tris-HCl pH 7.4ストック溶液100 μL、5 M NaClストック溶液20 μL、1 M MgCl 2ストック溶液30 μL、10%NP-40ストック溶液18.75 μL、40 U/μL RNase阻害剤ストック50 μLを使用し、RNAseフリーddH2 Oで容量を10 mLにします。
3.核を分離する
- 凍結サンプルを使用する場合は、氷上で10分間解凍します。解剖したばかりの脳を使用する場合は、ステップ3.2に直接進んでください
注:このプロトコルは単一の脳で機能しますが、若い魚(5〜6週齢)からの小さなサンプルは収量が低くなります。魚の年齢や性別に関係なく、2つの脳を1つのサンプルとして処理することで、常に十分な収量を得ることができます(表1)。このプロトコルは、GRZおよびZMZ1001株の両方の動物を含む、5〜26週齢の魚から高品質の核を単離することに成功しました。このプロトコルを他の株に適用しても問題は予想されません。 - 2 mLのダウンスホモジナイザーで1 mLの氷冷核溶解バッファーで脳をダウンスします。ホモジナイザーを氷の上に保ち、サンプルを溶解している間に気泡が発生しないようにしてください。サイクルあたり180°のひねりで、約0.5秒/ダウンストロークと0.5秒/アップストロークの速度でダウンします。緩い乳棒を15ストローク使用するか、追加のストロークが必要な場合は組織/溶解バッファー混合物が均一に見えるまでダウンスします。
注意: ダウンスホモジナイザーは、洗浄し、蒸留水ですすぎ、使用の合間に標準的な乾式オートクレーブ滅菌サイクルで滅菌する必要があります。- タイトな乳棒を使用して、30ストロークごとに10秒から1分、小さな休憩を取って10ストロークします。サイクルあたり180°のひねりで、約0.5秒/ダウンストロークと0.5秒/アップストロークの速度でダウンします。サンプルをDounceホモジナイザーの氷上で2分間休ませます。
注:このインキュベーション時間は適切な溶解を保証しますが、核の過剰溶解が観察された場合は短縮する必要があります。
- タイトな乳棒を使用して、30ストロークごとに10秒から1分、小さな休憩を取って10ストロークします。サイクルあたり180°のひねりで、約0.5秒/ダウンストロークと0.5秒/アップストロークの速度でダウンします。サンプルをDounceホモジナイザーの氷上で2分間休ませます。
- サンプルを70 μmのセルフィルターを通して、5% BSAでプレコートされた15 mLのコニカルチューブに入れます。
- ステップ3.3の70 μmセルフィルター上で洗浄バッファーをピペッティングして、4 mLの核洗浄バッファーをサンプルに加え、転倒して5回穏やかに混合します。
注:これにより、フィルターに閉じ込められている可能性のある核を回収でき、収量が向上します。 - スイングバケットローターを使用して、500 x g、4°C、10分間遠心分離します。廃液容器にそっと注いで上清を捨てます。サンプルを直立位置に戻し、P1000ピペットを使用して残りの洗浄バッファーを除去します。
注:核ペレットは、1つのサンプルで2つの脳から開始するときに見える可能性があります。しかしながら、若い動物(5〜6週齢)からの単一の脳を処理する場合、より低い収量が予想され、そしてペレットが常に見えるとは限らない。この場合、上清は、チューブの底部でのペレットの位置を想定しながら慎重に除去する必要があります。 - すぐに、広口径P1000ピペットチップを備えた1 mLの核洗浄バッファーに核を再懸濁します。
- 4 mLの核洗浄バッファーを加えてサンプルを5 mLにし、転倒によって5回穏やかに混合します。スイングバケットローターを用いて500 x g、4°C、10分間遠心分離し、上清を廃棄した。
- ワイドボアピペットチップを備えた1 mLの核洗浄バッファーに核を再懸濁し、フローサイトメトリー(FACS)チューブに移します。
- 300 μLの破片除去溶液(材料表)を加え、混合物が均一になるまでワイドボアチップでピペッティングして完全に混合します。
- P1000ピペットを使用して、ステップ3.9で調製した核溶液の上に1 mLの核洗浄バッファーを静かに重ね、チューブをわずかな角度で保持します(補足図2)。デブリ除去液画分と核洗浄バッファー画分は、正しく層状化されていれば明確な界面を形成するはずです。
- スイングバケットローターで3000 x g、4°C、10分間遠心分離します。P1000ピペットを使用して、上部の2つのフェーズを完全に廃棄します。
注:透明なFACSチューブは、遠心分離後の3つの異なる相(上、間相、下)の視覚化を可能にします。最大限の破片除去を容易にするために、上位2つのフェーズの除去において保守的よりも積極的にすることをお勧めします(つまり、上部のフェーズのいずれかを持ち越すよりも少量のボトムフェーズを除去することが望ましいです。 補足図2)。さらに、間相層が薄すぎて視覚化できない場合があります。この場合、間相層を含む一番上の(見かけの)層を削除します。保持される最下層には、~1 mLの総容量が含まれている必要があります。 - 最下層を5%BSAでプレコートされた15 mLコニカルチューブに移します。
- コニカルチューブで、核洗浄バッファーで容量を15 mLにし、3回反転させて混合します。
- スイングバケットローターで1000 x g、4°C、10分間遠心分離します。上清を慎重に取り除きます。
- ワイドボアピペットチップを使用して、150 μLの核洗浄バッファーに直ちに再懸濁します。
- ~300 μLに設定された標準ボアピペットチップに切り替えます。 サンプル全体を取り込み、サンプルが排出されないように注意しながら、ピペットチップの端に40 μmのオンチップフィルターを取り付けます。
注:オンチップフィルターは、ダウンストリームアプリケーションに十分な核濃度を維持するために必要な、より小さなボリュームを得るために必要です。例えば、マイクロフルイディクスを用いたsnRNA-seqの場合、>300核/μLの最小濃度が推奨されますが、最適な範囲は700-1200核/μLです18。高濃度の核も、必要に応じて簡単に希釈できます。 - サンプルをフィルターを通して低DNA結合1.5 mLマイクロ遠心チューブに強制的に排出することにより、サンプルをろ過します。最終溶出量は120〜150μLです。
注意: ろ過により、泡立ちが生じる場合があります。これは核の質に影響を与えないようです。
4. 顕微鏡による原子核の品質評価
- 別のマイクロ遠心チューブで、穏やかなピペッティングにより、ろ過したサンプル10 μLを0.4%トリパンブルー溶液10 μLと混合します。サンプルはインキュベーション時間を延長する必要がなく、トリパンブルー溶液と混合した直後に可視化することができます。
- 染色された核10μLを計数チャンバースライドのチャンバーに堆積させます。
注:または、染色した核サンプル10 μLを血球計算盤または顕微鏡スライドに塗布し、カバースリップで覆います。 - 光学顕微鏡で核の品質を評価します。
注意: 核の欠陥は高倍率(つまり、60倍以上)でのみ視覚的にわかるため、低倍率は核を拡大するためにのみ使用する必要があります。このステップは、核調製の成功を評価するために迅速に行うことができ、目視検査以外の二次分析は必要ありません。高品質で無傷の核は、はっきりと定義された境界20 を有するであろう(図2A)。質の悪い核は、核膜を破壊し、核膜近くの斑状のトリパンブルー染色が潜在的な核酸漏出を示す、および/またはブレブの証拠を示します20 (図2B)。健康な核は直径10〜15μmと予想されています。
5. フローサイトメトリーによる一重項核、デブリ、マルチプレット比率の定量
注:フローサイトメーターソフトウェアの特定の用語とインターフェースは、マシンのブランドによって異なる場合がありますが、これらの手順は、必要に応じて他のシステムに簡単に適合させる必要があります。
- FACSチューブで、ろ過した核サンプル10 μLをフローサイトメトリーに推奨される90 μLのバッファーに再懸濁し、1:10に希釈します。この目的のために、0.22 μmのろ過滅菌PBS、pH 7.2、2 mM EDTAおよび0.5%BSAがこの研究で使用されます。
注:この希釈はほとんどの核調製で機能しますが、収量の低いサンプルの場合(つまり、希釈サンプルでは<30核/ μL)、品質評価に十分な核をサンプリングするには、より低い希釈(1:5など)が必要になる場合があります。 - ヨウ化プロピジウム(PI)で最終濃度1 μg/mLでサンプルを染色します。インキュベーション時間は不要で、核をすぐに分析できます。
注:または、最終濃度0.1 μg/mL DAPIでサンプルを染色します。DAPIはPIとは異なる蛍光チャンネル(Vioblue-A V1-Aチャンネル;405 nmでの励起、450/50 nmでの発光)で読み取る必要があることに注意してください。 - フローサイトメーターでサンプルを次のように分析します。
- ワークスペースを設定します。
- フローサイトメーターを取得モードにします。[ ファイル]をクリックし、ドロップダウンメニューから[ 新しいワークスペース ]を選択します。左側のパネルの [実験 ] タブで、 プロジェクトの名前 と サンプル ID をそれぞれのフィールドに入力します。
- 左上のツールバーで、[ 新しい分析ウィンドウ ]ボタン(散布図アイコン)をクリックします。ポップアップメニューから3つのプロット(プロット4t)のボックスをクリックします。3つのプロットが画面に表示されます。左上のツールバーの[ 分析モード ]ボタン(アイコン)をクリックして、オレンジ色ではなく灰色にします。
- 分析プロットを設定します。
- 3つのプロットの軸を次のように変更し、それぞれX軸とY軸の順に並べます。
プロット1: X軸: FSC-A, Y軸: SSC-A
プロット 2: X 軸: HDR-T, Y 軸: SSC-A
プロット 3: X 軸: PerCP-Vio700-A B3-A, Y 軸: SSC-A - 軸を変更するには、 軸ラベル をクリックし、ドロップダウン メニューから目的のチャネルを選択します。
- 各プロットの右上隅の横に表示される四角い灰色の「i」アイコンをクリックして、プロットを密度色分けするように設定します。 [プロパティ ] ウィンドウが開き、左側にボタンのパネルが表示されます。 [プロパティ ]ウィンドウで、 散布図 アイコン(パネルの左側の上から2番目)をクリックします。 OKをクリックします。
注:PerCP-Vio700-A B3-A蛍光チャネルは、488 nmでの励起と650-730 nmの範囲の発光に対応します。
- 3つのプロットの軸を次のように変更し、それぞれX軸とY軸の順に並べます。
- 機器設定のセットアップ:
- 左側のパネルの[チャンネル]タブをクリックします。すべてのチャンネルのリストが右側に3つのボックスで表示されます。B3、FSC-A、およびSSC-AをHlogに設定するには、右側のそれぞれの最初のボックスの下向き矢印をクリックし、ドロップダウンメニューから[Hlog]を選択します。SSCの電圧を640 V、FSCを300 V、B3を480 Vに設定し、右側のそれぞれの中央のボックスにこれらの数値を入力し、Enterキーを押します。右側の 3 番目のボックスは、入力に交互に使用できるトグルです。
- [トリガー] ヘッダーで、下矢印をクリックし、左側のドロップダウン メニューから選択し、右側のボックスに数値を入力して Enter キーを押して、FSC トリガーを 4 に設定し、SSC トリガーと B3 トリガーを 0 に設定します。右側には、入力の代わりに使用できるトグルボックスがあることに注意してください。
注:PMT電圧は、特定のフローサイトメトリーマシンごとに最適化する必要がありますが、核のトリガーは、細胞に通常使用されるものよりも低くなければなりません。さらに、軸スケールはh-logに設定する必要があります。
- フローソフトウェアウィンドウの左側にある テキストボックスに 100 μL、テキストボックスの 取り込み量 に50 μLと入力します。このステップで核が溶解しないように、[ サンプルを 混合]パラメータが [穏やかに混合 ]に設定されていることを確認します。右下隅の円(再生 アイコン)内の三角形を押して、フローを開始します。
- フロー品質を確認します。
- 側方散乱面積(SSC-A)とHDR-Tを使用して、サンプル内の気泡や塊をチェックします。このプロットが点の滑らかな連続体であることを確認します。気泡または塊は、SSC-A対HDR-Tプロットに空白領域になります。
- 側方散乱(SSC-A)対前方散乱(FSC-A)のプロットをチェックして、使用されている電圧がサンプルに対して正しいことを確認します。
注:細胞とは異なり、核は側方散乱対前方散乱プロットの破片から完全には解決されません。ただし、プロットの中央に向かって、核に対応する高密度のイベントクラスター(暖かい色)があり、背景にはデブリに対応するイベントの密度が低い(より冷たい色)必要があります。
- 核数と品質の解析:
- 拡大ビューの SSC-A 対 PerCp-Vio-700Aプロット をダブルクリックします。左上のツールバーの垂直線(象限)の付いたボタンをクリックして、象限ゲートを選択します。次に、 SSC-A対PerCp-Vio-700Aプロット の任意の場所をクリックすると、プロット内に象限が表示されます。
- 象限の分割線上の任意の場所をクリックし、カーソルをスライドして象限の配置を変更します。左上の象限に左端の人口(デブリ)が含まれ、右上の象限にいくつかの涙滴状のクラスター(核)が含まれるように象限を配置します(デブリ除去ステップを含む、または含まない準備の典型的な結果については、ゲートのセットアップとフロー結果の例については 図3 を参照してください)。
- 破片対原子核数:
- プロットの右上隅にある四角い灰色の「i」アイコンをクリックして、 プロパティ ウィンドウを開きます。 [領域関数 ]タブをクリックします。プロット領域と関数のリストが表示されます。
- [領域]リストで、一番上の項目の横に緑色のチェックマークが表示され、プロット全体が選択されていることを示します。関数リストで、カウント/μLをクリックして緑色のチェックマークを生成します。OKをクリックすると、カウント/μLメトリックが各象限に表示されます。
- 生のカウントとパーセンテージを表示するには、必要に応じて [領域関数] タブから [カウント] と [%-T] を選択します。左上象限と右象限のカウント/μLは、それぞれデブリと原子核の収量に対応しています。
- シングレットカウント:
- 右上の象限の下部にある左端の涙滴状のクラスターはシングレットを表します。この人口の周囲にポリゴンゲートを描画するには、左上のツールバーのポリゴンボタン(ポリゴン)をクリックします。
- 1 回クリックし、マウスをスライドさせて描画を開始し、もう一度クリックしてゲートの線形セグメントを終了し、次のセグメントを開始します。ダブルクリックしてゲートを終了します。ゲートの境界をクリックし、マウスをスライドさせてゲートの位置を変更します。
- ゲートの頂点をクリックして、形状を変更します。ゲート付き母集団(シングレット)のカウント/μLが表示されます。これは、初期希釈による核調製の濃度です。
注:細胞を流動させるときに一重項率を決定するために一般的に使用される前方散乱面積と高さ1:1の線形関係は、核には適用されず、無視できます。
- 希釈した核分取の濃度と希釈係数を使用して、初期分取の濃度を逆算します(たとえば、1:10の希釈の場合、観測濃度に10を掛けます)。>300核/μLからの濃度はsnRNA-seqに適しています。
- ワークスペースを設定します。
結果
ここで説明するメダカの脳核分離プロトコルは、メダカのために特別に最適化されており、図1に要約されています。核抽出に加えて、プロトコルは単離された核の質と量を評価するためのさまざまな方法を詳述しています。図2は、光学顕微鏡によって評価された健康な核(図2A)と不健康な(図2B)核の両方の例を示しています。下流分析に適した健康な核(図2A)は、無傷の膜を有する一重項核として存在する。図2Bに示すように、このプロトコル(および他の核分離プロトコル)の最も一般的な障害モードは、損傷した核膜を特徴とする過剰核の生成です。これはしばしば核の凝集につながり、破裂した核からの核酸の漏れにより、ダウンストリームアプリケーションのバックグラウンドシグナルに寄与する可能性があります。過剰な凝集が観察された場合は、ダウンスステップ中は穏やかに、および/または溶解バッファーでのインキュベーション時間を短縮することをお勧めします。
このプロトコルでは、フローサイトメトリーを使用して単離核の数を定量化し、サンプル中の多重項核の相対的な割合を決定します。さらに、フローサイトメトリーを使用して、汚染された破片、しばしば破裂した核断片、および核サンプルの下流アッセイに悪影響を与える可能性のあるその他の細胞破片の相対的な含有量を評価することができます。代表的なフローデータを 図3に示します。高品質の核分離手順により、1)小さな破片画分、および2)一重項核と多重項核の割合が高い(核画分の>80%)が生成されます。核酸を染色するPI染色を使用すると、一重項核を破片や多重項核から分離することができます。図 3A は破片で汚染された準備の例であり、 図3B は高品質の実験の例です。
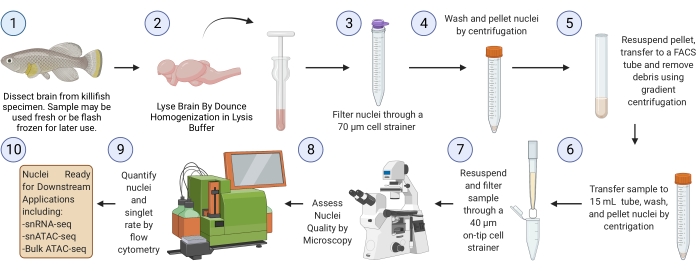
図1:メダカの脳核分離ワークフロー。 凍結または新鮮なメダカの脳からの核分離のための実験ワークフロー。単離して評価すると、核はさまざまな下流の「オミクス」分析に使用できます。 この図の拡大版を表示するには、ここをクリックしてください。
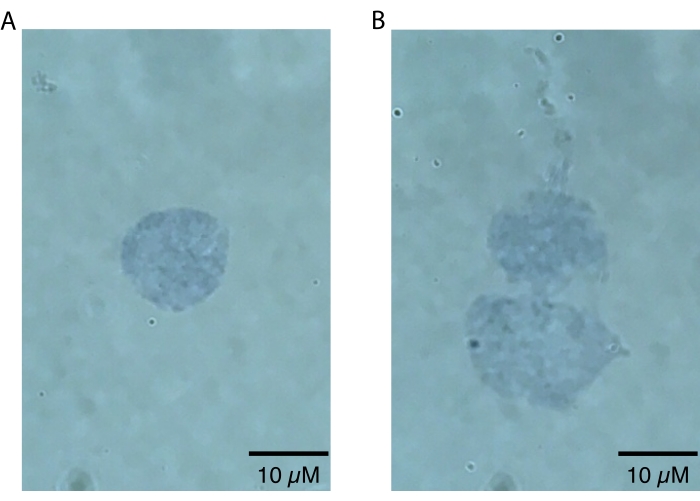
図2:顕微鏡による原子核の品質評価。 核を0.4%トリパンブルーの溶液中で1:1で混合し、エコー回転顕微鏡上で60倍の明視野イメージングによって可視化した。 (A)高品質の核の例。核は一重項として存在し、核膜は無傷です。(B)質の悪い原子核の例。核膜が損傷し、核がダブレットに凝集しているのが、これはおそらく最上部の核の上部から漏れているのが見られる粘着性DNAの漏れが原因です。 この図の拡大版を表示するには、ここをクリックしてください。
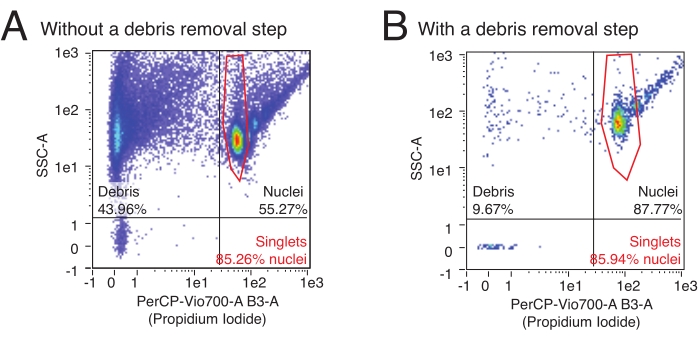
図3:フローサイトメトリーによる核定量と純度評価。 核サンプルを1:100希釈のPIで染色し、フローサイトメーターで実行しました。核は(A,B)の右上の象限に一重項と多重項の形で存在し、一重項がイベントの最低の雲であり、その後にダブレット、トリプレットなどが昇順で続きます。破片は、左端の2つの象限のイベントによってマークされます。(A)デブリ除去ステップが省略され、デブリがイベントの>40%を占める低品質の原子核調製の例。(B)デブリ除去工程を含む高品質の核試料の一例。この例では、破片はフローサイトメーターによって登録されたすべてのイベントの<10%を占めています。 この図の拡大版を表示するには、ここをクリックしてください。
| サンプルタイプ(2脳) | 平均収量(4つの独立した準備) |
| 5週間の男性の脳 | 3.59 ± 1.76×105 |
| 10週間の男性の脳 | 6.41 ± 1.33×105 |
| 15週間の男性の脳 | 14.59 ± 2.05×105 |
| 5週間の女性の脳 | 2.54 ± 0.75×105 |
| 10週間の女性の脳 | 4.66 ± 1.29×105 |
| 15週間の女性の脳 | 7.95 ± 3.51×105 |
表1:アフリカターコイズメダカの2つの脳からの性別と年齢にわたる平均期待収量。 平均収率は、各カテゴリーにおける4つの独立した核調製物にわたる平均の標準誤差±105 核として表した。
補足図1:凍結メダカの脳に対する標準プロトコルと最適化されたプロトコルを使用した核分離品質の比較。 (A)顕微鏡による核品質評価。核を0.4%トリパンブルーの溶液中で1:1で混合し、60倍の明視野イメージングによって顕微鏡上で視覚化した。 (B)フローサイトメトリーによる核および破片負荷の定量化。核サンプルを1:100希釈のPIで染色し、フローサイトメーターで実行しました。(C)異なるベンチマークプロトコルを使用した顕微鏡およびフローサイトメトリーによる品質評価指標の要約。 このファイルをダウンロードするには、ここをクリックしてください。
補足図2:がれき除去ステップの概略図。 (A)遠心分離前のデブリ除去層化のスキーム。(B)遠心分離後の上清除去のスキーム。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
ここで紹介するプロトコルは、メダカの脳から高品質の核を再現性よく生成するために使用できます。このプロトコルは、メダカの脳に適用される典型的な哺乳類ベースの脳核分離プロトコルが一貫して私たちの手の核の質を低下させるため、メダカの脳用に特別に設計する必要がありました。これは、哺乳類の脳細胞溶解に必要な過酷な条件に応じて溶解して凝集するメダカの脳の相対的なミエリン含有量が哺乳類のメダカと比較して低いためであると思われます。このプロトコルは、脊椎動物の脳老化の費用効果と時間効率の高いモデルで、単一細胞レベルでの脳老化の調査を容易にするため、老化およびメダカの分野の進歩です。
このプロトコルは、新鮮なサンプルや凍結したサンプルに対して堅牢ですが、新鮮な組織や凍結した組織を使用する場合は、下流のアプリケーションを考慮する必要があります。凍結組織は、サンプルが収集されている間、数ヶ月間収集および保存できるため、多くの場合便利です。このようなサンプルは、snRNA-seqなどのアプリケーションに安全に使用できます。しかし、凍結するサンプルは核構造を破壊する可能性があり、したがってATAC-seq21によってクロマチンランドスケープを正確に測定する能力。したがって、バルクATAC-seqやsnATAC-seqなどのダウンストリームアプリケーションでは、凍結した脳の代わりに新たに解剖した脳を使用することをお勧めします。さらに、脳のホモジナイゼーション後のすべてのステップを並行して実行できるため、このプロトコルは妥当な時間枠で複数のサンプルを実行するのに適しているため、氷上での長時間のインキュベーションによって引き起こされるRNA分解を制限します。
さらに、核抽出を行ってから新鮮な(数時間以内に)バッファーを調製することが不可欠です。界面活性剤とBSAは、プロトコルを開始する 直前に バッファーに添加する必要があることがわかりました。塩(PBS、NaClなど)のみを含むバッファーを濃縮液として作成し、フィルター滅菌(0.22 μm)し、室温で無期限に保存することができます。BSAストック溶液は、核抽出から数日以内に調製、滅菌、および4°Cで保存することができますが(粉末から調製する場合)、プロトコルを実施する直前に、このプロトコルで使用されるバッファーに必ず追加する必要があります。ただし、プロトコル当日にBSAソリューションを準備することをお勧めします。サードパーティの既製のBSAソリューションを使用する場合は、新鮮な未開封のボトルを使用することをお勧めします。新鮮なBSAを使用すると、一般的に核調製中の破片含有量が低くなります。
新鮮なサンプルと凍結サンプルのどちらを投入として使用する場合でも、核分離後の核品質を評価することが重要です。このプロトコルは過剰溶解を避けるために特別に設計されていますが、これが核の品質低下の最も一般的な原因です。過剰溶解は、溶解バッファーに費やされた時間が長すぎる、標準ボアピペットチップでの過度のピペッティングなどの核の過度に乱暴な取り扱い、または核の分離と下流アプリケーションの間に費やされる過度の時間(>1時間)に起因する可能性があります。過剰に溶解した核は、しばしば核周辺を損傷し、DNAを漏らして凝集を引き起こします(図2B)。これにより、マルチプレットの数が増加し、ダウンストリームアプリケーション、特にsnRNA-seqを妨害するバックグラウンド核酸に寄与します。両方の品質は、核分離後の顕微鏡検査によって評価することができます。過剰な核凝集が観察された場合は、過剰溶解の可能性を減らすために、溶解ステップのインキュベーションを短くすることをお勧めします。核一重項を増加させるための代替方法として、蛍光支援セルソーティング(FACS)を使用して、このプロトコルの下流の一重項を濃縮することができます。ただし、凍結組織からすでに壊れやすい核を扱う場合、選別中に発生するせん断応力により、核破裂が増加し、周囲のRNA/DNAが増加する可能性があることに注意してください。さらに、複数のサンプルを処理する場合、核のFACS収率選別を実行するのに必要な時間は、他のサンプルが選別されている間、すべての核サンプルが何時間も氷上に留まる必要があることに注意してください。したがって、FACSアプローチで複数のサンプルを並行して処理する場合の待ち時間の増加も、全体的な核品質の低下につながり、RNA分解のリスクを高める可能性があります。したがって、ダブレット率の低下のためにFACSが必要な場合は、収量選別後にデブリ含有量を再度チェックし、潜在的な警告としてシングルセルRNA-seqアプリケーションでRNA品質の低下の可能性を考慮することをお勧めします。
核数と一重項比率の正確な推定は、ほぼすべてのダウンストリーム「オミクス」アプリケーションにとって不可欠であり、最も重要です。サイズによって核を簡単にゲートしてカウントできるため、フローサイトメトリーは、私たちが評価した核をカウントする最も正確な方法です。あるいは、InvitrogenのCountess 2 FL自動セルカウンターやDeNovix CellDrop自動セルカウンターなどのセルカウンターを使用して核を定量することもできます。Invitrogen の Countess 2 FL 自動セルカウンター、および程度ははるかに低いものの DeNovix は、デブリを核として数えることで核数を過大評価する傾向があり、手動のサイズゲーティングが必要になる可能性があることに注意してください。さらに、フローサイトメーターを使用すると、核の純度を簡単に評価できます。一重項核と多重項核の相対的な比率は、顕微鏡では困難な定量的な方法で識別できます。snRNA-seqおよびsnATAC-seqは、これらのプロトコルがマルチプレットサンプルの過剰に悩まされ、ダウンストリーム分析から除外する必要があるため、これは不可欠です。マルチプレットに加えて、「デブリ」(断片化された核、細胞デブリ)の相対的な割合はフローサイトメトリーで定量することができ、この材料にはバックグラウンドシグナルに寄与し、単一の核「オミクス」データを破壊する可能性のある汚染核酸が含まれていることが多いため、比較的低くなければなりません。
前述の核分離プロトコルと同様に、元の組織における細胞型の割合は、核調製19において忠実に再現されない可能性があるため、慎重に解釈されるべきである。すべての硬骨魚と同様に、アフリカターコイズメダカには有核赤血球があり、これも核準備で表されると予想されます。これらの核は、ヘモグロビン遺伝子のより高い発現/アクセス可能性によってsnRNA-seqおよびsnATAC-seqデータセットで同定することができ、必要に応じて計算上除外することができる。
開示事項
著者は開示するものは何もありません。
謝辞
一部のパネルは BioRender.com で生成されました。私たちの研究室でのこの研究は、NIA T32 AG052374ポスドクトレーニング助成金、老化脳の可塑性のためのサイモンズコラボレーションの一環としてのサイモンズ財団からの助成金、ナビゲーション財団からのパイロット助成金、およびB.A.B.へのハンソン-ソレルファミリー賞によってサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| 0.4% Trypan Blue solution | Gibco | 15250061 | |
| 10x PBS | Bioland | PBS01-03 | |
| 15 mL Conicle Centrifuge Tube | VWR | 89039-664 | |
| 2 mL Tissue Grinder | Kimble | 885300-0002 | Dounce Homogenizer |
| 5 mL Polystyrene Round-Bottom Tube | Falcon | 352054 | |
| 5M Sodium Chloride, Molecular Biology Grade | Promega | V4221 | |
| autoMACS Rinsing Solution | Miltenyi Biotec | 130-091-222 | This corresponds to 1x PBS pH 7.2, 2 mM EDTA (used for flow cytometry) |
| Debris Removal Solution | Miltenyi Biotec | 130-109-398 | |
| DNA LoBInd Tube | Eppendorf | 22431021 | |
| Echo Revolve microscope (fitted with 60x objective) | Echo | NA | No catalog number; Used to visually inspect nuclei. |
| Falcon Round-Bottom Polystyrene Tubes, 5 mL | Falcon | 352052 | FACS tube |
| FLOWMI Cell Strainers, 40 μM | SP Bel-Art | 136800040 | Referred to as on-tip filters in Protocol |
| Hydrochloric Acid | Sigma-Aldrich | 258146-500 mL | Used to lower TRIS pH from 8.0 to 7.4 |
| Leica EZ4 dissecting scope | Leica | NA | No catalog number |
| MACS BSA stock solution | Miltenyi Biotec | 130091376 | |
| MACS SmartStrainers (70 μM) | Miltenyi Biotec | 130-110-916 | |
| MACSQuant Analyzer 10 Flow Cytometer | Miltenyi Biotec | NA | No catalog number |
| Magnesium Chloride, Hexahydrate, Molecular Biology Grade (Powder) | Millipore | 442611 | |
| Megafuge 16R Centrifuge | ThermoScientific | 75003629 | |
| Micro Cover Glass | VWR | 48393081 | |
| Micro Slides Superfrost Plus | VWR | 48311-703 | |
| Nonidet P-40 Substitute | Roche | (Roche) 11332473001/ Catalog: 983739 P Code: -102368106 (Sigma Aldrich) | |
| NP-40 Surfact-Amps Detergent Solution | ThermoFisher | 85124 | |
| Nuclease-Free HyPure Molecular Biology Grade Water | HyClone | SH30538.02 | |
| NxGen RNase Inhibitor (50,000 U) | Lucigen | 30281-2 | |
| Propidium Iodide solution | MBL | FP00010020 | |
| PureBlu DAPI Nuclear Staining Dye | Biorad | 1351303 | |
| TipOne RPT Pipette Tips (Ultra low retention, filtered) in 10 µL, 20 µL, 200 µL, and 1000 µL sizes | USA Scientific | #1181-3810; #1180-1810; #1180-8810; #1182-1830 | |
| Tricaine-S (MS 222) | Syndel | Tricaine10G | Syndel is an FDA-approved provider for pharmaceutical grade Tricaine |
| TRIS, 1 M, pH 8.0 | VWR | E199-500 mL | |
| Wide Bore Pipet Tips | Axygen | T-1005-WB-C |
参考文献
- Yankner, B. A., Lu, T., Loerch, P. The aging brain. Annual Review of Pathology. 3 (1), 41-66 (2008).
- Hu, C. K., Brunet, A. The African turquoise killifish: A research organism to study vertebrate aging and diapause. Aging Cell. 17 (3), 12757 (2018).
- McKay, A., et al. An automated feeding system for the African killifish reveals effects of dietary restriction on lifespan and allows scalable assessment of associative learning. bioRxiv. , (2021).
- Valenzano, D. R., Terzibasi, E., Cattaneo, A., Domenici, L., Cellerino, A. Temperature affects longevity and age-related locomotor and cognitive decay in the short-lived fish Nothobranchius furzeri. Aging Cell. 5 (3), 275-278 (2006).
- Vanhunsel, S., et al. The killifish visual system as an in vivo model to study brain aging and rejuvenation. NPJ Aging and Mechanisms of Disease. 7 (1), 22 (2021).
- Armand, E. J., Li, J., Xie, F., Luo, C., Mukamel, E. A. Single-cell sequencing of brain cell transcriptomes and epigenomes. Neuron. 109 (1), 11-26 (2021).
- Bakken, T. E., et al. Single-nucleus and single-cell transcriptomes compared in matched cortical cell types. PLoS One. 13 (12), 0209648 (2018).
- Ziffra, R. S., et al. Single-cell epigenomics reveals mechanisms of human cortical development. Nature. 598 (7879), 205-213 (2021).
- Grindberg, R. V., et al. RNA-sequencing from single nuclei. Proceedings of the National Academy of Sciences. 110 (49), 19802-19807 (2013).
- Kalish, B. T., et al. Single-nucleus RNA sequencing of mouse auditory cortex reveals critical period triggers and brakes. Proceedings of the National Academy of Sciences. 117 (21), 11744-11752 (2020).
- Slyper, M., et al. A single-cell and single-nucleus RNA-Seq toolbox for fresh and frozen human tumors. Nature Medicine. 26 (5), 792-802 (2020).
- Ayhan, F., Douglas, C., Lega, B. C., Konopka, G. Nuclei isolation from surgically resected human hippocampus. STAR Protocols. 2 (4), 100844 (2021).
- Gaublomme, J. T., et al. Nuclei multiplexing with barcoded antibodies for single-nucleus genomics. Nature Communications. 10 (1), 2907 (2019).
- Narayanan, A., et al. Nuclei isolation from fresh frozen brain tumors for single-nucleus RNA-seq and ATAC-seq. Journal of Visualized Experiments. (162), e61542 (2020).
- Saunders, A., et al. Molecular diversity and specializations among the cells of the adult mouse brain. Cell. 174 (4), 1015-1030 (2018).
- . Isolation of Nuclei for Single Cell RNA Sequencing & Tissues for Single Cell RNA Sequencing Available from: https://support.10xgenomics.com/permalink/1dlB6Z91VqClgUmSC2OM8k (2021)
- Martin, C., et al. Frozen tissue nuclei extraction (for 10xV3 snSEQ) V.2. protocols.io. , (2020).
- Nuclei Isolation from Adult Mouse Brain Tissue for Single Cell RNA Sequencing. 10xGenomics Available from: https://www.10xgenomics.com/support/single-cell-gene-expression/documentation/steps/sample-prep/nuclei-isolation-from-adult-mouse-brain-tissue-for-single-cell-ma-sequencing (2022)
- Denisenko, E., et al. Systematic assessment of tissue dissociation and storage biases in single-cell and single-nucleus RNA-seq workflows. Genome Biology. 21 (1), 130 (2020).
- What are the best practices for working with nuclei samples for 3' single-cell gene expression. 10xGenomics Available from: https://kb.10xgenomics.com/hc/en-us/articles/360050780051-What-are-the-best-practices-for-working-with-nuclei-samples-for-3-single-cell-gene-expression (2022)
- Rocks, D., et al. Cell type-specific chromatin accessibility analysis in the mouse and human brain. Epigenetics. 17 (2), 202-219 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved