Method Article
عزل لطيف للنوى من أنسجة المخ لسمك كيليفيش الفيروزي الأفريقي البالغ ، وهو نموذج قصير العمر بشكل طبيعي لأبحاث الشيخوخة
In This Article
Summary
نقدم هنا بروتوكولا لعزل النوى من أدمغة نموذج الفقاريات قصير العمر Nothobranchius furzeri للتطبيقات النهائية مثل تسلسل الحمض النووي الريبي أحادي النواة أو مقايسة النواة الواحدة للكروماتين الذي يمكن الوصول إليه بواسطة transposase مع التسلسل (ATAC-seq).
Abstract
لا تزال دراسة شيخوخة الدماغ بدقة الخلية الواحدة في أنظمة الفقاريات صعبة بسبب التكلفة والوقت والقيود التقنية. هنا ، نوضح بروتوكولا لإنشاء مكتبات تسلسل الحمض النووي الريبي أحادي النواة (snRNA-seq) من أدمغة الفقاريات الأفريقية الفيروزية ذات العمر القصير بشكل طبيعي Nothobranchius furzeri. يبلغ عمر سمك الكيلي الفيروزي الأفريقي 4-6 أشهر ويمكن إيواؤه بطريقة فعالة من حيث التكلفة ، وبالتالي تقليل حواجز التكلفة والوقت لدراسة شيخوخة دماغ الفقاريات. ومع ذلك ، هناك حاجة إلى بروتوكولات مصممة خصيصا لعزل النوى ذات الجودة الكافية لتجارب الخلية الواحدة في اتجاه مجرى النهر من دماغ الأسماك الصغيرة والمسنين. هنا ، نعرض بروتوكولا محسنا تجريبيا لعزل النوى عالية الجودة من دماغ سمك كيليفيش الفيروزي الأفريقي البالغ ، وهي خطوة حاسمة في توليد مكتبات أوميك أحادية النوى عالية الجودة. علاوة على ذلك ، نوضح أن خطوات تقليل تلوث الحمض النووي الريبي في الخلفية مهمة للتمييز بوضوح بين أنواع الخلايا. باختصار ، يوضح هذا البروتوكول جدوى دراسة شيخوخة الدماغ في الكائنات الحية النموذجية غير التقليدية.
Introduction
يعد فهم آليات شيخوخة دماغ الفقاريات أمرا بالغ الأهمية لمعالجة الأمراض التنكسية العصبية المرتبطة بالعمر مثل مرض الزهايمر والخرف1. كيليفيش الفيروز الأفريقي (Nothobranchus furzeri) هو أقصر الفقاريات عمرا التي يمكن تربيتها في الأسر ، وبسبب عمرها القصير وضعف الإدراك المرتبط بالعمر ، فهي نموذج ممتاز لشيخوخة الدماغ2،3،4،5. في الآونة الأخيرة ، سمح ظهور تقنيات "omics" أحادية الخلية ، مثل النواة المفردة RNA-seq (snRNA-seq) ومقايسة النوى المفردة للكروماتين الذي يمكن الوصول إليه بواسطة transposase مع التسلسل (snATAC-seq) ، للباحثين باستجواب الدماغ المسن بدقة غير مسبوقة6،7،8. تعتمد هذه الطرق على عزل النوى ، نظرا لأن استعادة خلايا الدماغ مثل الخلايا العصبية غالبا ما يكون صعبا للغاية لعزل6،7،8،9،10. ومع ذلك ، تم تحسين معظم بروتوكولات عزل النوى المنشورة للكائنات النموذجية للثدييات11،12،13،14،15. وبالتالي ، نظرا لوجود حاجة غير ملباة حاليا لعزل نوى الدماغ في killifish ككائن نموذجي جديد قادم في مجال أبحاث الشيخوخة2 ، فإن الهدف من هذا البروتوكول هو إنشاء طريقة لعزل النوى عالية الجودة من أنسجة killifish المخية المجمدة.
هنا ، يتم إنشاء سير عمل مبسط وقوي يستخدم المواد المتاحة بشكل شائع لعزل النوى عالية الجودة من أدمغة killifish. تم تعديل هذا البروتوكول من بروتوكول 10x Genomics لأدمغة الفئران لاستيعاب أدمغة محتوى المايلين المنخفض لسمك الكيلي الفيروزي الأفريقي ، وهشاشة الأنسجة المجمدة ، والحاجة إلى تقليل محتوى الحطام المحيط للتطبيقات المتعلقة بالتسلسل16. في الواقع ، تؤدي البروتوكولات المحسنة سابقا لأنسجة دماغ الثدييات17,18 إلى جودة رديئة للنوى (أي الإفراط في التحلل) و / أو محتوى حطام مرتفع عند استخدامها على أدمغة أسماك الكيلي المجمدة ، مما يجعلها غير مناسبة للاستخدام مع snRNA-seq وفقا لتوصيات النوى المفردة RNA-seq باستخدام الموائع الدقيقة (الشكل التكميلي 1).
بالإضافة إلى عزل النوى ، نوضح كيفية تقييم جودة النوى والعائد عن طريق الفحص المجهري وقياس التدفق الخلوي. توفر هذه المقالة أمثلة على كل من النتائج المثلى ودون المثلى وتناقش استكشاف الأخطاء وإصلاحها. تم تصميم هذا البروتوكول وتحسينه لأدمغة سمك الكيلي المجمدة ولكن يمكن استخدامه أيضا دون تعديلات كبيرة على عينات سمك الكيلي التي تم تشريحها حديثا. تم تحسين نوى دماغ Killifish المعزولة باستخدام هذه الطريقة للاستخدام في نواة واحدة RNA-seq (snRNA-seq) كتطبيق نهائي ، ولكن يجب أيضا أن تكون قابلة للاستخدام في snATAC-seq و ATAC-seq السائبة.
Protocol
تم إجراء رعاية الحيوانات والتجارب على الحيوانات وفقا لجامعة جنوب كاليفورنيا IACUC بموجب البروتوكولات المعتمدة # 21215. لأي عمل يستخدم هذا البروتوكول ، من الضروري الحصول على موافقة من IACUC للمؤسسة قبل البدء في أي عمل بحثي على الحيوانات الفقارية.
ملاحظة: يجب أن يستغرق التشغيل الكامل من خلال البروتوكول بدءا من أنسجة المخ المجمدة (بدءا من الخطوة 3) ~ 2.5 ساعة لست عينات (الشكل 1).
1. تشريح أدمغة كيليفيش
- القتل الرحيم إنسانيا killifish باستخدام محلول 1.5 جم / لتر من ميثانوسلفونات / تريكايين (MS-222) في مياه النظام.
- استخدم مقصا حادا لقطع رأس سمك الكيلي بسرعة بعد توقف حركة الجسم والخياشيم.
- تشريح الرأس مقطوع الرأس على طبق بتري نظيف كما هو موضح سابقا19.
- ضع الطبق تحت مجهر تشريح (باستخدام نطاق تكبير 8x-35x). أدر الرأس بحيث تكون الأشعة الفرعية في بؤرة التركيز
- باستخدام مقص ، وقطع من خلال الأسنان بحيث يتم الكشف عن أشعة branchiostegal والجمجمة.
- باستخدام الملقط، اضغط باستمرار على الأشعة المتفرعة على جانبي الجمجمة. استخدم زوجا آخر من الملقط لإزالة أي شظايا الأنسجة المتبقية من الجمجمة. يجب أن يصبح chiasm البصري على شكل حرف V الذي يربط الدماغ والعينين مرئيا.
- قطع chiasm البصرية باستخدام مقص لفصل كلتا العينين عن الدماغ. استخدم الملقط لتحرير الجمجمة برفق.
- اقلب الجمجمة واستخدم الملقط لكشط العضلات من الجانب الظهري للجمجمة.
- استخدم زوجا من الملقط لتثبيت الجمجمة في مكانها وزوجا آخر من الملقط لإزالة عظام الجمجمة برفق ، وكشف الدماغ.
- يبدو الدماغ أبيض وناعم. بمجرد ظهورها ، لا يلزم إزالة جميع عظام الجمجمة. إزالة الدماغ مع ملقط نظيف عن طريق رفع بلطف وكشط.
- قم بتجميد الدماغ عن طريق وضعه في أنبوب طرد مركزي دقيق مخزن على ثلج جاف.
ملاحظة: يمكن تخزين أنسجة المخ المجمدة عند -80 درجة مئوية حتى يتم جمع جميع العينات المراد معالجتها معا للحد من تأثيرات الدفعات عند المعالجة لإنشاء المكتبة. في حين أن العينات المخزنة في -80 درجة مئوية لا يمكن تخزينها إلى أجل غير مسمى ، فقد تم إجراء هذا البروتوكول بنجاح على أدمغة killifish المخزنة لمدة تصل إلى 12 شهرا دون انخفاض ملحوظ في الجودة.
2. تحضير مخازن جديدة
- تحضير المحلول المؤقت لغسل النوى (2٪ ألبومين مصل بقري [BSA] في 1x PBS ، درجة حموضة ملحية مخزنة بالفوسفات 7.4 ، و 0.2 وحدة / ميكرولتر مثبط RNase) وتخزينها على الثلج. قم بإعداد 250 مل من محلول غسيل النوى لما يصل إلى ثماني عينات. بالنسبة إلى 250 مل ، استخدم 50 مل من محلول مخزون BSA بنسبة 10٪ ، و 25 مل من محلول مخزون PBS 10x ، و 1.25 مل من مخزون مثبط RNase 40 وحدة / ميكرولتر ، ثم ارفع الحجم إلى 250 مل باستخدام ddH2O الخالي من الحمض النووي الريبي.
- تحضير محلول تحلل النوى (10 mM Tris-HCl pH 7.4 ، 10 mM NaCl ، 3 mM MgCl 2 ، 0.01875٪ v / v NP-40 ، و0.2 U / μL RNase مثبط) وتخزينها على الثلج. تحضير 10 مل من محلول تحلل النوى لما يصل إلى ثماني عينات. بالنسبة إلى 10 مل ، استخدم 100 ميكرولتر من محلول مخزون 1 M Tris-HCl pH 7.4 ، و 20 ميكرولتر من محلول مخزون 5 M NaCl ، و 30 ميكرولتر من محلول مخزون 1 M MgCl 2 ، و 18.75 ميكرولتر من محلول مخزون NP-40 بنسبة 10٪ ، و 50 ميكرولتر من مخزون مثبط RNase 40 U / μL ، ثم ارفع الحجم إلى 10 مل باستخدام ddH2O الخالي من الحمض النووي الريبي.
3. عزل النوى
- في حالة استخدام عينات مجمدة ، قم بإذابتها على الثلج لمدة 10 دقائق. إذا كنت تستخدم أدمغة تم تشريحها حديثا ، فانتقل مباشرة إلى الخطوة 3.2
ملاحظة: على الرغم من أن هذا البروتوكول يمكن أن يعمل على أدمغة واحدة ، إلا أن العينات الأصغر من الأسماك الصغيرة (5-6 أسابيع) سيكون لها عائد أقل. يمكن دائما الحصول على غلات كافية عن طريق معالجة دماغين كعينة واحدة ، بغض النظر عن عمر الأسماك وجنسها (الجدول 1). نجح هذا البروتوكول في عزل نوى عالية الجودة من الأسماك التي تتراوح أعمارها بين 5 و 26 أسبوعا ، بما في ذلك الحيوانات من سلالات GRZ و ZMZ1001. لا توجد مشاكل متوقعة في تطبيق هذا البروتوكول على سلالات أخرى. - قم بتدسيس الدماغ في 1 مل من محلول تحلل النوى الباردة في خالط Dounce سعة 2 مل. احتفظ بالخالط على الجليد وتجنب توليد الفقاعات أثناء تحلل العينة. ارتد بمعدل تقريبي قدره 0.5 ثانية / ضربة لأسفل و 0.5 ثانية / ضربة أعلى مع لف 180 درجة لكل دورة. ارتد باستخدام المدقة السائبة لمدة 15 ضربة ، أو حتى يبدو خليط عازلة الأنسجة / التحلل متجانسا إذا كانت هناك حاجة إلى ضربات إضافية.
ملاحظة: يجب غسل المجانسات Dounce وشطفها بالماء المقطر وتعقيمها بدورات تعقيم الأوتوكلاف الجافة القياسية بين الاستخدامات.- انقض باستخدام المدقة الضيقة لمدة 30 ضربة مع فترات راحة صغيرة ، من 30 ثانية إلى 1 دقيقة ، كل 10 ضربات. ارتد بمعدل تقريبي قدره 0.5 ثانية / ضربة لأسفل و 0.5 ثانية / ضربة أعلى مع لف 180 درجة لكل دورة. دع العينة ترتاح على الثلج في الخالط Dounce لمدة 2 دقيقة.
ملاحظة: يضمن وقت الحضانة هذا التحلل الكافي ولكن يجب تقصيره إذا لوحظ فرط التحلل النووي.
- انقض باستخدام المدقة الضيقة لمدة 30 ضربة مع فترات راحة صغيرة ، من 30 ثانية إلى 1 دقيقة ، كل 10 ضربات. ارتد بمعدل تقريبي قدره 0.5 ثانية / ضربة لأسفل و 0.5 ثانية / ضربة أعلى مع لف 180 درجة لكل دورة. دع العينة ترتاح على الثلج في الخالط Dounce لمدة 2 دقيقة.
- صفي العينة من خلال مرشح خلية 70 ميكرومتر في أنبوب مخروطي سعة 15 مل مطلي مسبقا بنسبة 5٪ BSA.
- أضف 4 مل من محلول غسيل النوى إلى العينة عن طريق سحب المخزن المؤقت للغسيل فوق مرشح الخلية 70 ميكرومتر من الخطوة 3.3 واخلطه برفق عن طريق الانعكاس خمس مرات.
ملاحظة: هذا يسمح باستعادة النوى التي قد تكون محاصرة على المرشح ويحسن العائد. - جهاز طرد مركزي باستخدام دوار دلو متأرجح عند 500 × جم ، 4 درجات مئوية ، لمدة 10 دقائق. تخلص من المادة الطافية عن طريق سكبها برفق في وعاء النفايات السائلة. أعد العينة إلى وضع رأسي وقم بإزالة المخزن المؤقت المتبقي للغسيل باستخدام ماصة P1000.
ملاحظة: من المحتمل أن تكون حبيبات النوى مرئية عند البدء من دماغين في عينة واحدة. ومع ذلك ، عند معالجة أدمغة واحدة من الحيوانات الصغيرة (5-6 أسابيع) ، من المتوقع انخفاض العائد ، وقد لا تكون الكريات مرئية دائما. في هذه الحالة ، يجب إزالة المادة الطافية بعناية أثناء افتراض موضع الحبيبات في أسفل الأنبوب. - أعد تعليق النوى على الفور في 1 مل من المخزن المؤقت لغسل النوى بطرف ماصة P1000 واسع التجويف.
- احضر العينة إلى 5 مل بإضافة 4 مل من محلول غسيل النوى واخلطها برفق عن طريق الانقلاب خمس مرات. جهاز طرد مركزي باستخدام دوار دلو متأرجح عند 500 × جم ، 4 درجات مئوية ، لمدة 10 دقائق ، وتخلص من المادة الطافية.
- أعد تعليق النوى في 1 مل من المخزن المؤقت لغسل النوى بطرف ماصة عريض التجويف وانقله إلى أنبوب قياس التدفق الخلوي (FACS).
- أضف 300 ميكرولتر من محلول إزالة الحطام (جدول المواد) واخلطه جيدا عن طريق السحب بطرف تجويف عريض حتى يصبح الخليط متجانسا.
- قم بتراكب 1 مل من المخزن المؤقت لغسل النوى برفق أعلى محلول النوى المحضر في الخطوة 3.9 باستخدام ماصة P1000 مع الاستمرار في الأنبوب بزاوية طفيفة (الشكل التكميلي 2). يجب أن يشكل جزء محلول إزالة الحطام وجزء المخزن المؤقت لغسل النوى واجهة واضحة إذا تم وضع طبقات بشكل صحيح.
- جهاز طرد مركزي في دوار دلو متأرجح عند 3000 × جم ، 4 درجات مئوية ، لمدة 10 دقائق. تخلص تماما من المرحلتين العلويتين باستخدام ماصة P1000.
ملاحظة: سيسمح أنبوب FACS الشفاف بتصور المراحل الثلاث المتميزة بعد الطرد المركزي (أعلى ، بين الطور ، أسفل). ولتيسير إزالة الحطام إلى أقصى حد، ينصح بأن تكون أكثر جرأة من التحفظ في إزالة المرحلتين العلويتين (أي أن إزالة كمية صغيرة من المرحلة السفلية أفضل من ترحيل أي من المراحل العليا؛ الشكل التكميلي 2). بالإضافة إلى ذلك ، قد تكون طبقة الطور البيني رقيقة جدا بحيث لا يمكن تصورها. في هذه الحالة ، قم بإزالة الطبقة العلوية (الظاهرة) ، التي تحتوي على طبقة الطور البيني. يجب أن تحتوي الطبقة السفلية المحتفظ بها على ~ 1 مل من الحجم الإجمالي. - انقل الطبقة السفلية إلى أنبوب مخروطي سعة 15 مل مطلي مسبقا بنسبة 5٪ BSA.
- في الأنبوب المخروطي ، ارفع الحجم إلى 15 مل باستخدام محلول غسيل النوى واقلبه ثلاث مرات للخلط.
- جهاز طرد مركزي في دوار دلو متأرجح عند 1000 × جم ، 4 درجات مئوية ، لمدة 10 دقائق. قم بإزالة المادة الطافية بعناية.
- أعد التعليق على الفور في 150 ميكرولتر من المخزن المؤقت لغسل النوى باستخدام طرف ماصة عريض التجويف.
- قم بالتبديل إلى طرف ماصة تتحمل قياسي مضبوط على ~ 300 ميكرولتر. قم بامتصاص العينة بأكملها ثم قم بتوصيل مرشح 40 ميكرومتر على الطرف بنهاية طرف الماصة ، مع الحرص على عدم طرد العينة.
ملاحظة: تعد المرشحات الموجودة على الطرف ضرورية للحصول على أحجام أصغر ، وهي ضرورية للحفاظ على تركيز كاف للنوى للتطبيقات النهائية. على سبيل المثال ، بالنسبة ل snRNA-seq باستخدام الموائع الدقيقة ، يوصى بتركيز لا يقل عن >300 نواة / ميكرولتر ، على الرغم من أن النطاق الأمثل هو 700-1200 نواة / ميكرولتر18. يمكن أيضا تخفيف تركيزات أعلى من النوى بسهولة إذا لزم الأمر. - قم بتصفية العينة عن طريق طرد العينة بقوة من خلال المرشح إلى أنبوب طرد مركزي دقيق منخفض الارتباط بالحمض النووي سعة 1.5 مل. يجب أن يكون حجم الشطف النهائي 120-150 ميكرولتر.
ملاحظة: قد ينتج بعض الرغوة عن الترشيح. لا يبدو أن هذا يؤثر على جودة النوى.
4. تقييم جودة النوى عن طريق الفحص المجهري
- في أنبوب طرد مركزي دقيق منفصل ، امزج 10 ميكرولتر من العينة المفلترة مع 10 ميكرولتر من محلول تريبان الأزرق 0.4٪ عن طريق السحب اللطيف. لا تتطلب العينات وقت حضانة ممتد وتكون جاهزة للتصور مباشرة بعد الاختلاط بمحلول تريبان الأزرق.
- قم بإيداع 10 ميكرولتر من النوى الملطخة في غرفة شريحة غرفة العد.
ملاحظة: بدلا من ذلك ، قم بإيداع 10 ميكرولتر من عينة النوى الملطخة على مقياس الدم أو شريحة الفحص المجهري وقم بتغطيتها بقسيمة غطاء. - تقييم جودة النوى عن طريق الفحص المجهري الضوئي.
ملاحظة: يجب استخدام التكبيرات المنخفضة فقط لتكبير النوى ، نظرا لأن عيوب النوى لن تظهر بصريا إلا عند التكبير الأعلى (أي 60x أو أعلى). يمكن القيام بهذه الخطوة بسرعة لتقييم نجاح تحضير النوى ولا تتطلب تحليلا ثانويا يتجاوز الفحص البصري. سيكون للنوى السليمة عالية الجودة حدود محددة بدقة20 (الشكل 2 أ). ستؤدي النوى ذات الجودة الرديئة إلى تعطيل الأغشية النووية ، وتلطيخ التريبان الأزرق غير المكتمل بالقرب من الغشاء النووي مما يدل على تسرب محتمل للحمض النووي ، و / أو دليل على وجود فقاعات20 (الشكل 2 ب). من المتوقع أن يتراوح قطر النوى السليمة بين 10 و 15 ميكرومتر.
5. تحديد النوى المفردة والحطام ونسبة الضرب عن طريق قياس التدفق الخلوي
ملاحظة: قد تختلف المصطلحات والواجهة المحددة لبرنامج مقياس التدفق الخلوي بناء على العلامة التجارية للجهاز ، ولكن يجب تكييف هذه الخطوات بسهولة مع الأنظمة الأخرى إذا لزم الأمر.
- في أنبوب FACS ، أعد تعليق 10 ميكرولتر من عينة النوى المفلترة في 90 ميكرولتر من المخزن المؤقت الموصى به لقياس التدفق الخلوي لتخفيف 1:10. لهذا الغرض ، يتم استخدام 0.22 ميكرومتر PBS معقم مصفى ، درجة الحموضة 7.2 ، مع 2 mM EDTA و 0.5 ٪ BSA في هذه الدراسة.
ملاحظة: على الرغم من أن هذا التخفيف سيعمل مع معظم تحضيرات النوى، فقد تكون هناك حاجة إلى تخفيف أقل (على سبيل المثال، 1: 5) لأخذ عينات كافية من النوى لتقييم الجودة في حالة عينة ذات إنتاجية أقل (أي <30 نواة/ميكرولتر في العينة المخففة). - قم بتلطيخ العينات باستخدام يوديد البروبيديوم (PI) بتركيز نهائي قدره 1 ميكروغرام / مل. لا يلزم وقت الحضانة ، ويمكن تحليل النوى على الفور.
ملاحظة: بدلا من ذلك ، قم بتلطيخ العينات بتركيز نهائي قدره 0.1 ميكروغرام / مل DAPI. لاحظ أنه يجب قراءة DAPI على قناة مضان مختلفة عن PI (قناة Vioblue-A V1-A ؛ الإثارة عند 405 نانومتر ، الانبعاث عند 450/50 نانومتر). - تحليل العينات على مقياس التدفق الخلوي على النحو التالي:
- إعداد مساحة عمل:
- احصل على مقياس التدفق الخلوي في وضع الاستحواذ. انقر فوق ملف ، ثم حدد مساحة عمل جديدة من القائمة المنسدلة. ضمن علامة التبويب التجربة في اللوحة اليمنى، أدخل اسم المشروع ومعرف العينة في الحقول الخاصة بكل منهما.
- في شريط الأدوات العلوي الأيسر ، انقر فوق الزر " نافذة تحليل جديدة " (رمز مخطط مبعثر). انقر فوق المربع الذي يحتوي على ثلاث قطع (قطعة 4t) من القائمة المنبثقة. ستظهر ثلاث مؤامرات على الشاشة. انقر فوق الزر " وضع التحليل " في شريط الأدوات الأيسر العلوي (رمز) بحيث يكون رماديا وليس برتقاليا.
- إعداد مخططات التحليل:
- قم بتغيير محاور المؤامرات الثلاث على النحو التالي ، مرتبة كمحور X والمحور Y ، على التوالي:
قطعة 1: المحور X: FSC-A ، المحور Y: SSC-A
قطعة 2: المحور X: HDR-T ، المحور Y: SSC-A
قطعة 3: المحور السيني: PerCP-Vio700-A B3-A ، المحور Y: SSC-A - قم بتغيير المحاور بالنقر فوق تسمية المحور وتحديد القناة المطلوبة من القائمة المنسدلة.
- قم بتعيين المخططات لتكون مرمزة بكثافة اللون بالنقر فوق رمز "i" الرمادي المربع الذي يظهر بجوار الزاوية اليمنى العليا من كل قطعة أرض. تفتح نافذة الخصائص مع لوحة من الأزرار على اليسار. في نافذة الخصائص ، انقر فوق رمز Scatterplot (الثاني من الأعلى على يسار اللوحة). انقر فوق موافق.
ملاحظة: تتوافق قناة PerCP-Vio700-A B3-A الفلورية مع الإثارة عند 488 نانومتر ، والانبعاثات في نطاق 650-730 نانومتر.
- قم بتغيير محاور المؤامرات الثلاث على النحو التالي ، مرتبة كمحور X والمحور Y ، على التوالي:
- إعداد إعدادات الجهاز:
- انقر فوق علامة التبويب القنوات في اللوحة اليمنى. ستظهر قائمة بجميع القنوات مع ثلاثة مربعات على اليمين. قم بتعيين B3 و FSC-A و SSC-A إلى Hlog بالنقر فوق السهم لأسفل في المربعات الأولى الخاصة بها على اليمين وتحديد Hlog من القائمة المنسدلة. اضبط جهد SSC على 640 فولت ، و FSC على 300 فولت ، و B3 على 480 فولت عن طريق كتابة هذه الأرقام في المربعات الوسطى الخاصة بها إلى اليمين والضغط على مفتاح Enter. لاحظ أن المربع الثالث إلى اليمين هو مفتاح تبديل يمكن استخدامه بالتناوب للكتابة.
- ضمن رأس المشغل ، اضبط مشغل FSC على 4 ومشغل SSC وB3 على 0 بالنقر فوق السهم لأسفل، وتحديدهما من القائمة المنسدلة على اليسار، وكتابة الرقم في المربع على اليمين، ثم الضغط على مفتاح Enter . لاحظ أن هناك مربع تبديل على اليمين يمكن استخدامه بدلا من الكتابة.
ملاحظة: يجب تحسين الفولتية PMT لكل آلة قياس التدفق الخلوي ، ولكن يجب أن يكون مشغل النوى أقل مما يستخدم عادة للخلايا. علاوة على ذلك ، يجب ضبط مقياس المحور على h-log.
- اكتب 100 ميكرولتر في مربع النص حجم العينة و 50 ميكرولتر في مربع النص حجم الامتصاص على الجانب الأيسر من نافذة برنامج التدفق. تحقق من تعيين المعلمة Mix Sample إلى Mix Gentle لتجنب تحلل النوى في هذه الخطوة. اضغط على المثلث داخل دائرة (أيقونة التشغيل ) في الزاوية اليمنى السفلية لبدء التدفق.
- تحقق من جودة التدفق:
- استخدم منطقة التشتت الجانبية (SSC-A) مقابل HDR-T للتحقق من وجود فقاعات هواء أو كتل في العينة. تأكد من أن هذه المؤامرة هي سلسلة متصلة سلسة من النقاط. ستؤدي فقاعات الهواء أو التكتلات إلى مناطق فارغة في مخطط SSC-A مقابل HDR-T.
- تحقق من مخطط التشتت الجانبي (SSC-A) مقابل مخطط التشتت الأمامي (FSC-A) للتحقق من صحة الفولتية المستخدمة للعينة.
ملاحظة: على عكس الخلايا ، لن تحل النوى تماما من الحطام في مخطط التشتت الجانبي مقابل مخطط التشتت الأمامي. ومع ذلك ، يجب أن تكون هناك مجموعة عالية الكثافة من الأحداث باتجاه منتصف قطعة الأرض المقابلة للنوى (ملونة أكثر دفئا) مع كثافة أقل للأحداث (ملونة أكثر برودة) في الخلفية المقابلة للحطام.
- تحليل عدد النوى وجودتها:
- انقر نقرا مزدوجا فوق مخطط SSC-A مقابل PerCp-Vio-700A للحصول على عرض مكبر. انقر فوق الزر الموجود على شريط الأدوات الأيسر العلوي بخطوط عمودية (رباعي) لتحديد بوابة رباعية. بعد ذلك ، انقر في أي مكان في مخطط SSC-A مقابل PerCp-Vio-700A وستظهر الأرباع داخل المؤامرة.
- انقر في أي مكان على الخطوط الفاصلة الرباعية وحرك المؤشر لتعديل موضع الربع. ضع الأرباع بحيث يحتوي الربع العلوي الأيسر على أقصى اليسار (الحطام) ، ويحتوي الربع العلوي الأيمن على عدة مجموعات على شكل دمعة (نوى) (انظر الشكل 3 لإعداد البوابة وأمثلة على نتائج التدفق للحصول على نتائج نموذجية مع الاستعدادات بما في ذلك أو لا تشمل خطوة إزالة الحطام).
- الحطام مقابل عدد النوى:
- انقر على أيقونة "i" الرمادية المربعة في الزاوية اليمنى العليا من قطعة الأرض لفتح نافذة الخصائص . انقر فوق علامة التبويب وظائف المنطقة ؛ ستظهر قوائم مناطق المؤامرة والوظائف.
- ضمن قائمة المناطق ، تأكد من وجود علامة اختيار خضراء بجوار العنصر العلوي، تشير إلى تحديد قطعة الأرض بأكملها. ضمن قائمة الوظائف ، انقر فوق Count / μL لإنتاج علامة اختيار خضراء. انقر فوق " موافق" ، وسيظهر مقياس counts / μL في كل ربع.
- لعرض الأعداد الأولية والنسب المئوية، حدد Count و ٪-T من علامة التبويب وظائف المنطقة إذا رغبت في ذلك. تتوافق الأعداد / ميكرولتر في الربعين العلوي الأيسر والأيمن مع الحطام وعائد النوى ، على التوالي.
- التهم المفردة:
- تمثل الكتلة على شكل دمعة في أقصى اليسار في الجزء السفلي من الربع الأيمن العلوي مفردات. ارسم بوابة متعددة الأضلاع حول هذه المجموعة السكانية بالنقر فوق زر المضلع (المضلع) في شريط الأدوات الأيسر العلوي.
- انقر مرة واحدة ، وحرك الماوس لبدء الرسم ، وانقر مرة أخرى لإنهاء جزء خطي من البوابة وبدء الجزء التالي. انقر نقرا مزدوجا لإنهاء البوابة. انقر فوق حد البوابة وحرك الماوس لتغيير موضع البوابة.
- انقر فوق رؤوس البوابة لتعديل الشكل. ستظهر التهم / ميكرولتر من السكان المسورين (الفردي). هذا هو تركيز تحضير النوى مع التخفيف الأولي.
ملاحظة: لا تنطبق العلاقة الخطية لمنطقة التشتت الأمامية مقابل الارتفاع 1: 1 ، والتي تستخدم عادة لتحديد معدل المفردة عند تدفق الخلايا ، على النوى ويمكن تجاهلها.
- باستخدام تركيز تحضير النوى المخففة وعامل التخفيف ، قم بحساب تركيز التحضير الأولي (على سبيل المثال ، للتخفيف 1:10 ، اضرب التركيز المرصود في 10). التركيزات من >300 نواة / ميكرولتر مناسبة ل snRNA-seq.
- إعداد مساحة عمل:
النتائج
تم تحسين بروتوكول عزل نوى دماغ killifish الموصوف هنا خصيصا ل killifish ويتم تلخيصه في الشكل 1. بالإضافة إلى استخراج النوى ، يفصل البروتوكول طرقا مختلفة لتقييم جودة وكمية النوى المعزولة. يوضح الشكل 2 أمثلة على كل من النوى السليمة (الشكل 2 أ) وغير الصحية (الشكل 2 ب) كما تم تقييمها بواسطة الفحص المجهري الضوئي. توجد نوى صحية مناسبة للتحليل النهائي (الشكل 2 أ) كنوى مفردة ذات أغشية سليمة. كما هو موضح في الشكل 2B ، فإن وضع الفشل الأكثر شيوعا لهذا البروتوكول (وبروتوكولات عزل النوى الأخرى) هو توليد نوى مفرطة ، والتي تتميز بأغشية نووية تالفة. غالبا ما يؤدي هذا إلى تكتل النوى ويمكن أن يساهم في إشارات الخلفية في التطبيقات النهائية بسبب تسرب الأحماض النووية من النوى الممزقة. إذا لوحظ تكتل مفرط ، نوصي بأن نكون أكثر لطفا أثناء خطوات الارتداد و / أو تقليل أوقات الحضانة في محلول التحلل.
يستخدم هذا البروتوكول قياس التدفق الخلوي لتحديد عدد النوى المعزولة وتحديد النسبة النسبية للنوى المتعددة في العينة. بالإضافة إلى ذلك ، يمكن استخدام قياس التدفق الخلوي لتقييم المحتوى النسبي للحطام الملوث ، وغالبا ما تتمزق شظايا النوى وغيرها من الحطام الخلوي الذي يمكن أن يؤثر بشكل ضار على مقايسات المصب في عينة النوى. يمكن رؤية بيانات التدفق التمثيلي في الشكل 3. سينتج إجراء عزل النوى عالي الجودة: 1) جزء صغير من الحطام ، و 2) جزء كبير من النوى المفردة مقابل النوى المتعددة (> 80٪ من جزء النوى). يسمح استخدام تلطيخ PI ، الذي يلطخ الأحماض النووية ، بفصل النوى المفردة عن الحطام ومضاعفة النوى. الشكل 3 أ هو مثال على التحضير الملوث بالحطام ، في حين أن الشكل 3 ب هو مثال على تجربة عالية الجودة.
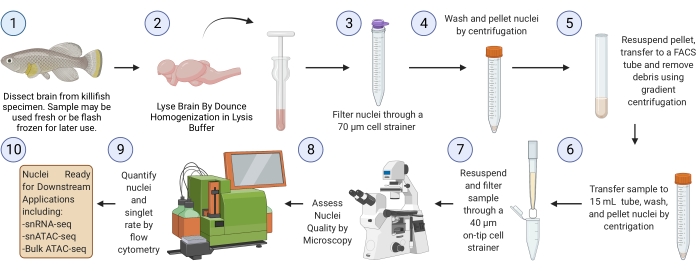
الشكل 1: سير عمل عزل نوى دماغ Killifish. سير العمل التجريبي لعزل النوى عن أدمغة killifish المجمدة أو الطازجة. بمجرد عزلها وتقييمها ، يمكن استخدام النوى في العديد من تحليلات "omics" النهائية. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
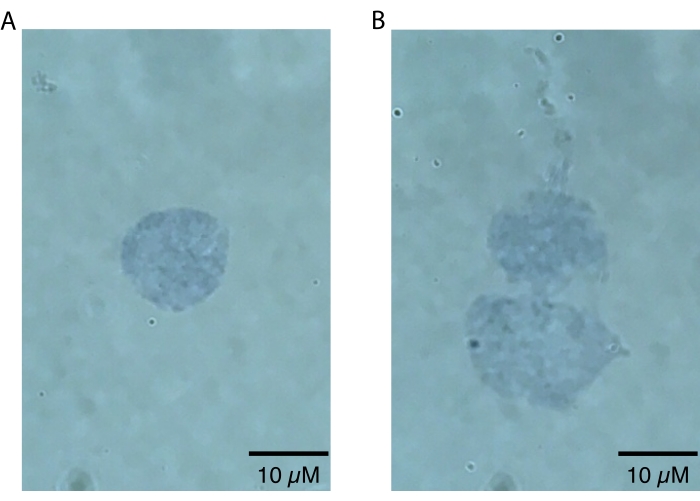
الشكل 2: تقييم جودة النوى عن طريق الفحص المجهري. تم خلط النوى بنسبة 1: 1 في محلول بنسبة 0.4٪ من Trypan Blue وتم تصورها على مجهر Echo Revolve بواسطة تصوير برايتفيلد بمعدل 60x. (أ) مثال على نواة عالية الجودة. النواة موجودة كمفردة والغشاء النووي سليم. ب: مثال على النوى ذات النوعية الرديئة. تضررت الأغشية النووية ، وتتجمع النوى في دوبل ، ويرجع ذلك على الأرجح إلى تسرب الحمض النووي اللزج ، والذي يمكن رؤيته يتسرب من أعلى النواة العلوية. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
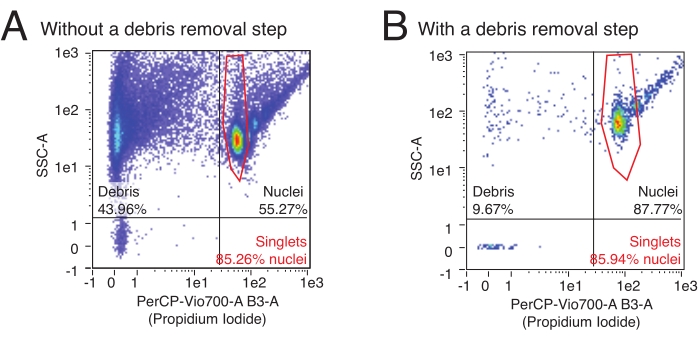
الشكل 3: تقدير كمية النوى وتقييم النقاء عن طريق قياس التدفق الخلوي. تم تلطيخ عينات النوى بتخفيف 1: 100 من PI وتشغيلها على مقياس التدفق الخلوي. توجد النوى في أشكال مفردة ومضاعفة في الربع الأيمن العلوي من (A ، B) مع مفردات كأدنى سحابة من الأحداث تليها ثنائيات وثلاثية وما إلى ذلك بترتيب تصاعدي. يتميز الحطام بالأحداث في الربعين في أقصى اليسار. (أ) مثال على إعداد نوى منخفضة الجودة ، حيث تم حذف خطوة إزالة الحطام ويشكل الحطام >40٪ من الأحداث. (ب) مثال على عينة نوى عالية الجودة، مع خطوة إزالة الحطام المضمنة. في هذا المثال، يشكل الحطام <10٪ من جميع الأحداث المسجلة بواسطة مقياس التدفق الخلوي. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
| نوع العينة (2 أدمغة) | متوسط العائد (4 تحضيرات مستقلة) |
| أدمغة الذكور لمدة 5 أسابيع | 3.59 ± 1.76 س 105 |
| أدمغة الذكور لمدة 10 أسابيع | 6.41 ± 1.33 س 105 |
| أدمغة الذكور لمدة 15 أسبوعا | 14.59 ± 2.05 س 105 |
| أدمغة الإناث لمدة 5 أسابيع | 2.54 ± 0.75 س 105 |
| أدمغة الإناث لمدة 10 أسابيع | 4.66 ± 1.29 س 105 |
| أدمغة الإناث لمدة 15 أسبوعا | 7.95 ± 3.51 س 105 |
الجدول 1: متوسط الغلة المتوقعة من دماغين من سمك الكيلي الفيروزي الأفريقي عبر الجنس والعمر. متوسط الغلة معبرا عنه ب 105 نوى ± خطأ معياري للمتوسط على أربعة مستحضرات نوى مستقلة في كل فئة.
الشكل التكميلي 1: مقارنة جودة عزل النوى باستخدام البروتوكولات القياسية وبروتوكولنا الأمثل على أدمغة أسماك الكيلي المجمدة. (أ) تقييم جودة النوى بالفحص المجهري. تم خلط النوى بنسبة 1: 1 في محلول بنسبة 0.4٪ من Trypan Blue وتم تصورها على المجهر بواسطة تصوير برايت فيلد عند 60x. (ب) قياس كمية حمل النوى والحطام عن طريق قياس التدفق الخلوي. تم تلطيخ عينات النوى بتخفيف 1: 100 من PI وتشغيلها على مقياس التدفق الخلوي. (ج) ملخص مقاييس تقييم الجودة عن طريق الفحص المجهري وقياس التدفق الخلوي مع البروتوكولات المعيارية المختلفة. الرجاء الضغط هنا لتنزيل هذا الملف.
الشكل التكميلي 2: تمثيل تخطيطي لخطوات إزالة الحطام. (أ) مخطط إزالة الحطام بطبقات الطرد المركزي المسبق. (ب) مخطط إزالة المواد الطافية بعد الطرد المركزي. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
يمكن استخدام البروتوكول المقدم هنا لتوليد نوى عالية الجودة من أدمغة killifish. كان لا بد من تصميم هذا البروتوكول خصيصا لدماغ killifish حيث أدت بروتوكولات عزل نوى الدماغ النموذجية القائمة على الثدييات المطبقة على أدمغة killifish باستمرار إلى ضعف جودة النوى في أيدينا. نشك في أن هذا يرجع إلى انخفاض محتوى المايلين النسبي في دماغ killifish مقارنة بنظرائهم في الثدييات ، والتي من شأنها أن تتحلل وتتجمع استجابة للظروف القاسية المطلوبة لتحلل خلايا دماغ الثدييات. هذا البروتوكول هو تقدم في مجالات الشيخوخة و killifish لأنه يسهل استكشاف شيخوخة الدماغ على مستوى الخلية الواحدة في نموذج فعال من حيث التكلفة والوقت لشيخوخة دماغ الفقاريات.
هذا البروتوكول قوي للعينات الطازجة أو المجمدة ، على الرغم من أنه يجب على المرء أن يأخذ في الاعتبار التطبيقات النهائية عند استخدام الأنسجة الطازجة أو المجمدة. غالبا ما تكون الأنسجة المجمدة مريحة حيث يمكن جمعها وتخزينها لعدة أشهر أثناء جمع العينات. يمكن استخدام هذه العينات بأمان لتطبيقات مثل snRNA-seq. ومع ذلك ، قد تؤدي عينات التجميد إلى تعطيل البنية النووية وبالتالي القدرة على قياس مشهد الكروماتين بدقة بواسطة ATAC-seq21. وبالتالي ، بالنسبة للتطبيقات النهائية مثل ATAC-seq السائبة أو snATAC-seq ، يوصى باستخدام أدمغة تشريح طازجة بدلا من العقول المجمدة. بالإضافة إلى ذلك ، نظرا لأنه يمكن إجراء جميع الخطوات بعد تجانس الدماغ بالتوازي ، فإن هذا البروتوكول قابل لتشغيل عينات متعددة في إطار زمني معقول ، وبالتالي الحد من تدهور الحمض النووي الريبي الناجم عن الحضانة المطولة على الجليد.
علاوة على ذلك ، من الضروري تحضير مخازن مؤقتة طازجة (في غضون ساعات) من إجراء استخراج النوى. وجدنا أنه يجب إضافة المنظفات وكذلك BSA إلى المخازن المؤقتة مباشرة قبل بدء البروتوكول. يمكن صنع المخازن المؤقتة التي تحتوي على أملاح فقط (PBS ، NaCl ، إلخ) كمركزات ، وتعقيمها بالمرشح (0.22 ميكرومتر) ، وتخزينها إلى أجل غير مسمى في درجة حرارة الغرفة. يمكن تحضير محاليل مخزون BSA وتعقيمها وتخزينها عند 4 درجات مئوية في غضون أيام من استخراج النوى (إذا تم تحضيرها من مسحوق) ولكن يجب دائما إضافتها إلى المخازن المؤقتة المستخدمة في هذا البروتوكول مباشرة قبل إجراء البروتوكول. ومع ذلك ، نوصي بإعداد حلول BSA في يوم البروتوكول. في حالة استخدام حلول BSA مسبقة الصنع من طرف ثالث ، ينصح باستخدام زجاجات جديدة غير مفتوحة. يؤدي استخدام BSA الطازج بشكل عام إلى انخفاض محتوى الحطام في تحضيرات النوى.
سواء تم استخدام العينات الطازجة أو المجمدة كمدخلات ، فمن المهم تقييم جودة النوى بعد عزل النوى. على الرغم من أن هذا البروتوكول مصمم خصيصا لتجنب الإفراط في التحلل ، إلا أن هذا هو السبب الأكثر شيوعا لفقدان جودة النوى. قد ينتج التحلل المفرط عن قضاء الكثير من الوقت في المخزن المؤقت للتحلل ، أو التعامل القاسي المفرط مع النوى مثل السحب المفرط بطرف ماصة التجويف القياسي ، أو مقدار مفرط من الوقت المستغرق بين عزل النوى والتطبيقات النهائية (>1 ساعة). غالبا ما تكون النوى المفرطة في التلف في الأطراف النووية ، والتي تسرب الحمض النووي وتسبب التكتل (الشكل 2 ب). سيؤدي ذلك إلى زيادة عدد المضاعفات والمساهمة في الأحماض النووية الخلفية التي ستتداخل مع التطبيقات النهائية ، وخاصة snRNA-seq. يمكن تقييم كلتا الصفتين عن طريق الفحص المجهري بعد عزل النوى. إذا لوحظ تكتل نووي مفرط ، نوصي بمحاولة تقصير حضانة خطوة التحلل لتقليل فرصة الإفراط في التحلل. كطريقة بديلة لزيادة مفردات النوى ، يمكن استخدام فرز الخلايا بمساعدة التألق (FACS) لإثراء المفردات في اتجاه مجرى هذا البروتوكول. ومع ذلك ، نلاحظ أنه عند العمل مع نوى هشة بالفعل من الأنسجة المجمدة ، قد يؤدي إجهاد القص الذي يحدث أثناء الفرز إلى زيادة التمزق النووي وبالتالي زيادة الحمض النووي الريبي / الحمض النووي المحيط. بالإضافة إلى ذلك ، نلاحظ أن الوقت اللازم لتشغيل فرز عائد FACS للنوى عند معالجة عينات متعددة سيتطلب بقاء جميع عينات النوى على الجليد لساعات ، بينما يتم فرز العينات الأخرى. وبالتالي ، فإن زيادة أوقات الانتظار عند معالجة عينات متعددة بالتوازي مع نهج نظام مراقبة الأصول الميدانية يمكن أن تؤدي أيضا إلى انخفاض جودة النوى بشكل عام وزيادة خطر تدهور الحمض النووي الريبي. ومن ثم، إذا كان نظام مراقبة الأصول الميدانية مرغوبا فيه بالنسبة لانخفاض معدل الازدواج، فإننا نوصي بفحص محتوى الحطام مرة أخرى بعد فرز الغلة وأن تؤخذ في الاعتبار إمكانية انخفاض جودة الحمض النووي الريبي بالنسبة لتطبيقات الحمض النووي الريبي أحادي الخلية كتحذير محتمل.
يعد التقدير الدقيق لعدد النوى ونسبة المفردة أمرا ضروريا لجميع تطبيقات "omics" النهائية تقريبا وهو ذو أهمية قصوى. نظرا للقدرة على بوابة النوى وعدها بسهولة حسب الحجم ، فإن قياس التدفق الخلوي هو الطريقة الأكثر دقة لحساب النوى التي قمنا بتقييمها. بدلا من ذلك ، يمكن للمرء تحديد النوى باستخدام عدادات الخلايا مثل عداد الخلايا الآلي Countess 2 FL من Invitrogen أو عداد الخلايا الآلي DeNovix CellDrop. تجدر الإشارة إلى أن عداد الخلايا الآلي Countess 2 FL من Invitrogen ، وإلى حد أقل بكثير DeNovix ، يميلان إلى المبالغة في تقدير عدد النوى عن طريق حساب الحطام كنوى ، مما يعني أن بوابة الحجم اليدوية قد تكون مطلوبة. علاوة على ذلك ، يسمح مقياس التدفق الخلوي للمرء بتقييم نقاء النوى بسهولة. يمكن للمرء أن يميز النسبة النسبية للنوى المفردة مقابل النوى المتعددة بطريقة كمية يصعب إجراؤها بواسطة الفحص المجهري. وهذا أمر حيوي بالنسبة ل snRNA-seq و snATAC-seq ، لأن هذين البروتوكولين سيعانيان من فائض في العينات المتعددة ، والتي يجب استبعادها من التحليلات النهائية. بالإضافة إلى المضاعفات ، يمكن قياس النسبة النسبية ل "الحطام" (النوى المجزأة ، الحطام الخلوي) عن طريق قياس التدفق الخلوي ويجب أن تكون منخفضة نسبيا ، لأن هذه المادة غالبا ما تحتوي على أحماض نووية ملوثة يمكن أن تسهم في إشارة خلفية وبيانات "omics" أحادية النواة الفاسدة.
كما هو الحال مع بروتوكولات عزل النوى الموصوفة سابقا ، قد لا يتم تلخيص نسب أنواع الخلايا في الأنسجة الأصلية بأمانة في إعداد النوى19 ، وبالتالي يجب تفسيرها بحذر. تجدر الإشارة ، مثل جميع teleosts ، يحتوي سمك كيليفيش الفيروزي الأفريقي على كريات الدم الحمراء ذات النواة ، والتي من المتوقع أيضا أن يتم تمثيلها في إعداد النوى. يمكن تحديد هذه النوى في مجموعات بيانات snRNA-seq و snATAC-seq من خلال التعبير العالي / إمكانية الوصول إلى جينات الهيموجلوبين ويمكن استبعادها حسابيا إذا رغبت في ذلك.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم إنشاء بعض اللوحات باستخدام BioRender.com. تم دعم هذا العمل في مختبرنا من خلال منحة تدريب ما بعد الدكتوراه NIA T32 AG052374 إلى BT ، ومنحة من مؤسسة Simons كجزء من تعاون Simons من أجل اللدونة في دماغ الشيخوخة ، ومنحة تجريبية من مؤسسة Navigage ، وجائزة عائلة Hanson-Thorell إلى B.A.B.
Materials
| Name | Company | Catalog Number | Comments |
| 0.4% Trypan Blue solution | Gibco | 15250061 | |
| 10x PBS | Bioland | PBS01-03 | |
| 15 mL Conicle Centrifuge Tube | VWR | 89039-664 | |
| 2 mL Tissue Grinder | Kimble | 885300-0002 | Dounce Homogenizer |
| 5 mL Polystyrene Round-Bottom Tube | Falcon | 352054 | |
| 5M Sodium Chloride, Molecular Biology Grade | Promega | V4221 | |
| autoMACS Rinsing Solution | Miltenyi Biotec | 130-091-222 | This corresponds to 1x PBS pH 7.2, 2 mM EDTA (used for flow cytometry) |
| Debris Removal Solution | Miltenyi Biotec | 130-109-398 | |
| DNA LoBInd Tube | Eppendorf | 22431021 | |
| Echo Revolve microscope (fitted with 60x objective) | Echo | NA | No catalog number; Used to visually inspect nuclei. |
| Falcon Round-Bottom Polystyrene Tubes, 5 mL | Falcon | 352052 | FACS tube |
| FLOWMI Cell Strainers, 40 μM | SP Bel-Art | 136800040 | Referred to as on-tip filters in Protocol |
| Hydrochloric Acid | Sigma-Aldrich | 258146-500 mL | Used to lower TRIS pH from 8.0 to 7.4 |
| Leica EZ4 dissecting scope | Leica | NA | No catalog number |
| MACS BSA stock solution | Miltenyi Biotec | 130091376 | |
| MACS SmartStrainers (70 μM) | Miltenyi Biotec | 130-110-916 | |
| MACSQuant Analyzer 10 Flow Cytometer | Miltenyi Biotec | NA | No catalog number |
| Magnesium Chloride, Hexahydrate, Molecular Biology Grade (Powder) | Millipore | 442611 | |
| Megafuge 16R Centrifuge | ThermoScientific | 75003629 | |
| Micro Cover Glass | VWR | 48393081 | |
| Micro Slides Superfrost Plus | VWR | 48311-703 | |
| Nonidet P-40 Substitute | Roche | (Roche) 11332473001/ Catalog: 983739 P Code: -102368106 (Sigma Aldrich) | |
| NP-40 Surfact-Amps Detergent Solution | ThermoFisher | 85124 | |
| Nuclease-Free HyPure Molecular Biology Grade Water | HyClone | SH30538.02 | |
| NxGen RNase Inhibitor (50,000 U) | Lucigen | 30281-2 | |
| Propidium Iodide solution | MBL | FP00010020 | |
| PureBlu DAPI Nuclear Staining Dye | Biorad | 1351303 | |
| TipOne RPT Pipette Tips (Ultra low retention, filtered) in 10 µL, 20 µL, 200 µL, and 1000 µL sizes | USA Scientific | #1181-3810; #1180-1810; #1180-8810; #1182-1830 | |
| Tricaine-S (MS 222) | Syndel | Tricaine10G | Syndel is an FDA-approved provider for pharmaceutical grade Tricaine |
| TRIS, 1 M, pH 8.0 | VWR | E199-500 mL | |
| Wide Bore Pipet Tips | Axygen | T-1005-WB-C |
References
- Yankner, B. A., Lu, T., Loerch, P. The aging brain. Annual Review of Pathology. 3 (1), 41-66 (2008).
- Hu, C. K., Brunet, A. The African turquoise killifish: A research organism to study vertebrate aging and diapause. Aging Cell. 17 (3), 12757 (2018).
- McKay, A., et al. An automated feeding system for the African killifish reveals effects of dietary restriction on lifespan and allows scalable assessment of associative learning. bioRxiv. , (2021).
- Valenzano, D. R., Terzibasi, E., Cattaneo, A., Domenici, L., Cellerino, A. Temperature affects longevity and age-related locomotor and cognitive decay in the short-lived fish Nothobranchius furzeri. Aging Cell. 5 (3), 275-278 (2006).
- Vanhunsel, S., et al. The killifish visual system as an in vivo model to study brain aging and rejuvenation. NPJ Aging and Mechanisms of Disease. 7 (1), 22 (2021).
- Armand, E. J., Li, J., Xie, F., Luo, C., Mukamel, E. A. Single-cell sequencing of brain cell transcriptomes and epigenomes. Neuron. 109 (1), 11-26 (2021).
- Bakken, T. E., et al. Single-nucleus and single-cell transcriptomes compared in matched cortical cell types. PLoS One. 13 (12), 0209648 (2018).
- Ziffra, R. S., et al. Single-cell epigenomics reveals mechanisms of human cortical development. Nature. 598 (7879), 205-213 (2021).
- Grindberg, R. V., et al. RNA-sequencing from single nuclei. Proceedings of the National Academy of Sciences. 110 (49), 19802-19807 (2013).
- Kalish, B. T., et al. Single-nucleus RNA sequencing of mouse auditory cortex reveals critical period triggers and brakes. Proceedings of the National Academy of Sciences. 117 (21), 11744-11752 (2020).
- Slyper, M., et al. A single-cell and single-nucleus RNA-Seq toolbox for fresh and frozen human tumors. Nature Medicine. 26 (5), 792-802 (2020).
- Ayhan, F., Douglas, C., Lega, B. C., Konopka, G. Nuclei isolation from surgically resected human hippocampus. STAR Protocols. 2 (4), 100844 (2021).
- Gaublomme, J. T., et al. Nuclei multiplexing with barcoded antibodies for single-nucleus genomics. Nature Communications. 10 (1), 2907 (2019).
- Narayanan, A., et al. Nuclei isolation from fresh frozen brain tumors for single-nucleus RNA-seq and ATAC-seq. Journal of Visualized Experiments. (162), e61542 (2020).
- Saunders, A., et al. Molecular diversity and specializations among the cells of the adult mouse brain. Cell. 174 (4), 1015-1030 (2018).
- . Isolation of Nuclei for Single Cell RNA Sequencing & Tissues for Single Cell RNA Sequencing Available from: https://support.10xgenomics.com/permalink/1dlB6Z91VqClgUmSC2OM8k (2021)
- Martin, C., et al. Frozen tissue nuclei extraction (for 10xV3 snSEQ) V.2. protocols.io. , (2020).
- Nuclei Isolation from Adult Mouse Brain Tissue for Single Cell RNA Sequencing. 10xGenomics Available from: https://www.10xgenomics.com/support/single-cell-gene-expression/documentation/steps/sample-prep/nuclei-isolation-from-adult-mouse-brain-tissue-for-single-cell-ma-sequencing (2022)
- Denisenko, E., et al. Systematic assessment of tissue dissociation and storage biases in single-cell and single-nucleus RNA-seq workflows. Genome Biology. 21 (1), 130 (2020).
- What are the best practices for working with nuclei samples for 3' single-cell gene expression. 10xGenomics Available from: https://kb.10xgenomics.com/hc/en-us/articles/360050780051-What-are-the-best-practices-for-working-with-nuclei-samples-for-3-single-cell-gene-expression (2022)
- Rocks, D., et al. Cell type-specific chromatin accessibility analysis in the mouse and human brain. Epigenetics. 17 (2), 202-219 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved