Method Article
Isolement en douceur des noyaux du tissu cérébral d’un poisson turquoise africain adulte, un modèle naturellement éphémère pour la recherche sur le vieillissement
Dans cet article
Résumé
Nous présentons ici un protocole pour isoler les noyaux du cerveau du modèle de vertébrés à courte durée de vie Nothobranchius furzeri pour des applications en aval telles que le séquençage de l’ARN mononucléeau ou le test mononucléique pour la chromatine accessible par transposase avec séquençage (ATAC-seq).
Résumé
L’étude du vieillissement cérébral à une résolution unicellulaire dans les systèmes de vertébrés reste difficile en raison des contraintes de coût, de temps et techniques. Ici, nous démontrons un protocole pour générer des bibliothèques de séquençage d’ARN mononoyau (snRNA-seq) à partir du cerveau du killifish turquoise africain naturellement éphébré Nothobranchius furzeri. Le killifish turquoise africain a une durée de vie de 4 à 6 mois et peut être hébergé de manière rentable, réduisant ainsi les obstacles de coût et de temps pour étudier le vieillissement cérébral des vertébrés. Cependant, des protocoles sur mesure sont nécessaires pour isoler des noyaux de qualité suffisante pour les expériences unicellulaires en aval du cerveau de poissons jeunes et âgés. Ici, nous démontrons un protocole empiriquement optimisé pour l’isolement de noyaux de haute qualité du cerveau de killifish turquoise africain adulte, une étape critique dans la génération de bibliothèques de noyaux uniques de haute qualité. De plus, nous montrons que les étapes visant à réduire l’ARN de fond contaminant sont importantes pour distinguer clairement les types de cellules. En résumé, ce protocole démontre la faisabilité de l’étude du vieillissement cérébral chez des organismes modèles de vertébrés non traditionnels.
Introduction
Comprendre les mécanismes du vieillissement cérébral des vertébrés est essentiel pour lutter contre les maladies neurodégénératives liées à l’âge telles que la maladie d’Alzheimer et la démence1. Le killifish turquoise africain (Nothobranchus furzeri) est le vertébré ayant la plus courte durée de vie qui puisse être élevé en captivité, et en raison de sa courte durée de vie et de sa déficience cognitive associée à l’âge, c’est un excellent modèle de vieillissement cérébral 2,3,4,5. Récemment, l’avènement de technologies « omiques » unicellulaires, telles que le séquençage de l’ARN à noyau unique (snRNA-seq) et le dosage à noyau unique de la chromatine accessible par transposase avec séquençage (snATAC-seq), a permis aux chercheurs d’interroger le cerveau vieillissant à une résolution sans précédentde 6,7,8. Ces méthodes reposent sur l’isolement des noyaux, car la récupération des cellules cérébrales telles que les neurones est souvent trop difficile à isoler 6,7,8,9,10. Cependant, la plupart des protocoles d’isolement des noyaux publiés sont optimisés pour les organismes modèles de mammifères 11,12,13,14,15. Ainsi, comme il existe actuellement un besoin non satisfait d’isoler les noyaux cérébraux du killifish en tant que nouvel organisme modèle prometteur dans le domaine de la recherche sur le vieillissement2, l’objectif de ce protocole est d’établir une méthode pour isoler les noyaux de haute qualité des tissus cérébraux congelés.
Ici, un flux de travail rationalisé et robuste est établi qui utilise des matériaux couramment disponibles pour isoler des noyaux de haute qualité des cerveaux de killifish. Ce protocole a été modifié à partir d’un protocole de génomique 10x pour les cerveaux de souris afin de tenir compte de la faible teneur en myéline des killifish turquoises africains, de la fragilité des tissus congelés et de la nécessité de réduire la teneur en débris ambiants pour les applications liées au séquençage16. En effet, les protocoles précédemment optimisés pour les tissus cérébraux de mammifères17,18 conduisent à des noyaux de mauvaise qualité (c.-à-d. une surlyse) et / ou à une teneur élevée en débris lorsqu’ils sont utilisés sur des cerveaux de killifish congelés, ce qui les rend impropres à une utilisation avec le séquençage de l’ARNn selon les recommandations pour le séquençage de l’ARN à noyau unique utilisant la microfluidique (Figure supplémentaire 1).
En plus de l’isolement des noyaux, nous démontrons comment évaluer la qualité et le rendement des noyaux par microscopie et cytométrie en flux. Cet article fournit des exemples de résultats optimaux et sous-optimaux et traite du dépannage. Ce protocole a été conçu et optimisé pour les cerveaux de killifish congelés, mais peut également être utilisé sans modifications majeures sur des échantillons de killifish fraîchement disséqués. Les noyaux cérébraux de Killifish isolés à l’aide de cette méthode ont été optimisés pour une utilisation dans le séquençage de l’ARN à noyau unique (snRNA-seq) en tant qu’application en aval, mais devraient également pouvoir être utilisés dans snATAC-seq et ATAC-seq en vrac.
Protocole
Les soins aux animaux et l’expérimentation animale ont été effectués conformément à l’IACUC de l’Université de Californie du Sud en vertu des protocoles approuvés #21215. Pour tout travail utilisant ce protocole, il est nécessaire d’obtenir l’approbation de l’IACUC de l’institution avant de commencer tout travail de recherche sur les animaux vertébrés.
REMARQUE : Une exécution complète du protocole à partir de tissus cérébraux surgelés (à partir de l’étape 3) devrait prendre ~2,5 h pour six échantillons (Figure 1).
1. Disséquer les cerveaux de killifish
- Euthanasier sans cruauté le killifish en utilisant une solution de 1,5 g/L de méthanosulfonate/tricaïne (MS-222) dans l’eau du système.
- Utilisez des ciseaux tranchants pour décapiter rapidement les killifish une fois que tout mouvement du corps et des branchies a cessé.
- Disséquer la tête décapitée sur une boîte de Petri propre comme décrit précédemment19.
- Placez la capsule sous un microscope à dissection (en utilisant une plage de grossissement de 8x-35x). Tournez la tête de manière à ce que les rayons branchiostégals soient au point
- À l’aide de ciseaux, coupez à travers le dentier de manière à ce que les rayons branchiostégals et le crâne soient révélés.
- À l’aide d’une pince, maintenez les rayons branchiostégals de chaque côté du crâne. Utilisez une autre paire de pinces pour enlever les fragments de tissu restants du crâne. Le chiasme optique en forme de V qui relie le cerveau et les yeux devrait devenir visible.
- Coupez le chiasme optique à l’aide de ciseaux pour détacher les deux yeux du cerveau. Utilisez une pince pour libérer doucement le crâne.
- Inversez le crâne et utilisez une pince pour gratter le muscle de la face dorsale du crâne.
- Utilisez une paire de forceps pour maintenir le crâne en place et une autre paire de pinces pour retirer doucement les os du crâne, révélant ainsi le cerveau.
- Le cerveau apparaît blanc et mou. Une fois visible, il n’est pas nécessaire d’enlever tous les os crâniens. Retirez le cerveau avec une pince propre en soulevant et en grattant doucement.
- Flashez le cerveau en le plaçant dans un tube de microcentrifugeuse stocké sur de la glace sèche.
REMARQUE: Le tissu cérébral congelé peut être stocké à -80 ° C jusqu’à ce que tous les échantillons à traiter ensemble aient été prélevés pour limiter les effets de lot lors du traitement pour la génération de bibliothèque. Bien que les échantillons stockés à -80 ° C ne puissent pas être stockés indéfiniment, ce protocole a été exécuté avec succès sur des cerveaux de killifish stockés jusqu’à 12 mois sans baisse notable de la qualité.
2. Préparez des tampons frais
- Préparer le tampon de lavage des noyaux (albumine sérique bovine [BSA] à 2 % dans 1x PBS, solution saline tamponnée au phosphate pH 7,4 et inhibiteur de la RNase 0,2 U/μL) et conserver sur de la glace. Préparer 250 mL de tampon de lavage des noyaux pour un maximum de huit échantillons. Pour 250 mL, utiliser 50 mL de solution mère de BSA à 10 %, 25 mL d’une solution mère de PBS 10x, 1,25 mL du stock d’inhibiteur de RNase à 40 U/μL, puis porter le volume à 250 mL avec du ddH2O sans RNAse.
- Préparer le tampon de lyse des noyaux (10 mM Tris-HCl pH 7,4, 10 mM NaCl, 3 mM MgCl 2, 0,01875% v/v NP-40 et0,2 U/μL inhibiteur de RNase) et conserver sur de la glace. Préparer 10 mL de tampon de lyse des noyaux pour un maximum de huit échantillons. Pour 10 mL, utiliser 100 μL de solution mère de 1 M Tris-HCl pH 7,4, 20 μL de solution mère de NaCl 5 M, 30 μL de solution mère de 1 M MgCl 2, 18,75 μL d’une solution mère de NP-40 à 10 %, 50 μL du stock d’inhibiteur de RNase 40 U/μL, puis porter le volume à 10 mL avec ddH2O sans RNAse.
3. Isoler les noyaux
- Si vous utilisez des échantillons congelés, décongelez-les sur de la glace pendant 10 minutes. Si vous utilisez des cerveaux fraîchement disséqués, passez directement à l’étape 3.2
REMARQUE: Bien que ce protocole puisse fonctionner sur un seul cerveau, des échantillons plus petits de jeunes poissons (âgés de 5 à 6 semaines) auront un rendement plus faible. Des rendements suffisants peuvent toujours être obtenus en traitant deux cerveaux comme un seul échantillon, quels que soient l’âge et le sexe du poisson (tableau 1). Ce protocole a permis d’isoler avec succès des noyaux de haute qualité de poissons âgés de 5 à 26 semaines, y compris des animaux des souches GRZ et ZMZ1001. Aucun problème n’est prévu dans l’application de ce protocole à d’autres souches. - Faire rebondir le cerveau dans 1 mL de tampon de lyse des noyaux glacés dans un homogénéisateur Dounce de 2 mL. Gardez l’homogénéisateur sur la glace et évitez de générer des bulles pendant la lyse de l’échantillon. Rebondir à une vitesse approximative de 0,5 s/course descendante et 0,5 s/course ascendante avec une torsion de 180° par cycle. Rebondir à l’aide du pilon lâche pendant 15 coups, ou jusqu’à ce que le mélange tampon tissu/lyse semble homogène si des coups supplémentaires sont nécessaires.
REMARQUE: Les homogénéisateurs de rebondissement doivent être lavés, rincés à l’eau distillée et stérilisés avec des cycles de stérilisation en autoclave sec standard entre les utilisations.- Rebondir à l’aide du pilon serré pendant 30 coups avec de petites pauses, 30 s à 1 min, tous les 10 coups. Rebondir à une vitesse approximative de 0,5 s/course descendante et 0,5 s/course ascendante avec une torsion de 180° par cycle. Laisser reposer l’échantillon sur la glace dans l’homogénéisateur Dounce pendant 2 min.
NOTE: Ce temps d’incubation assure une lyse adéquate, mais doit être raccourci si une surlyse nucléaire est observée.
- Rebondir à l’aide du pilon serré pendant 30 coups avec de petites pauses, 30 s à 1 min, tous les 10 coups. Rebondir à une vitesse approximative de 0,5 s/course descendante et 0,5 s/course ascendante avec une torsion de 180° par cycle. Laisser reposer l’échantillon sur la glace dans l’homogénéisateur Dounce pendant 2 min.
- Filtrer l’échantillon à travers un filtre cellulaire de 70 μm dans un tube conique de 15 mL prérecouvert de BSA à 5%.
- Ajouter 4 mL de tampon de lavage des noyaux à l’échantillon en pipetant le tampon de lavage sur le filtre cellulaire de 70 μm de l’étape 3.3 et mélanger doucement par inversion cinq fois.
REMARQUE: Cela permet la récupération des noyaux qui peuvent être piégés sur le filtre et améliore le rendement. - Centrifuger à l’aide d’un rotor à godet oscillant à 500 x g, 4 °C, pendant 10 min. Jeter le surnageant en le versant doucement dans un récipient à déchets liquides. Remettez l’échantillon en position verticale et retirez le tampon de lavage restant à l’aide d’une pipette P1000.
REMARQUE: La pastille de noyaux est susceptible d’être visible lorsque vous partez de deux cerveaux dans un échantillon. Cependant, lors du traitement de cerveaux uniques de jeunes animaux (5-6 semaines), un rendement inférieur est attendu et les granulés peuvent ne pas toujours être visibles. Dans ce cas, le surnageant doit être soigneusement retiré tout en prenant la position de la pastille au fond du tube. - Remettez immédiatement les noyaux en suspension dans 1 mL de tampon de lavage des noyaux avec un embout de pipette P1000 de grand alésage.
- Porter l’échantillon à 5 mL en ajoutant 4 mL de tampon de lavage des noyaux et mélanger doucement par inversion cinq fois. Centrifuger à l’aide d’un rotor à godet oscillant à 500 x g, 4 °C, pendant 10 min, et jeter le surnageant.
- Resuspendre les noyaux dans 1 mL de tampon de lavage des noyaux avec une pointe de pipette à large alésage et transférer dans un tube de cytométrie en flux (FACS).
- Ajouter 300 μL de solution d’élimination des débris (Table des matières) et bien mélanger par pipetage avec une pointe large jusqu’à ce que le mélange soit homogène.
- Recouvrir doucement 1 mL de tampon de lavage des noyaux sur la solution de noyaux préparée à l’étape 3.9 à l’aide d’une pipette P1000 et en tenant le tube légèrement incliné (figure supplémentaire 2). La fraction de la solution d’élimination des débris et la fraction tampon de lavage des noyaux doivent former une interface claire si elles sont correctement stratifiées.
- Centrifuger dans un rotor à godet oscillant à 3000 x g, 4 °C, pendant 10 min. Jetez complètement les deux phases supérieures à l’aide d’une pipette P1000.
NOTE: Le tube FACS transparent permettra de visualiser les trois phases distinctes suivant la centrifugation (haut, interphase, bas). Pour faciliter l’enlèvement maximal des débris, il est conseillé d’être plus agressif que conservateur dans l’enlèvement des deux phases supérieures (c.-à-d. qu’il est préférable d’enlever une petite quantité de la phase inférieure plutôt que de reporter l’une des phases supérieures; Figure supplémentaire 2). De plus, la couche d’interphase peut être trop mince pour être visualisée. Dans ce cas, retirez la couche supérieure (apparente), qui contient la couche interphasique. La couche inférieure conservée doit contenir ~1 mL de volume total. - Transférer la couche inférieure dans un tube conique de 15 mL préduit de BSA à 5 %.
- Dans le tube conique, porter le volume à 15 mL avec le tampon de lavage des noyaux et retourner trois fois pour mélanger.
- Centrifuger dans un rotor à godet oscillant à 1000 x g, 4 °C, pendant 10 min. Retirez le surnageant avec précaution.
- Remettez immédiatement en suspension dans 150 μL de tampon de lavage des noyaux à l’aide d’un embout de pipette à large alésage.
- Passer à un embout de pipette d’alésage standard réglé sur ~300 μL. Prélever l’échantillon entier, puis fixer un filtre à pointe de 40 μm à l’extrémité de l’embout de la pipette, en prenant soin de ne pas expulser l’échantillon.
NOTE: Des filtres sur pointe sont nécessaires pour obtenir de plus petits volumes, qui sont nécessaires pour maintenir une concentration suffisante de noyaux pour les applications en aval. Par exemple, pour le séquençage de l’ARNn utilisant la microfluidique, une concentration minimale de >300 noyaux/μL est recommandée, bien que la plage optimale soit de 700-1200 noyaux/μL18. Des concentrations plus élevées de noyaux peuvent également être facilement diluées si nécessaire. - Filtrer l’échantillon en l’expulsant de force à travers le filtre dans un tube microcentrifuge de 1,5 mL à faible liaison à l’ADN. Le volume final d’élution doit être compris entre 120 et 150 μL.
NOTE: Une certaine mousse peut résulter de la filtration. Cela ne semble pas affecter la qualité des noyaux.
4. Évaluer la qualité des noyaux par microscopie
- Dans un tube à microcentrifugation séparé, mélanger 10 μL de l’échantillon filtré avec 10 μL de solution de bleu de trypan à 0,4 % par pipetage doux. Les échantillons ne nécessitent pas de temps d’incubation prolongé et sont prêts à être visualisés immédiatement après le mélange avec une solution de bleu de trypan.
- Déposer 10 μL des noyaux colorés dans une chambre d’une lame de chambre de comptage.
REMARQUE: Sinon, déposer 10 μL de l’échantillon de noyaux colorés sur une lame d’hémocytomètre ou de microscopie et couvrir avec un couvercle. - Évaluer la qualité des noyaux par microscopie optique.
REMARQUE : Les grossissements inférieurs ne doivent être utilisés que pour zoomer sur les noyaux, car les défauts des noyaux ne seront visuellement apparents qu’à des grossissements plus élevés (c.-à-d. 60x ou plus). Cette étape peut être effectuée rapidement pour évaluer le succès de la préparation des noyaux et ne nécessite pas d’analyse secondaire au-delà de l’inspection visuelle. Les noyaux intacts de haute qualité auront une bordurenettement définie 20 (Figure 2A). Les noyaux de mauvaise qualité auront des membranes nucléaires perturbées, une coloration inégale au bleu trypan près de la membrane nucléaire indiquant une fuite potentielle d’acide nucléique et/ou des signes de blebbing20 (Figure 2B). Les noyaux sains devraient avoir un diamètre de 10 à 15 μm.
5. Quantifier les noyaux singulet, les débris et les proportions de multiplets par cytométrie de flux
REMARQUE: La terminologie spécifique et l’interface du logiciel de cytomètre en flux peuvent différer en fonction de la marque de la machine, mais ces étapes doivent être facilement adaptées à d’autres systèmes si nécessaire.
- Dans un tube FACS, remettre en suspension 10 μL de l’échantillon de noyaux filtrés dans 90 μL du tampon recommandé pour la cytométrie en flux pour une dilution de 1:10. À cette fin, 0,22 μm de PBS stérilisé filtré, pH 7,2, avec 2 mM d’EDTA et 0,5% de BSA est utilisé dans cette étude.
NOTA : Bien que cette dilution fonctionne pour la plupart des préparations de noyaux, une dilution plus faible (p. ex. 1:5) peut être nécessaire pour échantillonner suffisamment de noyaux pour l’évaluation de la qualité dans le cas d’un échantillon à faible rendement (c.-à-d. <30 noyaux/μL dans l’échantillon dilué). - Colorer les échantillons avec de l’iodure de propidium (PI) à une concentration finale de 1 μg/mL. Aucun temps d’incubation n’est requis et les noyaux peuvent être analysés immédiatement.
REMARQUE : Vous pouvez également colorer les échantillons avec une concentration finale de 0,1 μg/mL de DAPI. Notez que DAPI doit être lu sur un canal de fluorescence différent de PI (canal Vioblue-A V1-A; excitation à 405 nm, émission à 450/50 nm). - Analysez les échantillons sur un cytomètre en flux comme suit :
- Configurer un espace de travail :
- Avoir le cytomètre en flux en mode Acquisition. Cliquez sur Fichier, puis sélectionnez Nouvel espace de travail dans le menu déroulant. Sous l’onglet Expérience du panneau de gauche, entrez le nom du projet et l’ID de l’échantillon dans leurs champs respectifs.
- Dans la barre d’outils supérieure gauche, cliquez sur le bouton Nouvelle fenêtre d’analyse (icône de nuage de points). Cliquez sur la case avec trois tracés (Tracé 4t) dans le menu contextuel. Trois tracés apparaîtront à l’écran. Cliquez sur le bouton Mode d’analyse dans la barre d’outils supérieure gauche (icône A) pour qu’il soit gris et non orange.
- Paramétrer les diagrammes d’analyse :
- Modifiez les axes des trois tracés comme suit, classés respectivement comme axe X et axe Y:
Graphique 1: Axe X: FSC-A, Axe Y: SSC-A
Parcelle 2: Axe X: HDR-T, Axe Y: SSC-A
Graphique 3: Axe X: PerCP-Vio700-A B3-A, Axe Y: SSC-A - Modifiez les axes en cliquant sur l’étiquette de l’axe et en sélectionnant le canal souhaité dans le menu déroulant.
- Définissez les tracés pour qu’ils soient codés par couleur en cliquant sur l’icône « i » grise carrée qui apparaît en regard du coin supérieur droit de chaque tracé. Une fenêtre Propriétés s’ouvre avec un panneau de boutons sur la gauche. Dans la fenêtre Propriétés, cliquez sur l’icône Nuage de points (deuxième en partant du haut à gauche du panneau). Cliquez sur OK.
REMARQUE: Le canal de fluorescence PerCP-Vio700-A B3-A correspond à une excitation à 488 nm et à une émission comprise entre 650 et 730 nm.
- Modifiez les axes des trois tracés comme suit, classés respectivement comme axe X et axe Y:
- Configurer les paramètres de l’instrument :
- Cliquez sur l’onglet Canaux dans le panneau de gauche. Une liste de tous les canaux apparaîtra avec trois cases à droite. Définissez B3, FSC-A et SSC-A sur Hlog en cliquant sur la flèche vers le bas sur leurs premières cases respectives à droite et en sélectionnant Hlog dans le menu déroulant. Réglez la tension de SSC à 640 V, FSC à 300 V et B3 à 480 V en tapant ces chiffres dans leurs cases centrales respectives à droite et en appuyant sur la touche Entrée . Notez que la troisième case à droite est une bascule qui peut être utilisée alternativement pour taper.
- Sous l’en-tête Trigger , définissez le déclencheur FSC sur 4 et le trigger SSC et B3 sur 0 en cliquant sur la flèche vers le bas, en les sélectionnant dans le menu déroulant à gauche, en tapant le numéro dans la zone de droite, puis en appuyant sur la touche Entrée . Notez qu’il y a une boîte à bascule sur la droite qui peut être utilisée alternativement à la frappe.
REMARQUE: Les tensions PMT doivent être optimisées pour chaque machine de cytométrie en flux particulière, mais le déclencheur des noyaux doit être inférieur à ce qui est généralement utilisé pour les cellules. De plus, l’échelle de l’axe doit être réglée sur h-log.
- Tapez 100 μL dans la zone de texte Volume de l’échantillon et 50 μL dans la zone de texte Volume d’absorption sur le côté gauche de la fenêtre du logiciel d’écoulement. Vérifiez que le paramètre Mix Sample est défini sur Mix Gentle pour éviter de lyser les noyaux à cette étape. Appuyez sur le triangle à l’intérieur d’un cercle (icône de lecture) dans le coin inférieur droit pour démarrer le flux.
- Vérifier la qualité du flux :
- Utilisez la zone de diffusion latérale (SSC-A) par rapport au HDR-T pour vérifier la présence de bulles ou de touffes d’air dans l’échantillon. Assurez-vous que ce tracé est un continuum lisse de points. Les bulles ou les amas d’air entraîneront des régions vides dans le graphique SSC-A par rapport au HDR-T.
- Vérifiez le diagramme de diffusion latérale (SSC-A) par rapport à la diffusion directe (FSC-A) pour vérifier que les tensions utilisées sont correctes pour l’échantillon.
REMARQUE: Contrairement aux cellules, les noyaux ne se dissoudront pas complètement des débris dans un nuage de points par rapport à un nuage de points vers l’avant. Cependant, il devrait y avoir un groupe d’événements à haute densité vers le milieu de la parcelle correspondant à des noyaux (de couleur plus chaude) avec une densité plus faible d’événements (de couleur plus froide) en arrière-plan correspondant à des débris.
- Analyser le nombre et la qualité des noyaux :
- Double-cliquez sur le tracé SSC-A vs PerCp-Vio-700A pour l’agrandir. Cliquez sur le bouton dans la barre d’outils supérieure gauche avec des lignes perpendiculaires (quadrant) pour sélectionner une porte quadrant. Ensuite, cliquez n’importe où dans le tracé SSC-A vs PerCp-Vio-700A et les quadrants apparaîtront à l’intérieur du tracé.
- Cliquez n’importe où sur les lignes de séparation du quadrant et faites glisser le curseur pour modifier l’emplacement du quadrant. Placez les quadrants de telle sorte que le quadrant supérieur gauche contienne la population extrême gauche (débris) et que le quadrant supérieur droit contienne plusieurs grappes en forme de larme (noyaux) (voir la figure 3 pour la configuration des portes et des exemples de résultats d’écoulement pour les résultats typiques avec des préparations incluant ou non une étape d’enlèvement des débris).
- Nombre de débris par rapport au nombre de noyaux :
- Cliquez sur l’icône « i » grise carrée dans le coin supérieur droit du tracé pour ouvrir la fenêtre Propriétés . Cliquez sur l’onglet Fonctions de la région ; Des listes de régions et de fonctions de tracé apparaîtront.
- Sous la liste Régions , assurez-vous qu’une coche verte est à côté de l’élément supérieur, indiquant que l’ensemble du tracé est sélectionné. Sous la liste Fonctions , cliquez sur Count/μL pour produire une coche verte. Cliquez sur OK, et une métrique de nombre/μL apparaîtra dans chaque quadrant.
- Pour afficher les nombres bruts et les pourcentages, sélectionnez Nombre et %-T dans l’onglet Fonctions de région si vous le souhaitez. Les nombres/μL dans les quadrants supérieur gauche et droit correspondent respectivement au rendement des débris et des noyaux.
- Nombre de singulets:
- Le groupe en forme de larme le plus à gauche dans la partie inférieure du quadrant supérieur droit représente des singulettes. Dessinez une porte polygonale autour de cette population en cliquant sur le bouton polygonal (Polygone) dans la barre d’outils supérieure gauche.
- Cliquez une seule fois, faites glisser la souris pour commencer à dessiner, puis cliquez à nouveau pour terminer un segment linéaire de la porte et commencer la suivante. Double-cliquez pour terminer la porte. Cliquez sur la bordure de la porte et faites glisser la souris pour repositionner la porte.
- Cliquez sur les sommets de la porte pour modifier la forme. Les nombres/μL de la population fermée (singlets) apparaîtront. Il s’agit de la concentration des noyaux de préparation avec la dilution initiale.
REMARQUE: La relation linéaire de 1:1 entre la zone de diffusion vers l’avant et la hauteur, couramment utilisée pour déterminer le taux singulet lors de l’écoulement des cellules, ne s’applique pas aux noyaux et peut être ignorée.
- À l’aide de la concentration de la préparation des noyaux dilués et du facteur de dilution, calculer rétrospectivement la concentration de la préparation initiale (p. ex., pour une dilution de 1:10, multiplier la concentration observée par 10). Les concentrations de >300 noyaux/μL conviennent au snRNA-seq.
- Configurer un espace de travail :
Résultats
Le protocole d’isolement des noyaux cérébraux des killifish décrit ici est optimisé spécifiquement pour le killifish et est résumé à la figure 1. En plus de l’extraction des noyaux, le protocole détaille différentes méthodes d’évaluation de la qualité et de la quantité des noyaux isolés. La figure 2 montre des exemples de noyaux sains (figure 2A) et malsains (figure 2B) évalués par microscopie optique. Les noyaux sains convenant à l’analyse en aval (figure 2A) se présentent sous forme de noyaux singulet avec des membranes intactes. Comme le montre la figure 2B, le mode de défaillance le plus courant de ce protocole (et d’autres protocoles d’isolement des noyaux) est la génération de noyaux surlysés, caractérisés par des membranes nucléaires endommagées. Cela conduit souvent à l’agglutination des noyaux et peut contribuer aux signaux de fond dans les applications en aval en raison de la fuite d’acides nucléiques des noyaux rompus. Si une agglutination excessive est observée, nous recommandons d’être plus doux pendant les étapes de rebond et / ou de réduire les temps d’incubation dans le tampon de lyse.
Ce protocole utilise la cytométrie en flux pour quantifier le nombre de noyaux isolés et déterminer la proportion relative de noyaux multiplets dans un échantillon. De plus, la cytométrie en flux peut être utilisée pour évaluer la teneur relative des débris contaminants, des fragments de noyaux souvent rompus et d’autres débris cellulaires qui peuvent nuire aux essais en aval dans l’échantillon de noyaux. Des données de débit représentatives sont présentées à la figure 3. Une procédure d’isolement des noyaux de haute qualité produira: 1) une petite fraction de débris et 2) une fraction élevée de noyaux singulet par rapport aux noyaux multiplets (> 80% de la fraction des noyaux). L’utilisation de la coloration PI, qui colore les acides nucléiques, permet de séparer les noyaux singulet des débris et des noyaux multiplets. La figure 3A est un exemple de préparation contaminée par des débris, tandis que la figure 3B est un exemple d’expérience de haute qualité.
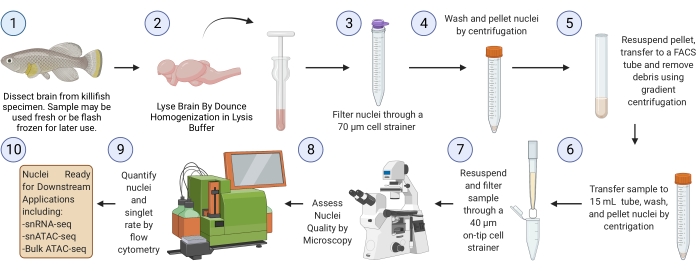
Figure 1 : Flux de travail d’isolement des noyaux cérébraux de Killifish. Flux de travail expérimental pour l’isolement des noyaux à partir de cerveaux de killifish congelés ou frais. Une fois isolés et évalués, les noyaux peuvent être utilisés pour diverses analyses « omiques » en aval. Veuillez cliquer ici pour voir une version agrandie de cette figure.
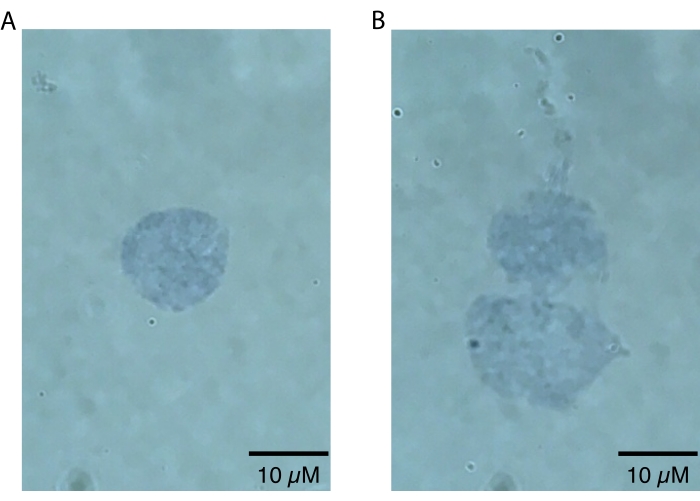
Figure 2 : Évaluation de la qualité des noyaux par microscopie. Les noyaux ont été mélangés 1:1 dans une solution de bleu de trypan à 0,4% et visualisés sur un microscope Echo Revolve par imagerie en fond clair à 60x. (A) Un exemple de noyau de haute qualité. Le noyau est présent sous forme de singulet et la membrane nucléaire est intacte. (B) Un exemple de noyaux de mauvaise qualité. Les membranes nucléaires sont endommagées et les noyaux s’agglutinent en un doublet, probablement en raison d’une fuite d’ADN collant, qui peut être vu fuir du haut du noyau le plus haut. Veuillez cliquer ici pour voir une version agrandie de cette figure.
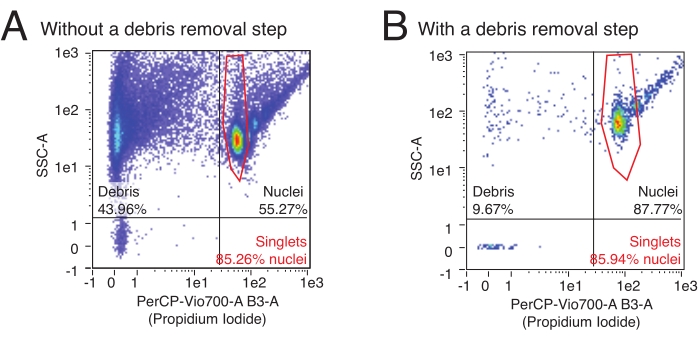
Figure 3 : Quantification des noyaux et évaluation de la pureté par cytométrie en flux. Les échantillons de noyaux ont été colorés avec une dilution de PI de 1:100 et exécutés sur un cytomètre en flux. Les noyaux sont présents sous forme singulet et multiplet dans le quadrant supérieur droit de (A, B) avec des singulets comme nuage inférieur d’événements suivis de doublets, triplets, etc. dans l’ordre croissant. Les débris sont marqués par les événements dans les deux quadrants les plus à gauche. (A) Un exemple de préparation de noyaux de mauvaise qualité, où l’étape d’enlèvement des débris a été omise et où les débris représentent >40% des événements. (B) Un exemple d’échantillon de noyaux de haute qualité, avec l’étape d’enlèvement des débris incluse. Dans cet exemple, les débris représentent <10% de tous les événements enregistrés par le cytomètre en flux. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Type d’échantillon (2 cerveaux) | Rendement moyen (4 préparations indépendantes) |
| Cerveau masculin de 5 semaines | 3,59 ± 1,76 x 105 |
| Cerveau masculin de 10 semaines | 6,41 ± 1,33 x 105 |
| Cerveau masculin de 15 semaines | 14,59 ± 2,05 x 105 |
| Cerveau féminin de 5 semaines | 2,54 ± 0,75 x 105 |
| Cerveau féminin de 10 semaines | 4,66 ± 1,29 x 105 |
| Cerveau féminin de 15 semaines | 7,95 ± 3,51 x 105 |
Tableau 1 : Rendements moyens attendus de deux cerveaux de killifish turquoise africain selon le sexe et l’âge. Les rendements moyens exprimés en 105 noyaux ±erreur type de la moyenne sur quatre préparations de noyaux indépendants dans chaque catégorie.
Figure supplémentaire 1 : Comparaison de la qualité de l’isolement des noyaux à l’aide de protocoles standard et de notre protocole optimisé sur les cerveaux de killifish congelés. (A) Évaluation de la qualité des noyaux par microscopie. Les noyaux ont été mélangés 1:1 dans une solution de bleu de trypan à 0,4% et visualisés au microscope par imagerie en fond clair à 60x. (B) Quantification des noyaux et de la charge de débris par cytométrie en flux. Les échantillons de noyaux ont été colorés avec une dilution de PI de 1:100 et exécutés sur un cytomètre en flux. (C) Résumé des paramètres d’évaluation de la qualité par microscopie et cytométrie en flux avec les différents protocoles étalonnés. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 2 : Représentation schématique des étapes d’enlèvement des débris. (A) Schéma de stratification de la précentrifugation par enlèvement des débris. (B) Schéma d’élimination du surnageant après centrifugation. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Le protocole présenté ici peut être utilisé pour générer de manière reproductible des noyaux de haute qualité à partir de cerveaux de killifish. Ce protocole devait être spécialement conçu pour le cerveau des killifish, car les protocoles d’isolement des noyaux cérébraux typiques des mammifères appliqués aux cerveaux de killifish entraînaient systématiquement une mauvaise qualité des noyaux entre nos mains. Nous soupçonnons que cela est dû à la teneur relative en myéline plus faible du cerveau du killifish par rapport à leurs homologues mammifères, qui se lyseraient et s’agglutineraient en réponse aux conditions difficiles requises pour la lyse des cellules cérébrales des mammifères. Ce protocole est une avancée dans les domaines du vieillissement et du killifish, car il facilite l’exploration du vieillissement cérébral au niveau de la cellule unique dans un modèle rentable et rapide du vieillissement du cerveau des vertébrés.
Ce protocole est robuste pour les échantillons frais ou congelés, bien qu’il faille tenir compte des applications en aval lors de l’utilisation de tissus frais ou congelés. Les tissus congelés sont souvent pratiques car ils peuvent être prélevés et stockés pendant des mois pendant que les échantillons sont collectés. De tels échantillons peuvent être utilisés en toute sécurité pour des applications telles que le snRNA-seq. Cependant, la congélation des échantillons peut perturber la structure nucléaire et donc la capacité de mesurer avec précision le paysage chromatinique par ATAC-seq21. Ainsi, pour les applications en aval telles que l’ATAC-seq en vrac ou le snATAC-seq, il est recommandé d’utiliser des cerveaux fraîchement disséqués au lieu de cerveaux congelés. De plus, comme toutes les étapes suivant l’homogénéisation du cerveau peuvent être effectuées en parallèle, ce protocole se prête à l’exécution de plusieurs échantillons dans un délai raisonnable, limitant ainsi la dégradation de l’ARN causée par une incubation prolongée sur la glace.
De plus, il est impératif de préparer des tampons frais (dans les heures qui suivent l’extraction des noyaux). Nous avons constaté que des détergents ainsi que du BSA doivent être ajoutés aux tampons immédiatement avant le début du protocole. Les tampons contenant uniquement des sels (PBS, NaCl, etc.) peuvent être fabriqués sous forme de concentrés, stérilisés par filtre (0,22 μm) et stockés indéfiniment à température ambiante. Les solutions mères de BSA peuvent être préparées, stérilisées et stockées à 4 °C dans les jours suivant l’extraction des noyaux (si elles sont préparées à partir d’une poudre), mais elles doivent toujours être ajoutées aux tampons utilisés dans ce protocole immédiatement avant d’entreprendre le protocole. Cependant, nous recommandons de préparer les solutions BSA le jour du protocole. Si vous utilisez des solutions BSA préfabriquées d’un tiers, il est conseillé d’utiliser des bouteilles fraîches et non ouvertes. L’utilisation de BSA frais entraîne généralement une réduction de la teneur en débris dans les préparations des noyaux.
Que des échantillons frais ou congelés soient utilisés comme intrants, il est important d’évaluer la qualité des noyaux après l’isolement des noyaux. Bien que ce protocole soit spécifiquement conçu pour éviter la surlyse, c’est la cause la plus fréquente de perte de qualité des noyaux. La surlyse peut résulter d’un temps trop long passé dans le tampon de lyse, d’une manipulation trop brutale des noyaux telle qu’un pipetage excessif avec une pointe de pipette d’alésage standard, ou d’un temps excessif passé entre l’isolement des noyaux et les applications en aval (>1 h). Les noyaux trop lysés auront souvent des périphéries nucléaires endommagées, qui fuient l’ADN et provoquent des agglutinations (Figure 2B). Cela conduira à un nombre accru de multiplets et contribuera aux acides nucléiques de fond qui interféreront avec les applications en aval, en particulier le séquençage de l’ARNn. Les deux qualités peuvent être évaluées par microscopie après isolement des noyaux. Si une agrégation nucléaire excessive est observée, nous recommandons d’essayer de raccourcir l’incubation de l’étape de lyse pour réduire le risque de surlyse. Comme méthode alternative pour augmenter les singulets des noyaux, le tri cellulaire assisté par fluorescence (FACS) peut être utilisé pour enrichir les singulettes en aval de ce protocole. Cependant, nous notons que, lorsque l’on travaille avec des noyaux déjà fragiles provenant de tissus congelés, la contrainte de cisaillement survenant lors du tri peut entraîner une rupture nucléaire accrue et donc une augmentation de l’ARN/ADN ambiant. De plus, nous notons que le temps requis pour effectuer un tri du rendement FACS pour les noyaux lors du traitement de plusieurs échantillons exigerait que tous les échantillons de noyaux restent sur la glace pendant des heures, tandis que d’autres échantillons sont triés. Ainsi, l’augmentation des temps d’attente lors du traitement de plusieurs échantillons en parallèle avec l’approche FACS pourrait également entraîner une réduction globale de la qualité des noyaux et augmenter le risque de dégradation de l’ARN. Ainsi, si le FACS est souhaité pour un taux de doublet réduit, nous recommandons que la teneur en débris soit vérifiée à nouveau après le tri du rendement et que la qualité éventuelle réduite de l’ARN soit prise en compte pour les applications de séquençage d’ARN unicellulaire comme mise en garde potentielle.
Une estimation précise du nombre de noyaux et de la proportion singulet est essentielle pour presque toutes les applications « omiques » en aval et est de la plus haute importance. En raison de la capacité de porter et de compter facilement les noyaux par taille, la cytométrie en flux est la méthode la plus précise de comptage des noyaux que nous ayons évaluée. Alternativement, on peut quantifier les noyaux en utilisant des compteurs de cellules tels que le compteur de cellules automatisé Countess 2 FL d’Invitrogen ou le compteur de cellules automatisé DeNovix CellDrop. À noter, le compteur automatisé de cellules Countess 2 FL d’Invitrogen et, dans une bien moindre mesure, le DeNovix, ont tendance à surestimer le nombre de noyaux en comptant les débris comme des noyaux, ce qui signifie que des contrôles manuels peuvent être nécessaires. De plus, le cytomètre en flux permet d’évaluer facilement la pureté des noyaux. On peut discerner la proportion relative de noyaux singulet par rapport aux noyaux multiplets d’une manière quantitative qui est difficile par microscopie. Ceci est vital pour snRNA-seq et snATAC-seq, car ces protocoles souffriront d’un surplus d’échantillons multiplet, qui doivent être exclus des analyses en aval. En plus des multisegments, la proportion relative de « débris » (noyaux fragmentés, débris cellulaires) peut être quantifiée par cytométrie de flux et doit être relativement faible, car ce matériau contient souvent des acides nucléiques contaminants qui peuvent contribuer à un signal de fond et corrompre les données « omiques » à noyau unique.
Comme pour les protocoles d’isolement des noyaux décrits précédemment, les proportions de types de cellules dans le tissu d’origine peuvent ne pas être récapitulées fidèlement dans la préparation des noyaux19 et doivent donc être interprétées avec prudence. À noter, comme tous les téléostéens, les killifish turquoises africains ont des érythrocytes nucléés, qui devraient également être représentés dans la préparation des noyaux. Ces noyaux peuvent être identifiés dans les ensembles de données snRNA-seq et snATAC-seq par l’expression / accessibilité plus élevée des gènes de l’hémoglobine et peuvent être exclus par calcul si désiré.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Certains panneaux ont été générés avec BioRender.com. Ce travail dans notre laboratoire a été soutenu par la subvention de formation postdoctorale NIA T32 AG052374 à B.T., une subvention de la Fondation Simons dans le cadre de la Simons Collaboration for Plasticity in the Aging Brain, une subvention pilote de la Navigage Foundation et une bourse de la famille Hanson-Thorell à B.A.B.
matériels
| Name | Company | Catalog Number | Comments |
| 0.4% Trypan Blue solution | Gibco | 15250061 | |
| 10x PBS | Bioland | PBS01-03 | |
| 15 mL Conicle Centrifuge Tube | VWR | 89039-664 | |
| 2 mL Tissue Grinder | Kimble | 885300-0002 | Dounce Homogenizer |
| 5 mL Polystyrene Round-Bottom Tube | Falcon | 352054 | |
| 5M Sodium Chloride, Molecular Biology Grade | Promega | V4221 | |
| autoMACS Rinsing Solution | Miltenyi Biotec | 130-091-222 | This corresponds to 1x PBS pH 7.2, 2 mM EDTA (used for flow cytometry) |
| Debris Removal Solution | Miltenyi Biotec | 130-109-398 | |
| DNA LoBInd Tube | Eppendorf | 22431021 | |
| Echo Revolve microscope (fitted with 60x objective) | Echo | NA | No catalog number; Used to visually inspect nuclei. |
| Falcon Round-Bottom Polystyrene Tubes, 5 mL | Falcon | 352052 | FACS tube |
| FLOWMI Cell Strainers, 40 μM | SP Bel-Art | 136800040 | Referred to as on-tip filters in Protocol |
| Hydrochloric Acid | Sigma-Aldrich | 258146-500 mL | Used to lower TRIS pH from 8.0 to 7.4 |
| Leica EZ4 dissecting scope | Leica | NA | No catalog number |
| MACS BSA stock solution | Miltenyi Biotec | 130091376 | |
| MACS SmartStrainers (70 μM) | Miltenyi Biotec | 130-110-916 | |
| MACSQuant Analyzer 10 Flow Cytometer | Miltenyi Biotec | NA | No catalog number |
| Magnesium Chloride, Hexahydrate, Molecular Biology Grade (Powder) | Millipore | 442611 | |
| Megafuge 16R Centrifuge | ThermoScientific | 75003629 | |
| Micro Cover Glass | VWR | 48393081 | |
| Micro Slides Superfrost Plus | VWR | 48311-703 | |
| Nonidet P-40 Substitute | Roche | (Roche) 11332473001/ Catalog: 983739 P Code: -102368106 (Sigma Aldrich) | |
| NP-40 Surfact-Amps Detergent Solution | ThermoFisher | 85124 | |
| Nuclease-Free HyPure Molecular Biology Grade Water | HyClone | SH30538.02 | |
| NxGen RNase Inhibitor (50,000 U) | Lucigen | 30281-2 | |
| Propidium Iodide solution | MBL | FP00010020 | |
| PureBlu DAPI Nuclear Staining Dye | Biorad | 1351303 | |
| TipOne RPT Pipette Tips (Ultra low retention, filtered) in 10 µL, 20 µL, 200 µL, and 1000 µL sizes | USA Scientific | #1181-3810; #1180-1810; #1180-8810; #1182-1830 | |
| Tricaine-S (MS 222) | Syndel | Tricaine10G | Syndel is an FDA-approved provider for pharmaceutical grade Tricaine |
| TRIS, 1 M, pH 8.0 | VWR | E199-500 mL | |
| Wide Bore Pipet Tips | Axygen | T-1005-WB-C |
Références
- Yankner, B. A., Lu, T., Loerch, P. The aging brain. Annual Review of Pathology. 3 (1), 41-66 (2008).
- Hu, C. K., Brunet, A. The African turquoise killifish: A research organism to study vertebrate aging and diapause. Aging Cell. 17 (3), 12757 (2018).
- McKay, A., et al. An automated feeding system for the African killifish reveals effects of dietary restriction on lifespan and allows scalable assessment of associative learning. bioRxiv. , (2021).
- Valenzano, D. R., Terzibasi, E., Cattaneo, A., Domenici, L., Cellerino, A. Temperature affects longevity and age-related locomotor and cognitive decay in the short-lived fish Nothobranchius furzeri. Aging Cell. 5 (3), 275-278 (2006).
- Vanhunsel, S., et al. The killifish visual system as an in vivo model to study brain aging and rejuvenation. NPJ Aging and Mechanisms of Disease. 7 (1), 22 (2021).
- Armand, E. J., Li, J., Xie, F., Luo, C., Mukamel, E. A. Single-cell sequencing of brain cell transcriptomes and epigenomes. Neuron. 109 (1), 11-26 (2021).
- Bakken, T. E., et al. Single-nucleus and single-cell transcriptomes compared in matched cortical cell types. PLoS One. 13 (12), 0209648 (2018).
- Ziffra, R. S., et al. Single-cell epigenomics reveals mechanisms of human cortical development. Nature. 598 (7879), 205-213 (2021).
- Grindberg, R. V., et al. RNA-sequencing from single nuclei. Proceedings of the National Academy of Sciences. 110 (49), 19802-19807 (2013).
- Kalish, B. T., et al. Single-nucleus RNA sequencing of mouse auditory cortex reveals critical period triggers and brakes. Proceedings of the National Academy of Sciences. 117 (21), 11744-11752 (2020).
- Slyper, M., et al. A single-cell and single-nucleus RNA-Seq toolbox for fresh and frozen human tumors. Nature Medicine. 26 (5), 792-802 (2020).
- Ayhan, F., Douglas, C., Lega, B. C., Konopka, G. Nuclei isolation from surgically resected human hippocampus. STAR Protocols. 2 (4), 100844 (2021).
- Gaublomme, J. T., et al. Nuclei multiplexing with barcoded antibodies for single-nucleus genomics. Nature Communications. 10 (1), 2907 (2019).
- Narayanan, A., et al. Nuclei isolation from fresh frozen brain tumors for single-nucleus RNA-seq and ATAC-seq. Journal of Visualized Experiments. (162), e61542 (2020).
- Saunders, A., et al. Molecular diversity and specializations among the cells of the adult mouse brain. Cell. 174 (4), 1015-1030 (2018).
- . Isolation of Nuclei for Single Cell RNA Sequencing & Tissues for Single Cell RNA Sequencing Available from: https://support.10xgenomics.com/permalink/1dlB6Z91VqClgUmSC2OM8k (2021)
- Martin, C., et al. Frozen tissue nuclei extraction (for 10xV3 snSEQ) V.2. protocols.io. , (2020).
- Nuclei Isolation from Adult Mouse Brain Tissue for Single Cell RNA Sequencing. 10xGenomics Available from: https://www.10xgenomics.com/support/single-cell-gene-expression/documentation/steps/sample-prep/nuclei-isolation-from-adult-mouse-brain-tissue-for-single-cell-ma-sequencing (2022)
- Denisenko, E., et al. Systematic assessment of tissue dissociation and storage biases in single-cell and single-nucleus RNA-seq workflows. Genome Biology. 21 (1), 130 (2020).
- What are the best practices for working with nuclei samples for 3' single-cell gene expression. 10xGenomics Available from: https://kb.10xgenomics.com/hc/en-us/articles/360050780051-What-are-the-best-practices-for-working-with-nuclei-samples-for-3-single-cell-gene-expression (2022)
- Rocks, D., et al. Cell type-specific chromatin accessibility analysis in the mouse and human brain. Epigenetics. 17 (2), 202-219 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon