Method Article
Çekirdek Mekanobiyolojisini Incelemek için 3D Manyetik Kuvvet Aktüatörü ve Çok Fonksiyonlu Floresan Görüntülemeyi Birleştirmek
Bu Makalede
Özet
Bu çalışma, sitoplazmaya verilen manyetik mikroboncuklar yoluyla hücre çekirdeğine doğrudan mekanik kuvvet uygulamak ve eşzamanlı canlı hücre floresan görüntülemesi yapmak için yeni bir protokol sunmaktadır.
Özet
Mekanobiyolojide temel bir soru, canlı hücrelerin hücre fizyolojisi ve patolojisi bağlamında hücre dışı mekanik uyaranları nasıl algıladıklarıdır. Hücre dışı mekanik uyaranların hücresel mekano-hissinin membran reseptörleri, ilişkili protein kompleksi ve hücre iskeleti yoluyla olduğuna inanılmaktadır. Mekanobiyolojideki son gelişmeler, sitoplazmadaki hücre çekirdeğinin mekanik uyaranları aynı anda bağımsız olarak algılayabildiğini göstermektedir. Bununla birlikte, hücre çekirdeğinin mekanik uyaranları nasıl algıladığına, dönüştürdüğüne ve tepki verdiğine dair mekanik bir anlayış, esas olarak geleneksel araçlarla çekirdek mekaniğine erişme ve ölçmedeki teknik zorluklar nedeniyle eksiktir. Bu yazıda, hücre çekirdeğini doğrudan deforme etmek için hassas ve invaziv olmayan 3D mekanik uyaranlar uygulayan yeni bir manyetik kuvvet aktüatörünün tasarımı, üretimi ve uygulanması açıklanmaktadır. CRISPR / Cas9 mühendisliği yapılmış hücreleri kullanan bu çalışma, bu aracın, yüksek çözünürlüklü konfokal floresan görüntüleme ile birleştiğinde, çekirdek deformasyonunun bir fonksiyonu olarak tek hücrelerde mekanoya duyarlı evet ile ilişkili bir proteinin (YAP) gerçek zamanlı dinamiklerinin ortaya çıkarılmasını sağladığını göstermektedir. Bu basit yöntem, mekanobiyoloji topluluğundaki mevcut teknoloji boşluğunu kapatma ve çekirdek mekanotransdüksiyonu ile hücre fonksiyonu arasındaki ilişkide var olan bilgi boşluğuna cevap verme potansiyeline sahiptir.
Giriş
Bu çalışma, mekanik kuvveti doğrudan hücre çekirdeğine uygulayan manyetik aktüatörler ile yapısal ve fonksiyonel hücre altı değişiklikleri aynı anda görüntüleyen konfokal floresan mikroskobu birleştirilerek çekirdek mekanobiyolojisini aydınlatmak için yeni bir teknik geliştirmeyi ve uygulamayı amaçlamaktadır. Hücreler, doku sertliği 1,2,3,4, interstisyel sıvı basıncı ve kesme gerilmesi 5,6,7, yüzey topolojisi / geometrisi 8,9,10,11,12 ve gerilim / sıkıştırma gerilimi 13,14 dahil olmak üzere hücre dışı biyofiziksel sinyalleri algılar. 15,16. Biyofiziksel sinyaller biyokimyasal sinyallere dönüştürülür ve gen ekspresyonunun ve hücre davranışlarının potansiyel aşağı akış değişikliklerini tetikler - mekanotransdüksiyon 17,18,19,20,21,22,23,24,25,26,27 olarak bilinen bir süreç . Mekanotransdüksiyon süreçlerini incelemek için, atomik kuvvet mikroskobu 28, hücre germe cihazı29, biyo-MEMS (mikro-elektromekanik sistemler) kuvvet sensörü 15,30,31, kesme reolojisi32 ve StereoGörüş Sistemi 33 gibi hücrelere mekanik kuvvet uygulamak için sayısız teknik geliştirilmiştir. . Yakın tarihli bir derleme, hücre dışı mekanik ipuçlarını uygulamak ve mekanosensing'e müdahale etmek için yaklaşımları özetlemektedir34. Bugüne kadar, bu yöntemlerin çoğu hücre plazma zarına kuvvet uygular ve hücreler bu hücre dışı biyofiziksel sinyalleri doğrudan integrin, kadherin, iyon kanalları ve G-Proteini bağlı reseptörler gibi membran reseptörleri aracılığıyla alırlar. Daha sonra, sinyali hücre içi hücre iskeletine ve çekirdeğe iletir. Örneğin, mekano-algılamanın bir göstergesi olarak evet ilişkili protein (YAP) translokasyonu kullanılarak, hücrelerin substrat sertliğinin ve hücre dışı gerilimin mekanik sinyallerini hücre zarından algıladıkları ve YAP sitoplazmasından çekirdeğe translokasyonunu indüklemek için bunları hücre iskeletinden çekirdeğe ilettikleri gösterilmiştir28,35.
Son kanıtlar, hücre çekirdeğinin kendisinin bağımsız bir mekano-sensör 8,36,37 olduğunu göstermektedir. Bu, hücrelerden toplanan izole çekirdek üzerinde yapılan deneylerle kanıtlanmıştır; burada çekirdeklerin, doğrudan üzerlerine uygulanan mekanik kuvvete yanıt olarak sertliklerini adaptif olarak değiştirdiği ortaya çıkmıştır36. Birçok fizyolojik durumda, hem tümör hem de sağlıklı hücrelerdeki çekirdekler hücre dışı biyofiziksel sinyalleri algılar ve mekanik özelliklerini ve düzeneklerini değiştirir38,39,40. Örneğin, ekstravazasyon üzerine, tümör hücrelerinin nükleer sertliği azalır ve 24 saat38'in üzerinde yumuşaklığı korur. Kapalı interstisyel boşluktan göç sırasında, tümör hücrelerinin çekirdekleri sıklıkla yapısal bütünlüklerini kaybeder ve geri kazanır39. Bununla birlikte, çekirdeğin biyofiziksel sinyali algılama şekli bilinmemekle birlikte, Lamin Klima ve nükleoskeleton ve sitoiskelet (LINC) kompleksi 38,41'in bağlayıcısı gibi çeşitli nükleer zarf proteinleri ve protein ailelerinin dahil olduğu bulunmuştur. Bu nedenle, çekirdeğe doğrudan kuvvet uygulayabilen yeni invaziv olmayan yöntemler, kuvvet iletiminin etkisini hücre-plazma zarından ve sitoiskeletten ayıracak ve nükleer mekano-algılamanın daha önce erişilemeyen moleküler mekanizmalarını aydınlatmaya yardımcı olacaktır.
Organel 42'yi manipüle etmek için optik cımbız kullanan ve hücrelere enjekte edilen mikroboncuklar43'ü kullanan araştırmalar, çekirdeğe doğrudan kuvvet uygulamanın teknolojik yeteneğini gösterdi. Bununla birlikte, optik-cımbız tekniğinin birkaç sınırlaması vardır: (1) düşük verimli optik cımbız genellikle bir seferde yalnızca bir hücreyi veya mikroboncuğu manipüle eder; ve (2) nükleerin potansiyel fotohasarı ve sıcaklık artefakt-deformasyonu onlarca pN36 gerektirir ve karşılık gelen gerekli lazer gücü pN44,45 başına yaklaşık 10 mW'dir. Bu tür lazer yoğunluğu, hücrelerdeki fotohasarı tetiklemek ve deney46 sırasında hücre fonksiyonlarını bozmak için yeterlidir.
Canlı hücrelerdeki mikroboncuklar yoluyla uygulanan manyetik kuvvet, çekirdeğe doğrudan kuvvet uygulama potansiyelini gösterir ve optik cımbızların sınırlamalarının üstesinden gelir. Mikroboncuklar sitoplazmaya verildikten sonra, manyetik bir alan aynı anda yüksek verimli bir şekilde birden fazla mikroboncuk üzerinde manyetik bir kuvvet uygulayabilir. Manyetik alan hücre fonksiyonlarını etkilemez47, ancak pN'den nN'ye kuvvet üretir, bu da nükleer deformasyonu indüklemek için yeterlidir 36,48,49. Bugüne kadar, manyetik mikroboncukların manipülasyonu hücre plazma zarı48, sitoplazma50 içinde, F-aktin51, çekirdek47 içinde ve izole çekirdek36 üzerinde uygulanmıştır. Bununla birlikte, mikroboncukların manyetik manipülasyonu, çekirdekteki mekanotransdüksiyonu incelemek için nükleer zarf üzerine doğrudan mekanik kuvvet uygulamak için hiçbir zaman kullanılmamıştır.
Bu yazıda, manyetik mikroboncukları sitoplazmaya invaziv olmayan bir şekilde iletmek ve bu mikroboncukları çekirdeğe mekanik kuvvet uygulamak için kullanmak için basit bir teknik geliştirilmiştir (Şekil 1). Burada, yöntemi doğrulamak için mNeonGreen21-10/11 etiketli YAP'ı endojen olarak eksprese eden CRISPR / Cas9 mühendisliği insan normal B2B hücre hatları kullanılır. YAP, mekanoya duyarlı bir proteindir ve YAP'ın translokasyonu nükleer mekano-algılama14,28 ile düzenlenir. Endojen YAP'ı floresan protein (FP) mNeonGreen21-10/11 ile etiketlemek için CRISPR / Cas9 tarafından düzenlenmiş knock-in yaklaşımı seçildi. CRISPR düzenlemesinin eksik verimliliğe ve hedef dışı etkiye sahip olduğu bilinmesine rağmen, önceki yayınlardaki protokoller, doğru açık okuma çerçevesi ekleme52,53,54'ü seçmek için floresan sıralamayı entegre etti. Bu ek seçim katmanıyla, daha önce 52,53,54,55 oluşturulan 20'den fazla hücre satırında hedef dışı etiketleme olayı gözlenmedi. Bu bölünmüş bir floresan protein yapısıdır, ancak prensip olarak, herhangi bir ifade edilebilir floresan etiketi kullanılabilir olabilir. Bu etiketleme yaklaşımı transgen veya antikor yöntemlerinden daha üstündür. İlk olarak, transgen ekspresyonundan farklı olarak, etiketli protein, tek kopyalı gen dozajını korur ve doğal gen düzenleyici ağın fizyolojik bağlamında, protein konsantrasyonundaki, lokalizasyonundaki ve etkileşimindeki sapmaları sınırlayarak ifade eder. Bu çalışmada kullanılan etiketleme yöntemi, tam FP etiketlemeden daha yüksek bir büyüklük sırasına göre daha yüksek verim ve verimlilik elde etmektedir. Ayrıca, fiksasyon artefaktları ve yüksek kaliteli, yüksek özgüllüklü antikorların sınırlı mevcudiyeti nedeniyle immünofloresan ile ilişkili zorlukları da önler. İkincisi, bu makalede kullanılan yaklaşım, hücre fizyolojisinde minimum bozulma sağlar ve tüm endojen YAP'ların gerçek zamanlı olarak ortaya çıkarılmasını sağlar. Buna karşılık, diğer yaygın transgen yöntemleri sıklıkla YAP'ın aşırı ekspresyonuna yol açar. Ortaya çıkan yapay dağılım potansiyel olarak sitotoksisiteye neden olabilir ve hücrelerin mekano-algılamasını etkileyebilir56,57,58.
Bu çalışma, sitoplazmaya verilen manyetik mikroboncuklar yoluyla çekirdeğe doğrudan kuvvet uygulamak ve eşzamanlı canlı hücre floresan görüntülemesi yapmak için bir protokol sunmaktadır. Özetle, burada sunulan protokoller, (1) çekirdeğin dışındayken manyetik mikroboncukların hücreye nasıl iletileceğini, (2) çekirdeğe manyetik kuvvet uygulamak için mikroboncukların nasıl manipüle edileceğini, (3) manipülasyon sırasında hücrelerin konfokal floresan görüntülemesinin nasıl gerçekleştirileceğini ve (4) kuvvet uygulama süreci boyunca YAP nükleer / sitoplazma (N / C) oranının nicel olarak nasıl analiz edileceğini göstermektedir. Sonuçlar, (1) endositoz yoluyla, manyetik mikroboncukların 7 saat içinde B2B hücrelerinin sitoplazmasına invaziv olmayan bir şekilde verilebileceğini göstermektedir (Şekil 2 ve Şekil 3); ve (2) doğrudan çekirdeğe uygulanan niceliksel manyetik kuvvet (Şekil 4, Şekil 5 ve Şekil 6) tek başına CRISPR/Cas9 mühendisliği B2B hücrelerinde YAP N/C oranının çeşitli değişikliklerini tetikleyebilir (Şekil 7 ve Şekil 8).
Protokol
1. CRISPR / Cas9 mühendisliği B2B hücrelerinin bakımı
- RPMI-1640'lı bir T25 şişesindeki kültür B2B hücreleri,% 10 fetal sığır serumu ve% 1 penisilin-streptomisin ile desteklenir.
- B2B hücrelerini nemlendirilmiş bir inkübatörde% 5 CO2 ile 37 ° C'de tutun.
- Alt kültür, B2B hücreleri, akıcılık% 70 ila% 80'e ulaştığında.
- B2B hücre hattını RPMI-1640 kültür ortamında, %10 (v/v) DMSO ile -80 °C dondurucuda saklayın.
- Deneylerde geçiş numarası 10'dan az olan B2B hücrelerini kullanın.
2. Hücre kültürü
- Hücreleri cam tabanlı bir Petri kabına tohumlayın.
- İçinde B2B hücreleri bulunan şişeyi inkübatörden biyogüvenlik kabinine taşıyın.
- Şişedeki kültür ortamını, vakum pompası bağlı aspire edici bir pipet kullanarak çıkarın.
- Şişeyi 2 mL fosfat tamponlu salin (PBS) ile yıkayın.
- Aspire edici pipeti kullanarak PBS'yi çıkarın.
- Hücreleri şişe substratının altından ayırmak için 0.5 mL% 0.05 Tripsin çözeltisi ekleyin.
- Şişeyi 5 dakika boyunca inkübatöre koyun.
- Şişeyi biyogüvenlik kabinine taşıyın. Şişeye 5 mL yeni kültür ortamı ekleyin ve çözeltiyi yukarı ve aşağı pipetleyin.
- Ortamın 50 μL'sini hücrelerle (300 hücre / μL) cam tabanlı Petri kabına koyun. Petri kabına 2 mL kültür ortamı ekleyin.
- Petri kabını inkübatöre yerleştirin. Hücrelerin bağlanması için 12 saat bekleyin.
- Manyetik mikroboncuklarla hücreleri kültürleyin.
- 0,2 g ağırlığında 7 μm ortalama çaplı karbonil demir mikroboncuklar (bundan böyle 7 μm mikroboncuklar olarak anılacaktır, Malzeme Tablosuna bakınız).
- Mikroboncukları 1 mL RPMI-1640 kültür ortamında askıya almak için bir pipet kullanın.
- B2B hücreli Petri kabını biyogüvenlik kabinine götürün.
- Petri kabına mikroboncuk içeren ortamın 200 μL'sini ekleyin.
NOT: Mikro boncukların çökelmesini önlemek için ortamı hızlı bir şekilde ekleyin. - Petri kabını, mikroboncuklar hücreler tarafından içselleştirilene kadar inkübatöre geri koyun. Farklı hücre hatları için içselleştirme için en uygun zamanı belirlemek üzere içselleştirmeyi her 6 saatte bir kontrol edin.
- İçselleştirmeyi kontrol etmek için, mikroboncuk, nükleer ve hücre sınırını görselleştirmek için konfokal floresan görüntüleme gerçekleştirin. Mikroboncuk hücre tarafından içselleştirilirse, hücre sınırı içinde olacaktır.
3. Çekirdeğin görselleştirilmesi
- İnkübatördeki kültür ortamının 1,5 mL'sini 15 dakika ısıtın.
- Biyogüvenlik kabininin ışığını kapatın. Hücreyi, ısıtılmış kültür ortamını, nükleer lekeyi ve Verapamil HCl'yi içeren Petri kabını biyogüvenlik kabinine alın.
NOT: Nükleer boyama bileşenleri ışığa duyarlıdır. Çalışma sırasında ışığa maruz kalmaktan kaçının. - DMSO ile 1000x nükleer lekeyi 100x'e kadar seyreltin.
- DMSO ile 100 mM Verapamil HCl'yi 10 mM'ye kadar seyreltin.
- 1,5 mL kültür ortamına 15 μL 100x nükleer leke ve 15 μL 10 mM Verapamil HCl ekleyin. Yukarı ve aşağı pipetle çekerek iyice karıştırın.
- Kültür ortamını Petri kabından çıkarın. Petri kabına nükleer boyama içeren kültür ortamını ekleyin.
- Hücreleri 2 saatten fazla bir süre boyunca inkübatöre geri koyun.
4. Manyetik kuvvet uygulama donanımının hazırlanması
- Tüm parçaları akrilonitril bütadien stiren (ABS) kullanarak 3D baskı yapın ve CAD tasarımını izleyerek birleştirin (Şekil 1A). CAD tasarımı Malzeme Tablosuna dahil edilmiştir.
- Mıknatısı mıknatıs hareket ettiren cihaza bağlamak için çift taraflı bant kullanın (Şekil 1A).
- Mıknatıs hareket ettirici cihazı mikroskop aşamasının yanına yerleştirin. Petri kabının üzerinde 13 mm ile 120 mm arasında hareket edene kadar mıknatısın uzamsal konumunu ayarlamak için üç düğmeyi kullanın.
NOT: Manyetik mikro boncuklar üzerinde istenmeyen kuvvet uygulanmasını önlemek için mıknatıs ve Petri kabı arasındaki mesafenin üst sınırının mümkün olduğunca büyük olduğundan emin olun. 120 mm, bu deney düzeneğindeki maksimum değerdir. Mıknatısın, hedefler ve motorlu aşamalar dahil olmak üzere mikroskop parçalarına müdahale etmediğinden emin olun. - Mıknatısı en yüksek z konumuna (120 mm'de) ayarlayın.
5. Zorla uygulama ve canlı hücre görüntüleme
- Uzun süreli görüntüleme için çevre odasının kurulması
- Çevre odasını iyice sterilize etmek ve temizlemek için% 75 etanol çözeltisi uygulayın.
- Çevre odasını ters çevrilmiş mikroskobun motorlu aşamasına yerleştirin.
- CO2 tankını açın ve CO2 giriş hızını 160 mL / dak'ya ayarlayın.
- Odanın sıcaklığını 44 °C (Üst), 42 °C (Banyo) ve 40 °C (Aşama) olarak ayarlayın.
- % 90 nemi korumak için çevre odasının banyosuna 20 mL arıtılmış su ekleyin.
- Hedef hücreleri içeren cam tabanlı Petri kabını doku kültürü inkübatöründen çıkarın ve odaya yerleştirin.
- Petri çanağı konumunu sabitlemek için çevre odasının metal kelepçesini uygulayın.
NOT: Petri kabı haznede sıkıca kenetlenmelidir, çünkü manyetik kuvvet kelepçelenmezse çanağı hareket ettirebilir. - Odanın kapağını kapatın.
- Görüntüleme parametrelerinin optimizasyonu
- İğne deliği boyutunu optimize edin: İğne deliği, odak dışı fotonları engeller. Daha büyük bir iğne deliği boyutu, daha fazla odak dışı foton verir, ancak daha parlak bir görüntü verir. Daha küçük bir iğne deliği boyutu, daha odaklanmış ve daha kısık bir görüntü sağlar. Uygun sinyal-gürültü oranına sahip odak içi konfokal görüntüler elde etmek için iğne deliği boyutunu optimize ettiğinizden emin olun.
- Lazer yoğunluğunu optimize edin: Lazer yoğunluğu, uyarılma yoğunluğunu ve dolayısıyla emisyon ışığını belirler. Düşük lazer yoğunluğu, düşük sinyal-gürültü oranı sağlar. Çok yüksek bir lazer yoğunluğu fotobeyazlatmaya neden olur. Lazer yoğunluğunu buna göre ayarlayın.
- Adım boyutunu ve adımlarını optimize edin: Adımlar ve adım boyutu, bir Z-yığınında kaç görüntü alacağını belirler. Daha küçük adım boyutları ve daha fazla adım, Z-yığını çözünürlüğünü artıracak, ancak aynı zamanda fotobeyazlatmayı da artıracaktır. Bu deneyde, ~15 μm hücre yüksekliğine sahip hücreler için 1 μm adım boyutu kullanılmıştır.
- Maruz kalma süresini optimize edin: Maruz kalma süresi, hücrenin uyarma lazerine ne kadar süre maruz kalacağını belirler. Düşük pozlama süresi sinyal-gürültü oranını azaltacaktır. Yüksek pozlama süresi fotobeyazlatmaya neden olur. Bu deneyde 4 sn'de 1 karelik bir pozlama süresi kullanılmıştır.
- Görüntüleme parametrelerinin optimizasyonu: Dört parametreden birini yinelemeli olarak değiştirin ve diğer parametreleri tutarlı tutun. Her seferinde, her görüntünün YAP N / C oranını ölçün ve fotobeyazlatma seviyesini belirlemek için YAP N / C oranı değişimini karşılaştırın. Sinyal-gürültü oranı, görüntüleme hızı ve fotobeyazlatma arasında bir denge kurana kadar optimizasyon işlemini tekrarlayın.
- Deneyler sırasında daha hızlı görüntüleme ayarları için optimize edilmiş görüntüleme parametrelerini kullanarak görüntüleme yapılandırmalarını tanımlayın.
NOT: Bu çalışmada kullanılan konfigürasyonlar görüntüleme parametrelerinin 5.3. bölümünde açıklanmıştır. Bölüm 5.3'teki konfigürasyonların görüntüleme parametrelerini optimize etmek için, adım 5.2.5'teki yöntemle aynı yöntemi kullanın.
- Küçük kuvvet uygulaması ve konfokal görüntüleme
NOT: Bu çalışmada görüntüleme için Nikon Ti2-E mikroskobu kullanılmıştır ve görüntü elde etmek için ayrıntılı adımlar aşağıda verilmiştir.- Ters çevrilmiş mikroskobu açın. Elements yazılım uygulamasını açın.
- Yapılandırma magnetic_find tanımlayın. Yalnızca FITC kanalını kontrol edin. PMT HV = 70, Ofset = 0, Lazer yoğunluğu = 10 olarak ayarlayın. 1/2 düğmesine tıklayarak tarama hızını 2 sn'de 1 kareye ayarlayın. 1,2 A.U. düğmesine tıklayarak iğne deliği boyutunu 1,2 AU olarak ayarlayın. Bu yapılandırma adım 5.3.5'te kullanılacaktır.
- Yapılandırma magnetic_YAP_Nucleus tanımlayın. FITC kanalını kontrol edin. PMT HV = 70, Ofset = 0, Lazer yoğunluğu = 10 olarak ayarlayın. 1 /2 düğmesine tıklayarak tarama hızını 4 sn'de 1 kareye ayarlayın. 1,2 A.U. düğmesine tıklayarak iğne deliği boyutunu 1,2 AU olarak ayarlayın. Çekirdek sınırını ve nükleer leke yoğunluğunu görüntülemek için Cy5 kanalını kontrol edin. PMT HV = 70, Ofset = 0, Lazer yoğunluğu = 10 olarak ayarlayın. İğne deliği boyutu 3D YAP görüntüleme için optimize edilmiştir. Cy5 kanalını kontrol ettikten sonra 1.2 A.U . düğmesine tekrar tıklamayın. Bu yapılandırma adım 5.3.7'de kullanılacaktır.
- Gerekirse Elements üzerinden DIA'yı açın. SpinView'i açın, parlak bir alan kullanın ve hücrelerin net bir odak içi görüntüsünü elde etmek için nesnenin odağını ayarlayın. Üç koşulda uygun çoklu tek hücreleri bulmak için 10x hedefi kullanın: içinde tek bir mikroboncuk ile, içinde birden fazla mikroboncuk ile ve içinde herhangi bir mikroboncuk olmadan. 40x hedefine geçin. Bu pozisyonu uygun pozisyon numarasıyla adlandırın.
- Elements'ı açın. magnetic_find tıklayın. Kilidi Kaldır düğmesini tıklayın.
- Tara'yı tıklatın ve odak düzleminin Z-konumunu ayarlayın. Seçili hücrelerin Z yığını için alt ve üst sınırı ayarlamak üzere Üst ve Alt düğmelerini tıklatın. Tara'yı tekrar tıklatarak taramayı durdurun.
- magnetic_YAP_Nucleus yapılandırmasına geçin. Dosya adını before_small_force.nd2 olarak ayarlayın. Kaydedilen Z-yığını ile Çalıştır düğmesine tıklayın.
- Sağ ışık yoluna geçin ve DIA'yı açın. SpinView'i açın ve Kayıt düğmesine tıklayın. Bu arada, mıknatısı Petri kabının tabanından 46 mm yukarıya doğru hareket ettirmek için mıknatıs hareket ettiren cihazın düğmesini döndürün. Parlak alan görüntü dizisini veya videoyu kaydedin. Mikroboncukların manyetik kuvvetin neden olduğu yer değiştirmeyi gösterdiğini doğrulamak için videoyu kontrol edin.
- 5.3.5-5.3.7 arasındaki adımları yineleyin; dosya adını after_small_force.nd2 olarak ayarlayın.
- Sağ ışık yoluna geçin ve DIA'yı açın. Ardından, SpinView'i açın ve Kayıt düğmesine tıklayın. Bu arada, mıknatısı Petri kabının tabanından 120 mm yukarıya taşımak için mıknatıs hareket ettiren cihazın düğmesini döndürün. Parlak alan görüntü dizisini veya videoyu kaydedin.
- 5.3.5-5.3.7 arasındaki adımları yineleyin ve dosya adını before_large_force.nd2 olarak ayarlayın.
- Büyük kuvvet uygulaması ve konfokal görüntüleme
- Mıknatısın Petri kabı tabanının 13 mm yukarısına ulaşmasını sağlamak için çevre odasının kapağını çıkarın.
- Sağ ışık yoluna geçin ve DIA'yı açın. SpinView'i açın ve Kayıt düğmesine tıklayın. Bu arada, mıknatısı Petri kabının tabanından 13 mm yukarıya doğru hareket ettirmek için mıknatıs hareket ettiren cihazın düğmesini döndürün. Parlak alan görüntü dizisini veya videoyu kaydedin. Mikroboncukların manyetik kuvvetin neden olduğu yer değiştirmeyi gösterdiğini doğrulamak için videoyu kontrol edin.
- 5.3.5-5.3.7 arasındaki adımları yineleyin ve dosya adını after_large_force.nd2 olarak ayarlayın.
- Sağ ışık yoluna geçin ve DIA'yı açın. Ardından, SpinView'i açın ve Kayıt düğmesine tıklayın. Bu arada, mıknatısı Petri kabının tabanından 120 mm yukarıya taşımak için mıknatıs hareket ettiren cihazın düğmesini döndürün. Parlak alan görüntü dizisini veya videoyu kaydedin.
- 5.3.5-5.3.7 arasındaki adımları yineleyin; dosya adını retract_large_force.nd2 olarak ayarlayın.
- Çevre odasının kapağını kapatın.
- Gerekirse daha fazla veri elde etmek üzere birden çok görünüm alanı için 5.2 ve 5.3 numaralı adımları yineleyin.
6. Görüntü işleme ve veri analizi
- YAP N/C oranının ölçülmesi
- Fiji ImageJ'yi açın. Adım 5'te çekilen .nd2 görüntülerini açın.
- Analiz Et > Ölçümleri Ayarla'ya tıklayın. Alanı, entegre yoğunluğu, ortalama gri değeri ve şekil tanımlayıcılarını kontrol edin.
- Çekirdeği tanımlamak için Cy5 kanalını kullanın. Çekirdeği özetlemek üzere serbest seçim aracını kullanmak için Serbest El Seçimleri'ne tıklayın. Ayrıca, ImageJ'deki otomatik nükleer maske makrosunu kontrol edin ( bkz.
- FITC kanalında Analiz > Ölçü'yü tıklayın. Ortalamanın ölçülen değeri, ortalama nükleer YAP yoğunluğu DN'dir.
- Çekirdeği tanımlamak için Cy5 kanalını kullanın. Hücreyi tanımlamak için FITC kanalını kullanın. Sitoplazma içinde ilgilenilen bir bölgeyi seçmek ve manyetik mikroboncuklardan kaçınmak üzere serbest seçim aracını kullanmak için Serbest El Seçimleri'ni tıklayın. Bu ilgi alanı çekirdeği içermemelidir.
- FITC kanalında Analiz > Ölçü'yü tıklayın. Ortalamanın ölçülen değeri, ortalama sitoplazmik YAP yoğunluğu DC'dir.
- YAP N/C oranını = DN / DC'yi hesaplayın.
- Nükleer şeklin ve normalleştirilmiş nükleer leke yoğunluğunun ölçülmesi
- Fiji ImageJ'yi açın. Adım 5'te çekilen .nd2 görüntülerini açın.
- Analiz Et > Ölçümleri Ayarla'ya tıklayın. Alanı, entegre yoğunluğu, ortalama gri değeri ve şekil tanımlayıcılarını kontrol edin.
- Çekirdeği tanımlamak için Cy5 kanalını kullanın. Çekirdeği özetlemek üzere serbest seçim aracını kullanmak için Serbest El Seçimleri'ne tıklayın.
- Cy5 kanalında Analiz > Ölçü'ye tıklayın. Ortalamanın ölçülen değeri nükleer leke yoğunluğudur. Circ'in ölçülen değeri. nükleer döngüselliktir.
- Nükleer leke yoğunluğunu farklı kuvvet durumunda karşılaştırmak için, tüm nükleer leke yoğunluğu, normalleştirilmiş nükleer leke yoğunluğunu üretmek için "before_small_force.nd2" deki nükleer leke yoğunluğuna bölünür.
Sonuçlar
Mıknatıs hareket ettirici bir cihazın tasarımı ve manyetik kuvvet uygulaması
Manyetik mikroboncuklar aracılığıyla çekirdeğe kuvvet uygulamak için, mıknatısın uzamsal konumunu kontrol etmek için mıknatıs hareket ettirici bir cihaz tasarlanmış ve üretilmiştir. Mıknatıs hareket ettiren cihaz, bağlı mıknatısı döngü başına 1,59 mm'lik uzamsal çözünürlükte bağımsız olarak x, y ve z yönlerinde hareket ettirmek için merkezi bir çerçeve, üç düğme ve raylar içerir (Şekil 1A). Mıknatıs, hücrelere verilen 7 μm mikroboncuklara yaklaştırıldığında (Şekil 1B), mikro boncukları manyetik olarak çeker ve çekirdeğe kuvvet uygular (Şekil 1C). Kuvvet yönü ve büyüklüğü, mıknatıs ve mikroboncuklar arasındaki göreceli konum tarafından kontrol edilir.
Bu yazıda, mikroboncuklara iki farklı kuvvet büyüklüğü uygulanmıştır: (1) mıknatıs hücrenin 46 mm yukarısına yerleştirildiğinde nispeten küçük bir kuvvet; ve (2) mıknatıs hücrenin 13 mm yukarısına yerleştirildiğinde nispeten büyük bir kuvvet. Mikroboncuk F'ye uygulanan manyetik kuvvetdenklem 59 ile hesaplanabilir:  , burada Nd manyetiksizleştirme faktörüdür (bir küre için 0.33), μ bir vakumda geçirgenliktir (demir için 6.3 × 10-3H / m), Vp mikroboncuk hacmidir (7 μm mikroboncuk için 178 μm3), ve H, A / m birimi ile manyetik alan yoğunluğudur. H, Tesla birimi ile manyetik akı yoğunluğu B ile orantılıdır. Tek bir 7 μm mikroboncuk üzerine etki eden manyetik kuvvetin son derece küçük olması ve bir kuvvet dönüştürücü tarafından tespit edilmesi zor olması beklendiğinden, referans olarak manyetik akı yoğunluğu B, mikroboncuklara uygulanan manyetik kuvvetin büyüklüğünü belirtmek için ölçülmüştür. Manyetik akı yoğunluğunu ölçmek için Petri kabının tabanının bulunduğu yere bir Hall sensörü tanıtıldı ve mıknatıs, Petri kabının tabanından 13 mm veya 46 mm mesafeye yerleştirildi. 7 μm mikroboncuklar manyetik alanı etkilediğinden, manyetik akı yoğunluğu mikroboncuklarla ve mikroboncuklar olmadan ölçüldü. 7 μm mikroboncukların varlığından bağımsız olarak, aynı manyetik akı yoğunluğu elde edildi: 13 mm mesafede B = 60.1 mT ve 46 mm mesafede B = 3.7 mT. Bu ölçüm, 7 μm mikroboncukların 12.7 mm çapında ve 12.7 mm yüksekliğinde silindirik mıknatıs tarafından üretilen manyetik alan üzerindeki etkisinin (Malzeme Tablosuna bakınız) bu çalışmada kullanılan Hall sensörü tarafından tespit edilemediğini göstermektedir. Bununla birlikte, 13 mm mesafeli kasadaki manyetik akı yoğunluğu, 46 mm mesafeye sahip olandan yaklaşık 16 kat daha yüksekti. Manyetik kuvvetin deneysel kalibrasyonu aşağıdaki bölümde açıklanmıştır (Şekil 6).
, burada Nd manyetiksizleştirme faktörüdür (bir küre için 0.33), μ bir vakumda geçirgenliktir (demir için 6.3 × 10-3H / m), Vp mikroboncuk hacmidir (7 μm mikroboncuk için 178 μm3), ve H, A / m birimi ile manyetik alan yoğunluğudur. H, Tesla birimi ile manyetik akı yoğunluğu B ile orantılıdır. Tek bir 7 μm mikroboncuk üzerine etki eden manyetik kuvvetin son derece küçük olması ve bir kuvvet dönüştürücü tarafından tespit edilmesi zor olması beklendiğinden, referans olarak manyetik akı yoğunluğu B, mikroboncuklara uygulanan manyetik kuvvetin büyüklüğünü belirtmek için ölçülmüştür. Manyetik akı yoğunluğunu ölçmek için Petri kabının tabanının bulunduğu yere bir Hall sensörü tanıtıldı ve mıknatıs, Petri kabının tabanından 13 mm veya 46 mm mesafeye yerleştirildi. 7 μm mikroboncuklar manyetik alanı etkilediğinden, manyetik akı yoğunluğu mikroboncuklarla ve mikroboncuklar olmadan ölçüldü. 7 μm mikroboncukların varlığından bağımsız olarak, aynı manyetik akı yoğunluğu elde edildi: 13 mm mesafede B = 60.1 mT ve 46 mm mesafede B = 3.7 mT. Bu ölçüm, 7 μm mikroboncukların 12.7 mm çapında ve 12.7 mm yüksekliğinde silindirik mıknatıs tarafından üretilen manyetik alan üzerindeki etkisinin (Malzeme Tablosuna bakınız) bu çalışmada kullanılan Hall sensörü tarafından tespit edilemediğini göstermektedir. Bununla birlikte, 13 mm mesafeli kasadaki manyetik akı yoğunluğu, 46 mm mesafeye sahip olandan yaklaşık 16 kat daha yüksekti. Manyetik kuvvetin deneysel kalibrasyonu aşağıdaki bölümde açıklanmıştır (Şekil 6).
Manyetik mikroboncukların sitoplazmaya verilmesi
Cam tabanlı Petri kabındaki hücrelerin tohumlanmasından 12 saat sonra, kültür ortamına 7 μm mikroboncuk eklenir. Mikroboncuklar hücreler tarafından kendiliğinden içselleştirilir. Mikroboncuklar FITC veya Cy5 kanalında lazer uyarımı altında floresan yaymadığından, içselleştirilmiş mikroboncukların yeri, YAP ve çekirdeğin floresansının konfokal görüntülenmesi ile karanlık oyuğun yeri ile tanımlanabilir. Hem 2D hem de 3D görüntüler, mikroboncuğun çekirdeğin dışındayken sitoplazmada olduğunu göstermektedir (Şekil 2).
Mikroboncukların hücrelere içselleştirme seviyeleri, hücrelerin ve mikro boncukların ortak kültürünün süresine bağlıdır. Böylece, hücreler içselleştirilmiş mikroboncukların miktarına göre üç tipe ayrıldı - mikroboncuksuz, tek mikroboncuklu ve çoklu mikroboncuklar (Şekil 3A). Ko-kültürün 7 saatinde, hücrelerin% 62'si mikroboncuk içmedi, hücrelerin% 15'i tek bir mikroboncuk içselleştirildi ve hücrelerin% 23'ü çoklu mikroboncukları içselleştirdi (toplam hücre sayısı = 13). Ko-kültürün 12 saatinde, hücrelerin% 53'ü mikroboncuk içmedi, hücrelerin% 26'sı tek bir mikroboncuk içselleştirildi ve hücrelerin% 21'i çoklu mikroboncukları içselleştirdi (toplam hücre sayısı = 62). Ko-kültürün 24 saatinde, hücrelerin% 20'si mikroboncuk içmedi, hücrelerin% 28'i tek bir mikroboncuk içselleştirildi ve hücrelerin% 53'ü çoklu mikroboncukları içselleştirdi (toplam hücre sayısı = 40) (Şekil 3B).
Sitoplazmadaki mikroboncuklar nükleer şekli ve YAP aktivitesini etkilemez
Mikroboncukların içselleştirilmesinin nükleer şekil ve protein aktivitesi üzerindeki etkisini incelemek için, nükleer şekil öncelikle dairesellik ve YAP aktivitesi sırasıyla YAP N/C oranı ile ölçülmüştür. Dairesellik, Dairesellik = 4μ (alan / çevre2) ile hesaplanır. YAP N/C oranını ölçmek için ayrıntılı adımlar önceki bir yayın60'ta açıklanmıştır. Kısaca YAP N/C oranı, çekirdekteki ortalama YAP yoğunluğunun sitoplazmadaki ortalama YAP yoğunluğuna bölünmesiyle hesaplanmıştır. Mikroboncukların ve hücrelerin ortak kültürünün içselleştirilmemiş olsa bile nükleer şekli etkileyebileceği ihtimali göz önüne alındığında, ko-kültürsüz hücreler (siyah noktalar, kontrol #1, Dairesellik = 0.806 ± 0.037, n = 20), mikroboncuklarla birlikte kültürlenmiş ancak içselleştirme yapılmamış hücreler (gri noktalar, kontrol #2, Dairesellik = 0.806 ± 0.035, n = 22), tek mikroboncuk içselleştiren hücreler (kırmızı noktalar, tek mikroboncuk, Dairesellik = 0.793 ± 0.048, n = 15) ve çoklu mikroboncukları içselleştiren hücreler (mavi noktalar, çoklu mikroboncuklar, n = 7) (Şekil 3C) karşılaştırıldı. Sonuç, test edilen dört grup arasında nükleer döngüselliğin anlamlı bir farkı olmadığını göstermektedir (Şekil 3C).
Daha sonra, YAP N/C oranının mikroboncukların içselleştirilmesinden etkilenip etkilenmediğini incelemek için, mikroboncuklarla birlikte kültürlenmiş ancak içselleştirme yapılmamış hücreler (gri noktalar, kontrol #2, YAP N/C oranı = 1.155 ± 0.074, n=35) sadece tek veya çoklu mikroboncuk içselleştirmesi olan hücrelerle (kırmızı noktalar, mikroboncuklu hücre, YAP N/C oranı = 1.140 ± 0.078, n = 36) ortak kültürün 12. saatinde (Şekil 3D). Ko-kültürü olmayan hücreler karşılaştırılmamıştır, çünkü mikroboncuklu çanak daha düşük hücre yoğunluğu gösterir, bu da YAP N / C oranınıetkileyebilir 12. Sonuç, iki grup arasındaki YAP N/C oranında anlamlı bir fark (p değeri = 0.667) göstermeyerek, mikroboncukların içselleştirilmesinin YAP aktivitesini etkilemediğini göstermektedir (Şekil 3D).
Manyetik kuvvet çekirdeği deforme eder
İlk olarak, çekirdeğin deformasyonu gösterilir. Çekirdeğin deformasyonu, sitoiskelet içeren hücrelerde mikroboncukların (Şekil 4A ve Şekil 4A1-3) uyguladığı sıkıştırma kuvvetinden kaynaklanır. Bu veriler (yani, mikroboncuğun sıkışmasıyla deforme olan çekirdek), mikroboncuğun gerçekten de kalabalık sitoplazmadaki çekirdeğe bir kuvvet uyguladığını desteklemektedir. Kuvvet uygulama sürecini gösteren parlak alan videosu ek materyale dahil edilmiştir (Ek Video 1). İkincisi, mikroboncukların aynı anda çevredeki sitoiskelete kuvvet uygulaması ve çekirdeği dolaylı olarak deforme etmesi mümkün olduğundan, kompresyon deneyleri bozulmuş aktin filamentlerine sahip hücrelerde tekrarlanmıştır (SitoD tedavisi (2.5 μM, 1 saat); Şekil 4B). Bu çalışma, aktin filamentlerinin gerçekten depolimerize olduğunu (Şekil 4B) ve çekirdeğin mikroboncuklar tarafından deforme olduğunu göstermektedir (Şekil 4B1-3). Bu veriler, mikroboncukların, iç içe geçmiş çevre sitoiskeletinin yokluğunda doğrudan çekirdeğe bir kuvvet uyguladığını desteklemektedir. Toplu olarak, bu veriler protokollerin ve araçların doğrudan çekirdeğe bir kuvvet uygulayabileceğini göstermektedir.
Hücre içi manyetik mikroboncukların mekansal ve zamansal kontrolü
Mikroboncukların mekansal kontrolünü sağlamak için, mikroboncuğu hareket ettirmek ve girintinin çekirdek üzerindeki yerini kontrol etmek için bir çift mıknatıs kullanılmıştır (Şekil 5A). Boncuk sadece 2,2 μm'ye kadar yer değiştirme ile hareket ettirilebilir (Şekil 5A1-4), ancak karşılık gelen yerlerde çekirdeğe esnek bir şekilde girinti uygulayabilir. Çevreleyen aktin sitoiskeleti mikroboncukların hareketini kısıtlayabilir. Bu nedenle, aktin sitoiskeleti SitoD tedavisi (2.5 μM, 1 saat) ile bozuldu ve mikroboncuk lokalizasyonu manipüle edildi ancak benzer sonuçlar gösterdi. Bu nedenle, bir hipotez önerilebilir: mikroboncuk, sitoplazmadaki çekirdek ve diğer çevreleyen organellere fiziksel / kimyasal olarak bağlanabilir, bu da büyük uzamsal hareketini kısıtlar (>2.2 μm).
Mikroboncukların mekansal kontrolünü sağlamak için, mikroboncukları çekirdeğin aynı yerinde kuvveti iki kez (farklı kuvvet büyüklüğünde) uygulamak ve serbest bırakmak için kontrol eden bir çift mıknatıs kullanılmıştır (Şekil 5B ve Şekil 5B1-B4). Bir kuvvet uygulama ve serbest bırakma döngüsü için geçerli zaman süresi 12 sn'dir. Zamansal kontrolün hızı, XYZ taşıyıcının çalışma hızına göre belirlenir.
Manyetik kuvvetin kalibrasyonu
Çekirdeğe uygulanan boncuk kuvveti, çekirdeğin benzer bir deformasyonuna neden olan kalibre edilmiş bir atomik kuvvet mikroskobu (AFM) tarafından uygulanan kuvveti deneysel olarak ölçerek tahmin edildi. Spesifik olarak, aktin sitoiskeleti ilk olarak SitoD (2.5 μM; 1 saat, Şekil 4B) tarafından çözüldü, çünkü AFM hücrenin apikal yüzeyine kuvvet uygular ve aktin korteks ve sitoiskeletin çıkarılması AFM ucu ile hücre çekirdeği arasında daha doğrudan temasa izin verir. Aktin korteksi ve sitoiskeleti çözünmüş olan hücreler, nükleer şekil ve nükleer boyama yoğunluğunun sağlıklı hücrelerdekilerle karşılaştırılmasına dayanarak canlıdır (Ek Şekil 1). İkincisi, mikroboncuklarınkine benzer bir boyut ve şekle sahip olan işlevselleştirilmemiş AFM ucu (yarı küresel, yarıçap = 5 μm), hücrenin apikal yüzeyini kuvvet kontrollü bir şekilde girintilemek ve aynı anda hücre ve çekirdek cisimlerinin 3D konfokal görüntülerini elde etmek için kullanılmıştır (Şekil 6A). Basınç kuvvetinin 0.8 nN'den 2.0 nN'ye kadar olan büyüklüğü seçildi, çünkü literatür24'e dayanarak, 1.5 nN büyüklüğündeki kuvvetin çekirdeği yeterince deforme ettiği biliniyordu. Üçüncüsü, AFM girintisinin neden olduğu çekirdeğin normal deformasyonu kantitatif görüntüleme analizi ile ölçüldü. Ayrıca, nicel AFM kuvvet-yer değiştirme ilişkisini sağlayan kalibrasyon eğrisi (Şekil 6B) elde edilmiştir. Dördüncüsü, benzer boyut ve şekle sahip mikro boncukları kontrol ederek çekirdeğin yanal yüzeyine bir basınç kuvveti uygulandı (yarıçap = 7 μm; Şekil 6C) ve nükleer membranın deformasyonu görüntüleme analizi ile ölçüldü. Boncukların uyguladığı kuvvet, AFM kuvvet-yer değiştirme ilişkisine dayanarak tahmin edilir.
Örneğin, Şekil 6C'de, manyetik mikroboncukların (çap = ~ 7 μm) neden olduğu çekirdeğin 'büyük kuvvette' deformasyonu yaklaşık 1.5 μm'dir. Şekil 6D'de, 1.5 μm nükleer deformasyon elde etmek için çekirdeğin üstündeki hücreyi girintilemek için 5 μm yarı küresel probu olan bir AFM ucu kullanılmıştır. AFM tarafından kaydedilen karşılık gelen kuvvet 1.4 nN'dir. Bu nedenle, mikroboncuklar tarafından uygulanan kuvvetin ~ 1.4 nN olduğu tahmin edilmektedir. Aynı yaklaşımı takiben, 'küçük kuvvet'teki manyetik kuvvet 0.8 nN olarak kalibre edilir ve 0.4 μm nükleer girintiye neden olur.
Bu çalışma, AFM tarafından ölçülen kuvvetin, aşağıdaki varsayımlara dayanarak mikroboncuk uygulanan kuvveti temsil edebileceğini düşünmektedir: (1) Farklı hücrelerdeki çekirdeğin sertliği benzerdir. (2) Çekirdeğin mekanik özellikleri, girintinin uygulandığı nükleer bölgelere bağlı değildir. Manyetik kuvvet çekirdeğin yanal taraflarına yatay olarak uygulanırken, AFM kuvveti çekirdeğin apikal taraflarına dikey olarak uygulanır. Aralarındaki mekanik farkın ihmal edilebilir olduğu varsayılır. (3) AFM deneylerinde, prob doğrudan hücre zarı ve hücre iskeleti yoluyla çekirdeğe kuvvet uygular. Aktin filamentlerini bozduktan sonra, çekirdeğe uygulanan AFM uygulanan kuvvet, önceki durumda AFM probu ile çekirdek arasında hala bulunan zara rağmen, çekirdeğe uygulanan mikroboncukların uyguladığı kuvvete benzer.
Manyetik kuvvet YAP N/C oranının değişimini tetikler
Mikroboncuklara uygulanan manyetik kuvvetin çekirdeği deforme edebileceğini ve YAP translokasyonunu indükleyebileceğini kanıtlamak için, mikroboncuk içselleştirmeli hücrelerin YAP N / C oranı üç aşamada ölçülmüştür: (1) kuvveti uygulamadan önce, (2) kuvveti uyguladıktan sonra ve (3) kuvveti serbest bıraktıktan sonra. Bazı hücreler, kuvvet uygulandığında veya serbest bırakıldığında nükleer şekil ve YAP N/C oranında bir değişiklik gösterdi (Şekil 7A,C). YAP'daki yoğunluk değişiklikleri iki olası mekanizma ile atfedilebilir: (1) YAP-FP proteinleri, kuvvet uygulamasından sonra sitoplazmadan çekirdeğe dönüşür. Bu durumda, nükleer boyama sinyal değişikliği göstermemelidir. Nükleer boyama yoğunluğu büyük ölçüde değişmemelidir; (2) YAP-FP proteinleri kuvvet uygulamasından sonra yer değiştirmez. Gözlenen YAP yoğunluk değişiklikleri, kuvvet kaynaklı nükleer hacim değişiminden ve bunun sonucunda ortaya çıkan YAP-FP konsantrasyon değişiminden kaynaklanmaktadır. Bu durumda, nükleer boyama yoğunluğu, YAP nükleer yoğunluğu ile benzer bir eğilimde değişmelidir, çünkü boyama boyasının konsantrasyonu, çekirdek hacmi değiştikçe de değişir. Bu nedenle kırmızı kanaldan kaynaklanan nükleer boyama yoğunluğu değişimi (uyarma: 650 nm; emisyon: 681 nm) ölçüldü. Yeşil kanalda YAP'da yoğunluk değişir, ancak kırmızı kanalda çekirdek boyamasında yoğunluk değişikliği yoktur. Bu nedenle, ilk mekanizma muhtemelen mevcuttur (Şekil 7B). Toplu olarak, sonuçlar manyetik kuvvet kaynaklı nükleer deformasyonun YAP translokasyonunu tetiklediğini göstermektedir.
Daha sonra, YAP N / C oranının net değişimi iki hücre grubu içinde ölçüldü: (1) içselleştirilmiş mikroboncuksuz hücreler (gri noktalar, kontrol, n = 9); ve (2) YAP N/C oranının değişimini gösteren içselleştirilmiş mikroboncuk(lar)a sahip seçilmiş hücreler (küçük kuvvet için yeşil noktalar, büyük kuvvet için kırmızı noktalar, n = 11). 0.8 nN kuvvetinde, içselleştirilmiş mikroboncuk (lar) a sahip hücreler net YAP N / C oranı değişimi = -0.030 ± 0.029, n = 11; kontrol hücreleri net YAP N/C oranı değişimi = -0.003 ± 0.012, n = 9 gösterir. 1.4 nN kuvvetinde, içselleştirilmiş mikroboncuk (lar) a sahip hücreler net YAP N / C oranı değişimi = 0.011 ± 0.040, n = 11; kontrol hücreleri net YAP N/C oranı değişimi = 0.005 ± 0.005, n = 9 göstermektedir (Şekil 8A). 0.8 nN kuvvetinde, içselleştirilmiş mikroboncuk (lar) a sahip hücreler mutlak net YAP N / C oranı değişimi = 0.057 ± 0.017, n = 11; kontrol hücreleri net YAP N/C oranı değişimi = 0.021 ± 0.007, n = 9 gösterir. Aradaki fark anlamlıdır (p değeri = 0,0093, **). 1.4 nN kuvvetinde, içselleştirilmiş mikroboncuk (lar) a sahip hücreler mutlak net YAP N / C oranı değişimi = 0.070 ± 0.020, n = 11; kontrol hücreleri net YAP N/C oranı değişimi = 0.010 ± 0.003, n = 9 gösterir. Aradaki fark anlamlıdır (p değeri = 0.0007, ***) (Şekil 8B). Birlikte, bu sonuçlar, sitoplazma içindeki mikroboncuklara uygulanan manyetik kuvvetin gerçekten YAP translokasyonunu indükleyebileceğini ve YAP N / C oranını değiştirebileceğini doğrulamaktadır.
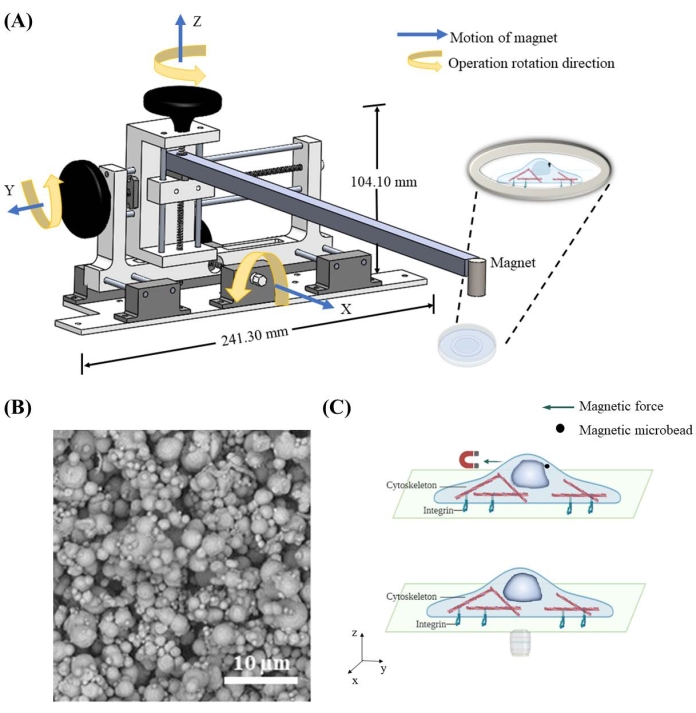
Şekil 1: Manyetik hareket eden cihazın tasarımı ve manyetik mikroboncuklarla hücredeki şematik kuvvet uygulaması . (A) Mıknatısı tutmak ve x, y ve z yönlerinde hareket ettirmek için uygulanan cihazın üç boyutlu şeması. Cihaz 241,3 mm genişliğinde ve 104,1 mm yüksekliğinde bir taban, iki düğme, bir çubuk ve bir mıknatıstan oluşur. Düğmeler, karşılık gelen yönde hareket sağlayacak doğru çalışma dönüş yönünde astarlanacaktır. Mıknatıs, manyetik mikroboncuklar üzerinde farklı büyüklük ve yönlerde manyetik kuvvet uygulamak için çanağa daha yakın / daha da yükseltilecektir. (B) 7 μm demir mikroboncuğun örnek taramalı elektron mikroskobu (SEM) görüntüsü. (C) Sitoplazmanın içine verilen manyetik mikroboncuklar, manyetik alan uygulandığında çekirdek gibi organellere kuvvet uygulayabilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
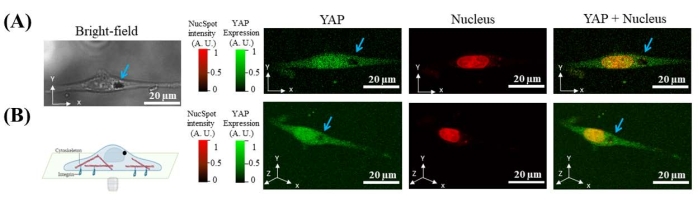
Şekil 2: Manyetik mikroboncuk (mavi okla işaret edilen siyah oyuk) gösteren temsili görüntüler, hücrenin içine (YAP ile gösterilir) ve çekirdeğin dışına içselleştirilir . (A) YAP (yeşil), çekirdek (kırmızı) ve parlak alan hücresinin X-Y kesiti. (B) Hücrenin 3B rekonstrüksiyonu. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 3: Hücreler tarafından içselleştirilen mikroboncuklar nükleer şekli ve YAP N/C oranını etkilemez . (A) Mikroboncuk, tek mikroboncuk ve çoklu mikroboncuk içselleştirmesi olmayan hücrelerin temsili parlak alan ve floresan görüntüleri. Mavi oklar, sitoplazma içindeki mikroboncukların konumunu gösterir. (B) 7 saat (n = 13), 12 saat (n = 62) ve 24 saat (n = 40) ko-kültürde, mikroboncuk, tek mikroboncuk ve çoklu mikroboncuk içselleştirmesi göstermeyen hücrelerin yüzdesi. (C) Nükleer döngüsellik, kontrol hücreleri ile mikroboncuk içselleştirmesi olan hücreler arasında anlamlı bir fark göstermez. Kontrol #1 (mikroboncuk ortak kültürü olmadan): Dairesellik = 0.806 ± 0.037, n = 20; Kontrol #2 (mikroboncuk ortak kültürü ile, mikroboncuk içselleştirmesi olmadan): Dairesellik = 0.806 ± 0.035, n = 22; Tek mikroboncuk içselleştirme: Dairesellik = 0.793 ± 0.048, n = 15; çoklu mikroboncuk içselleştirme: Dairesellik = 0.780 ± 0.061, n = 7. (D) YAP N/C oranı, kontrol hücreleri (mikroboncuk ko-kültürü ile, mikroboncuk içselleştirmesi olmadan, YAP N/C oranı = 1.155 ± 0.074, n=35) ile mikroboncuk içselleştirmeli hücreler (YAP N/C oranı = 1.140 ± 0.078, n = 36) arasında anlamlı bir fark (p değeri = 0.667) göstermez. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 4: Aktin filamentli ve aktin filamentsiz çekirdeğe doğrudan kuvvet uygulaması. (A) Hücreler aktin filamentlerini (sarı) gösterir. (A1) Hiçbir kuvvet uygulanmadığında çekirdeğin görüntüsü. (A2) Kuvvet uygulandıktan sonra çekirdeğin görüntüsü. (A3) Kuvvet uygulamasından önce ve sonra nükleer sınırın örtüşme görüntüsü nükleer girintiyi gösterir. (B) Hücreler, SitoD tedavisinden sonra bozulmuş aktin filamentleri (sarı) gösterir (2.5 μM, 1 saat). (B1) Hiçbir kuvvet uygulanmadığında çekirdeğin görüntüsü. (B2) Kuvvet uygulandıktan sonra çekirdeğin görüntüsü. (B3) Kuvvet uygulamasından önce ve sonra nükleer sınırın örtüşme görüntüsü, bozulmuş aktin sitoiskeleti ile nükleer girintiyi göstermektedir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 5: Hücre içi manyetik mikroboncuğun uzamsal ve zamansal kontrolü . (A) Bir çift mıknatıs, manyetik mikroboncuğu mekansal olarak kontrol eder. (A1) 1. konumdaki hücre sınırının (yeşil çizgi), nükleer sınırın (kırmızı çizgi) ve manyetik mikroboncuğun (sarı çizgi) parlak alan görüntüsü. (A2) Manyetik mikroboncuk, çekirdeği 1. konumda girintilendirir. (A3) Manyetik mikroboncuk pozisyon 2'ye (sarı çizgi) taşınır. Konum 1 referans olarak gösterilir (sarı kesikli çizgi). (A4) Manyetik mikroboncuk, çekirdeği 2. konumda girintilendirir. (B) Bir çift mıknatıs geçici olarak manyetik mikroboncuğu kontrol eder. (B1) Zaman noktasında kuvvet uygulanmayan bir hücrenin parlak alan görüntüsü I. (B2) Manyetik mikroboncuk, II. zaman noktasında çekirdeğe bir kuvvet uygular. (B3) Manyetik mikroboncuk, kuvveti III. Zaman Noktasında çekirdekten serbest bırakır. (B4) Manyetik mikroboncuk, IV. zaman noktasında çekirdeğe daha büyük bir kuvvet uygular. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
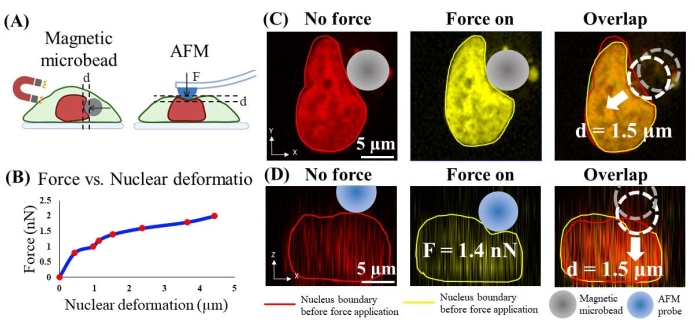
Şekil 6. AFM girintisi kullanılarak çekirdeğe mikroboncuk uygulanan kuvvetin kalibrasyonu. (A) Kalibrasyon prosesinin şematik gösterimi. Manyetik mikroboncuk çekirdeğe yatay sıkıştırma uygular (solda) ve AFM probu çekirdeğe dikey olarak girinti yapar. (B) AFM girinti kuvvetine karşı nükleer deformasyon. (C) Manyetik mikroboncuk ile kuvvet uygulamasından önce ve sonra çekirdek deformasyonunun (1.5 μm) temsili görüntüsü. (D) 1.4 nN kuvvet ile AFM girintisinden önce ve sonra benzer çekirdek deformasyonunun (1.5 μm) temsili görüntüsü. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 7: YAP N/C oran değişimini gösteren temsili veriler, manyetik kuvvet uygulaması ve serbest bırakılması ile indüklenir . (A) Hücrenin YAP (yeşil) ve çekirdek (kırmızı) floresan görüntüsünün X-Y kesiti kuvvetsiz, kuvvetsiz ve kuvvetsiz olarak kapatılır. Kuvvet açma durumunda, nükleer YAP yoğunluğu artarken, sarı bir okla işaret edilen yerde sitoplazmik YAP yoğunluğu azalır. YAP N/C oranı artar. (B) YAP N/C oranı kuvvet açıldığında artar (1,0791'den 1,2327'ye) ve kuvvet kesildiğinde azalır (1,2327'den 1,1548'e). Normalize nükleer leke yoğunluğu, kuvvet uygulaması (1.00117) ve serbest bırakma (0.95578) ile küçük değişiklikler gösterir. (C) Hücrenin YAP (yeşil) ve çekirdek (kırmızı) görüntüsünün X-Z kesiti kuvvetsiz, zorlama ve zorlama olmadan. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 8: Manyetik kuvvet uygulamasının neden olduğu YAP N/C oranı değişimi. (A) 0.8 nN kuvvetinde, içselleştirilmiş mikroboncuk(lar)a sahip hücreler net YAP N/C oranı değişimini göstermektedir = -0.030 ± 0.029, n = 11; kontrol hücreleri net YAP N/C oranı değişimi = -0.003 ± 0.012, n = 9 gösterir. 1.4 nN kuvvetinde, içselleştirilmiş mikroboncuk (lar) a sahip hücreler net YAP N / C oranı değişimi = 0.011 ± 0.040, n = 11; kontrol hücreleri net YAP N/C oranı değişimi = 0.005 ± 0.005, n = 9 gösterir. (B) 0.8 nN kuvvetinde, içselleştirilmiş mikroboncuk (lar) a sahip hücreler mutlak net YAP N / C oranı değişimi = 0.057 ± 0.017, n = 11; kontrol hücreleri net YAP N/C oranı değişimi = 0.021 ± 0.007, n = 9 gösterir. Aradaki fark anlamlıdır (p değeri = 0,0093, **). 1.4 nN kuvvetinde, içselleştirilmiş mikroboncuk (lar) a sahip hücreler mutlak net YAP N / C oranı değişimi = 0.070 ± 0.020, n = 11; kontrol hücreleri net YAP N/C oranı değişimi = 0.010 ± 0.003, n = 9 gösterir. Aradaki fark önemlidir (p değeri = 0.0007, ***) Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: Nükleer şekil ve nükleer boyama yoğunluğu. (A) SitoD tedavisi olmadan, (B) SitoD tedavisi ile ve (C) Ölü hücre. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Video 1: Kuvvet uygulama sürecini gösteren parlak alan videosu. Bu videoyu indirmek için lütfen tıklayınız.
Tartışmalar
Manyetik mikroboncukların içselleştirilmesi (bölüm 2.2) kritiktir, çünkü hücre dışı mikroboncuklar doğrudan çekirdeğe kuvvet uygulayamaz. Kuvvet uygulaması ve görüntüleme (bölüm 5.3) bu deneydeki kritik adımlardır ve çekirdeği deforme etmek ve anlamlı biyolojik sonuçlara neden olmak için gereken kuvvet örneğe bağlı olabilir. Bu deneydeki kuvvet büyüklüğü (0.8 nN ve 1.4 nN), daha az hassas hücrelerde nükleer mekano-algılamayı tetiklemek için daha da arttırılabilir.
Manyetik kuvveti yüksek verimle nicel bir şekilde uygulamak için, tek bir mikroboncuğun içselleştirilmesi ideal bir yaklaşımdır. Bu çalışmada, tek mikroboncuk içselleştirmesi olan hücrelerin yüzdesi 12 saat (%26) ve 24 saat (%28) oranında benzerken, mikroboncuk içselleştirmesi olmayan hücreler 12 saatte (%53) 24 saatte (%20) olduğundan daha yüksekti (Şekil 3B). 12 saatin kuvvet uygulama deneyi için en uygun zaman olduğu düşünülmektedir, çünkü daha fazla tek mikroboncuk dahil edilebilir ve hücreler kontrol edilebilir. Farklı hücre hatları ve mikroboncuk boyutları için, karşılık gelen optimal koşulları belirlemek için ko-kültür süresi ve mikroboncuk konsantrasyonu test edilmelidir.
Deneylerde, mikroboncuklar çekirdeğe özel olarak bağlanacak şekilde kaplanmadı. Bu nedenle, mikroboncuklardan çekirdeğe doğrudan iletilen kuvvet muhtemelen sadece sıkıştırıcıdır. Sonuçlar, YAP N/C oranının hücre popülasyonunu arttırdığını ve azalttığını göstermektedir (Şekil 8A). Bunun olası bir nedeni, mikroboncuklar aracılığıyla uygulanan manyetik kuvvetin sitoiskelet içinde pozitif veya negatif gerilim değişimine neden olabilmesi ve YAP N/C oranının sırasıyla artması veya azalması için düzenlenmesidir,28. Önceki araştırmalar, çekirdek üzerindeki basınç kuvvetinin YAP N / C oranında bir artışa neden olduğunu göstermektedir28. Gelecekteki deneylerde, çekirdeğin doğrudan kuvvet algılamasını incelemek için, hücre iskeletinden çekirdeğe kuvvet iletimini ortadan kaldırmak için sitoiskelet bozulabilir.
Mevcut yöntemlerde iki potansiyel dezavantaj vardır. İlk olarak, bu deneylerde, gerçek zamanlı konfokal görüntüleme ile izlenen ve çekirdeğe bir basınç kuvveti uygulamayı amaçlayan boncukların hareketini ayarlamak için 3D hareket ettirici (Şekil 1A) kullanılmıştır. Bununla birlikte, nükleer membranın kaygan doğası ve sitoplazmadaki karmaşık ortam nedeniyle, boncuklarla uygulanan kuvvetin yönü tamamen sıkıştırıcı olmayabilir (yani, nükleer membran yüzeyine kesinlikle dik olmayabilir). Bu kusur, nükleer membrana bir kesme kuvveti uygulanmasına neden olabilir. İkincisi, bu çalışmada kullanılan mevcut mikroboncuklar, çekirdeğe bağlanmak için antikor ile konjuge edilmemiştir, çünkü boncukların uzamsal hareketliliği, temassız manyetik aktüatörün avantajını göstermek için mevcut deneyde kritik öneme sahiptir. Bu nedenle, mevcut yöntem nükleer membrana gerilim uygulayamaz.
Gelecekte, (1) anti-nesprin-1 antikoruna sahip boncuklar, çekirdeğe özel olarak bağlanmak üzere konjuge edilecektir. Bu, mikroboncuklar ve hedef proteinler arasındaki doğrudan ve spesifik kuvvet iletimini garanti edebilir. (2) Kuvvetin yönü, floresan boncuklarla gömülü yumuşak hidrojel içindeki tek manyetik mikroboncuk manipüle edilerek kalibre edilecektir. Floresan boncukların 3D yer değiştirmesi, hidrojelin deformasyon alanını hesaplamak ve uygulanan manyetik alanın bir fonksiyonu olarak kuvvet yönünü belirlemek için kullanılabilir. Mikroboncuk çekirdeğe kimyasal olarak bağlandıktan sonra, bilinen bir yöne sahip bir kuvvet uygulamak kuvvet tipini (gerginlik, sıkıştırma veya kesme) belirleyecektir. (3) Nükleer boyamanın 3D görüntülemesi, çekirdeğin 3D simülasyon FEM modelini oluşturmak için kullanılacaktır. Kuvvet yönü, manyetik kuvvet uygulamasından önce ve sonra nükleer deformasyonun karşılaştırılmasıyla doğrulanabilir.
Bu çalışmada geliştirilen benzersiz teknik, çeşitli potansiyel avantajlar sağlar: (1) AFM probları tarafından dikey girinti ile karşılaştırıldığında, manyetik mikroboncuklar herhangi bir yönde kuvvet uygulayabilir. 2D substrat yüzeylerinde kültürlenen hücreler, plazma zarının ve nükleer zarfın dikey ve yatay yüzeylerinde heterojen protein dağılımına ve oryantasyonuna sahip olabilir. Yatay olarak kuvvet uygulamak, daha önce gözlemlenmemiş mekano-algılama tepkilerine neden olabilir. (2) Mikroboncuklar çekirdeğe bağlanmak için işlevsel olarak kaplandıktan sonra, farklı kuvvet yönleri nedeniyle diferansiyel nükleer mekano-algılamayı daha fazla incelemek için hem itme hem de çekme kuvvetleri doğrudan çekirdeğe uygulanabilir. (3) Mikroboncukların belirli nükleer zarf proteinlerine spesifik bağlanmasını kontrol ederek, daha önce az araştırılmış nükleer kuvvet algılama mekanizmaları açıklığa kavuşturulabilir. Ortaya çıkan kanıtlar, çekirdeğin muhtemelen bir mekano-sensör36 olduğunu ve nükleer mekano-algılamanın YAP translokasyon28'in en doğrudan düzenleyicisi olduğunu göstermektedir. Nükleer regüle YAP translokasyonunun mekanizması aktif olarak incelenmekte ve nükleer gözenek boyutu28, nükleer şekil 25,61, LINC kompleksi ve nükleer zarf gerilimi20 dahil olmak üzere çekirdekteki çeşitli mekano-sensör veya parametre adayları önerilmektedir. Manyetik mikroboncukların manipüle edilmesi, LINC kompleksi üzerinde doğrudan kuvvet uygulaması ve nükleer zarf gerilimi ve şeklinin kontrollü düzenlemeleri ile bu tür mekanizmaların ayrıntılı olarak araştırılması olasılığını ortaya çıkarmaktadır. (4) Çekirdeğe kuvvet uygulanmasına ek olarak, mikroboncuklar, membran proteinlerinin hücre içi alanlarının ve komplekslerinin biyofiziksel sinyallere nasıl tepki verdiğini ortaya çıkarmak için plazma zarının iç tarafına bağlanacak şekilde tasarlanmaya da uygundur.
Özetle, bu makale (1) nükleer morfolojiyi ve protein fonksiyonlarını etkilemeden sitoplazmaya mikro boyutlu demir mikroboncuklar veren, (2) manyetik mikroboncuklarla çekirdeğe kuvvet uygulayan ve (3) kuvvet uygulaması sırasında konfokal floresan canlı hücre görüntülemesi yapan bir yöntem göstermiştir. Bu non-invaziv araçlar, tek hücrelerdeki organellerin doğrudan epigenetik manipülasyonu, çekirdek mekanotransdüksiyonunun süper çözünürlüklü görüntüleme tabanlı sorgulanması ve kuvvet tarafından düzenlenen 3D kromozom organizasyonunun ayrıntılı olarak araştırılması (Hi-C: yüksek çözünürlüklü kromozom doğrulama yakalaması ile birlikte) ve hücre fizyolojisi ve patobiyolojisi bağlamlarında yeniden programlama olanaklarını ortaya koymaktadır.
Açıklamalar
Beyan edilecek herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu proje UF Gatorade Ödülü Başlangıç Paketi (X. T.), UFHCC Pilot Ödülü (X. T. ve Dr. Dietmar Siemann), UF Fırsat Tohum Fonu (X. T.) ve UFHCC Üniversitesi Bilim İnsanları Programı (H. Y. Wang) tarafından finanse edilmektedir. Dr. Jonathan Licht (UFHCC), Dr. Rolf Renne (UFHCC), Dr. Christopher Vulpe (UFHCC), Dr. Blanka Sharma (BME), Dr. Mark Sheplak (MAE & ECE), Dr. Daniel Ferris (BME), Dr. Malisa Sarntinoranont (MAE), Dr. Ashok Kumar (MAE), Dr. Benjamin Keselowsky (BME), Dr. Brent Gila (RSC), Dr. Philip Feng (ECE), Dr. Gregory A. Hudalla (BME), Dr. Steven Ghivizzani (OSSM), Dr. Yenisel Cruz-Almeida (CDBS), Dr. Roger Fillingim (CD-BS), Dr. Robert Caudle (OMS), Dr. John Neubert (DN-OR), Dr. Justin Hiliard (Nöroşirürji), Dr. Tian He (Harvard Üniversitesi), Dr. Youhua Tan (Hong Kong Politeknik Üniversitesi), Dr. Jessie L-S Au (Kantitatif Sistemler Farmakoloji Enstitüsü), Dr. David Hahn (Arizona Üniversitesi), ve Nikon Destek Ekibi (Dr. Jose Serrano-Velez, Larry Kordon ve Jon Ekman). Tang'ın, Yamaguchi'nin, Sharma'nın, Au'nun, Siemann'ın ve Guan'ın araştırma laboratuvarlarının tüm üyelerinden ve UF MAE Departmanının tüm personelinden gelen etkili destek için derinden minnettarız.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.05 % Trypsin | Corning | 25-051-CI | |
| 25 cm2 flask | Corning | 156340 | |
| 7-µm mean diameter carbonyl iron microbeads | N/A | N/A | |
| A1R confocal system | Nikon | ||
| Carbonyl Iron Powder CM | BASF | 30042253 | Magnetic microbead |
| Culture medium (RPMI-1640) | Gibco | 11875093 | |
| Desktop Computer | Dell | with Windows 10 operating system | |
| Environmental chamber TIZB | Tokai Hit | TIZB | |
| Fetal bovine serum (FBS) | Gibco | 26140 | |
| Fiji ImageJ | National Institutes of Health and the Laboratory for Optical and Computational Instrumentation | ||
| Glass-bottom petri dish | MatTek | P35G-1.5-14-C | |
| Magnet | K&J Magnetics, Inc. | D99-N52 | |
| Monochrome Camera | FLIR | BFS-U3-70S7M-C | |
| NIS-Elements software platform | Nikon | software platform | |
| Nucleus mask ImageJ macro | https://github.com/KOLIUG/Nuclear mask | ||
| NucSpot Live 650 | Biotium | #40082 | Nuclear stain |
| Penicillin-streptomycin | Gibco | 15140122 | |
| Phosphate buffered saline (PBS) | Gibco | 10010023 | |
| Ti2-E inverted microscope | Nikon | ||
| XYZ mover (CAD files) | https://github.com/KOLIUG/XYZ-mover |
Referanslar
- Discher, D. E., Janmey, P., Wang, Y. Tissue cells feel and respond to the stiffness of their substrate. Science. 310 (5751), 1139-1143 (2005).
- Janmey, P. A., Fletcher, D. A., Reinhart-King, C. A. Stiffness sensing by cells. Physiological Reviews. 100 (2), 695-724 (2020).
- Bajaj, P., Tang, X., Saif, T. A., Bashir, R. Stiffness of the substrate influences the phenotype of embryonic chicken cardiac myocytes. Journal of Biomedical Materials Research Part A. 95 (4), 1261-1269 (2020).
- Tang, X., et al. Mechanical force affects expression of an in vitro metastasis-like phenotype in HCT-8 cells. Biophysical Journal. 99 (8), 2460-2469 (2010).
- Hofmann, M., et al. Lowering of tumor interstitial fluid pressure reduces tumor cell proliferation in a xenograft tumor model. Neoplasia. 8 (2), 89-95 (2006).
- Yankaskas, C. L., et al. The fluid shear stress sensor TRPM7 regulates tumor cell intravasation. Science Advances. 7 (28), (2021).
- Kim, E., et al. A biosynthetic hybrid spidroin-amyloid-mussel foot protein for underwater adhesion on diverse surfaces. ACS Applied Materials and Interfaces. 13 (41), 48457-48468 (2021).
- Tajik, A., et al. Transcription upregulation via force-induced direct stretching of chromatin. Nature Materials. 15 (12), 1287-1296 (2016).
- Lee, J., Abdeen, A. A., Tang, X., Saif, T. A., Kilian, K. A. Matrix directed adipogenesis and neurogenesis of mesenchymal stem cells derived from adipose tissue and bone marrow. Acta Biomaterialia. 42, 46-55 (2016).
- Lee, J., Abdeen, A. A., Tang, X., Saif, T. A., Kilian, K. A. Geometric guidance of integrin mediated traction stress during stem cell differentiation. Biomaterials. 69, 174-183 (2015).
- Ren, B., et al. Study of sacrificial ink-assisted embedded printing for 3D perfusable channel creation for biomedical applications. Applied Physics Reviews. 9 (1), 011408(2022).
- Coyle, S., et al. Cell alignment modulated by surface nano-topography-Roles of cell-matrix and cell-cell interactions. Acta Biomaterialia. 142, 149-159 (2022).
- Sawada, Y., et al. Force sensing by mechanical extension of the Src family kinase substrate p130Cas. Cell. 127 (5), 1015-1026 (2006).
- Aragona, M., et al. A mechanical checkpoint controls multicellular growth through YAP/TAZ regulation by actin-processing factors. Cell. 154 (5), 1047-1059 (2013).
- Tang, X., et al. Specific and non-specific adhesion in cancer cells with various metastatic potentials. Mechanobiology of Cell-Cell and Cell-Matrix Interactions. , Springer. Boston, MA. 105-122 (2011).
- Tang, X., Saif, T. A. Adhesivity of colon cancer cells during in vitro metastasis. International Journal of Applied Mechanics. 5 (03), 1350025(2013).
- Chaudhuri, O., et al. Effects of extracellular matrix viscoelasticity on cellular behaviour. Nature. 584 (7822), 535-546 (2020).
- Ohashi, K., Fujiwara, S., Mizuno, K. Roles of the cytoskeleton, cell adhesion and rho signalling in mechanosensing and mechanotransduction. The Journal of Biochemistry. 161 (3), 245-254 (2017).
- Hamill, O. P., Martinac, B. Molecular basis of mechanotransduction in living cells. Physiological Reviews. 81 (2), 685-740 (2001).
- Liang, C., et al. Towards an integrative understanding of cancer mechanobiology: Calcium, YAP, and microRNA under biophysical Forces. Soft Matter. 18, 1112-1148 (2022).
- Tan, Y., et al. Matrix softness regulates plasticity of tumour-repopulating cells via H3K9 demethylation and Sox2 expression. Nature Communications. 5 (1), 1-12 (2014).
- Poh, Y., et al. Dynamic force-induced direct dissociation of protein complexes in a nuclear body in living cells. Nature Communications. 3 (1), 1-10 (2012).
- Tang, X., et al. A mechanically-induced colon cancer cell population shows increased metastatic potential. Molecular Cancer. 13 (1), 1-15 (2014).
- Wu, J., et al. Effects of dynein on microtubule mechanics and centrosome positioning. Molecular Biology of the Cell. 22 (24), 4834-4841 (2011).
- Tang, X., Ali, M. Y., Saif, M. T. A novel technique for micro-patterning proteins and cells on polyacrylamide gels. Soft Matter. 8 (27), 7197-7206 (2011).
- Tang, X., Bajaj, P., Bashir, R., Saif, T. A. How far cardiac cells can see each other mechanically. Soft Matter. 7 (13), 6151-6158 (2011).
- Tang, X., et al. Mechanical force affects expression of an in vitro metastasis-like phenotype in HCT-8 cells. Biophysical Journal. 99 (8), 2460-2469 (2010).
- Elosegui-Artola, A., et al. Force triggers YAP nuclear entry by regulating transport across nuclear pores. Cell. 171 (6), 1397-1410 (2017).
- Gudipaty, S. A., et al. Mechanical stretch triggers rapid epithelial cell division through Piezo1. Nature. 543 (7643), 118-121 (2017).
- Tang, X., et al. Attenuation of cell mechanosensitivity in colon cancer cells during in vitro metastasis. PLoS One. 7 (11), 50443(2012).
- Cha, C., et al. Top-down synthesis of versatile polyaspartamide linkers for single-step protein conjugation to materials. Bioconjugate Chemistry. 22 (12), 2377-2382 (2012).
- Chen, X., et al. Glycosaminoglycans modulate long-range mechanical communication between cells in collagen networks. Proceedings of the National Academy of Sciences of the United States of America. 119 (15), (2022).
- Boyle, J. J., Pless, R. B., Thomopoulos, S., Genin, G. M. Direct estimation of surface strain fields from a stereo vision system. Journal of Biomechanical Engineering. 142 (7), 074503(2020).
- Kim, S., Uroz, M., Bays, J. L., Chen, C. S. Harnessing mechanobiology for tissue engineering. Developmental Cell. 56 (2), 180-191 (2021).
- Driscoll, T. P., et al. Cytoskeletal to nuclear strain transfer regulates YAP signaling in mesenchymal stem cells. Biophysical Journal. 108 (12), 2783-2793 (2015).
- Guilluy, C., et al. Isolated nuclei adapt to force and reveal a mechanotransduction pathway in the nucleus. Nature Cell Biology. 16 (4), 376-381 (2014).
- Vashisth, M. Scaling concepts in 'omics: Nuclear lamin-B scales with tumor growth and often predicts poor prognosis, unlike fibrosis. Proceedings of the National Academy of Sciences of the United States of America. 118 (48), (2021).
- Roberts, A. B., et al. Tumor cell nuclei soften during transendothelial migration. Journal of Biomechanics. 121, 110400(2021).
- Denais, C. M., et al. Nuclear envelope rupture and repair during cancer cell migration. Science. 352 (6283), 353-358 (2016).
- Raab, M., et al. ESCRT III repairs nuclear envelope ruptures during cell migration to limit DNA damage and cell death. Science. 352 (6283), 359-362 (2016).
- Lammerding, J., et al. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. The Journal of Clinical Investigation. 113 (3), 370-378 (2004).
- Shelby, J., Patrick, J., Edgar, S., Chiu, D. T. Monitoring cell survival after extraction of a single subcellular organelle using optical trapping and pulsed-nitrogen laser ablation. Photochemistry and Photobiology. 81 (4), 994-1001 (2005).
- Caspi, A., Granek, R., Elbaum, M. Diffusion and directed motion in cellular transport. Physical Review E. 66 (1), 011916(2002).
- Svoboda, K., Block, S. M. Biological applications of optical forces. Annual Review of Biophysics and Biomolecular Structure. 23 (1), 247-285 (1994).
- Rohrbach, A. Stiffness of optical traps: quantitative agreement between experiment and electromagnetic theory. Physical Review Letters. 95 (16), 168102(2005).
- Neuman, K. C., et al. Characterization of photodamage to Escherichia coli in optical traps. Biophysical Journal. 77 (5), 2856-2863 (1999).
- Kanger, J. S., Subramaniam, V., Driel, R. V. Intracellular manipulation of chromatin using magnetic microbeads. Chromosome Research. 16 (3), 511-522 (2008).
- Bausch, A. R., et al. Local measurements of viscoelastic parameters of adherent cell surfaces by magnetic microbead microrheometry. Biophysical Journal. 75 (4), 2038-2049 (1998).
- Fisher, J. K., et al. Three-dimensional force microscope: a nanometric optical tracking and magnetic manipulation system for the biomedical sciences. Review of Scientific Instruments. 76 (5), 053711(2005).
- Berret, J. -F. Local viscoelasticity of living cells measured by rotational magnetic spectroscopy. Nature Communications. 7, 10134(2016).
- Hu, B., Dobson, J., El Haj, A. J. Control of smooth muscle α-actin (SMA) up-regulation in HBMSCs using remote magnetic microbead mechano-activation. Nanomedicine: Nanotechnology, Biology and Medicine. 10 (1), 45-55 (2014).
- Kamiyama, D., et al. Versatile protein tagging in cells with split fluorescent protein. Nature Communications. 7, 11046(2016).
- Feng, S., et al. Improved split fluorescent proteins for endogenous protein labeling. Nature Communications. 8, 370(2017).
- Leonetti, M. D., Sekine, S., Kamiyama, D., Weissman, J. S., Huang, B. A scalable strategy for high-throughput GFP tagging of endogenous human proteins. Proceedings of the National Academy of Sciences of the United States of America. 113 (25), 3501-3508 (2016).
- Tulpule, A., et al. Kinase-mediated RAS signaling via membraneless cytoplasmic protein granules. Cell. 184 (10), 2649-2664 (2021).
- Ansari, A. M., et al. Cellular GFP toxicity and immunogenicity: potential confounders in in vivo cell tracking experiments. Stem Cell Reviews and Reports. 12 (5), 553-559 (2016).
- Gibson, T. J., Seiler, M., Veitia, R. A. The transience of transient overexpression. Nature Methods. 10 (8), 715-721 (2013).
- Ratz, M., et al. CRISPR/Cas9-mediated endogenous protein tagging for RESOLFT super-resolution microscopy of living human cells. Scientific Reports. 5, 9592(2015).
- Suzuki, H., Ho, C., Kasagi, N. A chaotic mixer for magnetic microbead-based micro cell sorter. Journal of Microelectromechanical Systems. 13 (5), 779-790 (2004).
- Luo, Q., et al. All-optical mechanobiology interrogation of yes-associated protein in human cancer and normal cells using a multi-functional system. Journal of Visualized Experiments. (178), e62934(2021).
- Koushki, N., et al. Lamin A redistribution mediated by nuclear deformation determines dynamic localization of YAP. BioRxiv. , (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır