Method Article
Kombination von 3D-Magnetkraftaktor und multifunktionaler Fluoreszenzbildgebung zur Untersuchung der Kernmechanobiologie
In diesem Artikel
Zusammenfassung
Diese Studie stellt ein neues Protokoll vor, um mechanische Kraft direkt auf den Zellkern durch magnetische Mikroperlen auszuüben, die in das Zytoplasma abgegeben werden, und simultane Live-Zell-Fluoreszenzbildgebung durchzuführen.
Zusammenfassung
Eine grundlegende Frage in der Mechanobiologie ist, wie lebende Zellen extrazelluläre mechanische Reize im Kontext der Zellphysiologie und -pathologie wahrnehmen. Es wird angenommen, dass die zelluläre Mechano-Empfindung extrazellulärer mechanischer Reize durch die Membranrezeptoren, den zugehörigen Proteinkomplex und das Zytoskelett erfolgt. Jüngste Fortschritte in der Mechanobiologie zeigen, dass der Zellkern im Zytoplasma selbst selbstständig mechanische Reize gleichzeitig wahrnehmen kann. Ein mechanistisches Verständnis darüber, wie der Zellkern mechanische Reize wahrnimmt, umleitet und darauf reagiert, fehlt jedoch, hauptsächlich aufgrund der technischen Herausforderungen beim Zugriff auf und der Quantifizierung der Kernmechanik mit herkömmlichen Werkzeugen. Dieses Papier beschreibt das Design, die Herstellung und die Implementierung eines neuen magnetischen Kraftaktors, der präzise und nicht-invasive mechanische 3D-Reize anwendet, um den Zellkern direkt zu verformen. Unter Verwendung von CRISPR/Cas9-Zellen zeigt diese Studie, dass dieses Werkzeug in Kombination mit hochauflösender konfokaler fluoreszierender Bildgebung die Aufdeckung der Echtzeitdynamik eines mechanosensitiven yes-assoziierten Proteins (YAP) in einzelnen Zellen als Funktion der Kernverformung ermöglicht. Diese einfache Methode hat das Potenzial, die derzeitige Technologielücke in der Mechanobiologie zu schließen und Antworten auf die Wissenslücke zu geben, die in der Beziehung zwischen Kernmechanotransduktion und Zellfunktion besteht.
Einleitung
Diese Studie zielt darauf ab, eine neue Technik zur Aufklärung der Kernmechanobiologie zu entwickeln und anzuwenden, indem die magnetischen Aktoren, die mechanische Kraft direkt auf den Zellkern ausüben, und die konfokale Fluoreszenzmikroskopie, die gleichzeitig die strukturellen und funktionellen subzellulären Veränderungen abbildet, kombiniert werden. Zellen erfassen extrazelluläre biophysikalische Signale einschließlich Gewebesteifigkeit 1,2,3,4, interstitiellen Flüssigkeitsdruck und Scherspannung 5,6,7, Oberflächentopologie/-geometrie 8,9,10,11,12 und Zug-/Druckspannung13,14, 15,16. Biophysikalische Signale werden in biochemische Signale umgewandelt und lösen mögliche nachgeschaltete Veränderungen der Genexpression und des Zellverhaltens aus - ein Prozess, der als Mechanotransduktion bekannt ist 17,18,19,20,21,22,23,24,25,26,27 . Um Mechanotransduktionsprozesse zu untersuchen, wurde eine Vielzahl von Techniken entwickelt, um mechanische Kraft auf die Zellen auszuüben, wie Rasterkraftmikroskopie28, Zelldehnungsgerät29, Bio-MEMS (mikroelektromechanische Systeme) Kraftsensor 15,30,31, Scherrheologie 32 und Stereo Vision System 33 . Eine kürzlich durchgeführte Übersicht fasst die Ansätze zur Anwendung extrazellulärer mechanischer Hinweise und zur Störung der Mechanosensorik zusammen34. Bisher üben die meisten dieser Methoden Kraft auf die Zellplasmamembran aus, und Zellen empfangen diese extrazellulären biophysikalischen Signale direkt über Membranrezeptoren wie Integrin, Cadherin, Ionenkanäle und G-Protein-gekoppelte Rezeptoren. Anschließend leiten sie das Signal an das intrazelluläre Zytoskelett und den Zellkern weiter. Zum Beispiel wird gezeigt, dass Zellen unter Verwendung der YAP-Translokation (Yes-assoziiertes Protein) als Indikator für die Mechano-Sensorik die mechanischen Signale der Substratsteifigkeit und extrazellulären Spannung von der Zellmembran wahrnehmen und durch das Zytoskelett in den Zellkern übertragen, um eine YAP-Zytoplasma-zu-Zellkern-Translokation zu induzieren28,35.
Neuere Erkenntnisse deuten darauf hin, dass der Zellkern selbst ein unabhängiger Mechanosensorist 8,36,37. Dies wird durch Experimente bewiesen, die an dem isolierten Kern aus Zellen durchgeführt wurden, wo gezeigt wurde, dass Kerne ihre Steifigkeit adaptiv als Reaktion auf die mechanische Kraft ändern, die direkt auf sie ausgeübt wird36. Unter vielen physiologischen Bedingungen nehmen Kerne sowohl in Tumor- als auch in gesunden Zellen extrazelluläre biophysikalische Signale wahr und verändern ihre mechanischen Eigenschaften und Anordnungen38,39,40. Zum Beispiel nimmt bei Extravasation die Kernsteifigkeit von Tumorzellen ab und hält die Weichheit für mehr als 24 h38 aufrecht. Während der Migration durch den begrenzten interstitiellen Raum verlieren die Kerne von Tumorzellen häufig ihre strukturelle Integrität und gewinnen sie wieder39. Die Art und Weise, wie der Zellkern das biophysikalische Signal wahrnimmt, ist jedoch unbekannt, obwohl mehrere Kernhüllproteine und Proteinfamilien beteiligt sind, wie Lamin A / C und Linker of Nucleoskeleton and Cytoskeleton (LINC) -Komplex38,41. Neue nicht-invasive Methoden, die direkt Kraft auf den Zellkern ausüben können, werden daher die Wirkung der Kraftübertragung von der Zell-Plasma-Membran und dem Zytoskelett entkoppeln und dazu beitragen, die bisher unzugänglichen molekularen Mechanismen der nuklearen Mechano-Sensorik aufzuklären.
Forschungen, die optische Pinzetten zur Manipulation von Organellen42 und Mikroperlen, die in Zellen43 injiziert wurden, verwendeten, zeigten die technologische Fähigkeit, direkt Kraft auf den Kern auszuüben. Die optische Pinzettentechnik hat jedoch mehrere Einschränkungen: (1) optische Pinzetten mit niedrigem Durchsatz manipulieren oft nur eine Zelle oder Mikroperle gleichzeitig; und (2) potentielle Photoschäden und Temperaturartefakt-Verformungen von Kernkern erfordern Dutzende von pN36, und die entsprechende notwendige Laserleistung beträgt etwa 10 mW pro pN44,45. Eine solche Laserintensität ist ausreichend, um Photoschäden in den Zellen auszulösen und die Zellfunktionen während des Experiments46 zu stören.
Die magnetische Kraft, die durch Mikroperlen in lebenden Zellen ausgeübt wird, zeigt das Potenzial, direkt Kraft auf den Kern auszuüben und überwindet die Einschränkungen optischer Pinzetten. Sobald Mikroperlen in das Zytoplasma abgegeben werden, kann ein Magnetfeld eine magnetische Kraft auf mehrere Mikrokügelchen gleichzeitig und mit hohem Durchsatz ausüben. Das Magnetfeld beeinflusst nicht die Zellfunktionen47, sondern erzeugt Kraft von pN nach nN, was ausreicht, um eine Kernverformung 36,48,49 zu induzieren. Bisher wurde die Manipulation magnetischer Mikroperlen an der Zellplasmamembran48, im Zytoplasma50, an F-Aktin51, im Kern47 und am isolierten Kern36 angewendet. Die magnetische Manipulation von Mikroperlen wurde jedoch nie verwendet, um direkte mechanische Kraft auf die Kernhülle auszuüben, um die Mechanotransduktion im Kern zu untersuchen.
In dieser Arbeit wird eine einfache Technik entwickelt, um nicht-invasiv magnetische Mikroperlen in das Zytoplasma zu transportieren und diese Mikroperlen zu verwenden, um mechanische Kraft auf den Kern auszuüben (Abbildung 1). Hier werden CRISPR/Cas9-entwickelte humane normale B2B-Zelllinien, die endogen mNeonGreen21-10/11-markiertes YAP exprimieren, verwendet, um die Methode zu validieren. YAP ist ein mechanosensitives Protein, und die Translokation von YAP wird durch nukleare mechano-sensingreguliert 14,28. Der CRISPR/Cas9-regulierte Knock-in-Ansatz wurde gewählt, um endogenes YAP mit einem fluoreszierenden Protein (FP) mNeonGreen21-10/11 zu markieren. Obwohl bekannt ist, dass die CRISPR-Bearbeitung eine unvollständige Effizienz und einen Off-Target-Effekt hat, integrierten die Protokolle in früheren Publikationen eine Fluoreszenzsortierung, um die korrekte Einfügung des offenen Leserahmens52,53,54 auszuwählen. Mit dieser zusätzlichen Selektionsschicht wurde in 20+ Zelllinien, die zuvor52,53,54,55 erzeugt wurden, kein Off-Target-Tagging-Ereignis beobachtet. Dies ist ein Split-Fluoreszenzprotein-Konstrukt, aber im Prinzip könnte jede ausdrückbare fluoreszierende Markierung verwendbar sein. Dieser Markierungsansatz ist Transgen- oder Antikörpermethoden überlegen. Erstens behält das markierte Protein im Gegensatz zur Transgenexpression die Einzelkopie-Gendosierung bei und exprimiert im physiologischen Kontext des nativen genregulatorischen Netzwerks, wodurch Abweichungen in Proteinkonzentration, Lokalisation und Interaktion begrenzt werden. Die in dieser Studie verwendete Tagging-Methode erreicht über eine Größenordnung einen höheren Durchsatz und eine höhere Effizienz als das vollständige FP-Tagging. Es vermeidet auch Herausforderungen im Zusammenhang mit Immunfluoreszenz aufgrund von Fixierungsartefakten und der begrenzten Verfügbarkeit von qualitativ hochwertigen Antikörpern mit hoher Spezifität. Zweitens führt der in dieser Arbeit verwendete Ansatz eine minimale Störung der Zellphysiologie durch und ermöglicht die authentische Offenbarung aller endogenen YAPs in Echtzeit. Im Gegensatz dazu führen andere gängige Transgenmethoden oft zu einer Überexpression von YAP. Die daraus resultierende künstliche Verteilung kann möglicherweise Zytotoxizität verursachen und die mechano-sensing von Zellenbeeinflussen 56,57,58.
Diese Studie stellt ein Protokoll vor, um durch magnetische Mikroperlen, die in das Zytoplasma abgegeben werden, direkt Kraft auf den Kern auszuüben und gleichzeitig eine Live-Zell-Fluoreszenzbildgebung durchzuführen. Zusammenfassend zeigen die hier vorgestellten Protokolle, wie man (1) magnetische Mikroperlen in die Zelle außerhalb des Kerns liefert, (2) die Mikroperlen manipuliert, um magnetische Kraft auf den Kern auszuüben, (3) konfokale fluoreszierende Bildgebung der Zellen während der Manipulation durchführt und (4) das YAP-Kern- / Zytoplasma-Verhältnis (N / C) während des gesamten Kraftanwendungsprozesses quantitativ analysiert. Die Ergebnisse deuten darauf hin, dass (1) durch Endozytose magnetische Mikrokügelchen innerhalb von 7 h nicht-invasiv in das Zytoplasma von B2B-Zellen abgegeben werden können (Abbildung 2 und Abbildung 3); und (2) quantifizierte magnetische Kraft, die direkt auf den Kern ausgeübt wird (Abbildung 4, Abbildung 5 und Abbildung 6), kann allein verschiedene Änderungen des YAP N / C-Verhältnisses in CRISPR / Cas9-B-Zellen auslösen (Abbildung 7 und Abbildung 8).
Protokoll
1. Wartung von CRISPR/Cas9-entwickelten B2B-Zellen
- Kultur von B2B-Zellen in einem T25-Kolben mit RPMI-1640, ergänzt mit 10% fetalem Rinderserum und 1% Penicillin-Streptomycin.
- Die B2B-Zellen werden in einem befeuchteten Inkubator bei 37 °C mit 5%CO2 gehalten.
- Subkultur der B2B-Zellen, wenn der Konfluenz 70% bis 80% erreicht.
- Lagern Sie die B2B-Zelllinie in RPMI-1640 Kulturmedium mit 10% (v/v) DMSO in einem -80 °C Gefrierschrank.
- Verwenden Sie die B2B-Zellen mit einer Passagenzahl kleiner als 10 in den Experimenten.
2. Zellkultur
- Säen Sie die Zellen auf eine Petrischale mit Glasboden.
- Bringen Sie den Kolben, der B2B-Zellen enthält, vom Inkubator in die Biosicherheitswerkbank.
- Entfernen Sie das Kulturmedium im Kolben mit einer Ansaugpipette mit angeschlossener Vakuumpumpe.
- Waschen Sie den Kolben mit 2 ml phosphatgepufferter Kochsalzlösung (PBS).
- Entfernen Sie PBS mit der Ansaugpipette.
- Fügen Sie 0,5 ml 0,05% ige Trypsinlösung hinzu, um die Zellen vom Boden des Kolbensubstrats zu lösen.
- Stellen Sie den Kolben für 5 min in den Inkubator.
- Bringen Sie den Kolben in die Biosicherheitswerkbank. 5 ml neues Kulturmedium in den Kolben geben und die Lösung nach oben und unten pipettieren.
- 50 μL des Mediums mit Zellen (300 Zellen/μL) auf die Glasboden-Petrischale geben. 2 ml Kulturmedium in die Petrischale geben.
- Stellen Sie die Petrischale in den Inkubator. Warten Sie 12 Stunden, bis die Zellen angebracht sind.
- Kulturieren Sie die Zellen mit magnetischen Mikroperlen.
- Er wiegt 0,2 g Carbonyleisen-Mikroperlen mit einem mittleren Durchmesser von 7 μm (im Folgenden 7 μm Mikroperlen genannt, siehe Materialtabelle).
- Verwenden Sie eine Pipette, um die Mikroperlen in 1 ml RPMI-1640-Kulturmedium aufzuhängen.
- Bringen Sie die Petrischale mit B2B-Zellen zur Biosicherheitswerkbank.
- 200 μL des mikroperlenhaltigen Mediums in die Petrischale geben.
HINWEIS: Fügen Sie das Medium schnell hinzu, um den Niederschlag der Mikroperlen zu vermeiden. - Stellen Sie die Petrischale zurück in den Inkubator, bis Mikroperlen von den Zellen verinnerlicht sind. Überprüfen Sie die Internalisierung alle 6 h, um den optimalen Zeitpunkt für die Internalisierung für verschiedene Zelllinien zu bestimmen.
- Um die Internalisierung zu überprüfen, führen Sie konfokale Fluoreszenzbildgebung durch, um die Mikroperlen-, Kern- und Zellgrenze zu visualisieren. Wenn die Mikroperle von der Zelle verinnerlicht wird, befindet sie sich innerhalb der Zellgrenze.
3. Visualisierung des Zellkerns
- 1,5 mL des Kulturmediums im Inkubator für 15 min erwärmen.
- Schalten Sie das Licht der Biosicherheitswerkbank aus. Nehmen Sie die Petrischale, die die Zelle, das erwärmte Kulturmedium, die Kernfärbung und Verapamil HCl enthält, in die Biosicherheitswerkbank.
HINWEIS: Kernfärbungskomponenten sind lichtempfindlich. Vermeiden Sie Lichteinwirkung während des Betriebs. - Verdünnen Sie den 1000-fachen Kernfleck mit DMSO auf 100x.
- 100 mM Verapamil HCl durch DMSO auf 10 mM verdünnen.
- 15 μL 100x Kernfärbung und 15 μL 10 mM Verapamil HCl zu 1,5 ml Kulturmedium geben. Gut mischen, indem Sie auf und ab pipettieren.
- Entfernen Sie das Kulturmedium aus der Petrischale. Geben Sie das Kulturmedium mit der Kernfärbung in die Petrischale.
- Legen Sie die Zellen für mehr als 2 h zurück in den Inkubator.
4. Vorbereitung der Magnetkraft-Anwendungshardware
- 3D-Druck aller Teile mit Acrylnitril-Butadien-Styrol (ABS) und Montage nach dem CAD-Design (Abbildung 1A). Die CAD-Konstruktion ist in der Materialtabelle enthalten.
- Verwenden Sie doppelseitiges Klebeband, um den Magneten an der Magnetbewegungsvorrichtung zu befestigen (Abbildung 1A).
- Stellen Sie das magnetbewegliche Gerät neben den Mikroskoptisch. Verwenden Sie die drei Knöpfe, um die räumliche Position des Magneten einzustellen, bis er sich zwischen 13 mm und 120 mm über die Petrischale bewegen kann.
HINWEIS: Stellen Sie sicher, dass die obere Grenze des Abstands zwischen Magnet und Petrischale so groß wie möglich ist, um unerwünschte Krafteinwirkung auf die magnetischen Mikroperlen zu vermeiden. 120 mm ist der Maximalwert in diesem Versuchsaufbau. Stellen Sie sicher, dass der Magnet die Mikroskopteile, einschließlich Objektive und motorisierte Tische, nicht stört. - Stellen Sie den Magneten auf die höchste Z-Position (bei 120 mm).
5. Kraftanwendung und Lebendzellbildgebung
- Aufbau der Umgebungskammer für Langzeitbildgebung
- Tragen Sie 75% ige Ethanollösung auf, um die Umgebungskammer gründlich zu sterilisieren und zu reinigen.
- Stellen Sie die Umgebungskammer auf den motorisierten Tisch des inversen Mikroskops.
- Öffnen Sie den CO 2 -Tank und stellen Sie den CO2 -Zufluss auf 160 ml/min ein.
- Stellen Sie die Temperatur der Kammer auf 44 °C (oben), 42 °C (Bad) und 40 °C (Tisch) ein.
- Geben Sie 20 ml gereinigtes Wasser in das Bad der Umgebungskammer, um 90% Luftfeuchtigkeit zu erhalten.
- Nehmen Sie die Petrischale mit Glasboden, die Zielzellen enthält, aus dem Gewebekulturinkubator heraus und legen Sie sie in die Kammer.
- Bringen Sie die Metallklemme der Umgebungskammer an, um die Position der Petrischale zu fixieren.
HINWEIS: Die Petrischale muss fest in der Kammer eingespannt werden, da die Magnetkraft die Schale bewegen kann, wenn sie nicht eingespannt ist. - Schließen Sie den Deckel der Kammer.
- Optimierung von Bildgebungsparametern
- Optimieren Sie die Pinhole-Größe: Das Pinhole blockiert die unscharfen Photonen. Eine größere Pinhole-Größe liefert mehr unscharfe Photonen, aber ein helleres Bild. Eine kleinere Lochblendengröße ergibt ein fokussierteres und dunkleres Bild. Stellen Sie sicher, dass Sie die Lochgröße optimieren, um konfokale Bilder mit dem entsprechenden Signal-Rausch-Verhältnis zu erhalten.
- Laserintensität optimieren: Die Laserintensität bestimmt die Intensität der Anregung und damit das Emissionslicht. Die geringe Laserintensität sorgt für ein niedriges Signal-Rausch-Verhältnis. Eine zu hohe Laserintensität führt zu Photobleiche. Stellen Sie die Laserintensität entsprechend ein.
- Optimieren Sie die Schrittweite und Schritte: Schritte und Schrittweite bestimmen, wie viele Bilder in einem Z-Stack aufgenommen werden. Kleinere Schrittgrößen und mehr Schritte erhöhen die Auflösung des Z-Stacks, erhöhen aber auch das Photobleaching. In diesem Experiment wurde 1 μm Schrittweite für die Zellen mit ~15 μm Zellhöhe verwendet.
- Belichtungszeit optimieren: Die Belichtungszeit bestimmt, wie lange die Zelle dem Anregungslaser ausgesetzt wird. Eine geringe Belichtungszeit verringert das Signal-Rausch-Verhältnis. Eine hohe Belichtungszeit führt zu Photobleiche. In diesem Experiment wurde eine Belichtungszeit von 1 Bild pro 4 s verwendet.
- Optimierung der Bildgebungsparameter: Ändern Sie einen der vier Parameter iterativ und halten Sie die anderen Parameter konsistent. Messen Sie jedes Mal das YAP N/C-Verhältnis jedes Bildes und vergleichen Sie die Änderung des YAP N/C-Verhältnisses, um den Photobleichpegel zu bestimmen. Wiederholen Sie den Optimierungsprozess, bis ein Gleichgewicht zwischen Signal-Rausch-Verhältnis, Bildgeschwindigkeit und Fotobleiche erreicht ist.
- Definieren Sie die Imaging-Konfigurationen mit den optimierten Imaging-Parametern für schnellere Imaging-Einstellungen während der Experimente.
HINWEIS: Die in dieser Studie verwendeten Konfigurationen sind in Abschnitt 5.3 der Bildgebungsparameter beschrieben. Um die Imaging-Parameter der Konfigurationen in Abschnitt 5.3 zu optimieren, verwenden Sie dieselbe Methode wie in Schritt 5.2.5.
- Kleine Kraftanwendung und konfokale Bildgebung
HINWEIS: Nikon Ti2-E Mikroskop wurde für die Bildgebung in dieser Studie verwendet, und detaillierte Schritte für die Bildaufnahme sind unten angegeben.- Öffnen Sie das invertierte Mikroskop. Öffnen Sie die Softwareanwendung Elements.
- Definieren Sie Konfigurations magnetic_find. Überprüfen Sie nur den FITC-Kanal. Stellen Sie PMT HV = 70, Offset = 0, Laserintensität = 10 ein. Stellen Sie die Scangeschwindigkeit auf 1 Bild pro 2 s ein, indem Sie auf die 1/2-Schaltfläche klicken. Stellen Sie die Lochgröße auf 1,2 AE ein, indem Sie auf die Schaltfläche 1,2 AU klicken. Diese Konfiguration wird in Schritt 5.3.5 verwendet.
- Definieren Sie die Konfiguration magnetic_YAP_Nucleus. Überprüfen Sie den FITC-Kanal. Stellen Sie PMT HV = 70, Offset = 0, Laserintensität = 10 ein. Stellen Sie die Scangeschwindigkeit auf 1 Bild pro 4 s ein, indem Sie auf die 1/2-Schaltfläche klicken. Stellen Sie die Lochgröße auf 1,2 AE ein, indem Sie auf die Schaltfläche 1,2 AU klicken. Um die Kerngrenze und die Intensität der Kernfärbung abzubilden, überprüfen Sie den Cy5-Kanal. Stellen Sie PMT HV = 70, Offset = 0, Laserintensität = 10 ein. Die Lochgröße ist für die 3D-YAP-Bildgebung optimiert. Klicken Sie nicht erneut auf die Taste 1.2 A.U., nachdem Sie den Cy5-Kanal überprüft haben. Diese Konfiguration wird in Schritt 5.3.7 verwendet.
- Aktivieren Sie DIA bei Bedarf über Elemente . Öffnen Sie SpinView, verwenden Sie ein Hellfeld und passen Sie den Fokus des Objekts an, um ein klares Bild der Zellen zu erhalten. Verwenden Sie ein 10x-Objektiv, um mehrere einzelne Zellen unter drei Bedingungen zu finden: mit einer einzelnen Mikroperle im Inneren, mit mehreren Mikroperlen im Inneren und ohne Mikroperle im Inneren. Wechseln Sie zum 40-fachen Objektiv. Benennen Sie diese Position mit der entsprechenden Positionsnummer.
- Öffnen Sie Elemente. Klicken Sie auf magnetic_find. Klicken Sie auf die Schaltfläche Verriegelung entfernen.
- Klicken Sie auf Scannen und passen Sie die Z-Position der Fokusebene an. Klicken Sie auf die Schaltflächen oben und unten , um den unteren und oberen Grenzwert für den Z-Stapel der ausgewählten Zellen festzulegen. Beenden Sie den Scanvorgang, indem Sie erneut auf Scannen klicken.
- Wechseln Sie zu magnetic_YAP_Nucleus Konfiguration. Legen Sie den Dateinamen auf before_small_force.nd2 fest. Klicken Sie auf die Schaltfläche Ausführen mit dem aufgezeichneten Z-Stack.
- Wechseln Sie zum rechten Lichtpfad und schalten Sie DIA ein. Öffnen Sie SpinView und klicken Sie auf die Schaltfläche Aufnahme . Drehen Sie in der Zwischenzeit den Knopf des Magnetbewegungsgeräts, um den Magneten bis zu 46 mm über dem Petrischalenboden zu bewegen. Speichern Sie Hellfeld-Bildsequenzen oder Videos. Überprüfen Sie das Video, um zu bestätigen, dass Mikroperlen eine durch Magnetkraft induzierte Verschiebung zeigen.
- Wiederholen Sie die Schritte 5.3.5-5.3.7; Legen Sie den Dateinamen auf after_small_force.nd2 fest.
- Wechseln Sie zum rechten Lichtpfad und schalten Sie DIA ein. Öffnen Sie anschließend SpinView und klicken Sie auf die Schaltfläche Aufnahme . In der Zwischenzeit drehen Sie den Knopf des Magnetbewegungsgeräts, um den Magneten bis zu 120 mm über den Boden der Petrischale zu bewegen. Speichern Sie Hellfeld-Bildsequenzen oder Videos.
- Wiederholen Sie die Schritte 5.3.5-5.3.7 und setzen Sie den Dateinamen auf before_large_force.nd2.
- Großkraftapplikation und konfokale Bildgebung
- Entfernen Sie den Deckel der Umgebungskammer, damit der Magnet 13 mm über den Boden der Petrischale reicht.
- Wechseln Sie zum rechten Lichtpfad und schalten Sie DIA ein. Öffnen Sie SpinView und klicken Sie auf die Schaltfläche Aufnahme . Drehen Sie in der Zwischenzeit den Knopf des Magnetbewegungsgeräts, um den Magneten bis zu 13 mm über den Boden der Petrischale zu bewegen. Speichern Sie Hellfeld-Bildsequenzen oder Videos. Überprüfen Sie das Video, um zu bestätigen, dass Mikroperlen eine durch Magnetkraft induzierte Verschiebung zeigen.
- Wiederholen Sie die Schritte 5.3.5-5.3.7 und setzen Sie den Dateinamen auf after_large_force.nd2.
- Wechseln Sie zum rechten Lichtpfad und schalten Sie DIA ein. Öffnen Sie anschließend SpinView und klicken Sie auf die Schaltfläche Aufnahme . In der Zwischenzeit drehen Sie den Knopf des Magnetbewegungsgeräts, um den Magneten bis zu 120 mm über den Boden der Petrischale zu bewegen. Speichern Sie Hellfeld-Bildsequenzen oder Videos.
- Wiederholen Sie die Schritte 5.3.5-5.3.7; Legen Sie den Dateinamen auf retract_large_force.nd2 fest.
- Schließen Sie den Deckel der Umgebungskammer.
- Wiederholen Sie die Schritte 5.2 und 5.3 für mehrere Sichtfelder, um bei Bedarf weitere Daten zu erhalten.
6. Bildverarbeitung und Datenanalyse
- Quantifizierung des YAP N/C Verhältnisses
- Öffnen Sie Fiji ImageJ. Öffnen Sie die in Schritt 5 aufgenommenen ND2-Abbilder.
- Klicken Sie auf Analysieren > Messungen einstellen. Prüfbereich, integrierte Dichte, mittlerer Grauwert und Formbeschreibungen.
- Verwenden Sie den Cy5-Kanal, um den Kern zu identifizieren. Klicken Sie auf Freihandauswahl , um das Freiauswahlwerkzeug zu verwenden, um den Kern zu skizzieren. Überprüfen Sie auch das automatische Kernmaskenmakro in ImageJ (siehe Materialtabelle).
- Klicken Sie im FITC-Kanal auf Analyze > Measure . Der gemessene Wert des Mittelwerts ist die mittlere Kern-YAP-Intensität DN.
- Verwenden Sie den Cy5-Kanal, um den Kern zu identifizieren. Verwenden Sie den FITC-Kanal, um die Zelle zu identifizieren. Klicken Sie auf Freihandauswahl , um mit dem Freiauswahlwerkzeug einen Bereich von Interesse innerhalb des Zytoplasmas auszuwählen und die magnetische Mikroperle zu vermeiden. Diese Region von Interesse darf nicht den Kern umfassen.
- Klicken Sie im FITC-Kanal auf Analyze > Measure . Der gemessene Wert des Mittelwerts ist die mittlere zytoplasmatische YAP-Intensität DC.
- Berechnen Sie das YAP N/C-Verhältnis = D N / DC.
- Quantifizierung der Kernform und normalisierten Kernfleckenintensität
- Öffnen Sie Fiji ImageJ. Öffnen Sie die in Schritt 5 aufgenommenen ND2-Abbilder.
- Klicken Sie auf Analysieren > Messungen festlegen. Prüfbereich, integrierte Dichte, mittlerer Grauwert und Formbeschreibungen.
- Verwenden Sie den Cy5-Kanal, um den Kern zu identifizieren. Klicken Sie auf Freihandauswahl , um das Freiauswahlwerkzeug zu verwenden, um den Kern zu skizzieren.
- Klicken Sie auf Analyze > Measure in Cy5 channel. Der gemessene Wert des Mittelwerts ist die Intensität der Kernfärbung. Der Messwert von Circ. ist nukleare Zirkularität.
- Um die Intensität der Kernfärbung bei verschiedenen Kraftzuständen zu vergleichen, wird die gesamte Intensität der Kernfärbung durch die Intensität der Kernfärbung in "before_small_force.nd2" dividiert, um die normalisierte Kernfleckenintensität zu erzeugen.
Ergebnisse
Entwurf einer magnetbeweglichen Vorrichtung und Anwendung der Magnetkraft
Um Kraft auf den Kern durch die magnetischen Mikroperlen auszuüben, wurde eine magnetbewegliche Vorrichtung entworfen und gebaut, um die räumliche Position des Magneten zu steuern. Die magnetbewegliche Vorrichtung enthält einen zentralen Rahmen, drei Drehknöpfe und Schienen, um den angebrachten Magneten unabhängig voneinander in x-, y- und z-Richtung mit der räumlichen Auflösung von 1,59 mm pro Zyklus zu bewegen (Abbildung 1A). Sobald der Magnet in die Nähe der 7 μm Mikrokügelchen bewegt wird, die in die Zellen abgegeben werden (Abbildung 1B), zieht er die Mikroperlen magnetisch an und übt Kraft auf den Kern aus (Abbildung 1C). Die Kraftrichtung und -stärke wird durch die relative Position zwischen Magnet und Mikroperlen gesteuert.
In dieser Arbeit wurden zwei verschiedene Kraftgrößen auf die Mikroperlen angewendet: (1) eine relativ kleine Kraft, wenn der Magnet 46 mm über der Zelle platziert wurde; und (2) eine relativ große Kraft, wenn der Magnet 13 mm über der Zelle platziert wurde. Die magnetische Kraft, die auf die Mikroperle F ausgeübt wird, kann durch die Gleichung59 berechnet werden:  , wobei Nd der Entmagnetisierungsfaktor ist (0,33 für eine Kugel), μ die Permeabilität im Vakuum ist (6,3 × 10-3H/m für Eisen), Vp das Volumen der Mikroperle (178 μm3 für eine 7 μm Mikroperle), und H ist die Magnetfeldstärke mit der Einheit A/m. H ist proportional zur magnetischen Flussdichte B mit Einheit Tesla. Da erwartet wurde, dass die magnetische Kraft, die auf eine einzelne 7-μm-Mikroperle wirkt, extrem klein und von einem Kraftaufnehmer schwer zu erfassen ist, wurde die magnetische Flussdichte B als Referenz gemessen, um die Größe der auf die Mikroperlen ausgeübten Magnetkraft anzuzeigen. Ein Hall-Sensor wurde an der Stelle des Petrischalenbodens eingeführt, um die magnetische Flussdichte zu messen, und der Magnet wurde in einem Abstand von 13 mm oder 46 mm vom Boden der Petrischale platziert. Da die 7 μm Mikroperlen das Magnetfeld beeinflussen, wurde die magnetische Flussdichte mit und ohne Mikroperlen gemessen. Unabhängig von der Anwesenheit der 7 μm Mikrokügelchen wurde die gleiche magnetische Flussdichte erhalten: B = 60,1 mT in einem Abstand von 13 mm und B = 3,7 mT in einem Abstand von 46 mm. Diese Messung zeigt, dass die Wirkung von 7 μm Mikroperlen auf das Magnetfeld, das von dem zylindrischen Magneten mit 12,7 mm Durchmesser und 12,7 mm Höhe erzeugt wird (siehe Materialtabelle), mit dem in dieser Studie verwendeten Hall-Sensor nicht nachweisbar war. Allerdings war die magnetische Flussdichte im Gehäuse mit einem Abstand von 13 mm etwa 16-mal höher als die mit einem Abstand von 46 mm. Die experimentelle Kalibrierung der magnetischen Kraft wird im folgenden Abschnitt beschrieben (Abbildung 6).
, wobei Nd der Entmagnetisierungsfaktor ist (0,33 für eine Kugel), μ die Permeabilität im Vakuum ist (6,3 × 10-3H/m für Eisen), Vp das Volumen der Mikroperle (178 μm3 für eine 7 μm Mikroperle), und H ist die Magnetfeldstärke mit der Einheit A/m. H ist proportional zur magnetischen Flussdichte B mit Einheit Tesla. Da erwartet wurde, dass die magnetische Kraft, die auf eine einzelne 7-μm-Mikroperle wirkt, extrem klein und von einem Kraftaufnehmer schwer zu erfassen ist, wurde die magnetische Flussdichte B als Referenz gemessen, um die Größe der auf die Mikroperlen ausgeübten Magnetkraft anzuzeigen. Ein Hall-Sensor wurde an der Stelle des Petrischalenbodens eingeführt, um die magnetische Flussdichte zu messen, und der Magnet wurde in einem Abstand von 13 mm oder 46 mm vom Boden der Petrischale platziert. Da die 7 μm Mikroperlen das Magnetfeld beeinflussen, wurde die magnetische Flussdichte mit und ohne Mikroperlen gemessen. Unabhängig von der Anwesenheit der 7 μm Mikrokügelchen wurde die gleiche magnetische Flussdichte erhalten: B = 60,1 mT in einem Abstand von 13 mm und B = 3,7 mT in einem Abstand von 46 mm. Diese Messung zeigt, dass die Wirkung von 7 μm Mikroperlen auf das Magnetfeld, das von dem zylindrischen Magneten mit 12,7 mm Durchmesser und 12,7 mm Höhe erzeugt wird (siehe Materialtabelle), mit dem in dieser Studie verwendeten Hall-Sensor nicht nachweisbar war. Allerdings war die magnetische Flussdichte im Gehäuse mit einem Abstand von 13 mm etwa 16-mal höher als die mit einem Abstand von 46 mm. Die experimentelle Kalibrierung der magnetischen Kraft wird im folgenden Abschnitt beschrieben (Abbildung 6).
Abgabe von magnetischen Mikroperlen in das Zytoplasma
12 h nach der Aussaat von Zellen auf der Glasboden-Petrischale werden 7 μm Mikroperlen in das Kulturmedium gegeben. Mikroperlen werden spontan von den Zellen verinnerlicht. Da die Mikrokügelchen unter Laseranregung im FITC- oder Cy5-Kanal keine Fluoreszenz emittieren, kann der Ort der internalisierten Mikrokügelchen durch die Position der dunklen Mulde mit der konfokalen Abbildung der Fluoreszenz von YAP und Kern identifiziert werden. Sowohl 2D- als auch 3D-Bilder zeigen, dass sich die Mikroperle außerhalb des Zellkerns im Zytoplasma befindet (Abbildung 2).
Der Internalisierungsgrad von Mikrokügelchen in die Zellen hängt von der Dauer der Kokultur von Zellen und Mikroperlen ab. Daher wurden die Zellen entsprechend der Menge der internalisierten Mikroperlen in drei Typen eingeteilt - keine Mikroperle, einzelne Mikroperle und Multimikroperlen (Abbildung 3A). Nach 7 h Kokultur internalisierten 62% der Zellen keine Mikroperle, 15% der Zellen internalisierten eine einzelne Mikroperle und 23% der Zellen internalisierten Multimikrokügelchen (Gesamtzahl der Zellen = 13). Nach 12 Stunden Kokultur internalisierten 53% der Zellen keine Mikroperle, 26% der Zellen internalisierten eine einzelne Mikroperle und 21% der Zellen internalisierten Multimikroperlen (Gesamtzahl der Zellen = 62). Nach 24 Stunden Kokultur internalisierten 20% der Zellen keine Mikroperle, 28% der Zellen internalisierten eine einzelne Mikroperle und 53% der Zellen internalisierten Multimikroperlen (Gesamtzahl der Zellen = 40) (Abbildung 3B).
Mikroperlen im Zytoplasma beeinflussen Kernform und YAP-Aktivität nicht
Um den Effekt der Internalisierung von Mikrokügelchen auf die Kernform und Proteinaktivität zu untersuchen, wurde zunächst die Kernform durch Zirkularität und die YAP-Aktivität durch YAP N/C-Verhältnis quantifiziert. Die Zirkularität wird durch Zirkularität = 4μ (Fläche / Umfang2) berechnet. Die detaillierten Schritte zur Quantifizierung des YAP-N/C-Verhältnisses wurden in einer früheren Veröffentlichung60 beschrieben. Kurz gesagt, das YAP N/C-Verhältnis wurde berechnet, indem die mittlere YAP-Intensität im Kern durch die mittlere YAP-Intensität im Zytoplasma dividiert wurde. Unter Berücksichtigung der Möglichkeit, dass die Kokultur von Mikroperlen und Zellen die Kernform beeinflussen kann, auch wenn keine Mikroperle internalisiert wird, die Zellen ohne Kokultur (schwarze Punkte, Kontrolle #1, Zirkularität = 0,806 ± 0,037, n = 20), Zellen, die mit Mikroperlen co-kultiviert wurden, aber ohne Internalisierung (graue Punkte, Kontrolle #2, Zirkularität = 0,806 ± 0,035, n = 22), Zellen, die einzelne Mikroperlen internalisieren (rote Punkte, einzelne Mikroperle, Zirkularität = 0,793 ± 0,048, n = 15) und Zellen, die Multimikroperlen internalisieren (blaue Punkte, Multimikroperlen, n = 7) (Abbildung 3C) wurden verglichen. Das Ergebnis zeigt, dass zwischen allen vier getesteten Gruppen die Kernzirkularität keinen signifikanten Unterschied aufwies (Abbildung 3C).
Um zu untersuchen, ob das YAP N/C-Verhältnis durch die Internalisierung von Mikrokügelchen beeinflusst wird, wurden die mit Mikroperlen kokultivierten Zellen, aber ohne Internalisierung (graue Punkte, Kontrolle #2, YAP N/C-Verhältnis = 1,155 ± 0,074, n = 35) nur mit den Zellen mit Einzel- oder Multi-Mikroperlen-Internalisierung (rote Punkte, Zelle mit Mikroperlen, YAP N/C-Verhältnis = 1,140 ± 0,078, n = 36) zur 12. Stunde der Kokultur (Abbildung 3D). Die Zellen ohne Kokultur wurden nicht verglichen, da die Schale mit Mikroperlen eine geringere Zelldichte aufweist, was das YAP N/C Verhältnisbeeinflussen kann 12. Das Ergebnis zeigt keinen signifikanten Unterschied (p-Wert = 0,667) im YAP N/C-Verhältnis zwischen den beiden Gruppen, was darauf hindeutet, dass die Internalisierung von Mikroperlen die YAP-Aktivität nicht beeinflusst (Abbildung 3D).
Magnetische Kraft verformt den Kern
Zunächst wird die Verformung des Kerns gezeigt. Die Verformung des Zellkerns wird durch die Kompressionskraft verursacht, die von den Mikroperlen (Abbildung 4A und Abbildung 4A1-3) in Zellen ausgeübt wird, die Zytoskelett enthalten. Diese Daten (d.h. der Kern wird durch die Kompression der Mikroperle verformt) unterstützen, dass die Mikroperle tatsächlich eine Kraft auf den Kern im überfüllten Zytoplasma ausübt. Ein Hellfeldvideo, das den Krafteinbringungsprozess zeigt, ist im Ergänzungsmaterial enthalten (Ergänzungsvideo 1). Zweitens, weil es möglich ist, dass die Mikroperle gleichzeitig Kraft auf das umgebende Zytoskelett ausübt und den Kern indirekt verformt, wurden die Kompressionsexperimente in Zellen wiederholt, die die gestörten Aktinfilamente aufweisen (Behandlung von Cyto D (2,5 μM, 1 h); Abbildung 4B). Diese Studie zeigt, dass die Aktinfilamente tatsächlich depolymerisiert werden (Abbildung 4B) und der Kern durch die Mikroperlen verformt wird (Abbildung 4B1-3). Diese Daten belegen, dass die Mikroperlen eine Kraft direkt auf den Zellkern ausüben, wenn kein ineinander verschlungenes umgebendes Zytoskelett vorhanden ist. Zusammengenommen zeigen diese Daten, dass die Protokolle und Werkzeuge eine Kraft direkt auf den Kern ausüben können.
Räumliche und zeitliche Kontrolle intrazellulärer magnetischer Mikrokügelchen
Um eine räumliche Kontrolle der Mikroperlen zu erreichen, wurde ein Magnetpaar verwendet, um die Mikroperle zu bewegen und ihre Position der Vertiefung auf dem Kern zu steuern (Abbildung 5A). Die Perle kann nur mit bis zu 2,2 μm Verschiebung bewegt werden (Abbildung 5A1-4), kann aber an entsprechenden Stellen flexibel Einkerbungen auf den Kern aufbringen. Das umgebende Aktinzytoskelett kann die Bewegung von Mikroperlen einschränken. Daher wurde das Aktinzytoskelett durch die Behandlung mit Cyto D (2,5 μM, 1 h) gestört und die Position der Mikroperlen manipuliert, zeigte aber ähnliche Ergebnisse. Daher kann eine Hypothese aufgestellt werden: Die Mikroperle kann physikalisch/chemisch an den Zellkern und andere umgebende Organellen im Zytoplasma binden, was ihre große räumliche Bewegung (>2,2 μm) einschränkt.
Um eine räumliche Kontrolle der Mikroperlen zu erreichen, wurde ein Magnetpaar verwendet, das die Mikroperlen steuert, um die Kraft zweimal (mit unterschiedlicher Kraftgröße) an derselben Stelle des Kerns anzuwenden und freizusetzen (Abbildung 5B und Abbildung 5B1-B4). Die aktuelle Zeitdauer für einen Zyklus der Krafteinleitung und -freigabe beträgt 12 s. Die Geschwindigkeit der zeitlichen Steuerung wird durch die Betriebsgeschwindigkeit des XYZ-Movers bestimmt.
Kalibrierung der Magnetkraft
Die auf den Kern ausgeübte Perlenkraft wurde durch experimentelle Messung der Kraft geschätzt, die durch eine kalibrierte Rasterkraftmikroskopie (AFM) ausgeübt wird, die eine ähnliche Verformung des Kerns verursacht. Insbesondere wurde das Aktinzytoskelett zuerst durch CytoD (2,5 μM; 1 h, Abbildung 4B) aufgelöst, da das AFM Kraft auf die apikale Oberfläche der Zelle ausübt und die Entfernung von Aktinkortex und Zytoskelett einen direkteren Kontakt zwischen AFM-Spitze und Zellkern ermöglicht. Die Zellen, deren Aktinkortex und Zytoskelett aufgelöst sind, sind lebendig, basierend auf dem Vergleich der Kernform und der Kernfärbungsintensität mit denen in gesunden Zellen (ergänzende Abbildung 1). Zweitens wurde die nicht funktionalisierte AFM-Spitze (semi-sphärisch, Radius = 5 μm), die eine ähnliche Größe und Form wie die der Mikrokügelchen hat, verwendet, um die apikale Oberfläche der Zelle kraftkontrolliert einzudrücken und gleichzeitig konfokale 3D-Bilder der Zell- und Kernkörper aufzunehmen (Abbildung 6A). Die Größe der Druckkraft von 0,8 nN bis 2,0 nN wurde gewählt, weil aufgrund der Literatur24 eine Kraft bei einer Größe von 1,5 nN bekannt war, um den Kern ausreichend zu verformen. Drittens wurde die normale Verformung des Kerns, die durch die AFM-Indentation verursacht wurde, durch quantitative Bildgebungsanalyse gemessen. Außerdem wurde die Kalibrierkurve erhalten, die die quantitative AFM-Kraft-Weg-Beziehung liefert (Abbildung 6B). Viertens wurde eine Druckkraft auf die laterale Oberfläche des Kerns ausgeübt, indem Mikroperlen ähnlicher Größe und Form (Radius = 7 μm; Abbildung 6C), und die Verformung der Kernmembran wurde mittels bildgebender Analyse gemessen. Die perlgewirkte Kraft wird basierend auf der AFM-Kraft-Weg-Beziehung geschätzt.
Zum Beispiel beträgt in Abbildung 6C die Verformung des Kerns durch magnetische Mikroperlen (Durchmesser = ~7 μm) bei "großer Kraft" etwa 1,5 μm. In Abbildung 6D wurde eine AFM-Spitze mit einer halbkugelförmigen 5-μm-Sonde verwendet, um die Zelle oben auf dem Kern einzudrücken, um eine Kernverformung von 1,5 μm zu erreichen. Die entsprechende von AFM aufgezeichnete Kraft beträgt 1,4 nN. Daher wird die von den Mikroperlen ausgeübte Kraft auf ~1,4 nN geschätzt. Nach dem gleichen Ansatz wird die magnetische Kraft bei "kleiner Kraft" als 0,8 nN kalibriert und verursachte einen Kerneindruck von 0,4 μm.
Diese Studie geht davon aus, dass die AFM-gemessene Kraft die von Mikroperlen ausgeübte Kraft darstellen kann, basierend auf den folgenden Annahmen: (1) Die Steifigkeit des Kerns innerhalb verschiedener Zellen ist ähnlich. (2) Die mechanischen Eigenschaften des Kerns hängen nicht von den Kernstandorten ab, an denen die Eindringung angebracht wurde. Die magnetische Kraft wird horizontal auf die lateralen Seiten des Kerns ausgeübt, während die AFM-Kraft vertikal auf die apikalen Seiten des Kerns ausgeübt wird. Der mechanische Unterschied zwischen ihnen wird als vernachlässigbar angenommen. (3) In AFM-Experimenten übt die Sonde direkt Kraft durch die Zellmembran und das Zytoskelett auf den Zellkern aus. Nach dem Aufbrechen der Aktinfilamente ist die von AFM ausgeübte Kraft auf den Kern ähnlich der von Mikroperlen ausgeübten Kraft auf den Kern, obwohl sich die Membran im ersten Fall immer noch zwischen der AFM-Sonde und dem Kern befindet.
Magnetkraft löst Änderung des YAP N/C-Verhältnisses aus
Um zu beweisen, dass die magnetische Kraft, die auf die Mikroperlen ausgeübt wird, den Kern verformen und eine YAP-Translokation induzieren kann, wurde das YAP N/C-Verhältnis der Zellen mit Mikroperleninternalisierung in drei Stufen quantifiziert: (1) vor dem Anlegen der Kraft, (2) nach der Krafteinwirkung und (3) nach dem Loslassen der Kraft. Einige Zellen zeigten eine Veränderung der Kernform und des YAP N/C-Verhältnisses, wenn die Kraft angewendet oder freigesetzt wurde (Abbildung 7A,C). Die Intensitätsänderungen in YAP können durch zwei mögliche Mechanismen zurückgeführt werden: (1) YAP-FP-Proteine translozieren nach Kraftanwendung aus dem Zytoplasma in den Zellkern. In diesem Fall sollte die nukleare Färbung keine Signaländerungen zeigen. Die Intensität der nuklearen Färbung sollte sich nicht wesentlich ändern; (2) YAP-FP-Proteine translozieren sich nach Kraftanwendung nicht. Die beobachteten YAP-Intensitätsänderungen sind auf die kraftinduzierte Kernvolumenänderung und die daraus resultierende YAP-FP-Konzentrationsänderung zurückzuführen. In diesem Fall sollte sich die Intensität der Kernfärbung in einem ähnlichen Trend wie die YAP-Kernintensität ändern, da sich auch die Konzentration des Färbefarbstoffs ändert, wenn sich das Kernvolumen ändert. Dazu wurde die Änderung der Kernfärbungsintensität aus dem roten Kanal (Anregung: 650 nm; Emission: 681 nm) gemessen. Die Intensität ändert sich in YAP im grünen Kanal, aber es gibt keine Intensitätsänderungen in der Kernfärbung im roten Kanal. Somit existiert wahrscheinlich der erste Mechanismus (Abbildung 7B). Insgesamt zeigen die Ergebnisse, dass die magnetkraftinduzierte Kernverformung die YAP-Translokation auslöst.
Als nächstes wurde die Nettoänderung des YAP N/C-Verhältnisses innerhalb von zwei Zellgruppen quantifiziert: (1) Zellen ohne Mikroperlen internalisiert (graue Punkte, Kontrolle, n = 9); und (2) ausgewählte Zellen mit internalisierten Mikroperlen, die eine Änderung des YAP N/C-Verhältnisses zeigen (grüne Punkte für kleine Kraft, rote Punkte für große Kraft, n = 11). Bei 0,8 nN-Kraft zeigen Zellen mit internalisierten Mikroperlen(n) eine Netto-YAP N/C-Verhältnisänderung = -0,030 ± 0,029, n = 11; Kontrollzellen zeigen Netto-YAP N/C-Verhältnisänderung = -0,003 ± 0,012, n = 9. Bei 1,4 nN-Kraft zeigen Zellen mit internalisierten Mikroperlen(n) eine Netto-YAP N/C-Verhältnisänderung = 0,011 ± 0,040, n = 11; Kontrollzellen zeigen eine Netto-YAP-N/C-Verhältnisänderung = 0,005 ± 0,005, n = 9 (Abbildung 8A). Bei 0,8 nN-Kraft zeigen Zellen mit internalisierten Mikroperlen(n) eine absolute Netto-YAP N/C-Verhältnisänderung = 0,057 ± 0,017, n = 11; Kontrollzellen zeigen Netto-YAP N/C-Verhältnisänderung = 0,021 ± 0,007, n = 9. Die Differenz ist signifikant (p-Wert = 0,0093, **). Bei 1,4 nN-Kraft zeigen Zellen mit internalisierten Mikroperlen(n) eine absolute Netto-YAP N/C-Verhältnisänderung = 0,070 ± 0,020, n = 11; Kontrollzellen zeigen Netto-YAP N/C-Verhältnisänderung = 0,010 ± 0,003, n = 9. Der Unterschied ist signifikant (p-Wert = 0,0007, ***) (Abbildung 8B). Zusammen bestätigen diese Ergebnisse, dass die magnetische Kraft, die auf die Mikroperlen im Zytoplasma ausgeübt wird, tatsächlich eine YAP-Translokation induzieren und das YAP N / C-Verhältnis ändern kann.
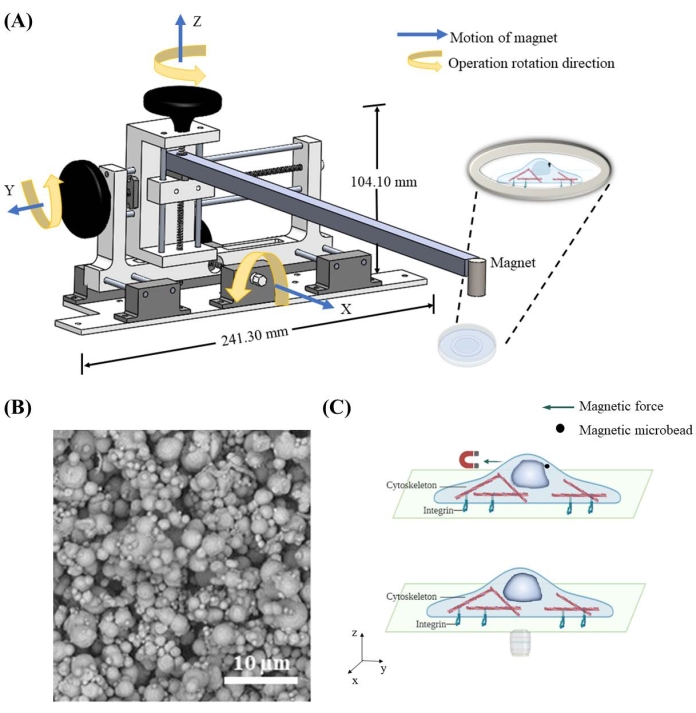
Abbildung 1: Aufbau der magnetischen beweglichen Vorrichtung und schematische Krafteinwirkung in der Zelle durch magnetische Mikroperlen . (A) Dreidimensionales Schema der Vorrichtung, die implementiert ist, um den Magneten zu halten und ihn in x-, y- und z-Richtung zu bewegen. Das Gerät besteht aus einem Sockel von 241,3 mm Breite und 104,1 mm Höhe, zwei Knöpfen, einer Stange und einem Magneten. Die Knöpfe werden in die richtige Rotationsrichtung verzahnt, wodurch eine Bewegung in die entsprechende Richtung erfolgt. Der Magnet wird näher an die Schüssel abgesenkt / weiter angehoben, um magnetische Kraft mit unterschiedlicher Größe und Richtung auf magnetische Mikroperlen anzuwenden. (B) Beispiel eines Rasterelektronenmikroskops (REM) von 7 μm Eisenmikroperle. (C) Magnetische Mikrokügelchen, die im Zytoplasma abgegeben werden, können Kraft auf die Organellen wie den Kern ausüben, wenn ein Magnetfeld angelegt wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
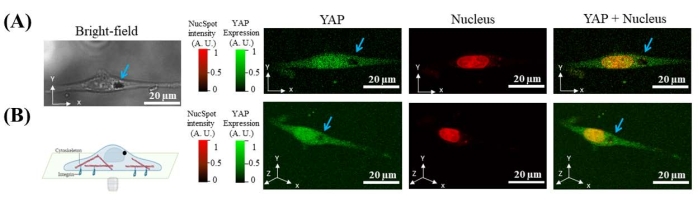
Abbildung 2: Repräsentative Bilder, die zeigen, dass magnetische Mikroperlen (schwarze hohle Höhle mit blauem Pfeil) in der Zelle (gekennzeichnet durch YAP) und außerhalb des Zellkerns internalisiert sind . (A) X-Y-Querschnitt einer Zelle aus YAP (grün), Kern (rot) und Hellfeld. (B) 3D-Rekonstruktion der Zelle. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 3: Von den Zellen internalisierte Mikrokügelchen haben keinen Einfluss auf die Kernform und das YAP N/C-Verhältnis . (A) Repräsentative Hellfeld- und Fluoreszenzbilder von Zellen ohne Mikroperlen-, Einzelperlen- und Multi-Mikroperlen-Internalisierung. Blaue Pfeile zeigen die Position von Mikroperlen im Zytoplasma an. (B) Bei 7 h (n = 13), 12 h (n = 62) und 24 h (n = 40) der Kokultur der Prozentsatz der Zellen, die keine Mikroperlen-, Einzelmikroperlen- und Multimikroperleninternalisierung aufweisen. (C) Die Kernzirkularität zeigt keinen signifikanten Unterschied zwischen Kontrollzellen und Zellen mit Mikroperleninternalisierung. Kontrolle #1 (ohne Mikroperlen-Kokultur): Zirkularität = 0,806 ± 0,037, n = 20; Kontrolle #2 (mit Mikroperlen-Kokultur, ohne Mikroperleninternalisierung): Zirkularität = 0,806 ± 0,035, n = 22; Internalisierung einzelner Mikrokügelchen: Zirkularität = 0,793 ± 0,048, n = 15; Multimikroperlen-Internalisierung: Zirkularität = 0,780 ± 0,061, n = 7. (D) Das YAP N/C-Verhältnis zeigt keinen signifikanten Unterschied (p-Wert = 0,667) zwischen Kontrollzellen (mit Mikroperlen-Kokultur, ohne Mikroperleninternalisierung, YAP N/C-Verhältnis = 1,155 ± 0,074, n = 35) und Zellen mit Mikroperleninternalisierung (YAP N/C-Verhältnis = 1,140 ± 0,078, n = 36). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 4: Direkte Krafteinwirkung auf den Kern mit und ohne Aktinfilamente. (A) Zellen zeigen Aktinfilamente (gelb). (A1) Bild des Kerns, wenn keine Kraft ausgeübt wird. (A2) Bild des Kerns nach Krafteinwirkung. (A3) Das Überlappungsbild der Kerngrenze vor und nach der Kraftanwendung zeigt eine nukleare Vertiefung. (B) Zellen zeigen gestörte Aktinfilamente (gelb) nach Cyto-D-Behandlung (2,5 μM, 1 h). (B1) Bild des Kerns, wenn keine Kraft ausgeübt wird. (B2) Bild des Kerns nach Krafteinwirkung. (B3) Das Überlappungsbild der Kerngrenze vor und nach der Kraftanwendung zeigt eine nukleare Vertiefung mit dem gestörten Aktinzytoskelett. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 5: Räumliche und zeitliche Kontrolle der intrazellulären magnetischen Mikroperle. (A) Ein Magnetpaar steuert die magnetische Mikroperle räumlich. (A1) Hellfeldbild der Zellgrenze (grüne Linie), der Kerngrenze (rote Linie) und der magnetischen Mikroperle (gelbe Linie) an Position 1. (A2) Magnetische Mikroperle drückt den Kern an Position 1 ein. (A3) Die magnetische Mikroperle wird an Position 2 (gelbe Linie) bewegt. Position 1 wird als Referenz angezeigt (gelbe gestrichelte Linie). (A4) Magnetische Mikroperle drückt den Kern an Position 2 ein. (B) Ein Magnetpaar steuert zeitlich magnetische Mikroperlen. (B1) Hellfeldbild einer Zelle ohne Krafteinwirkung zum Zeitpunkt I. (B2) Magnetische Mikroperle übt zum Zeitpunkt II eine Kraft auf den Kern aus. (B3) Magnetische Mikroperle setzt die Kraft aus dem Kern zum Zeitpunkt III frei. (B4) Magnetische Mikroperle übt zum Zeitpunkt IV eine größere Kraft auf den Kern aus. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
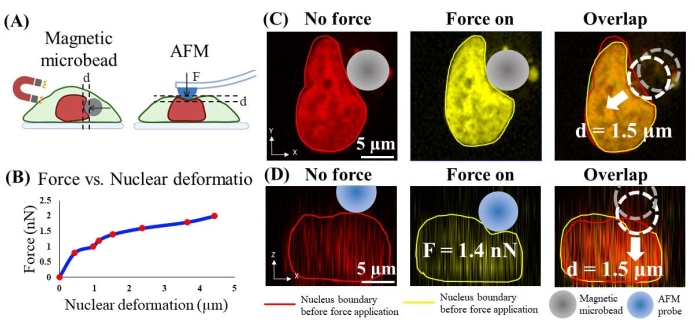
Abbildung 6. Kalibrierung der von Mikroperlen ausgeübten Kraft auf den Kern mittels AFM-Eindringung. (A) Schematische Darstellung des Kalibrierungsprozesses. Die magnetische Mikroperle wendet eine horizontale Kompression auf den Kern an (links) und die AFM-Sonde nimmt den Kern vertikal ein. (B) AFM-Eindringkraft vs. Kernverformung. (C) Repräsentatives Bild der Kernverformung (1,5 μm) vor und nach Krafteinwirkung durch magnetische Mikroperlen. (D) Repräsentatives Bild einer ähnlichen Kernverformung (1,5 μm) vor und nach AFM-Eindringung mit 1,4 nN-Kraft. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 7: Repräsentative Daten, die zeigen, dass die Änderung des YAP N/C-Verhältnisses durch magnetische Krafteinleitung und -abgabe induziert wird . (A) X-Y-Querschnitt von YAP (grün) und Kern (rot) fluoreszierendes Bild der Zelle ohne Kraft, Kraft an und Kraft aus. Im Force-On-Zustand nimmt die zytoplasmatische YAP-Intensität an der Stelle ab, die durch einen gelben Pfeil gekennzeichnet ist, während die Intensität des Kern-YAP zunimmt. YAP N/C Verhältnis steigt. (B) Das YAP N/C-Verhältnis steigt bei eingeschalteter Kraft (von 1,0791 auf 1,2327) und nimmt ab, wenn die Kraft ausgeschaltet wird (von 1,2327 auf 1,1548). Die normalisierte Kernfleckenintensität zeigt eine geringfügige Änderung bei Krafteinwirkung (1,00117) und Freisetzung (0,95578). (C) X-Z-Querschnitt von YAP (grün) und Kern (rot) Bild der Zelle ohne Kraft, Kraft an und Kraft aus. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 8: Änderung des YAP N/C-Verhältnisses, induziert durch Magnetkrafteinwirkung. (A) Bei 0,8 nN-Kraft zeigen Zellen mit internalisierten Mikroperlen(n) eine Nettoänderung des YAP N/C-Verhältnisses = -0,030 ± 0,029, n = 11; Kontrollzellen zeigen Netto-YAP N/C-Verhältnisänderung = -0,003 ± 0,012, n = 9. Bei 1,4 nN-Kraft zeigen Zellen mit internalisierten Mikroperlen(n) eine Netto-YAP N/C-Verhältnisänderung = 0,011 ± 0,040, n = 11; Kontrollzellen zeigen Netto-YAP N/C-Verhältnisänderung = 0,005 ± 0,005, n = 9. (B) Bei 0,8 nN-Kraft zeigen Zellen mit internalisierten Mikroperlen(n) eine absolute Netto-YAP N/C-Verhältnisänderung = 0,057 ± 0,017, n = 11; Kontrollzellen zeigen Netto-YAP N/C-Verhältnisänderung = 0,021 ± 0,007, n = 9. Die Differenz ist signifikant (p-Wert = 0,0093, **). Bei 1,4 nN-Kraft zeigen Zellen mit internalisierten Mikroperlen(n) eine absolute Netto-YAP N/C-Verhältnisänderung = 0,070 ± 0,020, n = 11; Kontrollzellen zeigen Netto-YAP N/C-Verhältnisänderung = 0,010 ± 0,003, n = 9. Der Unterschied ist signifikant (p-Wert = 0,0007, ***) Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Abbildung 1: Kernform und Kernfärbungsintensität. (A) Ohne Cyto D-Behandlung, (B) mit Cyto-D-Behandlung und (C) tote Zellen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzendes Video 1: Ein Hellfeld-Video, das den Krafteinbringungsprozess zeigt. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Diskussion
Die Internalisierung magnetischer Mikroperlen (Abschnitt 2.2) ist von entscheidender Bedeutung, da extrazelluläre Mikroperlen keine Kraft direkt auf den Kern ausüben können. Krafteinleitung und Bildgebung (Abschnitt 5.3) sind kritische Schritte in diesem Experiment, und die Kraft, die benötigt wird, um den Kern zu verformen und sinnvolle biologische Konsequenzen zu induzieren, könnte probenabhängig sein. Die Kraftstärke in diesem Experiment (0,8 nN und 1,4 nN) kann weiter erhöht werden, um die nukleare Mechano-Sensorik in weniger empfindlichen Zellen auszulösen.
Um magnetische Kraft quantitativ mit hohem Durchsatz anzuwenden, ist die Internalisierung einer einzelnen Mikroperle ein idealer Ansatz. In dieser Studie war der Prozentsatz der Zellen mit Einzelperleninternalisierung nach 12 h (26%) und 24 h (28%) ähnlich, während die Zellen ohne Mikroperleninternalisierung nach 12 h (53%) höher waren als nach 24 h (20%) (Abbildung 3B). Es wird angenommen, dass 12 h der optimale Zeitpunkt für Kraftapplikationsexperimente ist, da mehr einzelne Mikrokügelchen einbezogen und Zellen kontrolliert werden können. Für verschiedene Zelllinien und Mikroperlengrößen sollten Kokulturzeit und Mikroperlenkonzentration getestet werden, um die entsprechenden optimalen Bedingungen zu bestimmen.
In den Experimenten wurden die Mikroperlen nicht beschichtet, um spezifisch an den Zellkern zu binden. Daher ist die Kraft, die direkt von den Mikroperlen auf den Kern übertragen wird, wahrscheinlich nur kompressiv. Die Ergebnisse zeigen, dass das YAP N/C-Verhältnis die Zellpopulation erhöht und verringert (Abbildung 8A). Ein möglicher Grund ist, dass die Magnetkraft , die über die Mikroperlen ausgeübt wird, eine positive oder negative Spannungsänderung innerhalb des Zytoskeletts verursachen und das YAP N / C-Verhältnis regulieren kann, um zu erhöhen oder zu verringern bzw.28. Frühere Forschungen zeigen, dass die Druckkraft auf den Kern eine Erhöhung des YAP N/C-Verhältnisses induziert28. In zukünftigen Experimenten kann das Zytoskelett gestört werden, um die direkte Krafterfassung des Kerns zu untersuchen, um die Kraftübertragung vom Zytoskelett in den Kern zu eliminieren.
Es gibt zwei potenzielle Nachteile in den derzeitigen Methoden. Zunächst wurde in diesen Experimenten der 3D-Mover (Abbildung 1A) verwendet, um die Bewegung der Perlen anzupassen, die durch konfokale Echtzeit-Bildgebung überwacht wird und darauf abzielt, eine Druckkraft auf den Kern auszuüben. Aufgrund der rutschigen Natur der Kernmembran und der komplexen Umgebung im Zytoplasma ist die Richtung der auf Perlen ausgeübten Kraft jedoch möglicherweise nicht rein kompressiv (dh nicht absolut senkrecht zur Kernmembranoberfläche). Diese Unvollkommenheit kann dazu führen, dass eine Scherkraft auf die Kernmembran ausgeübt wird. Zweitens sind die aktuellen Mikrokügelchen, die in dieser Studie verwendet werden, nicht mit dem Antikörper konjugiert, um an den Kern zu binden, da die räumliche Mobilität der Perlen im aktuellen Experiment entscheidend ist, um den Vorteil eines berührungslosen magnetischen Aktors zu demonstrieren. Daher kann die derzeitige Methode keine Spannung auf die Kernmembran ausüben.
In Zukunft werden (1) Beads mit Anti-Nesprin-1-Antikörpern konjugiert, um spezifisch an den Zellkern zu binden. Dadurch kann die direkte und spezifische Kraftübertragung zwischen Mikroperlen und den Zielproteinen gewährleistet werden. (2) Die Richtung der Kraft wird kalibriert, indem die einzelne magnetische Mikroperle in weichem Hydrogel manipuliert wird, das mit fluoreszierenden Perlen eingebettet ist. Die 3D-Verschiebung fluoreszierender Perlen kann verwendet werden, um das Verformungsfeld des Hydrogels zu berechnen und die Kraftrichtung als Funktion des angelegten Magnetfeldes zu bestimmen. Nachdem die Mikroperle chemisch mit dem Kern verbunden ist, bestimmt die Anwendung einer Kraft mit einer bekannten Richtung den Krafttyp (Spannung, Kompression oder Scherung). (3) Die 3D-Bildgebung der Kernfärbung wird verwendet, um ein 3D-Simulations-FEM-Modell des Kerns zu erstellen. Die Kraftrichtung kann durch Vergleich der Kernverformung vor und nach der magnetischen Krafteinwirkung überprüft werden.
Die einzigartige Technik, die in dieser Studie entwickelt wurde, bietet mehrere potenzielle Vorteile: (1) Im Vergleich zur vertikalen Eindringung durch AFM-Sonden können magnetische Mikroperlen Kraft in jede Richtung ausüben. Zellen, die auf 2D-Substratoberflächen kultiviert werden, können eine heterogene Proteinverteilung und -orientierung auf ihren vertikalen und horizontalen Oberflächen der Plasmamembran und der Kernhülle aufweisen. Die horizontale Kraftanwendung kann bisher unbeobachtete mechanosensorische Reaktionen induzieren. (2) Sobald die Mikroperlen funktionell beschichtet sind, um an die Kerne zu binden, können sowohl Schub- als auch Zugkräfte direkt auf den Kern ausgeübt werden, um die differentielle nukleare Mechano-Erfassung aufgrund der unterschiedlichen Kraftrichtungen weiter zu untersuchen. (3) Durch die Kontrolle der spezifischen Bindung von Mikrokügelchen an bestimmte Kernhüllenproteine können bisher wenig untersuchte Mechanismen der Kernkraftmessung aufgeklärt werden. Neue Beweise zeigen, dass der Kern wahrscheinlich ein Mechanosensor36 ist und die nukleare Mechano-Sensorik der direkteste Regulator der YAP-Translokation28 ist. Der Mechanismus der kernregulierten YAP-Translokation wird aktiv untersucht und mehrere Kandidaten für Mechano-Sensoren oder Parameter im Kern vorgeschlagen, einschließlich Kernporengröße28, Kernform 25,61, LINC-Komplex und Kernhüllenspannung20. Die Manipulation der magnetischen Mikroperlen eröffnet die Möglichkeit zur detaillierten Erforschung solcher Mechanismen durch direkte Kraftanwendung auf den LINC-Komplex und kontrollierte Regulierung der nuklearen Hüllkurve Spannung und Form. (4) Neben der Anwendung von Kräften auf den Zellkern eignen sich Mikroperlen auch dazu, an die Innenseite der Plasmamembran zu binden, um zu zeigen, wie die intrazellulären Domänen von Membranproteinen und ihr Komplex auf biophysikalische Signale reagieren.
Zusammenfassend demonstrierte diese Arbeit eine Methode, die (1) mikrogroße Eisenmikroperlen in das Zytoplasma liefert, ohne die Kernmorphologie und Proteinfunktionen zu beeinträchtigen, (2) Kraft auf den Kern durch magnetische Mikroperlen ausübt und (3) während der Kraftanwendung konfokale Fluoreszenz-Lebendzellbildgebung durchführt. Diese nicht-invasiven Werkzeuge eröffnen die Möglichkeiten für die direkte epigenetische Manipulation von Organellen in einzelnen Zellen, die auf Super-Resolution-Bildgebung basierende Abfrage der Nukleus-Mechanotransduktion und die detaillierte Erforschung der kraftregulierten 3D-Chromosomenorganisation (in Kombination mit Hi-C: hochauflösende Chromosomenbestätigung) und Reprogrammierung im Kontext der Zellphysiologie und Pathobiologie.
Offenlegungen
Es gibt keine Interessenkonflikte zu erklären.
Danksagungen
Dieses Projekt wird durch das UF Gatorade Award Start-up Package (X. T.), den UFHCC Pilot Award (X. T. und Dr. Dietmar Siemann), den UF Opportunity Seed Fund (X. T.) und das UFHCC University Scholars Program (H. Y. Wang) finanziert. Wir schätzen die intellektuellen Gespräche und die fachliche Unterstützung durch Dr. Jonathan Licht (UFHCC), Dr. Rolf Renne (UFHCC), Dr. Christopher Vulpe (UFHCC), Dr. Blanka Sharma (BME), Dr. Mark Sheplak (MAE & ECE), Dr. Daniel Ferris (BME), Dr. Malisa Sarntinoranont (MAE), Dr. Ashok Kumar (MAE), Dr. Benjamin Keselowsky (BME), Dr. Brent Gila (RSC), Dr. Philip Feng (ECE), Dr. Gregory A. Hudalla (BME), Dr. Steven Ghivizzani (OSSM), Dr. Yenisel Cruz-Almeida (CDBS), Dr. Roger Fillingim (CD-BS), Dr. Robert Caudle (OMS), Dr. John Neubert (DN-OR), Dr. Justin Hiliard (Neurochirurgie), Dr. Tian He (Harvard University), Dr. Youhua Tan (Hong Kong Polytechnic University), Dr. Jessie L-S Au (Institute of Quantitative Systems Pharmacology), Dr. David Hahn (University of Arizona), und Support-Team von Nikon (Dr. Jose Serrano-Velez, Larry Kordon und Jon Ekman). Wir sind zutiefst dankbar für die effektive Unterstützung durch alle Mitglieder der Forschungslabors von Tang, Yamaguchi, Sharma, Au, Siemann und Guan sowie alle Mitarbeiter der UF MAE-Abteilung.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.05 % Trypsin | Corning | 25-051-CI | |
| 25 cm2 flask | Corning | 156340 | |
| 7-µm mean diameter carbonyl iron microbeads | N/A | N/A | |
| A1R confocal system | Nikon | ||
| Carbonyl Iron Powder CM | BASF | 30042253 | Magnetic microbead |
| Culture medium (RPMI-1640) | Gibco | 11875093 | |
| Desktop Computer | Dell | with Windows 10 operating system | |
| Environmental chamber TIZB | Tokai Hit | TIZB | |
| Fetal bovine serum (FBS) | Gibco | 26140 | |
| Fiji ImageJ | National Institutes of Health and the Laboratory for Optical and Computational Instrumentation | ||
| Glass-bottom petri dish | MatTek | P35G-1.5-14-C | |
| Magnet | K&J Magnetics, Inc. | D99-N52 | |
| Monochrome Camera | FLIR | BFS-U3-70S7M-C | |
| NIS-Elements software platform | Nikon | software platform | |
| Nucleus mask ImageJ macro | https://github.com/KOLIUG/Nuclear mask | ||
| NucSpot Live 650 | Biotium | #40082 | Nuclear stain |
| Penicillin-streptomycin | Gibco | 15140122 | |
| Phosphate buffered saline (PBS) | Gibco | 10010023 | |
| Ti2-E inverted microscope | Nikon | ||
| XYZ mover (CAD files) | https://github.com/KOLIUG/XYZ-mover |
Referenzen
- Discher, D. E., Janmey, P., Wang, Y. Tissue cells feel and respond to the stiffness of their substrate. Science. 310 (5751), 1139-1143 (2005).
- Janmey, P. A., Fletcher, D. A., Reinhart-King, C. A. Stiffness sensing by cells. Physiological Reviews. 100 (2), 695-724 (2020).
- Bajaj, P., Tang, X., Saif, T. A., Bashir, R. Stiffness of the substrate influences the phenotype of embryonic chicken cardiac myocytes. Journal of Biomedical Materials Research Part A. 95 (4), 1261-1269 (2020).
- Tang, X., et al. Mechanical force affects expression of an in vitro metastasis-like phenotype in HCT-8 cells. Biophysical Journal. 99 (8), 2460-2469 (2010).
- Hofmann, M., et al. Lowering of tumor interstitial fluid pressure reduces tumor cell proliferation in a xenograft tumor model. Neoplasia. 8 (2), 89-95 (2006).
- Yankaskas, C. L., et al. The fluid shear stress sensor TRPM7 regulates tumor cell intravasation. Science Advances. 7 (28), (2021).
- Kim, E., et al. A biosynthetic hybrid spidroin-amyloid-mussel foot protein for underwater adhesion on diverse surfaces. ACS Applied Materials and Interfaces. 13 (41), 48457-48468 (2021).
- Tajik, A., et al. Transcription upregulation via force-induced direct stretching of chromatin. Nature Materials. 15 (12), 1287-1296 (2016).
- Lee, J., Abdeen, A. A., Tang, X., Saif, T. A., Kilian, K. A. Matrix directed adipogenesis and neurogenesis of mesenchymal stem cells derived from adipose tissue and bone marrow. Acta Biomaterialia. 42, 46-55 (2016).
- Lee, J., Abdeen, A. A., Tang, X., Saif, T. A., Kilian, K. A. Geometric guidance of integrin mediated traction stress during stem cell differentiation. Biomaterials. 69, 174-183 (2015).
- Ren, B., et al. Study of sacrificial ink-assisted embedded printing for 3D perfusable channel creation for biomedical applications. Applied Physics Reviews. 9 (1), 011408(2022).
- Coyle, S., et al. Cell alignment modulated by surface nano-topography-Roles of cell-matrix and cell-cell interactions. Acta Biomaterialia. 142, 149-159 (2022).
- Sawada, Y., et al. Force sensing by mechanical extension of the Src family kinase substrate p130Cas. Cell. 127 (5), 1015-1026 (2006).
- Aragona, M., et al. A mechanical checkpoint controls multicellular growth through YAP/TAZ regulation by actin-processing factors. Cell. 154 (5), 1047-1059 (2013).
- Tang, X., et al. Specific and non-specific adhesion in cancer cells with various metastatic potentials. Mechanobiology of Cell-Cell and Cell-Matrix Interactions. , Springer. Boston, MA. 105-122 (2011).
- Tang, X., Saif, T. A. Adhesivity of colon cancer cells during in vitro metastasis. International Journal of Applied Mechanics. 5 (03), 1350025(2013).
- Chaudhuri, O., et al. Effects of extracellular matrix viscoelasticity on cellular behaviour. Nature. 584 (7822), 535-546 (2020).
- Ohashi, K., Fujiwara, S., Mizuno, K. Roles of the cytoskeleton, cell adhesion and rho signalling in mechanosensing and mechanotransduction. The Journal of Biochemistry. 161 (3), 245-254 (2017).
- Hamill, O. P., Martinac, B. Molecular basis of mechanotransduction in living cells. Physiological Reviews. 81 (2), 685-740 (2001).
- Liang, C., et al. Towards an integrative understanding of cancer mechanobiology: Calcium, YAP, and microRNA under biophysical Forces. Soft Matter. 18, 1112-1148 (2022).
- Tan, Y., et al. Matrix softness regulates plasticity of tumour-repopulating cells via H3K9 demethylation and Sox2 expression. Nature Communications. 5 (1), 1-12 (2014).
- Poh, Y., et al. Dynamic force-induced direct dissociation of protein complexes in a nuclear body in living cells. Nature Communications. 3 (1), 1-10 (2012).
- Tang, X., et al. A mechanically-induced colon cancer cell population shows increased metastatic potential. Molecular Cancer. 13 (1), 1-15 (2014).
- Wu, J., et al. Effects of dynein on microtubule mechanics and centrosome positioning. Molecular Biology of the Cell. 22 (24), 4834-4841 (2011).
- Tang, X., Ali, M. Y., Saif, M. T. A novel technique for micro-patterning proteins and cells on polyacrylamide gels. Soft Matter. 8 (27), 7197-7206 (2011).
- Tang, X., Bajaj, P., Bashir, R., Saif, T. A. How far cardiac cells can see each other mechanically. Soft Matter. 7 (13), 6151-6158 (2011).
- Tang, X., et al. Mechanical force affects expression of an in vitro metastasis-like phenotype in HCT-8 cells. Biophysical Journal. 99 (8), 2460-2469 (2010).
- Elosegui-Artola, A., et al. Force triggers YAP nuclear entry by regulating transport across nuclear pores. Cell. 171 (6), 1397-1410 (2017).
- Gudipaty, S. A., et al. Mechanical stretch triggers rapid epithelial cell division through Piezo1. Nature. 543 (7643), 118-121 (2017).
- Tang, X., et al. Attenuation of cell mechanosensitivity in colon cancer cells during in vitro metastasis. PLoS One. 7 (11), 50443(2012).
- Cha, C., et al. Top-down synthesis of versatile polyaspartamide linkers for single-step protein conjugation to materials. Bioconjugate Chemistry. 22 (12), 2377-2382 (2012).
- Chen, X., et al. Glycosaminoglycans modulate long-range mechanical communication between cells in collagen networks. Proceedings of the National Academy of Sciences of the United States of America. 119 (15), (2022).
- Boyle, J. J., Pless, R. B., Thomopoulos, S., Genin, G. M. Direct estimation of surface strain fields from a stereo vision system. Journal of Biomechanical Engineering. 142 (7), 074503(2020).
- Kim, S., Uroz, M., Bays, J. L., Chen, C. S. Harnessing mechanobiology for tissue engineering. Developmental Cell. 56 (2), 180-191 (2021).
- Driscoll, T. P., et al. Cytoskeletal to nuclear strain transfer regulates YAP signaling in mesenchymal stem cells. Biophysical Journal. 108 (12), 2783-2793 (2015).
- Guilluy, C., et al. Isolated nuclei adapt to force and reveal a mechanotransduction pathway in the nucleus. Nature Cell Biology. 16 (4), 376-381 (2014).
- Vashisth, M. Scaling concepts in 'omics: Nuclear lamin-B scales with tumor growth and often predicts poor prognosis, unlike fibrosis. Proceedings of the National Academy of Sciences of the United States of America. 118 (48), (2021).
- Roberts, A. B., et al. Tumor cell nuclei soften during transendothelial migration. Journal of Biomechanics. 121, 110400(2021).
- Denais, C. M., et al. Nuclear envelope rupture and repair during cancer cell migration. Science. 352 (6283), 353-358 (2016).
- Raab, M., et al. ESCRT III repairs nuclear envelope ruptures during cell migration to limit DNA damage and cell death. Science. 352 (6283), 359-362 (2016).
- Lammerding, J., et al. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. The Journal of Clinical Investigation. 113 (3), 370-378 (2004).
- Shelby, J., Patrick, J., Edgar, S., Chiu, D. T. Monitoring cell survival after extraction of a single subcellular organelle using optical trapping and pulsed-nitrogen laser ablation. Photochemistry and Photobiology. 81 (4), 994-1001 (2005).
- Caspi, A., Granek, R., Elbaum, M. Diffusion and directed motion in cellular transport. Physical Review E. 66 (1), 011916(2002).
- Svoboda, K., Block, S. M. Biological applications of optical forces. Annual Review of Biophysics and Biomolecular Structure. 23 (1), 247-285 (1994).
- Rohrbach, A. Stiffness of optical traps: quantitative agreement between experiment and electromagnetic theory. Physical Review Letters. 95 (16), 168102(2005).
- Neuman, K. C., et al. Characterization of photodamage to Escherichia coli in optical traps. Biophysical Journal. 77 (5), 2856-2863 (1999).
- Kanger, J. S., Subramaniam, V., Driel, R. V. Intracellular manipulation of chromatin using magnetic microbeads. Chromosome Research. 16 (3), 511-522 (2008).
- Bausch, A. R., et al. Local measurements of viscoelastic parameters of adherent cell surfaces by magnetic microbead microrheometry. Biophysical Journal. 75 (4), 2038-2049 (1998).
- Fisher, J. K., et al. Three-dimensional force microscope: a nanometric optical tracking and magnetic manipulation system for the biomedical sciences. Review of Scientific Instruments. 76 (5), 053711(2005).
- Berret, J. -F. Local viscoelasticity of living cells measured by rotational magnetic spectroscopy. Nature Communications. 7, 10134(2016).
- Hu, B., Dobson, J., El Haj, A. J. Control of smooth muscle α-actin (SMA) up-regulation in HBMSCs using remote magnetic microbead mechano-activation. Nanomedicine: Nanotechnology, Biology and Medicine. 10 (1), 45-55 (2014).
- Kamiyama, D., et al. Versatile protein tagging in cells with split fluorescent protein. Nature Communications. 7, 11046(2016).
- Feng, S., et al. Improved split fluorescent proteins for endogenous protein labeling. Nature Communications. 8, 370(2017).
- Leonetti, M. D., Sekine, S., Kamiyama, D., Weissman, J. S., Huang, B. A scalable strategy for high-throughput GFP tagging of endogenous human proteins. Proceedings of the National Academy of Sciences of the United States of America. 113 (25), 3501-3508 (2016).
- Tulpule, A., et al. Kinase-mediated RAS signaling via membraneless cytoplasmic protein granules. Cell. 184 (10), 2649-2664 (2021).
- Ansari, A. M., et al. Cellular GFP toxicity and immunogenicity: potential confounders in in vivo cell tracking experiments. Stem Cell Reviews and Reports. 12 (5), 553-559 (2016).
- Gibson, T. J., Seiler, M., Veitia, R. A. The transience of transient overexpression. Nature Methods. 10 (8), 715-721 (2013).
- Ratz, M., et al. CRISPR/Cas9-mediated endogenous protein tagging for RESOLFT super-resolution microscopy of living human cells. Scientific Reports. 5, 9592(2015).
- Suzuki, H., Ho, C., Kasagi, N. A chaotic mixer for magnetic microbead-based micro cell sorter. Journal of Microelectromechanical Systems. 13 (5), 779-790 (2004).
- Luo, Q., et al. All-optical mechanobiology interrogation of yes-associated protein in human cancer and normal cells using a multi-functional system. Journal of Visualized Experiments. (178), e62934(2021).
- Koushki, N., et al. Lamin A redistribution mediated by nuclear deformation determines dynamic localization of YAP. BioRxiv. , (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten