Method Article
Combinación de actuador de fuerza magnética 3D e imágenes de fluorescencia multifuncionales para estudiar la mecanobiología del núcleo
En este artículo
Resumen
Este estudio presenta un nuevo protocolo para aplicar directamente fuerza mecánica en el núcleo celular a través de microperlas magnéticas entregadas en el citoplasma y para realizar imágenes fluorescentes simultáneas de células vivas.
Resumen
Una pregunta fundamental en mecanobiología es cómo las células vivas perciben los estímulos mecánicos extracelulares en el contexto de la fisiología y patología celular. Se cree que la mecano-sensación celular de los estímulos mecánicos extracelulares es a través de los receptores de membrana, el complejo proteico asociado y el citoesqueleto. Los avances recientes en mecanobiología demuestran que el núcleo celular en el citoplasma puede detectar independientemente los estímulos mecánicos simultáneamente. Sin embargo, falta una comprensión mecanicista de cómo el núcleo celular detecta, transduce y responde a los estímulos mecánicos, principalmente debido a los desafíos técnicos para acceder y cuantificar la mecánica del núcleo mediante herramientas convencionales. Este documento describe el diseño, fabricación e implementación de un nuevo actuador de fuerza magnética que aplica estímulos mecánicos 3D precisos y no invasivos para deformar directamente el núcleo celular. Utilizando células diseñadas con CRISPR / Cas9, este estudio demuestra que esta herramienta, combinada con imágenes fluorescentes confocales de alta resolución, permite la revelación de la dinámica en tiempo real de una proteína asociada a sí mecanosensible (YAP) en células individuales en función de la deformación del núcleo. Este método simple tiene el potencial de cerrar la brecha tecnológica actual en la comunidad mecanobiológica y proporcionar respuestas a la brecha de conocimiento que existe en la relación entre la mecanotransducción del núcleo y la función celular.
Introducción
Este estudio tiene como objetivo desarrollar y aplicar una nueva técnica para dilucidar la mecanobiología del núcleo mediante la combinación de los actuadores magnéticos que aplican fuerza mecánica directamente sobre el núcleo celular y la microscopía de fluorescencia confocal que simultáneamente imágenes de los cambios subcelulares estructurales y funcionales. Las células detectan señales biofísicas extracelulares, incluida la rigidez tisular 1,2,3,4, la presión del líquido intersticial y la tensión de cizallamiento 5,6,7, la topología/geometría de la superficie8,9,10,11,12 y la tensión / tensión de compresión 13,14, 15,16. Las señales biofísicas se convierten en señales bioquímicas y desencadenan posibles cambios posteriores de la expresión génica y los comportamientos celulares, un proceso conocido como mecanotransducción 17,18,19,20,21,22,23,24,25,26,27 . Para estudiar los procesos de mecanotransducción, se han desarrollado una miríada de técnicas para aplicar fuerza mecánica en las células, como la microscopía de fuerza atómica28, el dispositivo de estiramiento celular29, el sensor de fuerza bio-MEMS (sistemas microelectromecánicos) 15,30,31, la reología de cizallamiento 32 y el sistema de visión estéreo 33 . Una revisión reciente resume los enfoques para aplicar señales mecánicas extracelulares e interferir con la mecanodetección34. Hasta la fecha, la mayoría de estos métodos aplican fuerza sobre la membrana plasmática celular, y las células reciben directamente estas señales biofísicas extracelulares a través de receptores de membrana como integrina, cadherina, canales iónicos y receptores acoplados a proteínas G. Posteriormente, transmiten la señal al citoesqueleto y núcleo intracelular. Por ejemplo, utilizando la translocación de proteínas asociadas a sí (YAP) como indicador de mecanodetección, se muestra que las células detectan las señales mecánicas de rigidez del sustrato y tensión extracelular de la membrana celular y las transmiten a través del citoesqueleto al núcleo para inducir la translocación de citoplasma a núcleo YAP28,35.
La evidencia reciente sugiere que el núcleo celular en sí es un mecano-sensor independiente 8,36,37. Esto es probado por experimentos realizados en el núcleo aislado cosechado de las células, donde se reveló que los núcleos cambian adaptativamente su rigidez en respuesta a la fuerza mecánica aplicada directamente sobre ellos36. Durante muchas condiciones fisiológicas, los núcleos tanto en las células tumorales como en las sanas detectan señales biofísicas extracelulares y cambian sus propiedades mecánicas y ensamblajes38,39,40. Por ejemplo, tras la extravasación, la rigidez nuclear de las células tumorales disminuye y mantiene la suavidad durante más de 24 h38. Durante la migración a través del espacio intersticial confinado, los núcleos de las células tumorales frecuentemente pierden y recuperan su integridad estructural39. Sin embargo, se desconoce la forma en que el núcleo detecta la señal biofísica, aunque se ha encontrado que varias proteínas de la envoltura nuclear y familias de proteínas están involucradas, como Lamin A / C y el complejo de enlace de nucleoesqueleto y citoesqueleto (LINC)38,41. Por lo tanto, los nuevos métodos no invasivos que pueden aplicar fuerza directamente al núcleo desacoplarán el efecto de la transmisión de fuerza desde la membrana plasmática celular y el citoesqueleto, y ayudarán a dilucidar los mecanismos moleculares previamente inaccesibles de la mecanodetección nuclear.
La investigación que empleó pinzas ópticas para manipular orgánulos42 y microperlas inyectadas en las células43 mostró la capacidad tecnológica de aplicar fuerza directamente sobre el núcleo. Sin embargo, la técnica de pinzas ópticas tiene varias limitaciones: (1) las pinzas ópticas de bajo rendimiento a menudo solo manipulan una célula o microperla a la vez; y (2) el fotodaño potencial y la deformación del artefacto de temperatura de la energía nuclear requieren decenas de pN36, y la potencia láser necesaria correspondiente es de aproximadamente 10 mW por pN44,45. Tal intensidad del láser es suficiente para desencadenar fotodaño en las células y perturbar las funciones celulares durante el experimento46.
La fuerza magnética aplicada a través de microperlas dentro de las células vivas muestra el potencial de aplicar fuerza directamente sobre el núcleo y supera las limitaciones de las pinzas ópticas. Una vez que las microperlas se entregan en el citoplasma, un campo magnético puede ejercer una fuerza magnética sobre múltiples microperlas simultáneamente de una manera de alto rendimiento. El campo magnético no influye en las funciones celulares47, pero genera fuerza de pN a nN, que es suficiente para inducir la deformación nuclear 36,48,49. Hasta la fecha, la manipulación de microperlas magnéticas se ha aplicado en la membrana plasmática celular48, dentro del citoplasma50, en la actina F51, dentro del núcleo47 y en el núcleo aislado36. Sin embargo, la manipulación magnética de microperlas nunca se ha utilizado para aplicar fuerza mecánica directa sobre la envoltura nuclear para estudiar la mecanotransducción en el núcleo.
En este documento, se desarrolla una técnica simple para administrar microperlas magnéticas de forma no invasiva en el citoplasma y utilizar estas microperlas para aplicar fuerza mecánica sobre el núcleo (Figura 1). Aquí, se utilizan líneas celulares B2B normales humanas diseñadas por CRISPR / Cas9 que expresan endógenamente YAP marcado con mNeonGreen21-10 / 11 para validar el método. YAP es una proteína mecanosensible, y la translocación de YAP está regulada por la mecanodetección nuclear 14,28. Se eligió el enfoque knock-in regulado por CRISPR/Cas9 para marcar YAP endógeno con una proteína fluorescente (FP) mNeonGreen21-10/11. Aunque se sabe que la edición CRISPR tiene una eficiencia incompleta y un efecto fuera del objetivo, los protocolos en publicaciones anteriores integraron la clasificación de fluorescencia para seleccionar la inserción correcta del marco de lectura abierto52,53,54. Con esta capa adicional de selección, no se observó ningún evento de etiquetado fuera del objetivo en 20+ líneas celulares generadas previamente52,53,54,55. Esta es una construcción de proteína fluorescente dividida, pero en principio, cualquier etiqueta fluorescente expresable podría ser utilizable. Este enfoque de etiquetado es superior a los métodos transgénicos o de anticuerpos. Primero, a diferencia de la expresión transgénica, la proteína marcada mantiene la dosis del gen de copia única y se expresa en el contexto fisiológico de la red reguladora de genes nativos, limitando las desviaciones en la concentración, localización e interacción de proteínas. El método de etiquetado utilizado en este estudio logra un rendimiento y una eficiencia más altos en un orden de magnitud que el etiquetado FP completo. También evita los desafíos asociados con la inmunofluorescencia debido a los artefactos de fijación y la disponibilidad limitada de anticuerpos de alta calidad y alta especificidad. En segundo lugar, el enfoque utilizado en este documento hace una perturbación mínima a la fisiología celular y permite la revelación en tiempo real de todos los YAP endógenos auténticamente. En contraste, otros métodos transgénicos comunes a menudo conducen a la sobreexpresión de YAP. La distribución artificial resultante puede potencialmente causar citotoxicidad y afectar la mecanodetección de las células56,57,58.
Este estudio presenta un protocolo para aplicar fuerza directamente sobre el núcleo a través de microperlas magnéticas entregadas en el citoplasma y para realizar imágenes fluorescentes simultáneas de células vivas. En resumen, los protocolos presentados aquí demuestran cómo (1) entregar microperlas magnéticas en la célula mientras está fuera del núcleo, (2) manipular las microperlas para aplicar fuerza magnética en el núcleo, (3) realizar imágenes fluorescentes confocales de las células durante la manipulación, y (4) analizar cuantitativamente la relación nuclear / citoplasma (N / C) de YAP durante todo el proceso de aplicación de fuerza. Los resultados sugieren que (1) a través de endocitosis, las microperlas magnéticas pueden administrarse de forma no invasiva en el citoplasma de las células B2B dentro de las 7 h (Figura 2 y Figura 3); y (2) la fuerza magnética cuantificada aplicada directamente sobre el núcleo (Figura 4, Figura 5 y Figura 6) por sí sola puede desencadenar diversos cambios en la relación YAP N/C en células B2B diseñadas con CRISPR / Cas9 (Figura 7 y Figura 8).
Protocolo
1. Mantenimiento de células B2B diseñadas con CRISPR/Cas9
- Cultivo de células B2B en un matraz T25 con RPMI-1640 suplementado con 10% de suero fetal bovino y 1% de penicilina-estreptomicina.
- Mantener las células B2B en una incubadora humidificada a 37 °C con 5% deCO2.
- Subcultivo de las células B2B cuando la confluencia alcanza el 70% al 80%.
- Almacene la línea celular B2B en medio de cultivo RPMI-1640 con DMSO al 10% (v/v) en un congelador de -80 °C.
- Utilice las celdas B2B con un número de pasaje inferior a 10 en los experimentos.
2. Cultivo celular
- Siembra las células en una placa de Petri con fondo de vidrio.
- Mueva el matraz que contiene células B2B dentro de la incubadora al gabinete de bioseguridad.
- Retirar el medio de cultivo del matraz con una pipeta aspiradora con una bomba de vacío conectada.
- Lavar el matraz con 2 ml de solución salina tamponada con fosfato (PBS).
- Retire PBS con la pipeta aspiradora.
- Añadir 0,5 ml de solución de tripsina al 0,05% para desprender las células del fondo del sustrato del matraz.
- Coloque el matraz en la incubadora durante 5 minutos.
- Mover el matraz al armario de bioseguridad. Añadir 5 ml de nuevo medio de cultivo en el matraz y pipetear la solución hacia arriba y hacia abajo.
- Depositar 50 μL del medio con células (300 células/μL) en la placa de Petri con fondo de vidrio. Añadir 2 ml de medio de cultivo en la placa de Petri.
- Coloque la placa de Petri en la incubadora. Espere 12 h para que las celdas se unan.
- Cultive las células con microperlas magnéticas.
- Pesar 0,2 g de microperlas de hierro carbonilo de diámetro medio de 7 μm (en lo sucesivo denominadas microperlas de hierro carbonilo de 7 μm, véase la Tabla de materiales).
- Utilice una pipeta para suspender las microperlas en 1 ml de medio de cultivo RPMI-1640.
- Lleve la placa de Petri con células B2B al gabinete de bioseguridad.
- Añadir 200 μL del medio que contiene microperlas en la placa de Petri.
NOTA: Agregue el medio rápidamente para evitar la precipitación de las microperlas. - Vuelva a colocar la placa de Petri en la incubadora hasta que las microperlas sean internalizadas por las células. Verifique la internalización cada 6 h para determinar el momento óptimo para la internalización para diferentes líneas celulares.
- Para verificar la internalización, realice imágenes de fluorescencia confocal para visualizar el límite microperla, nuclear y celular. Si la microperla es internalizada por la célula, estará dentro del límite celular.
3. Visualización del núcleo
- Calentar 1,5 ml del medio de cultivo en la incubadora durante 15 min.
- Apague la luz del gabinete de bioseguridad. Lleve la placa de Petri que contiene la célula, el medio de cultivo calentado, la tinción nuclear y el HCl verapamilo en el gabinete de bioseguridad.
NOTA: Los componentes de tinción nuclear son sensibles a la luz. Evite la exposición a la luz durante la operación. - Diluir la tinción nuclear 1000x por DMSO a 100x.
- Diluir 100 mM de verapamilo HCl por DMSO a 10 mM.
- Añadir 15 μL de tinción nuclear 100x y 15 μL de HCl verapamilo 10 mM a 1,5 mL de medio de cultivo. Mezclar bien pipeteando hacia arriba y hacia abajo.
- Retire el medio de cultivo de la placa de Petri. Añadir el medio de cultivo que contiene tinción nuclear en la placa de Petri.
- Vuelva a colocar las células en la incubadora durante más de 2 h.
4. Preparación del hardware de aplicación de fuerza magnética
- Imprima en 3D todas las piezas utilizando acrilonitrilo butadieno estireno (ABS) y móntelas siguiendo el diseño CAD (Figura 1A). El diseño CAD se incluye en la Tabla de materiales.
- Use cinta adhesiva de doble cara para fijar el imán al dispositivo que mueve el imán (Figura 1A).
- Coloque el dispositivo de movimiento magnético junto a la etapa del microscopio. Utilice las tres perillas para ajustar la ubicación espacial del imán hasta que pueda moverse por encima de la placa de Petri entre 13 mm y 120 mm.
NOTA: Asegúrese de que el límite superior de la distancia entre el imán y la placa de Petri sea lo más grande posible para evitar la aplicación de fuerza no deseada en las microperlas magnéticas. 120 mm es el valor máximo en esta configuración experimental. Asegúrese de que el imán no interfiera con las piezas del microscopio, incluidos los objetivos y las etapas motorizadas. - Coloque el imán en la posición z más alta (a 120 mm).
5. Aplicación forzada e imágenes de células vivas
- Configuración de la cámara ambiental para obtener imágenes a largo plazo
- Aplique una solución de etanol al 75% para esterilizar y limpiar completamente la cámara ambiental.
- Coloque la cámara ambiental en la etapa motorizada del microscopio invertido.
- Abra el tanque deCO2 y ajuste el caudal de entrada de CO2 a 160 ml / min.
- Ajuste la temperatura de la cámara a 44 °C (arriba), 42 °C (baño) y 40 °C (etapa).
- Agregue 20 ml de agua purificada en el baño de la cámara ambiental para mantener el 90% de humedad.
- Saque la placa de Petri con fondo de vidrio que contiene células diana de la incubadora de cultivo de tejidos y colóquela en la cámara.
- Aplique la abrazadera metálica de la cámara ambiental para fijar la posición de la placa de Petri.
NOTA: La placa de Petri debe sujetarse firmemente en la cámara porque la fuerza magnética puede mover la placa si no se sujeta. - Cierre la tapa de la cámara.
- Optimización de los parámetros de imagen
- Optimice el tamaño del agujero de alfiler: el agujero de alfiler bloquea los fotones desenfocados. Un tamaño de agujero de alfiler más grande produce más fotones desenfocados pero una imagen más brillante. Un tamaño estenopeico más pequeño produce una imagen más enfocada y tenue. Asegúrese de optimizar el tamaño del agujero de alfiler para obtener imágenes confocales enfocadas con la relación señal-ruido adecuada.
- Optimizar la intensidad del láser: La intensidad del láser determina la intensidad de la excitación y, por lo tanto, la luz de emisión. La baja intensidad del láser proporciona una baja relación señal-ruido. Una intensidad láser demasiado alta causará fotoblanqueo. Ajuste la intensidad del láser en consecuencia.
- Optimizar el tamaño del paso y los pasos: Los pasos y el tamaño del paso determinan cuántas imágenes se tomarán en una pila Z. Los tamaños de paso más pequeños y más pasos aumentarán la resolución de la pila Z, pero también aumentarán el fotoblanqueo. En este experimento, se utilizó un tamaño de paso de 1 μm para las células con ~ 15 μm de altura celular.
- Optimice el tiempo de exposición: El tiempo de exposición determina cuánto tiempo estará expuesta la célula al láser de excitación. Un tiempo de exposición bajo disminuirá la relación señal-ruido. Un tiempo de exposición alto causará fotoblanqueo. En este experimento se utilizó un tiempo de exposición de 1 fotograma por 4 s.
- Optimización de los parámetros de imagen: cambie uno de los cuatro parámetros de forma iterativa y mantenga la coherencia de los demás parámetros. Cada vez, mida la relación YAP N/C de cada imagen y compare el cambio en la relación YAP N/C para determinar el nivel de fotoblanqueo. Repita el proceso de optimización hasta lograr un equilibrio entre la relación señal-ruido, la velocidad de imagen y el fotoblanqueo.
- Defina las configuraciones de imágenes utilizando los parámetros de imagen optimizados para una configuración de imágenes más rápida durante los experimentos.
NOTA: Las configuraciones utilizadas en este estudio se describen en la sección 5.3 de parámetros de imagen. Para optimizar los parámetros de imagen de las configuraciones de la sección 5.3, utilice el mismo método que en el paso 5.2.5.
- Aplicación de fuerza pequeña e imágenes confocales
NOTA: El microscopio Nikon Ti2-E se utilizó para obtener imágenes en este estudio, y los pasos detallados para la adquisición de imágenes se dan a continuación.- Abra el microscopio invertido. Abra la aplicación de software Elements.
- Defina la magnetic_find de configuración. Compruebe solo el canal FIFC. Ajuste PMT HV = 70, Offset = 0, Intensidad del láser = 10. Establezca la velocidad de escaneo en 1 fotograma por 2 s haciendo clic en el botón 1/2 . Establezca el tamaño estenopeico en 1,2 UA haciendo clic en el botón 1,2 UA. Esta configuración se utilizará en el paso 5.3.5.
- Defina la magnetic_YAP_Nucleus de configuración. Consulta el canal FIFC. Ajuste PMT HV = 70, Offset = 0, Intensidad del láser = 10. Establezca la velocidad de escaneo en 1 fotograma por 4 s haciendo clic en el botón 1/2 . Establezca el tamaño estenopeico en 1,2 UA haciendo clic en el botón 1,2 UA. Para obtener imágenes del límite del núcleo y la intensidad de la tinción nuclear, compruebe el canal Cy5. Ajuste PMT HV = 70, Offset = 0, Intensidad del láser = 10. El tamaño estenopeico está optimizado para imágenes YAP 3D. No vuelva a hacer clic en el botón 1.2 A.U . después de verificar el canal Cy5. Esta configuración se utilizará en el paso 5.3.7.
- Active DIA a través de Elements si es necesario. Abra SpinView, use un campo brillante y ajuste el enfoque del objeto para obtener una imagen clara de las celdas. Use un objetivo de 10x para encontrar múltiples células individuales apropiadas en tres condiciones: con una sola microperla dentro, con múltiples microperlas dentro y sin ninguna microperla dentro. Cambie a un objetivo 40x. Asigne a esta posición el número de posición apropiado.
- Elementos abiertos. Haga clic en magnetic_find. Haga clic en el botón Eliminar bloqueo.
- Haga clic en Escanear y ajuste la posición Z del plano focal. Haga clic en los botones superior e inferior para establecer el límite inferior y superior de la pila Z de las celdas seleccionadas. Detenga el escaneo haciendo clic en Escanear nuevamente.
- Cambie a magnetic_YAP_Nucleus configuración. Establezca el nombre de archivo como before_small_force.nd2. Haga clic en el botón Ejecutar con la pila Z grabada.
- Cambie a la ruta de luz derecha y encienda DIA. Abra SpinView y haga clic en el botón Grabación . Mientras tanto, gire la perilla del dispositivo de movimiento magnético para mover el imán hacia abajo a 46 mm por encima del fondo de la placa de Petri. Guarde secuencias de imágenes o videos de campo brillante. Mira el video para confirmar que las microperlas muestran el desplazamiento inducido por la fuerza magnética.
- Repita los pasos 5.3.5-5.3.7; Establezca el nombre de archivo en after_small_force.nd2.
- Cambie a la ruta de luz derecha y encienda DIA. A continuación, abra SpinView y haga clic en el botón Grabación . Mientras tanto, gire la perilla del dispositivo de movimiento magnético para mover el imán hasta 120 mm por encima del fondo de la placa de Petri. Guarde secuencias de imágenes o videos de campo brillante.
- Repita los pasos 5.3.5-5.3.7 y establezca el nombre de archivo en before_large_force.nd2.
- Aplicación de gran fuerza e imágenes confocales
- Retire la tapa de la cámara ambiental para permitir que el imán alcance 13 mm por encima del fondo de la placa de Petri.
- Cambie a la ruta de luz derecha y encienda DIA. Abra SpinView y haga clic en el botón Grabación . Mientras tanto, gire la perilla del dispositivo de movimiento magnético para mover el imán hacia abajo a 13 mm por encima del fondo de la placa de Petri. Guarde secuencias de imágenes o videos de campo brillante. Mira el video para confirmar que las microperlas muestran el desplazamiento inducido por la fuerza magnética.
- Repita los pasos 5.3.5-5.3.7 y establezca el nombre de archivo en after_large_force.nd2.
- Cambie a la ruta de luz derecha y encienda DIA. A continuación, abra SpinView y haga clic en el botón Grabación . Mientras tanto, gire la perilla del dispositivo de movimiento magnético para mover el imán hasta 120 mm por encima del fondo de la placa de Petri. Guarde secuencias de imágenes o videos de campo brillante.
- Repita los pasos 5.3.5-5.3.7; Establezca el nombre de archivo en retract_large_force.nd2.
- Cierre la tapa de la cámara ambiental.
- Repita los pasos 5.2 y 5.3 para varios campos de visión para obtener más datos si es necesario.
6. Procesamiento de imágenes y análisis de datos
- Cuantificación de la relación YAP N/C
- Abra Fiji ImageJ. Abra las imágenes .nd2 tomadas en el paso 5.
- Haga clic en Analizar > establecer medidas. Área de verificación, densidad integrada, valor gris medio y descriptores de forma.
- Utilice el canal Cy5 para identificar el núcleo. Haga clic en Selecciones a mano alzada para utilizar la herramienta de selección libre para delinear el núcleo. Además, compruebe la macro de máscara nuclear automática en ImageJ (consulte la Tabla de materiales).
- Haga clic en Analizar > medir en el canal FIFC. El valor medido de la media es la intensidad nuclear promedio de YAP DN.
- Utilice el canal Cy5 para identificar el núcleo. Utilice el canal FITC para identificar la célula. Haga clic en Selecciones a mano alzada para utilizar la herramienta de selección libre para seleccionar una región de interés dentro del citoplasma y evitar la microperla magnética. Esta región de interés no debe incluir el núcleo.
- Haga clic en Analizar > medir en el canal FIFC. El valor medido de la media es la intensidad YAP citoplasmática media DC.
- Calcule la relación YAP N/C = D N / DC.
- Cuantificación de la forma nuclear y la intensidad normalizada de la tinción nuclear
- Abra Fiji ImageJ. Abra las imágenes .nd2 tomadas en el paso 5.
- Haga clic en Analizar > establecer medidas. Área de verificación, densidad integrada, valor gris medio y descriptores de forma.
- Utilice el canal Cy5 para identificar el núcleo. Haga clic en Selecciones a mano alzada para utilizar la herramienta de selección libre para delinear el núcleo.
- Haga clic en Analizar > medir en el canal Cy5. El valor medido de la media es la intensidad de la tinción nuclear. El valor medido de Circ. es circularidad nuclear.
- Para comparar la intensidad de la tinción nuclear en un estado de fuerza diferente, toda la intensidad de la tinción nuclear se divide por la intensidad de la tinción nuclear en "before_small_force.nd2" para generar la intensidad de la tinción nuclear normalizada.
Resultados
Diseño de un dispositivo de movimiento magnético y aplicación de fuerza magnética
Para aplicar fuerza sobre el núcleo a través de las microperlas magnéticas, se diseñó y construyó un dispositivo de movimiento magnético para controlar la posición espacial del imán. El dispositivo de movimiento magnético contiene un marco central, tres perillas y rieles para mover el imán conectado en direcciones x, y y z de forma independiente a la resolución espacial de 1,59 mm por ciclo (Figura 1A). Una vez que el imán se mueve cerca de las microperlas de 7 μm entregadas a las células (Figura 1B), atrae magnéticamente las microperlas y aplica fuerza sobre el núcleo (Figura 1C). La dirección de la fuerza y la magnitud están controladas por la posición relativa entre el imán y las microperlas.
En este documento, se aplicaron dos magnitudes diferentes de fuerza a las microperlas: (1) una fuerza relativamente pequeña cuando el imán se colocó a 46 mm por encima de la célula; y (2) una fuerza relativamente grande cuando el imán se colocó a 13 mm por encima de la celda. La fuerza magnética aplicada a la microperla F puede calcularse mediante la ecuación59:  , donde Nd es el factor de desmagnetización (0,33 para una esfera), μ es la permeabilidad en el vacío (6,3 × 10-3H/m para el hierro), Vp es el volumen de la microperla (178 μm3 para una microperla de 7 μm), y H es la intensidad del campo magnético con la unidad A/m. H es proporcional a la densidad de flujo magnético B con la unidad Tesla. Dado que se esperaba que la fuerza magnética que actúa sobre una sola microperla de 7 μm fuera extremadamente pequeña y difícil de detectar por un transductor de fuerza, se midió la densidad de flujo magnético B como referencia para indicar la magnitud de la fuerza magnética aplicada a las microperlas. Se introdujo un sensor Hall en la ubicación del fondo de la placa de Petri para medir la densidad de flujo magnético, y el imán se colocó a una distancia de 13 mm o 46 mm del fondo de la placa de Petri. Debido a que las microperlas de 7 μm influyen en el campo magnético, la densidad del flujo magnético se midió con y sin microperlas. Independientemente de la presencia de las microperlas de 7 μm, se obtuvo la misma densidad de flujo magnético: B = 60,1 mT a una distancia de 13 mm y B = 3,7 mT a una distancia de 46 mm. Esta medición muestra que el efecto de microperlas de 7 μm sobre el campo magnético generado por el imán cilíndrico con 12,7 mm de diámetro y 12,7 mm de altura (ver la Tabla de materiales) no fue detectable por el sensor Hall utilizado en este estudio. Sin embargo, la densidad de flujo magnético en el caso con una distancia de 13 mm fue aproximadamente 16 veces mayor que la de una distancia de 46 mm. La calibración experimental de la fuerza magnética se describe en la siguiente sección (Figura 6).
, donde Nd es el factor de desmagnetización (0,33 para una esfera), μ es la permeabilidad en el vacío (6,3 × 10-3H/m para el hierro), Vp es el volumen de la microperla (178 μm3 para una microperla de 7 μm), y H es la intensidad del campo magnético con la unidad A/m. H es proporcional a la densidad de flujo magnético B con la unidad Tesla. Dado que se esperaba que la fuerza magnética que actúa sobre una sola microperla de 7 μm fuera extremadamente pequeña y difícil de detectar por un transductor de fuerza, se midió la densidad de flujo magnético B como referencia para indicar la magnitud de la fuerza magnética aplicada a las microperlas. Se introdujo un sensor Hall en la ubicación del fondo de la placa de Petri para medir la densidad de flujo magnético, y el imán se colocó a una distancia de 13 mm o 46 mm del fondo de la placa de Petri. Debido a que las microperlas de 7 μm influyen en el campo magnético, la densidad del flujo magnético se midió con y sin microperlas. Independientemente de la presencia de las microperlas de 7 μm, se obtuvo la misma densidad de flujo magnético: B = 60,1 mT a una distancia de 13 mm y B = 3,7 mT a una distancia de 46 mm. Esta medición muestra que el efecto de microperlas de 7 μm sobre el campo magnético generado por el imán cilíndrico con 12,7 mm de diámetro y 12,7 mm de altura (ver la Tabla de materiales) no fue detectable por el sensor Hall utilizado en este estudio. Sin embargo, la densidad de flujo magnético en el caso con una distancia de 13 mm fue aproximadamente 16 veces mayor que la de una distancia de 46 mm. La calibración experimental de la fuerza magnética se describe en la siguiente sección (Figura 6).
Entrega de microperlas magnéticas en el citoplasma
12 h después de sembrar células en la placa de Petri con fondo de vidrio, se agregan microperlas de 7 μm al medio de cultivo. Las microperlas son internalizadas espontáneamente por las células. Debido a que las microperlas no emiten fluorescencia bajo excitación láser en el canal FITC o Cy5, la ubicación de las microperlas internalizadas se puede identificar por la ubicación del hueco oscuro con la imagen confocal de fluorescencia de YAP y núcleo. Tanto las imágenes 2D como 3D muestran que la microperla está en el citoplasma mientras está fuera del núcleo (Figura 2).
Los niveles de internalización de microperlas en las células dependen de la duración del cocultivo de células y microperlas. Por lo tanto, las células se clasificaron en tres tipos de acuerdo con la cantidad de microperlas internalizadas: sin microperlas, microperlas individuales y multimicroperlas (Figura 3A). A las 7 h de cocultivo, el 62% de las células internalizaron ninguna microperla, el 15% de las células internalizaron una sola microperla y el 23% de las células internalizaron multimicroperlas (número total de células = 13). A las 12 h de cocultivo, el 53% de las células internalizaron ninguna microperla, el 26% de las células internalizaron una sola microperla y el 21% de las células internalizaron multimicroperlas (número total de células = 62). A las 24 h de cocultivo, el 20% de las células internalizaron ninguna microperla, el 28% de las células internalizaron una sola microperla y el 53% de las células internalizaron multimicroperlas (número total de células = 40) (Figura 3B).
Las microperlas en el citoplasma no influyen en la forma nuclear y la actividad YAP
Para examinar el efecto de la internalización de microperlas en la forma nuclear y la actividad de las proteínas, la forma nuclear se cuantificó primero por circularidad y la actividad YAP por la relación YAP N / C, respectivamente. La circularidad se calcula por Circularidad = 4μ (área / perímetro2). Los pasos detallados para cuantificar la relación YAP N/C se describieron en una publicación anterior60. Brevemente, la relación YAP N/C se calculó dividiendo la intensidad media de YAP en el núcleo por la intensidad media de YAP en el citoplasma. Considerando la posibilidad de que el cocultivo de microperlas y células pueda influir en la forma nuclear incluso si no se internaliza ninguna microperla, las células sin cocultivo (puntos negros, control #1, Circularidad = 0.806 ± 0.037, n = 20), células cocultivadas con microperlas pero sin internalización (puntos grises, control #2, Circularidad = 0.806 ± 0.035, n = 22), células que internalizan microperlas individuales (puntos rojos, microperlas individuales, Se compararon la circularidad = 0,793 ± 0,048, n = 15), y las células que internalizan multimicroperlas (puntos azules, multimicroperlas, n = 7) (Figura 3C). El resultado muestra que entre los cuatro grupos probados, la circularidad nuclear no tuvo diferencias significativas (Figura 3C).
A continuación, para examinar si la relación YAP N/C está influenciada por la internalización de las microperlas, las células cocultivadas con microperlas pero sin internalización (puntos grises, control #2, relación YAP N/C = 1,155 ± 0,074, n = 35) se compararon solo con las células con internalización de microperlas simples o múltiples (puntos rojos, célula con microperlas, relación YAP N/C = 1,140 ± 0,078, n = 36) ala hora 12 de cocultivo (Figura 3D). Las células sin cocultivo no se compararon porque el plato con microperlas muestra menor densidad celular, lo que puede influir en la relación YAP N/C12. El resultado no muestra diferencia significativa (valor de p = 0,667) en la relación YAP N/C entre los dos grupos, lo que indica que la internalización de las microperlas no influye en la actividad YAP (Figura 3D).
La fuerza magnética deforma el núcleo
Primero, se muestra la deformación del núcleo. La deformación del núcleo es causada por la fuerza de compresión aplicada por las microperlas (Figura 4A y Figura 4A1-3) en las células que contienen citoesqueleto. Estos datos (es decir, el núcleo que se deforma por la compresión de la microperla) apoyan que la microperla está aplicando una fuerza sobre el núcleo en el citoplasma abarrotado. En el material suplementario se incluye un video de campo brillante que muestra el proceso de aplicación de la fuerza (Video suplementario 1). En segundo lugar, debido a que es posible que la microperla aplique simultáneamente fuerza sobre el citoesqueleto circundante y deforme el núcleo indirectamente, los experimentos de compresión se repitieron en células que tienen los filamentos de actina interrumpidos (tratamiento de Cyto D (2.5 μM, 1 h); Figura 4B). Este estudio muestra que los filamentos de actina están efectivamente despolimerizados (Figura 4B), y el núcleo está deformado por las microperlas (Figura 4B1-3). Estos datos apoyan que las microperlas están aplicando una fuerza directamente sobre el núcleo en ausencia de citoesqueleto circundante entrelazado. Colectivamente, estos datos muestran que los protocolos y herramientas pueden aplicar una fuerza directamente sobre el núcleo.
Control espacial y temporal de microperlas magnéticas intracelulares
Para lograr el control espacial de las microperlas, se utilizaron un par de imanes para mover la microperla y controlar su ubicación de la hendidura en el núcleo (Figura 5A). La cuenta solo se puede mover con hasta 2,2 μm de desplazamiento (Figura 5A1-4), pero puede aplicar de manera flexible la hendidura en el núcleo en las ubicaciones correspondientes. El citoesqueleto de actina circundante puede restringir el movimiento de microperlas. Por lo tanto, el citoesqueleto de actina fue interrumpido por el tratamiento con Cyto D (2,5 μM, 1 h), y la ubicación de la microperla se manipuló, pero mostró resultados similares. Por lo tanto, se puede proponer una hipótesis: la microperla puede unirse física / químicamente con el núcleo y otros orgánulos circundantes en el citoplasma, lo que restringe su gran movimiento espacial (>2.2 μm).
Para lograr el control espacial de las microperlas, se utilizó un par de imanes que controlan las microperlas para aplicar y liberar la fuerza dos veces (con diferente magnitud de fuerza) en la misma ubicación del núcleo (Figura 5B y Figura 5B1-B4). La duración actual para un ciclo de aplicación y liberación de fuerza es de 12 s. La velocidad de control temporal está determinada por la velocidad de operación del motor XYZ.
Calibración de la fuerza magnética
La fuerza aplicada por la perla sobre el núcleo se estimó midiendo experimentalmente la fuerza aplicada por una microscopía de fuerza atómica calibrada (AFM) que causa una deformación similar del núcleo. Específicamente, el citoesqueleto de actina fue disuelto primero por CytoD (2.5 μM; 1 h, Figura 4B) porque el AFM aplica fuerza en la superficie apical de la célula, y la eliminación de la corteza de actina y el citoesqueleto permite un contacto más directo entre la punta de AFM y el núcleo celular. Las células que tienen su corteza de actina y citoesqueleto disueltos están vivas según la comparación de la forma nuclear y la intensidad de tinción nuclear con las de las células sanas (Figura suplementaria 1). En segundo lugar, la punta AFM no funcionalizada (semiesférica, radio = 5 μm) que tiene un tamaño y forma similares a los de las microperlas se utilizó para sangrar la superficie apical de la célula de una manera controlada por la fuerza y simultáneamente adquirir imágenes confocales 3D de los cuerpos de la célula y el núcleo (Figura 6A). Se eligió la magnitud de la fuerza de compresión de 0,8 nN a 2,0 nN porque, según la literatura24, se sabía que la fuerza a una magnitud de 1,5 nN deformaba suficientemente el núcleo. En tercer lugar, la deformación normal del núcleo causada por la hendidura de AFM se midió a través del análisis cuantitativo de imágenes. Además, se obtuvo la curva de calibración que proporciona la relación cuantitativa fuerza-desplazamiento AFM (Figura 6B). En cuarto lugar, se aplicó una fuerza de compresión a la superficie lateral del núcleo mediante el control de microperlas que tienen un tamaño y forma similares (radio = 7 μm; Figura 6C), y la deformación de la membrana nuclear se midió mediante análisis de imágenes. La fuerza aplicada por cuentas se estima en función de la relación fuerza-desplazamiento AFM.
Por ejemplo, en la Figura 6C, la deformación del núcleo causada por microperlas magnéticas (diámetro = ~ 7 μm) a "fuerza grande" es de alrededor de 1,5 μm. En la Figura 6D, se utilizó una punta AFM que tiene una sonda semiesférica de 5 μm para sangrar la celda en la parte superior del núcleo para lograr una deformación nuclear de 1,5 μm. La fuerza correspondiente registrada por AFM es de 1,4 nN. Por lo tanto, la fuerza aplicada por las microperlas se estima en ~ 1.4 nN. Siguiendo el mismo enfoque, la fuerza magnética a "fuerza pequeña" se calibra como 0,8 nN, y causó una sangría nuclear de 0,4 μm.
Este estudio considera que la fuerza medida por AFM puede representar la fuerza aplicada por microperlas en base a los siguientes supuestos: (1) La rigidez del núcleo dentro de diferentes células es similar. (2) Las propiedades mecánicas del núcleo no dependen de los sitios nucleares en los que se aplicó la hendidura. La fuerza magnética se aplica horizontalmente en los lados laterales del núcleo, mientras que la fuerza AFM se aplica verticalmente en los lados apicales del núcleo. La diferencia mecánica entre ellos se asume como insignificante. (3) En experimentos de AFM, la sonda está aplicando fuerza directamente a través de la membrana celular y el citoesqueleto sobre el núcleo. Después de interrumpir los filamentos de actina, la fuerza aplicada por AFM sobre el núcleo es similar a la fuerza aplicada por las microperlas sobre el núcleo, a pesar de que la membrana todavía se encuentra entre la sonda AFM y el núcleo en el primer caso.
La fuerza magnética desencadena el cambio de la relación YAP N/C
Para demostrar que la fuerza magnética aplicada sobre las microperlas puede deformar el núcleo e inducir la translocación YAP, la relación YAP N/C de las células con internalización de microperlas se cuantificó en tres etapas: (1) antes de aplicar la fuerza, (2) después de aplicar la fuerza, y (3) después de liberar la fuerza. Algunas células mostraron un cambio de forma nuclear y relación YAP N/C cuando se aplicó o liberó la fuerza (Figura 7A, C). Los cambios de intensidad en YAP pueden atribuirse por dos posibles mecanismos: (1) Las proteínas YAP-FP se translocan desde el citoplasma al núcleo después de la aplicación de fuerza. En este caso, la tinción nuclear no debería mostrar cambios de señal. La intensidad de la tinción nuclear no debe cambiar en gran medida; (2) Las proteínas YAP-FP no se translocan después de la aplicación forzada. Los cambios observados en la intensidad de YAP se deben al cambio de volumen nuclear inducido por la fuerza y al cambio resultante en la concentración de YAP-FP. En este caso, la intensidad de tinción nuclear debería cambiar en una tendencia similar a la intensidad nuclear YAP porque la concentración de colorante de tinción también cambia a medida que se altera el volumen del núcleo. Por lo tanto, se midió el cambio de intensidad de tinción nuclear del canal rojo (excitación: 650 nm; emisión: 681 nm). La intensidad cambia en YAP en el canal verde, pero no hay cambios de intensidad en la tinción del núcleo en el canal rojo. Por lo tanto, es probable que exista el primer mecanismo (Figura 7B). En conjunto, los resultados muestran que la deformación nuclear inducida por la fuerza magnética desencadena la translocación YAP.
A continuación, se cuantificó el cambio neto de la relación YAP N/C dentro de dos grupos de células: (1) células sin microperlas internalizadas (puntos grises, control, n = 9); y (2) células seleccionadas con microperlas internalizadas que muestran un cambio en la relación YAP N/C (puntos verdes para fuerza pequeña, puntos rojos para fuerza grande, n = 11). A una fuerza de 0,8 nN, las células con microperla(s) internalizada(s) muestran un cambio neto en la relación YAP N/C = -0,030 ± 0,029, n = 11; las células de control muestran un cambio neto en la relación YAP N/C = -0,003 ± 0,012, n = 9. A una fuerza de 1,4 nN, las células con microperlas internalizadas muestran un cambio neto en la relación YAP N/C = 0,011 ± 0,040, n = 11; las células de control muestran un cambio neto en la relación YAP N/C = 0,005 ± 0,005, n = 9 (Figura 8A). A una fuerza de 0,8 nN, las células con microperla(s) internalizada(s) muestran un cambio neto absoluto en la relación YAP N/C = 0,057 ± 0,017, n = 11; las células de control muestran un cambio neto en la relación YAP N/C = 0,021 ± 0,007, n = 9. La diferencia es significativa (valor de p = 0,0093, **). A una fuerza de 1,4 nN, las células con microperla(s) internalizada(s) muestran un cambio neto absoluto en la relación YAP N/C = 0,070 ± 0,020, n = 11; las células de control muestran un cambio neto en la relación YAP N/C = 0,010 ± 0,003, n = 9. La diferencia es significativa (valor de p = 0,0007, ***) (Figura 8B). Juntos, estos resultados corroboran que la fuerza magnética aplicada a las microperlas dentro del citoplasma puede inducir la translocación YAP y cambiar la relación YAP N / C.
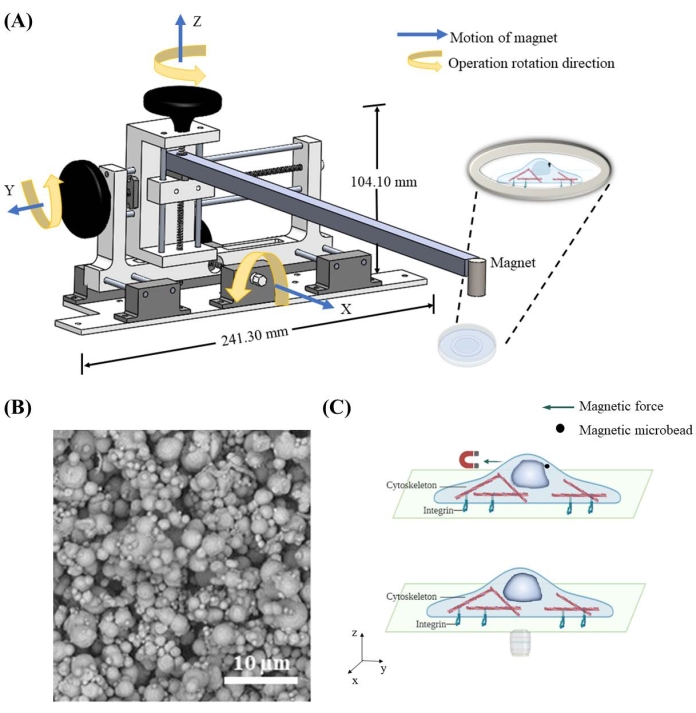
Figura 1: Diseño del dispositivo móvil magnético y aplicación de fuerza esquemática en la célula mediante microperlas magnéticas . (A) Esquema tridimensional del dispositivo implementado para sostener el imán y moverlo en direcciones x, y y z. El dispositivo consta de una base de 241,3 mm de ancho y 104,1 mm de altura, dos perillas, una barra y un imán. Las perillas se estriarán en la dirección de rotación de operación correcta, lo que entregará movimiento en la dirección correspondiente. El imán se bajará más cerca / levantará aún más del plato para aplicar fuerza magnética con diferente magnitud y dirección en microperlas magnéticas. (B) Ejemplo de imagen de microscopio electrónico de barrido (SEM) de microperlas de hierro de 7 μm. (C) Las microperlas magnéticas entregadas dentro del citoplasma pueden aplicar fuerza a los orgánulos como el núcleo cuando se aplica un campo magnético. Haga clic aquí para ver una versión más grande de esta figura.
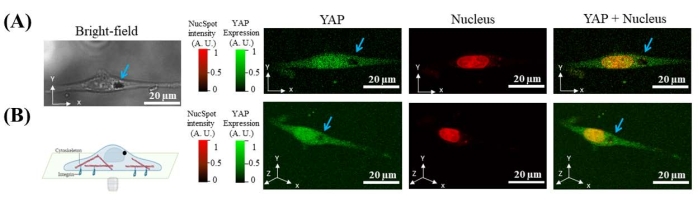
Figura 2: Imágenes representativas que muestran microperlas magnéticas (hueco negro apuntado por flecha azul) internalizadas en la célula (indicadas por YAP) y fuera del núcleo. (A) Sección transversal X-Y de una célula de YAP (verde), núcleo (rojo) y campo brillante. (B) Reconstrucción 3D de la célula. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Las microperlas internalizadas por las células no afectan la forma nuclear y la relación YAP N/C . (A) Imágenes representativas de campo claro y fluorescencia de células sin microperlas, microperlas individuales e internalización de microperlas múltiples. Las flechas azules indican la posición de las microperlas dentro del citoplasma. (B) A las 7 h (n = 13), 12 h (n = 62) y 24 h (n = 40) de cocultivo, el porcentaje de células que no muestran internalización de microperlas, microperlas individuales y multimicroperlas. (C) La circularidad nuclear no muestra diferencias significativas entre las células de control y las células con internalización de microperlas. Control #1 (sin cocultivo de microperlas): Circularidad = 0,806 ± 0,037, n = 20; Control #2 (con cocultivo de microperlas, sin internalización de microperlas): Circularidad = 0,806 ± 0,035, n = 22; Internalización de microperlas simples: circularidad = 0,793 ± 0,048, n = 15; internalización multimicroperla: circularidad = 0,780 ± 0,061, n = 7. (D) La relación YAP N/C no muestra diferencias significativas (valor de p = 0,667) entre las células control (con cocultivo de microperlas, sin internalización de microperlas, relación YAP N/C = 1,155 ± 0,074, n = 35) y las células con internalización de microperlas (relación YAP N/C = 1,140 ± 0,078, n = 36). Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Aplicación de fuerza directa sobre núcleo con y sin filamentos de actina. (A) Las células muestran filamentos de actina (amarillo). (A1) Imagen del núcleo cuando no se aplica ninguna fuerza. (A2) Imagen del núcleo después de aplicar la fuerza. (A3) La imagen superpuesta del límite nuclear antes y después de la aplicación de la fuerza muestra la sangría nuclear. (B) Las células muestran filamentos de actina alterados (amarillo) después del tratamiento con Cyto D (2,5 μM, 1 h). (B1) Imagen del núcleo cuando no se aplica ninguna fuerza. (B2) Imagen del núcleo después de aplicar la fuerza. (B3) La imagen superpuesta del límite nuclear antes y después de la aplicación de la fuerza muestra la hendidura nuclear con el citoesqueleto de actina interrumpido. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Control espacial y temporal de la microperla magnética intracelular. (A) Un par de imanes controla espacialmente la microperla magnética. (A1) Imagen de campo claro del límite celular (línea verde), límite nuclear (línea roja) y microperla magnética (línea amarilla) en la posición 1. (A2) La microperla magnética indenta el núcleo en la posición 1. (A3) La microperla magnética se mueve a la posición 2 (línea amarilla). La posición 1 se muestra como referencia (línea discontinua amarilla). (A4) La microperla magnética indenta el núcleo en la posición 2. (B) Un par de imanes controla temporalmente la microperla magnética. (B1) Imagen de campo claro de una célula sin fuerza aplicada en el punto de tiempo I. (B2) La microperla magnética aplica una fuerza sobre el núcleo en el punto de tiempo II. (B3) La microperla magnética libera la fuerza del núcleo en el punto de tiempo III. (B4) La microperla magnética aplica una fuerza mayor sobre el núcleo en el punto de tiempo IV. Haga clic aquí para ver una versión más grande de esta figura.
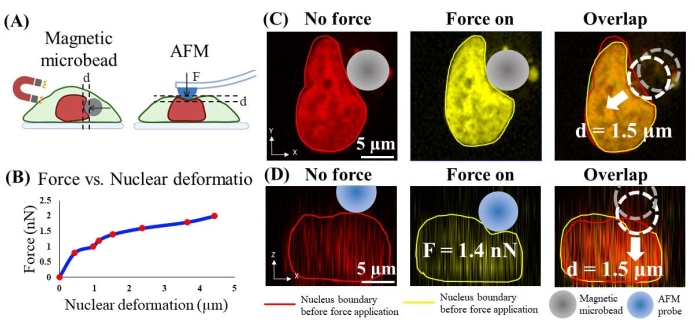
Figura 6. Calibración de la fuerza aplicada por microperlas en el núcleo mediante sangría AFM. (A) Ilustración esquemática del proceso de calibración. La microperla magnética aplica compresión horizontal en el núcleo (izquierda), y la sonda AFM se hunde verticalmente en el núcleo. (B) Fuerza de hendidura AFM vs. deformación nuclear. (C) Imagen representativa de la deformación del núcleo (1,5 μm) antes y después de la aplicación forzada por microperla magnética. (D) Imagen representativa de una deformación similar del núcleo (1,5 μm) antes y después de la hendidura AFM con una fuerza de 1,4 nN. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Datos representativos que muestran que el cambio en la relación YAP N/C es inducido por la aplicación y liberación de fuerza magnética. (A) Sección transversal X-Y de YAP (verde) y núcleo (rojo) imagen fluorescente de la célula sin fuerza, fuerza de encendido y apagado. En la condición de fuerza encendida, la intensidad citoplasmática de YAP disminuye en la ubicación apuntada por una flecha amarilla, mientras que la intensidad nuclear de YAP aumenta. La relación YAP N/C aumenta. (B) La relación YAP N/C aumenta cuando se fuerza (de 1.0791 a 1.2327) y disminuye cuando se fuerza (de 1.2327 a 1.1548). La intensidad normalizada de la tinción nuclear muestra un cambio menor con la aplicación de fuerza (1.00117) y la liberación (0.95578). (C) Sección transversal X-Z de la imagen YAP (verde) y núcleo (rojo) de la célula sin fuerza, fuerza de encendido y apagado. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8: Cambio en la relación YAP N/C inducido por la aplicación de fuerza magnética. (A) A una fuerza de 0,8 nN, las células con microperlas internalizadas muestran un cambio neto en la relación YAP N/C = -0,030 ± 0,029, n = 11; las células de control muestran un cambio neto en la relación YAP N/C = -0,003 ± 0,012, n = 9. A una fuerza de 1,4 nN, las células con microperlas internalizadas muestran un cambio neto en la relación YAP N/C = 0,011 ± 0,040, n = 11; las células de control muestran un cambio neto en la relación YAP N/C = 0,005 ± 0,005, n = 9. (B) A una fuerza de 0,8 nN, las células con microperla(s) internalizada(s) muestran un cambio neto absoluto en la relación YAP N/C = 0,057 ± 0,017, n = 11; las células de control muestran un cambio neto en la relación YAP N/C = 0,021 ± 0,007, n = 9. La diferencia es significativa (valor de p = 0,0093, **). A una fuerza de 1,4 nN, las células con microperla(s) internalizada(s) muestran un cambio neto absoluto en la relación YAP N/C = 0,070 ± 0,020, n = 11; las células de control muestran un cambio neto en la relación YAP N/C = 0,010 ± 0,003, n = 9. La diferencia es significativa (valor de p = 0,0007, ***) Haga clic aquí para ver una versión más grande de esta figura.
Figura complementaria 1: Forma nuclear e intensidad de tinción nuclear. (A) Sin tratamiento con Cyto D, (B) Con tratamiento con Cyto D y (C) Células muertas. Haga clic aquí para descargar este archivo.
Video complementario 1: Un video de campo brillante que muestra el proceso de solicitud de fuerza. Haga clic aquí para descargar este video.
Discusión
La internalización de microperlas magnéticas (sección 2.2) es crítica porque las microperlas extracelulares no pueden aplicar fuerza directamente al núcleo. La aplicación de fuerza y la obtención de imágenes (sección 5.3) son pasos críticos en este experimento, y la fuerza necesaria para deformar el núcleo e inducir consecuencias biológicas significativas podría depender de la muestra. La magnitud de la fuerza en este experimento (0,8 nN y 1,4 nN) se puede aumentar aún más para desencadenar la detección de mecano-nucleares en células menos sensibles.
Para aplicar la fuerza magnética de una manera cuantitativa con alto rendimiento, la internalización de una sola microperla es un enfoque ideal. En este estudio, el porcentaje de células con internalización de microperlas simples fue similar a las 12 h (26%) y 24 h (28%), mientras que las células sin internalización de microperlas fueron mayores a las 12 h (53%) que a las 24 h (20%) (Figura 3B). Se considera que 12 h es el tiempo óptimo para el experimento de aplicación forzada porque se pueden incluir más microperlas individuales y se pueden controlar las células. Para diferentes líneas celulares y tamaños de microperlas, se debe probar el tiempo de cocultivo y la concentración de microperlas para determinar las condiciones óptimas correspondientes.
En los experimentos, las microperlas no fueron recubiertas para unirse específicamente al núcleo. Por lo tanto, la fuerza transmitida directamente desde las microperlas al núcleo es probablemente solo compresiva. Los resultados muestran que la relación YAP N/C aumenta y disminuye la población celular (Figura 8A). Una posible razón es que la fuerza magnética aplicada a través de las microperlas puede causar un cambio de tensión positivo o negativo dentro del citoesqueleto y regular la relación YAP N/C para aumentar o disminuir, respectivamente28. Investigaciones anteriores muestran que la fuerza de compresión sobre el núcleo induce un aumento en la relación YAP N/C28. En experimentos futuros, para estudiar la detección de fuerza directa del núcleo, el citoesqueleto puede interrumpirse para eliminar la transmisión de fuerza del citoesqueleto al núcleo.
Hay dos inconvenientes potenciales en los métodos actuales. Primero, en estos experimentos, el motor 3D (Figura 1A) se utilizó para ajustar el movimiento de las cuentas, que se monitorea mediante imágenes confocales en tiempo real y tiene como objetivo aplicar una fuerza de compresión en el núcleo. Sin embargo, debido a la naturaleza resbaladiza de la membrana nuclear y el entorno complejo en el citoplasma, la dirección de la fuerza aplicada por las perlas puede no ser puramente compresiva (es decir, no absolutamente perpendicular a la superficie de la membrana nuclear). Esta imperfección puede hacer que se aplique una fuerza de cizallamiento a la membrana nuclear. En segundo lugar, las microperlas actuales utilizadas en este estudio no están conjugadas con el anticuerpo para unirse con el núcleo, porque la movilidad espacial de las perlas es crítica en el experimento actual para demostrar la ventaja del actuador magnético sin contacto. Por lo tanto, el método actual no puede aplicar tensión a la membrana nuclear.
En el futuro, (1) las perlas con anticuerpo anti-nesprin-1 se conjugarán para unirse específicamente con el núcleo. Esto puede garantizar la transmisión de fuerza directa y específica entre las microperlas y las proteínas diana. (2) La dirección de la fuerza se calibrará manipulando la microperla magnética única en hidrogel blando incrustado con perlas fluorescentes. El desplazamiento 3D de las perlas fluorescentes se puede utilizar para calcular el campo de deformación del hidrogel y determinar la dirección de la fuerza en función del campo magnético aplicado. Después de que la microperla se une químicamente con el núcleo, la aplicación de una fuerza con una dirección conocida determinará el tipo de fuerza (tensión, compresión o cizallamiento). (3) Las imágenes 3D de la tinción nuclear se utilizarán para construir un modelo FEM de simulación 3D del núcleo. La dirección de la fuerza se puede verificar comparando la deformación nuclear antes y después de la aplicación de la fuerza magnética.
La técnica única desarrollada en este estudio proporciona varias ventajas potenciales: (1) En comparación con la indentación vertical por sondas AFM, las microperlas magnéticas pueden aplicar fuerza en cualquier dirección. Las células cultivadas en superficies de sustrato 2D pueden tener una distribución y orientación heterogénea de proteínas en sus superficies verticales y horizontales de la membrana plasmática y la envoltura nuclear. La aplicación de fuerza horizontalmente puede inducir respuestas de detección mecanológica previamente no observadas. (2) Una vez que las microperlas están funcionalmente recubiertas para unirse a los núcleos, tanto las fuerzas de empuje como las de tracción se pueden aplicar directamente sobre el núcleo para estudiar más a fondo la mecanodetección nuclear diferencial debido a las distintas direcciones de fuerza. (3) Al controlar la unión específica de microperlas a ciertas proteínas de la envoltura nuclear, se pueden dilucidar mecanismos de detección de fuerza nuclear previamente poco investigados. La evidencia emergente muestra que el núcleo es probablemente un mecano-sensor36, y la mecano-detección nuclear es el regulador más directo de la translocación YAP28. El mecanismo de translocación YAP regulada nuclear se estudia activamente y se proponen varios candidatos de mecano-sensor o parámetros en el núcleo, incluyendo el tamaño de poro nuclear28, la forma nuclear 25,61, el complejo LINC y la tensión de la envoltura nuclear20. La manipulación de las microperlas magnéticas abre la posibilidad de una exploración detallada de tales mecanismos mediante la aplicación directa de fuerza en el complejo LINC y las regulaciones controladas de la tensión y la forma de la envoltura nuclear. (4) Además de aplicar fuerzas sobre el núcleo, las microperlas también son adecuadas para ser diseñadas para unirse al lado interno de la membrana plasmática para revelar cómo los dominios intracelulares de las proteínas de membrana y su complejo responden a las señales biofísicas.
En resumen, este documento demostró un método que (1) libera microperlas de hierro de tamaño micro en el citoplasma sin afectar la morfología nuclear y las funciones de las proteínas, (2) aplica fuerza sobre el núcleo mediante microperlas magnéticas y (3) realiza imágenes de células vivas de fluorescencia confocal durante la aplicación de fuerza. Estas herramientas no invasivas abren las posibilidades para la manipulación epigenética directa de orgánulos en células individuales, el interrogatorio basado en imágenes de superresolución de la mecanotransducción del núcleo y la exploración detallada de la organización cromosómica 3D regulada por la fuerza (en combinación con Hi-C: captura de confirmación cromosómica de alta resolución) y la reprogramación en los contextos de fisiología celular y patobiología.
Divulgaciones
No hay conflictos de intereses que declarar.
Agradecimientos
Este proyecto está financiado por UF Gatorade Award Start-up Package (X. T.), el UFHCC Pilot Award (X. T. y el Dr. Dietmar Siemann), UF Opportunity Seed Fund (X. T.) y UFHCC University Scholars Program (H. Y. Wang). Agradecemos sinceramente las discusiones intelectuales y el apoyo técnico del Dr. Jonathan Licht (UFHCC), Dr. Rolf Renne (UFHCC), Dr. Christopher Vulpe (UFHCC), Dr. Blanka Sharma (BME), Dr. Mark Sheplak (MAE y ECE), Dr. Daniel Ferris (BME), Dra. Malisa Sarntinoranont (MAE), Dr. Ashok Kumar (MAE), Dr. Benjamin Keselowsky (BME), Dr. Brent Gila (RSC), Dr. Philip Feng (ECE), Dr. Gregory A. Hudalla (BME), Dr. Steven Ghivizzani (OSSM), Dr. Yenisel Cruz-Almeida (CDBS), Dr. Roger Fillingim (CD-BS), Dr. Robert Caudle (OMS), Dr. John Neubert (DN-OR), Dr. Justin Hiliard (Neurocirugía), Dr. Tian He (Universidad de Harvard), Dr. Youhua Tan (Universidad Politécnica de Hong Kong), Dr. Jessie L-S Au (Instituto de Farmacología de Sistemas Cuantitativos), Dr. David Hahn (Universidad de Arizona), y el equipo de soporte de Nikon (Drs. José Serrano-Vélez, Larry Kordon y Jon Ekman). Estamos profundamente agradecidos por el apoyo efectivo de todos los miembros de los laboratorios de investigación de Tang, Yamaguchi, Sharma, Au, Siemann y Guan y todos los miembros del personal del Departamento MAE de UF.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.05 % Trypsin | Corning | 25-051-CI | |
| 25 cm2 flask | Corning | 156340 | |
| 7-µm mean diameter carbonyl iron microbeads | N/A | N/A | |
| A1R confocal system | Nikon | ||
| Carbonyl Iron Powder CM | BASF | 30042253 | Magnetic microbead |
| Culture medium (RPMI-1640) | Gibco | 11875093 | |
| Desktop Computer | Dell | with Windows 10 operating system | |
| Environmental chamber TIZB | Tokai Hit | TIZB | |
| Fetal bovine serum (FBS) | Gibco | 26140 | |
| Fiji ImageJ | National Institutes of Health and the Laboratory for Optical and Computational Instrumentation | ||
| Glass-bottom petri dish | MatTek | P35G-1.5-14-C | |
| Magnet | K&J Magnetics, Inc. | D99-N52 | |
| Monochrome Camera | FLIR | BFS-U3-70S7M-C | |
| NIS-Elements software platform | Nikon | software platform | |
| Nucleus mask ImageJ macro | https://github.com/KOLIUG/Nuclear mask | ||
| NucSpot Live 650 | Biotium | #40082 | Nuclear stain |
| Penicillin-streptomycin | Gibco | 15140122 | |
| Phosphate buffered saline (PBS) | Gibco | 10010023 | |
| Ti2-E inverted microscope | Nikon | ||
| XYZ mover (CAD files) | https://github.com/KOLIUG/XYZ-mover |
Referencias
- Discher, D. E., Janmey, P., Wang, Y. Tissue cells feel and respond to the stiffness of their substrate. Science. 310 (5751), 1139-1143 (2005).
- Janmey, P. A., Fletcher, D. A., Reinhart-King, C. A. Stiffness sensing by cells. Physiological Reviews. 100 (2), 695-724 (2020).
- Bajaj, P., Tang, X., Saif, T. A., Bashir, R. Stiffness of the substrate influences the phenotype of embryonic chicken cardiac myocytes. Journal of Biomedical Materials Research Part A. 95 (4), 1261-1269 (2020).
- Tang, X., et al. Mechanical force affects expression of an in vitro metastasis-like phenotype in HCT-8 cells. Biophysical Journal. 99 (8), 2460-2469 (2010).
- Hofmann, M., et al. Lowering of tumor interstitial fluid pressure reduces tumor cell proliferation in a xenograft tumor model. Neoplasia. 8 (2), 89-95 (2006).
- Yankaskas, C. L., et al. The fluid shear stress sensor TRPM7 regulates tumor cell intravasation. Science Advances. 7 (28), (2021).
- Kim, E., et al. A biosynthetic hybrid spidroin-amyloid-mussel foot protein for underwater adhesion on diverse surfaces. ACS Applied Materials and Interfaces. 13 (41), 48457-48468 (2021).
- Tajik, A., et al. Transcription upregulation via force-induced direct stretching of chromatin. Nature Materials. 15 (12), 1287-1296 (2016).
- Lee, J., Abdeen, A. A., Tang, X., Saif, T. A., Kilian, K. A. Matrix directed adipogenesis and neurogenesis of mesenchymal stem cells derived from adipose tissue and bone marrow. Acta Biomaterialia. 42, 46-55 (2016).
- Lee, J., Abdeen, A. A., Tang, X., Saif, T. A., Kilian, K. A. Geometric guidance of integrin mediated traction stress during stem cell differentiation. Biomaterials. 69, 174-183 (2015).
- Ren, B., et al. Study of sacrificial ink-assisted embedded printing for 3D perfusable channel creation for biomedical applications. Applied Physics Reviews. 9 (1), 011408(2022).
- Coyle, S., et al. Cell alignment modulated by surface nano-topography-Roles of cell-matrix and cell-cell interactions. Acta Biomaterialia. 142, 149-159 (2022).
- Sawada, Y., et al. Force sensing by mechanical extension of the Src family kinase substrate p130Cas. Cell. 127 (5), 1015-1026 (2006).
- Aragona, M., et al. A mechanical checkpoint controls multicellular growth through YAP/TAZ regulation by actin-processing factors. Cell. 154 (5), 1047-1059 (2013).
- Tang, X., et al. Specific and non-specific adhesion in cancer cells with various metastatic potentials. Mechanobiology of Cell-Cell and Cell-Matrix Interactions. , Springer. Boston, MA. 105-122 (2011).
- Tang, X., Saif, T. A. Adhesivity of colon cancer cells during in vitro metastasis. International Journal of Applied Mechanics. 5 (03), 1350025(2013).
- Chaudhuri, O., et al. Effects of extracellular matrix viscoelasticity on cellular behaviour. Nature. 584 (7822), 535-546 (2020).
- Ohashi, K., Fujiwara, S., Mizuno, K. Roles of the cytoskeleton, cell adhesion and rho signalling in mechanosensing and mechanotransduction. The Journal of Biochemistry. 161 (3), 245-254 (2017).
- Hamill, O. P., Martinac, B. Molecular basis of mechanotransduction in living cells. Physiological Reviews. 81 (2), 685-740 (2001).
- Liang, C., et al. Towards an integrative understanding of cancer mechanobiology: Calcium, YAP, and microRNA under biophysical Forces. Soft Matter. 18, 1112-1148 (2022).
- Tan, Y., et al. Matrix softness regulates plasticity of tumour-repopulating cells via H3K9 demethylation and Sox2 expression. Nature Communications. 5 (1), 1-12 (2014).
- Poh, Y., et al. Dynamic force-induced direct dissociation of protein complexes in a nuclear body in living cells. Nature Communications. 3 (1), 1-10 (2012).
- Tang, X., et al. A mechanically-induced colon cancer cell population shows increased metastatic potential. Molecular Cancer. 13 (1), 1-15 (2014).
- Wu, J., et al. Effects of dynein on microtubule mechanics and centrosome positioning. Molecular Biology of the Cell. 22 (24), 4834-4841 (2011).
- Tang, X., Ali, M. Y., Saif, M. T. A novel technique for micro-patterning proteins and cells on polyacrylamide gels. Soft Matter. 8 (27), 7197-7206 (2011).
- Tang, X., Bajaj, P., Bashir, R., Saif, T. A. How far cardiac cells can see each other mechanically. Soft Matter. 7 (13), 6151-6158 (2011).
- Tang, X., et al. Mechanical force affects expression of an in vitro metastasis-like phenotype in HCT-8 cells. Biophysical Journal. 99 (8), 2460-2469 (2010).
- Elosegui-Artola, A., et al. Force triggers YAP nuclear entry by regulating transport across nuclear pores. Cell. 171 (6), 1397-1410 (2017).
- Gudipaty, S. A., et al. Mechanical stretch triggers rapid epithelial cell division through Piezo1. Nature. 543 (7643), 118-121 (2017).
- Tang, X., et al. Attenuation of cell mechanosensitivity in colon cancer cells during in vitro metastasis. PLoS One. 7 (11), 50443(2012).
- Cha, C., et al. Top-down synthesis of versatile polyaspartamide linkers for single-step protein conjugation to materials. Bioconjugate Chemistry. 22 (12), 2377-2382 (2012).
- Chen, X., et al. Glycosaminoglycans modulate long-range mechanical communication between cells in collagen networks. Proceedings of the National Academy of Sciences of the United States of America. 119 (15), (2022).
- Boyle, J. J., Pless, R. B., Thomopoulos, S., Genin, G. M. Direct estimation of surface strain fields from a stereo vision system. Journal of Biomechanical Engineering. 142 (7), 074503(2020).
- Kim, S., Uroz, M., Bays, J. L., Chen, C. S. Harnessing mechanobiology for tissue engineering. Developmental Cell. 56 (2), 180-191 (2021).
- Driscoll, T. P., et al. Cytoskeletal to nuclear strain transfer regulates YAP signaling in mesenchymal stem cells. Biophysical Journal. 108 (12), 2783-2793 (2015).
- Guilluy, C., et al. Isolated nuclei adapt to force and reveal a mechanotransduction pathway in the nucleus. Nature Cell Biology. 16 (4), 376-381 (2014).
- Vashisth, M. Scaling concepts in 'omics: Nuclear lamin-B scales with tumor growth and often predicts poor prognosis, unlike fibrosis. Proceedings of the National Academy of Sciences of the United States of America. 118 (48), (2021).
- Roberts, A. B., et al. Tumor cell nuclei soften during transendothelial migration. Journal of Biomechanics. 121, 110400(2021).
- Denais, C. M., et al. Nuclear envelope rupture and repair during cancer cell migration. Science. 352 (6283), 353-358 (2016).
- Raab, M., et al. ESCRT III repairs nuclear envelope ruptures during cell migration to limit DNA damage and cell death. Science. 352 (6283), 359-362 (2016).
- Lammerding, J., et al. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. The Journal of Clinical Investigation. 113 (3), 370-378 (2004).
- Shelby, J., Patrick, J., Edgar, S., Chiu, D. T. Monitoring cell survival after extraction of a single subcellular organelle using optical trapping and pulsed-nitrogen laser ablation. Photochemistry and Photobiology. 81 (4), 994-1001 (2005).
- Caspi, A., Granek, R., Elbaum, M. Diffusion and directed motion in cellular transport. Physical Review E. 66 (1), 011916(2002).
- Svoboda, K., Block, S. M. Biological applications of optical forces. Annual Review of Biophysics and Biomolecular Structure. 23 (1), 247-285 (1994).
- Rohrbach, A. Stiffness of optical traps: quantitative agreement between experiment and electromagnetic theory. Physical Review Letters. 95 (16), 168102(2005).
- Neuman, K. C., et al. Characterization of photodamage to Escherichia coli in optical traps. Biophysical Journal. 77 (5), 2856-2863 (1999).
- Kanger, J. S., Subramaniam, V., Driel, R. V. Intracellular manipulation of chromatin using magnetic microbeads. Chromosome Research. 16 (3), 511-522 (2008).
- Bausch, A. R., et al. Local measurements of viscoelastic parameters of adherent cell surfaces by magnetic microbead microrheometry. Biophysical Journal. 75 (4), 2038-2049 (1998).
- Fisher, J. K., et al. Three-dimensional force microscope: a nanometric optical tracking and magnetic manipulation system for the biomedical sciences. Review of Scientific Instruments. 76 (5), 053711(2005).
- Berret, J. -F. Local viscoelasticity of living cells measured by rotational magnetic spectroscopy. Nature Communications. 7, 10134(2016).
- Hu, B., Dobson, J., El Haj, A. J. Control of smooth muscle α-actin (SMA) up-regulation in HBMSCs using remote magnetic microbead mechano-activation. Nanomedicine: Nanotechnology, Biology and Medicine. 10 (1), 45-55 (2014).
- Kamiyama, D., et al. Versatile protein tagging in cells with split fluorescent protein. Nature Communications. 7, 11046(2016).
- Feng, S., et al. Improved split fluorescent proteins for endogenous protein labeling. Nature Communications. 8, 370(2017).
- Leonetti, M. D., Sekine, S., Kamiyama, D., Weissman, J. S., Huang, B. A scalable strategy for high-throughput GFP tagging of endogenous human proteins. Proceedings of the National Academy of Sciences of the United States of America. 113 (25), 3501-3508 (2016).
- Tulpule, A., et al. Kinase-mediated RAS signaling via membraneless cytoplasmic protein granules. Cell. 184 (10), 2649-2664 (2021).
- Ansari, A. M., et al. Cellular GFP toxicity and immunogenicity: potential confounders in in vivo cell tracking experiments. Stem Cell Reviews and Reports. 12 (5), 553-559 (2016).
- Gibson, T. J., Seiler, M., Veitia, R. A. The transience of transient overexpression. Nature Methods. 10 (8), 715-721 (2013).
- Ratz, M., et al. CRISPR/Cas9-mediated endogenous protein tagging for RESOLFT super-resolution microscopy of living human cells. Scientific Reports. 5, 9592(2015).
- Suzuki, H., Ho, C., Kasagi, N. A chaotic mixer for magnetic microbead-based micro cell sorter. Journal of Microelectromechanical Systems. 13 (5), 779-790 (2004).
- Luo, Q., et al. All-optical mechanobiology interrogation of yes-associated protein in human cancer and normal cells using a multi-functional system. Journal of Visualized Experiments. (178), e62934(2021).
- Koushki, N., et al. Lamin A redistribution mediated by nuclear deformation determines dynamic localization of YAP. BioRxiv. , (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados