Method Article
Combinazione di attuatore di forza magnetica 3D e imaging a fluorescenza multifunzionale per studiare la meccanobiologia del nucleo
In questo articolo
Riepilogo
Questo studio presenta un nuovo protocollo per applicare direttamente la forza meccanica sul nucleo cellulare attraverso microsfere magnetiche consegnate nel citoplasma e per condurre simultanee immagini fluorescenti di cellule vive.
Abstract
Una questione fondamentale in meccanobiologia è come le cellule viventi percepiscono gli stimoli meccanici extracellulari nel contesto della fisiologia e della patologia cellulare. Si ritiene che la meccano-sensazione cellulare degli stimoli meccanici extracellulari sia attraverso i recettori di membrana, il complesso proteico associato e il citoscheletro. I recenti progressi nella meccanobiologia dimostrano che il nucleo cellulare nel citoplasma stesso può percepire indipendentemente gli stimoli meccanici contemporaneamente. Tuttavia, manca una comprensione meccanicistica di come il nucleo cellulare percepisce, trasduce e risponde agli stimoli meccanici, principalmente a causa delle sfide tecniche nell'accesso e nella quantificazione della meccanica del nucleo con strumenti convenzionali. Questo documento descrive la progettazione, la fabbricazione e l'implementazione di un nuovo attuatore di forza magnetica che applica stimoli meccanici 3D precisi e non invasivi per deformare direttamente il nucleo cellulare. Utilizzando cellule ingegnerizzate con CRISPR / Cas9, questo studio dimostra che questo strumento, combinato con l'imaging fluorescente confocale ad alta risoluzione, consente la rivelazione della dinamica in tempo reale di una proteina associata al sì meccano-sensibile (YAP) in singole cellule in funzione della deformazione del nucleo. Questo semplice metodo ha il potenziale per colmare l'attuale divario tecnologico nella comunità meccanobiologica e fornire risposte al divario di conoscenze che esiste nella relazione tra meccanotrasduzione del nucleo e funzione cellulare.
Introduzione
Questo studio mira a sviluppare e applicare una nuova tecnica per chiarire la meccanobiologia del nucleo combinando gli attuatori magnetici che applicano la forza meccanica direttamente sul nucleo cellulare e la microscopia a fluorescenza confocale che visualizza simultaneamente i cambiamenti subcellulari strutturali e funzionali. Le cellule rilevano segnali biofisici extracellulari tra cui rigidità tissutale 1,2,3,4, pressione del liquido interstiziale e sforzo di taglio 5,6,7, topologia / geometria di superficie8,9,10,11,12 e tensione / sforzo di compressione 13,14, 15,16. I segnali biofisici vengono convertiti in segnali biochimici e innescano potenziali cambiamenti a valle dell'espressione genica e dei comportamenti cellulari, un processo noto come meccanotrasduzione 17,18,19,20,21,22,23,24,25,26,27 . Per studiare i processi di meccanotrasduzione, sono state sviluppate una miriade di tecniche per applicare la forza meccanica sulle cellule, come la microscopia a forza atomica28, il dispositivo di allungamento cellulare29, il sensore di forza bio-MEMS (sistemi micro-elettromeccanici) 15,30,31, la reologia di taglio 32 e il sistema di visione stereoscopica 33 . Una recente revisione riassume gli approcci per applicare segnali meccanici extracellulari e interferire con il meccanorilevamento34. Ad oggi, la maggior parte di questi metodi applica forza sulla membrana plasmatica cellulare e le cellule ricevono direttamente questi segnali biofisici extracellulari attraverso recettori di membrana come integrina, caderina, canali ionici e recettori accoppiati a proteine G. Successivamente, trasmettono il segnale al citoscheletro intracellulare e al nucleo. Ad esempio, utilizzando la traslocazione di proteine associate sì (YAP) come indicatore di meccano-rilevamento, le cellule hanno dimostrato di percepire i segnali meccanici di rigidità del substrato e tensione extracellulare dalla membrana cellulare e trasmetterli attraverso il citoscheletro nel nucleo per indurre la traslocazione da citoplasma YAP a nucleo28,35.
Prove recenti suggeriscono che il nucleo cellulare stesso è un meccano-sensore indipendente 8,36,37. Ciò è dimostrato da esperimenti condotti sul nucleo isolato raccolto dalle cellule, dove è stato rivelato che i nuclei cambiano in modo adattivo la loro rigidità in risposta alla forza meccanica applicata direttamente su di essi36. Durante molte condizioni fisiologiche, i nuclei sia nelle cellule tumorali che in quelle sane percepiscono segnali biofisici extracellulari e cambiano le loro proprietà meccaniche e gli assemblaggi38,39,40. Ad esempio, dopo lo stravaso, la rigidità nucleare delle cellule tumorali diminuisce e mantiene la morbidezza per oltre 24 ore38. Durante la migrazione attraverso lo spazio interstiziale confinato, i nuclei delle cellule tumorali spesso perdono e recuperano la loro integrità strutturale39. Tuttavia, il modo in cui il nucleo percepisce il segnale biofisico è sconosciuto, sebbene siano state trovate coinvolte diverse proteine dell'involucro nucleare e famiglie di proteine, come Lamin A / C e linker del complesso nucleoscheletro e citoscheletro (LINC)38,41. Quindi, nuovi metodi non invasivi che possono applicare direttamente la forza al nucleo disaccoppiano l'effetto della trasmissione della forza dalla membrana cellulare-plasma e dal citoscheletro e aiuteranno a chiarire i meccanismi molecolari precedentemente inaccessibili del meccano-rilevamento nucleare.
La ricerca che ha impiegato pinzette ottiche per manipolare organelli42 e microsfere iniettate nelle cellule43 ha mostrato la capacità tecnologica di applicare direttamente la forza sul nucleo. Tuttavia, la tecnica delle pinzette ottiche ha diverse limitazioni: (1) le pinzette ottiche a bassa produttività spesso manipolano solo una cellula o microbead alla volta; e (2) il potenziale fotodanneggiamento e la deformazione dell'artefatto di temperatura del nucleare richiedono decine di pN36 e la corrispondente potenza laser necessaria è di circa 10 mW per pN44,45. Tale intensità laser è sufficiente per innescare il fotodanneggiamento nelle cellule e perturbare le funzioni delle cellule durante l'esperimento46.
La forza magnetica applicata attraverso microsfere all'interno delle cellule viventi mostra il potenziale per applicare direttamente la forza sul nucleo e supera i limiti delle pinzette ottiche. Una volta che le microsfere vengono consegnate nel citoplasma, un campo magnetico può esercitare una forza magnetica su più microsfere contemporaneamente in modo ad alto rendimento. Il campo magnetico non influenza le funzioni cellulari47, ma genera forza da pN a nN, che è sufficiente per indurre la deformazione nucleare 36,48,49. Ad oggi, la manipolazione delle microsfere magnetiche è stata applicata sulla membrana plasmatica cellulare48, all'interno del citoplasma50, sulla F-actina51, all'interno del nucleo47 e sul nucleo isolato36. Tuttavia, la manipolazione magnetica delle microsfere non è mai stata utilizzata per applicare una forza meccanica diretta sull'involucro nucleare per studiare la meccanotrasduzione nel nucleo.
In questo articolo, viene sviluppata una semplice tecnica per fornire in modo non invasivo microsfere magnetiche nel citoplasma e utilizzare queste microsfere per applicare forza meccanica sul nucleo (Figura 1). Qui, le normali linee cellulari B2B umane ingegnerizzate da CRISPR / Cas9 che esprimono endogenamente mNeonGreen21-10/11-tagged YAP vengono utilizzate per convalidare il metodo. YAP è una proteina meccano-sensibile e la traslocazione di YAP è regolata dal meccano-rilevamento nucleare14,28. L'approccio knock-in regolato da CRISPR / Cas9 è stato scelto per etichettare YAP endogeno con una proteina fluorescente (FP) mNeonGreen21-10/11. Sebbene l'editing CRISPR sia noto per avere un'efficienza incompleta e un effetto fuori bersaglio, i protocolli nelle pubblicazioni precedenti hanno integrato l'ordinamento a fluorescenza per selezionare il corretto inserimento del frame di lettura aperto52,53,54. Con questo ulteriore livello di selezione, non è stato osservato alcun evento di tagging off-target in 20+ linee cellulari precedentemente generate52,53,54,55. Questo è un costrutto proteico fluorescente diviso, ma in linea di principio, qualsiasi tag fluorescente esprimibile potrebbe essere utilizzabile. Questo approccio di etichettatura è superiore ai metodi transgenici o anticorpali. In primo luogo, a differenza dell'espressione transgenica, la proteina marcata mantiene il dosaggio genico a copia singola ed si esprime nel contesto fisiologico della rete di regolazione genica nativa, limitando le deviazioni nella concentrazione, localizzazione e interazione della proteina. Il metodo di tagging utilizzato in questo studio raggiunge un throughput e un'efficienza superiori di oltre un ordine di grandezza rispetto all'etichettatura FP completa. Evita anche le sfide associate all'immunofluorescenza a causa degli artefatti di fissazione e della limitata disponibilità di anticorpi di alta qualità e ad alta specificità. In secondo luogo, l'approccio utilizzato in questo articolo riduce al minimo le perturbazioni della fisiologia cellulare e consente la rivelazione in tempo reale di tutti gli YAP endogeni in modo autentico. Al contrario, altri metodi transgenici comuni spesso portano alla sovraespressione di YAP. La distribuzione artificiale risultante può potenzialmente causare citotossicità e influenzare il meccano-rilevamento delle cellule56,57,58.
Questo studio presenta un protocollo per applicare direttamente la forza sul nucleo attraverso microsfere magnetiche consegnate nel citoplasma e per condurre simultanee immagini fluorescenti a cellule vive. In sintesi, i protocolli qui presentati dimostrano come (1) fornire microsfere magnetiche nella cellula mentre si trova all'esterno del nucleo, (2) manipolare le microsfere per applicare forza magnetica sul nucleo, (3) eseguire l'imaging fluorescente confocale delle cellule durante la manipolazione e (4) analizzare quantitativamente il rapporto YAP nucleare/citoplasma (N/C) durante tutto il processo di applicazione della forza. I risultati suggeriscono che (1) attraverso l'endocitosi, le microsfere magnetiche possono essere erogate in modo non invasivo nel citoplasma delle cellule B2B entro 7 ore (Figura 2 e Figura 3); e (2) la forza magnetica quantificata applicata direttamente sul nucleo (Figura 4, Figura 5 e Figura 6) da sola può innescare diversi cambiamenti del rapporto YAP N/C nelle cellule B2B ingegnerizzate da CRISPR / Cas9 (Figura 7 e Figura 8).
Protocollo
1. Mantenimento di cellule B2B ingegnerizzate con CRISPR / Cas9
- Coltura di cellule B2B in un pallone T25 con RPMI-1640 integrato con il 10% di siero bovino fetale e l'1% di penicillina-streptomicina.
- Mantenere le celle B2B in un incubatore umidificato a 37 °C con il 5% di CO2.
- Sottocoltura delle cellule B2B quando la confluenza raggiunge il 70% all'80%.
- Conservare la linea cellulare B2B in terreno di coltura RPMI-1640 con DMSO al 10% (v/v) in un congelatore a -80 °C.
- Usa le celle B2B con un numero di passaggio inferiore a 10 negli esperimenti.
2. Coltura cellulare
- Seminare le cellule su una capsula di Petri con fondo di vetro.
- Spostare il pallone che contiene le cellule B2B all'interno dall'incubatore all'armadio di biosicurezza.
- Rimuovere il terreno di coltura nel pallone utilizzando una pipetta di aspirazione con una pompa per vuoto collegata.
- Lavare il matraccio con 2 mL di soluzione salina tamponata fosfato (PBS).
- Rimuovere PBS utilizzando la pipetta di aspirazione.
- Aggiungere 0,5 mL di soluzione di tripsina allo 0,05% per staccare le cellule dal fondo del substrato del pallone.
- Mettere il pallone nell'incubatrice per 5 minuti.
- Spostare il pallone nell'armadio di biosicurezza. Aggiungere 5 mL di nuovo terreno di coltura nel matraccio e pipettare la soluzione su e giù.
- Depositare 50 μL del mezzo con celle (300 cellule/μL) sulla capsula di Petri con fondo di vetro. Aggiungere 2 ml di terreno di coltura nella capsula di Petri.
- Posizionare la capsula di Petri nell'incubatrice. Attendere 12 ore affinché le celle si attacchino.
- Coltiva le cellule con microsfere magnetiche.
- Pesare 0,2 g di microsfere di ferro carbonile di diametro medio di 7 μm (di seguito denominate microsfere da 7 μm, vedere la tabella dei materiali).
- Utilizzare una pipetta per sospendere le microsfere in 1 mL di terreno di coltura RPMI-1640.
- Porta la capsula di Petri con cellule B2B nell'armadio di biosicurezza.
- Aggiungere 200 μL del mezzo contenente microsfere nella capsula di Petri.
NOTA: Aggiungere rapidamente il mezzo per evitare la precipitazione delle microsfere. - Rimetti la capsula di Petri nell'incubatore fino a quando le microsfere non vengono internalizzate dalle cellule. Controllare l'internalizzazione ogni 6 ore per determinare il momento ottimale per l'internalizzazione per diverse linee cellulari.
- Per verificare l'internalizzazione, eseguire l'imaging a fluorescenza confocale per visualizzare il confine della microsfera, del nucleare e della cellula. Se la microsfere è internalizzata dalla cellula, sarà all'interno del confine cellulare.
3. Visualizzazione del nucleo
- Riscaldare 1,5 ml del terreno di coltura nell'incubatore per 15 minuti.
- Spegnere la luce dell'armadio di biosicurezza. Prendi la capsula di Petri che contiene la cellula, il terreno di coltura riscaldato, la colorazione nucleare e Verapamil HCl nell'armadio di biosicurezza.
NOTA: I componenti di colorazione nucleare sono sensibili alla luce. Evitare l'esposizione alla luce durante il funzionamento. - Diluire la colorazione nucleare 1000x di DMSO a 100x.
- Diluire 100 mM Verapamil HCl mediante DMSO a 10 mM.
- Aggiungere 15 μL di colorante nucleare 100x e 15 μL di 10 mM Verapamil HCl a 1,5 mL di terreno di coltura. Mescolare bene pipettando su e giù.
- Rimuovere il terreno di coltura dalla capsula di Petri. Aggiungere il terreno di coltura contenente la colorazione nucleare nella capsula di Petri.
- Rimettere le cellule nell'incubatore per oltre 2 ore.
4. Preparazione dell'hardware di applicazione della forza magnetica
- Stampare in 3D tutte le parti utilizzando acrilonitrile-butadiene-stirene (ABS) e assemblarle seguendo il design CAD (Figura 1A). Il progetto CAD è incluso nella tabella dei materiali.
- Utilizzare del nastro biadesivo per fissare il magnete al dispositivo di spostamento del magnete (Figura 1A).
- Posizionare il dispositivo di spostamento magnetico accanto al palco del microscopio. Utilizzare le tre manopole per regolare la posizione spaziale del magnete fino a quando non può spostarsi sopra la piastra di Petri tra 13 mm e 120 mm.
NOTA: Assicurarsi che il limite superiore della distanza tra il magnete e la capsula di Petri sia il più grande possibile per evitare l'applicazione di forza indesiderata sulle microsfere magnetiche. 120 mm è il valore massimo in questa configurazione sperimentale. Assicurarsi che il magnete non interferisca con le parti del microscopio, compresi gli obiettivi e gli stadi motorizzati. - Impostare il magnete sulla posizione z più alta (a 120 mm).
5. Applicazione forzata e imaging di cellule vive
- Allestimento della camera ambientale per l'imaging a lungo termine
- Applicare una soluzione di etanolo al 75% per sterilizzare e pulire accuratamente la camera dell'ambiente.
- Posizionare la camera ambientale sul palco motorizzato del microscopio invertito.
- Aprire il serbatoio di CO 2 e impostare la velocità di afflusso di CO2 su 160 ml/min.
- Regolare la temperatura della camera a 44 °C (superiore), 42 °C (bagno) e 40 °C (stadio).
- Aggiungere 20 ml di acqua purificata nel bagno della camera dell'ambiente per mantenere il 90% di umidità.
- Estrarre la capsula di Petri con fondo di vetro che contiene cellule bersaglio dall'incubatore di coltura tissutale e posizionarla nella camera.
- Applicare il morsetto metallico della camera ambiente per fissare la posizione della capsula di Petri.
NOTA: La capsula di Petri deve essere serrata saldamente nella camera perché la forza magnetica può spostare la capsula se non viene bloccata. - Chiudere il coperchio della camera.
- Ottimizzazione dei parametri di imaging
- Ottimizzare la dimensione del foro stenopeico: il foro stenopeico blocca i fotoni fuori fuoco. Una dimensione stenopeica più grande produce più fotoni fuori fuoco ma un'immagine più luminosa. Una dimensione stenopeica più piccola produce un'immagine più focalizzata e più fioca. Assicurati di ottimizzare le dimensioni del foro stenopeico per ottenere immagini confocali a fuoco con il rapporto segnale-rumore appropriato.
- Ottimizzare l'intensità del laser: l'intensità del laser determina l'intensità dell'eccitazione e quindi l'emissione luminosa. La bassa intensità laser offre un basso rapporto segnale-rumore. Un'intensità laser troppo elevata causerà il fotosbiancamento. Regolare l'intensità del laser di conseguenza.
- Ottimizza le dimensioni e i passaggi dei passi: i passaggi e le dimensioni dei passi determinano quante immagini occuperanno in uno stack Z. Dimensioni dei passi più piccole e più passaggi aumenteranno la risoluzione Z-stack ma aumenteranno anche il fotosbiancamento. In questo esperimento, è stata utilizzata una dimensione del passo di 1 μm per le cellule con ~ 15 μm di altezza della cella.
- Ottimizzare il tempo di esposizione: il tempo di esposizione determina per quanto tempo la cellula sarà esposta al laser di eccitazione. Un tempo di esposizione basso ridurrà il rapporto segnale-rumore. Un tempo di esposizione elevato causerà il fotosbiancamento. In questo esperimento è stato utilizzato un tempo di esposizione di 1 fotogramma per 4 s.
- Ottimizzazione dei parametri di imaging: modificare uno dei quattro parametri in modo iterativo e mantenere coerenti gli altri parametri. Ogni volta, misurare il rapporto YAP N/C di ciascuna immagine e confrontare la variazione del rapporto YAP N/C per determinare il livello di photobleaching. Ripetere il processo di ottimizzazione fino a raggiungere un equilibrio tra il rapporto segnale/rumore, la velocità di imaging e il fotosbiancamento.
- Definire le configurazioni di imaging utilizzando i parametri di imaging ottimizzati per impostazioni di imaging più rapide durante gli esperimenti.
NOTA: Le configurazioni utilizzate in questo studio sono descritte nel paragrafo 5.3 dei parametri di imaging. Per ottimizzare i parametri di imaging delle configurazioni nella sezione 5.3, usare lo stesso metodo del punto 5.2.5.
- Applicazione di piccole forze e imaging confocale
NOTA: Il microscopio Nikon Ti2-E è stato utilizzato per l'imaging in questo studio e i passaggi dettagliati per l'acquisizione delle immagini sono riportati di seguito.- Aprire il microscopio invertito. Aprire l'applicazione software Elements.
- Definire magnetic_find di configurazione. Controlla solo il canale FITC. Impostare PMT HV = 70, Offset = 0, Intensità laser = 10. Impostare la velocità di scansione su 1 fotogramma per 2 secondi facendo clic sul pulsante 1/2 . Impostare la dimensione del foro stenopeico su 1,2 UA facendo clic sul pulsante 1,2 U.A. Questa configurazione verrà utilizzata nel passaggio 5.3.5.
- Definire magnetic_YAP_Nucleus di configurazione. Controlla il canale FITC. Impostare PMT HV = 70, Offset = 0, Intensità laser = 10. Impostare la velocità di scansione su 1 fotogramma per 4 secondi facendo clic sul pulsante 1/2 . Impostare la dimensione del foro stenopeico su 1,2 UA facendo clic sul pulsante 1,2 U.A. Per visualizzare il confine del nucleo e l'intensità della macchia nucleare, controllare il canale Cy5. Impostare PMT HV = 70, Offset = 0, Intensità laser = 10. La dimensione del foro stenopeico è ottimizzata per l'imaging 3D YAP. Non fare nuovamente clic sul pulsante 1.2 A.U . dopo aver controllato il canale Cy5. Questa configurazione verrà utilizzata nel passaggio 5.3.7.
- Se necessario, attiva DIA tramite Elements . Aprite SpinView, usate un campo luminoso e regolate la messa a fuoco dell'oggetto per ottenere un'immagine chiara delle celle. Usa un obiettivo 10x per trovare più celle singole appropriate in tre condizioni: con una singola microsfere all'interno, con più microsfere all'interno e senza alcuna microsfere all'interno. Passa all'obiettivo 40x. Assegnare un nome a questa posizione con il numero di posizione appropriato.
- Elementi aperti. Clicca su magnetic_find. Fare clic sul pulsante Rimuovi interblocco.
- Fare clic su Scansione e regolare la posizione Z del piano focale. Fare clic sui pulsanti Superiore e Inferiore per impostare il limite inferiore e superiore per lo stack Z delle celle selezionate. Interrompere la scansione facendo nuovamente clic su Scansione .
- Passare alla configurazione magnetic_YAP_Nucleus . Impostare il nome del file come before_small_force.nd2. Fare clic sul pulsante Esegui con lo stack Z registrato.
- Passa al percorso della luce a destra e attiva DIA. Apri SpinView e fai clic sul pulsante Registrazione . Nel frattempo, ruotare la manopola del dispositivo di movimento magnetico per spostare il magnete fino a 46 mm sopra il fondo della capsula di Petri. Salva una sequenza di immagini o video in campo chiaro. Controlla il video per confermare che le microsfere mostrano lo spostamento indotto dalla forza magnetica.
- Ripetere i passaggi 5.3.5-5.3.7; Impostare il nome del file su after_small_force.nd2.
- Passa al percorso della luce a destra e attiva DIA. Quindi, apri SpinView e fai clic sul pulsante Registrazione . Nel frattempo, ruotare la manopola del dispositivo di movimento magnetico per spostare il magnete fino a 120 mm sopra il fondo della capsula di Petri. Salva una sequenza di immagini o video in campo chiaro.
- Ripetere i passaggi 5.3.5-5.3.7 e impostare il nome del file su before_large_force.nd2.
- Applicazione di grandi forze e imaging confocale
- Rimuovere il coperchio della camera ambiente per consentire al magnete di raggiungere 13 mm sopra il fondo della piastra di Petri.
- Passa al percorso della luce a destra e attiva DIA. Apri SpinView e fai clic sul pulsante Registrazione . Nel frattempo, ruotare la manopola del dispositivo di movimento magnetico per spostare il magnete fino a 13 mm sopra il fondo della capsula di Petri. Salva una sequenza di immagini o video in campo chiaro. Controlla il video per confermare che le microsfere mostrano lo spostamento indotto dalla forza magnetica.
- Ripetere i passaggi 5.3.5-5.3.7 e impostare il nome del file su after_large_force.nd2.
- Passa al percorso della luce a destra e attiva DIA. Quindi, apri SpinView e fai clic sul pulsante Registrazione . Nel frattempo, ruotare la manopola del dispositivo di movimento magnetico per spostare il magnete fino a 120 mm sopra il fondo della capsula di Petri. Salva una sequenza di immagini o video in campo chiaro.
- Ripetere i passaggi 5.3.5-5.3.7; Impostare il nome del file su retract_large_force.nd2.
- Chiudere il coperchio della camera dell'ambiente.
- Ripetere i passaggi 5.2 e 5.3 per più campi visivi per ottenere più dati, se necessario.
6. Elaborazione delle immagini e analisi dei dati
- Quantificazione del rapporto YAP N/C
- Apri Fiji ImageJ. Aprire le immagini .nd2 scattate nel passaggio 5.
- Fare clic su Analizza > Imposta misurazioni. Area di controllo, densità integrata, valore medio di grigio e descrittori di forma.
- Utilizzare il canale Cy5 per identificare il nucleo. Fare clic su Selezioni a mano libera per utilizzare lo strumento di selezione libera per delineare il nucleo. Inoltre, controllare la macro maschera nucleare automatica in ImageJ (vedere la tabella dei materiali).
- Fare clic su Analizza > misura nel canale FITC. Il valore misurato della media è l'intensità YAP nucleare media DN.
- Utilizzare il canale Cy5 per identificare il nucleo. Utilizzare il canale FITC per identificare la cella. Fare clic su Selezioni a mano libera per utilizzare lo strumento di selezione libera per selezionare una regione di interesse all'interno del citoplasma ed evitare la microsfera magnetica. Questa regione di interesse non deve includere il nucleo.
- Fare clic su Analizza > misura nel canale FITC. Il valore misurato della media è l'intensità media YAP citoplasmatica DC.
- Calcola il rapporto YAP N/C = D N / DC.
- Quantificazione della forma nucleare e dell'intensità normalizzata della colorazione nucleare
- Apri Fiji ImageJ. Aprire le immagini .nd2 scattate nel passaggio 5.
- Fare clic su Analizza > Imposta misurazioni. Area di controllo, densità integrata, valore medio di grigio e descrittori di forma.
- Utilizzare il canale Cy5 per identificare il nucleo. Fare clic su Selezioni a mano libera per utilizzare lo strumento di selezione libera per delineare il nucleo.
- Fare clic su Analizza > misura nel canale Cy5. Il valore misurato della media è l'intensità della macchia nucleare. Il valore misurato di Circ. è la circolarità nucleare.
- Per confrontare l'intensità della macchia nucleare a diversi stati di forza, tutta l'intensità della macchia nucleare è divisa per l'intensità della macchia nucleare in "before_small_force.nd2" per generare l'intensità della macchia nucleare normalizzata.
Risultati
Progettazione di un dispositivo di movimento magnetico e applicazione della forza magnetica
Per applicare forza sul nucleo attraverso le microsfere magnetiche, è stato progettato e costruito un dispositivo di movimento magnetico per controllare la posizione spaziale del magnete. Il dispositivo di spostamento del magnete contiene un telaio centrale, tre manopole e guide per spostare il magnete collegato nelle direzioni x, y e z indipendentemente alla risoluzione spaziale di 1,59 mm per ciclo (Figura 1A). Una volta che il magnete viene spostato vicino alle microsfere da 7 μm consegnate nelle cellule (Figura 1B), attrae magneticamente le microsfere e applica forza sul nucleo (Figura 1C). La direzione della forza e la magnitudine sono controllate dalla posizione relativa tra il magnete e le microsfere.
In questo articolo, due diverse grandezze di forza sono state applicate alle microsfere: (1) una forza relativamente piccola quando il magnete è stato posizionato 46 mm sopra la cella; e (2) una forza relativamente grande quando il magnete è stato posizionato 13 mm sopra la cella. La forza magnetica applicata alla microsfere F può essere calcolata dall'equazione59:  , dove Nd è il fattore di smagnetizzazione (0,33 per una sfera), μ è la permeabilità nel vuoto (6,3 × 10-3 H/m per il ferro), Vp è il volume della microsfere (178 μm 3 per una microsfere da 7 μm), e H è l'intensità del campo magnetico con l'unità A/m. H è proporzionale alla densità del flusso magnetico B con l'unità Tesla. Poiché ci si aspettava che la forza magnetica che agiva su una singola microsfera da 7 μm fosse estremamente piccola e difficile da rilevare da un trasduttore di forza, la densità del flusso magnetico B come riferimento è stata misurata per indicare l'entità della forza magnetica applicata sulle microsfere. Un sensore Hall è stato introdotto nella posizione del fondo della capsula di Petri per misurare la densità del flusso magnetico e il magnete è stato posizionato a una distanza di 13 mm o 46 mm dal fondo della capsula di Petri. Poiché le microsfere da 7 μm influenzano il campo magnetico, la densità del flusso magnetico è stata misurata con e senza microsfere. Indipendentemente dalla presenza delle microsfere da 7 μm, è stata ottenuta la stessa densità di flusso magnetico : B = 60,1 mT a una distanza di 13 mm e B = 3,7 mT a una distanza di 46 mm. Questa misurazione mostra che l'effetto delle microsfere da 7 μm sul campo magnetico generato dal magnete cilindrico con diametro di 12,7 mm e altezza di 12,7 mm (vedi la tabella dei materiali) non era rilevabile dal sensore Hall utilizzato in questo studio. Tuttavia, la densità del flusso magnetico nel caso con una distanza di 13 mm era circa 16 volte superiore a quella con una distanza di 46 mm. La calibrazione sperimentale della forza magnetica è descritta nella sezione seguente (Figura 6).
, dove Nd è il fattore di smagnetizzazione (0,33 per una sfera), μ è la permeabilità nel vuoto (6,3 × 10-3 H/m per il ferro), Vp è il volume della microsfere (178 μm 3 per una microsfere da 7 μm), e H è l'intensità del campo magnetico con l'unità A/m. H è proporzionale alla densità del flusso magnetico B con l'unità Tesla. Poiché ci si aspettava che la forza magnetica che agiva su una singola microsfera da 7 μm fosse estremamente piccola e difficile da rilevare da un trasduttore di forza, la densità del flusso magnetico B come riferimento è stata misurata per indicare l'entità della forza magnetica applicata sulle microsfere. Un sensore Hall è stato introdotto nella posizione del fondo della capsula di Petri per misurare la densità del flusso magnetico e il magnete è stato posizionato a una distanza di 13 mm o 46 mm dal fondo della capsula di Petri. Poiché le microsfere da 7 μm influenzano il campo magnetico, la densità del flusso magnetico è stata misurata con e senza microsfere. Indipendentemente dalla presenza delle microsfere da 7 μm, è stata ottenuta la stessa densità di flusso magnetico : B = 60,1 mT a una distanza di 13 mm e B = 3,7 mT a una distanza di 46 mm. Questa misurazione mostra che l'effetto delle microsfere da 7 μm sul campo magnetico generato dal magnete cilindrico con diametro di 12,7 mm e altezza di 12,7 mm (vedi la tabella dei materiali) non era rilevabile dal sensore Hall utilizzato in questo studio. Tuttavia, la densità del flusso magnetico nel caso con una distanza di 13 mm era circa 16 volte superiore a quella con una distanza di 46 mm. La calibrazione sperimentale della forza magnetica è descritta nella sezione seguente (Figura 6).
Consegna di microsfere magnetiche nel citoplasma
12 ore dopo la semina delle cellule sulla capsula di Petri con fondo di vetro, le microsfere da 7 μm vengono aggiunte al terreno di coltura. Le microsfere sono spontaneamente interiorizzate dalle cellule. Poiché le microsfere non emettono fluorescenza sotto eccitazione laser nel canale FITC o Cy5, la posizione delle microsfere internalizzate può essere identificata dalla posizione della cavità scura con l'imaging confocale della fluorescenza di YAP e nucleo. Sia le immagini 2D che quelle 3D mostrano che il microsfer si trova nel citoplasma mentre si trova all'esterno del nucleo (Figura 2).
I livelli di internalizzazione delle microsfere nelle cellule dipendono dalla durata della co-coltura di cellule e microsfere. Pertanto, le cellule sono state classificate in tre tipi in base alla quantità di microsfere internalizzate: nessuna microsfera, microsfere singola e multi-microsfere (Figura 3A). A 7 ore di co-coltura, il 62% delle cellule non ha internalizzato nessuna microsfera, il 15% delle cellule ha internalizzato una singola microsfere e il 23% delle cellule ha internalizzato multi-microsfere (numero totale di cellule = 13). A 12 ore di co-coltura, il 53% delle cellule non ha interiorizzato nessuna microsfera, il 26% delle cellule ha interiorizzato una singola microsfere e il 21% delle cellule ha internalizzato multi-microsfere (numero totale di cellule = 62). A 24 ore di co-coltura, il 20% delle cellule non ha internalizzato nessuna microsfera, il 28% delle cellule ha internalizzato una singola microsfere e il 53% delle cellule ha internalizzato multi-microsfere (numero totale di cellule = 40) (Figura 3B).
Le microsfere nel citoplasma non influenzano la forma nucleare e l'attività YAP
Per esaminare l'effetto dell'internalizzazione delle microsfere sulla forma nucleare e sull'attività proteica, la forma nucleare è stata innanzitutto quantificata rispettivamente dalla circolarità e dall'attività YAP dal rapporto YAP N/C. La circolarità è calcolata da Circolarità = 4μ (area / perimetro2). I passaggi dettagliati per quantificare il rapporto YAP N/C sono stati descritti in una precedente pubblicazione60. In breve, il rapporto YAP N/C è stato calcolato dividendo l'intensità media YAP nel nucleo per l'intensità media YAP nel citoplasma. Considerando la possibilità che la co-coltura di microsfere e cellule possa influenzare la forma nucleare anche se nessuna microsfere è internalizzata, le cellule senza co-coltura (punti neri, controllo #1, circolarità = 0,806 ± 0,037, n = 20), cellule co-coltivate con microsfere ma senza internalizzazione (punti grigi, controllo #2, circolarità = 0,806 ± 0,035, n = 22), cellule che internalizzano microsfere singole (punti rossi, microsfere singole, Sono state confrontate circolarità = 0,793 ± 0,048, n = 15) e cellule che internalizzano multi-microsfere (punti blu, multi-microsfere, n = 7) (Figura 3C). Il risultato mostra che tra tutti e quattro i gruppi testati, la circolarità nucleare non ha avuto differenze significative (Figura 3C).
Successivamente, per esaminare se il rapporto YAP N/C è influenzato dall'internalizzazione delle microsfere, le cellule co-coltivate con microsfere ma senza internalizzazione (punti grigi, controllo #2, rapporto YAP N/C = 1,155 ± 0,074, n = 35) sono state confrontate solo con le cellule con internalizzazione singola o multi-sfere (punti rossi, cellula con microsfere, rapporto YAP N/C = 1,140 ± 0,078, n = 36) alla 12aora di co-cultura (Figura 3D). Le cellule senza co-coltura non sono state confrontate perché il piatto con microsfere mostra una densità cellulare inferiore, che può influenzare il rapporto YAP N/C12. Il risultato non mostra alcuna differenza significativa (valore p = 0,667) nel rapporto YAP N/C tra i due gruppi, indicando che l'internalizzazione delle microsfere non influenza l'attività YAP (Figura 3D).
La forza magnetica deforma il nucleo
Innanzitutto, viene mostrata la deformazione del nucleo. La deformazione del nucleo è causata dalla forza di compressione applicata dalle microsfere (Figura 4A e Figura 4A1-3) nelle cellule che contengono citoscheletro. Questi dati (cioè, il nucleo viene deformato dalla compressione della microsfera) supportano che la microsfere sta effettivamente applicando una forza sul nucleo nel citoplasma affollato. Un video a campo chiaro che mostra il processo di applicazione della forza è incluso nel materiale supplementare (video supplementare 1). In secondo luogo, poiché è possibile che il microbead applichi simultaneamente forza sul citoscheletro circostante e deformi indirettamente il nucleo, gli esperimenti di compressione sono stati ripetuti in cellule che hanno i filamenti di actina interrotti (trattamento di Cyto D (2,5 μM, 1 h); Figura 4B). Questo studio mostra che i filamenti di actina sono effettivamente depolimerizzati (Figura 4B) e il nucleo è deformato dalle microsfere (Figura 4B1-3). Questi dati supportano che le microsfere stanno applicando una forza direttamente sul nucleo in assenza di citoscheletro circostante intrecciato. Collettivamente, questi dati mostrano che i protocolli e gli strumenti possono applicare una forza direttamente sul nucleo.
Controllo spaziale e temporale delle microsfere magnetiche intracellulari
Per ottenere il controllo spaziale delle microsfere, sono stati utilizzati una coppia di magneti per spostare la microsfere e controllare la sua posizione della rientranza sul nucleo (Figura 5A). Il tallone può essere spostato solo con un massimo di 2,2 μm di spostamento (Figura 5A1-4), ma può applicare in modo flessibile l'indentazione sul nucleo nelle posizioni corrispondenti. Il citoscheletro di actina circostante può limitare il movimento delle microsfere. Pertanto, il citoscheletro di actina è stato interrotto dal trattamento con Cyto D (2,5 μM, 1 ora) e la posizione della microsfere è stata manipolata ma ha mostrato risultati simili. Pertanto, si può proporre un'ipotesi: il microbead può legarsi fisicamente/chimicamente con il nucleo e altri organelli circostanti nel citoplasma, il che limita il suo ampio movimento spaziale (>2,2 μm).
Per ottenere il controllo spaziale delle microsfere, è stata utilizzata una coppia di magneti che controlla le microsfere per applicare e rilasciare la forza due volte (con diversa grandezza della forza) nella stessa posizione del nucleo (Figura 5B e Figura 5B1-B4). La durata attuale per un ciclo di applicazione e rilascio della forza è di 12 s. La velocità del controllo temporale è determinata dalla velocità operativa del motore XYZ.
Calibrazione della forza magnetica
La forza applicata al tallone sul nucleo è stata stimata misurando sperimentalmente la forza applicata da una microscopia a forza atomica calibrata (AFM) che causa una deformazione simile del nucleo. In particolare, il citoscheletro di actina è stato prima sciolto da CytoD (2,5 μM; 1 h, Figura 4B) perché l'AFM applica forza sulla superficie apicale della cellula e la rimozione della corteccia di actina e del citoscheletro consente un contatto più diretto tra la punta dell'AFM e il nucleo cellulare. Le cellule che hanno la corteccia di actina e il citoscheletro disciolti sono vive in base al confronto della forma nucleare e dell'intensità della colorazione nucleare con quelle delle cellule sane (Figura supplementare 1). In secondo luogo, la punta AFM non funzionalizzata (semi-sferica, raggio = 5 μm) che ha dimensioni e forma simili a quelle delle microsfere è stata utilizzata per indentare la superficie apicale della cellula in modo controllato dalla forza e contemporaneamente acquisire immagini confocali 3D dei corpi della cellula e del nucleo (Figura 6A). L'entità della forza di compressione da 0,8 nN a 2,0 nN è stata scelta perché, sulla base della letteratura24, la forza ad una magnitudine di 1,5 nN era nota per deformare sufficientemente il nucleo. In terzo luogo, la normale deformazione del nucleo causata dall'indentazione AFM è stata misurata attraverso l'analisi quantitativa di imaging. Inoltre, è stata ottenuta la curva di calibrazione che fornisce la relazione quantitativa AFM forza-spostamento (Figura 6B). In quarto luogo, una forza di compressione è stata applicata alla superficie laterale del nucleo controllando microsfere che hanno dimensioni e forma simili (raggio = 7 μm; Figura 6C), e la deformazione della membrana nucleare è stata misurata tramite analisi di imaging. La forza applicata alle perline è stimata in base alla relazione forza-spostamento AFM.
Ad esempio, nella Figura 6C, la deformazione del nucleo causata dalle microsfere magnetiche (diametro = ~ 7 μm) a "grande forza" è di circa 1,5 μm. Nella Figura 6D, una punta AFM che ha una sonda semisferica da 5 μm è stata utilizzata per indentare la cella sopra il nucleo per ottenere una deformazione nucleare di 1,5 μm. La forza corrispondente registrata da AFM è di 1,4 nN. Quindi, la forza applicata dalle microsfere è stimata in ~ 1,4 nN. Seguendo lo stesso approccio, la forza magnetica a "piccola forza" è calibrata come 0,8 nN e ha causato un'indentazione nucleare di 0,4 μm.
Questo studio ritiene che la forza misurata dall'AFM possa rappresentare la forza applicata alle microsfere sulla base delle seguenti ipotesi: (1) La rigidità del nucleo all'interno di cellule diverse è simile. (2) Le proprietà meccaniche del nucleo non dipendono dai siti nucleari sui quali è stata applicata l'impronta. La forza magnetica viene applicata orizzontalmente sui lati laterali del nucleo, mentre la forza AFM viene applicata verticalmente sui lati apicali del nucleo. La differenza meccanica tra loro è assunta come trascurabile. (3) Negli esperimenti AFM, la sonda applica direttamente la forza attraverso la membrana cellulare e il citoscheletro sul nucleo. Dopo aver interrotto i filamenti di actina, la forza applicata dall'AFM sul nucleo è simile alla forza applicata dalle microsfere sul nucleo, nonostante la membrana si trovi ancora tra la sonda AFM e il nucleo nel primo caso.
La forza magnetica innesca il cambiamento del rapporto YAP N/C
Per dimostrare che la forza magnetica applicata sulle microsfere può deformare il nucleo e indurre la traslocazione YAP, il rapporto YAP N/C delle cellule con internalizzazione delle microsfere è stato quantificato in tre fasi: (1) prima di applicare la forza, (2) dopo aver applicato la forza e (3) dopo aver rilasciato la forza. Alcune celle hanno mostrato un cambiamento della forma nucleare e del rapporto YAP N/C quando la forza è stata applicata o rilasciata (Figura 7A,C). I cambiamenti di intensità in YAP possono essere attribuiti da due possibili meccanismi: (1) le proteine YAP-FP traslocano dal citoplasma nel nucleo dopo l'applicazione forzata. In questo caso, la colorazione nucleare non dovrebbe mostrare cambiamenti di segnale. L'intensità della colorazione nucleare non dovrebbe cambiare molto; (2) Le proteine YAP-FP non traslocano dopo l'applicazione forzata. Le variazioni di intensità YAP osservate sono dovute alla variazione di volume nucleare indotta dalla forza e alla conseguente variazione di concentrazione YAP-FP. In questo caso, l'intensità della colorazione nucleare dovrebbe cambiare in una tendenza simile all'intensità nucleare YAP perché anche la concentrazione del colorante cambia quando il volume del nucleo cambia. Pertanto, è stata misurata la variazione dell'intensità della colorazione nucleare dal canale rosso (eccitazione: 650 nm; emissione: 681 nm). L'intensità cambia in YAP nel canale verde, ma non ci sono cambiamenti di intensità nella colorazione del nucleo nel canale rosso. Pertanto, il primo meccanismo probabilmente esiste (Figura 7B). Collettivamente, i risultati mostrano che la deformazione nucleare indotta dalla forza magnetica innesca la traslocazione YAP.
Successivamente, la variazione netta del rapporto YAP N/C è stata quantificata all'interno di due gruppi di cellule: (1) cellule senza microsfere internalizzate (punti grigi, controllo, n = 9); e (2) cellule selezionate con microsfere internalizzate che mostrano variazioni del rapporto YAP N/C (punti verdi per piccola forza, punti rossi per grande forza, n = 11). A una forza di 0,8 nN, le cellule con microsfere internalizzate mostrano una variazione netta del rapporto N/C YAP = -0,030 ± 0,029, n = 11; le celle di controllo mostrano la variazione netta del rapporto YAP N/C = -0,003 ± 0,012, n = 9. A una forza di 1,4 nN, le cellule con microsfere internalizzate mostrano una variazione netta del rapporto YAP N/C = 0,011 ± 0,040, n = 11; le celle di controllo mostrano una variazione netta del rapporto N/C YAP = 0,005 ± 0,005, n = 9 (Figura 8A). A una forza di 0,8 nN, le cellule con microsfere internalizzate mostrano una variazione assoluta del rapporto netto YAP N/C = 0,057 ± 0,017, n = 11; le celle di controllo mostrano una variazione netta del rapporto YAP N/C = 0,021 ± 0,007, n = 9. La differenza è significativa (valore p = 0,0093, **). A una forza di 1,4 nN, le cellule con microsfere internalizzate mostrano una variazione assoluta del rapporto netto YAP N/C = 0,070 ± 0,020, n = 11; le celle di controllo mostrano la variazione netta del rapporto N/C YAP = 0,010 ± 0,003, n = 9. La differenza è significativa (valore p = 0,0007, ***) (Figura 8B). Insieme, questi risultati confermano che la forza magnetica applicata alle microsfere all'interno del citoplasma può effettivamente indurre la traslocazione YAP e modificare il rapporto YAP N/C.
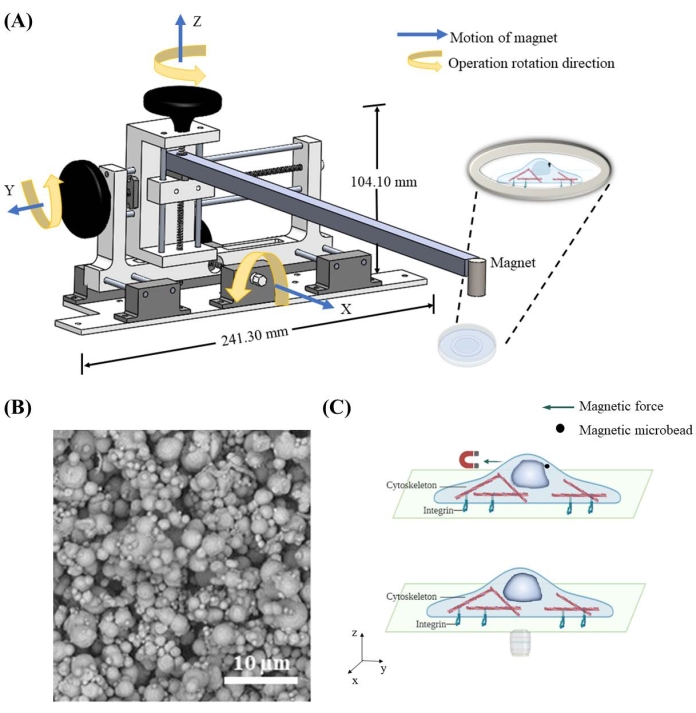
Figura 1: Progettazione del dispositivo magnetico in movimento e applicazione della forza schematica nella cella mediante microsfere magnetiche. (A) Schema tridimensionale del dispositivo implementato per tenere il magnete e spostarlo nelle direzioni x, y e z. Il dispositivo è costituito da una base di 241,3 mm di larghezza e 104,1 mm di altezza, due manopole, una barra e un magnete. Le manopole saranno scanalate nella corretta direzione di rotazione del funzionamento, che fornirà il movimento nella direzione corrispondente. Il magnete verrà abbassato più vicino / sollevato ulteriormente al piatto per applicare forza magnetica con diversa grandezza e direzione su microsfere magnetiche. (B) Esempio di immagine al microscopio elettronico a scansione (SEM) di microsfere di ferro da 7 μm. (C) Le microsfere magnetiche erogate all'interno del citoplasma possono applicare forza agli organelli come il nucleo quando viene applicato un campo magnetico. Fare clic qui per visualizzare una versione ingrandita di questa figura.
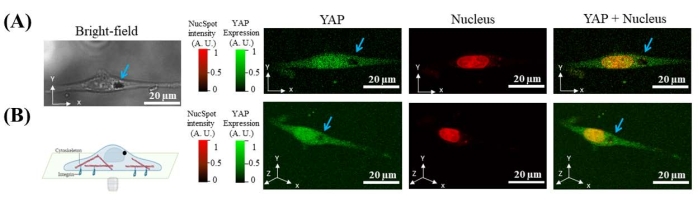
Figura 2: Immagini rappresentative che mostrano la microsfera magnetica (cavità nera puntata da una freccia blu) è internalizzata nella cellula (indicata da YAP) e all'esterno del nucleo. (A) Sezione trasversale X-Y di una cella di YAP (verde), nucleo (rosso) e campo luminoso. (B) Ricostruzione 3D della cella. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 3: Le microsfere internalizzate dalle cellule non influenzano la forma nucleare e il rapporto YAP N/C . (A) Immagini rappresentative in campo chiaro e fluorescenza di cellule senza microsfere, microsfere singole e internalizzazione multi-microsfere. Le frecce blu indicano la posizione delle microsfere all'interno del citoplasma. (B) A 7 ore (n = 13), 12 h (n = 62) e 24 ore (n = 40) di co-coltura, la percentuale delle cellule che non mostra microsfere, microsfere singole e internalizzazione multi-sfere. (C) La circolarità nucleare non mostra differenze significative tra le cellule di controllo e le cellule con internalizzazione delle microsfere. Controllo #1 (senza co-coltura di microsfere): circolarità = 0,806 ± 0,037, n = 20; Controllo #2 (con co-coltura di microsfere, senza internalizzazione di microsfere): circolarità = 0,806 ± 0,035, n = 22; Internalizzazione di microsfere singole: circolarità = 0,793 ± 0,048, n = 15; Internalizzazione multi-microsfere: circolarità = 0,780 ± 0,061, n = 7. (D) Il rapporto YAP N/C non mostra differenze significative (valore p = 0,667) tra cellule di controllo (con co-coltura di microsfere, senza internalizzazione di microsfere, rapporto YAP N/C = 1,155 ± 0,074, n = 35) e cellule con internalizzazione di microsfere (rapporto YAP N/C = 1,140 ± 0,078, n = 36). Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 4: Applicazione diretta della forza sul nucleo con e senza filamenti di actina. (A) Le celle mostrano filamenti di actina (giallo). (A1) Immagine del nucleo quando non viene applicata alcuna forza. (A2) Immagine del nucleo dopo l'applicazione della forza. (A3) L'immagine sovrapposta del confine nucleare prima e dopo l'applicazione della forza mostra l'indentazione nucleare. (B) Le cellule mostrano filamenti di actina interrotti (giallo) dopo il trattamento con Cyto D (2,5 μM, 1 ora). (B1) Immagine del nucleo quando non viene applicata alcuna forza. (B2) Immagine del nucleo dopo l'applicazione della forza. (B3) L'immagine sovrapposta del confine nucleare prima e dopo l'applicazione della forza mostra l'indentazione nucleare con il citoscheletro di actina interrotto. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 5: Controllo spaziale e temporale della microsfera magnetica intracellulare . (A) Una coppia di magneti controlla spazialmente la microsfera magnetica. (A1) Immagine in campo chiaro del confine della cella (linea verde), del confine nucleare (linea rossa) e della microsfera magnetica (linea gialla) in posizione 1. (A2) La microsfere magnetiche rientra nel nucleo in posizione 1. (A3) Il microsfer magnetico viene spostato in posizione 2 (linea gialla). La posizione 1 è mostrata come riferimento (linea tratteggiata gialla). (A4) La microsfera magnetica rientra nel nucleo in posizione 2. (B) Una coppia di magneti controlla temporalmente la microsfera magnetica. (B1) Immagine in campo luminoso di una cellula senza forza applicata al punto temporale I. (B2) La microsfera magnetica applica una forza sul nucleo nel punto temporale II. (B3) La microsfera magnetica rilascia la forza dal nucleo nel punto temporale III. (B4) La microsfere magnetica applica una forza maggiore sul nucleo nel punto temporale IV. Fare clic qui per visualizzare una versione ingrandita di questa figura.
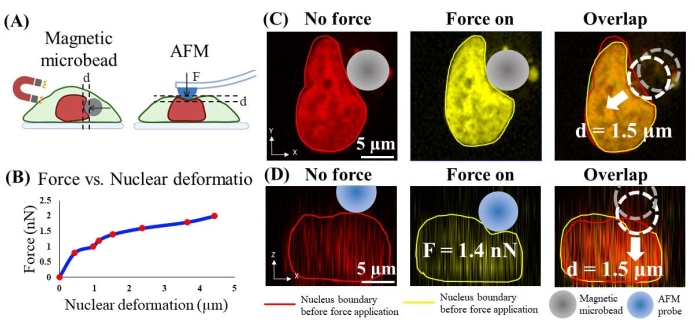
Figura 6. Calibrazione della forza applicata al microbead sul nucleo mediante indentazione AFM. (A) Illustrazione schematica del processo di taratura. La microsfere magnetica applica la compressione orizzontale sul nucleo (a sinistra) e la sonda AFM rientra verticalmente sul nucleo. (B) Forza di indentazione AFM vs. deformazione nucleare. (C) Immagine rappresentativa della deformazione del nucleo (1,5 μm) prima e dopo l'applicazione forzata mediante microsfere magnetiche. (D) Immagine rappresentativa di una deformazione del nucleo simile (1,5 μm) prima e dopo l'indentazione AFM con forza 1,4 nN. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 7: Dati rappresentativi che mostrano che la variazione del rapporto YAP N/C è indotta dall'applicazione e dal rilascio della forza magnetica . (A) Sezione trasversale X-Y dell'immagine fluorescente YAP (verde) e del nucleo (rosso) della cella senza forza, forza accesa e forza spenta. Nella condizione di forzatura, l'intensità citoplasmatica di YAP diminuisce nella posizione indicata da una freccia gialla mentre l'intensità YAP nucleare aumenta. Aumenta il rapporto N/C YAP. (B) Il rapporto YAP N/C aumenta quando la forza si accende (da 1,0791 a 1,2327) e diminuisce quando si spegne la forza (da 1,2327 a 1,1548). L'intensità della colorazione nucleare normalizzata mostra lievi cambiamenti con l'applicazione della forza (1,00117) e il rilascio (0,95578). (C) Sezione trasversale X-Z dell'immagine YAP (verde) e del nucleo (rosso) della cella senza forza, forza accesa e forza disattivata. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 8: Variazione del rapporto YAP N/C indotta dall'applicazione della forza magnetica. (A) A una forza di 0,8 nN, le cellule con microsfere internalizzate mostrano una variazione netta del rapporto N/C YAP = -0,030 ± 0,029, n = 11; le celle di controllo mostrano la variazione netta del rapporto YAP N/C = -0,003 ± 0,012, n = 9. A una forza di 1,4 nN, le cellule con microsfere internalizzate mostrano una variazione netta del rapporto YAP N/C = 0,011 ± 0,040, n = 11; le celle di controllo mostrano una variazione netta del rapporto N/C YAP = 0,005 ± 0,005, n = 9. (B) A una forza di 0,8 nN, le cellule con microsfere internalizzate mostrano una variazione assoluta del rapporto netto YAP N/C = 0,057 ± 0,017, n = 11; le celle di controllo mostrano una variazione netta del rapporto YAP N/C = 0,021 ± 0,007, n = 9. La differenza è significativa (valore p = 0,0093, **). A una forza di 1,4 nN, le cellule con microsfere internalizzate mostrano una variazione assoluta del rapporto netto YAP N/C = 0,070 ± 0,020, n = 11; le celle di controllo mostrano la variazione netta del rapporto N/C YAP = 0,010 ± 0,003, n = 9. La differenza è significativa (valore p = 0,0007, ***) Fare clic qui per visualizzare una versione ingrandita di questa figura.
Figura supplementare 1: Forma nucleare e intensità della colorazione nucleare. (A) Senza trattamento Cyto D, (B) Con trattamento Cyto D e (C) Dead cell. Clicca qui per scaricare questo file.
Video supplementare 1: un video in campo chiaro che mostra il processo di applicazione della forza. Clicca qui per scaricare questo video.
Discussione
L'internalizzazione delle microsfere magnetiche (sezione 2.2) è fondamentale perché le microsfere extracellulari non possono applicare forza direttamente al nucleo. L'applicazione della forza e l'imaging (sezione 5.3) sono passaggi critici in questo esperimento e la forza necessaria per deformare il nucleo e indurre conseguenze biologiche significative potrebbe dipendere dal campione. La grandezza della forza in questo esperimento (0,8 nN e 1,4 nN) può essere ulteriormente aumentata per innescare il rilevamento meccano-meccano nucleare in cellule meno sensibili.
Per applicare la forza magnetica in modo quantitativo con un elevato rendimento, l'internalizzazione di una singola microsfere è un approccio ideale. In questo studio, la percentuale di cellule con internalizzazione a microsfere singole era simile a 12 ore (26%) e 24 ore (28%), mentre le cellule senza internalizzazione di microsfere erano più alte a 12 ore (53%) rispetto a quella a 24 ore (20%) (Figura 3B). Si ritiene che 12 ore sia il momento ottimale per l'esperimento di applicazione della forza perché possono essere incluse più microsfere singole e le cellule possono essere controllate. Per diverse linee cellulari e dimensioni delle microsfere, il tempo di cocoltura e la concentrazione di microsfere devono essere testati per determinare le condizioni ottimali corrispondenti.
Negli esperimenti, le microsfere non sono state rivestite per legarsi specificamente al nucleo. Pertanto, la forza trasmessa direttamente dalle microsfere al nucleo è probabilmente solo compressiva. I risultati mostrano che il rapporto YAP N/C aumenta e diminuisce la popolazione cellulare (Figura 8A). Una possibile ragione è che la forza magnetica applicata attraverso le microsfere può causare cambiamenti di tensione positivi o negativi all'interno del citoscheletro e regolare l'aumento o la diminuzione del rapporto YAP N/C, rispettivamente28. Ricerche precedenti mostrano che la forza di compressione sul nucleo induce un aumento del rapporto YAP N/C28. In esperimenti futuri, al fine di studiare il rilevamento diretto della forza del nucleo, il citoscheletro può essere interrotto per eliminare la trasmissione della forza dal citoscheletro nel nucleo.
Ci sono due potenziali svantaggi nei metodi attuali. In primo luogo, in questi esperimenti, il motore 3D (Figura 1A) è stato utilizzato per regolare il movimento delle perline, che viene monitorato dall'imaging confocale in tempo reale e mira ad applicare una forza di compressione sul nucleo. Tuttavia, a causa della natura scivolosa della membrana nucleare e dell'ambiente complesso nel citoplasma, la direzione della forza applicata alle perline potrebbe non essere puramente compressiva (cioè non assolutamente perpendicolare alla superficie della membrana nucleare). Questa imperfezione può causare l'applicazione di una forza di taglio alla membrana nucleare. In secondo luogo, le attuali microsfere utilizzate in questo studio non sono coniugate con l'anticorpo per legarsi al nucleo, perché la mobilità spaziale delle perle è fondamentale nell'attuale esperimento per dimostrare il vantaggio dell'attuatore magnetico senza contatto. Quindi, il metodo attuale non può applicare tensione alla membrana nucleare.
In futuro, (1) le perle con anticorpo anti-nesprin-1 saranno coniugate per legarsi specificamente con il nucleo. Questo può garantire la trasmissione diretta e specifica della forza tra le microsfere e le proteine bersaglio. (2) La direzione della forza sarà calibrata manipolando la singola microsfera magnetica in idrogel morbido incorporato con sfere fluorescenti. Lo spostamento 3D delle sfere fluorescenti può essere utilizzato per calcolare il campo di deformazione dell'idrogel e determinare la direzione della forza in funzione del campo magnetico applicato. Dopo che la microsfere è stata legata chimicamente con il nucleo, l'applicazione di una forza con una direzione nota determinerà il tipo di forza (tensione, compressione o taglio). (3) L'imaging 3D della colorazione nucleare sarà utilizzato per costruire un modello FEM di simulazione 3D del nucleo. La direzione della forza può essere verificata confrontando la deformazione nucleare prima e dopo l'applicazione della forza magnetica.
La tecnica unica sviluppata in questo studio offre diversi potenziali vantaggi: (1) Rispetto all'indentazione verticale mediante sonde AFM, le microsfere magnetiche possono applicare forza in qualsiasi direzione. Le cellule coltivate su superfici di substrato 2D possono avere una distribuzione e un orientamento proteico eterogenei sulle loro superfici verticali e orizzontali della membrana plasmatica e dell'involucro nucleare. L'applicazione della forza orizzontalmente può indurre risposte meccano-sensibili precedentemente non osservate. (2) Una volta che le microsfere sono funzionalmente rivestite per legarsi ai nuclei, entrambe le forze di spinta e trazione possono essere applicate direttamente sul nucleo per studiare ulteriormente il meccano-rilevamento nucleare differenziale a causa delle distinte direzioni di forza. (3) Controllando il legame specifico delle microsfere a determinate proteine dell'involucro nucleare, è possibile chiarire i meccanismi precedentemente poco studiati del rilevamento della forza nucleare. Prove emergenti mostrano che il nucleo è probabilmente un meccano-sensore36, e il meccano-rilevamento nucleare è il regolatore più diretto della traslocazione YAP28. Il meccanismo di traslocazione YAP regolata nucleare viene attivamente studiato e vengono proposti diversi candidati di meccano-sensore o parametri nel nucleo, tra cui la dimensione dei pori nucleari28, la forma nucleare 25,61, il complesso LINC e la tensione dell'involucro nucleare20. La manipolazione delle microsfere magnetiche apre la possibilità di un'esplorazione dettagliata di tali meccanismi mediante l'applicazione diretta della forza sul complesso LINC e le regolazioni controllate della tensione e della forma dell'involucro nucleare. (4) Oltre ad applicare forze sul nucleo, le microsfere sono anche adatte per essere ingegnerizzate per legarsi al lato interno della membrana plasmatica per rivelare come i domini intracellulari delle proteine di membrana e il loro complesso rispondono ai segnali biofisici.
In sintesi, questo articolo ha dimostrato un metodo che (1) fornisce microsfere di ferro di dimensioni micro nel citoplasma senza influenzare la morfologia nucleare e le funzioni proteiche, (2) applica forza sul nucleo mediante microsfere magnetiche e (3) esegue l'imaging di cellule vive a fluorescenza confocale durante l'applicazione della forza. Questi strumenti non invasivi aprono la possibilità per la manipolazione epigenetica diretta degli organelli in singole cellule, l'interrogazione basata sull'imaging a super-risoluzione della meccanotrasduzione del nucleo e l'esplorazione dettagliata dell'organizzazione cromosomica 3D regolata dalla forza (in combinazione con Hi-C: acquisizione di conferma cromosomica ad alta risoluzione) e la riprogrammazione nei contesti della fisiologia cellulare e della patobiologia.
Divulgazioni
Non ci sono conflitti di interesse da dichiarare.
Riconoscimenti
Questo progetto è finanziato da UF Gatorade Award Start-up Package (X. T.), UFHCC Pilot Award (X. T. e Dr. Dietmar Siemann), UF Opportunity Seed Fund (X. T.) e UFHCC University Scholars Program (H. Y. Wang). Apprezziamo sinceramente le discussioni intellettuali e il supporto tecnico del Dr. Jonathan Licht (UFHCC), Dr. Rolf Renne (UFHCC), Dr. Christopher Vulpe (UFHCC), Dr. Blanka Sharma (BME), Dr. Mark Sheplak (MAE & ECE), Dr. Daniel Ferris (BME), Dr. Malisa Sarntinoranont (MAE), Dr. Ashok Kumar (MAE), Dr. Benjamin Keselowsky (BME), Dr. Brent Gila (RSC), Dr. Philip Feng (ECE), Dr. Gregory A. Hudalla (BME), Dr. Steven Ghivizzani (OSSM), Dr. Yenisel Cruz-Almeida (CDBS), Dr. Roger Fillingim (CD-BS), Dr. Robert Caudle (OMS), Dr. John Neubert (DN-OR), Dr. Justin Hiliard (Neurochirurgia), Dr. Tian He (Harvard University), Dr. Youhua Tan (Hong Kong Polytechnic University), Dr. Jessie L-S Au (Institute of Quantitative Systems Pharmacology), Dr. David Hahn (University of Arizona), e il team di supporto di Nikon (Drs. Jose Serrano-Velez, Larry Kordon e Jon Ekman). Siamo profondamente grati per l'efficace supporto di tutti i membri dei laboratori di ricerca di Tang, Yamaguchi, Sharma, Au, Siemann e Guan e di tutti i membri del personale del Dipartimento UF MAE.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.05 % Trypsin | Corning | 25-051-CI | |
| 25 cm2 flask | Corning | 156340 | |
| 7-µm mean diameter carbonyl iron microbeads | N/A | N/A | |
| A1R confocal system | Nikon | ||
| Carbonyl Iron Powder CM | BASF | 30042253 | Magnetic microbead |
| Culture medium (RPMI-1640) | Gibco | 11875093 | |
| Desktop Computer | Dell | with Windows 10 operating system | |
| Environmental chamber TIZB | Tokai Hit | TIZB | |
| Fetal bovine serum (FBS) | Gibco | 26140 | |
| Fiji ImageJ | National Institutes of Health and the Laboratory for Optical and Computational Instrumentation | ||
| Glass-bottom petri dish | MatTek | P35G-1.5-14-C | |
| Magnet | K&J Magnetics, Inc. | D99-N52 | |
| Monochrome Camera | FLIR | BFS-U3-70S7M-C | |
| NIS-Elements software platform | Nikon | software platform | |
| Nucleus mask ImageJ macro | https://github.com/KOLIUG/Nuclear mask | ||
| NucSpot Live 650 | Biotium | #40082 | Nuclear stain |
| Penicillin-streptomycin | Gibco | 15140122 | |
| Phosphate buffered saline (PBS) | Gibco | 10010023 | |
| Ti2-E inverted microscope | Nikon | ||
| XYZ mover (CAD files) | https://github.com/KOLIUG/XYZ-mover |
Riferimenti
- Discher, D. E., Janmey, P., Wang, Y. Tissue cells feel and respond to the stiffness of their substrate. Science. 310 (5751), 1139-1143 (2005).
- Janmey, P. A., Fletcher, D. A., Reinhart-King, C. A. Stiffness sensing by cells. Physiological Reviews. 100 (2), 695-724 (2020).
- Bajaj, P., Tang, X., Saif, T. A., Bashir, R. Stiffness of the substrate influences the phenotype of embryonic chicken cardiac myocytes. Journal of Biomedical Materials Research Part A. 95 (4), 1261-1269 (2020).
- Tang, X., et al. Mechanical force affects expression of an in vitro metastasis-like phenotype in HCT-8 cells. Biophysical Journal. 99 (8), 2460-2469 (2010).
- Hofmann, M., et al. Lowering of tumor interstitial fluid pressure reduces tumor cell proliferation in a xenograft tumor model. Neoplasia. 8 (2), 89-95 (2006).
- Yankaskas, C. L., et al. The fluid shear stress sensor TRPM7 regulates tumor cell intravasation. Science Advances. 7 (28), (2021).
- Kim, E., et al. A biosynthetic hybrid spidroin-amyloid-mussel foot protein for underwater adhesion on diverse surfaces. ACS Applied Materials and Interfaces. 13 (41), 48457-48468 (2021).
- Tajik, A., et al. Transcription upregulation via force-induced direct stretching of chromatin. Nature Materials. 15 (12), 1287-1296 (2016).
- Lee, J., Abdeen, A. A., Tang, X., Saif, T. A., Kilian, K. A. Matrix directed adipogenesis and neurogenesis of mesenchymal stem cells derived from adipose tissue and bone marrow. Acta Biomaterialia. 42, 46-55 (2016).
- Lee, J., Abdeen, A. A., Tang, X., Saif, T. A., Kilian, K. A. Geometric guidance of integrin mediated traction stress during stem cell differentiation. Biomaterials. 69, 174-183 (2015).
- Ren, B., et al. Study of sacrificial ink-assisted embedded printing for 3D perfusable channel creation for biomedical applications. Applied Physics Reviews. 9 (1), 011408(2022).
- Coyle, S., et al. Cell alignment modulated by surface nano-topography-Roles of cell-matrix and cell-cell interactions. Acta Biomaterialia. 142, 149-159 (2022).
- Sawada, Y., et al. Force sensing by mechanical extension of the Src family kinase substrate p130Cas. Cell. 127 (5), 1015-1026 (2006).
- Aragona, M., et al. A mechanical checkpoint controls multicellular growth through YAP/TAZ regulation by actin-processing factors. Cell. 154 (5), 1047-1059 (2013).
- Tang, X., et al. Specific and non-specific adhesion in cancer cells with various metastatic potentials. Mechanobiology of Cell-Cell and Cell-Matrix Interactions. , Springer. Boston, MA. 105-122 (2011).
- Tang, X., Saif, T. A. Adhesivity of colon cancer cells during in vitro metastasis. International Journal of Applied Mechanics. 5 (03), 1350025(2013).
- Chaudhuri, O., et al. Effects of extracellular matrix viscoelasticity on cellular behaviour. Nature. 584 (7822), 535-546 (2020).
- Ohashi, K., Fujiwara, S., Mizuno, K. Roles of the cytoskeleton, cell adhesion and rho signalling in mechanosensing and mechanotransduction. The Journal of Biochemistry. 161 (3), 245-254 (2017).
- Hamill, O. P., Martinac, B. Molecular basis of mechanotransduction in living cells. Physiological Reviews. 81 (2), 685-740 (2001).
- Liang, C., et al. Towards an integrative understanding of cancer mechanobiology: Calcium, YAP, and microRNA under biophysical Forces. Soft Matter. 18, 1112-1148 (2022).
- Tan, Y., et al. Matrix softness regulates plasticity of tumour-repopulating cells via H3K9 demethylation and Sox2 expression. Nature Communications. 5 (1), 1-12 (2014).
- Poh, Y., et al. Dynamic force-induced direct dissociation of protein complexes in a nuclear body in living cells. Nature Communications. 3 (1), 1-10 (2012).
- Tang, X., et al. A mechanically-induced colon cancer cell population shows increased metastatic potential. Molecular Cancer. 13 (1), 1-15 (2014).
- Wu, J., et al. Effects of dynein on microtubule mechanics and centrosome positioning. Molecular Biology of the Cell. 22 (24), 4834-4841 (2011).
- Tang, X., Ali, M. Y., Saif, M. T. A novel technique for micro-patterning proteins and cells on polyacrylamide gels. Soft Matter. 8 (27), 7197-7206 (2011).
- Tang, X., Bajaj, P., Bashir, R., Saif, T. A. How far cardiac cells can see each other mechanically. Soft Matter. 7 (13), 6151-6158 (2011).
- Tang, X., et al. Mechanical force affects expression of an in vitro metastasis-like phenotype in HCT-8 cells. Biophysical Journal. 99 (8), 2460-2469 (2010).
- Elosegui-Artola, A., et al. Force triggers YAP nuclear entry by regulating transport across nuclear pores. Cell. 171 (6), 1397-1410 (2017).
- Gudipaty, S. A., et al. Mechanical stretch triggers rapid epithelial cell division through Piezo1. Nature. 543 (7643), 118-121 (2017).
- Tang, X., et al. Attenuation of cell mechanosensitivity in colon cancer cells during in vitro metastasis. PLoS One. 7 (11), 50443(2012).
- Cha, C., et al. Top-down synthesis of versatile polyaspartamide linkers for single-step protein conjugation to materials. Bioconjugate Chemistry. 22 (12), 2377-2382 (2012).
- Chen, X., et al. Glycosaminoglycans modulate long-range mechanical communication between cells in collagen networks. Proceedings of the National Academy of Sciences of the United States of America. 119 (15), (2022).
- Boyle, J. J., Pless, R. B., Thomopoulos, S., Genin, G. M. Direct estimation of surface strain fields from a stereo vision system. Journal of Biomechanical Engineering. 142 (7), 074503(2020).
- Kim, S., Uroz, M., Bays, J. L., Chen, C. S. Harnessing mechanobiology for tissue engineering. Developmental Cell. 56 (2), 180-191 (2021).
- Driscoll, T. P., et al. Cytoskeletal to nuclear strain transfer regulates YAP signaling in mesenchymal stem cells. Biophysical Journal. 108 (12), 2783-2793 (2015).
- Guilluy, C., et al. Isolated nuclei adapt to force and reveal a mechanotransduction pathway in the nucleus. Nature Cell Biology. 16 (4), 376-381 (2014).
- Vashisth, M. Scaling concepts in 'omics: Nuclear lamin-B scales with tumor growth and often predicts poor prognosis, unlike fibrosis. Proceedings of the National Academy of Sciences of the United States of America. 118 (48), (2021).
- Roberts, A. B., et al. Tumor cell nuclei soften during transendothelial migration. Journal of Biomechanics. 121, 110400(2021).
- Denais, C. M., et al. Nuclear envelope rupture and repair during cancer cell migration. Science. 352 (6283), 353-358 (2016).
- Raab, M., et al. ESCRT III repairs nuclear envelope ruptures during cell migration to limit DNA damage and cell death. Science. 352 (6283), 359-362 (2016).
- Lammerding, J., et al. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. The Journal of Clinical Investigation. 113 (3), 370-378 (2004).
- Shelby, J., Patrick, J., Edgar, S., Chiu, D. T. Monitoring cell survival after extraction of a single subcellular organelle using optical trapping and pulsed-nitrogen laser ablation. Photochemistry and Photobiology. 81 (4), 994-1001 (2005).
- Caspi, A., Granek, R., Elbaum, M. Diffusion and directed motion in cellular transport. Physical Review E. 66 (1), 011916(2002).
- Svoboda, K., Block, S. M. Biological applications of optical forces. Annual Review of Biophysics and Biomolecular Structure. 23 (1), 247-285 (1994).
- Rohrbach, A. Stiffness of optical traps: quantitative agreement between experiment and electromagnetic theory. Physical Review Letters. 95 (16), 168102(2005).
- Neuman, K. C., et al. Characterization of photodamage to Escherichia coli in optical traps. Biophysical Journal. 77 (5), 2856-2863 (1999).
- Kanger, J. S., Subramaniam, V., Driel, R. V. Intracellular manipulation of chromatin using magnetic microbeads. Chromosome Research. 16 (3), 511-522 (2008).
- Bausch, A. R., et al. Local measurements of viscoelastic parameters of adherent cell surfaces by magnetic microbead microrheometry. Biophysical Journal. 75 (4), 2038-2049 (1998).
- Fisher, J. K., et al. Three-dimensional force microscope: a nanometric optical tracking and magnetic manipulation system for the biomedical sciences. Review of Scientific Instruments. 76 (5), 053711(2005).
- Berret, J. -F. Local viscoelasticity of living cells measured by rotational magnetic spectroscopy. Nature Communications. 7, 10134(2016).
- Hu, B., Dobson, J., El Haj, A. J. Control of smooth muscle α-actin (SMA) up-regulation in HBMSCs using remote magnetic microbead mechano-activation. Nanomedicine: Nanotechnology, Biology and Medicine. 10 (1), 45-55 (2014).
- Kamiyama, D., et al. Versatile protein tagging in cells with split fluorescent protein. Nature Communications. 7, 11046(2016).
- Feng, S., et al. Improved split fluorescent proteins for endogenous protein labeling. Nature Communications. 8, 370(2017).
- Leonetti, M. D., Sekine, S., Kamiyama, D., Weissman, J. S., Huang, B. A scalable strategy for high-throughput GFP tagging of endogenous human proteins. Proceedings of the National Academy of Sciences of the United States of America. 113 (25), 3501-3508 (2016).
- Tulpule, A., et al. Kinase-mediated RAS signaling via membraneless cytoplasmic protein granules. Cell. 184 (10), 2649-2664 (2021).
- Ansari, A. M., et al. Cellular GFP toxicity and immunogenicity: potential confounders in in vivo cell tracking experiments. Stem Cell Reviews and Reports. 12 (5), 553-559 (2016).
- Gibson, T. J., Seiler, M., Veitia, R. A. The transience of transient overexpression. Nature Methods. 10 (8), 715-721 (2013).
- Ratz, M., et al. CRISPR/Cas9-mediated endogenous protein tagging for RESOLFT super-resolution microscopy of living human cells. Scientific Reports. 5, 9592(2015).
- Suzuki, H., Ho, C., Kasagi, N. A chaotic mixer for magnetic microbead-based micro cell sorter. Journal of Microelectromechanical Systems. 13 (5), 779-790 (2004).
- Luo, Q., et al. All-optical mechanobiology interrogation of yes-associated protein in human cancer and normal cells using a multi-functional system. Journal of Visualized Experiments. (178), e62934(2021).
- Koushki, N., et al. Lamin A redistribution mediated by nuclear deformation determines dynamic localization of YAP. BioRxiv. , (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon