Method Article
Combinaison d’un actionneur de force magnétique 3D et d’une imagerie par fluorescence multifonctionnelle pour étudier la mécanobiologie du noyau
Dans cet article
Résumé
Cette étude présente un nouveau protocole pour appliquer directement une force mécanique sur le noyau cellulaire par le biais de microbilles magnétiques livrées dans le cytoplasme et pour effectuer simultanément l’imagerie fluorescente de cellules vivantes.
Résumé
Une question fondamentale en mécanobiologie est de savoir comment les cellules vivantes perçoivent les stimuli mécaniques extracellulaires dans le contexte de la physiologie et de la pathologie cellulaires. On pense que la mécano-sensation cellulaire des stimuli mécaniques extracellulaires se fait à travers les récepteurs membranaires, le complexe protéique associé et le cytosquelette. Les progrès récents de la mécanobiologie démontrent que le noyau cellulaire du cytoplasme lui-même peut détecter indépendamment simultanément les stimuli mécaniques. Cependant, une compréhension mécaniste de la façon dont le noyau cellulaire détecte, transduit et répond aux stimuli mécaniques fait défaut, principalement en raison des défis techniques liés à l’accès et à la quantification de la mécanique du noyau par des outils conventionnels. Cet article décrit la conception, la fabrication et la mise en œuvre d’un nouvel actionneur de force magnétique qui applique des stimuli mécaniques 3D précis et non invasifs pour déformer directement le noyau cellulaire. En utilisant des cellules modifiées par CRISPR/Cas9, cette étude démontre que cet outil, combiné à l’imagerie confocale fluorescente à haute résolution, permet la révélation de la dynamique en temps réel d’une protéine associée oui (YAP) mécano-sensible dans des cellules individuelles en fonction de la déformation du noyau. Cette méthode simple a le potentiel de combler le fossé technologique actuel dans la communauté de la mécanobiologie et de fournir des réponses au manque de connaissances qui existe dans la relation entre la mécanotransduction du noyau et la fonction cellulaire.
Introduction
Cette étude vise à développer et à appliquer une nouvelle technique pour élucider la mécanobiologie du noyau en combinant les actionneurs magnétiques qui appliquent une force mécanique directement sur le noyau cellulaire et la microscopie confocale à fluorescence qui imagera simultanément les changements subcellulaires structurels et fonctionnels. Les cellules détectent les signaux biophysiques extracellulaires, y compris la rigidité tissulaire 1,2,3,4, la pression du fluide interstitiel et la contrainte de cisaillement 5,6,7, la topologie/géométrie de surface 8,9,10,11,12 et la contrainte de tension/compression13,14, 15,16. Les signaux biophysiques sont convertis en signaux biochimiques et déclenchent des changements potentiels en aval de l’expression génique et des comportements cellulaires - un processus connu sous le nom de mécanotransduction 17,18,19,20,21,22,23,24,25,26,27 . Pour étudier les processus de mécanotransduction, une myriade de techniques ont été développées pour appliquer une force mécanique sur les cellules, telles que la microscopie à force atomique28, le dispositif d’étirement cellulaire29, le capteur de force bio-MEMS (systèmes micro-électromécaniques) 15,30,31, la rhéologie de cisaillement 32 et le système de vision stéréoscopique 33 . Une revue récente résume les approches pour appliquer des signaux mécaniques extracellulaires et interférer avec la mécanodétection34. À ce jour, la plupart de ces méthodes appliquent une force sur la membrane plasmique cellulaire, et les cellules reçoivent directement ces signaux biophysiques extracellulaires via des récepteurs membranaires tels que l’intégrine, la cadhérine, les canaux ioniques et les récepteurs couplés aux protéines G. Par la suite, ils transmettent le signal au cytosquelette intracellulaire et au noyau. Par exemple, en utilisant la translocation de protéines associées à l’oui (YAP) comme indicateur de mécano-détection, il est démontré que les cellules détectent les signaux mécaniques de rigidité du substrat et de tension extracellulaire de la membrane cellulaire et les transmettent à travers le cytosquelette dans le noyau pour induire la translocation du cytoplasme au noyauYAP 28,35.
Des preuves récentes suggèrent que le noyau cellulaire lui-même est un mécano-capteur indépendant 8,36,37. Ceci est prouvé par des expériences effectuées sur le noyau isolé prélevé sur des cellules, où il a été révélé que les noyaux modifient adaptativement leur rigidité en réponse à la force mécanique directement appliquée sur eux36. Au cours de nombreuses conditions physiologiques, les noyaux des cellules tumorales et saines détectent les signaux biophysiques extracellulaires et modifient leurs propriétés mécaniques et leurs assemblages38,39,40. Par exemple, lors de l’extravasation, la rigidité nucléaire des cellules tumorales diminue et maintient la douceur pendant plus de 24 h38. Au cours de la migration à travers l’espace interstitiel confiné, les noyaux des cellules tumorales perdent fréquemment et retrouvent leur intégrité structurelle39. Cependant, la façon dont le noyau détecte le signal biophysique est inconnue, bien que plusieurs protéines d’enveloppe nucléaire et familles de protéines se soient révélées impliquées, telles que Lamin A / C et linker of nucleoskeleton and cytoskeleton complex (LINC)38,41. Par conséquent, de nouvelles méthodes non invasives capables d’appliquer directement une force au noyau découpleront l’effet de la transmission de la force de la membrane cellule-plasma et du cytosquelette, et aideront à élucider les mécanismes moléculaires auparavant inaccessibles de la mécano-détection nucléaire.
Les recherches utilisant des pincettes optiques pour manipuler les organites42 et les microbilles injectées dans les cellules43 ont montré la capacité technologique d’appliquer directement une force sur le noyau. Cependant, la technique de la pince optique présente plusieurs limites : (1) les pinces optiques à faible débit ne manipulent souvent qu’une seule cellule ou microbille à la fois; et (2) les photodommages potentiels et la déformation des artefacts de température du nucléaire nécessitent des dizaines de pN36, et la puissance laser nécessaire correspondante est d’environ 10 mW par pN44,45. Une telle intensité laser est suffisante pour déclencher des photodommages dans les cellules et perturber les fonctions cellulaires au cours de l’expérience46.
La force magnétique appliquée à travers les microbilles dans les cellules vivantes montre le potentiel d’appliquer directement une force sur le noyau et surmonte les limites des pincettes optiques. Une fois que les microbilles sont livrées dans le cytoplasme, un champ magnétique peut exercer une force magnétique sur plusieurs microbilles simultanément à haut débit. Le champ magnétique n’influence pas les fonctions cellulaires47, mais génère une force de pN à nN, ce qui est suffisant pour induire une déformation nucléaire 36,48,49. À ce jour, la manipulation de microbilles magnétiques a été appliquée sur la membrane plasmique cellulaire48, à l’intérieur du cytoplasme50, sur la F-actine51, à l’intérieur du noyau47 et sur le noyauisolé 36. Cependant, la manipulation magnétique des microbilles n’a jamais été utilisée pour appliquer une force mécanique directe sur l’enveloppe nucléaire afin d’étudier la mécanotransduction dans le noyau.
Dans cet article, une technique simple est développée pour délivrer de manière non invasive des microbilles magnétiques dans le cytoplasme et utiliser ces microbilles pour appliquer une force mécanique sur le noyau (Figure 1). Ici, des lignées cellulaires B2B humaines normales conçues par CRISPR / Cas9 qui expriment de manière endogène mNeonGreen21-10/11-marqué YAP sont utilisées pour valider la méthode. YAP est une protéine mécano-sensible, et la translocation de YAP est régulée par le mécano-détection nucléaire 14,28. L’approche knock-in régulée par CRISPR/Cas9 a été choisie pour marquer le YAP endogène avec une protéine fluorescente (FP) mNeonGreen21-10/11. Bien que l’édition CRISPR soit connue pour avoir une efficacité incomplète et un effet hors cible, les protocoles des publications précédentes ont intégré le tri par fluorescence pour sélectionner l’insertion correcte d’un cadre de lecture ouvert52,53,54. Avec cette couche supplémentaire de sélection, aucun événement de marquage hors cible n’a été observé dans 20+ lignées cellulaires précédemment générées52,53,54,55. Il s’agit d’une construction protéique fluorescente divisée, mais en principe, n’importe quelle étiquette fluorescente exprimable pourrait être utilisable. Cette approche de marquage est supérieure aux méthodes de transgène ou d’anticorps. Premièrement, contrairement à l’expression transgénique, la protéine marquée maintient le dosage du gène en une seule copie et s’exprime dans le contexte physiologique du réseau de régulation des gènes natifs, limitant ainsi les écarts dans la concentration, la localisation et l’interaction des protéines. La méthode de marquage utilisée dans cette étude permet d’atteindre un débit et une efficacité supérieurs d’un ordre de grandeur à ceux du marquage FP complet. Il évite également les défis associés à l’immunofluorescence en raison des artefacts de fixation et de la disponibilité limitée d’anticorps de haute qualité et de haute spécificité. Deuxièmement, l’approche utilisée dans cet article perturbe le moins possible la physiologie cellulaire et permet la révélation en temps réel de tous les YAP endogènes de manière authentique. En revanche, d’autres méthodes transgéniques courantes conduisent souvent à une surexpression de YAP. La distribution artificielle qui en résulte peut potentiellement provoquer une cytotoxicité et affecter la mécano-détection des cellules56,57,58.
Cette étude présente un protocole permettant d’appliquer directement une force sur le noyau par le biais de microbilles magnétiques introduites dans le cytoplasme et de réaliser simultanément une imagerie fluorescente de cellules vivantes. En résumé, les protocoles présentés ici démontrent comment (1) délivrer des microbilles magnétiques dans la cellule à l’extérieur du noyau, (2) manipuler les microbilles pour appliquer une force magnétique sur le noyau, (3) effectuer une imagerie confocale fluorescente des cellules pendant la manipulation et (4) analyser quantitativement le rapport nucléaire / cytoplasme YAP (N / C) tout au long du processus d’application de la force. Les résultats suggèrent que (1) par endocytose, les microbilles magnétiques peuvent être livrées de manière non invasive dans le cytoplasme des cellules B2B en 7 heures (Figure 2 et Figure 3); et (2) la force magnétique quantifiée directement appliquée sur le noyau (Figure 4, Figure 5 et Figure 6) seule peut déclencher divers changements du rapport YAP N/C dans les cellules B2B modifiées par CRISPR/Cas9 (Figure 7 et Figure 8).
Protocole
1. Maintenance des cellules B2B conçues par CRISPR/Cas9
- Culture de cellules B2B dans une fiole T25 avec RPMI-1640 supplémentée avec 10% de sérum bovin fœtal et 1% de pénicilline-streptomycine.
- Maintenir les cellules B2B dans un incubateur humidifié à 37 °C avec 5% de CO2.
- Sous-culture des cellules B2B lorsque la confluence atteint 70% à 80%.
- Conservez la lignée cellulaire B2B dans un milieu de culture RPMI-1640 contenant 10 % (v/v) de DMSO dans un congélateur à -80 °C.
- Utilisez les cellules B2B avec un nombre de passage inférieur à 10 dans les expériences.
2. Culture cellulaire
- Ensemencez les cellules sur une boîte de Petri à fond de verre.
- Déplacez le flacon contenant des cellules B2B à l’intérieur de l’incubateur vers l’enceinte de biosécurité.
- Retirer le milieu de culture dans le ballon à l’aide d’une pipette d’aspiration munie d’une pompe à vide.
- Laver la fiole avec 2 mL de solution saline tamponnée au phosphate (PBS).
- Retirez le PBS à l’aide de la pipette d’aspiration.
- Ajouter 0,5 mL de solution de trypsine à 0,05 % pour détacher les cellules du fond du substrat de la fiole.
- Mettez la fiole dans l’incubateur pendant 5 min.
- Déplacer la fiole dans l’enceinte de biosécurité. Ajouter 5 mL de nouveau milieu de culture dans la fiole et pipeter la solution de haut en bas.
- Déposer 50 μL du milieu avec des cellules (300 cellules/μL) sur la boîte de Petri à fond de verre. Ajouter 2 ml de milieu de culture dans la boîte de Pétri.
- Placez la boîte de Petri dans l’incubateur. Attendez 12 h pour que les cellules se fixent.
- Culture des cellules avec des microbilles magnétiques.
- Peser 0,2 g de microbilles de fer carbonyle de diamètre moyen de 7 μm (ci-après appelées microbilles de 7 μm, voir le tableau des matières).
- Utilisez une pipette pour suspendre les microbilles dans 1 mL de milieu de culture RPMI-1640.
- Apportez la boîte de Petri avec des cellules B2B à l’armoire de biosécurité.
- Ajouter 200 μL du milieu contenant des microbilles dans la boîte de Pétri.
REMARQUE : Ajouter le milieu rapidement pour éviter la précipitation des microbilles. - Remettez la boîte de Petri dans l’incubateur jusqu’à ce que les microbilles soient internalisées par les cellules. Vérifiez l’internalisation toutes les 6 heures pour déterminer le temps optimal d’internalisation pour différentes lignées cellulaires.
- Pour vérifier l’internalisation, effectuez une imagerie confocale par fluorescence pour visualiser la limite microbille, nucléaire et cellulaire. Si la microbille est internalisée par la cellule, elle sera à l’intérieur des limites cellulaires.
3. Visualisation du noyau
- Réchauffer 1,5 mL du milieu de culture dans l’incubateur pendant 15 min.
- Éteignez la lumière de l’enceinte de biosécurité. Prenez la boîte de Petri qui contient la cellule, le milieu de culture chauffé, la coloration nucléaire et le HCl de vérapamil dans l’armoire de biosécurité.
NOTE: Les composants de coloration nucléaire sont sensibles à la lumière. Évitez l’exposition à la lumière pendant le fonctionnement. - Diluer la coloration nucléaire 1000x par DMSO à 100x.
- Diluer 100 mM de vérapamil HCl par DMSO à 10 mM.
- Ajouter 15 μL de colorant nucléaire 100x et 15 μL de 10 mM de vérapamil HCl à 1,5 mL de milieu de culture. Bien mélanger en pipetant de haut en bas.
- Retirer le milieu de culture de la boîte de Pétri. Ajouter le milieu de culture contenant la coloration nucléaire dans la boîte de Pétri.
- Remettez les cellules dans l’incubateur pendant plus de 2 h.
4. Préparation du matériel d’application de la force magnétique
- Imprimez en 3D toutes les pièces à l’aide d’acrylonitrile butadiène styrène (ABS) et assemblez-les selon la conception CAO (Figure 1A). La conception CAO est incluse dans le tableau des matériaux.
- Utilisez du ruban adhésif double face pour fixer l’aimant au dispositif de déplacement de l’aimant (Figure 1A).
- Placez le dispositif de déplacement magnétique à côté de l’étage du microscope. Utilisez les trois boutons pour ajuster l’emplacement spatial de l’aimant jusqu’à ce qu’il puisse se déplacer au-dessus de la boîte de Petri entre 13 mm et 120 mm.
REMARQUE: Assurez-vous que la limite supérieure de la distance entre l’aimant et la boîte de Petri est aussi grande que possible pour éviter l’application de force indésirable sur les microbilles magnétiques. 120 mm est la valeur maximale dans cette configuration expérimentale. Assurez-vous que l’aimant n’interfère pas avec les parties du microscope, y compris les objectifs et les étages motorisés. - Réglez l’aimant à la position z la plus élevée (à 120 mm).
5. Application de force et imagerie de cellules vivantes
- Mise en place de la chambre environnementale pour l’imagerie à long terme
- Appliquez une solution d’éthanol à 75% pour stériliser et nettoyer soigneusement la chambre environnementale.
- Placez la chambre d’environnement sur la platine motorisée du microscope inversé.
- Ouvrez le réservoir de CO 2 et réglez le débit entrant de CO2 à 160 mL/min.
- Ajustez la température de la chambre à 44 °C (en haut), 42 °C (bain) et 40 °C (étage).
- Ajouter 20 ml d’eau purifiée dans le bain de la chambre environnementale pour maintenir 90% d’humidité.
- Sortez la boîte de Petri à fond de verre qui contient les cellules cibles de l’incubateur de culture tissulaire et placez-la dans la chambre.
- Appliquez la pince métallique de la chambre d’environnement pour fixer la position de la boîte de Pétri.
REMARQUE: La boîte de Petri doit être serrée fermement dans la chambre car la force magnétique peut déplacer la boîte si elle n’est pas serrée. - Fermez le couvercle de la chambre.
- Optimisation des paramètres d’imagerie
- Optimiser la taille du sténopé : Le sténopé bloque les photons flous. Une taille de sténopé plus grande donne plus de photons flous mais une image plus lumineuse. Une taille de sténopé plus petite donne une image plus nette et plus sombre. Assurez-vous d’optimiser la taille du sténopé pour obtenir des images confocales nettes avec le rapport signal sur bruit approprié.
- Optimiser l’intensité du laser: L’intensité laser détermine l’intensité de l’excitation et donc l’émission de lumière. La faible intensité laser donne un faible rapport signal sur bruit. Une intensité laser trop élevée provoquera un photoblanchiment. Ajustez l’intensité du laser en conséquence.
- Optimiser la taille et les étapes : les étapes et la taille des étapes déterminent le nombre d’images qui seront prises dans une pile Z. Des pas plus petits et plus d’étapes augmenteront la résolution Z-stack, mais augmenteront également le photoblanchiment. Dans cette expérience, une taille de pas de 1 μm a été utilisée pour les cellules avec une hauteur de cellule de ~ 15 μm.
- Optimiser le temps d’exposition: Le temps d’exposition détermine combien de temps la cellule sera exposée au laser d’excitation. Un temps d’exposition faible diminuera le rapport signal sur bruit. Un temps d’exposition élevé provoquera un photoblanchiment. Un temps d’exposition de 1 image toutes les 4 s a été utilisé dans cette expérience.
- Optimisation des paramètres d’imagerie : modifiez l’un des quatre paramètres de manière itérative et conservez la cohérence des autres paramètres. Chaque fois, mesurez le rapport YAP N/C de chaque image et comparez le changement de rapport YAP N/C pour déterminer le niveau de photoblanchiment. Répétez le processus d’optimisation jusqu’à atteindre un équilibre entre le rapport signal sur bruit, la vitesse d’imagerie et le photoblanchiment.
- Définissez les configurations d’imagerie à l’aide des paramètres d’imagerie optimisés pour des paramètres d’imagerie plus rapides pendant les expériences.
REMARQUE : Les configurations utilisées dans cette étude sont décrites à la section 5.3 des paramètres d’imagerie. Pour optimiser les paramètres d’imagerie des configurations de la section 5.3, utilisez la même méthode qu’à l’étape 5.2.5.
- Application à petite force et imagerie confocale
REMARQUE: Le microscope Nikon Ti2-E a été utilisé pour l’imagerie dans cette étude, et les étapes détaillées pour l’acquisition d’images sont données ci-dessous.- Ouvrez le microscope inversé. Ouvrez l’application logicielle Elements.
- Définissez les magnetic_find de configuration. Vérifiez uniquement le canal FITC. Régler PMT HV = 70, Décalage = 0, Intensité laser = 10. Réglez la vitesse de numérisation sur 1 image toutes les 2 s en cliquant sur le bouton 1/2 . Définissez la taille du sténopé sur 1,2 UA en cliquant sur le bouton 1,2 UA . Cette configuration sera utilisée à l’étape 5.3.5.
- Définissez magnetic_YAP_Nucleus de configuration. Vérifiez le canal FITC. Régler PMT HV = 70, Décalage = 0, Intensité laser = 10. Réglez la vitesse de numérisation sur 1 image toutes les 4 s en cliquant sur le bouton 1/2 . Définissez la taille du sténopé sur 1,2 UA en cliquant sur le bouton 1,2 UA . Pour imager la limite du noyau et l’intensité de la coloration nucléaire, vérifiez le canal Cy5. Régler PMT HV = 70, Décalage = 0, Intensité laser = 10. La taille du sténopé est optimisée pour l’imagerie 3D YAP. Ne cliquez plus sur le bouton 1.2 A.U . après avoir vérifié le canal Cy5. Cette configuration sera utilisée à l’étape 5.3.7.
- Activez DIA via Elements si nécessaire. Ouvrez SpinView, utilisez un champ clair et ajustez la mise au point de l’objet pour obtenir une image nette des cellules. Utilisez un objectif 10x pour trouver plusieurs cellules individuelles appropriées dans trois conditions : avec une seule microbille à l’intérieur, avec plusieurs microbilles à l’intérieur et sans microbilles à l’intérieur. Passez à l’objectif 40x. Nommez ce poste avec le numéro de poste approprié.
- Éléments ouverts. Cliquez sur magnetic_find. Cliquez sur le bouton Supprimer le verrouillage.
- Cliquez sur Numériser et réglez la position Z du plan focal. Cliquez sur les boutons Haut et Bas pour définir la limite inférieure et supérieure de la pile Z des cellules sélectionnées. Arrêtez l’analyse en cliquant à nouveau sur Analyser .
- Passez à la configuration magnetic_YAP_Nucleus . Définissez le nom de fichier sur before_small_force.nd2. Cliquez sur le bouton Exécuter avec la pile Z enregistrée.
- Passez sur le bon chemin lumineux et activez DIA. Ouvrez SpinView et cliquez sur le bouton Enregistrement . Pendant ce temps, faites tourner le bouton du dispositif de déplacement de l’aimant pour déplacer l’aimant jusqu’à 46 mm au-dessus du fond de la boîte de Pétri. Enregistrez une séquence d’images ou une vidéo en champ clair. Regardez la vidéo pour confirmer que les microbilles montrent un déplacement induit par la force magnétique.
- Répéter les étapes 5.3.5 à 5.3.7; Définissez le nom de fichier sur after_small_force.nd2.
- Passez sur le bon chemin lumineux et activez DIA. Ensuite, ouvrez SpinView et cliquez sur le bouton Enregistrement . Pendant ce temps, faites tourner le bouton du dispositif de déplacement de l’aimant pour déplacer l’aimant jusqu’à 120 mm au-dessus du fond de la boîte de Pétri. Enregistrez une séquence d’images ou une vidéo en champ clair.
- Répétez les étapes 5.3.5 à 5.3.7 et définissez le nom de fichier sur before_large_force.nd2.
- Application de grande force et imagerie confocale
- Retirez le couvercle de la chambre d’environnement pour permettre à l’aimant d’atteindre 13 mm au-dessus du fond de la boîte de Pétri.
- Passez sur le bon chemin lumineux et activez DIA. Ouvrez SpinView et cliquez sur le bouton Enregistrement . Pendant ce temps, faites tourner le bouton du dispositif de déplacement de l’aimant pour déplacer l’aimant jusqu’à 13 mm au-dessus du fond de la boîte de Pétri. Enregistrez une séquence d’images ou une vidéo en champ clair. Regardez la vidéo pour confirmer que les microbilles montrent un déplacement induit par la force magnétique.
- Répétez les étapes 5.3.5 à 5.3.7 et définissez le nom de fichier sur after_large_force.nd2.
- Passez sur le bon chemin lumineux et activez DIA. Ensuite, ouvrez SpinView et cliquez sur le bouton Enregistrement . Pendant ce temps, faites tourner le bouton du dispositif de déplacement de l’aimant pour déplacer l’aimant jusqu’à 120 mm au-dessus du fond de la boîte de Pétri. Enregistrez une séquence d’images ou une vidéo en champ clair.
- Répéter les étapes 5.3.5 à 5.3.7; Définissez le nom de fichier sur retract_large_force.nd2.
- Fermez le couvercle de la chambre environnementale.
- Répétez les étapes 5.2 et 5.3 pour plusieurs champs de vision afin d’obtenir plus de données si nécessaire.
6. Traitement d’images et analyse de données
- Quantification du rapport YAP N/C
- Ouvrez Fiji ImageJ. Ouvrez les images .nd2 prises à l’étape 5.
- Cliquez sur Analyser > définir les mesures. Vérifiez la surface, la densité intégrée, la valeur moyenne de gris et les descripteurs de forme.
- Utilisez le canal Cy5 pour identifier le noyau. Cliquez sur Freehand Selections pour utiliser l’outil de sélection libre pour définir le noyau. Vérifiez également la macro du masque nucléaire automatique dans ImageJ (voir le tableau des matériaux).
- Cliquez sur Analyser > mesurer dans le canal FITC. La valeur mesurée de la moyenne est l’intensité moyenne du YAP nucléaire DN.
- Utilisez le canal Cy5 pour identifier le noyau. Utilisez le canal FITC pour identifier la cellule. Cliquez sur Sélections à main levée pour utiliser l’outil de sélection libre afin de sélectionner une région d’intérêt dans le cytoplasme et d’éviter la microbille magnétique. Cette région d’intérêt ne doit pas inclure le noyau.
- Cliquez sur Analyser > mesurer dans le canal FITC. La valeur mesurée de la moyenne est l’intensité moyenne cytoplasmique YAP DC.
- Calculer le rapport YAP N/C = D N / DC.
- Quantification de la forme nucléaire et de l’intensité normalisée de la coloration nucléaire
- Ouvrez Fiji ImageJ. Ouvrez les images .nd2 prises à l’étape 5.
- Cliquez sur Analyser > définir les mesures. Vérifiez la surface, la densité intégrée, la valeur moyenne de gris et les descripteurs de forme.
- Utilisez le canal Cy5 pour identifier le noyau. Cliquez sur Freehand Selections pour utiliser l’outil de sélection libre pour définir le noyau.
- Cliquez sur Analyser > mesurer dans le canal Cy5. La valeur mesurée de la moyenne est l’intensité de la coloration nucléaire. La valeur mesurée de Circ. est la circularité nucléaire.
- Pour comparer l’intensité de la coloration nucléaire à différents états de force, toute l’intensité de la coloration nucléaire est divisée par l’intensité de la coloration nucléaire en « before_small_force.nd2 » pour générer l’intensité normalisée de la coloration nucléaire.
Résultats
Conception d’un dispositif de déplacement d’aimant et application d’une force magnétique
Pour appliquer une force sur le noyau à travers les microbilles magnétiques, un dispositif de déplacement d’aimant a été conçu et construit pour contrôler la position spatiale de l’aimant. Le dispositif de déplacement de l’aimant contient un cadre central, trois boutons et des rails pour déplacer l’aimant attaché dans les directions x, y et z indépendamment à la résolution spatiale de 1,59 mm par cycle (Figure 1A). Une fois que l’aimant est déplacé près des microbilles de 7 μm livrées dans les cellules (Figure 1B), il attire magnétiquement les microbilles et applique une force sur le noyau (Figure 1C). La direction et l’amplitude de la force sont contrôlées par la position relative entre l’aimant et les microbilles.
Dans cet article, deux amplitudes de force différentes ont été appliquées aux microbilles : (1) une force relativement faible lorsque l’aimant était placé à 46 mm au-dessus de la cellule; et (2) une force relativement importante lorsque l’aimant était placé à 13 mm au-dessus de la cellule. La force magnétique appliquée à la microbille F peut être calculée par l’équation59 :  , où Nd est le facteur de démagnétisation (0,33 pour une sphère), μ est la perméabilité dans le vide (6,3 × 10-3H/m pour le fer), Vp est le volume de la microbille (178 μm3 pour une microbille de 7 μm), et H est l’intensité du champ magnétique avec l’unité A/m. H est proportionnelle à la densité de flux magnétique B avec l’unité Tesla. Comme on s’attendait à ce que la force magnétique agissant sur une seule microbille de 7 μm soit extrêmement faible et difficile à détecter par un transducteur de force, la densité de flux magnétique B comme référence a été mesurée pour indiquer l’ampleur de la force magnétique appliquée aux microbilles. Un capteur à effet Hall a été introduit à l’emplacement du fond de la boîte de Petri pour mesurer la densité de flux magnétique, et l’aimant a été placé à une distance de 13 mm ou 46 mm du fond de la boîte de Pétri. Comme les microbilles de 7 μm influencent le champ magnétique, la densité de flux magnétique a été mesurée avec et sans microbilles. Indépendamment de la présence des microbilles de 7 μm, la même densité de flux magnétique a été obtenue : B = 60,1 mT à une distance de 13 mm et B = 3,7 mT à une distance de 46 mm. Cette mesure montre que l’effet de microbilles de 7 μm sur le champ magnétique généré par l’aimant cylindrique de 12,7 mm de diamètre et de 12,7 mm de hauteur (voir le tableau des matériaux) n’était pas détectable par le capteur Hall utilisé dans cette étude. Cependant, la densité de flux magnétique dans le cas avec une distance de 13 mm était environ 16 fois plus élevée que celle avec une distance de 46 mm. L’étalonnage expérimental de la force magnétique est décrit dans la section suivante (figure 6).
, où Nd est le facteur de démagnétisation (0,33 pour une sphère), μ est la perméabilité dans le vide (6,3 × 10-3H/m pour le fer), Vp est le volume de la microbille (178 μm3 pour une microbille de 7 μm), et H est l’intensité du champ magnétique avec l’unité A/m. H est proportionnelle à la densité de flux magnétique B avec l’unité Tesla. Comme on s’attendait à ce que la force magnétique agissant sur une seule microbille de 7 μm soit extrêmement faible et difficile à détecter par un transducteur de force, la densité de flux magnétique B comme référence a été mesurée pour indiquer l’ampleur de la force magnétique appliquée aux microbilles. Un capteur à effet Hall a été introduit à l’emplacement du fond de la boîte de Petri pour mesurer la densité de flux magnétique, et l’aimant a été placé à une distance de 13 mm ou 46 mm du fond de la boîte de Pétri. Comme les microbilles de 7 μm influencent le champ magnétique, la densité de flux magnétique a été mesurée avec et sans microbilles. Indépendamment de la présence des microbilles de 7 μm, la même densité de flux magnétique a été obtenue : B = 60,1 mT à une distance de 13 mm et B = 3,7 mT à une distance de 46 mm. Cette mesure montre que l’effet de microbilles de 7 μm sur le champ magnétique généré par l’aimant cylindrique de 12,7 mm de diamètre et de 12,7 mm de hauteur (voir le tableau des matériaux) n’était pas détectable par le capteur Hall utilisé dans cette étude. Cependant, la densité de flux magnétique dans le cas avec une distance de 13 mm était environ 16 fois plus élevée que celle avec une distance de 46 mm. L’étalonnage expérimental de la force magnétique est décrit dans la section suivante (figure 6).
Livraison de microbilles magnétiques dans le cytoplasme
12 h après l’ensemencement des cellules sur la boîte de Petri à fond de verre, des microbilles de 7 μm sont ajoutées dans le milieu de culture. Les microbilles sont spontanément internalisées par les cellules. Étant donné que les microbilles n’émettent pas de fluorescence sous excitation laser dans le canal FITC ou Cy5, l’emplacement des microbilles internalisées peut être identifié par l’emplacement du creux foncé avec l’imagerie confocale de la fluorescence du YAP et du noyau. Les images 2D et 3D montrent que la microbille se trouve dans le cytoplasme alors qu’elle se trouve à l’extérieur du noyau (Figure 2).
Les niveaux d’internalisation des microbilles dans les cellules dépendent de la durée de la co-culture des cellules et des microbilles. Ainsi, les cellules ont été classées en trois types selon la quantité de microbilles internalisées : aucune microbille, microbille unique et multimicrobilles (figure 3A). À 7 h de co-culture, 62 % des cellules n’ont intériorisé aucune microbille, 15 % des cellules ont internalisé une seule microbille et 23 % des cellules ont internalisé des multi-microbilles (nombre total de cellules = 13). À 12 h de co-culture, 53 % des cellules n’ont intériorisé aucune microbille, 26 % des cellules ont internalisé une seule microbille et 21 % des cellules ont internalisé des multi-microbilles (nombre total de cellules = 62). À 24 h de coculture, 20 % des cellules n’ont intériorisé aucune microbille, 28 % des cellules ont internalisé une seule microbille et 53 % des cellules ont internalisé des multimicrobilles (nombre total de cellules = 40) (figure 3B).
Les microbilles dans le cytoplasme n’influencent pas la forme nucléaire et l’activité YAP
Pour examiner l’effet de l’internalisation des microbilles sur la forme nucléaire et l’activité des protéines, la forme nucléaire a d’abord été quantifiée par la circularité et l’activité YAP par le rapport YAP N/C, respectivement. La circularité est calculée par Circularité = 4μ (surface / périmètre2). Les étapes détaillées pour quantifier le rapport YAP N/C ont été décrites dans une publication précédente60. En bref, le rapport YAP N/C a été calculé en divisant l’intensité YAP moyenne dans le noyau par l’intensité YAP moyenne dans le cytoplasme. Compte tenu de la possibilité que la co-culture de microbilles et de cellules puisse influencer la forme nucléaire même si aucune microbille n’est internalisée, les cellules sans co-culture (points noirs, contrôle #1, circularité = 0,806 ± 0,037, n = 20), les cellules co-cultivées avec des microbilles mais sans internalisation (points gris, contrôle #2, circularité = 0,806 ± 0,035, n = 22), les cellules internalisant une seule microbille (points rouges, microbilles simples, La circularité = 0,793 ± 0,048, n = 15) et les cellules internalisant les multimicrobilles (points bleus, multimicrobilles, n = 7) (figure 3C) ont été comparées. Le résultat montre que parmi les quatre groupes testés, la circularité nucléaire n’avait pas de différence significative (Figure 3C).
Ensuite, pour examiner si le rapport YAP N/C est influencé par l’internalisation des microbilles, les cellules co-cultivées avec des microbilles mais sans internalisation (points gris, témoin #2, rapport YAP N/C = 1,155 ± 0,074, n = 35) ont été comparées uniquement avec les cellules avec internalisation d’une ou de plusieurs microbilles (points rouges, cellule avec microbilles, rapport YAP N/C = 1,140 ± 0,078, n = 36) à la 12ème heure de co-culture (Figure 3D). Les cellules sans coculture n’ont pas été comparées parce que la boîte avec des microbilles montre une densité cellulaire plus faible, ce qui peut influencer le rapport YAP N/C12. Le résultat ne montre aucune différence significative (valeur p = 0,667) dans le rapport YAP N/C entre les deux groupes, ce qui indique que l’internalisation des microbilles n’influence pas l’activité YAP (Figure 3D).
La force magnétique déforme le noyau
Tout d’abord, la déformation du noyau est montrée. La déformation du noyau est causée par la force de compression appliquée par les microbilles (Figure 4A et Figure 4A1-3) dans les cellules qui contiennent le cytosquelette. Ces données (c.-à-d. le noyau étant déformé par la compression de la microbille) soutiennent que la microbille applique effectivement une force sur le noyau dans le cytoplasme encombré. Une vidéo en champ clair montrant le processus d’application de la force est incluse dans le supplément (vidéo supplémentaire 1). Deuxièmement, parce qu’il est possible que la microbille applique simultanément une force sur le cytosquelette environnant et déforme indirectement le noyau, les expériences de compression ont été répétées dans des cellules qui ont les filaments d’actine perturbés (traitement de Cyto D (2,5 μM, 1 h); Figure 4B). Cette étude montre que les filaments d’actine sont effectivement dépolymérisés (Figure 4B), et que le noyau est déformé par les microbilles (Figure 4B1-3). Ces données soutiennent que les microbilles appliquent une force directement sur le noyau en l’absence de cytosquelette environnant entrelacé. Collectivement, ces données montrent que les protocoles et les outils peuvent appliquer une force directement sur le noyau.
Contrôle spatial et temporel des microbilles magnétiques intracellulaires
Pour obtenir un contrôle spatial des microbilles, une paire d’aimants a été utilisée pour déplacer la microbille et contrôler l’emplacement de l’indentation sur le noyau (figure 5A). Le cordon ne peut être déplacé qu’avec un déplacement allant jusqu’à 2,2 μm (figure 5A1-4), mais peut appliquer de manière flexible une indentation sur le noyau aux endroits correspondants. Le cytosquelette d’actine environnant peut restreindre le mouvement des microbilles. Par conséquent, le cytosquelette d’actine a été perturbé par le traitement au Cyto D (2,5 μM, 1 h), et l’emplacement des microbilles a été manipulé mais a montré des résultats similaires. Par conséquent, une hypothèse peut être proposée: la microbille peut se lier physiquement/chimiquement au noyau et aux autres organites environnants dans le cytoplasme, ce qui limite son grand mouvement spatial (>2,2 μm).
Pour obtenir un contrôle spatial des microbilles, une paire d’aimants a été utilisée pour contrôler les microbilles afin d’appliquer et de libérer la force deux fois (avec une amplitude de force différente) au même endroit du noyau (Figure 5B et Figure 5B1-B4). La durée actuelle d’un cycle d’application et de libération de la force est de 12 s. La vitesse de contrôle temporel est déterminée par la vitesse de fonctionnement du moteur XYZ.
Calibrage de la force magnétique
La force appliquée par les billes sur le noyau a été estimée en mesurant expérimentalement la force appliquée par une microscopie à force atomique calibrée (AFM) qui provoque une déformation similaire du noyau. Plus précisément, le cytosquelette d’actine a d’abord été dissous par CytoD (2,5 μM; 1 h, Figure 4B) parce que l’AFM applique une force sur la surface apicale de la cellule, et l’élimination du cortex d’actine et du cytosquelette permet un contact plus direct entre la pointe AFM et le noyau cellulaire. Les cellules dont le cortex d’actine et le cytosquelette sont dissous sont vivantes d’après la comparaison de la forme nucléaire et de l’intensité de la coloration nucléaire avec celles des cellules saines (Figure supplémentaire 1). Deuxièmement, l’extrémité AFM non fonctionnalisée (semi-sphérique, rayon = 5 μm) qui a une taille et une forme similaires à celles des microbilles a été utilisée pour indenter la surface apicale de la cellule d’une manière contrôlée par force et acquérir simultanément des images confocales 3D des corps de la cellule et du noyau (Figure 6A). L’amplitude de la force de compression de 0,8 nN à 2,0 nN a été choisie parce que, sur la base de la littérature24, une force d’une magnitude de 1,5 nN était connue pour déformer suffisamment le noyau. Troisièmement, la déformation normale du noyau causée par l’indentation de l’AFM a été mesurée par une analyse d’imagerie quantitative. De plus, la courbe d’étalonnage qui fournit la relation quantitative force-déplacement AFM (figure 6B) a été obtenue. Quatrièmement, une force de compression a été appliquée à la surface latérale du noyau en contrôlant des microbilles de taille et de forme similaires (rayon = 7 μm; Figure 6C), et la déformation de la membrane nucléaire a été mesurée par analyse par imagerie. La force appliquée par les billes est estimée en fonction de la relation entre la force et le déplacement de l’AFM.
Par exemple, sur la figure 6C, la déformation du noyau provoquée par les microbilles magnétiques (diamètre = ~7 μm) à « force importante » est d’environ 1,5 μm. Dans la figure 6D, une pointe AFM dotée d’une sonde semi-sphérique de 5 μm a été utilisée pour indenter la cellule au-dessus du noyau afin d’obtenir une déformation nucléaire de 1,5 μm. La force correspondante enregistrée par AFM est de 1,4 nN. Par conséquent, la force appliquée par les microbilles est estimée à ~1,4 nN. En suivant la même approche, la force magnétique à « faible force » est calibrée à 0,8 nN, et elle a provoqué une indentation nucléaire de 0,4 μm.
Cette étude considère que la force mesurée par AFM peut représenter la force appliquée par les microbilles en se basant sur les hypothèses suivantes : (1) La rigidité du noyau dans différentes cellules est similaire. (2) Les propriétés mécaniques du noyau ne dépendent pas des sites nucléaires sur lesquels l’empreinte a été appliquée. La force magnétique est appliquée horizontalement sur les côtés latéraux du noyau, tandis que la force AFM est appliquée verticalement sur les côtés apicaux du noyau. La différence mécanique entre eux est supposée négligeable. (3) Dans les expériences AFM, la sonde applique directement une force à travers la membrane cellulaire et le cytosquelette sur le noyau. Après avoir perturbé les filaments d’actine, la force appliquée par AFM sur le noyau est similaire à la force appliquée par les microbilles sur le noyau, malgré la membrane toujours située entre la sonde AFM et le noyau dans le premier cas.
La force magnétique déclenche un changement du rapport N / C YAP
Pour prouver que la force magnétique appliquée sur les microbilles peut déformer le noyau et induire la translocation YAP, le rapport YAP N/C des cellules avec internalisation des microbilles a été quantifié en trois étapes: (1) avant l’application de la force, (2) après application de la force et (3) après libération de la force. Certaines cellules présentaient un changement de forme nucléaire et de rapport YAP N/C lorsque la force était appliquée ou relâchée (figure 7A, C). Les changements d’intensité dans YAP peuvent être attribués par deux mécanismes possibles: (1) Les protéines YAP-FP se transloquent du cytoplasme dans le noyau après application de force. Dans ce cas, la coloration nucléaire ne devrait montrer aucun changement de signal. L’intensité de la coloration nucléaire ne devrait pas changer beaucoup; (2) Les protéines YAP-FP ne se transloquent pas après application de force. Les changements d’intensité YAP observés sont dus au changement de volume nucléaire induit par la force et au changement de concentration YAP-FP qui en résulte. Dans ce cas, l’intensité de la coloration nucléaire devrait changer selon une tendance similaire à celle de l’intensité nucléaire YAP parce que la concentration du colorant colorant change également à mesure que le volume du noyau change. Par conséquent, le changement d’intensité de coloration nucléaire du canal rouge (excitation: 650 nm; émission: 681 nm) a été mesuré. L’intensité change dans YAP dans le canal vert, mais il n’y a pas de changements d’intensité dans la coloration du noyau dans le canal rouge. Ainsi, le premier mécanisme existe probablement (figure 7B). Collectivement, les résultats montrent que la déformation nucléaire induite par la force magnétique déclenche la translocation YAP.
Ensuite, la variation nette du rapport N/C YAP a été quantifiée dans deux groupes de cellules : (1) cellules sans microbilles internalisées (points gris, témoin, n = 9); et (2) des cellules sélectionnées avec des microbilles internalisées qui montrent un changement du rapport YAP N/C (points verts pour une force faible, points rouges pour une force grande, n = 11). À une force de 0,8 nN, les cellules avec des microbilles internalisées montrent une variation nette du rapport YAP N/C = -0,030 ± 0,029, n = 11; Les cellules témoins montrent un changement net du rapport YAP N/C = -0,003 ± 0,012, n = 9. À une force de 1,4 nN, les cellules avec microbilles internalisées montrent un changement net du rapport YAP N/C = 0,011 ± 0,040, n = 11; Les cellules témoins montrent une variation nette du rapport YAP N/C = 0,005 ± 0,005, n = 9 (figure 8A). À une force de 0,8 nN, les cellules avec microbilles internalisées présentent un changement net absolu du rapport YAP N/C = 0,057 ± 0,017, n = 11; Les cellules témoins montrent une variation nette du rapport YAP N/C = 0,021 ± 0,007, n = 9. La différence est significative (valeur p = 0,0093, **). À une force de 1,4 nN, les cellules avec microbilles internalisées montrent une variation nette absolue du rapport YAP N/C = 0,070 ± 0,020, n = 11; Les cellules témoins montrent une variation nette du rapport YAP N/C = 0,010 ± 0,003, n = 9. La différence est significative (valeur p = 0,0007, ***) (figure 8B). Ensemble, ces résultats corroborent que la force magnétique appliquée aux microbilles dans le cytoplasme peut effectivement induire la translocation YAP et modifier le rapport YAP N/C.
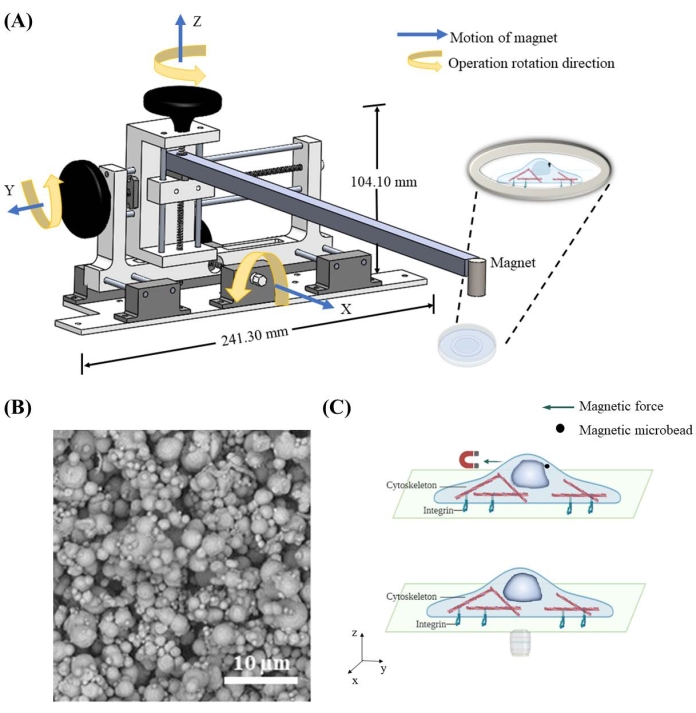
Figure 1 : Conception du dispositif de déplacement magnétique et application schématique de la force dans la cellule par des microbilles magnétiques. (A) Schéma tridimensionnel du dispositif mis en œuvre pour maintenir l’aimant et le déplacer dans les directions x, y et z. L’appareil se compose d’une base de 241,3 mm de largeur et 104,1 mm de hauteur, de deux boutons, d’une barre et d’un aimant. Les boutons seront épissés dans le sens de rotation de fonctionnement correct, ce qui fournira un mouvement dans la direction correspondante. L’aimant sera abaissé plus près / soulevé plus loin de la parabole pour appliquer une force magnétique avec une magnitude et une direction différentes sur les microbilles magnétiques. (B) Exemple d’image au microscope électronique à balayage (MEB) de microbilles de fer de 7 μm. (C) Les microbilles magnétiques délivrées à l’intérieur du cytoplasme peuvent appliquer une force aux organites tels que le noyau lorsqu’un champ magnétique est appliqué. Veuillez cliquer ici pour voir une version agrandie de cette figure.
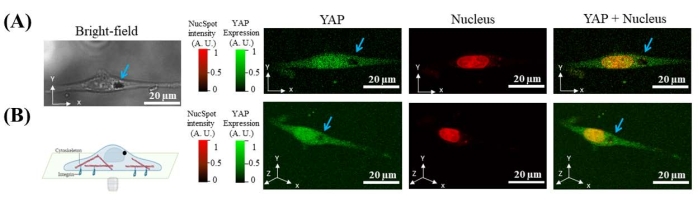
Figure 2 : Des images représentatives montrant une microbille magnétique (creux noir pointu par une flèche bleue) est internalisée dans la cellule (indiquée par YAP) et à l’extérieur du noyau. (A) Coupe efficace X-Y d’une cellule de YAP (vert), noyau (rouge) et champ clair. (B) reconstruction 3D de la cellule. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Les microbilles internalisées par les cellules n’affectent pas la forme nucléaire et le rapport YAP N/C. (A) Images représentatives en fond clair et en fluorescence de cellules sans microbilles, microbilles uniques et internalisation multimicrobilles. Les flèches bleues indiquent la position des microbilles à l’intérieur du cytoplasme. (B) À 7 h (n = 13), 12 h (n = 62) et 24 h (n = 40) de coculture, le pourcentage de cellules ne présentant aucune internalisation par microbille, microbille unique et multimicrobilles. (C) La circularité nucléaire ne montre pas de différence significative entre les cellules témoins et les cellules avec internalisation des microbilles. Contrôle #1 (sans coculture de microbilles) : Circularité = 0,806 ± 0,037, n = 20; Contrôle #2 (avec co-culture de microbilles, sans internalisation des microbilles) : Circularité = 0,806 ± 0,035, n = 22; Internalisation d’une seule microbille : circularité = 0,793 ± 0,048, n = 15; internalisation multimicrobilles : circularité = 0,780 ± 0,061, n = 7. (D) Le rapport YAP N/C ne montre aucune différence significative (valeur p = 0,667) entre les cellules témoins (avec coculture de microbilles, sans internalisation des microbilles, rapport YAP N/C = 1,155 ± 0,074, n = 35) et les cellules avec internalisation des microbilles (rapport YAP N/C = 1,140 ± 0,078, n = 36). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Application directe de force sur le noyau avec et sans filaments d’actine. (A) Les cellules montrent des filaments d’actine (jaune). (A1) Image du noyau lorsqu’aucune force n’est appliquée. (A2) Image du noyau après l’application de la force. (A3) L’image de chevauchement de la frontière nucléaire avant et après l’application de la force montre l’indentation nucléaire. (B) Les cellules présentent des filaments d’actine perturbés (jaune) après traitement au Cyto D (2,5 μM, 1 h). (B1) Image du noyau lorsqu’aucune force n’est appliquée. (B2) Image du noyau après l’application de la force. (B3) L’image de chevauchement de la frontière nucléaire avant et après l’application de force montre l’indentation nucléaire avec le cytosquelette d’actine perturbé. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Contrôle spatial et temporel de la microbille magnétique intracellulaire. (A) Une paire d’aimants contrôle spatialement la microbille magnétique. (A1) Image en champ clair de la limite cellulaire (ligne verte), de la limite nucléaire (ligne rouge) et de la microbille magnétique (ligne jaune) à la position 1. (A2) La microbille magnétique indente le noyau en position 1. (A3) La microbille magnétique est déplacée à la position 2 (ligne jaune). La position 1 est indiquée comme référence (ligne pointillée jaune). (A4) La microbille magnétique indente le noyau en position 2. (B) Une paire d’aimants contrôle temporellement la microbille magnétique. (B1) Image en champ clair d’une cellule sans force appliquée au point de temps I. (B2) La microbille magnétique applique une force sur le noyau au point de temps II. (B3) La microbille magnétique libère la force du noyau au point de temps III. (B4) La microbille magnétique applique une force plus importante sur le noyau au point de temps IV. Veuillez cliquer ici pour voir une version agrandie de cette figure.
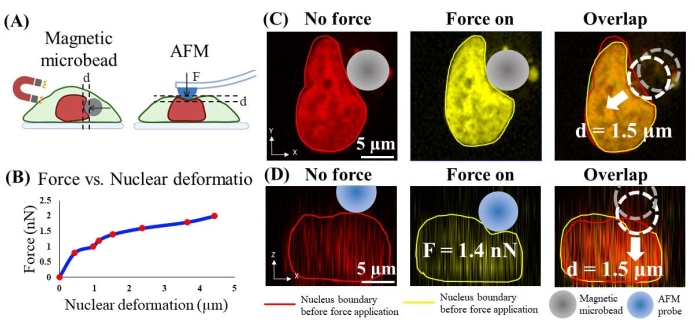
Graphique 6. Étalonnage de la force appliquée par microbilles sur le noyau à l’aide de l’indentation AFM. (A) Illustration schématique du procédé d’étalonnage. La microbille magnétique applique une compression horizontale sur le noyau (à gauche) et la sonde AFM s’indente verticalement sur le noyau. (B) Force d’indentation AFM par rapport à la déformation nucléaire. (C) Image représentative de la déformation du noyau (1,5 μm) avant et après application de force par microbille magnétique. (D) Image représentative d’une déformation similaire du noyau (1,5 μm) avant et après indentation AFM avec une force de 1,4 nN. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 7 : Des données représentatives montrant que le changement du rapport YAP N/C est induit par l’application et la libération de force magnétique. (A) Coupe efficace X-Y de YAP (vert) et noyau (rouge) image fluorescente de la cellule sans force, force activée et forcée. Dans l’état de force, l’intensité du YAP cytoplasmique diminue à l’endroit indiqué par une flèche jaune, tandis que l’intensité du YAP nucléaire augmente. Le rapport YAP N/C augmente. (B) Le rapport YAP N/C augmente lorsque la force est activée (de 1,0791 à 1,2327) et diminue lorsque la force est désactivée (de 1,2327 à 1,1548). L’intensité normalisée des taches nucléaires montre un changement mineur avec l’application de force (1,00117) et la libération (0,95578). (C) Coupe efficace X-Z de YAP (vert) et image du noyau (rouge) de la cellule sans force, force activée et force éteinte. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 8 : Changement du rapport YAP N/C induit par l’application d’une force magnétique. (A) À une force de 0,8 nN, les cellules avec microbilles internalisées montrent un changement net du rapport YAP N/C = -0,030 ± 0,029, n = 11; Les cellules témoins montrent un changement net du rapport YAP N/C = -0,003 ± 0,012, n = 9. À une force de 1,4 nN, les cellules avec microbilles internalisées montrent un changement net du rapport YAP N/C = 0,011 ± 0,040, n = 11; Les cellules témoins montrent un changement net du rapport YAP N/C = 0,005 ± 0,005, n = 9. (B) À une force de 0,8 nN, les cellules avec microbilles internalisées montrent une variation absolue nette du rapport YAP N/C = 0,057 ± 0,017, n = 11; Les cellules témoins montrent une variation nette du rapport YAP N/C = 0,021 ± 0,007, n = 9. La différence est significative (valeur p = 0,0093, **). À une force de 1,4 nN, les cellules avec microbilles internalisées montrent une variation nette absolue du rapport YAP N/C = 0,070 ± 0,020, n = 11; Les cellules témoins montrent une variation nette du rapport YAP N/C = 0,010 ± 0,003, n = 9. La différence est significative (valeur p = 0,0007, ***) Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure supplémentaire 1 : Forme nucléaire et intensité de coloration nucléaire. (A) Sans traitement Cyto D, (B) Avec traitement Cyto D et (C) Cellules mortes. Veuillez cliquer ici pour télécharger ce fichier.
Vidéo supplémentaire 1 : Une vidéo en champ clair montrant le processus de demande de la force. Veuillez cliquer ici pour télécharger cette vidéo.
Discussion
L’internalisation des microbilles magnétiques (section 2.2) est essentielle parce que les microbilles extracellulaires ne peuvent pas appliquer de force directement sur le noyau. L’application de force et l’imagerie (section 5.3) sont des étapes critiques dans cette expérience, et la force nécessaire pour déformer le noyau et induire des conséquences biologiques significatives pourrait dépendre de l’échantillon. L’amplitude de la force dans cette expérience (0,8 nN et 1,4 nN) peut encore être augmentée pour déclencher la mécanodétection nucléaire dans les cellules moins sensibles.
Pour appliquer une force magnétique de manière quantitative avec un débit élevé, l’internalisation d’une seule microbille est une approche idéale. Dans cette étude, le pourcentage de cellules ayant une internalisation par une seule microbille était semblable à 12 h (26 %) et 24 h (28 %), tandis que les cellules sans internalisation par microbille étaient plus élevées à 12 h (53 %) qu’à 24 h (20 %) (figure 3B). On considère que 12 h est le moment optimal pour l’expérience d’application de force, car il est possible d’inclure davantage de microbilles simples et de contrôler les cellules. Pour différentes lignées cellulaires et tailles de microbilles, le temps de co-culture et la concentration de microbilles doivent être testés pour déterminer les conditions optimales correspondantes.
Dans les expériences, les microbilles n’ont pas été enrobées pour se lier spécifiquement au noyau. Par conséquent, la force directement transmise des microbilles au noyau n’est probablement que compressive. Les résultats montrent que le rapport YAP N/C augmente et diminue la population cellulaire (Figure 8A). Une raison possible est que la force magnétique appliquée via les microbilles peut provoquer un changement de tension positif ou négatif dans le cytosquelette et réguler le rapport YAP N/C pour augmenter ou diminuer, respectivement28. Des recherches antérieures ont montré que la force de compression sur le noyau induit une augmentation du rapport YAP N/C28. Dans les expériences futures, afin d’étudier la détection de la force directe du noyau, le cytosquelette peut être perturbé pour éliminer la transmission de la force du cytosquelette dans le noyau.
Les méthodes actuelles présentent deux inconvénients potentiels. Tout d’abord, dans ces expériences, le moteur 3D (Figure 1A) a été utilisé pour ajuster le mouvement des billes, qui est surveillé par imagerie confocale en temps réel et vise à appliquer une force de compression sur le noyau. Cependant, en raison de la nature glissante de la membrane nucléaire et de l’environnement complexe dans le cytoplasme, la direction de la force appliquée par les billes peut ne pas être purement compressive (c.-à-d. pas absolument perpendiculaire à la surface de la membrane nucléaire). Cette imperfection peut entraîner l’application d’une force de cisaillement à la membrane nucléaire. Deuxièmement, les microbilles actuelles utilisées dans cette étude ne sont pas conjuguées avec l’anticorps pour se lier au noyau, car la mobilité spatiale des billes est essentielle dans l’expérience actuelle pour démontrer l’avantage de l’actionneur magnétique sans contact. Par conséquent, la méthode actuelle ne peut pas appliquer de tension à la membrane nucléaire.
À l’avenir, (1) les billes contenant des anticorps anti-nesprine-1 seront conjuguées pour se lier spécifiquement au noyau. Cela peut garantir la transmission directe et spécifique de la force entre les microbilles et les protéines cibles. (2) La direction de la force sera étalonnée en manipulant la microbille magnétique unique dans de l’hydrogel souple incorporé avec des billes fluorescentes. Le déplacement 3D des billes fluorescentes peut être utilisé pour calculer le champ de déformation de l’hydrogel et déterminer la direction de la force en fonction du champ magnétique appliqué. Une fois que la microbille est chimiquement liée au noyau, l’application d’une force avec une direction connue déterminera le type de force (tension, compression ou cisaillement). (3) L’imagerie 3D de la coloration nucléaire sera utilisée pour construire un modèle FEM de simulation 3D du noyau. La direction de la force peut être vérifiée en comparant la déformation nucléaire avant et après l’application de la force magnétique.
La technique unique développée dans cette étude offre plusieurs avantages potentiels : (1) Par rapport à l’indentation verticale par les sondes AFM, les microbilles magnétiques peuvent appliquer une force dans n’importe quelle direction. Les cellules cultivées sur des surfaces de substrat 2D peuvent avoir une distribution et une orientation de protéines hétérogènes sur leurs surfaces verticales et horizontales de la membrane plasmique et de l’enveloppe nucléaire. L’application horizontale d’une force peut induire des réponses mécano-sensorielles non observées auparavant. (2) Une fois que les microbilles sont fonctionnellement recouvertes pour se lier aux noyaux, les forces de poussée et de traction peuvent être appliquées directement sur le noyau pour étudier plus en détail le mécano-détection nucléaire différentiel en raison des directions de force distinctes. (3) En contrôlant la liaison spécifique des microbilles à certaines protéines de l’enveloppe nucléaire, il est possible d’élucider des mécanismes de détection de force nucléaire jusque-là peu étudiés. De nouvelles preuves montrent que le noyau est probablement un mécano-capteur36, et que le mécano-détection nucléaire est le régulateur le plus direct de la translocation YAP28. Le mécanisme de translocation YAP régulée par le nucléaire est activement étudié et plusieurs candidats de mécano-capteur ou de paramètres dans le noyau sont proposés, notamment la taille des pores nucléaires28, la forme nucléaire 25,61, le complexe LINC et la tension de l’enveloppe nucléaire20. La manipulation des microbilles magnétiques ouvre la possibilité d’une exploration détaillée de ces mécanismes par application directe de force sur le complexe LINC et des réglementations contrôlées de la tension et de la forme de l’enveloppe nucléaire. (4) En plus d’appliquer des forces sur le noyau, les microbilles peuvent également être conçues pour se lier à la face interne de la membrane plasmique afin de révéler comment les domaines intracellulaires des protéines membranaires et leur complexe répondent aux signaux biophysiques.
En résumé, cet article a démontré une méthode qui (1) délivre des microbilles de fer de taille microscopique dans le cytoplasme sans affecter la morphologie nucléaire et les fonctions protéiques, (2) applique une force sur le noyau par des microbilles magnétiques et (3) effectue une imagerie confocale par fluorescence vivante pendant l’application de force. Ces outils non invasifs ouvrent les possibilités de manipulation épigénétique directe d’organites dans des cellules individuelles, d’interrogation basée sur l’imagerie à super-résolution de la mécanotransduction du noyau et d’exploration détaillée de l’organisation chromosomique 3D régulée par force (en combinaison avec Hi-C : capture de confirmation chromosomique à haute résolution) et de la reprogrammation dans les contextes de physiologie cellulaire et de pathobiologie.
Déclarations de divulgation
Il n’y a pas de conflits d’intérêts à déclarer.
Remerciements
Ce projet est financé par UF Gatorade Award Start-up Package (X. T.), le UFHCC Pilot Award (X. T. et Dr. Dietmar Siemann), UF Opportunity Seed Fund (X. T.) et UFHCC University Scholars Program (H. Y. Wang). Nous apprécions sincèrement les discussions intellectuelles et le soutien technique du Dr Jonathan Licht (UFHCC), du Dr Rolf Renne (UFHCC), du Dr Christopher Vulpe (UFHCC), du Dr Blanka Sharma (BME), du Dr Mark Sheplak (MAE & ECE), du Dr Daniel Ferris (BME), du Dr Malisa Sarntinoranont (MAE), du Dr Ashok Kumar (MAE), du Dr Benjamin Keselowsky (BME), du Dr Brent Gila (RSC), du Dr Philip Feng (ECE), Dr Gregory A. Hudalla (BME), Dr Steven Ghivizzani (OSSM), Dr Yenisel Cruz-Almeida (CDBS), Dr Roger Fillingim (CD-BS), Dr Robert Caudle (OMS), Dr John Neubert (DN-OR), Dr Justin Hiliard (neurochirurgie), Dr Tian He (Université Harvard), Dr Youhua Tan (Université polytechnique de Hong Kong), Dr Jessie L-S Au (Institut de pharmacologie des systèmes quantitatifs), Dr David Hahn (Université de l’Arizona), et l’équipe de soutien de Nikon (Drs Jose Serrano-Velez, Larry Kordon et Jon Ekman). Nous sommes profondément reconnaissants pour le soutien efficace de tous les membres des laboratoires de recherche de Tang, Yamaguchi, Sharma, Au, Siemann et Guan et de tous les membres du personnel du département UF MAE.
matériels
| Name | Company | Catalog Number | Comments |
| 0.05 % Trypsin | Corning | 25-051-CI | |
| 25 cm2 flask | Corning | 156340 | |
| 7-µm mean diameter carbonyl iron microbeads | N/A | N/A | |
| A1R confocal system | Nikon | ||
| Carbonyl Iron Powder CM | BASF | 30042253 | Magnetic microbead |
| Culture medium (RPMI-1640) | Gibco | 11875093 | |
| Desktop Computer | Dell | with Windows 10 operating system | |
| Environmental chamber TIZB | Tokai Hit | TIZB | |
| Fetal bovine serum (FBS) | Gibco | 26140 | |
| Fiji ImageJ | National Institutes of Health and the Laboratory for Optical and Computational Instrumentation | ||
| Glass-bottom petri dish | MatTek | P35G-1.5-14-C | |
| Magnet | K&J Magnetics, Inc. | D99-N52 | |
| Monochrome Camera | FLIR | BFS-U3-70S7M-C | |
| NIS-Elements software platform | Nikon | software platform | |
| Nucleus mask ImageJ macro | https://github.com/KOLIUG/Nuclear mask | ||
| NucSpot Live 650 | Biotium | #40082 | Nuclear stain |
| Penicillin-streptomycin | Gibco | 15140122 | |
| Phosphate buffered saline (PBS) | Gibco | 10010023 | |
| Ti2-E inverted microscope | Nikon | ||
| XYZ mover (CAD files) | https://github.com/KOLIUG/XYZ-mover |
Références
- Discher, D. E., Janmey, P., Wang, Y. Tissue cells feel and respond to the stiffness of their substrate. Science. 310 (5751), 1139-1143 (2005).
- Janmey, P. A., Fletcher, D. A., Reinhart-King, C. A. Stiffness sensing by cells. Physiological Reviews. 100 (2), 695-724 (2020).
- Bajaj, P., Tang, X., Saif, T. A., Bashir, R. Stiffness of the substrate influences the phenotype of embryonic chicken cardiac myocytes. Journal of Biomedical Materials Research Part A. 95 (4), 1261-1269 (2020).
- Tang, X., et al. Mechanical force affects expression of an in vitro metastasis-like phenotype in HCT-8 cells. Biophysical Journal. 99 (8), 2460-2469 (2010).
- Hofmann, M., et al. Lowering of tumor interstitial fluid pressure reduces tumor cell proliferation in a xenograft tumor model. Neoplasia. 8 (2), 89-95 (2006).
- Yankaskas, C. L., et al. The fluid shear stress sensor TRPM7 regulates tumor cell intravasation. Science Advances. 7 (28), (2021).
- Kim, E., et al. A biosynthetic hybrid spidroin-amyloid-mussel foot protein for underwater adhesion on diverse surfaces. ACS Applied Materials and Interfaces. 13 (41), 48457-48468 (2021).
- Tajik, A., et al. Transcription upregulation via force-induced direct stretching of chromatin. Nature Materials. 15 (12), 1287-1296 (2016).
- Lee, J., Abdeen, A. A., Tang, X., Saif, T. A., Kilian, K. A. Matrix directed adipogenesis and neurogenesis of mesenchymal stem cells derived from adipose tissue and bone marrow. Acta Biomaterialia. 42, 46-55 (2016).
- Lee, J., Abdeen, A. A., Tang, X., Saif, T. A., Kilian, K. A. Geometric guidance of integrin mediated traction stress during stem cell differentiation. Biomaterials. 69, 174-183 (2015).
- Ren, B., et al. Study of sacrificial ink-assisted embedded printing for 3D perfusable channel creation for biomedical applications. Applied Physics Reviews. 9 (1), 011408 (2022).
- Coyle, S., et al. Cell alignment modulated by surface nano-topography-Roles of cell-matrix and cell-cell interactions. Acta Biomaterialia. 142, 149-159 (2022).
- Sawada, Y., et al. Force sensing by mechanical extension of the Src family kinase substrate p130Cas. Cell. 127 (5), 1015-1026 (2006).
- Aragona, M., et al. A mechanical checkpoint controls multicellular growth through YAP/TAZ regulation by actin-processing factors. Cell. 154 (5), 1047-1059 (2013).
- Tang, X., et al. Specific and non-specific adhesion in cancer cells with various metastatic potentials. Mechanobiology of Cell-Cell and Cell-Matrix Interactions. , 105-122 (2011).
- Tang, X., Saif, T. A. Adhesivity of colon cancer cells during in vitro metastasis. International Journal of Applied Mechanics. 5 (03), 1350025 (2013).
- Chaudhuri, O., et al. Effects of extracellular matrix viscoelasticity on cellular behaviour. Nature. 584 (7822), 535-546 (2020).
- Ohashi, K., Fujiwara, S., Mizuno, K. Roles of the cytoskeleton, cell adhesion and rho signalling in mechanosensing and mechanotransduction. The Journal of Biochemistry. 161 (3), 245-254 (2017).
- Hamill, O. P., Martinac, B. Molecular basis of mechanotransduction in living cells. Physiological Reviews. 81 (2), 685-740 (2001).
- Liang, C., et al. Towards an integrative understanding of cancer mechanobiology: Calcium, YAP, and microRNA under biophysical Forces. Soft Matter. 18, 1112-1148 (2022).
- Tan, Y., et al. Matrix softness regulates plasticity of tumour-repopulating cells via H3K9 demethylation and Sox2 expression. Nature Communications. 5 (1), 1-12 (2014).
- Poh, Y., et al. Dynamic force-induced direct dissociation of protein complexes in a nuclear body in living cells. Nature Communications. 3 (1), 1-10 (2012).
- Tang, X., et al. A mechanically-induced colon cancer cell population shows increased metastatic potential. Molecular Cancer. 13 (1), 1-15 (2014).
- Wu, J., et al. Effects of dynein on microtubule mechanics and centrosome positioning. Molecular Biology of the Cell. 22 (24), 4834-4841 (2011).
- Tang, X., Ali, M. Y., Saif, M. T. A novel technique for micro-patterning proteins and cells on polyacrylamide gels. Soft Matter. 8 (27), 7197-7206 (2011).
- Tang, X., Bajaj, P., Bashir, R., Saif, T. A. How far cardiac cells can see each other mechanically. Soft Matter. 7 (13), 6151-6158 (2011).
- Tang, X., et al. Mechanical force affects expression of an in vitro metastasis-like phenotype in HCT-8 cells. Biophysical Journal. 99 (8), 2460-2469 (2010).
- Elosegui-Artola, A., et al. Force triggers YAP nuclear entry by regulating transport across nuclear pores. Cell. 171 (6), 1397-1410 (2017).
- Gudipaty, S. A., et al. Mechanical stretch triggers rapid epithelial cell division through Piezo1. Nature. 543 (7643), 118-121 (2017).
- Tang, X., et al. Attenuation of cell mechanosensitivity in colon cancer cells during in vitro metastasis. PLoS One. 7 (11), 50443 (2012).
- Cha, C., et al. Top-down synthesis of versatile polyaspartamide linkers for single-step protein conjugation to materials. Bioconjugate Chemistry. 22 (12), 2377-2382 (2012).
- Chen, X., et al. Glycosaminoglycans modulate long-range mechanical communication between cells in collagen networks. Proceedings of the National Academy of Sciences of the United States of America. 119 (15), (2022).
- Boyle, J. J., Pless, R. B., Thomopoulos, S., Genin, G. M. Direct estimation of surface strain fields from a stereo vision system. Journal of Biomechanical Engineering. 142 (7), 074503 (2020).
- Kim, S., Uroz, M., Bays, J. L., Chen, C. S. Harnessing mechanobiology for tissue engineering. Developmental Cell. 56 (2), 180-191 (2021).
- Driscoll, T. P., et al. Cytoskeletal to nuclear strain transfer regulates YAP signaling in mesenchymal stem cells. Biophysical Journal. 108 (12), 2783-2793 (2015).
- Guilluy, C., et al. Isolated nuclei adapt to force and reveal a mechanotransduction pathway in the nucleus. Nature Cell Biology. 16 (4), 376-381 (2014).
- Vashisth, M. Scaling concepts in 'omics: Nuclear lamin-B scales with tumor growth and often predicts poor prognosis, unlike fibrosis. Proceedings of the National Academy of Sciences of the United States of America. 118 (48), (2021).
- Roberts, A. B., et al. Tumor cell nuclei soften during transendothelial migration. Journal of Biomechanics. 121, 110400 (2021).
- Denais, C. M., et al. Nuclear envelope rupture and repair during cancer cell migration. Science. 352 (6283), 353-358 (2016).
- Raab, M., et al. ESCRT III repairs nuclear envelope ruptures during cell migration to limit DNA damage and cell death. Science. 352 (6283), 359-362 (2016).
- Lammerding, J., et al. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. The Journal of Clinical Investigation. 113 (3), 370-378 (2004).
- Shelby, J., Patrick, J., Edgar, S., Chiu, D. T. Monitoring cell survival after extraction of a single subcellular organelle using optical trapping and pulsed-nitrogen laser ablation. Photochemistry and Photobiology. 81 (4), 994-1001 (2005).
- Caspi, A., Granek, R., Elbaum, M. Diffusion and directed motion in cellular transport. Physical Review E. 66 (1), 011916 (2002).
- Svoboda, K., Block, S. M. Biological applications of optical forces. Annual Review of Biophysics and Biomolecular Structure. 23 (1), 247-285 (1994).
- Rohrbach, A. Stiffness of optical traps: quantitative agreement between experiment and electromagnetic theory. Physical Review Letters. 95 (16), 168102 (2005).
- Neuman, K. C., et al. Characterization of photodamage to Escherichia coli in optical traps. Biophysical Journal. 77 (5), 2856-2863 (1999).
- Kanger, J. S., Subramaniam, V., Driel, R. V. Intracellular manipulation of chromatin using magnetic microbeads. Chromosome Research. 16 (3), 511-522 (2008).
- Bausch, A. R., et al. Local measurements of viscoelastic parameters of adherent cell surfaces by magnetic microbead microrheometry. Biophysical Journal. 75 (4), 2038-2049 (1998).
- Fisher, J. K., et al. Three-dimensional force microscope: a nanometric optical tracking and magnetic manipulation system for the biomedical sciences. Review of Scientific Instruments. 76 (5), 053711 (2005).
- Berret, J. -. F. Local viscoelasticity of living cells measured by rotational magnetic spectroscopy. Nature Communications. 7, 10134 (2016).
- Hu, B., Dobson, J., El Haj, A. J. Control of smooth muscle α-actin (SMA) up-regulation in HBMSCs using remote magnetic microbead mechano-activation. Nanomedicine: Nanotechnology, Biology and Medicine. 10 (1), 45-55 (2014).
- Kamiyama, D., et al. Versatile protein tagging in cells with split fluorescent protein. Nature Communications. 7, 11046 (2016).
- Feng, S., et al. Improved split fluorescent proteins for endogenous protein labeling. Nature Communications. 8, 370 (2017).
- Leonetti, M. D., Sekine, S., Kamiyama, D., Weissman, J. S., Huang, B. A scalable strategy for high-throughput GFP tagging of endogenous human proteins. Proceedings of the National Academy of Sciences of the United States of America. 113 (25), 3501-3508 (2016).
- Tulpule, A., et al. Kinase-mediated RAS signaling via membraneless cytoplasmic protein granules. Cell. 184 (10), 2649-2664 (2021).
- Ansari, A. M., et al. Cellular GFP toxicity and immunogenicity: potential confounders in in vivo cell tracking experiments. Stem Cell Reviews and Reports. 12 (5), 553-559 (2016).
- Gibson, T. J., Seiler, M., Veitia, R. A. The transience of transient overexpression. Nature Methods. 10 (8), 715-721 (2013).
- Ratz, M., et al. CRISPR/Cas9-mediated endogenous protein tagging for RESOLFT super-resolution microscopy of living human cells. Scientific Reports. 5, 9592 (2015).
- Suzuki, H., Ho, C., Kasagi, N. A chaotic mixer for magnetic microbead-based micro cell sorter. Journal of Microelectromechanical Systems. 13 (5), 779-790 (2004).
- Luo, Q., et al. All-optical mechanobiology interrogation of yes-associated protein in human cancer and normal cells using a multi-functional system. Journal of Visualized Experiments. (178), e62934 (2021).
- Koushki, N., et al. Lamin A redistribution mediated by nuclear deformation determines dynamic localization of YAP. BioRxiv. , (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon