Method Article
Сочетание 3D-привода магнитной силы и многофункциональной флуоресцентной визуализации для изучения метанобиологии ядра
В этой статье
Резюме
Это исследование представляет новый протокол для непосредственного применения механической силы на ядро клетки через магнитные микрошарики, доставляемые в цитоплазму, и для проведения одновременной флуоресцентной визуализации живых клеток.
Аннотация
Фундаментальный вопрос в механобиологии заключается в том, как живые клетки воспринимают внеклеточные механические стимулы в контексте клеточной физиологии и патологии. Считается, что клеточное механо-ощущение внеклеточных механических стимулов проходит через мембранные рецепторы, связанный белковый комплекс и цитоскелет. Последние достижения в области механобиологии демонстрируют, что ядро клетки в самой цитоплазме может независимо воспринимать механические стимулы одновременно. Тем не менее, механистическое понимание того, как клеточное ядро воспринимает, преобразует и реагирует на механические стимулы, отсутствует, главным образом из-за технических проблем в доступе и количественной оценке механики ядра с помощью обычных инструментов. В этой статье описывается проектирование, изготовление и реализация нового магнитного силового привода, который применяет точные и неинвазивные 3D-механические стимулы для прямой деформации ядра клетки. Используя клетки, спроектированные CRISPR / Cas9, это исследование демонстрирует, что этот инструмент в сочетании с конфокальной флуоресцентной визуализацией с высоким разрешением позволяет выявить динамику в реальном времени механочувствительного yes-ассоциированного белка (YAP) в отдельных клетках в зависимости от деформации ядра. Этот простой метод может преодолеть существующий технологический разрыв в механобиологическом сообществе и дать ответы на пробел в знаниях, который существует в отношении между механотрансдукцией ядра и функцией клетки.
Введение
Это исследование направлено на разработку и применение новой техники для выяснения механобиологии ядра путем объединения магнитных приводов, которые применяют механическую силу непосредственно к ядру клетки, и конфокальной флуоресцентной микроскопии, которая одновременно отображает структурные и функциональные субклеточные изменения. Клетки воспринимают внеклеточные биофизические сигналы, включая жесткость тканей 1,2,3,4, давление интерстициальной жидкости и напряжение сдвига 5,6,7, топологию/геометрию поверхности 8,9,10,11,12 и напряжение растяжения/сжатия 13,14, 15,16. Биофизические сигналы преобразуются в биохимические сигналы и вызывают потенциальные последующие изменения экспрессии генов и поведения клеток - процесс, известный как механотрансдукция 17,18,19,20,21,22,23,24,25,26,27 . Для изучения процессов механотрансдукции было разработано множество методов применения механической силы к клеткам, таких как атомно-силовая микроскопия28, устройство растяжения клеток29, датчик силы био-MEMS (микроэлектромеханические системы) 15,30,31, реология сдвига32 и стереовидение System 33 . Недавний обзор обобщает подходы к применению внеклеточных механических сигналов и вмешательству в механозондирование34. На сегодняшний день большинство из этих методов применяют силу на клеточную плазматическую мембрану, и клетки непосредственно получают эти внеклеточные биофизические сигналы через мембранные рецепторы, такие как интегрин, кадгерин, ионные каналы и рецепторы, связанные с G-белком. Впоследствии они передают сигнал на внутриклеточный цитоскелет и ядро. Например, используя транслокацию yes-ассоциированного белка (YAP) в качестве индикатора механо-зондирования, показано, что клетки воспринимают механические сигналы жесткости субстрата и внеклеточного напряжения от клеточной мембраны и передают их через цитоскелет в ядро, чтобы индуцировать транслокацию YAP цитоплазмы в ядро28,35.
Последние данные свидетельствуют о том, что само ядро клетки является независимым механосенсором 8,36,37. Это доказано экспериментами, выполненными на изолированном ядре, собранном из клеток, где было выявлено, что ядра адаптивно изменяют свою жесткость в ответ на механическую силу, непосредственно приложенную на них36. Во время многих физиологических состояний ядра как в опухолевых, так и в здоровых клетках воспринимают внеклеточные биофизические сигналы и изменяют свои механические свойства и сборки 38,39,40. Например, при экстравазации ядерная жесткость опухолевых клеток уменьшается и сохраняет мягкость более 24 ч38. Во время миграции через замкнутое интерстициальное пространство ядра опухолевых клеток часто теряют и восстанавливают свою структурную целостность39. Однако способ, которым ядро воспринимает биофизический сигнал, неизвестен, хотя было обнаружено, что в нем участвуют несколько белков ядерной оболочки и семейств белков, таких как Lamin A / C и линкер нуклеоскелета и комплекса цитоскелетов (LINC) 38,41. Следовательно, новые неинвазивные методы, которые могут непосредственно прикладывать силу к ядру, отделят эффект передачи силы от клеточно-плазматической мембраны и цитоскелета и помогут прояснить ранее недоступные молекулярные механизмы ядерного механо-зондирования.
Исследования, в которых использовались оптические пинцеты для манипулирования органеллами42 и микрошариками, вводимыми в клетки43, показали технологическую способность непосредственно прикладывать силу к ядру. Однако метод оптического пинцета имеет несколько ограничений: (1) оптический пинцет с низкой пропускной способностью часто манипулирует только одной клеткой или микрогранулой за раз; и (2) потенциальное фотоповреждение и температурный артефакт-деформация ядра требуют десятков пН36, а соответствующая необходимая мощность лазера составляет около 10 мВт на пН 44,45. Такой интенсивности лазера достаточно, чтобы вызвать фотоповреждения в клетках и возмутить функции клеток во время эксперимента46.
Магнитная сила, приложенная через микрошарики в живых клетках, показывает потенциал непосредственного приложения силы к ядру и преодолевает ограничения оптического пинцета. Как только микрошарики доставляются в цитоплазму, магнитное поле может оказывать магнитную силу на несколько микрошариков одновременно с высокой пропускной способностью. Магнитное поле не влияет на функции ячейки47, но генерирует силу от pN до nN, которой достаточно, чтобы вызвать ядерную деформацию 36,48,49. На сегодняшний день манипуляции с магнитными микрошариками применяются на клеточной плазматической мембране48, внутри цитоплазмы50, на F-актине51, внутри ядра47 и на изолированном ядре36. Однако магнитные манипуляции с микрошариками никогда не использовались для применения прямой механической силы на ядерную оболочку для изучения механотрансдукции в ядре.
В этой статье разработан простой метод неинвазивной доставки магнитных микрошариков в цитоплазму и использования этих микрошариков для приложения механической силы к ядру (рисунок 1). Здесь для проверки метода используются нормальные клеточные линии человека, спроектированные CRISPR / Cas9, которые эндогенно экспрессируют mNeonGreen21-10/11 YAP. YAP является механочувствительным белком, и транслокация YAP регулируется ядерным механо-зондированием14,28. Подход, регулируемый CRISPR/Cas9, был выбран для маркировки эндогенного YAP флуоресцентным белком (FP) mNeonGreen21-10/11. Хотя известно, что редактирование CRISPR имеет неполную эффективность и нецелевой эффект, протоколы в предыдущих публикациях интегрировали флуоресцентную сортировку для выбора для правильной вставки открытого кадра чтения 52,53,54. С этим дополнительным слоем отбора не наблюдалось никакого события нецелевой маркировки в более чем 20 клеточных линиях, ранее сгенерированных 52,53,54,55. Это расщепленная флуоресцентная белковая конструкция, но в принципе любая экспрессируемая флуоресцентная метка может быть пригодна для использования. Этот подход к маркировке превосходит методы трансгенов или антител. Во-первых, в отличие от трансгенной экспрессии, меченый белок поддерживает дозировку гена с одной копией и экспрессируется в физиологическом контексте регуляторной сети нативного гена, ограничивая отклонения в концентрации белка, локализации и взаимодействии. Метод маркировки, используемый в этом исследовании, обеспечивает более высокую пропускную способность и эффективность на порядок, чем полная маркировка FP. Это также позволяет избежать проблем, связанных с иммунофлуоресценцией из-за артефактов фиксации и ограниченной доступности высококачественных антител с высокой специфичностью. Во-вторых, подход, используемый в этой статье, делает минимальное возмущение физиологии клеток и позволяет в режиме реального времени выявить все эндогенные YAP достоверно. Напротив, другие распространенные трансгенные методы часто приводят к гиперэкспрессии YAP. Полученное искусственное распределение может потенциально вызвать цитотоксичность и повлиять на механо-зондирование клеток 56,57,58.
В этом исследовании представлен протокол для непосредственного приложения силы к ядру через магнитные микрошарики, доставляемые в цитоплазму, и для проведения одновременной флуоресцентной визуализации живых клеток. Таким образом, представленные здесь протоколы демонстрируют, как (1) доставлять магнитные микрошарики в клетку, находясь вне ядра, (2) манипулировать микрошариками для приложения магнитной силы к ядру, (3) выполнять конфокальную флуоресцентную визуализацию клеток во время манипуляции и (4) количественно анализировать соотношение YAP ядерной / цитоплазмы (N / C) на протяжении всего процесса приложения силы. Результаты показывают, что (1) через эндоцитоз магнитные микрошарики могут быть неинвазивно доставлены в цитоплазму B2B-клеток в течение 7 ч (Рисунок 2 и Рисунок 3); и (2) количественная магнитная сила, непосредственно приложенная к ядру (рисунок 4, рисунок 5 и рисунок 6), сама по себе может вызвать различные изменения соотношения YAP N/C в ячейках B2B, спроектированных CRISPR/Cas9 (рисунок 7 и рисунок 8).
протокол
1. Обслуживание B2B-ячеек, разработанных CRISPR/Cas9
- Культивируйте B2B-клетки в колбе T25 с RPMI-1640, дополненным 10% фетальной бычьей сывороткой и 1% пенициллин-стрептомицином.
- Поддерживайте клетки B2B в увлажненном инкубаторе при 37 °C с 5% CO2.
- Субкультура B2B-клеток при слиянии достигает от 70% до 80%.
- Храните клеточную линию B2B в питательной среде RPMI-1640 с 10% (v/v) DMSO в морозильной камере -80 °C.
- Используйте в экспериментах B2B-клетки с числом прохода менее 10.
2. Клеточная культура
- Посейте клетки на чашку Петри со стеклянным дном.
- Переместите колбу, содержащую B2B-клетки внутри, из инкубатора в шкаф биобезопасности.
- Удалите питательную среду в колбу с помощью аспирирующей пипетки с подключенным вакуумным насосом.
- Промыть колбу 2 мл фосфатно-буферного физиологического раствора (PBS).
- Удалите PBS с помощью аспирационной пипетки.
- Добавляют 0,5 мл 0,05% раствора трипсина для отсоединения клеток от дна колбы субстрата.
- Поставьте колбу в инкубатор на 5 мин.
- Переместите колбу в шкаф биобезопасности. Добавьте 5 мл новой питательной среды в колбу и пипеткой раствор вверх и вниз.
- Нанесите 50 мкл среды с ячейками (300 клеток/мкл) на чашку Петри со стеклянным дном. Добавьте 2 мл питательной среды в чашку Петри.
- Поместите чашку Петри в инкубатор. Подождите 12 часов, пока ячейки не прикрепятся.
- Культивируйте клетки магнитными микрошариками.
- Весят 0,2 г карбонильных железных микрошариков среднего диаметра 7 мкм (далее именуемые микрошариками 7 мкм, см. Таблицу материалов).
- Используйте пипетку для суспендирования микрогранул в 1 мл питательной среды RPMI-1640.
- Возьмите чашку Петри с B2B-клетками в шкаф биобезопасности.
- Добавьте 200 мкл среды, содержащей микрогранулы, в чашку Петри.
ПРИМЕЧАНИЕ: Быстро добавляйте среду, чтобы избежать осаждения микрошариков. - Поместите чашку Петри обратно в инкубатор до тех пор, пока микрошарики не усвоятся клетками. Проверяйте интернализацию каждые 6 ч, чтобы определить оптимальное время интернализации для различных клеточных линий.
- Чтобы проверить интернализацию, выполните конфокальную флуоресцентную визуализацию для визуализации границы микрогранулы, ядра и клетки. Если микрогранула интернализуется клеткой, она будет находиться в пределах клеточной границы.
3. Визуализация ядра
- Прогреть 1,5 мл питательной среды в инкубаторе в течение 15 мин.
- Выключите свет шкафа биобезопасности. Возьмите чашку Петри, содержащую клетку, подогретую питательную среду, ядерное пятно и верапамил HCl, в шкаф биобезопасности.
ПРИМЕЧАНИЕ: Компоненты ядерного окрашивания чувствительны к свету. Избегайте воздействия света во время работы. - Разбавить 1000x ядерное пятно DMSO до 100x.
- Разбавляют 100 мМ верапамила HCl ДМСО до 10 мМ.
- Добавьте 15 мкл 100-кратного ядерного пятна и 15 мкл 10 мМ верапамила HCl к 1,5 мл питательной среды. Хорошо перемешайте, пипеткой вверх и вниз.
- Выньте питательную среду из чашки Петри. Добавьте в чашку Петри питательную среду, содержащую ядерное окрашивание.
- Поместите клетки обратно в инкубатор более чем на 2 ч.
4. Подготовка аппаратуры приложения магнитной силы
- 3D-печать всех деталей с использованием акрилонитрилбутадиенстирола (ABS) и сборка их в соответствии с конструкцией CAD (рисунок 1A). Конструкция САПР включена в Таблицу материалов.
- Используйте двустороннюю ленту для крепления магнита к магнитно-движущемуся устройству (рисунок 1А).
- Установите магнитно-движущееся устройство рядом со сценой микроскопа. Используйте три ручки, чтобы отрегулировать пространственное расположение магнита, пока он не сможет перемещаться над чашкой Петри между 13 мм и 120 мм.
ПРИМЕЧАНИЕ: Убедитесь, что верхний предел расстояния между магнитом и чашкой Петри как можно больше, чтобы избежать нежелательного применения силы на магнитные микрошарики. 120 мм является максимальным значением в этой экспериментальной установке. Убедитесь, что магнит не мешает частям микроскопа, включая объективы и моторизованные ступени. - Установите магнит в самое высокое z-положение (120 мм).
5. Принудительное применение и визуализация живых клеток
- Установка камеры окружающей среды для долгосрочной визуализации
- Нанесите 75% раствор этанола для тщательной стерилизации и очистки камеры окружающей среды.
- Поместите камеру окружающей среды на моторизованную ступень перевернутого микроскопа.
- Откройте резервуар CO2 и установите скорость притока CO2 на уровне 160 мл/мин.
- Отрегулируйте температуру камеры до 44 °C (сверху), 42 °C (ванна) и 40 °C (ступень).
- Добавьте 20 мл очищенной воды в ванну камеры окружающей среды для поддержания влажности 90%.
- Выньте чашку Петри со стеклянным дном, содержащую клетки-мишени, из инкубатора культуры тканей и поместите ее в камеру.
- Нанесите металлический зажим камеры окружающей среды, чтобы зафиксировать положение чашки Петри.
ПРИМЕЧАНИЕ: Чашка Петри должна быть плотно зажата в камере, потому что магнитная сила может переместить чашку, если она не зажата. - Закройте крышку камеры.
- Оптимизация параметров визуализации
- Оптимизируйте размер точечного отверстия: точечное отверстие блокирует фотоны вне фокуса. Больший размер точечного отверстия дает больше фотонов вне фокуса, но более яркое изображение. Меньший размер точечного отверстия дает более сфокусированное и тусклое изображение. Обязательно оптимизируйте размер точечного отверстия, чтобы получить конфокальные изображения в фокусе с соответствующим соотношением сигнал/шум.
- Оптимизация интенсивности лазера: интенсивность лазера определяет интенсивность возбуждения и, следовательно, излучения света. Низкая интенсивность лазера дает низкое отношение сигнал/шум. Слишком высокая интенсивность лазера вызовет фотоотбеливание. Отрегулируйте интенсивность лазера соответствующим образом.
- Оптимизация размера шага и шагов: шаги и размер шага определяют, сколько изображений будет сделано в Z-стеке. Меньшие размеры шагов и больше шагов увеличат разрешение Z-стека, но также увеличат фотоотбеливание. В этом эксперименте размер шага 1 мкм использовался для клеток с высотой ячейки ~ 15 мкм.
- Оптимизируйте время экспозиции: время экспозиции определяет, как долго клетка будет подвергаться воздействию лазера возбуждения. Низкое время экспозиции уменьшит отношение сигнал/шум. Высокое время экспозиции приведет к фотоотбеливанию. В этом эксперименте использовалось время экспозиции 1 кадр на 4 с.
- Оптимизация параметров изображения: измените один из четырех параметров итеративно и сохраните согласованность остальных параметров. Каждый раз измеряйте коэффициент YAP N/C каждого изображения и сравнивайте изменение коэффициента YAP N/C, чтобы определить уровень фотоотбеливания. Повторяйте процесс оптимизации до тех пор, пока не будет достигнут баланс между отношением сигнал/шум, скоростью изображения и фотоотбеливанием.
- Определите конфигурации изображений, используя оптимизированные параметры изображения для более быстрых настроек изображения во время экспериментов.
ПРИМЕЧАНИЕ: Конфигурации, используемые в данном исследовании, описаны в разделе 5.3 параметров визуализации. Для оптимизации параметров визуализации конфигураций в разделе 5.3 используйте тот же метод, что и на шаге 5.2.5.
- Применение малых усилий и конфокальная визуализация
ПРИМЕЧАНИЕ: Микроскоп Nikon Ti2-E использовался для визуализации в этом исследовании, и подробные шаги для получения изображения приведены ниже.- Откройте инвертированный микроскоп. Откройте программное приложение Elements.
- Определите magnetic_find конфигурации. Проверьте только канал FITC. Установите PMT HV = 70, Смещение = 0, Интенсивность лазера = 10. Установите скорость сканирования на 1 кадр в 2 с, нажав кнопку 1/2 . Установите размер точечного отверстия на 1,2 а.е., нажав кнопку 1.2 A.U. Эта конфигурация будет использоваться на шаге 5.3.5.
- Определите magnetic_YAP_Nucleus конфигурации. Проверьте канал FITC. Установите PMT HV = 70, Смещение = 0, Интенсивность лазера = 10. Установите скорость сканирования на 1 кадр в 4 с, нажав кнопку 1/2 . Установите размер точечного отверстия на 1,2 а.е., нажав кнопку 1.2 A.U. Чтобы сфотографировать границу ядра и интенсивность ядерного пятна, проверьте канал Cy5. Установите PMT HV = 70, Смещение = 0, Интенсивность лазера = 10. Размер точечного отверстия оптимизирован для 3D-визуализации YAP. Не нажимайте кнопку 1.2 A.U. снова после проверки канала Cy5. Эта конфигурация будет использоваться на шаге 5.3.7.
- При необходимости включите DIA через Elements . Откройте SpinView, используйте яркое поле и настройте фокус объекта, чтобы получить четкое изображение ячеек в фокусе. Используйте 10-кратную цель, чтобы найти подходящие несколько одиночных клеток в трех условиях: с одной микрогранулой внутри, с несколькими микрошариками внутри и без какой-либо микрогранулы внутри. Переключитесь на объектив 40x. Назовите эту позицию соответствующим номером позиции.
- Открытые элементы. Нажмите на magnetic_find. Нажмите кнопку Удалить блокировку.
- Нажмите кнопку Сканировать и отрегулируйте Z-положение фокальной плоскости. Нажмите кнопки «Сверху» и «Снизу», чтобы задать нижний и верхний пределы для Z-стека выделенных ячеек. Остановите сканирование, нажав кнопку Сканировать еще раз.
- Переключитесь на конфигурацию magnetic_YAP_Nucleus . Задайте имя файла before_small_force.nd2. Нажмите на кнопку Выполнить с записанным Z-стеком.
- Переключитесь на правильный путь освещения и включите DIA. Откройте SpinView и нажмите на кнопку Запись . Между тем, покрутите ручку магнитно-движущегося устройства, чтобы переместить магнит вниз на 46 мм над дном чашки Петри. Сохранение последовательности изображений или видео с ярким полем. Проверьте видео, чтобы подтвердить, что микрошарики показывают смещение, вызванное магнитной силой.
- Повторите шаги 5.3.5-5.3.7; задайте для файла имя after_small_force.nd2.
- Переключитесь на правильный путь освещения и включите DIA. Затем откройте SpinView и нажмите кнопку «Запись ». Между тем, покрутите ручку магнитно-движущегося устройства, чтобы переместить магнит до 120 мм над дном чашки Петри. Сохранение последовательности изображений или видео с ярким полем.
- Повторите шаги 5.3.5-5.3.7 и задайте имя файла before_large_force.nd2.
- Применение большого усилия и конфокальная визуализация
- Снимите крышку камеры окружающей среды, чтобы магнит достиг 13 мм над дном чашки Петри.
- Переключитесь на правильный путь освещения и включите DIA. Откройте SpinView и нажмите на кнопку Запись . Между тем, покрутите ручку магнитно-движущегося устройства, чтобы переместить магнит вниз на 13 мм над дном чашки Петри. Сохранение последовательности изображений или видео с ярким полем. Проверьте видео, чтобы подтвердить, что микрошарики показывают смещение, вызванное магнитной силой.
- Повторите шаги 5.3.5-5.3.7 и задайте имя файла after_large_force.nd2.
- Переключитесь на правильный путь освещения и включите DIA. Затем откройте SpinView и нажмите кнопку «Запись ». Между тем, покрутите ручку магнитно-движущегося устройства, чтобы переместить магнит до 120 мм над дном чашки Петри. Сохранение последовательности изображений или видео с ярким полем.
- Повторите шаги 5.3.5-5.3.7; задайте для файла имя retract_large_force.nd2.
- Закройте крышку камеры окружающей среды.
- Повторите шаги 5.2 и 5.3 для нескольких полей зрения, чтобы при необходимости получить дополнительные данные.
6. Обработка изображений и анализ данных
- Количественная оценка соотношения YAP N/C
- Открыть Фиджи ImageJ. Откройте изображения .nd2, сделанные на шаге 5.
- Нажмите «Анализировать > набор измерений». Проверьте область, интегрированную плотность, среднее значение серого цвета и дескрипторы формы.
- Используйте канал Cy5 для идентификации ядра. Нажмите на Freehand Selections, чтобы использовать инструмент свободного выделения для очертания ядра. Кроме того, проверьте автоматический макрос ядерной маски в ImageJ (см. Таблицу материалов).
- Щелкните Анализировать > меру в канале FITC. Измеренным значением среднего значения является средняя интенсивность ядерного YAP DN.
- Используйте канал Cy5 для идентификации ядра. Используйте канал FITC для идентификации ячейки. Нажмите « Выделение от руки», чтобы использовать инструмент свободного выбора, чтобы выбрать интересующую область в цитоплазме и избежать магнитной микрошарики. Эта область интереса не должна включать ядро.
- Щелкните Анализировать > меру в канале FITC. Измеренным значением среднего значения является средняя интенсивность цитоплазматического YAP DC.
- Рассчитайте отношение YAP N/C = DN / DC.
- Количественная оценка ядерной формы и нормированной интенсивности ядерных пятен
- Открыть Фиджи ImageJ. Откройте изображения .nd2, сделанные на шаге 5.
- Нажмите «Анализировать > набор измерений». Проверьте область, интегрированную плотность, среднее значение серого цвета и дескрипторы формы.
- Используйте канал Cy5 для идентификации ядра. Нажмите на Freehand Selections, чтобы использовать инструмент свободного выделения для очертания ядра.
- Нажмите «Анализировать > измерение » в канале Cy5. Измеренным значением среднего значения является интенсивность ядерного пятна. Измеренное значение Circ. — это ядерная цикличность.
- Чтобы сравнить интенсивность ядерного пятна при различном силовом состоянии, вся интенсивность ядерного пятна делится на интенсивность ядерного пятна в «before_small_force,nd2» для получения нормализованной интенсивности ядерного пятна.
Результаты
Конструкция магнитно-подвижного устройства и применение магнитной силы
Чтобы приложить силу к ядру через магнитные микрошарики, было спроектировано и построено магнитно-движущееся устройство для управления пространственным положением магнита. Магнитно-движущееся устройство содержит центральную раму, три ручки и рельсы для независимого перемещения прикрепленного магнита в направлениях x, y и z с пространственным разрешением 1,59 мм на цикл (рисунок 1A). Как только магнит перемещается близко к 7-мкм микрошарикам, доставленным в клетки (рисунок 1B), он магнитно притягивает микрогранулы и прикладывает силу к ядру (рисунок 1C). Направление силы и величина контролируются относительным положением между магнитом и микрошариками.
В этой статье к микрограмы были приложены две различные величины силы: (1) относительно небольшая сила, когда магнит был помещен на 46 мм выше ячейки; и (2) относительно большая сила, когда магнит был помещен на 13 мм выше ячейки. Магнитная сила, приложенная к микрогрануле F, может быть рассчитана по уравнению59:  , где Nd - коэффициент размагничивания (0,33 для сферы), μ - проницаемость в вакууме (6,3 × 10-3 H/m для железа), Vp - объем микрогранулы (178 μм3 для микрогранулы 7 мкм), и H — напряженность магнитного поля с единицей A/m. H пропорциональна плотности магнитного потока B с единицей Tesla. Поскольку магнитная сила, действующая на одну микрогранулу 7 мкм, должна была быть чрезвычайно мала и ее было трудно обнаружить с помощью датчика силы, плотность магнитного потока B в качестве эталона была измерена, чтобы указать величину магнитной силы, приложенной к микрошарикам. Датчик Холла был введен в месте расположения дна чашки Петри для измерения плотности магнитного потока, а магнит был размещен на расстоянии 13 мм или 46 мм от дна чашки Петри. Поскольку микрошарики 7 мкм влияют на магнитное поле, плотность магнитного потока измерялась с микрошариками и без них. Независимо от наличия микрошариков 7 мкм, была получена одинаковая плотность магнитного потока: B = 60,1 мТл на расстоянии 13 мм и В = 3,7 мТл на расстоянии 46 мм. Это измерение показывает, что влияние 7 мкм микрошариков на магнитное поле, генерируемое цилиндрическим магнитом диаметром 12,7 мм и высотой 12,7 мм (см. Таблицу материалов), не было обнаружено датчиком Холла, используемым в этом исследовании. Однако плотность магнитного потока в корпусе с расстоянием 13 мм была примерно в 16 раз выше, чем при расстоянии 46 мм. Экспериментальная калибровка магнитной силы описана в следующем разделе (рисунок 6).
, где Nd - коэффициент размагничивания (0,33 для сферы), μ - проницаемость в вакууме (6,3 × 10-3 H/m для железа), Vp - объем микрогранулы (178 μм3 для микрогранулы 7 мкм), и H — напряженность магнитного поля с единицей A/m. H пропорциональна плотности магнитного потока B с единицей Tesla. Поскольку магнитная сила, действующая на одну микрогранулу 7 мкм, должна была быть чрезвычайно мала и ее было трудно обнаружить с помощью датчика силы, плотность магнитного потока B в качестве эталона была измерена, чтобы указать величину магнитной силы, приложенной к микрошарикам. Датчик Холла был введен в месте расположения дна чашки Петри для измерения плотности магнитного потока, а магнит был размещен на расстоянии 13 мм или 46 мм от дна чашки Петри. Поскольку микрошарики 7 мкм влияют на магнитное поле, плотность магнитного потока измерялась с микрошариками и без них. Независимо от наличия микрошариков 7 мкм, была получена одинаковая плотность магнитного потока: B = 60,1 мТл на расстоянии 13 мм и В = 3,7 мТл на расстоянии 46 мм. Это измерение показывает, что влияние 7 мкм микрошариков на магнитное поле, генерируемое цилиндрическим магнитом диаметром 12,7 мм и высотой 12,7 мм (см. Таблицу материалов), не было обнаружено датчиком Холла, используемым в этом исследовании. Однако плотность магнитного потока в корпусе с расстоянием 13 мм была примерно в 16 раз выше, чем при расстоянии 46 мм. Экспериментальная калибровка магнитной силы описана в следующем разделе (рисунок 6).
Доставка магнитных микрошариков в цитоплазму
Через 12 ч после посева клеток на стеклянную чашку Петри в культуральную среду добавляют 7 мкм микрошариков. Микрошарики спонтанно усваиваются клетками. Поскольку микрошарики не излучают флуоресценцию при лазерном возбуждении в канале FITC или Cy5, расположение интернализованных микрошариков может быть идентифицировано по расположению темной полы с конфокальной визуализацией флуоресценции YAP и ядра. Как 2D, так и 3D изображения показывают, что микрогранула находится в цитоплазме, находясь вне ядра (рисунок 2).
Уровни интернализации микрошариков в клетках зависят от продолжительности совместной культивирования клеток и микрошариков. Таким образом, клетки были разделены на три типа в зависимости от количества интернализованных микрошариков - без микрогранул, одна микрогранула и мультимикроша (рисунок 3A). Через 7 ч кокультуры 62% клеток интернализировали отсутствие микрогранулы, 15% клеток интернализировали одну микрогранулу, а 23% клеток интернализировали мультимикрошарики (общее количество клеток = 13). Через 12 ч кокультуры 53% клеток интернализировали отсутствие микрогранулы, 26% клеток интернализировали одну микрогранулу, а 21% клеток интернализировали мультимикрошарики (общее количество клеток = 62). Через 24 ч кокультуры 20% клеток интернализировали отсутствие микрогранулы, 28% клеток интернализировали одну микрогранулу, а 53% клеток интернализировали мультимикрошарики (общее количество клеток = 40) (рисунок 3B).
Микрошарики в цитоплазме не влияют на ядерную форму и активность YAP
Чтобы изучить влияние интернализации микрошариков на ядерную форму и активность белка, ядерная форма была сначала количественно определена по циркулярности, а активность YAP - по соотношению YAP N / C соответственно. Циркулярность вычисляется по окружности = 4μ (площадь/периметр2). Подробные шаги по количественной оценке соотношения YAP N/C были описаны в предыдущей публикации60. Вкратце, соотношение YAP N/C было рассчитано путем деления средней интенсивности YAP в ядре на среднюю интенсивность YAP в цитоплазме. Учитывая возможность того, что кокультура микрошарики и клеток может влиять на ядерную форму, даже если не интернализируется микрошарика, клетки без кокультуры (черные точки, контроль No 1, циркулярность = 0,806 ± 0,037, n = 20), клетки, культивируемые совместно с микрошариками, но без интернализации (серые точки, контроль No 2, циркулярность = 0,806 ± 0,035, n = 22), клетки, интернализующие одну микрогранулу (красные точки, одна микрошарика, Сравнивали циркулярность = 0,793 ± 0,048, n = 15), а клетки, интернализующие мультимикрошарики (синие точки, мультимикрошарики, n = 7) (рисунок 3C). Результат показывает, что среди всех четырех протестированных групп ядерная цикличность не имела существенной разницы (рисунок 3C).
Далее, чтобы изучить, влияет ли на соотношение YAP N/C интернализация микрогранул, клетки, совместно культивируемые с микрошариками, но без интернализации (серые точки, контроль #2, коэффициент YAP N/C = 1,155 ± 0,074, n = 35), сравнивали только с клетками с интернализацией одного или нескольких микрогранул (красные точки, клетка с микрошариками, коэффициент YAP N/C = 1,140 ± 0,078, n = 36) на12-м часу совместной культуры (рисунок 3D). Клетки без кокультуры не сравнивали, потому что чашка с микрогранулами показывает более низкую плотность клеток, что может влиять на соотношение YAP N/C12. Результат не показывает существенной разницы (значение p = 0,667) в соотношении YAP N/C между двумя группами, что указывает на то, что интернализация микрогранул не влияет на активность YAP (рисунок 3D).
Магнитная сила деформирует ядро
Сначала показана деформация ядра. Деформация ядра вызвана силой сжатия, приложенной микрошариками (рисунок 4А и рисунок 4А1-3) в клетках, содержащих цитоскелет. Эти данные (то есть ядро деформируется в результате сжатия микрогранулы) подтверждают, что микрогранула действительно прикладывает силу к ядру в переполненной цитоплазме. Видео с ярким полем, демонстрирующее процесс применения силы, включено в материал дополнения (Дополнительное видео 1). Во-вторых, поскольку возможно, что микрогранула одновременно прикладывает силу к окружающему цитоскелету и деформирует ядро косвенно, компрессионные эксперименты повторялись в клетках, имеющих нарушенные актиновые нити (лечение Cyto D (2,5 мкМ, 1 ч); Рисунок 4B). Это исследование показывает, что актиновые нити действительно деполимеризуются (рисунок 4B), а ядро деформируется микрошариками (рисунок 4B1-3). Эти данные подтверждают, что микрогранулы прикладывают силу непосредственно к ядру в отсутствие переплетенного окружающего цитоскелета. В совокупности эти данные показывают, что протоколы и инструменты могут применять силу непосредственно к ядру.
Пространственный и временной контроль внутриклеточных магнитных микрошариков
Для достижения пространственного контроля микрошариков использовалась пара магнитов для перемещения микрогранулы и контроля ее расположения углубления на ядре (рисунок 5А). Шарик может перемещаться только с смещением до 2,2 мкм (рисунок 5A1-4), но может гибко наносить отступ на ядро в соответствующих местах. Окружающий актиновый цитоскелет может ограничивать движение микрошариков. Таким образом, актиновый цитоскелет был нарушен лечением Cyto D (2,5 мкМ, 1 ч), и местоположение микрогранулы манипулировали, но показали аналогичные результаты. Поэтому можно выдвинуть гипотезу: микрогранула может физически/химически связываться с ядром и другими окружающими органеллами в цитоплазме, что ограничивает ее большое пространственное движение (>2,2 мкм).
Для достижения пространственного управления микрошариками была использована пара магнитов, которая управляет микрошариками, чтобы приложить и выпустить силу дважды (с разной величиной силы) в одном и том же месте ядра (рисунок 5B и рисунок 5B1-B4). Текущая продолжительность времени для одного цикла приложения и высвобождения силы составляет 12 с. Скорость временного управления определяется скоростью работы двигателя XYZ.
Калибровка магнитной силы
Сила, приложенная к ядру, была оценена путем экспериментального измерения силы, приложенной калиброванной атомно-силовой микроскопией (AFM), которая вызывает аналогичную деформацию ядра. В частности, актиновый цитоскелет был впервые растворен CytoD (2,5 мкМ; 1 ч, рисунок 4B), потому что AFM применяет силу на апикальной поверхности клетки, а удаление актиновой коры и цитоскелета позволяет более прямой контакт между кончиком AFM и ядром клетки. Клетки, в которых растворена актиновая кора и цитоскелет, являются живыми на основе сравнения ядерной формы и интенсивности ядерного окрашивания с клетками в здоровых клетках (дополнительный рисунок 1). Во-вторых, нефункционализированный наконечник AFM (полусферический, радиус = 5 мкм), который имеет тот же размер и форму, что и у микрогранул, использовался для отступа апикальной поверхности клетки контролируемым силой способом и одновременного получения 3D-конфокальных изображений тел клетки и ядра (рисунок 6A). Величина силы сжатия от 0,8 нН до 2,0 нН была выбрана потому, что, исходя из литературы24, известно, что сила при величине 1,5 нН достаточно деформирует ядро. В-третьих, нормальная деформация ядра, вызванная отступом ОВМ, была измерена с помощью количественного анализа изображений. Также была получена калибровочная кривая, обеспечивающая количественное соотношение сила-смещение ОВМ (рисунок 6В). В-четвертых, к боковой поверхности ядра прикладывали сжимающую силу путем управления микрошариками, имеющими одинаковые размеры и форму (радиус = 7 мкм; Рисунок 6C), а деформация ядерной мембраны была измерена с помощью анализа изображений. Сила, приложенная к шарикам, оценивается на основе соотношения силы и смещения ОВМ.
Например, на рисунке 6C деформация ядра, вызванная магнитными микрошариками (диаметр = ~ 7 мкм) при «большой силе», составляет около 1,5 мкм. На рисунке 6D наконечник AFM, который имеет полусферический зонд 5 мкм, был использован для отступа ячейки поверх ядра для достижения ядерной деформации 1,5 мкм. Соответствующая сила, регистрируемая АСМ, составляет 1,4 нН. Следовательно, сила, приложенная микрошариками, оценивается в ~1,4 нН. Следуя тому же подходу, магнитная сила при «малой силе» калибруется как 0,8 нН, и это вызвало ядерный отступ 0,4 мкм.
Это исследование считает, что измеренная AFM сила может представлять силу, приложенную микрогранулами, основываясь на следующих предположениях: (1) Жесткость ядра в разных клетках одинакова. (2) Механические свойства ядра не зависят от ядерных объектов, на которых был нанесен отступ. Магнитная сила применяется горизонтально на боковых сторонах ядра, в то время как сила AFM применяется вертикально на апикальных сторонах ядра. Механическая разница между ними считается незначительной. (3) В экспериментах AFM зонд непосредственно прикладывает силу через клеточную мембрану и цитоскелет к ядру. После разрушения актиновых нитей приложенная к ядру сила, приложенная к ядру, аналогична силе, приложенной микрошариками к ядру, несмотря на то, что мембрана все еще расположена между зондом AFM и ядром в первом случае.
Магнитная сила инициирует изменение коэффициента YAP N/C
Чтобы доказать, что магнитная сила, приложенная к микрогранулам, может деформировать ядро и индуцировать транслокацию YAP, соотношение YAP N/C клеток с интернализацией микрогранул было количественно определено в три этапа: (1) перед применением силы, (2) после приложения силы и (3) после высвобождения силы. Некоторые ячейки показали изменение ядерной формы и соотношения YAP N/C при приложении или высвобождении силы (рисунок 7A,C). Изменения интенсивности YAP можно объяснить двумя возможными механизмами: (1) белки YAP-FP транслоцируются из цитоплазмы в ядро после применения силы. В этом случае ядерное окрашивание не должно показывать никаких изменений сигнала. Интенсивность ядерного окрашивания не должна существенно изменяться; (2) Белки YAP-FP не перемещаются после силового применения. Наблюдаемые изменения интенсивности YAP обусловлены вызванным силой изменением ядерного объема и результирующим изменением концентрации YAP-FP. В этом случае интенсивность ядерного окрашивания должна изменяться в той же тенденции, что и ядерная интенсивность YAP, потому что концентрация окрашивающего красителя также изменяется по мере изменения объема ядра. Поэтому измеряли изменение интенсивности ядерного окрашивания из красного канала (возбуждение: 650 нм; излучение: 681 нм). Интенсивность изменяется в YAP в зеленом канале, но нет изменений интенсивности окрашивания ядра в красном канале. Таким образом, первый механизм, вероятно, существует (рисунок 7B). В совокупности результаты показывают, что вызванная магнитной силой ядерная деформация вызывает транслокацию YAP.
Затем чистое изменение соотношения YAP N/C было количественно определено в двух группах клеток: (1) клетки без интернализованных микрошариков (серые точки, контроль, n = 9); и (2) отобранные клетки с интернализованными микрошариками, которые показывают изменение соотношения YAP N/C (зеленые точки для малой силы, красные точки для большой силы, n = 11). При силе 0,8 нН клетки с интернализованными микрошариками показывают чистое изменение соотношения YAP N/C = -0,030 ± 0,029, n = 11; контрольные ячейки показывают чистое изменение коэффициента YAP N/C = -0,003 ± 0,012, n = 9. При силе 1,4 нН клетки с интернализованными микрошариками показывают чистое изменение соотношения YAP N/C = 0,011 ± 0,040, n = 11; контрольные ячейки показывают чистое изменение коэффициента YAP N/C = 0,005 ± 0,005, n = 9 (рисунок 8A). При силе 0,8 нН клетки с интернализованными микрошариками показывают абсолютное чистое изменение отношения YAP N/C = 0,057 ± 0,017, n = 11; контрольные ячейки показывают чистое изменение коэффициента YAP N/C = 0,021 ± 0,007, n = 9. Разница существенная (значение p = 0,0093, **). При силе 1,4 нН клетки с интернализованными микрошариками показывают абсолютное чистое изменение отношения YAP N/C = 0,070 ± 0,020, n = 11; контрольные ячейки показывают чистое изменение коэффициента YAP N/C = 0,010 ± 0,003, n = 9. Разница значительна (значение p = 0,0007, ***) (рисунок 8B). Вместе эти результаты подтверждают, что магнитная сила, приложенная к микрошарикам в цитоплазме, действительно может индуцировать транслокацию YAP и изменять соотношение YAP N /C.
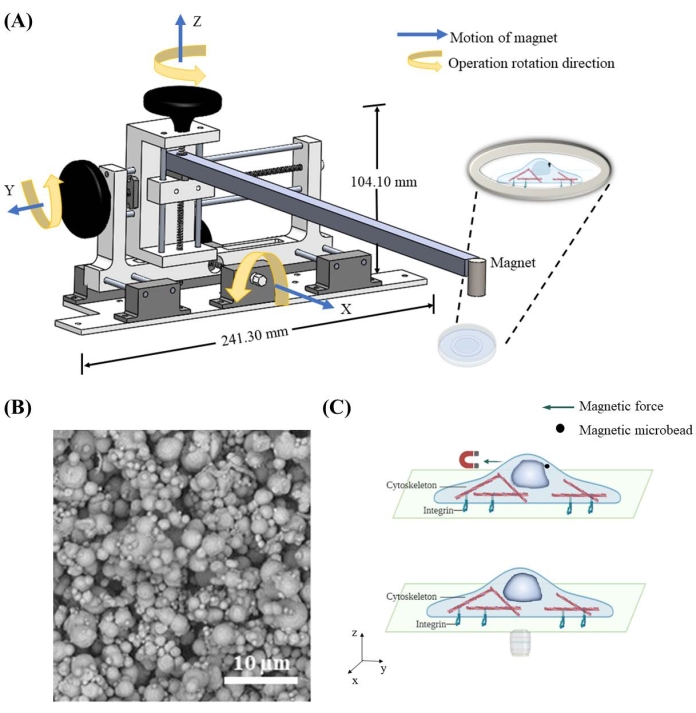
Рисунок 1: Проектирование магнитного движущегося устройства и схема приложения силы в ячейке магнитными микрошариками. (А) Трехмерная схема устройства, реализованная для удержания магнита и перемещения его в направлениях x, y и z. Устройство состоит из основания 241,3 мм в ширину и 104,1 мм в высоту, двух ручек, стержня и магнита. Ручки будут шинированы в правильном направлении вращения, что обеспечит движение в соответствующем направлении. Магнит будет опущен ближе / поднят дальше к тарелке, чтобы приложить магнитную силу с разной величиной и направлением к магнитным микрограмах. (B) Пример изображения сканирующего электронного микроскопа (SEM) 7 мкм железной микрогранулы. (C) Магнитные микрошарики, доставляемые внутрь цитоплазмы, могут прилагать силу к органеллам, таким как ядро, при приложении магнитного поля. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
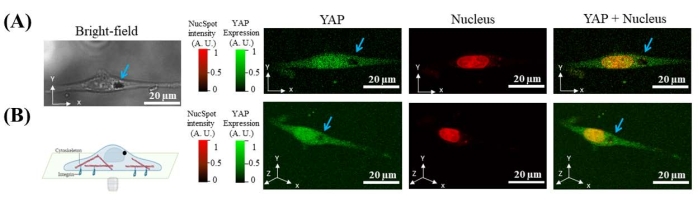
Рисунок 2: Репрезентативные изображения, показывающие магнитную микрогранулу (черная полая, заостренная синей стрелкой), интернализуется в клетку (обозначена YAP) и вне ядра. (A) X-Y поперечное сечение клетки YAP (зеленый), ядро (красный) и яркое поле. (B) 3D-реконструкция ячейки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Микрошарики, интернализируемые клетками, не влияют на ядерную форму и соотношение YAP N/C. (A) Репрезентативные изображения яркого поля и флуоресцентности клеток без микрогранулы, одной микрогранулы и мультимикрошной интернализации. Синие стрелки указывают на положение микрогранул внутри цитоплазмы. (B) Через 7 ч (n = 13), 12 ч (n = 62) и 24 ч (n = 40) кокультуры процент клеток, не показывающих микрогранулы, одной микрогранулы и мультимикрошной интернализации. (C) Ядерная цикличность не показывает существенной разницы между контрольными клетками и клетками с интернализацией микрогранул. Контроль No1 (без кокультуры микрогранул): циркулярность = 0,806 ± 0,037, n = 20; Контроль No2 (с кокультурой микрогранул, без интернализации микрогранул): Циркулярность = 0,806 ± 0,035, n = 22; Интернализация одного микрогранулы: циркулярность = 0,793 ± 0,048, n = 15; мультимикрошная интернализация: циркулярность = 0,780 ± 0,061, n = 7. (D) Соотношение YAP N/C не показывает существенной разницы (значение p = 0,667) между контрольными клетками (с кокультурой микрогранул, без интернализации микрогранул, коэффициент YAP N/C = 1,155 ± 0,074, n = 35) и клетками с интернализацией микрогранул (коэффициент YAP N/C = 1,140 ± 0,078, n = 36). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Прямое применение силы на ядре с актиновыми нитями и без них. (А) Клетки показывают актиновые нити (желтый). (А1) Изображение ядра, когда не прилагается сила. (А2) Изображение ядра после приложения силы. (А3) Перекрывающееся изображение ядерной границы до и после применения силы показывает ядерный отступ. (B) Клетки показывают нарушенные актиновые нити (желтый) после лечения Cyto D (2,5 мкМ, 1 ч). (В1) Изображение ядра, когда не прилагается сила. (В2) Изображение ядра после приложения силы. (В3) Перекрывающееся изображение ядерной границы до и после применения силы показывает ядерный отступ с нарушенным актиновым цитоскелетом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Пространственное и временное управление внутриклеточной магнитной микрогранулой. (А) Пара магнитов пространственно управляет магнитной микрогранулой. (А1) Ярко-полевое изображение границы ячейки (зеленая линия), ядерной границы (красная линия) и магнитной микрошарики (желтая линия) в позиции 1. (А2) Магнитная микрогранула вдавливает ядро в положении 1. (А3) Магнитная микрогранула перемещается в положение 2 (желтая линия). Позиция 1 показана в качестве ориентира (желтая пунктирная линия). (А4) Магнитная микрогранула вдавливает ядро в положении 2. (B) Пара магнитов временно контролирует магнитную микрогранулу. (В1) Изображение яркого поля клетки без силы, приложенной в точке времени I. (B2) Магнитная микрогранула прикладывает силу к ядру в точке времени II. (В3) Магнитная микрогранула высвобождает силу из ядра в точке времени III. (В4) Магнитная микрогранула прикладывает большую силу к ядру в точке времени IV. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
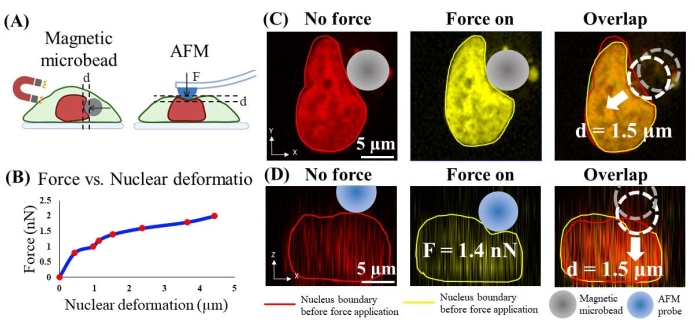
Рисунок 6. Калибровка приложенной силы микрогранулы на ядро с помощью углубления AFM. А) Схематическая иллюстрация процесса калибровки. Магнитная микрогранула применяет горизонтальное сжатие на ядре (слева), а зонд AFM делает вертикальные отступы на ядре. (B) Сила отступа ОВМ в сравнении с ядерной деформацией. (C) Репрезентативное изображение деформации ядра (1,5 мкм) до и после применения силы магнитной микрогранулой. (D) Репрезентативное изображение аналогичной деформации ядра (1,5 мкм) до и после отступа ОВМ с силой 1,4 нН. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 7: Репрезентативные данные, показывающие, что изменение соотношения YAP N/C индуцируется применением и высвобождением магнитной силы. (A) X-Y поперечное сечение YAP (зеленый) и ядра (красный) флуоресцентного изображения клетки без силы, силы включения и выключения. В состоянии force-on интенсивность цитоплазматического YAP уменьшается в месте, указанном желтой стрелкой, в то время как интенсивность ядерного YAP увеличивается. Коэффициент YAP N/C увеличивается. (B) Коэффициент YAP N/C увеличивается при включении силы (с 1,0791 до 1,2327) и уменьшается при выключении силы (с 1,2327 до 1,1548). Нормализованная интенсивность ядерных пятен показывает незначительные изменения при приложении силы (1,00117) и высвобождении (0,95578). (C) X-Z поперечное сечение YAP (зеленый) и ядра (красный) изображения клетки без силы, силы включения и выключения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 8: Изменение соотношения YAP N/C, вызванное применением магнитной силы. (A) При силе 0,8 нН клетки с интернализованными микрошариками показывают чистое изменение отношения YAP N/C = -0,030 ± 0,029, n = 11; контрольные ячейки показывают чистое изменение коэффициента YAP N/C = -0,003 ± 0,012, n = 9. При силе 1,4 нН клетки с интернализованными микрошариками показывают чистое изменение соотношения YAP N/C = 0,011 ± 0,040, n = 11; контрольные ячейки показывают чистое изменение коэффициента YAP N/C = 0,005 ± 0,005, n = 9. (B) При силе 0,8 нН клетки с интернализованными микрошариками показывают абсолютное чистое изменение отношения YAP N/C = 0,057 ± 0,017, n = 11; контрольные ячейки показывают чистое изменение коэффициента YAP N/C = 0,021 ± 0,007, n = 9. Разница существенная (значение p = 0,0093, **). При силе 1,4 нН клетки с интернализованными микрошариками показывают абсолютное чистое изменение отношения YAP N/C = 0,070 ± 0,020, n = 11; контрольные ячейки показывают чистое изменение коэффициента YAP N/C = 0,010 ± 0,003, n = 9. Разница значительна (значение p = 0.0007, ***) Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный рисунок 1: Ядерная форма и интенсивность ядерного окрашивания. (A) Без лечения Cyto D, (B) с лечением Cyto D и (C) Мертвой клеткой. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительное видео 1: Видео с ярким полем, показывающее процесс применения силы. Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Обсуждение
Интернализация магнитных микрошариков (раздел 2.2) имеет решающее значение, поскольку внеклеточные микрошарики не могут прикладывать силу непосредственно к ядру. Применение силы и визуализация (раздел 5.3) являются критическими шагами в этом эксперименте, и сила, необходимая для деформации ядра и индуцирования значимых биологических последствий, может зависеть от образца. Величина силы в этом эксперименте (0,8 нН и 1,4 нН) может быть дополнительно увеличена, чтобы вызвать ядерное механо-зондирование в менее чувствительных клетках.
Чтобы применить магнитную силу количественным образом с высокой пропускной способностью, интернализация одной микрогранулы является идеальным подходом. В этом исследовании процент клеток с интернализацией одной микрогранулы был аналогичным через 12 ч (26%) и 24 ч (28%), в то время как клетки без интернализации микрогранул были выше через 12 ч (53%), чем через 24 ч (20%) (рисунок 3B). Считается, что 12 ч является оптимальным временем для эксперимента с применением силы, потому что можно включить больше отдельных микрошариков, и клетки можно контролировать. Для различных клеточных линий и размеров микрогранул следует проверить время кокультуры и концентрацию микрогранул, чтобы определить соответствующие оптимальные условия.
В экспериментах микрошарики не были покрыты, чтобы специфически связываться с ядром. Поэтому сила, непосредственно передаваемая от микрогранул к ядру, скорее всего, только сжимающая. Результаты показывают, что соотношение YAP N/C увеличивает и уменьшает клеточную популяцию (рисунок 8A). Одна из возможных причин заключается в том, что магнитная сила, приложенная через микрошарики, может вызвать положительное или отрицательное изменение напряжения в цитоскелете и регулировать соотношение YAP N / C для увеличения или уменьшения, соответственно28. Предыдущие исследования показывают, что сила сжатия на ядре индуцирует увеличение коэффициента YAP N/C28. В будущих экспериментах, чтобы изучить прямое силовое зондирование ядра, цитоскелет может быть нарушен, чтобы устранить передачу силы от цитоскелета в ядро.
В существующих методах есть два потенциальных недостатка. Во-первых, в этих экспериментах 3D-движитель (рисунок 1A) использовался для регулировки движения бусин, которое контролируется конфокальной визуализацией в режиме реального времени и направлено на применение сжимающей силы на ядро. Однако из-за скользкой природы ядерной мембраны и сложной среды в цитоплазме направление приложенной силы шариков может быть не чисто сжимающим (т. е. не абсолютно перпендикулярным поверхности ядерной мембраны). Это несовершенство может привести к тому, что сила сдвига будет приложена к ядерной мембране. Во-вторых, современные микрошарики, используемые в этом исследовании, не сопряжены с антителом для связывания с ядром, потому что пространственная подвижность шариков имеет решающее значение в текущем эксперименте, чтобы продемонстрировать преимущество бесконтактного магнитного привода. Следовательно, современный метод не может применять напряжение к ядерной мембране.
В будущем (1) шарики с антителом против несприна-1 будут конъюгированы для специфического связывания с ядром. Это может гарантировать прямую и специфическую передачу силы между микрошариками и белками-мишенями. (2) Направление силы будет откалибровано путем манипулирования одной магнитной микрогранулой в мягком гидрогеле, встроенном в флуоресцентные шарики. 3D-смещение флуоресцентных шариков может быть использовано для расчета поля деформации гидрогеля и определения направления силы в зависимости от приложенного магнитного поля. После того, как микрогранула химически связана с ядром, применение силы с известным направлением определит тип силы (растяжение, сжатие или сдвиг). (3) 3D-визуализация ядерного окрашивания будет использоваться для построения 3D-имитационной FEM-модели ядра. Направление силы может быть проверено путем сравнения ядерной деформации до и после применения магнитной силы.
Уникальная методика, разработанная в этом исследовании, обеспечивает несколько потенциальных преимуществ: (1) По сравнению с вертикальным углублением зондами AFM, магнитные микрошарики могут прилагать силу в любом направлении. Клетки, культивируемые на поверхностях 2D-подложки, могут иметь гетерогенное распределение белка и ориентацию на своих вертикальных и горизонтальных поверхностях плазматической мембраны и ядерной оболочки. Применение силы по горизонтали может вызвать ранее ненаблюдаемые реакции механочувствительного действия. (2) Как только микрогранулы функционально покрыты для связывания с ядрами, как толкающие, так и притягивающие силы могут быть применены непосредственно к ядру для дальнейшего изучения дифференциального ядерного механо-зондирования из-за различных направлений силы. (3) Контролируя специфическое связывание микрогранул с определенными белками ядерной оболочки, можно выяснить ранее недостаточно изученные механизмы зондирования ядерной силы. Новые данные показывают, что ядро, вероятно, является механосенсором36, а ядерное механо-зондирование является наиболее прямым регулятором транслокации YAP28. Активно изучается механизм ядерно-регулируемой транслокации YAP и предлагается несколько кандидатов механосенсорных или параметров в ядре, включая размер ядернойпоры 28, ядерную форму25,61, комплекс ЛИНК и напряжение ядерной оболочки20. Манипулирование магнитными микрошариками открывает возможность детального исследования таких механизмов путем непосредственного применения силы на комплекс ЛИНК и контролируемых норм натяжения и формы ядерной оболочки. (4) В дополнение к приложению сил к ядру, микрошарики также подходят для сконструирования для связывания с внутренней стороной плазматической мембраны, чтобы выявить, как внутриклеточные домены мембранных белков и их комплекс реагируют на биофизические сигналы.
Таким образом, в этой статье продемонстрирован метод, который (1) доставляет микроразмерные железные микрошарики в цитоплазму, не влияя на ядерную морфологию и функции белка, (2) прикладывает силу к ядру магнитными микрошариками и (3) выполняет конфокальную флуоресцентную визуализацию живых клеток во время применения силы. Эти неинвазивные инструменты открывают возможности для прямых эпигенетических манипуляций с органеллами в отдельных клетках, опроса на основе визуализации ядра на основе сверхвысокого разрешения и детального исследования силовой регулируемой организации 3D-хромосом (в сочетании с Hi-C: захват подтверждения хромосом с высоким разрешением) и перепрограммирования в контексте клеточной физиологии и патобиологии.
Раскрытие информации
Нет никаких конфликтов интересов, о которых можно было бы заявить.
Благодарности
Этот проект финансируется UF Gatorade Award Start-up Package (X. T.), UFHCC Pilot Award (X. T. и Dr. Dietmar Siemann), UF Opportunity Seed Fund (X. T.) и UFHCC University Scholars Program (H. Y. Wang). Мы искренне ценим интеллектуальные дискуссии и техническую поддержку со стороны д-ра Джонатана Лихта (UFHCC), д-ра Рольфа Ренне (UFHCC), д-ра Кристофера Вульпе (UFHCC), д-ра Бланки Шармы (BME), д-ра Марка Шеплака (MAE & ECE), д-ра Даниэля Ферриса (BME), д-ра Малисы Сарнтиноранонт (MAE), д-ра Ашока Кумара (MAE), д-ра Бенджамина Кеселовски (BME), д-ра Брента Гила (RSC), д-ра Филиппа Фэна (ECE), Д-р Грегори А. Худалла (BME), д-р Стивен Гивизцани (OSSM), д-р Йенисель Круз-Алмейда (CDBS), д-р Роджер Филлингим (CD-BS), д-р Роберт Кодл (OMS), д-р Джон Нойберт (DN-OR), д-р Джастин Хилиард (нейрохирургия), д-р Тянь Хэ (Гарвардский университет), д-р Юхуа Тан (Гонконгский политехнический университет), д-р Джесси Л-С Ау (Институт фармакологии количественных систем), д-р Дэвид Хан (Университет Аризоны), и Группа поддержки компании «Никон» (д-р Хосе Серрано-Велес, Ларри Кордон и Джон Экман). Мы глубоко благодарны за эффективную поддержку со стороны всех членов исследовательских лабораторий Tang' s, Yamaguchi's, Sharma's, Au's, Siemann и Guan, а также всех сотрудников отдела UF MAE.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.05 % Trypsin | Corning | 25-051-CI | |
| 25 cm2 flask | Corning | 156340 | |
| 7-µm mean diameter carbonyl iron microbeads | N/A | N/A | |
| A1R confocal system | Nikon | ||
| Carbonyl Iron Powder CM | BASF | 30042253 | Magnetic microbead |
| Culture medium (RPMI-1640) | Gibco | 11875093 | |
| Desktop Computer | Dell | with Windows 10 operating system | |
| Environmental chamber TIZB | Tokai Hit | TIZB | |
| Fetal bovine serum (FBS) | Gibco | 26140 | |
| Fiji ImageJ | National Institutes of Health and the Laboratory for Optical and Computational Instrumentation | ||
| Glass-bottom petri dish | MatTek | P35G-1.5-14-C | |
| Magnet | K&J Magnetics, Inc. | D99-N52 | |
| Monochrome Camera | FLIR | BFS-U3-70S7M-C | |
| NIS-Elements software platform | Nikon | software platform | |
| Nucleus mask ImageJ macro | https://github.com/KOLIUG/Nuclear mask | ||
| NucSpot Live 650 | Biotium | #40082 | Nuclear stain |
| Penicillin-streptomycin | Gibco | 15140122 | |
| Phosphate buffered saline (PBS) | Gibco | 10010023 | |
| Ti2-E inverted microscope | Nikon | ||
| XYZ mover (CAD files) | https://github.com/KOLIUG/XYZ-mover |
Ссылки
- Discher, D. E., Janmey, P., Wang, Y. Tissue cells feel and respond to the stiffness of their substrate. Science. 310 (5751), 1139-1143 (2005).
- Janmey, P. A., Fletcher, D. A., Reinhart-King, C. A. Stiffness sensing by cells. Physiological Reviews. 100 (2), 695-724 (2020).
- Bajaj, P., Tang, X., Saif, T. A., Bashir, R. Stiffness of the substrate influences the phenotype of embryonic chicken cardiac myocytes. Journal of Biomedical Materials Research Part A. 95 (4), 1261-1269 (2020).
- Tang, X., et al. Mechanical force affects expression of an in vitro metastasis-like phenotype in HCT-8 cells. Biophysical Journal. 99 (8), 2460-2469 (2010).
- Hofmann, M., et al. Lowering of tumor interstitial fluid pressure reduces tumor cell proliferation in a xenograft tumor model. Neoplasia. 8 (2), 89-95 (2006).
- Yankaskas, C. L., et al. The fluid shear stress sensor TRPM7 regulates tumor cell intravasation. Science Advances. 7 (28), (2021).
- Kim, E., et al. A biosynthetic hybrid spidroin-amyloid-mussel foot protein for underwater adhesion on diverse surfaces. ACS Applied Materials and Interfaces. 13 (41), 48457-48468 (2021).
- Tajik, A., et al. Transcription upregulation via force-induced direct stretching of chromatin. Nature Materials. 15 (12), 1287-1296 (2016).
- Lee, J., Abdeen, A. A., Tang, X., Saif, T. A., Kilian, K. A. Matrix directed adipogenesis and neurogenesis of mesenchymal stem cells derived from adipose tissue and bone marrow. Acta Biomaterialia. 42, 46-55 (2016).
- Lee, J., Abdeen, A. A., Tang, X., Saif, T. A., Kilian, K. A. Geometric guidance of integrin mediated traction stress during stem cell differentiation. Biomaterials. 69, 174-183 (2015).
- Ren, B., et al. Study of sacrificial ink-assisted embedded printing for 3D perfusable channel creation for biomedical applications. Applied Physics Reviews. 9 (1), 011408(2022).
- Coyle, S., et al. Cell alignment modulated by surface nano-topography-Roles of cell-matrix and cell-cell interactions. Acta Biomaterialia. 142, 149-159 (2022).
- Sawada, Y., et al. Force sensing by mechanical extension of the Src family kinase substrate p130Cas. Cell. 127 (5), 1015-1026 (2006).
- Aragona, M., et al. A mechanical checkpoint controls multicellular growth through YAP/TAZ regulation by actin-processing factors. Cell. 154 (5), 1047-1059 (2013).
- Tang, X., et al. Specific and non-specific adhesion in cancer cells with various metastatic potentials. Mechanobiology of Cell-Cell and Cell-Matrix Interactions. , Springer. Boston, MA. 105-122 (2011).
- Tang, X., Saif, T. A. Adhesivity of colon cancer cells during in vitro metastasis. International Journal of Applied Mechanics. 5 (03), 1350025(2013).
- Chaudhuri, O., et al. Effects of extracellular matrix viscoelasticity on cellular behaviour. Nature. 584 (7822), 535-546 (2020).
- Ohashi, K., Fujiwara, S., Mizuno, K. Roles of the cytoskeleton, cell adhesion and rho signalling in mechanosensing and mechanotransduction. The Journal of Biochemistry. 161 (3), 245-254 (2017).
- Hamill, O. P., Martinac, B. Molecular basis of mechanotransduction in living cells. Physiological Reviews. 81 (2), 685-740 (2001).
- Liang, C., et al. Towards an integrative understanding of cancer mechanobiology: Calcium, YAP, and microRNA under biophysical Forces. Soft Matter. 18, 1112-1148 (2022).
- Tan, Y., et al. Matrix softness regulates plasticity of tumour-repopulating cells via H3K9 demethylation and Sox2 expression. Nature Communications. 5 (1), 1-12 (2014).
- Poh, Y., et al. Dynamic force-induced direct dissociation of protein complexes in a nuclear body in living cells. Nature Communications. 3 (1), 1-10 (2012).
- Tang, X., et al. A mechanically-induced colon cancer cell population shows increased metastatic potential. Molecular Cancer. 13 (1), 1-15 (2014).
- Wu, J., et al. Effects of dynein on microtubule mechanics and centrosome positioning. Molecular Biology of the Cell. 22 (24), 4834-4841 (2011).
- Tang, X., Ali, M. Y., Saif, M. T. A novel technique for micro-patterning proteins and cells on polyacrylamide gels. Soft Matter. 8 (27), 7197-7206 (2011).
- Tang, X., Bajaj, P., Bashir, R., Saif, T. A. How far cardiac cells can see each other mechanically. Soft Matter. 7 (13), 6151-6158 (2011).
- Tang, X., et al. Mechanical force affects expression of an in vitro metastasis-like phenotype in HCT-8 cells. Biophysical Journal. 99 (8), 2460-2469 (2010).
- Elosegui-Artola, A., et al. Force triggers YAP nuclear entry by regulating transport across nuclear pores. Cell. 171 (6), 1397-1410 (2017).
- Gudipaty, S. A., et al. Mechanical stretch triggers rapid epithelial cell division through Piezo1. Nature. 543 (7643), 118-121 (2017).
- Tang, X., et al. Attenuation of cell mechanosensitivity in colon cancer cells during in vitro metastasis. PLoS One. 7 (11), 50443(2012).
- Cha, C., et al. Top-down synthesis of versatile polyaspartamide linkers for single-step protein conjugation to materials. Bioconjugate Chemistry. 22 (12), 2377-2382 (2012).
- Chen, X., et al. Glycosaminoglycans modulate long-range mechanical communication between cells in collagen networks. Proceedings of the National Academy of Sciences of the United States of America. 119 (15), (2022).
- Boyle, J. J., Pless, R. B., Thomopoulos, S., Genin, G. M. Direct estimation of surface strain fields from a stereo vision system. Journal of Biomechanical Engineering. 142 (7), 074503(2020).
- Kim, S., Uroz, M., Bays, J. L., Chen, C. S. Harnessing mechanobiology for tissue engineering. Developmental Cell. 56 (2), 180-191 (2021).
- Driscoll, T. P., et al. Cytoskeletal to nuclear strain transfer regulates YAP signaling in mesenchymal stem cells. Biophysical Journal. 108 (12), 2783-2793 (2015).
- Guilluy, C., et al. Isolated nuclei adapt to force and reveal a mechanotransduction pathway in the nucleus. Nature Cell Biology. 16 (4), 376-381 (2014).
- Vashisth, M. Scaling concepts in 'omics: Nuclear lamin-B scales with tumor growth and often predicts poor prognosis, unlike fibrosis. Proceedings of the National Academy of Sciences of the United States of America. 118 (48), (2021).
- Roberts, A. B., et al. Tumor cell nuclei soften during transendothelial migration. Journal of Biomechanics. 121, 110400(2021).
- Denais, C. M., et al. Nuclear envelope rupture and repair during cancer cell migration. Science. 352 (6283), 353-358 (2016).
- Raab, M., et al. ESCRT III repairs nuclear envelope ruptures during cell migration to limit DNA damage and cell death. Science. 352 (6283), 359-362 (2016).
- Lammerding, J., et al. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. The Journal of Clinical Investigation. 113 (3), 370-378 (2004).
- Shelby, J., Patrick, J., Edgar, S., Chiu, D. T. Monitoring cell survival after extraction of a single subcellular organelle using optical trapping and pulsed-nitrogen laser ablation. Photochemistry and Photobiology. 81 (4), 994-1001 (2005).
- Caspi, A., Granek, R., Elbaum, M. Diffusion and directed motion in cellular transport. Physical Review E. 66 (1), 011916(2002).
- Svoboda, K., Block, S. M. Biological applications of optical forces. Annual Review of Biophysics and Biomolecular Structure. 23 (1), 247-285 (1994).
- Rohrbach, A. Stiffness of optical traps: quantitative agreement between experiment and electromagnetic theory. Physical Review Letters. 95 (16), 168102(2005).
- Neuman, K. C., et al. Characterization of photodamage to Escherichia coli in optical traps. Biophysical Journal. 77 (5), 2856-2863 (1999).
- Kanger, J. S., Subramaniam, V., Driel, R. V. Intracellular manipulation of chromatin using magnetic microbeads. Chromosome Research. 16 (3), 511-522 (2008).
- Bausch, A. R., et al. Local measurements of viscoelastic parameters of adherent cell surfaces by magnetic microbead microrheometry. Biophysical Journal. 75 (4), 2038-2049 (1998).
- Fisher, J. K., et al. Three-dimensional force microscope: a nanometric optical tracking and magnetic manipulation system for the biomedical sciences. Review of Scientific Instruments. 76 (5), 053711(2005).
- Berret, J. -F. Local viscoelasticity of living cells measured by rotational magnetic spectroscopy. Nature Communications. 7, 10134(2016).
- Hu, B., Dobson, J., El Haj, A. J. Control of smooth muscle α-actin (SMA) up-regulation in HBMSCs using remote magnetic microbead mechano-activation. Nanomedicine: Nanotechnology, Biology and Medicine. 10 (1), 45-55 (2014).
- Kamiyama, D., et al. Versatile protein tagging in cells with split fluorescent protein. Nature Communications. 7, 11046(2016).
- Feng, S., et al. Improved split fluorescent proteins for endogenous protein labeling. Nature Communications. 8, 370(2017).
- Leonetti, M. D., Sekine, S., Kamiyama, D., Weissman, J. S., Huang, B. A scalable strategy for high-throughput GFP tagging of endogenous human proteins. Proceedings of the National Academy of Sciences of the United States of America. 113 (25), 3501-3508 (2016).
- Tulpule, A., et al. Kinase-mediated RAS signaling via membraneless cytoplasmic protein granules. Cell. 184 (10), 2649-2664 (2021).
- Ansari, A. M., et al. Cellular GFP toxicity and immunogenicity: potential confounders in in vivo cell tracking experiments. Stem Cell Reviews and Reports. 12 (5), 553-559 (2016).
- Gibson, T. J., Seiler, M., Veitia, R. A. The transience of transient overexpression. Nature Methods. 10 (8), 715-721 (2013).
- Ratz, M., et al. CRISPR/Cas9-mediated endogenous protein tagging for RESOLFT super-resolution microscopy of living human cells. Scientific Reports. 5, 9592(2015).
- Suzuki, H., Ho, C., Kasagi, N. A chaotic mixer for magnetic microbead-based micro cell sorter. Journal of Microelectromechanical Systems. 13 (5), 779-790 (2004).
- Luo, Q., et al. All-optical mechanobiology interrogation of yes-associated protein in human cancer and normal cells using a multi-functional system. Journal of Visualized Experiments. (178), e62934(2021).
- Koushki, N., et al. Lamin A redistribution mediated by nuclear deformation determines dynamic localization of YAP. BioRxiv. , (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены
Мы используем файлы cookie для улучшения качества работы на нашем веб-сайте.
Продолжая пользоваться нашим веб-сайтом или нажимая кнопку «Продолжить», вы соглашаетесь принять наши файлы cookie.
