Method Article
Şeker Kamışı Kök Sistemlerini Karakterize Etmek için Çok Yönlü Fenotipleme Yaklaşımları
Bu Makalede
Özet
Kök sistemi özelliklerini karakterize etmek, özellikle şeker kamışında henüz emekleme aşamasında olan araştırma alanlarından biridir. Şeker kamışı köklerini kesin olarak fenotip yapmak için birden fazla yaklaşımın entegre edilmesi, geleneksel ve moleküler ıslah için tanımlanmış özelliklerin ve mekanizmaların kullanılmasını sağlayan kapsamlı ve bütünsel sonuçlara yol açar.
Özet
Kökler, su ve besin maddelerinin birincil iletkenleridir ve stresli ortamlarda büyüme ve verimin sürdürülmesinde hayati bir rol oynar. Bitki köklerinin incelenmesi, özellikle şeker kamışı (Saccharum spp.) için geçerli olan yerinde değerlendirme ve numune almada metodolojik zorluklar ortaya çıkarmaktadır. 1920'lerde geleneksel yöntemler, şeker kamışı kök sistemlerindeki genotipik varyasyonu belgeledi, daha sonra yakın zamana kadar şeker kamışı kök özellikleri hakkında çok az çalışma bildirildi. Morfolojiye ek olarak, allelopatik etkiler ve/veya mikrobiyal simbiyoz için afinite dahil olmak üzere rizosfer özellikleri, bitki oluşumunu ve hayatta kalmasını belirler.
Sonuç olarak, kök sistemleri şeker kamışının yer üstü verimliliğini tanımlar. İklime dayanıklı çeşitlerin itici gücüyle, şeker kamışının kök sistemi özelliklerindeki değişkenliği keşfetmek ve kullanmak daha alakalı hale geliyor. Bu makale, Hindistan Tarımsal Araştırma Konseyi-Şeker Kamışı Yetiştirme Enstitüsü'ndeki (ICAR-SBI) bir bilim adamı ekibi tarafından istihdam edilen, hendek örneklemesi ile saha kazısı, kök çekirdek örnekleyicisinin kullanımı, kök örneklemesi için yükseltilmiş platformlar ve hidroponik kültür altında bitki yetiştirme dahil olmak üzere şeker kamışı kökü fenotiplemesi için çok yönlü yaklaşımları açıklamaktadır.
Bitki köklerini doğal yetişme ortamlarında değerlendirmek için hendek örneklemesi ile saha kazısı zorunludur. Saha koşullarını simüle eden yükseltilmiş platformların ve bir kök çekirdek örnekleyicinin kullanılması, zaman içinde önemli bir azalma, tek tip numune boyutu ve daha az kök materyali kaybı ile alternatif yaklaşımlardır. Hidroponik bitki kültürü, organik bileşiklerin eksüdasyonu ve mikrobiyal etkileşimler dahil olmak üzere morfoloji, anatomik özellikler ve rizosfer biyolojisinin incelenmesine izin verir. Farklı örnekleme yöntemleri kullanılarak yapılan farklı deneylerden elde edilen veriler, şeker kamışının kök sistem özellikleri hakkındaki bilgi zenginliğine katkıda bulunur.
Giriş
Önemli bir besin ve biyoenerji kaynağı olan şeker kamışı (Saccharum spp.), tropikal ve subtropikal iklim koşullarına sahip birçok ülkede yetiştiriciliğe uygun önemli bir endüstriyel üründür. Karbon asimilasyonu için C4 fotosentetik yolu sayesinde şeker kamışı, su ve gübre gibi çiftlik girdilerini verimli bir şekilde kullanarak oldukça verimlidir. Şeker kamışının hasat sonrası işlenmesi, yan ürünleri olan melas, etanol ve enerjinin yanı sıra şeker ve jaggery gibi ekonomik açıdan değerli ürünler verir. Şeker kamışı, toplam ekilebilir arazinin yaklaşık% 1,5'i olan 25.97 Mha'lık bir alanda yaklaşık 100 ülke tarafından üretilmektedir. Hindistan tek başına dünya şeker kamışı üretiminin %16'sına (yaklaşık 306 Mt) katkıda bulunuyor ve ortalama 70 t·ha-1 1 verimlilikle katkıda bulunuyor. Şeker kamışı üretimini büyük ölçüde etkileyen başlıca abiyotik stresler arasında su açıkları, su birikintileri, aşırı sıcaklıklar ve besin eksikliği, tuzluluk, sodyukluk ve alkalinite gibi toprak özellikleri bulunur. Abiyotik strese dayanıklı mahsuller geliştirmenin en büyük zorluğu, stres koşulları altında önemli bir verim avantajı sağlayan belirli özellikleri belirlemektir.
Şeker kamışı fizyolojisinin, kamış verimliliğini büyük ölçüde etkileyen kök-sürgün ilişkisi de dahil olmak üzere çeşitli yönleri tam olarak anlaşılamamıştır. Şeker kamışı kökü, sürgünler kadar iyi çalışılmamıştır, ancak set kökleri, sürgün kökleri ve yetişkin kökleri gibi farklı türler, değişen işlevlerle gelişimsel olarak farklı olabilir. Çimlenme2 sırasında ortaya çıkan sett köklerinin sayısı ve uzunluğu ile ilgili genotipik farklılıklar gözlenmiştir. Sett kökleri, şeker kamışı tomurcuklarının çimlenmesinde rol oynar, erken mahsul oluşumunu sağlar ve daha sonra gelişmekte olan sürgününtabanından çıkan sağlam sürgün kökleri ile değiştirilir 3. Sett köklerinde gözlenen ince dallar, genç bitkilerin sabitlenmesine yardımcı olur ve yerini sürgün köklerine bırakana kadar su ve besin maddelerinin emilmesine yardımcı olur. Sett köklerine benzer şekilde, sürgün kökleri de bastonun alt, genişlememiş boğum aralarında bulunan kök primordiasından kaynaklanır.
Sürgün kökleri bitkide daha uzun süre kaldığı için set köklerine göre 4x-10x daha kalındır. Sürgün kökleri, şeker kamışının tek kök sistemini oluşturur ve daha fazla büyüme ve gelişmede önemli bir rol oynar. Sürgün köklerinin canlılığı, bitkinin genel vejetatif gücü ile pozitif olarak ilişkilidir. Sett köklerinin ve sürgün köklerinin devrinden kaynaklanan köklerin sürekli gelişimi, mevcut çevre koşullarına sürekli uyum sağlayan şeker kamışının "yetişkin kök sistemine" yol açar. Genel olarak, daha derin, daha üretken bir kök sistemi, mahsul için daha sığ bir kök dağılımından daha fazla su ve besin sağlar. Periyodik diseksiyonlar, toprak nem içeriği yüksek olduğunda sığ kök sistemlerinin gözlendiğini, buna karşın su tablası düştükçe çok daha derin bir kök sisteminin geliştiğini ortaya koymuştur2. Şeker kamışındaki kök sistemi, mahsulün hasat edilmesinden sonra bile aktif kalır ve yeraltı tomurcuklarından yeni sürgün kökleri çıkana kadar ratoon mahsulünün büyümesine katkıda bulunur4. Kök açısı ve kök dallanma seviyesi, bitki kökleri tarafından keşfedilen toprağın hacmini belirleyen iki önemli faktördür. Genotipik bir özellik olan kök açısı, biyotik ve abiyotik streslere toleransı artırmak için geleneksel ıslah veya moleküler yaklaşımlarla değiştirilebilir. Aksine, kök dallanma seviyesi çoğunlukla çevreden etkilenir ve kök gelişiminin periyodik olarak izlenmesini ve yerel toprak koşullarına tepkisini gerektirir.
Şeker kamışı köklerinin anatomik özellikleri, genotip ve çevre ile ilgili farklılıkları belirlemek için incelenmiştir. Şeker kamışındaki sett köklerinin anatomisi, mısır gibi diğer otlardaki olgun köklerinkine benzer, burada korteks düzenli bir düzende iyi farklılaşmış hücre katmanları içerir. Endodermis suberize edilir, ardından tek katmanlı bir perisikl gelir. Maksi elementleri, radyal olarak düzenlenmiş ve floem grupları ile serpiştirilmiş ana iletkenler veya su ve besin iyonlarıdır, ikincisi iki eşlik eden hücreye sahip bir elek elemanı içerir. Farklılaşmamış hücrelerin büyük merkezi kütlesi kök özünü oluşturur. Şeker kamışı çeşitlerinin farklı anatomik özellikleri, kök hidrolik özelliklerine karşılık gelir ve böylece su hareketini etkiler. Şeker kamışının kök anatomik özelliklerindeki farklılıklar üzerine yapılan erken çalışmalar, düşük nem stresi koşulları altında, endodermisin hemen içindeki katmanlarda, öz ile vasküler bölge arasında ve damarların etrafındaki katmanlarda hücre duvarında belirgin kalınlaşma gözlendiğini ortaya koymuştur5. Bu tür kalınlaşmış hücreler, özsuyun geriye doğru akışını önlemek ve stres sırasında mekanik mukavemet için bir adaptasyon olabilir.
Şeker kamışının kuraklık direncinde rol oynayan bazı önemli özellikler arasında ekzodermal katmanların nispi kalınlığı ve sayısı, korteksin stele oranı, korteksteki hücreler arası boşluklar ve kalınlaşmış kök kıl uçları yer alır. Kortikal hücrelerin kapladığı alanın, sürgün köklerinin yıldız dokularının kapladığı alana oranları, şeker kamışı çeşitleri arasında önemli ölçüde farklıdır ve stelin alanına göre geniş değişkenlik gösterir6. Şeker kamışı köklerinin hidrolik iletkenliği, sürgün köklerindeki metoksilem elementlerinin büyüklüğü ve sayısı ile ilgilidir. Kök içindeki hidrofobik hücre katmanlarının apoplastik su hareketi bölgelerini tanımlaması muhtemeldir. Suberize Casparian bantları, hidrofobik bariyerler olarak görev yapan endodermiste ve hipodermiste (ekzodermis olarak adlandırılır) bulunur. Kortikal hücrelerin parçalanması, gelişim yaşına bakılmaksızın yaşlı köklerde ve hipoksik koşullara maruz kalan bitkilerde lizijen aerenkima oluşumuna yol açar. Su basması stresi sırasında aerenkima oluşumu, dayanıklı çeşitlerdebüyümenin sürdürülmesi ile ilişkilidir 7.
Erianthus arundinaceus [Retzius] Jeswiet (Saccharum spp.) köklerinin morfolojisi ve anatomisi, çevresel streslere karşı güçlü toleransı ile ilişkilidir8. Erianthus arundinaceus kökleri, daha derin toprak bölgelerinden su ve besin iyonlarının alımını kolaylaştırmak için yoğun kök tüyleri ile dik açılarda dağılmış düğüm kökleri sergiler. Derin kök sistemi, dik büyüme açılarıyla büyüyen birçok düğüm kökünden oluşur. Düğüm köklerinin çapı, büyük ksilem damarlarının boyutu ve sayısı ile ilişkilidir, ilki 0,5 mm ila 5,0 mm arasında değişir. Bu düğüm kökleri ayrıca, dış kortekste (ekzodermis) odunsu sklerenkim, korteksin orta kısmında lizijen aerenkim ve steldeki nişasta granüllerini gösteren bir hipodermis ile rizomatöz bir kılıf oluşturur. Mimari ve morfolojik özelliklere ek olarak, kök sızıntılı organik bileşikler, makul allelopatik etkiler ve / veya mikrobiyal simbiyoz için afinite ile bitki çimlenmesini, oluşumunu ve hayatta kalmasını belirlemede önemli bir rol oynar.
Kök enzimatik aktivitesi ve kök kapağı pigmentasyonu ve yaralanma üzerine gençleşme potansiyeli dahil olmak üzere morfolojinin daha ince ayrıntıları, hidroponik kültür9 altında yetiştirilen şeker kamışı çeşitlerinde belgelenmiştir. Kök büyümesi, hem kök sisteminin şekli hem de boyutu açısından toprak ortamındaki değişikliklere oldukça plastik bir tepki gösterir. En verimli şeker kamışı çeşidi, stresli koşullarda daha iyi hayatta kalmaya yardımcı olan, buna bağlı olarak daha az sayıda köke sahip, az sayıda veya optimal sayıda sürgün içeren bir çeşittir. Bu nedenle, kök sisteminin sistematik çalışması, herhangi bir ürün iyileştirme programının önemli bir bileşenini oluşturmalıdır10. Köklere odaklanan deneylerin çoğu çoğunlukla gelişimsel yönlere dayanırken, fonksiyonel plastisiteye odaklanma genellikle eksiktir11. Yapısal dağılımın yanı sıra, fonksiyonel kök plastisitesi stres altında hayatta kalmada çok önemli bir rol oynar ve bu nedenle, yetiştiricileri abiyotik stres toleransı için seçim hattına kök sistemi özelliklerini dahil etme ve şeker kamışının sağlamlığını artırma çabalarında destekleyecektir.
Stresli ortamlarda büyüme ve verimin sürdürülmesindeki önemi göz önüne alındığında, şeker kamışının kök sistemi özelliklerindeki doğal değişkenliği araştırmak ve kullanmak önemlidir. Üstün kök sistemleri kazandıran bileşen özelliklerinin ve mekanizmalarının seçimine yapılan vurgu, değişen iklim koşullarında daha iyi mahsul performansı için ileriye giden yoldur. Fenotipik değerlendirme uzun ve maliyetli bir süreçtir; Bununla birlikte, çok yönlü yaklaşımların entegrasyonu, mahsul iyileştirmedeki faydasına muazzam bir değer katacaktır. Bu el yazmasında, şeker kamışında kök fenotiplemesi için dört farklı yaklaşım tanımlanmıştır, her biri kendi yararları ve dezavantajları vardır, bu da kapsamlı ve bütünsel sonuçlara ulaşmak için ortak bir çabanın gerekli olduğunu ima eder.
Protokol
1. Hendek örneklemesi ile saha kazısı
- Tarlada ticari şeker kamışı melezlerini (bundan böyle "çeşitler" olarak anılacaktır), 120 cm'lik bir sıra aralığında, 90 cm'si sıralar içinde olacak şekilde, önerilen uygulama paketini (POP) izleyerek yetiştirin.
- Mahsulün olgunluk aşamasının sonunda, tarlada bir hendek (1,5 m derinliğinde ve 1,0 m genişliğinde) kazmak için bir ekskavatör kullanın. Sürekli su jeti ile köklere zarar vermeden kök bölgelerinden toprakların temizlenmesini sağlayın (Şekil 1).
- Yapışan toprak gevşediğinde, kamışı kök sistemi ile birlikte sökün ve kök sayısının, kök uzunluğunun, hacminin ve ağırlığının manuel olarak ölçülmesi için laboratuvara götürün.

Şekil 1: Köklerin arazi kazısı için hendek örnekleme yöntemi. (A) Tarla boyunca kazılmış yana doğru hendek, (B) su jeti ve (C) açmanın derinliğini gösteren iç görünüm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. Örnekleme hatalarını azaltmak için kök çekirdek örnekleyici
- Tarlada şeker kamışı kökü örneklemesi için yumuşak çelik (MS) malzeme kullanılarak imal edilmiş, 61 cm yüksekliğinde ve 16 cm çapında, 8 kg ağırlığında silindirik bir kök çekirdek örnekleyici kullanın. Toprağa yerleştirirken kolay nüfuz etmesini kolaylaştırmak için örnekleyicinin alt kenarında keskin bir kenar sağlayın. Örnekleyiciyi kaldırmak için üst kısma 3 cm çapında bilezikler sağlayın (Şekil 2).
- Tarladaki şeker kamışı çeşitlerini, iyi mahsul oluşumu ve büyümesini sağlamak için önerilen POP'u takip ederek, 120 cm sıra aralığında, sıra içinde 90 cm olacak şekilde ekilen iki tomurcuklu setlerden yetiştirin.
- Mahsulün olgunluk aşamasında, numune alma cihazının üst kenarını birincil sürgüne/bastona sabitleyin ve istenen toprak derinliğine (45 cm) ulaşmak için sürekli olarak çekiçleyin. Tüm toprak kütlesini örnekleyiciye kaldırın ve yapışan kökleri ayırmak için akan su altında dikkatlice yıkayın.
- Kökleri iyice yıkadıktan sonra, manuel ölçümle ve ayrıca referans verilen yazılımı kullanarak ilgili sayısallaştırılmış görüntüleri taramak ve analiz etmek için kökleri şeffaf tepsilere yayarak hacmi, yüzey alanını, uzunluğu ve ağırlığı kaydedin (bkz. Malzeme Tablosu).

Şekil 2: Kök çekirdek örnekleyici. (A) Boyutlar, (B) üstten görünüm ve (C) örnekleme alanı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. Farklı fenofazlarda örneklemeyi kolaylaştırmak için kök fenotipleme yapısı
- Şeker kamışı köklerinden numune almak için 4,5 m x 10,1 m boyutlarında üç bitişik bölmeden oluşan bir kök fenotipleme yapısı oluşturun ve yeraltı kök sistemini (80-100 cm derinliğe kadar) ortaya çıkarmak için yan duvarların manuel olarak sökülmesi için hükümler oluşturun (Şekil 3). Yan duvarları 1,8 m uzunluğunda, 30 cm genişliğinde ve 4 cm kalınlığında prekast plakalarla inşa edin.
- Yapının tarla toprağı ile doldurun ve sıkıştırın, ~ 20 cm'lik bir üst boşluk bırakın ve toprağın havalanmasını kolaylaştırmak için yeterli drenaj delikleri bırakın.
- Saccharum officinarum L., Saccharum spontaneum L., Saccharum barberi Jesw., Saccharum sinense Roxb. ve Saccharum robustum Brandes ve Jeswiet ex Grassl'ı içeren germplazm klonlarının tomurcuk cipslerini ekin. (bundan böyle "Saccharum spp. klonları" olarak anılacaktır) ve köklendirme ortamı içeren protraylarda 30 gün boyunca çimlenmelerine izin verin (kırmızı toprak: çiftlik gübresi: kum = 2: 2: 2: 1). İyi mahsul oluşumu ve büyümesini sağlamak için önerilen POP'u izleyerek, 90 cm'lik bir sıra aralığında, 60 cm'lik bir sıra aralığında, düzgün ve sağlıklı yerleşimleri yapıya nakledin.
- Biçimlendirici (ekimden 60-120 gün sonra [DAP]) ve büyük büyüme (120-150 DAP) aşamaları sırasında, prekast plakalardan yapılmış yan duvarları manuel olarak çıkarın, ardından kökleri açığa çıkarmak için su jeti sürekli olarak püskürtülür.
- Tüm kök sistemini sökün ve uzunluk, hacim ve ağırlığın manuel ölçümü için laboratuvara götürün ve referans verilen yazılımda karşılık gelen sayısallaştırılmış görüntüleri taramak ve analiz etmek için kökleri şeffaf tepsilere yayın (bkz. Malzeme Tablosu).
- Bölmelerden birinde sulamayı durdurarak kuraklık stresi uygulayın ve su basması stresini simüle etmek için toprak doygunluğunu korumak için ikinci bölmedeki drenaj deliklerini kapatın. Tarla kapasitesini korumak ve kontrol görevi görmek için üçüncü bölmeyi önerilen POP'a göre sulayın.

Şekil 3: Kök fenotipleme yapısı. (A) Boyutlar, (B) üç bölmeye genel bakış ve (C) bir bölmenin görünümü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
4. Rizosfer biyolojisini incelemek için bitkilerin hidroponik kültürü
- Kök biyolojisinin daha ince ayrıntılarını incelemek için şeker kamışı yetiştirmeye elverişli, çevre kontrollü bir serada şirket içi bir hidroponik sistem üretin. Akvaryum pompaları tarafından sağlanan havalandırma ile 15 cm x 20 cm x 20 cm boyutlarındaki cam tanklara ~ 50 L modifiye Hoagland'ın besin solüsyonu (Tablo 50) ekleyin (Şekil 4).
- Şeker kamışı çeşitlerinin ve Saccharum spp. klonlarının tomurcuk parçalarını ekin ve kompost hindistan cevizi özü içeren tepsilerde 30 gün boyunca çimlenmelerine izin verin. Düzgün ve sağlıklı çökeltmeleri, tank başına üç çökeltme sıklığında hidroponik tanklara nakledin ve tüm kökü besin çözeltisine yerleştirmeye özen gösterin. Köklerin ışığa maruz kalmamasını sağlamak için tankları siyah bir bezle örtün. Bitkileri dik olarak desteklemek için cam tankların ağzında plastik bir ağ (20 cm x 20 cm) kullanın.
- Çimlenme aşamasının sonunda (60 gün), bozulmamış bitkilerin köklerini 50 mL tuzak çözeltisine (steril çift damıtılmış su) 4 saat (0800 saat ila 1200 saat) batırarak kök eksüdalarını toplayın. Toplanan çözeltiyi Whatman filtre kağıdından süzün, ardından anyon değişimi ve ardından katyon değişim reçineleri12 ile doldurulmuş cam sütunlardan geçirin. Ayrıştırılan fraksiyonları kuruyana kadar buharlaştırın ve daha sonraki işlemlere kadar -20 °C'de saklayın.
- İşlenmiş kök eksüda örneklerini standart protokole göre organik asitlerin12 belirlenmesi için HPLC ile ve toplam fenoliklerin 13, proteinlerin14, şekerlerin15 ve amino asitlerin16 tahmini için spektrofotometri ile analiz edin.
- Kök ucu pigmentasyonunu ve kök kıl yoğunluğunu kaydetmek için kök büyümesini haftalık aralıklarla izleyin. Standart protokole göre 3. ayda enzimlerin, peroksidaz17 ve süperoksit dismutaz18'in aktivitesini ve toplam fenolik içeriği19'u değerlendirin.
- Steril bir cerrahi bıçak kullanarak birincil kökte kök ucuna kadar uzunlamasına bir dilim uygulayarak kök yaralanmasına yanıtı değerlendirin ve değişiklikleri periyodik olarak izleyin.
| Kimyasal | Son konsantrasyon |
| Potasyum nitrat | 0,608 g· L-1 Serisi |
| Kalsiyum nitrat | 1.415 g· L-1 Serisi |
| Potasyum dihidrojen fosfat | 0,164 g· L-1 Serisi |
| Magnezyum sülfat | 0,560 g· L-1 Serisi |
| EDTA-ferrik monosodyum tuzu | 6,00 g·250L-1 |
| Borik asit | 1,43 g·250L-1 |
| Manganez klorür tetrahidrat | 0,91 g·250L-1 |
| Çinko sülfat | 0.11 g·250L-1 |
| Bakır suphate | 0,04 g·250L-1 |
| Molibdik asit | 0,01 g250L-1 |
Tablo 1: Şeker kamışı hidroponik kültürü için modifiye edilmiş besin çözeltisinin bileşimi.

Şekil 4: Hidroponik kurulum. Kurulum (A) şeker kamışı yetiştirmek ve (B) 5 aylık mahsul için özelleştirilmiş (yalnızca fotoğraf çekmek amacıyla siyah bez çıkarılmıştır). Bu şekil Hari ve ark.9'dan değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Şeker kamışı çeşitlerinin kök morfolojik özelliklerinde varyasyon
Hendek örneklemesi ile tarladan kazılan ve hidroponik bir kurulumda yetiştirilen Co 62175'teki kök sisteminin temsili görüntüleri Şekil 5A,B'de sunulmuştur. Co 62175 ve Co 99006 çeşitlerinde uzun kökler (~ 100 cm) gözlenirken, Co 99006 en yüksek kök ağırlığını (127 g · topak-1) kaydetmiştir. Kök özellikleri, Co 62175'in kümülatif kök uzunluğu, kök yüzey alanı ve kök hacmi açısından Co 99006'ya kıyasla üstün bir kök sistemine sahip olduğunu ortaya koyan bir kök çekirdek örnekleyici kullanılarak kaydedildi (Şekil 5C-E). Bununla birlikte, ortalama kök çapı Co 99006'da Co 62175'ten daha yüksekti (Şekil 5F).
Saccharum spp. klonlarının kök morfolojik özelliklerindeki varyasyon
Biçimlendirici fazdaki morfolojik özellikler, Saccharum spp. klonlar arasında önemli farklılıklar göstermiş, en yüksek kümülatif kök uzunluğu küme başına 39615.72 cm ile S. spontaneum'da (IND 85-490), en düşük ise S. sinense'de (Oshima) gözlenmiştir (Şekil 6A). Küme başına en yüksek kök yüzey alanı (4700.31 cm2) S. spontaneum'da (IND 85-490), ardından S. officinarum (Awela Green Sport) ve en düşük kök yüzey alanı S. sinense'de (Oshima) gözlenmiştir (Şekil 6B). Kök hacmi ve ortalama kök çapı durumunda da benzer bir eğilim gözlenmiştir (Şekil 6C,D). Büyük büyüme aşamasında örneklenen köklerin morfolojisi manuel olarak ölçüldü ve en uzun köklerin (131 cm) S. robustum'da (NG 77-237) bulunduğu ortaya çıktı (Şekil 6E), kök kuru ağırlığı ise S. spontaneum'da en yüksek (IND 85-490: 57.4 g·clump-1) ve en düşük S. sinense'de (Oshima: 11.2 g·clump-1) (Şekil 6F). Kök hacmi ve kök-sürgün oranı, kök kuru ağırlığı ile benzer bir eğilim izlemiştir (Şekil 6G,H).
Saccharum spp. klonlarının kök anatomik özelliklerinde varyasyon
Uçtan 10 mm'lik köklerin kesit alanı, Saccharum spp. klonlar, S. spontaneum (IND 85-490) en büyük alanı (27646.8 mm2) gösterirken, S. sinense (Oshima) en düşük alanı (7539.1 mm2) kaydetmiştir (Tablo 2). S. sinense'deki (Oshima) ana alan kortikal hücreler tarafından işgal edilirken, S. spontaneum'da (IND 85-490) stel dokusunun kapladığı alan belirgindi, bu da korteks-stel oranına ilişkin verilere yansımıştır. Metaksilem elementlerinin sayısı 6 (S. officinarum: Awela Green Sport) ile 13 (S. spontaneum: IND 85-490) arasında değişirken, hava boşluklarının sayısı (lizijen aerenchyma) 12 (S. barberi: Putli Khajee) ile 32 (S. spontaneum: IND 85-490) arasında değişmektedir. Maksi elementlerin kapladığı alan S. barberi'de (Putli Khajee) en yüksek (791.3 mm2) ve S. sinense'de (Oshima) en düşük (254.3 mm2) idi. Aedenkima tarafından işgal edilen alan S. spontaneum'da (IND 85-490) en yüksek (4921.3 mm2) iken, S. sinense (Oshima) ve S. robustum (NG 77-237) kökleri normal sulama koşullarında aerenkimatöz hücrelerden yoksundu. Saccharum sinense (Oshima), S. spontaneum (IND 85-490) ve S. barberi (Putli Khajee) kuraklık ve su basması stres koşullarında üstün kök anatomik fenleri sergilemiştir (Şekil 7A-C). Uzun kök kılları, sklerenkimatöz ekzodermis, azalmış kortikal hücre tabakaları, artmış kortikal aerenkim, artmış stel alanı ve büyük çaplı ksilem damar sayısı kuraklık altında elverişliyken, artmış aerenkimatöz hücreler ile artan kök çapı ve daha yüksek kortikal hücre alanı, su basması stresi altında mekanik mukavemeti, kök gözenekliliğini ve oksijen difüzyonunu artırdı.
Saccharum spp. klonlarının kök eksüdalarının türü ve miktarındaki değişim
Saccharum spp. çimlenme aşamasında klonlar, toplam protein oranı en yüksekti, bunu karboksilatlar, şekerler, fenoller ve serbest amino asitler izledi. Saccharum robustum (NG 77-221) en yüksek (5.11 mg·g-1·kök taze ağırlığı [RFW]·h−1) toplam karboksilat eksüdasyonunu gösterirken, en düşük (0.65 mg·g-1· RFW·h-1), S. spontaneum'da (IND 85-490) kaydedildi ve sızan bireysel karboksilik asidin türü ve miktarında önemli farklılıklar oldu (Şekil 8A). Saccharum officinarum (Awela Green Sport) en yüksek toplam fenol seviyelerini (0.034 mg · g - 1 · RFW·h−1), en düşük ise (0.002 mg·g−1· RFW·h-1) S. spontaneum (IND 85-490) olgusunda gözlenmiştir (Şekil 8B). En yüksek toplam protein eksüdasyonu (3.23 mg·g-1· RFW·h-1) S. officinarum'da (Awela Green Sport) gözlenirken, en yüksek toplam şeker (0.22 mg·g-1· RFW·h−1) ve toplam serbest amino asitler (0.04 mg·g−1· RFW·h−1) S. sinense'de (Oshima) kaydedilmiştir (Şekil 8C-E). En düşük toplam protein eksüdasyonu (2.08 mg·g-1· RFW·h-1), S. spontaneum'da (IND 85-490) gözlenirken, S. robustum (NG 77-221) en düşük toplam şeker miktarını (0.05 mg · g - 1 · RFW·h−1) ve toplam serbest amino asitler (0.01 mg·g−1· RFW·h−1).
Şeker kamışı çeşitlerinin kök ucu pigmentasyonu, enzimatik aktivitesi ve toplam fenolik içeriğindeki varyasyon
Kök başlığı şekilleri basit üçgenden (Co 62175) kubbeye (Co 86032) kadar değişirken, kök başlığı pigmentasyonu açık pembeden (Co 62175) koyu mor (Co 86032) ye kadar değişmekte olup, kök saç yoğunluğunda önemli farklılıklar vardır (Şekil 9A-C). Peroksidaz aktivitesi Co 86032'de en yüksek (40 birim · g - 1 · h - 1) ve Co 62175'te en düşük (26 birim · g - 1 · h - 1) iken, köklerde süperoksit dismutaz aktivitesi durumunda eğilim tersine döndü (Şekil 9D, E). Benzer şekilde, toplam fenolik içerik Co 86032'de en yüksek (18 μg·g-1) ve Co 62175'te en düşük (15 μg·g-1) idi (Şekil 9F).
Şeker kamışı çeşitlerinin kök yaralanması üzerine gençleşmenin gelişim aşamalarındaki farklılıklar
Kök yaralanması üzerine gençleşme, hidroponik bir kurulumda yetiştirilen CoC 671 ve Co 06022 şeker kamışı çeşitlerinde test edildi (Şekil 10A-I). CoC 671'de ikincil kökler yaralanmanın üçüncü gününde ortaya çıkarken, Co 06022'de ikincil kök başlangıcı sadece onuncu günde meydana geldi. Ayrıca, Co 06022'nin birincil kökü üçüncü günde yaşlanma belirtileri gösterirken, CoC 671 kökleri nispeten sağlıklı kaldı. CoC 671'de onuncu günde üçüncül kökler de gözlendi.

Şekil 5: Co 62175'in kök sistemleri ve farklı morfolojik özellikleri. Hendek örneklemesi ile kazılan (A) Co 62175'in kök sistemi, (B) hidroponik bir kurulumda yetiştirilen Co 62175 ve morfolojik özellikler (C) kümülatif kök uzunluğu, (D) kök yüzey alanı, (E) kök hacmi ve (F) kök çekirdek örnekleyici kullanılarak kaydedilen ortalama kök çapı. Veriler ortalama ± SEM'i temsil eder (n = 3). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 6: Kök morfolojik özellikleri. (A) Kümülatif kök uzunluğu, (B) kök yüzey alanı, (C) kök hacmi ve (D) oluşum fazındaki ortalama kök çapı ve (E) en uzun kökün uzunluğu, (F) kök kuru ağırlığı, (G) kök hacmi ve (H) Saccharum spp. fenotipleme yapısından kaydedilen klonların büyük büyüme fazında kök-sürgün oranı (S. officinarum: Awela Yeşil Spor, S. spontaneum: IND 85-490, S. sinense: Oshima, S. barberi: Putli Khajee, S. robustum: NG 77-237). Veriler ortalama ± SEM'i temsil eder (n = 3). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 7: S. sinense klonu Oshima'nın kök anatomik özellikleri. (A) Normal büyüme koşulları ve (B) kuraklık ve (C) su basması stresine yanıt olarak. Ölçek çubukları = 100 μm. Kısaltmalar: rh = kök kılları; ae = lizojenöz aerenchyma; mx = metaksilem; ex = ekzodermis; EP = epidermis. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 8: Kök eksüdasyonu. (A) Karboksilatlar, (B) toplam fenol, (C) toplam protein, (D) toplam şeker ve (E) Saccharum spp. klonlarında (S. officinarum: Awela Green Sport, S. spontaneum: IND 85-490, S. sinense: Oshima, S. barberi: Putli Khajee, S. robustum: NG 77-221). Veriler ortalama ± SEM'i temsil eder (n = 3). Kısaltma: RFW = kök taze ağırlığı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
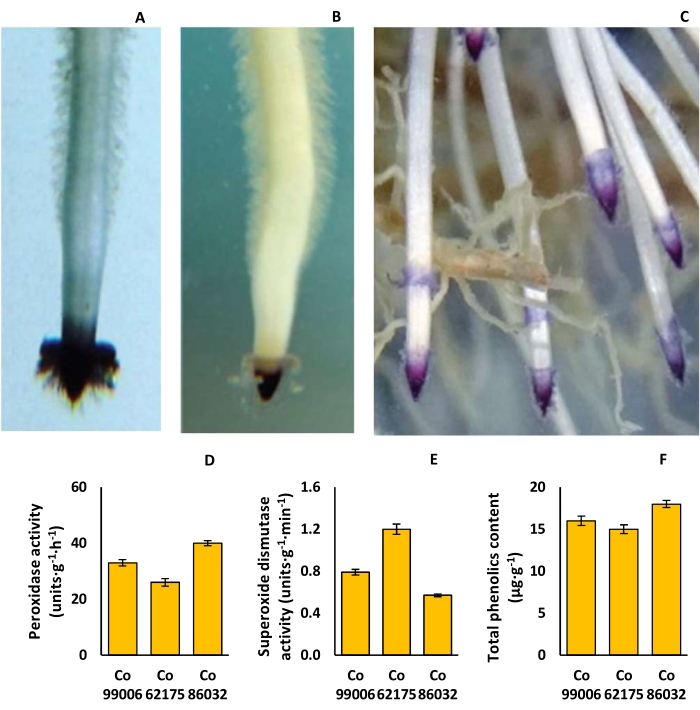
Şekil 9: Şeker kamışı çeşitlerinde rizosfer özellikleri. (A) Co 62175'te üçgen kök başlığı, (B) Co 86032'de kubbe şeklindeki kök başlığı, (C) Co 86032'de koyu mor kök ucu pigmentasyonu, (D) peroksidaz aktivitesi, (E) süperoksit dismutaz aktivitesi ve (F) hidroponik kurulumda yetiştirilen bitkilerin toplam fenolik içeriği. D, E ve F'deki veriler ortalama ± SEM'i temsil eder (n = 3). Bu şekil Hari ve ark.9'dan değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 10: Hidroponik kurulumda yetiştirilen şeker kamışı çeşitlerinde kök yaralanması üzerine gençleşmenin gelişim aşamaları. (AE) CoC 671 ve (F-I) Co 06022; (A,F) yaralanmamış kökler; (B,G) uzunlamasına dilimleme ile yaralanan kökler; (C,H) Yaralanmadan 3 gün sonra; (D,E,I) Yaralanmadan 10 gün sonra. Bu şekil Hari ve ark.9'dan değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Kökün kesit alanı (mm2) | Korteks-stel oranı | Ekzodermal katmanların sayısı | Maksi elementlerinin sayısı | Ortalama meleksilem çapı (mm) | Hava boşluğu sayısı | Metaksilemin kapladığı alan (mm2) | Hava boşluklarının kapladığı alan (mm2) | |
| S. officinarum | 6936.3±200.2 | 0,508±0,015 | 1,00±0,03 | 6.00±0.17 | 8.5±0.3 | 14.00±0.40 | 340.3±9.8 | 1993.0±57.5 |
| S. spontane | 27646.8±957.7 | 0,481±0,017 | 2,00±0,07 | 13.00±0.45 | 6.6±0.2 | 32.00±1.11 | 444.5±15.4 | 4921.3±170.5 |
| S. sinense | 7539.1±261.2 | 0,727±0,025 | 2,00±0,07 | 9.00±0.31 | 6.0±0.2 | - | 254.3±8.8 | - |
| S. barberi | 18859.6±435.6 | 0,692±0,015 | 1,00±0,02 | 7.00±0.16 | 12.0±0.3 | 12.00±0.28 | 791.3±18.3 | 4454.6±102.8 |
| S. robustum | 8328.1±288.5 | 0,563±0,019 | 2,00±0,07 | 10.00±0.35 | 7.0±0.2 | - | 384.7±13.3 | - |
Tablo 2: Saccharum spp. klonlarında gözlenen kök anatomik özellikleri. Veriler ortalama ± SEM'i (n = 3) temsil etmektedir (S. officinarum: Awela Green Sport, S. spontaneum: IND 85-490, S. sinense: Oshima, S. barberi: Putli Khajee, S. robustum: NG 77-237).
Tartışmalar
Kök sistemleri, şeker kamışının yer üstü verimliliğini tanımlar ve iklime dayanıklı çeşitlerin geliştirilmesi için tüm yönlerinin kapsamlı bir şekilde araştırılmasını ve anlaşılmasını gerektirir. ICAR-SBI'de bitki fizyologları, bir mikrobiyolog, bir ziraat mühendisi, bir biyokimyacı ve bitki ıslahçılarından oluşan bir bilim insanı ekibi, şeker kamışı kök fenotiplemesi için hendek örneklemesi ile saha kazısı, kök çekirdek örnekleyici kullanımı, kök örneklemesi için yükseltilmiş platformlar ve hidroponik kültür altında bitki yetiştirme dahil olmak üzere çok yönlü yaklaşımlar kullandı. Bireysel bir metodolojinin kapsamlı ve/veya münhasır olmayabileceği göz önüne alındığında, ideal bir kök fenotipinin bileşen özelliklerini ve mekanizmalarını ortaya çıkarmak için bilgilerin entegrasyonu gereklidir. Daha önceki kök örnekleme yöntemleri, çabalarında izole edilmişti, ancak burada açıklanan stratejiyi geliştirmek için yararlı oldu.
Venkatraman ve Thomas5 , araştırma için üç uygun yöntemi tanımlayarak şeker kamışı köklerinin incelenmesine öncülük etti. İlk yöntemde, bir bitkinin yan tarafında derin bir çukur kazıldı, bu da köklerin topraktan kesilmesine, badanalanmasına ve doğal pozisyonlarında fotoğraflanmasına izin verdi. İkinci yöntemde, bir bitkinin karşı taraflarında derin çukurlar kazılmıştır. Bitkiye bitişik çukurların kenarlarına tel örgüde 2'li çerçeveler yerleştirildi ve kökleri kendi pozisyonlarında tutmak için araya giren toprağın genişliğine demir çubuklar yerleştirildi. Toprak daha sonra su ile yıkandı ve kökler fotoğraflandı. Üçüncü bir yöntem ise kök çalışması için özel dikimler yapmaktı. Kazılan bir arsada belirli seviyelerde tel örgü yerleştirildi ve kazı, daha önce olduğu gibi ilgili katmanlarındaki toprağın yerini alarak yeniden dolduruldu. İncelenecek bitkiler arsa içinde yetiştirildi. İnceleme sırasında, bitkilerin etrafındaki toprak su ile yıkandı ve kök sistemleri tel örgülerin ağlarında yerinde asılı kaldı.
Rege ve Wagle20 , kamışın kenarından dikey olarak bir çukur kazarak ve toprağı belirli bir bölgede yıkayarak kök sistemini açığa çıkararak, sulama koşulları altında bir kök çalışması yöntemi geliştirdi. Bitki materyalinin en az israfına neden oldu ve araştırmacıların kök sistemini hem kalitatif hem de kantitatif olarak yerinde incelemelerini sağladı. Şeker kamışı köklerinin yapısını, gelişimini ve davranışını araştırmak için özel bir çalışma yapılmıştır21. "Kök kutusu yöntemi" ve "toprak kazı yöntemi", şeker kamışı köklerinin dağılımını incelemede oldukça yararlı oldu. Ağır topraklarda karışık veya daha hafif topraklara göre daha sığ köklerin olduğu bulunmuştur. İkincisinde yaygın olan gevşek doku ve havalandırma, kökün daha derin toprak bölgelerine nüfuz etmesini destekledi ve bu da onu kök gelişimi için daha uygun hale getirdi Gelişen ilk kökler doğrudan toprakta aşağı doğru büyüdü, 30-36 inçten daha fazla derinliğe nüfuz etti, ardından yüzey katmanlarında gözlenen sığ yayılan kökler (üst topraktan ~ 14 inç), burada köklerin ~% 85 -% 90'ı dağılmıştır. Daha derin kökler şüphesiz kurak dönemlerde bitkiler için nem sağladı. Köklerin ve sürgünlerin büyüme hızı, mahsul yılının iklim koşullarına ve çeşide göre değişmiştir. Köklerin aktif fizyolojik koşullarda tutulması, optimal bitki büyümesi için önemlidir, çünkü mümkünse kaçınılması gereken yetiştirme uygulamalarından sıklıkla rahatsız edilir. Seçilen şeker kamışı çeşitlerinde kök sistemi değişkenliği Küba'da "doğrudan inceleme yöntemi" ile incelenmiştir22. Kök gelişiminin açıklamaları, topraktaki kök dağılımının resimleriyle birlikte belgelenmiştir.
Hendek örneklemesi ile köklerin saha kazısı, Venkatraman ve Thomas5, Rege ve Wagle20 ve Ryker ve Edgerton21'in çalışmalarına dayanıyordu. En zahmetli ve zaman alıcı yöntem olmasına rağmen, kök fenotiplerini doğal büyüme ortamlarında anlamak için yerinde tarla örneklemesi zorunludur. Şeker pancarı ve tahıllarda kök ölçüm yöntemlerinin karşılaştırılması, hendek profil duvarından elde edilen verilerin dikkatle yorumlanması gerektiğini, burada hesaplanan kök uzunluğu yoğunluklarının (RLD) (kümülatif kök uzunluğunun toprak hacmine oranı), toprak tipine bağlı olarak kök çekirdek yönteminden elde edilenlerden 4x-10x daha düşük olduğunu ortaya koymuştur23. Minimum örnekleme hatasını sağlamak ve işçilik dahil kök ve kaynak kaybını en aza indirmek için hendek ile gövdeye uygun ve düzgün bir mesafe önemlidir. Hendek örneklemesi yoluyla kök büyümesinin izlenmesi, doğası gereği yıkıcı olduğundan ve gözlem düzlemine dayalı olarak kökün yalnızca küçük bir kısmı görülebildiğinden, uzun vadeli deneyler için uygun olmayabilir. Bununla birlikte, hendek örneklemesi, kök dağılımının ve toprak profili24 ile etkileşimin genel bir tahminini sağlar. Ticari şeker kamışı hibritlerinde kök sistemlerinin yayılması üzerine yapılan bu araştırma, fizyolojik olarak aktif köklerin ~%70'inin toprak profilinin 50 cm yakınında bulunduğunu ortaya koymuştur.
Hendek örnekleme yöntemi, çeşitli kök sınıflarının toprak profilindeki oluşum derinliklerine göre farklılaşmasına izin vermiştir. Genel olarak, toprağın daha derinlerine nüfuz eden kökler genellikle sığ bölgelerde bulunanlardan daha inceydi. Kök uzunluğu, hacmi ve ağırlığına göre geniş genotipik değişkenlik gözlenmiştir. Mahsul modelleme ve simülasyonundaki ilerlemeler, numune alma hatalarını ve deneysel heterojenliği en aza indirmek için algoritmalar geliştirerek geleneksel numune alma yöntemlerinden elde edilen verilerin iyileştirilmesine yardımcı olur. Yerinde bir toprak profilinden elde edilen şeker kamışı RLD verileri, toprak karot alma ile karşılaştırıldı, burada bir toprak profilindeki kök kesişimlerinin sayılmasının ve bir model kullanılarak RLD'nin tahmin edilmesinin, toprak çekirdek yöntemi25 ile elde edilenlere benzer RLD değerleri verdiği gözlendi. Soya fasulyesinde toprak kazısı ve karot alma yöntemlerinden elde edilen verilerin karşılaştırılması, kök biyokütlesinin benzer tahminlerini ortaya çıkardı ve kazı daha az toplam zaman ve daha fazla işçilik gerektirdi26. Çekirdek bazlı numuneler daha kesindi ve deney grafiğine minimum rahatsızlık vererek daha derin köklenme bölgelerinde numune almaya izin verdi. Bitki köklerini doğal yetişme ortamlarında incelemenin avantajı göz önüne alındığında, hendek örneklemesi, toprak profili verilerini ve RLD profilini birleştirmek için yararlı olabilir, ancak geniş bir alanda örnekleme yapmayı kolaylaştırmaz27. Bu bağlamda, kök çekirdek örnekleyicinin, kök dağılımını ölçmek ve daha geniş bir alanda daha fazla örneğe izin vermek için oldukça yararlı olduğu kanıtlanmıştır.
Kök çekirdek örnekleyici, tarladan köklerin alt örneklemesini kolaylaştırmak için tasarlanmıştır, bu da daha düşük bir varyans katsayısı ile örneklemede tekdüzeliği garanti eder; Örnekleme hatalarını önemli ölçüde azaltmıştır. Kök çekirdek örnekleyicinin kullanımı birkaç üründe benimsenmiştir; Yıkama sırasında kök kaybını önlemek için çok özen gösterilmesi gerektiğinden, numune alma sonrası işlem süresi büyük miktarda gerektirir28. Çekirdek örnekleyici, sabit bir hacimde toprakta köklerin örneklenmesini kolaylaştırdı ve kök sistemi özellikleri için test edilen klonlar arasındaki genotipik varyasyonu ortaya çıkararak, belirli bir zaman diliminde daha fazla örneğin test edilmesine izin verdi. Bitki sağlığını değerlendirmek için önemli bir parametre olan RLD, bir kök çekirdek örnekleyici yardımıyla hassas bir şekilde elde edilebilir. Genel olarak, sistematik varyasyon, gövdeden uzaklık açısından karot alma konumuna atfedilir ve bu da önemli ölçüde farklı kök verileriyle sonuçlanabilir. Bununla birlikte, şeker kamışı söz konusu olduğunda, örnekleyici, mahsulün benzersiz morfolojisine dayalı olarak üretilmiştir ve örnekleme sırasında birincil sürgün/kamış ona tutturulmuştur. Bu nedenle, numune alma hatasını en aza indirmek için tüm çeşitler için birincil sürgün/baston etrafında 16 cm çapında tek tip bir çekirdek sağlanır.
Kök tarayıcı yöntemi kullanılarak kaydedilen kök hacim verileri ile hacim yer değiştirme yöntemi29 arasında anlamlı bir korelasyon gözlenmiştir. Örneklem büyüklüğü hendek yönteminden çok daha düşük olduğundan, genotipler arasındaki değişkenlik kök çekirdek örnekleyici kullanılarak değerlendirilebilir. Fenotipik plastisite, toprak heterojenliği ve diğer bilinmeyen faktörlere bağlı rastgele varyasyon, bir kök çekirdek örnekleyiciden elde edilen verilerin güvenilirliğini etkiler ve bu, tekrarlanan ölçümler ve işlevsel olarak ilgili farklılıkları daraltmak için simülasyon yazılımının kullanılmasıyla üstesinden gelinebilir27. Kök sistem mimarisinin üç boyutlu modellerine ve bir alan ağırlıklandırma algoritmasına30 dayalı olarak mısırdaki farklı toprak karot alma stratejileri arasındaki varyasyonun sanal bir değerlendirmesi, güvenilir RLD tahminleri elde etmenin bu tür uygun maliyetli yollarının kök çalışmaları için ileriye giden yol olabileceğini ortaya koydu.
Bitişik bölmelere sahip kök fenotipleme yapıları, alanı simüle etme amacına hizmet eder ve aynı zamanda şeker kamışı germplazminin doğal değişkenliğini taramak için gereken homojenliği korur. Hendek örneklemesine göre önemli ölçüde daha az hasar ve kök israfı ile tahribatlı örneklemenin kolaylığı, tüm kök sisteminin farklı fenofazlarda analizini kolaylaştırır. Mahsul morfolojisine ve kök dağılımına dayalı özelleştirilmiş kök kutuları veya odalarının, sorgum31, soya fasulyesi ve karabuğday32 gibi diğer mahsullerde etkili olduğu kanıtlanmıştır. Benzer şekilde, bölmelerin boyutu ve derinliği şeker kamışının büyümesini desteklemek için optimize edilmiştir. Ayrıca, yan duvarlar, kök örneklemesi sırasında manuel olarak kolayca kaldırılabilen prekast plakalar kullanılarak inşa edilmiştir. Kök örnekleri, yan duvar manuel olarak kaldırılarak alınır ve ardından kökleri ortaya çıkarmak için su jeti ile kontrol edilir. Yan duvarlar daha sonra değiştirilir ve toprak yeniden doldurulur, böylece bitişik bitkilere minimum zarar verilir. Şeker kamışındaki kök özelliklerindeki varyasyon ve bunun sürgün büyümesi ile ilişkisi, kök fenotipleme yapısında yetiştirilen bitkilerde belgelenebilir. Şeker kamışında aşırı sulama yüzeysel bir kök sistemi oluştururken, su açığı hafif derin penetrasyon ile yanal yayılmayı teşvik eder33,34. Artan azot uygulaması ile kök ağırlığı azalırken, fosfatlı gübreler kök gelişimi üzerinde olumlu etki yaratmaktadır35,36. Yapıdaki bitişik bölmeler, sırasıyla sulama suyu miktarını manipüle ederek ve besin değeri tükenmiş toprağı kullanarak, şeker kamışının değişen abiyotik streslere ve toprak besin seviyelerine verdiği bu tür tepkilerin incelenmesine izin verir.
Hidroponik bitki kültürü, soya fasulyesi12, pirinç37, buğday38 ve mısır39'daki geniş ve çeşitli genotip popülasyonunda besin stresi tepkilerini değerlendirmek için tercih edilen yöntemdir. Şeker kamışında simüle edilmiş kök çalışmaları 192340 yılına kadar uzanır, burada köklerin göreceli derinliğini ve planını incelemek için tel örgülü bir toprak kap halkası sütunu kullanılmıştır. Kök gelişiminin sürekli izlenmesi için seyreltik Knop çözeltisi ile doldurulmuş toprak pişirme kapları kullanılarak hidroponik kültür de denendi. Kurum içi bir hidroponik tesis, kök gelişiminin ve rizosfer biyolojisindeki değişikliklerin daha ince ayrıntılarının incelenmesini sağlar9. Kap boyutu ve ekim yoğunluğu şeker kamışı için optimize edildi, burada bitkiler minimum konaklama ile 10 aya kadar yetiştirildi. Kök başlığı şekli ve kök ucu pigmentasyonu dahil olmak üzere rizosfer özellikleri, yalnızca hidroponik koşullar altında değerlendirilebilir, bu da örnekleme kolaylığını ve toprak yapıştırıcılarının yokluğunu kolaylaştırır. Bitkiler tarlada yetiştirildiğinde kök düzeyinde gelişimsel ve stres tepkilerinin değerlendirilmesi mümkün olmayabilir, oysa hidroponik kültür bu tür ölçümlere izin verir. Tarla koşullarında mümkün olmayabilecek kök eksüdalarının toplanmasını ve karakterizasyonunu kolaylaştırır. Kök penetrasyonunun önünde fiziksel engellerin olmaması bu yöntemin önemli bir dezavantajı olsa da, bitkiler hidroponik koşullar altında yetiştirildiğinde kök büyümesinin düzenli olarak izlenmesi bir avantajdır.
Yeni şeker kamışı çeşitlerinin mimarisinin, sürdürülebilir tarım talebini karşılayabilecek güçlü ve ideal bir kök fenotipine dayalı olarak yeniden tasarlanması esastır. Pirinç ve mısır için geliştirilen yüksek verimli kök fenotipleme platformları, toprak ve hidroponik, gelişmiş kök görüntüleme teknikleri ve yazılım araçları gibi çok çeşitli büyüme sistemlerine uyarlanabilen bileşenleri içerir41; Şeker kamışı için bu tür platformların yükseltilmesi, yakın gelecekte üretkenliği artırmak için çok fazla alan sunuyor. Şeker kamışının büyümesinin ve verimliliğinin önemli bir belirleyicisi olarak kök biyolojisine yapılan vurguya ve ileri kök fenotipleme tekniklerinin mevcudiyetine rağmen, şeker kamışı kök özellikleri hakkında kendi başına az sayıda çalışma rapor edilmiştir 42,43,44,45. Kökler en dinamik bitki organları olduğundan, özellikle şeker kamışı gibi bir üründe kök fenotiplerindeki varyasyonu değerlendirmek için tek bir metodoloji kesin olmayabilir. Çalışmanın amaçlarına uygun olarak uygun metodoloji permütasyonlarının uygulanması ve entegrasyonu, şeker kamışı yeraltı sistemlerinin anlaşılmasını geliştirmelidir.
Açıklamalar
Tüm yazarlar herhangi bir çıkar çatışması olmadığını beyan eder.
Teşekkürler
Yazarlar, şeker kamışı için kök fenotipleme tesisleri kurmak için ICAR-Şeker Kamışı Yetiştirme Enstitüsü, Coimbatore Direktörü tarafından sağlanan altyapıyı ve desteği kabul etmektedir. Hindistan Hükümeti Bilim ve Teknoloji Departmanı Bilim ve Mühendislik Araştırma Kurulu tarafından KV'ye Erken Kariyer Araştırma Ödülü (ECR/2017/000738) şeklinde sağlanan finansman, usulüne uygun olarak kabul edilmektedir. Yazarlar, titiz bir şekilde veri üretmedeki yardımları için Brindha, Karpagam, Rajesh, Sivaraj ve Amburose'a teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Aeration pump with pipeline accessories | Purchased from local sources | NA | Used for hydroponic culture of sugarcane |
| Boric acid | Sisco Research Laboratories, India | 80266 | Preparation of modified Hoagland's solution |
| Calcium nitrate | Central Drug House, India | 27606 | Preparation of modified Hoagland's solution |
| Composted coir pith | Purchased from local sources | NA | Used for germinating sugarcane setts |
| Cupric sulphate | Sisco Research Laboratories, India | 38869 | Preparation of modified Hoagland's solution |
| DEAE-cellulose | Sisco Research Laboratories, India | 10529 | anion exchange resin for processing of root exudates |
| EDTA-ferric monosodium salt | Sisco Research Laboratories, India | 59389 | Preparation of modified Hoagland's solution |
| Farm yard manure | Purchased from local sources | NA | Used for germinating sugarcane setts |
| Glass tanks | Fabricated in-house | NA | Used for hydroponic culture of sugarcane |
| HPLC | Agilent Technologies | 1200 Infinity | Quantification of organic acids in root exudates |
| Magnesium sulphate | Sisco Research Laboratories, India | 29117 | Preparation of modified Hoagland's solution |
| Manganese chloride | Sisco Research Laboratories, India | 75113 | Preparation of modified Hoagland's solution |
| Molybdic acid | Sisco Research Laboratories, India | 49664 | Preparation of modified Hoagland's solution |
| Potassium dihydrogen phosphate | Central Drug House, India | 29608 | Preparation of modified Hoagland's solution |
| Potassium nitrate | Central Drug House, India | 29638 | Preparation of modified Hoagland's solution |
| Protrays | Fabricated in-house | NA | Used for germinating sugarcane setts |
| Red soil | Purchased from local sources | NA | Used for germinating sugarcane setts |
| Root core sampler | Fabricated in-house | NA | Used for in situ root sampling |
| Sand | Purchased from local sources | NA | Used for germinating sugarcane setts |
| Seralite-120 | Sisco Research Laboratories, India | 14891 | cation exchange resin for processing of root exudates |
| Supporting frame | Purchased from local sources | NA | Used for hydroponic culture of sugarcane |
| Water motor pump | Purchased from local sources | NA | Used for hydroponic culture of sugarcane |
| Whatman filter paper grade 1 | Universal Scientific | 1001090 | Processing of root exudates |
| WinRhizo PRO (software) | Regent Instruments Inc., Canada | STD4800 | Two-dimensional root scanner with software for analysis of roots |
| Zinc sulphate | Sisco Research Laboratories, India | 76455 | Preparation of modified Hoagland's solution |
Referanslar
- Venkatraman, T. S., Thomas, R. Studies of sugarcane roots at different stages of growth. Agricultural Journal of India. 23, 166-176 (1928).
- Smith, D. M., Inman-Bamber, N. G., Thorburn, P. J. Growth and function of the sugarcane root system. Field Crops Research. 92 (2-3), 169-183 (2005).
- Glover, J. The behaviour of the root-system of sugarcane at and after harvest. Proceedings of the South African Sugar Technologists Association. 42, 133-135 (1968).
- Venkatraman, T. S., Thomas, R. Sugarcane root systems: Studies in development and anatomy. Agricultural Journal of India. 17 (4), 416-418 (1922).
- Saliendra, N. Z., Meinzer, F. C. Genotypic, developmental and drought-induced differences in root hydraulic conductance of contrasting sugarcane cultivars. Journal of Experimental Botany. 43 (9), 1209-1217 (1992).
- Gilbert, R. A., Rainbolt, C. R., Morris, D. R., Bennet, A. C. Morphological responses of sugarcane to long-term flooding. Agronomy Journal. 99 (6), 1622-1628 (2007).
- Shiotsu, F., Abe, J., Doi, T., Gau, M., Morita, S. Root morphology and anatomy of field-grown Erianthus arundinaceus. American Journal of Plant Sciences. 6 (1), 103-112 (2015).
- Hari, K., Vasantha, S., Anna Durai, A., Brindha, C., Shruthi, P. Sugarcane root growth and development in hydroponics system. Journal of Sugarcane Research. 7 (2), 71-82 (2017).
- Matsuoka, S., Garcia, A. A. F. Sugarcane underground organs: Going deep for sustainable production. Tropical Plant Biology. 4, 22-30 (2011).
- Koevoets, I. T., Venema, J. H., Elzenga, J. T. M., Testerink, C. Roots withstanding their environment: Exploiting root system architecture responses to abiotic stress to improve crop tolerance. Frontiers in Plant Science. 7, 1335 (2016).
- Vengavasi, K., Pandey, R. Root exudation index: Screening organic acid exudation and phosphorus acquisition efficiency in soybean genotypes. Crop and Pasture Science. 67 (10), 1096-1109 (2017).
- Bray, H. G., Thorpe, W. V. Analysis of phenolic compounds of interest in metabolism. Methods of Biochemical Analysis. 1, 27-52 (1954).
- Lowry, O. H., Rosebrough, N. J., Farr, A. L., Randall, R. J. Protein measurement with the folin phenol reagent. The Journal of Biological Chemistry. 193 (1), 265-275 (1951).
- Hedge, J. E., Hofreiter, B. T. Determination of total carbohydrate by anthrone method. Carbohydrate Chemistry: Volume 17. , (1962).
- Moore, S., Stein, W. H. Polyphenol oxidase. Methods in Enzymology. Vol 468. , (1948).
- Malik, C. P., Singh, M. B. . Plant Enzymology and Histo-enzymology: A text manual. , (1980).
- Beauchamp, C., Fridovich, I. Superoxide dismutase: Improved assays and an assay applicable to acrylamide gels. Analytical Biochemistry. 44, 276-287 (1971).
- Singleton, V. L., Rossi, J. A. Colorimetry of total phenolics with phosphomolybdic- phosphotungstic acid reagents. American Journal of Enology and Viticulture. 16, 144-158 (1965).
- Rege, R. D., Wagle, P. V. Problems of sugarcane physiology in the Deccan canal tract. III. The root-system. The Indian Journal of Agricultural Science. 2 (3), 356-373 (1940).
- Ryker, T. C., Edgerton, C. W. Studies on sugar cane roots. LSU Agricultural Experiment Station Reports. 223, (1931).
- Jensen, J. H. Some studies of root habits of sugar cane in Cuba. The Tropical Plant Research Foundation. , (1931).
- Kücke, M., Schmid, H., Spiess, A. A comparison of four methods for measuring roots of field crops in three contrasting soils. Plant and Soil. 172 (1), 63-71 (1995).
- Noordwijk, M., et al. Trench Profile Techniques and Core Break Methods. Root Methods: A handbook. , (2001).
- De Azevedo, M. C. B., Chopart, J. L., Medina, C. C. Sugarcane root length density and distribution from root intersection counting on a trench-profile. Scientia Agricola. 68 (1), 94-101 (2011).
- Nissen, T., Rodriguez, V., Wander, M. Sampling soybean roots: A comparison of excavation and coring methods. Communications in Soil Science and Plant Analysis. 39 (11-12), 1875-1883 (2008).
- Burridge, J. D., et al. An analysis of soil coring strategies to estimate root depth in maize (Zea mays) and common bean (Phaseolus vulgaris). Plant Phenomics. 2020, 3252703 (2020).
- Schroth, G., Kolbe, D. A method of processing soil core samples for root studies by subsampling. Biology and Fertility of Soils. 18, 60-62 (1994).
- Chandran, K., Nisha, M., Arun Kumar, R., Krishnapriya, V. Breeding varieties resistant to waterlogging. ICAR-SBI Annual Report 2016-17. , 128 (2016).
- Wu, Q., Wu, J., Zheng, B., Guo, Y. Optimizing soil-coring strategies to quantify root-length-density distribution in field-grown maize: Virtual coring trials using 3-D root architecture models. Annals of Botany. 121 (5), 809-819 (2018).
- Joshi, D. C., et al. Development of a phenotyping platform for high throughput screening of nodal root angle in sorghum. Plant Methods. 13, 56 (2017).
- Koyama, T., Murakami, S., Karasawa, T., Ejiri, M., Shiono, K. Complete root specimen of plants grown in soil-filled root box: Sampling, measuring, and staining method. Plant Methods. 17, 97 (2021).
- Gomathi, R., Gururaja Rao, P. N., Chandran, K., Selvi, A. Adaptive responses of sugarcane to waterlogging stress: An overview. Sugar Tech. 17, 325-338 (2014).
- Misra, V., et al. Morphological assessment of water stressed sugarcane: a comparison of waterlogged and drought affected crop. Saudi Journal of Biological Sciences. 27 (5), 1228-1236 (2020).
- Robinson, N., et al. Sugarcane genotypes differ in internal nitrogen use efficiency. Functional Plant Biology. 34 (12), 1122-1129 (2007).
- Arruda, B., et al. Biological and morphological traits of sugarcane roots in relation to phosphorus uptake. Journal of Soil Science and Plant Nutrition. 16 (4), 901-915 (2016).
- Sharma, S., Borah, P., Meena, M. K., Bindraban, P., Pandey, R. Evaluation of genotypic variation for growth of rice seedlings under optimized hydroponics medium. Indian Journal of Genetics and Plant Breeding. 78 (3), 292-301 (2018).
- Soumya, P. R., Singh, D., Sharma, S., Singh, A. M., Pandey, R. Evaluation of diverse wheat (Triticum aestivum) and triticale (× Triticosecale) genotypes for low phosphorus stress tolerance in soil and hydroponic conditions. Journal of Soil Science. 21, 1236-1251 (2021).
- Ganie, A. H., et al. Metabolite profiling and network analysis reveal coordinated changes in low-N tolerant and low-N sensitive maize genotypes under nitrogen deficiency and restoration conditions. Plants. 9 (11), 1459 (2020).
- Venkatraman, T. S., Thomas, R. Simple contrivances for studying root development in agricultural crops. Agricultural Journal of India. 18, 509-514 (1923).
- Clark, R. T., et al. High-throughput two-dimensional root system phenotyping platform facilitates genetic analysis of root growth and development. Plant, Cell and Environment. 36 (2), 454-466 (2013).
- Chopart, J. L., Rodrigues, S. R., Azevedo, M. C. B., Medina, C. C. Estimating sugarcane root length density through root mapping and orientation modelling. Plant and Soil. 313, 101-112 (2008).
- Chopart, J. L., Azevedo, M. C. B., Le Mezo, L., Marion, D. Functional relationship between sugarcane root biomass and length for cropping system applications. Sugar Tech. 12 (3-4), 317-321 (2010).
- De Silva, A. L. C., De Costa, W. A. J. M., Bandara, D. M. U. S. Growth of root system and the patterns of soil moisture utilization in sugarcane under rain-fed and irrigated conditions in Sri Lanka. Sugar Tech. 13 (3), 198-205 (2011).
- Otto, R., Silva, A. P., Franco, H. C. J., Oliveira, E. C. A., Trivelin, P. C. O. High soil penetration resistance reduces sugarcane root system development. Soil and Tillage Research. 117, 201-210 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır