Method Article
مناهج التنميط الظاهري متعددة الجوانب لتوصيف أنظمة جذر قصب السكر
In This Article
Summary
يعد توصيف سمات نظام الجذر أحد مجالات البحث التي لا تزال في مهدها ، لا سيما في قصب السكر. يؤدي دمج مناهج متعددة لجذور قصب السكر ذات النمط الظاهري بدقة إلى نتائج شاملة وشاملة ، مما يتيح استخدام السمات والآليات المحددة للتربية التقليدية والجزيئية.
Abstract
الجذور هي الموصلات الأساسية للمياه والمواد المغذية وتلعب دورا حيويا في الحفاظ على النمو والمحصول في ظل البيئات العصيبة. تطرح دراسة جذور النباتات صعوبات منهجية في التقييم وأخذ العينات في الموقع ، وهو ما ينطبق بشكل خاص على قصب السكر (Saccharum spp.). وثقت الطرق التقليدية خلال عشرينيات القرن العشرين التباين الجيني في أنظمة جذر قصب السكر ، وبعد ذلك تم الإبلاغ عن دراسات قليلة حول سمات جذر قصب السكر في حد ذاتها حتى وقت قريب. بالإضافة إلى التشكل ، تحدد خصائص الجذور ، بما في ذلك التأثيرات الأليلوباتشيكية و / أو التقارب مع التعايش الميكروبي ، تكوين النبات وبقائه.
في النهاية ، تحدد أنظمة الجذر إنتاجية قصب السكر فوق الأرض. مع الزخم للأصناف المقاومة للمناخ ، أصبح من الأكثر أهمية استكشاف واستخدام التباين في سمات نظام جذر قصب السكر. تصف هذه الورقة الأساليب متعددة الجوانب للتنميط الظاهري لجذر قصب السكر ، بما في ذلك التنقيب الميداني عن طريق أخذ عينات الخنادق ، واستخدام جهاز أخذ عينات قلب الجذر ، والمنصات المرتفعة لأخذ عينات الجذور ، وتربية النباتات تحت الزراعة المائية ، التي يستخدمها فريق من العلماء في المجلس الهندي للبحوث الزراعية - معهد تربية قصب السكر (ICAR-SBI).
يعد التنقيب الميداني عن طريق أخذ عينات الخنادق أمرا ضروريا لتقييم جذور النباتات في بيئة نموها الطبيعية. يعد استخدام المنصات المرتفعة التي تحاكي الظروف الميدانية وجهاز أخذ العينات الأساسي الجذري طرقا بديلة ، مع تقليل كبير في الوقت ، وحجم عينة موحد ، وفقدان أقل للمواد الجذرية. تسمح زراعة النباتات المائية بدراسة التشكل والسمات التشريحية وبيولوجيا الجذور ، بما في ذلك نضح المركبات العضوية والتفاعلات الميكروبية. تضيف البيانات التي تم إنشاؤها من تجارب مختلفة باستخدام طرق أخذ العينات المتنوعة إلى ثروة المعلومات حول سمات نظام جذر قصب السكر.
Introduction
قصب السكر (Saccharum spp.) ، وهو مصدر مهم للغذاء والطاقة الحيوية ، هو محصول صناعي مهم مناسب للزراعة في العديد من البلدان ذات الظروف المناخية الاستوائية وشبه الاستوائية. نظرا لمسار التمثيل الضوئي C4 لامتصاص الكربون ، فإن قصب السكر عالي الإنتاجية ، ويستخدم بكفاءة المدخلات الزراعية مثل المياه والأسمدة. تنتج معالجة قصب السكر بعد الحصاد منتجات ذات قيمة اقتصادية مثل السكر والجاجري ، جنبا إلى جنب مع منتجاته الثانوية - دبس السكر والإيثانول والطاقة. يتم إنتاج قصب السكر من قبل ما يقرب من 100 دولة على مساحة 25.97 مليون هكتار ، وهو ما يمثل حوالي 1.5٪ من إجمالي الأراضي الصالحة للزراعة. تساهم الهند وحدها في 16٪ من إنتاج قصب السكر العالمي (حوالي 306 طن متري) ، بمتوسط إنتاجية يبلغ 70 طن هكتار - 1 1. تشمل الضغوط اللاأحيائية الرئيسية التي تؤثر بشكل كبير على إنتاج قصب السكر نقص المياه ، والتشبع بالمياه ، ودرجات الحرارة القصوى ، وخصائص التربة مثل نقص المغذيات والملوحة والصودية والقلوية. يتمثل التحدي الأكبر لتطوير محاصيل غير أحيائية تتحمل الإجهاد في تحديد سمات محددة تمنح ميزة كبيرة في الغلة في ظل ظروف الإجهاد.
العديد من جوانب فسيولوجيا قصب السكر غير مفهومة جيدا ، بما في ذلك العلاقة بين الجذر والبراعم ، والتي تؤثر بشكل كبير على إنتاجية قصب السكر. لم تتم دراسة جذر قصب السكر جيدا مثل البراعم ، على الرغم من أن الأنواع المختلفة ، مثل جذور المجموعات وجذور البراعم والجذور البالغة ، قد تكون متميزة من الناحية التنموية بوظائف مختلفة. لوحظت اختلافات وراثية فيما يتعلق بعدد وطول جذور sett الناشئة أثناء الإنبات2. تتورط جذور Sett في إنبات براعم قصب السكر ، مما يضمن إنشاء المحاصيل المبكرة ، ويتم استبدالها لاحقا بجذور البراعم ، وهي قوية ، تخرج من قاعدة اللقطة النامية3. تساعد الفروع الدقيقة التي لوحظت في جذور sett في تثبيت النباتات الصغيرة وتساعد في امتصاص الماء والمواد المغذية حتى يتم استبدالها بجذور البراعم. على غرار جذور sett ، تنشأ جذور البراعم أيضا من جذر البدائية الموجودة في السلاسل الداخلية السفلية غير الموسعة للقصب.
نظرا لاستمرار جذور البراعم في النبات لفترة أطول ، فإنها تكون أكثر سمكا بمقدار 4 × -10 مرات من جذور sett. تشكل جذور البراعم نظام الجذر الوحيد لقصب السكر ، ولها دور مهم في زيادة النمو والتطور. ترتبط قوة جذور النبتة بشكل إيجابي بالقوة الخضرية الإجمالية للنبات. يؤدي التطور المستمر للجذور الناتجة عن دوران جذور الجذور وجذور البراعم إلى ظهور "نظام الجذر البالغ" لقصب السكر ، والذي يتكيف باستمرار مع الظروف البيئية السائدة. بشكل عام ، يوفر نظام الجذر الأعمق والأكثر إنتاجا المزيد من المياه والمواد المغذية للمحصول أكثر من التوزيع الضحل للجذور. كشفت عمليات التشريح الدورية أنه عندما كان محتوى رطوبة التربة مرتفعا ، لوحظت أنظمة جذر ضحلة ، في حين تطور نظام جذر أعمق بكثير مع انخفاض منسوب المياهالجوفية 2. يظل نظام الجذر في قصب السكر نشطا حتى بعد حصاد المحصول ، مما يساهم في نمو محصول الراتون حتى تظهر جذور براعم جديدة من البراعم تحت الأرض4. زاوية الجذر ومستوى تفرع الجذر عاملان مهمان يحددان حجم التربة التي تستكشفها جذور النباتات. يمكن تغيير زاوية الجذر ، وهي سمة وراثية ، من خلال التربية التقليدية أو الأساليب الجزيئية لتحسين تحمل الضغوط الحيوية وغير الحيوية. على العكس من ذلك ، يتأثر مستوى تفرع الجذور في الغالب بالبيئة ، مما يستلزم المراقبة الدورية لتطور الجذور واستجابتها لظروف التربة المحلية.
تم فحص السمات التشريحية لجذور قصب السكر للتأكد من الاختلافات فيما يتعلق بالنمط الجيني والبيئة. يشبه تشريح الجذور الثابتة في قصب السكر تشريح الجذور الناضجة في الأعشاب الأخرى مثل الذرة ، حيث تتكون القشرة من طبقات خلايا متمايزة جيدا في نمط منتظم. يتم تشويه الأدمة الباطنة ، تليها دراجة هوائية أحادية الطبقة. عناصر Metaxylem هي الموصلات الرئيسية أو أيونات الماء والمغذيات ، مرتبة شعاعيا وتتخللها مجموعات من اللحاء ، والأخيرة تتكون من عنصر غربال مع خليتين مصاحبتين. تشكل الكتلة المركزية الكبيرة للخلايا غير المتمايزة لب الجذر. تتوافق السمات التشريحية المميزة لأصناف قصب السكر مع الخصائص الهيدروليكية للجذر ، وبالتالي تؤثر على حركة الماء. كشفت الدراسات المبكرة حول الاختلافات في الصفات التشريحية الجذرية لقصب السكر أنه في ظل ظروف إجهاد الرطوبة المنخفضة ، لوحظ سماكة واضحة لجدار الخلية في الطبقات الموجودة داخل الأدمة الداخلية مباشرة ، بين اللب ومنطقة الأوعية الدموية ، وحول الأوعيةالدموية 5. قد تكون هذه الخلايا السميكة تكيفا لمنع التدفق العكسي للنسغ وللقوة الميكانيكية أثناء الإجهاد.
تشمل بعض السمات المهمة المتورطة في مقاومة قصب السكر للجفاف السماكة النسبية وعدد طبقات الأديم الخارجية ، ونسبة القشرة إلى الشاهدة ، والفراغات بين الخلايا في القشرة ، وأطراف شعر الجذور السميكة. تختلف نسب المساحة التي تشغلها الخلايا القشرية إلى المنطقة التي تشغلها الأنسجة النجمية لجذور البراعم اختلافا كبيرا بين أصناف قصب السكر ، مع تباين كبير فيما يتعلق بمساحة الشاهدة6. ترتبط الموصلية الهيدروليكية لجذور قصب السكر بحجم وعدد عناصر الميتاكسيليم في جذور البراعم. من المرجح أن تحدد طبقات الخلايا الكارهة للماء داخل الجذر مناطق حركة الماء الخارسة. تم العثور على العصابات الكاسبارية المصابة في الأدمة الباطنة وفي تحت الجلد (يطلق عليها اسم الجلد الخارجي) ، والتي تعمل كحواجز كارهة للماء. يؤدي تفكك الخلايا القشرية إلى تكوين اللحمة القشرية في الجذور القديمة وفي النباتات المعرضة لظروف نقص الأكسجين ، بغض النظر عن عمر النمو. يرتبط تكوين الحبيضة أثناء إجهاد التشبع بالمياه بالحفاظ على النمو في الأصناف المقاومة7.
مورفولوجيا وتشريح Erianthus arundinaceus [Retzius] Jeswiet (الأجناس المتعلقة بجذور Saccharum spp.) متورطة في تحملها القوي للضغوط البيئية8. تظهر جذور Erianthus arundinaceus جذورا عقدية موزعة بزوايا شديدة الانحدار ، مع جذور كثيفة الشعر لتسهيل امتصاص الماء وأيونات المغذيات من مناطق التربة العميقة. يتكون نظام الجذر العميق من العديد من الجذور العقدية التي تنمو بزوايا نمو حادة. يرتبط قطر الجذور العقدية بحجم وعدد أوعية نسيج الخشب الكبيرة ، حيث يتراوح الأول بشكل كبير من 0.5 مم إلى 5.0 مم. تشكل هذه الجذور العقدية أيضا غمدا جذريا ، مع ظهور تحت الجلد على تصلب خشبي في القشرة الخارجية (الجلد الخارجي) ، واللحمة الليسيجية في الجزء الأوسط من القشرة ، وحبيبات النشا في الشاهدة. بالإضافة إلى الهندسة المعمارية والسمات المورفولوجية ، تلعب المركبات العضوية المنضحة من الجذور دورا مهما في تحديد إنبات النبات وإنشائه وبقائه ، مع تأثيرات أليلوباتشي معقولة و / أو تقارب مع التعايش الميكروبي.
تم توثيق النشاط الأنزيمي للجذور والتفاصيل الدقيقة للتشكل ، بما في ذلك تصبغ غطاء الجذر وإمكانية التجديد عند الإصابة ، في أصناف قصب السكر المزروعة تحت زراعة الزراعةالمائية 9. يظهر نمو الجذور استجابة بلاستيكية للغاية للتغيرات في بيئة التربة ، سواء من حيث شكل وحجم نظام الجذر. سيكون أكثر أنواع قصب السكر كفاءة هو النوع الذي يحتوي على عدد قليل أو مثالي من البراعم ، مع عدد أقل من الجذور ، مما يساعد على البقاء على قيد الحياة بشكل أفضل أثناء الظروف العصيبة. وبالتالي ، يجب أن تشكل الدراسة المنهجية لنظام الجذر مكونا مهما في أي برنامج لتحسينالمحاصيل 10. تعتمد غالبية التجارب التي تركز على الجذور في الغالب على الجوانب التنموية ، بينما غالبا ما يفتقر التركيز على اللدونة الوظيفيةإلى 11. بصرف النظر عن التوزيع الهيكلي ، تلعب مرونة الجذر الوظيفية دورا مهما في البقاء تحت الضغط ، وبالتالي ، من شأنها دعم المربين في جهودهم لتضمين سمات نظام الجذر في خط أنابيب الاختيار لتحمل الإجهاد اللاأحيائي وتحسين متانة قصب السكر.
بالنظر إلى أهميته في الحفاظ على النمو والمحصول في ظل البيئات المجهدة ، من الضروري استكشاف واستخدام التباين المتأصل في سمات نظام جذر قصب السكر. إن التركيز على اختيار السمات والآليات المكونة التي تنقل أنظمة جذر متفوقة هو الطريق إلى الأمام لتحسين أداء المحاصيل في ظل الظروف المناخية المتغيرة. التقييم الظاهري هو عملية طويلة ومكلفة. ومع ذلك، فإن إدماج النهج المتعددة الجوانب من شأنه أن يضيف قيمة هائلة إلى فائدته في تحسين المحاصيل. في هذه المخطوطة ، تم وصف أربعة طرق مختلفة للتنميط الظاهري للجذور في قصب السكر ، ولكل منها مجموعة من المزايا والعيوب الخاصة بها ، مما يعني أن هناك حاجة إلى جهد متضافر للوصول إلى نتائج شاملة وشاملة.
Protocol
1. التنقيب الميداني عن طريق أخذ عينات الخنادق
- قم بتربية أنواع هجينة من قصب السكر التجارية (تسمى فيما يلي "الأصناف") في الحقل من مجموعات ذات برعمين مزروعة على مسافة صفية 120 سم ، مع 90 سم داخل الصفوف ، باتباع حزمة الممارسات الموصى بها (POP) لضمان إنشاء المحاصيل ونموها بشكل جيد.
- في نهاية مرحلة نضج المحصول ، استخدم حفارة لحفر خندق (بعمق 1.5 متر وعرض 1.0 متر) في الحقل. من خلال النفث المستمر للمياه ، تأكد من تطهير التربة من مناطق الجذر دون الإضرار بالجذور (الشكل 1).
- عندما ترتخي التربة الملتصقة ، اقتلع القصب مع نظام الجذر واصطحبه إلى المختبر للقياس اليدوي لعدد الجذور وطول الجذر والحجم والوزن.

الشكل 1: طريقة أخذ عينات الخندق للتنقيب الميداني عن الجذور. (أ) خندق جانبي محفور على طول الحقل ، (ب) نفث المياه ، و (ج) منظر داخلي يوضح عمق الخندق. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. جهاز أخذ العينات الأساسي الجذر لتقليل أخطاء أخذ العينات
- استخدم جهاز أخذ عينات أسطواني من قلب الجذر بارتفاع 61 سم وقطر 16 سم يزن 8 كجم ، مصنوع باستخدام مادة فولاذية خفيفة (MS) لأخذ عينات من جذر قصب السكر في الحقل. قم بتوفير حافة حادة في الحافة السفلية لجهاز أخذ العينات لتسهيل الاختراق السهل أثناء إدخالها في التربة. قم بتزويد الجزء العلوي بأطواق بقطر 3 سم لرفع جهاز أخذ العينات (الشكل 2).
- قم بتربية أصناف قصب السكر في الحقل من مجموعات ذات برعمين مزروعة على مسافة صفية 120 سم ، مع 90 سم داخل الصفوف ، باتباع الملوثات العضوية الثابتة الموصى بها لضمان إنشاء المحاصيل ونموها بشكل جيد.
- في مرحلة نضج المحصول ، اربط الحافة العلوية لجهاز أخذ العينات باللقطة / القصب الأساسي والمطرقة باستمرار للوصول إلى عمق التربة المطلوب (45 سم). ارفع كتلة التربة بالكامل في جهاز أخذ العينات واغسلها بعناية تحت الماء الجاري لفصل الجذور الملتصقة.
- بعد الغسيل الشامل للجذور ، قم بتسجيل الحجم ومساحة السطح والطول والوزن عن طريق القياس اليدوي ، وكذلك عن طريق نشر الجذور على صواني شفافة لمسح الصور الرقمية المقابلة وتحليلها باستخدام البرنامج المشار إليه (انظر جدول المواد).

الشكل 2: جهاز أخذ العينات الأساسي الجذر. (أ) الأبعاد، (ب) المنظر العلوي، (ج) موقع أخذ العينات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. هيكل التنميط الظاهري للجذر لتسهيل أخذ العينات في المراحل الظاهرية المختلفة
- قم ببناء هيكل تنمط ظاهري للجذر يتكون من ثلاث مقصورات متجاورة بأبعاد 4.5 م × 10.1 م لأخذ عينات من جذور قصب السكر ، مع أحكام لتفكيك الجدران الجانبية يدويا للكشف عن نظام الجذر تحت الأرض (حتى عمق 80-100 سم) (الشكل 3). قم ببناء الجدران الجانبية بألواح مسبقة الصب بأبعاد 1.8 متر وعرضها 30 سم وسماكة 4 سم.
- املأ الهيكل وضغطه بتربة الحقل ، مع ترك مسافة رأس ~ 20 سم ، مع فتحات تصريف كافية لتسهيل تهوية التربة.
- زرع رقائق البراعم من استنساخ الأصول الوراثية التي تتكون من Saccharum officinarum L. و Saccharum spontaneum L. و Saccharum barberi Jesw. و Saccharum sinense Roxb. و Saccharum robustum Brandes و Jeswiet ex Grassl. (يشار إليها فيما يلي ب "Saccharum spp. استنساخ") والسماح لها بالإنبات لمدة 30 يوما في protrays التي تشتمل على وسائط التجذير (التربة الحمراء: روث ساحة المزرعة: الرمل = 2: 2: 1). زرع مجموعات موحدة وصحية في الهيكل على تباعد صف 90 سم ، مع 60 سم داخل الصفوف ، باتباع الملوثات العضوية الثابتة الموصى بها لضمان إنشاء المحاصيل ونموها بشكل جيد.
- خلال المراحل التكوينية (60-120 يوما بعد الزراعة [DAP]) والنمو الكبير (120-150 DAP) ، قم بإزالة الجدران الجانبية المصنوعة من الألواح مسبقة الصب يدويا ، متبوعا بالرش المستمر لنفاثة الماء لكشف الجذور.
- اقتلع نظام الجذر بالكامل ونقله إلى المختبر للقياس اليدوي للطول والحجم والوزن ، وانشر الجذور على صواني شفافة لمسح وتحليل الصور الرقمية المقابلة في البرنامج المشار إليه (انظر جدول المواد).
- فرض إجهاد الجفاف عن طريق حجب الري في إحدى المقصورات ، وسد فتحات التصريف في المقصورة الثانية للحفاظ على تشبع التربة لمحاكاة إجهاد التشبع بالمياه. ري المقصورة الثالثة وفقا للملوثات العضوية الثابتة الموصى بها للحفاظ على السعة الميدانية والعمل كعنصر تحكم.

الشكل 3: هيكل التنميط الظاهري للجذر. (أ) الأبعاد ، (ب) نظرة عامة على المقصورات الثلاث ، و (ج) عرض مقصورة واحدة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. الزراعة المائية للنباتات لدراسة بيولوجيا الجذور
- قم بتصنيع نظام الزراعة المائية الداخلي في بيت زجاجي يتم التحكم فيه بالبيئة يفضي إلى زراعة قصب السكر لدراسة التفاصيل الدقيقة لبيولوجيا الجذر. أضف ~ 15 لترا من محلول المغذيات المعدل في Hoagland (الجدول 1) إلى خزانات زجاجية بأبعاد 20 سم × 20 سم × 50 سم ، مع التهوية التي توفرها مضخات أحواض السمك (الشكل 4).
- زرع رقائق البراعم من أصناف قصب السكر و Saccharum spp. استنساخ واسمح لها بالإنبات لمدة 30 يوما في نباتات تشتمل على لب جوز الهند السماد. زرع مجموعات موحدة وصحية في خزانات الزراعة المائية بتردد ثلاثة مجموعات لكل خزان ، مع الحرص على وضع الجذر بالكامل في محلول المغذيات. قم بتغطية الخزانات بقطعة قماش سوداء لضمان عدم تعرض الجذور للضوء. استخدم شبكة بلاستيكية (20 سم × 20 سم) على حافة الخزانات الزجاجية لدعم النباتات في وضع مستقيم.
- في نهاية مرحلة الإنبات (60 يوما) ، اجمع إفرازات الجذر عن طريق غمر جذور النباتات السليمة في 50 مل من محلول المصيدة (الماء المقطر المزدوج المعقم) لمدة 4 ساعات (0800 ساعة إلى 1200 ساعة) خلال وقت ذروة نشاط التمثيل الضوئي. قم بتصفية المحلول الذي تم جمعه من خلال ورق ترشيح Whatman ، ثم قم بتمريره عبر أعمدة زجاجية مملوءة بتبادل الأنيون متبوعا براتنجات التبادل الكاتيوني12. تبخر الأجزاء المملوءة حتى تجف وخزنها عند -20 درجة مئوية حتى مزيد من المعالجة.
- تحليل عينات إفرازات الجذر المعالجة بواسطة HPLC لتقدير الأحماض العضوية12 وقياس الطيف الضوئي لتقدير الفينولات الكلية13 والبروتينات14 والسكريات15 والأحماض الأمينية16 وفقا للبروتوكول القياسي.
- راقب نمو الجذور على فترات أسبوعية لتسجيل تصبغ طرف الجذر وكثافة شعر الجذور. تقييم نشاط الإنزيمات ، بيروكسيداز17 وسوبر أكسيدديسموتاز 18 ، والمحتوى الفينوليالكلي 19 في الشهر الثالث وفقا للبروتوكول القياسي.
- قم بتقييم الاستجابة لإصابة الجذر عن طريق إحداث شريحة طولية في الجذر الأولي حتى طرف الجذر باستخدام شفرة جراحية معقمة ، ومراقبة التغييرات بشكل دوري.
| كيميائي | التركيز النهائي |
| نترات البوتاسيوم | 0.608 غ· L-1 |
| نترات الكالسيوم | 1.415 غ· L-1 |
| فوسفات ثنائي هيدروجين البوتاسيوم | 0.164 غ· L-1 |
| كبريتات المغنيسيوم | 0.560 غ· L-1 |
| ملح أحادي الصوديوم EDTA-الحديديك | 6.00 جم · 250 لتر -1 |
| حمض البوريك | 1.43 جم · 250 لتر -1 |
| رباعي هيدرات كلوريد المنغنيز | 0.91 جم · 250 لتر -1 |
| كبريتات الزنك | 0.11 جم · 250 لتر -1 |
| النحاسية سوفات | 0.04 جم · 250 لتر -1 |
| حمض الموليبديك | 0.01 جم 250 لتر -1 |
الجدول 1: تكوين محلول المغذيات المعدل للزراعة المائية لقصب السكر.

الشكل 4: إعداد الزراعة المائية. الإعداد (أ) مخصص لزراعة قصب السكر و (ب) محصول عمره 5 أشهر (تمت إزالة القماش الأسود لغرض التصوير الفوتوغرافي فقط). تم تعديل هذا الرقم من Hari et al.9. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
الاختلاف في السمات المورفولوجية الجذرية لأصناف قصب السكر
يتم عرض الصور التمثيلية لنظام الجذر في Co 62175 ، التي تم التنقيب عنها من الحقل عن طريق أخذ عينات الخنادق وزراعتها في إعداد الزراعة المائية ، في الشكل 5 أ ، ب. لوحظت جذور طويلة (~ 100 سم) في أصناف Co 62175 و Co 99006 ، بينما سجل Co 99006 أعلى وزن جذر (127 جم · كتلة −1). تم تسجيل سمات الجذر باستخدام جهاز أخذ عينات قلب الجذر ، والذي كشف أن Co 62175 لديه نظام جذر متفوق مقارنة ب Co 99006 فيما يتعلق بطول الجذر التراكمي ومساحة سطح الجذر وحجم الجذر (الشكل 5C-E). ومع ذلك ، كان متوسط قطر الجذر أعلى في Co 99006 منه في Co 62175 (الشكل 5F).
التباين في السمات المورفولوجية الجذرية ل Saccharum spp. استنساخ
أظهرت السمات المورفولوجية في المرحلة التكوينية تباينا كبيرا بين Saccharum spp. استنساخ ، مع أعلى طول تراكمي للجذر يبلغ 39615.72 سم لكل كتلة لوحظ في S. spontaneum (IND 85-490) ، بينما لوحظ أدنى في S. sinense (أوشيما) (الشكل 6 أ). لوحظت أعلى مساحة سطح جذر لكل كتلة (4700.31 سم2) في S. spontaneum (IND 85-490) ، تليها S. officinarum (Awela Green Sport) ، وأدنى مستوى تم تسجيله في S. sinense (أوشيما) (الشكل 6 ب). لوحظ اتجاه مماثل في حالة حجم الجذر ومتوسط قطر الجذر (الشكل 6C ، D). تم قياس مورفولوجيا الجذور التي تم أخذ عينات منها في مرحلة النمو الكبرى يدويا وكشفت أن أطول الجذور (131 سم) كانت موجودة في S. robustum (NG 77-237) (الشكل 6E) ، في حين أن الوزن الجاف للجذور كان الأعلى في S. spontaneum (IND 85-490: 57.4 g · clump−1) والأدنى في S. sinense (أوشيما: 11.2 جم · كتلة −1) (الشكل 6F). اتبعت نسبة حجم الجذر ونسبة الجذر إلى البراعم اتجاها مشابها لوزن الجذر الجاف (الشكل 6G ، H).
التباين في السمات التشريحية الجذرية ل Saccharum spp. استنساخ
اختلفت مساحة المقطع العرضي للجذور عند 10 مم من الحافة بشكل كبير بين Saccharum spp. استنساخ ، مع S. spontaneum (IND 85-490) أظهر أكبر مساحة (27646.8 مم2) ، بينما S. sinense (أوشيما) سجلت أدنى (7539.1 مم2) (الجدول 2). المنطقة الرئيسية في S. sinense (أوشيما) كانت تحتلها الخلايا القشرية ، بينما في S. spontaneum (IND 85-490) ، كانت المنطقة التي يشغلها نسيج الشاهدة بارزة ، وهو ما ينعكس في البيانات المتعلقة بنسبة القشرة إلى الشاهدة. تراوح عدد عناصر الميتاكسيل من 6 (S. officinarum: Awela Green Sport) إلى 13 (S. spontaneum: IND 85-490) ، بينما تراوح عدد المساحات الهوائية (اللحمة اللحمية الليزيجينية) من 12 (S. barberi: Putli Khajee) إلى 32 (S. spontaneum: IND 85-490). كانت المساحة التي تشغلها عناصر الميتاكسيل أعلى (791.3 مم2) في S. barberi (Putli Khajee) والأدنى (254.3 مم2) في S. sinense (أوشيما). كانت المساحة التي تشغلها الحبيضة أعلى (4921.3 مم2) في S. spontaneum (IND 85-490) ، في حين أن S. sinense (Oshima) و S. robustum (NG 77-237) كانت الجذور خالية من الخلايا اللحمية في ظل ظروف الري العادية. Saccharum sinense (Oshima) و S. spontaneum (IND 85-490) و S. barberi (Putli Khajee) أظهر فينيات تشريحية متفوقة للجذور في ظل ظروف الجفاف وإجهاد التشبع بالمياه (الشكل 7A-C). كانت شعر الجذور الطويلة ، والأديم الخارجي المتصلب ، وانخفاض طبقات الخلايا القشرية ، وزيادة اللحمة القشرية ، وزيادة مساحة الشاهدة ، وعدد الأوعية الخشبية ذات القطر الكبير مواتية في ظل الجفاف ، في حين أن زيادة قطر الجذر وارتفاع مساحة الخلايا القشرية مع زيادة الخلايا اللحمية عززت القوة الميكانيكية ، ومسامية الجذر ، وانتشار الأكسجين تحت إجهاد التشبع بالمياه.
الاختلاف في نوع وكمية إفرازات الجذر من Saccharum spp. استنساخ
من بين المركبات العضوية التي تنضح بها Saccharum spp. استنساخ خلال مرحلة الإنبات ، كانت نسبة البروتين الكلي هي الأعلى ، تليها الكربوكسيل والسكريات والفينولات والأحماض الأمينية الحرة. أظهر Saccharum robustum (NG 77-221) أعلى (5.11 مجم · جم − 1 · وزن جذر طازج [RFW] · h − 1 ) إجمالي نضح الكربوكسيل ، بينما الأدنى (0.65 مجم · جم − 1 · RFW · h −1) في S. spontaneum (IND 85-490) ، مع اختلاف كبير في نوع وكمية حمض الكربوكسيل الفردي المنضح (الشكل 8 أ). نضح Saccharum officinarum (Awela Green Sport) بأعلى مستويات الفينول الكلية (0.034 مجم جم −1 · RFW · h − 1 ) ، في حين أن الأدنى (0.002 مجم · جم −1 · RFW · h −1) لوحظ في حالة S. spontaneum (IND 85-490) (الشكل 8 ب). أعلى نضح إجمالي للبروتين (3.23 مجم جم −1 · لوحظ RFW · h − 1 ) في S. officinarum (Awela Green Sport) ، في حين أن أعلى نسبة سكر إجمالي (0.22 مجم · جم −1 · RFW · h − 1) وإجمالي الأحماض الأمينية الحرة (0.04 مجم · جم −1 · RFW · h − 1) في S. sinense (أوشيما) (الشكل 8C-E). أقل نضح إجمالي للبروتين (2.08 مجم جم −1 · RFW · h −1) في S. spontaneum (IND 85-490) ، بينما S. robustum (NG 77-221) ينضح بأقل كميات من السكر الكلي (0.05 · مجم · جم −1 · RFW · h − 1 ) وإجمالي الأحماض الأمينية الحرة (0.01 مجم · جم − 1 · RFW · ح − 1).
التباين في تصبغ طرف الجذر ، والنشاط الأنزيمي ، والمحتوى الفينولي الكلي لأصناف قصب السكر
تراوحت أشكال غطاء الجذر من المثلث البسيط (Co 62175) إلى القبة (Co 86032) ، بينما تراوحت تصبغ غطاء الجذر من اللون الوردي الفاتح (Co 62175) إلى البنفسجي الغامق (Co 86032) ، مع اختلافات كبيرة في كثافة شعر الجذور (الشكل 9A-C). كان نشاط البيروكسيديز أعلى (40 وحدة · جم −1 · ساعة −1) في Co 86032 والأدنى (26 وحدة · g − 1 · h − 1) في Co 62175 ، بينما انعكس الاتجاه في حالة نشاط ديسموتاز الأكسيد الفائق في الجذور (الشكل 9D ، E). وبالمثل ، كان المحتوى الفينولي الكلي أعلى (18 ميكروغرام جم −1) في Co 86032 والأدنى (15 ميكروغرام جم −1) في Co 62175 (الشكل 9F).
التباين في مراحل النمو للتجديد عند إصابة جذر أصناف قصب السكر
تم اختبار التجديد عند إصابة الجذر في أصناف قصب السكر CoC 671 و Co 06022 التي تم تربيتها في إعداد الزراعة المائية (الشكل 10A-I). في CoC 671 ، ظهرت الجذور الثانوية في اليوم الثالث من الإصابة ، بينما في Co 06022 ، حدث بدء الجذر الثانوي فقط في اليوم العاشر. علاوة على ذلك ، أظهر الجذر الأساسي ل Co 06022 أعراض الشيخوخة في اليوم الثالث ، بينما ظلت جذور CoC 671 صحية نسبيا. كما لوحظت الجذور الثلاثية في اليوم العاشر في CoC 671.

الشكل 5: أنظمة جذر Co 62175 والسمات المورفولوجية المختلفة. نظام جذر (أ) Co 62175 تم التنقيب عنه عن طريق أخذ عينات الخندق ، (ب) Co 62175 المزروع في إعداد الزراعة المائية ، والسمات المورفولوجية (ج) طول الجذر التراكمي ، (د) مساحة سطح الجذر ، (ه) حجم الجذر ، و (F) متوسط قطر الجذر المسجل باستخدام جهاز أخذ عينات قلب الجذر. تمثل البيانات متوسط ± SEM (ن = 3). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: السمات المورفولوجية للجذور. (أ) طول الجذر التراكمي ، (ب) مساحة سطح الجذر ، (ج) حجم الجذر ، و (د) متوسط قطر الجذر في المرحلة التكوينية ، و (ه) طول أطول جذر ، (F) الوزن الجاف للجذر ، (G) حجم الجذر ، و (H) نسبة الجذر إلى البراعم في مرحلة النمو الكبرى ل Saccharum spp. استنساخ مسجلة من بنية التنميط الظاهري (S. officinarum: Awela Green Sport ، S. spontaneum: IND 85-490 ، S. sinense: Oshima ، S. barberi: Putli Khajee ، S. robustum: NG 77-237). تمثل البيانات متوسط ± SEM (ن = 3). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 7: السمات التشريحية الجذرية ل S. sinense استنساخ أوشيما. (أ) ظروف النمو الطبيعية واستجابة ل (ب) الجفاف و (ج) إجهاد التشبع بالمياه. أشرطة المقياس = 100 ميكرومتر. الاختصارات: rh = شعر الجذر. ae = aerenchyma lysigenous ؛ mx = ميتاكسيليم. ex = exodermis; EP = البشرة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 8: نضح الجذور. (أ) الكربوكسيل ، (ب) إجمالي الفينول ، (ج) البروتين الكلي ، (د) السكر الكلي ، و (ه) إجمالي الأحماض الأمينية الحرة في مرحلة الإنبات في Saccharum spp. استنساخ (S. officinarum: Awela Green Sport ، S. spontaneum: IND 85-490 ، S. sinense: Oshima ، S. barberi: Putli Khajee ، S. robustumNG 77-221.: تمثل البيانات متوسط ± SEM (ن = 3). الاختصار: RFW = الوزن الطازج للجذر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
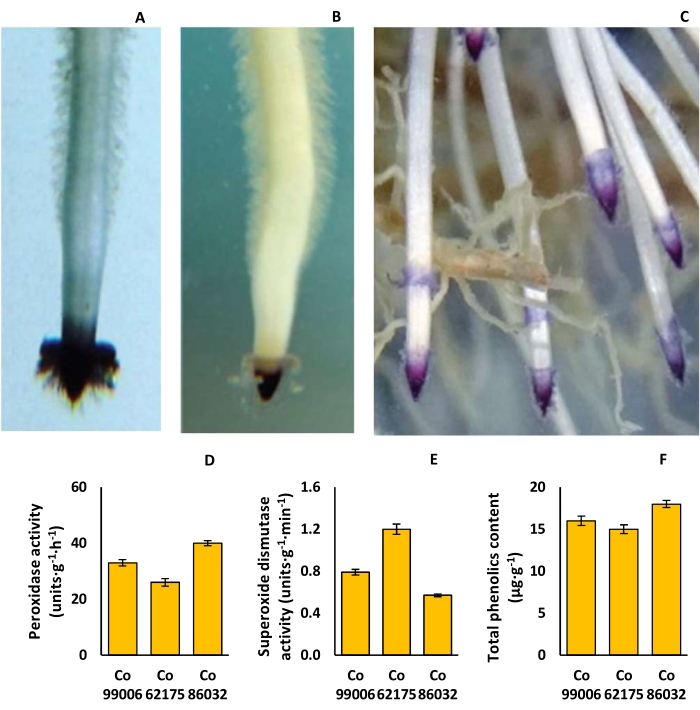
الشكل 9: سمات الجذور في أصناف قصب السكر. (أ) غطاء جذر مثلث في Co 62175 ، (ب) غطاء جذر على شكل قبة في Co 86032 ، (ج) تصبغ طرف الجذر البنفسجي العميق في Co 86032 ، (د) نشاط البيروكسيديز ، (ه) نشاط ديسموتاز فائق الأكسيد ، و (F) المحتوى الفينولي الكلي للنباتات التي يتم تربيتها في الإعداد المائي. تمثل البيانات في D و E و F متوسط ± SEM (ن = 3). تم تعديل هذا الرقم من Hari et al.9. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 10: مراحل النمو للتجديد عند إصابة الجذر في أصناف قصب السكر التي نشأت في الإعداد المائي. (A-E) CoC 671 و (F-I) Co 06022 ؛ (أ ، و) جذور غير مصابة ؛ (ب ، ز) الجذور المصابة بالتقطيع الطولي ؛ (ج ، ح) بعد 3 أيام من الإصابة ؛ (D ، E ، I) بعد 10 أيام من الإصابة. تم تعديل هذا الرقم من Hari et al.9. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| مساحة المقطع العرضي للجذر (مم2) | نسبة القشرة إلى الشاهدة | عدد طبقات الأديم الخارجي | عدد عناصر الميتاكسيليم | متوسط قطر الميتاكسيليم (مم) | عدد المساحات الجوية | المنطقة التي يشغلها الميتاكسيليم (مم2) | المساحة التي تشغلها المساحات الجوية (مم2) | |
| S. officinarum | 6936.3±200.2 | 0.508±0.015 | 1.00±0.03 | 6.00±0.17 | 8.5±0.3 | 14.00±0.40 | 340.3±9.8 | 1993.0±57.5 |
| S. عفوية | 27646.8±957.7 | 0.481±0.017 | 2.00±0.07 | 13.00±0.45 | 6.6±0.2 | 32.00±1.11 | 444.5±15.4 | 4921.3±170.5 |
| S. sinense | 7539.1±261.2 | 0.727±0.025 | 2.00±0.07 | 9.00±0.31 | 6.0±0.2 | - | 254.3±8.8 | - |
| س. باربري | 18859.6±435.6 | 0.692±0.015 | 1.00±0.02 | 7.00±0.16 | 12.0±0.3 | 12.00±0.28 | 791.3±18.3 | 4454.6±102.8 |
| S. robustum | 8328.1±288.5 | 0.563±0.019 | 2.00±0.07 | 10.00±0.35 | 7.0±0.2 | - | 384.7±13.3 | - |
الجدول 2: السمات التشريحية الجذرية التي لوحظت في Saccharum spp. استنساخ. تمثل البيانات متوسط ± SEM (ن = 3) (S. officinarum: Awela Green Sport ، S. spontaneum: IND 85-490 ، S. sinense: Oshima ، S. barberi: Putli Khajee ، S. robustum: NG 77-237).
Discussion
تحدد أنظمة الجذر إنتاجية قصب السكر فوق سطح الأرض ، مما يستلزم استكشاف جميع جوانبه وفهمها بدقة لتطوير أصناف مقاومة للمناخ. استخدم فريق من العلماء في ICAR-SBI يتألف من علماء فسيولوجيا النبات ، وعالم الأحياء الدقيقة ، ومهندس زراعي ، وعالم كيمياء حيوية ، ومربي النباتات مناهج متعددة الجوانب للتنميط الظاهري لجذور قصب السكر ، بما في ذلك التنقيب الميداني عن طريق أخذ عينات الخنادق ، واستخدام أخذ عينات قلب الجذر ، والمنصات المرتفعة لأخذ عينات الجذور ، وتربية النباتات تحت الزراعة المائية. بالنظر إلى أن المنهجية الفردية قد لا تكون شاملة و / أو حصرية ، فإن تكامل المعلومات مطلوب للكشف عن السمات المكونة وآليات النمط الظاهري للجذر المثالي. تم عزل الطرق السابقة لأخذ عينات الجذر في جهودهم ولكنها كانت مفيدة لتطوير الاستراتيجية الموضحة هنا.
كان فينكاترامان وتوماس5 رائدين في دراسة جذور قصب السكر من خلال وصف ثلاث طرق مناسبة للتحقيق. في الطريقة الأولى ، تم حفر حفرة عميقة على جانب النبات ، مما سمح بتشريح الجذور من التربة وتبييضها وتصويرها في مواقعها الطبيعية. في الطريقة الثانية ، تم حفر حفر عميقة على الجانبين المتقابلين للنبات. تم وضع أطر من 2 في شبكة سلكية على جوانب الحفر المجاورة للنبات ، مع إدخال قضبان حديدية من خلال عرض التربة المتداخلة لتثبيت الجذور في مواقعها. ثم تم غسل التربة بالماء ، وتم تصوير الجذور. كانت الطريقة الثالثة هي عمل مزارع خاصة لدراسة الجذر. تم وضع الشباك السلكية على مستويات معينة في قطعة أرض محفورة ، وأعيد ملء الحفريات ، لتحل محل التربة في طبقاتها كما كان من قبل. نمت النباتات المراد دراستها في قطعة الأرض. في وقت الفحص ، تم غسل التربة حول النباتات بالماء ، تاركة أنظمة الجذر معلقة في موضعها في شبكات الشبكة السلكية.
طور Rege and Wagle20 طريقة لدراسة الجذر في ظل ظروف الري عن طريق حفر حفرة عموديا أسفل حافة القصب وتعريض نظام الجذر عن طريق غسل التربة في منطقة محددة. تسبب في أقل إهدار للمواد النباتية ومكن الباحثين من دراسة نظام الجذر في الموقع نوعيا وكميا. تم إجراء دراسة خاصة للتحقيق في بنية جذور قصب السكر وتطورهاوسلوكها 21. أثبتت "طريقة صندوق الجذر" و "طريقة حفر التربة" أنها مفيدة جدا في دراسة توزيع جذور قصب السكر. وجد أن هناك جذورا ضحلة في التربة الثقيلة أكثر من التربة المختلطة أو الأخف وزنا. فضل الملمس الفضفاض والتهوية السائدة في الأخير تغلغل الجذور في مناطق التربة العميقة ، مما يجعلها أكثر قابلية لنمو الجذور ، نمت الجذور الأولى التي تطورت مباشرة إلى أسفل في التربة ، واخترقت أعماق تزيد عن 30-36 بوصة ، تليها جذور ضحلة منتشرة لوحظت في الطبقات السطحية (~ 14 بوصة من التربة السطحية) ، حيث يتم توزيع ~ 85٪ -90٪ من الجذور. لا شك أن الجذور العميقة توفر الرطوبة للنباتات خلال فترات الجفاف. اختلفت سرعة نمو الجذور والبراعم وفقا للظروف المناخية لسنة المحاصيل ومع التنوع. يعد الحفاظ على الجذور في الظروف الفسيولوجية النشطة أمرا مهما للنمو الأمثل للنبات ، حيث غالبا ما يتم إزعاجه من ممارسات الزراعة ، والتي يجب تجنبها إن أمكن. تمت دراسة تقلب نظام الجذر في أصناف مختارة من قصب السكر في كوبا بواسطة "طريقة الفحص المباشر"22. تم توثيق أوصاف تطور الجذر جنبا إلى جنب مع الرسوم التوضيحية لتوزيع الجذور في التربة.
استند التنقيب الميداني عن الجذور عن طريق أخذ عينات الخنادق إلى عمل Venkatraman و Thomas5 و Rege and Wagle20 و Ryker و Edgerton21. على الرغم من حقيقة أنها الطريقة الأكثر شاقة واستهلاكا للوقت ، إلا أن أخذ العينات الميدانية في الموقع أمر حتمي لفهم الأنماط الظاهرية للجذور في بيئة نموها الطبيعية. كشفت مقارنة طرق قياس الجذور في بنجر السكر والحبوب أنه يجب تفسير البيانات التي تم الحصول عليها من جدار ملف تعريف الخندق بحذر ، حيث كانت كثافة طول الجذر المحسوبة (RLD) (نسبة طول الجذر التراكمي إلى حجم التربة) أقل بمقدار 4x-10x من تلك التي تم الحصول عليها من طريقة قلب الجذر ، اعتمادا على نوع التربة23. تعد المسافة المناسبة والموحدة من الخندق إلى الساق مهمة لضمان الحد الأدنى من خطأ أخذ العينات وتقليل فقدان الجذور والموارد ، بما في ذلك العمالة. قد لا تكون مراقبة نمو الجذور عن طريق أخذ عينات الخنادق ممكنة للتجارب طويلة المدى ، لأنها مدمرة بطبيعتها ، ولا يمكن رؤية سوى جزء صغير من الجذر بناء على مستوى المراقبة. ومع ذلك ، فإن أخذ عينات الخنادق يوفر تقديرا عاما لتوزيع الجذر والتفاعل مع ملف تعريف التربة24. كشف هذا التحقيق حول انتشار أنظمة الجذر في هجينة قصب السكر التجارية أنه تم العثور على ~ 70٪ من الجذور النشطة فسيولوجيا في نطاق 50 سم من ملف تعريف التربة.
سمحت طريقة أخذ عينات الخندق بالتمييز بين فئات الجذر المختلفة وفقا لعمق حدوثها في ملف تعريف التربة. بشكل عام ، كانت الجذور التي تخترق التربة بشكل أعمق عادة أرق من تلك الموجودة في المناطق الضحلة. لوحظ تباين وراثي واسع فيما يتعلق بطول الجذر وحجمه ووزنه. تساعد التطورات في نمذجة المحاصيل ومحاكاتها في تحسين البيانات التي تم الحصول عليها من طرق أخذ العينات التقليدية من خلال تطوير خوارزميات لتقليل أخطاء أخذ العينات وعدم التجانس التجريبي. تمت مقارنة بيانات RLD لقصب السكر من ملف تعريف التربة في الموقع مع بيانات حفر التربة ، حيث لوحظ أن عد تقاطعات الجذر في ملف تعريف التربة وتقدير RLD باستخدام نموذج أعطى قيم RLD مماثلة لتلك التي تم الحصول عليها باستخدام طريقة قلب التربة25. كشفت مقارنة البيانات التي تم الحصول عليها من طرق حفر التربة والحفرة في فول الصويا عن تقديرات مماثلة للكتلة الحيوية للجذور ، وتطلب الحفر وقتا إجماليا أقل والمزيد منالعمالة 26. كانت العينات القائمة على النواة أكثر دقة ، مما سمح بأخذ العينات في مناطق التجذير العميقة مع الحد الأدنى من الاضطراب في المخطط التجريبي. نظرا لميزة دراسة جذور النباتات في بيئة نموها الطبيعية ، قد يكون أخذ عينات الخنادق مفيدا للجمع بين بيانات ملف تعريف التربة وملف تعريف RLD ، ولكنه لا يسهل أخذ العينات على مساحة واسعة27. في هذا السياق ، أثبت جهاز أخذ العينات الأساسي الجذري فائدته جدا في تحديد توزيع الجذر والسماح بمزيد من العينات على مساحة أكبر.
تم تصميم جهاز أخذ العينات الأساسية الجذرية لتسهيل أخذ العينات الفرعية للجذور من الحقل ، مما يستدعي التوحيد في أخذ العينات بمعامل تباين أقل. لقد قلل بشكل كبير من أخطاء أخذ العينات. تم اعتماد استخدام جهاز أخذ العينات الأساسي الجذري في العديد من المحاصيل. يتطلب قدرا كبيرا من وقت معالجة ما بعد أخذ العينات لأنه يجب إيلاء الكثير من العناية لتجنب فقدان الجذور أثناء الغسيل28. سهل جهاز أخذ العينات الأساسي أخذ عينات من الجذور في حجم ثابت من التربة وأظهر التباين الجيني بين المستنسخة المختبرة لسمات نظام الجذر ، مما يسمح باختبار المزيد من العينات في إطار زمني معين. يمكن اشتقاق RLD ، وهي معلمة مهمة لتقييم صحة النبات ، بدقة بمساعدة جهاز أخذ عينات قلب الجذر. بشكل عام ، يعزى التباين المنهجي إلى موقع الحفر من حيث المسافة من الجذع ، مما قد يؤدي إلى اختلاف كبير في بيانات الجذر. ومع ذلك ، في حالة قصب السكر ، تم تصنيع جهاز أخذ العينات بناء على التشكل الفريد للمحصول ، ويتم تثبيت اللقطة / القصب الأساسي عليه أثناء أخذ العينات. وبالتالي ، يتم ضمان نواة موحدة بقطر 16 سم حول اللقطة / القصب الأساسي لجميع الأصناف لتقليل خطأ أخذ العينات.
لوحظ ارتباط معتد به بين بيانات حجم الجذر المسجلة باستخدام طريقة الماسح الضوئي الجذر وطريقة إزاحة الحجم29. نظرا لأن حجم العينة أقل بكثير من حجم طريقة الخندق ، يمكن تقييم التباين بين الأنماط الجينية باستخدام جهاز أخذ عينات قلب الجذر. يؤثر التباين العشوائي بسبب اللدونة المظهرية ، وعدم تجانس التربة ، وعوامل أخرى غير معروفة على موثوقية البيانات التي تم الحصول عليها من جهاز أخذ العينات الأساسية الجذرية ، والتي يمكن التغلب عليها من خلال القياسات المتكررة واستخدام برامج المحاكاة لتضييق نطاق الاختلافات ذات الصلة وظيفيا27. كشف تقييم افتراضي للتباين بين استراتيجيات حفر التربة المختلفة في الذرة ، بناء على نماذج ثلاثية الأبعاد لبنية نظام الجذر وخوارزمية ترجيحالمساحة 30 ، أن مثل هذه الطرق الفعالة من حيث التكلفة للحصول على تقديرات موثوقة ل RLD قد تكون الطريق إلى الأمام لدراسات الجذر.
تخدم هياكل التنميط الظاهري للجذور ذات المقصورات المجاورة الغرض من محاكاة الحقل ، وفي الوقت نفسه ، تحافظ على التجانس المطلوب لفحص التباين المتأصل في الأصول الوراثية لقصب السكر. سهولة أخذ العينات المدمرة مع ضرر وهدر أقل بكثير من الجذور من أخذ عينات الخنادق تسهل تحليل نظام الجذر بأكمله في مراحل ظاهرية مختلفة. أثبتت صناديق أو غرف الجذر المخصصة بناء على مورفولوجيا المحاصيل وتوزيع الجذور فعاليتها في محاصيل أخرى مثل الذرةالرفيعة 31 وفول الصويا والحنطة السوداء32. وبالمثل ، تم تحسين حجم وعمق المقصورات لدعم نمو قصب السكر. علاوة على ذلك ، تم بناء الجدران الجانبية باستخدام ألواح مسبقة الصب ، والتي يمكن رفعها بسهولة يدويا أثناء أخذ عينات الجذور. يتم أخذ عينات الجذر عن طريق رفع الجدار الجانبي يدويا ، متبوعا بنفث الماء لكشف الجذور. ثم يتم استبدال الجدران الجانبية ، ويتم إعادة ملء التربة ، مما يضمن الحد الأدنى من الضرر للنباتات المجاورة. يمكن توثيق التباين في سمات الجذر في قصب السكر وعلاقته بنمو البراعم في النباتات التي تربى في بنية التنميط الظاهري للجذور. ينتج عن الري الزائد في قصب السكر نظام جذر سطحي ، بينما يشجع نقص المياه على الانتشار الجانبي مع اختراق عميق طفيف33،34. مع زيادة استخدام النيتروجين ، يتم تقليل وزن الجذر ، بينما تنتج الأسمدة الفوسفاتية تأثيرا إيجابيا على نمو الجذور35،36. تسمح المقصورات المجاورة في الهيكل بدراسة استجابات قصب السكر لضغوط غير أحيائية متفاوتة ومستويات مغذيات التربة عن طريق التلاعب بكمية مياه الري واستخدام التربة المستنفدة للمغذيات ، على التوالي.
الاستزراع النباتي المائي هو الطريقة المفضلة لتقييم استجابات إجهاد المغذيات في مجموعة كبيرة ومتنوعة من الأنماط الجينية في فول الصويا12 والأرز37 والقمح38 والذرة 39. يعود تاريخ دراسات الجذر المحاكاة في قصب السكر إلى عام 192340 ، حيث تم استخدام عمود من حلقات الفخار مع شبكة سلكية لدراسة العمق النسبي وخطة الجذور. كما تمت محاولة زراعة الزراعة المائية باستخدام أواني الطهي الفخارية المملوءة بمحلول Knop المخفف للمراقبة المستمرة لتطور الجذور. تتيح منشأة الزراعة المائية الداخلية دراسة التفاصيل الدقيقة لتطور الجذور والتغيرات في بيولوجيا الجذور9. تم تحسين حجم الحاوية وكثافة الزراعة لقصب السكر ، حيث نمت النباتات لمدة تصل إلى 10 أشهر مع الحد الأدنى من السكن. لا يمكن تقييم خصائص الجذور ، بما في ذلك شكل غطاء الجذر وتصبغ طرف الجذر ، إلا في ظل الظروف المائية ، مما يسهل سهولة أخذ العينات وغياب التماسك التربة. قد لا يكون تقييم الاستجابات التنموية والإجهادية على مستوى الجذر ممكنا عند زراعة النباتات في الحقل ، في حين تسمح الزراعة المائية بمثل هذه القياسات. يسهل جمع وتوصيف إفرازات الجذر ، والتي قد لا تكون ممكنة في ظل الظروف الميدانية. على الرغم من أن عدم وجود حواجز مادية أمام تغلغل الجذور هو عيب رئيسي لهذه الطريقة ، إلا أن المراقبة المنتظمة لنمو الجذور هي ميزة عندما تربى النباتات في ظل ظروف الزراعة المائية.
من الضروري إعادة تصميم بنية أصناف قصب السكر الجديدة بناء على نمط ظاهري قوي ومثالي للجذور يمكنه تلبية الطلب على الزراعة المستدامة. تتضمن منصات التنميط الظاهري الجذرية عالية الإنتاجية التي تم تطويرها للأرز والذرة مكونات قابلة للتكيف مع مجموعة واسعة من أنظمة النمو ، مثل التربة والزراعة المائية ، وتقنيات تصوير الجذور المتقدمة ، وأدواتالبرمجيات 41. يوفر رفع مستوى هذه المنصات لقصب السكر مجالا واسعا لتحسين الإنتاجية في المستقبل القريب. على الرغم من التركيز على بيولوجيا الجذر كمحدد مهم لنمو وإنتاجية قصب السكر وتوافر تقنيات التنميط الظاهري للجذور المتقدمة ، فقد أبلغت دراسات قليلة عن سمات جذر قصب السكر في حد ذاتها42،43،44،45. نظرا لأن الجذور هي أكثر أعضاء النبات ديناميكية ، فقد لا تكون منهجية واحدة لتقييم التباين في الأنماط الظاهرية للجذور حاسمة ، خاصة في محصول مثل قصب السكر. ومن شأن تطبيق ودمج التباديل المناسب للمنهجيات بما يتماشى مع أهداف الدراسة أن يعزز فهم أنظمة قصب السكر تحت الأرض.
Disclosures
يعلن جميع المؤلفين أنه لا يوجد تضارب في المصالح.
Acknowledgements
يقر المؤلفون بالبنية التحتية والدعم المقدم من قبل مدير معهد ICAR-Sugare Breeding ، كويمباتور ، لإنشاء مرافق التنميط الظاهري للجذور لقصب السكر. يتم الاعتراف على النحو الواجب بالتمويل المقدم من مجلس أبحاث العلوم والهندسة ، وزارة العلوم والتكنولوجيا ، حكومة الهند ، في شكل جائزة أبحاث الحياة المهنية المبكرة ل KV (ECR / 2017 / 000738). يقر المؤلفون ب Brindha و Karpagam و Rajesh و Sivaraj و Amburose لمساعدتهم في توليد البيانات بطريقة دقيقة.
Materials
| Name | Company | Catalog Number | Comments |
| Aeration pump with pipeline accessories | Purchased from local sources | NA | Used for hydroponic culture of sugarcane |
| Boric acid | Sisco Research Laboratories, India | 80266 | Preparation of modified Hoagland's solution |
| Calcium nitrate | Central Drug House, India | 27606 | Preparation of modified Hoagland's solution |
| Composted coir pith | Purchased from local sources | NA | Used for germinating sugarcane setts |
| Cupric sulphate | Sisco Research Laboratories, India | 38869 | Preparation of modified Hoagland's solution |
| DEAE-cellulose | Sisco Research Laboratories, India | 10529 | anion exchange resin for processing of root exudates |
| EDTA-ferric monosodium salt | Sisco Research Laboratories, India | 59389 | Preparation of modified Hoagland's solution |
| Farm yard manure | Purchased from local sources | NA | Used for germinating sugarcane setts |
| Glass tanks | Fabricated in-house | NA | Used for hydroponic culture of sugarcane |
| HPLC | Agilent Technologies | 1200 Infinity | Quantification of organic acids in root exudates |
| Magnesium sulphate | Sisco Research Laboratories, India | 29117 | Preparation of modified Hoagland's solution |
| Manganese chloride | Sisco Research Laboratories, India | 75113 | Preparation of modified Hoagland's solution |
| Molybdic acid | Sisco Research Laboratories, India | 49664 | Preparation of modified Hoagland's solution |
| Potassium dihydrogen phosphate | Central Drug House, India | 29608 | Preparation of modified Hoagland's solution |
| Potassium nitrate | Central Drug House, India | 29638 | Preparation of modified Hoagland's solution |
| Protrays | Fabricated in-house | NA | Used for germinating sugarcane setts |
| Red soil | Purchased from local sources | NA | Used for germinating sugarcane setts |
| Root core sampler | Fabricated in-house | NA | Used for in situ root sampling |
| Sand | Purchased from local sources | NA | Used for germinating sugarcane setts |
| Seralite-120 | Sisco Research Laboratories, India | 14891 | cation exchange resin for processing of root exudates |
| Supporting frame | Purchased from local sources | NA | Used for hydroponic culture of sugarcane |
| Water motor pump | Purchased from local sources | NA | Used for hydroponic culture of sugarcane |
| Whatman filter paper grade 1 | Universal Scientific | 1001090 | Processing of root exudates |
| WinRhizo PRO (software) | Regent Instruments Inc., Canada | STD4800 | Two-dimensional root scanner with software for analysis of roots |
| Zinc sulphate | Sisco Research Laboratories, India | 76455 | Preparation of modified Hoagland's solution |
References
- Venkatraman, T. S., Thomas, R. Studies of sugarcane roots at different stages of growth. Agricultural Journal of India. 23, 166-176 (1928).
- Smith, D. M., Inman-Bamber, N. G., Thorburn, P. J. Growth and function of the sugarcane root system. Field Crops Research. 92 (2-3), 169-183 (2005).
- Glover, J. The behaviour of the root-system of sugarcane at and after harvest. Proceedings of the South African Sugar Technologists Association. 42, 133-135 (1968).
- Venkatraman, T. S., Thomas, R. Sugarcane root systems: Studies in development and anatomy. Agricultural Journal of India. 17 (4), 416-418 (1922).
- Saliendra, N. Z., Meinzer, F. C. Genotypic, developmental and drought-induced differences in root hydraulic conductance of contrasting sugarcane cultivars. Journal of Experimental Botany. 43 (9), 1209-1217 (1992).
- Gilbert, R. A., Rainbolt, C. R., Morris, D. R., Bennet, A. C. Morphological responses of sugarcane to long-term flooding. Agronomy Journal. 99 (6), 1622-1628 (2007).
- Shiotsu, F., Abe, J., Doi, T., Gau, M., Morita, S. Root morphology and anatomy of field-grown Erianthus arundinaceus. American Journal of Plant Sciences. 6 (1), 103-112 (2015).
- Hari, K., Vasantha, S., Anna Durai, A., Brindha, C., Shruthi, P. Sugarcane root growth and development in hydroponics system. Journal of Sugarcane Research. 7 (2), 71-82 (2017).
- Matsuoka, S., Garcia, A. A. F. Sugarcane underground organs: Going deep for sustainable production. Tropical Plant Biology. 4, 22-30 (2011).
- Koevoets, I. T., Venema, J. H., Elzenga, J. T. M., Testerink, C. Roots withstanding their environment: Exploiting root system architecture responses to abiotic stress to improve crop tolerance. Frontiers in Plant Science. 7, 1335 (2016).
- Vengavasi, K., Pandey, R. Root exudation index: Screening organic acid exudation and phosphorus acquisition efficiency in soybean genotypes. Crop and Pasture Science. 67 (10), 1096-1109 (2017).
- Bray, H. G., Thorpe, W. V. Analysis of phenolic compounds of interest in metabolism. Methods of Biochemical Analysis. 1, 27-52 (1954).
- Lowry, O. H., Rosebrough, N. J., Farr, A. L., Randall, R. J. Protein measurement with the folin phenol reagent. The Journal of Biological Chemistry. 193 (1), 265-275 (1951).
- Hedge, J. E., Hofreiter, B. T. Determination of total carbohydrate by anthrone method. Carbohydrate Chemistry: Volume 17. , (1962).
- Moore, S., Stein, W. H. Polyphenol oxidase. Methods in Enzymology. Vol 468. , (1948).
- Malik, C. P., Singh, M. B. . Plant Enzymology and Histo-enzymology: A text manual. , (1980).
- Beauchamp, C., Fridovich, I. Superoxide dismutase: Improved assays and an assay applicable to acrylamide gels. Analytical Biochemistry. 44, 276-287 (1971).
- Singleton, V. L., Rossi, J. A. Colorimetry of total phenolics with phosphomolybdic- phosphotungstic acid reagents. American Journal of Enology and Viticulture. 16, 144-158 (1965).
- Rege, R. D., Wagle, P. V. Problems of sugarcane physiology in the Deccan canal tract. III. The root-system. The Indian Journal of Agricultural Science. 2 (3), 356-373 (1940).
- Ryker, T. C., Edgerton, C. W. Studies on sugar cane roots. LSU Agricultural Experiment Station Reports. 223, (1931).
- Jensen, J. H. Some studies of root habits of sugar cane in Cuba. The Tropical Plant Research Foundation. , (1931).
- Kücke, M., Schmid, H., Spiess, A. A comparison of four methods for measuring roots of field crops in three contrasting soils. Plant and Soil. 172 (1), 63-71 (1995).
- Noordwijk, M., et al. Trench Profile Techniques and Core Break Methods. Root Methods: A handbook. , (2001).
- De Azevedo, M. C. B., Chopart, J. L., Medina, C. C. Sugarcane root length density and distribution from root intersection counting on a trench-profile. Scientia Agricola. 68 (1), 94-101 (2011).
- Nissen, T., Rodriguez, V., Wander, M. Sampling soybean roots: A comparison of excavation and coring methods. Communications in Soil Science and Plant Analysis. 39 (11-12), 1875-1883 (2008).
- Burridge, J. D., et al. An analysis of soil coring strategies to estimate root depth in maize (Zea mays) and common bean (Phaseolus vulgaris). Plant Phenomics. 2020, 3252703 (2020).
- Schroth, G., Kolbe, D. A method of processing soil core samples for root studies by subsampling. Biology and Fertility of Soils. 18, 60-62 (1994).
- Chandran, K., Nisha, M., Arun Kumar, R., Krishnapriya, V. Breeding varieties resistant to waterlogging. ICAR-SBI Annual Report 2016-17. , 128 (2016).
- Wu, Q., Wu, J., Zheng, B., Guo, Y. Optimizing soil-coring strategies to quantify root-length-density distribution in field-grown maize: Virtual coring trials using 3-D root architecture models. Annals of Botany. 121 (5), 809-819 (2018).
- Joshi, D. C., et al. Development of a phenotyping platform for high throughput screening of nodal root angle in sorghum. Plant Methods. 13, 56 (2017).
- Koyama, T., Murakami, S., Karasawa, T., Ejiri, M., Shiono, K. Complete root specimen of plants grown in soil-filled root box: Sampling, measuring, and staining method. Plant Methods. 17, 97 (2021).
- Gomathi, R., Gururaja Rao, P. N., Chandran, K., Selvi, A. Adaptive responses of sugarcane to waterlogging stress: An overview. Sugar Tech. 17, 325-338 (2014).
- Misra, V., et al. Morphological assessment of water stressed sugarcane: a comparison of waterlogged and drought affected crop. Saudi Journal of Biological Sciences. 27 (5), 1228-1236 (2020).
- Robinson, N., et al. Sugarcane genotypes differ in internal nitrogen use efficiency. Functional Plant Biology. 34 (12), 1122-1129 (2007).
- Arruda, B., et al. Biological and morphological traits of sugarcane roots in relation to phosphorus uptake. Journal of Soil Science and Plant Nutrition. 16 (4), 901-915 (2016).
- Sharma, S., Borah, P., Meena, M. K., Bindraban, P., Pandey, R. Evaluation of genotypic variation for growth of rice seedlings under optimized hydroponics medium. Indian Journal of Genetics and Plant Breeding. 78 (3), 292-301 (2018).
- Soumya, P. R., Singh, D., Sharma, S., Singh, A. M., Pandey, R. Evaluation of diverse wheat (Triticum aestivum) and triticale (× Triticosecale) genotypes for low phosphorus stress tolerance in soil and hydroponic conditions. Journal of Soil Science. 21, 1236-1251 (2021).
- Ganie, A. H., et al. Metabolite profiling and network analysis reveal coordinated changes in low-N tolerant and low-N sensitive maize genotypes under nitrogen deficiency and restoration conditions. Plants. 9 (11), 1459 (2020).
- Venkatraman, T. S., Thomas, R. Simple contrivances for studying root development in agricultural crops. Agricultural Journal of India. 18, 509-514 (1923).
- Clark, R. T., et al. High-throughput two-dimensional root system phenotyping platform facilitates genetic analysis of root growth and development. Plant, Cell and Environment. 36 (2), 454-466 (2013).
- Chopart, J. L., Rodrigues, S. R., Azevedo, M. C. B., Medina, C. C. Estimating sugarcane root length density through root mapping and orientation modelling. Plant and Soil. 313, 101-112 (2008).
- Chopart, J. L., Azevedo, M. C. B., Le Mezo, L., Marion, D. Functional relationship between sugarcane root biomass and length for cropping system applications. Sugar Tech. 12 (3-4), 317-321 (2010).
- De Silva, A. L. C., De Costa, W. A. J. M., Bandara, D. M. U. S. Growth of root system and the patterns of soil moisture utilization in sugarcane under rain-fed and irrigated conditions in Sri Lanka. Sugar Tech. 13 (3), 198-205 (2011).
- Otto, R., Silva, A. P., Franco, H. C. J., Oliveira, E. C. A., Trivelin, P. C. O. High soil penetration resistance reduces sugarcane root system development. Soil and Tillage Research. 117, 201-210 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved
We use cookies to enhance your experience on our website.
By continuing to use our website or clicking “Continue”, you are agreeing to accept our cookies.