Method Article
Abordagens de fenotipagem multifacetada para caracterizar sistemas radiculares de cana-de-açúcar
Neste Artigo
Resumo
A caracterização de características do sistema radicular é uma das áreas de pesquisa que ainda está engatinhando, particularmente na cana-de-açúcar. A integração de múltiplas abordagens para fenótipo preciso de raízes de cana-de-açúcar leva a resultados abrangentes e holísticos, permitindo a utilização de características e mecanismos identificados para melhoramento convencional e molecular.
Resumo
As raízes são os principais condutores de água e nutrientes e desempenham um papel vital na manutenção do crescimento e rendimento em ambientes estressantes. O estudo das raízes das plantas apresenta dificuldades metodológicas na avaliação e amostragem in situ , o que é especialmente verdadeiro para a cana-de-açúcar (Saccharum spp.). Os métodos tradicionais durante a década de 1920 documentaram a variação genotípica nos sistemas radiculares da cana-de-açúcar, após o que poucos estudos foram relatados sobre as características radiculares da cana-de-açúcar per se até recentemente. Além da morfologia, as características da rizosfera, incluindo efeitos alelopáticos e/ou afinidade pela simbiose microbiana, determinam o estabelecimento e a sobrevivência da planta.
Em última análise, os sistemas radiculares definem a produtividade acima do solo da cana-de-açúcar. Com o ímpeto para variedades resistentes ao clima, está se tornando mais relevante explorar e utilizar a variabilidade nas características do sistema radicular da cana-de-açúcar. Este artigo descreve abordagens multifacetadas para a fenotipagem de raízes de cana-de-açúcar, incluindo escavação de campo por amostragem de trincheiras, o uso de um amostrador de núcleo de raiz, plataformas elevadas para amostragem de raízes e cultivo de plantas sob cultura hidropônica, empregadas por uma equipe de cientistas do Conselho Indiano de Pesquisa Agrícola-Instituto de Melhoramento de Cana-de-Açúcar (ICAR-SBI).
A escavação de campo por amostragem de trincheira é imperativa para avaliar as raízes das plantas em seu ambiente natural de crescimento. O uso de plataformas elevadas simulando condições de campo e um amostrador de núcleo radicular são abordagens alternativas, com redução considerável no tempo, tamanho amostral uniforme e menor perda de material radicular. A cultura de plantas hidropônicas permite o estudo da morfologia, características anatômicas e biologia da rizosfera, incluindo a exsudação de compostos orgânicos e interações microbianas. Os dados gerados a partir de diferentes experimentos usando diversos métodos de amostragem aumentam a riqueza de informações sobre as características do sistema radicular da cana-de-açúcar.
Introdução
A cana-de-açúcar (Saccharum spp.), uma importante fonte de alimento e bioenergia, é uma importante cultura industrial adequada para cultivo em muitos países com condições climáticas tropicais e subtropicais. Devido à via fotossintética C4 para assimilação de carbono, a cana-de-açúcar é altamente produtiva, utilizando eficientemente insumos agrícolas, como água e fertilizantes. O processamento pós-colheita da cana-de-açúcar produz produtos economicamente valiosos, como açúcar e açúcar mascavo, juntamente com seus subprodutos - melaço, etanol e energia. A cana-de-açúcar é produzida por quase 100 países em uma área de 25,97 Mha, o que representa aproximadamente 1,5% do total de terras aráveis. A Índia sozinha contribui com 16% da produção mundial de cana-de-açúcar (aproximadamente 306 Mt), com uma produtividade média de 70 t·ha−1 1. Os principais estresses abióticos que afetam drasticamente a produção de cana-de-açúcar incluem déficits hídricos, alagamento, temperaturas extremas e propriedades do solo, como deficiência de nutrientes, salinidade, sodicidade e alcalinidade. O maior desafio para o desenvolvimento de culturas abióticas tolerantes ao estresse é identificar características específicas que conferem uma vantagem substancial de rendimento em condições de estresse.
Vários aspectos da fisiologia da cana-de-açúcar são pouco compreendidos, incluindo a relação raiz-parte aérea, que afeta drasticamente a produtividade da cana. A raiz da cana-de-açúcar não é tão bem estudada quanto os brotos, embora os diferentes tipos, como raízes estabelecidas, raízes de brotos e raízes adultas, possam ser distintos em termos de desenvolvimento com funções variadas. Diferenças genotípicas foram observadas em relação ao número e comprimento das raízes estabelecidas que emergem durante a germinação2. As raízes do pegamento estão implicadas na germinação das gemas da cana-de-açúcar, garantindo o estabelecimento precoce da cultura, e são posteriormente substituídas por raízes da parte aérea, que são robustas, emergindo da base da parte aérea em desenvolvimento3. Ramos finos observados nas raízes fixas ajudam a ancorar as plantas jovens e auxiliam na absorção de água e nutrientes até que sejam substituídas por raízes de brotos. Semelhante às raízes fixas, as raízes dos brotos também surgem dos primórdios radiculares presentes nos entrenós inferiores e não expandidos da cana.
Como as raízes dos brotos persistem na planta por mais tempo, elas são 4x-10x mais grossas do que as raízes estabelecidas. As raízes da parte aérea constituem o único sistema radicular da cana-de-açúcar, com um papel importante no crescimento e desenvolvimento posteriores. O vigor das raízes da parte aérea está positivamente associado ao vigor vegetativo geral da planta. O desenvolvimento contínuo das raízes resultante da renovação das raízes estabelecidas e das raízes da parte aérea dá origem ao "sistema radicular adulto" da cana-de-açúcar, que está sempre se adaptando às condições ambientais prevalecentes. Em geral, um sistema radicular mais profundo e prolífico disponibiliza mais água e nutrientes para a cultura do que uma distribuição mais rasa de raízes. Dissecações periódicas revelaram que, quando o teor de umidade do solo era alto, sistemas radiculares rasos foram observados, enquanto um sistema radicular muito mais profundo se desenvolveu à medida que o lençol freáticocaiu 2. O sistema radicular da cana-de-açúcar permanece ativo mesmo após a colheita da cultura, contribuindo para o crescimento da soqueira até que novas raízes da parte aérea surjam das gemas subterrâneas4. O ângulo radicular e o nível de ramificação radicular são dois fatores importantes que determinam o volume de solo explorado pelas raízes das plantas. O ângulo da raiz, uma característica genotípica, pode ser alterado por meio de melhoramento convencional ou abordagens moleculares para melhorar a tolerância a estresses bióticos e abióticos. Pelo contrário, o nível de ramificação radicular é influenciado principalmente pelo ambiente, necessitando de monitoramento periódico do desenvolvimento radicular e sua resposta às condições localizadas do solo.
As características anatômicas das raízes da cana-de-açúcar foram examinadas para verificar diferenças em relação ao genótipo e ao ambiente. A anatomia das raízes fixas na cana-de-açúcar se assemelha à das raízes maduras em outras gramíneas, como o milho, em que o córtex compreende camadas celulares bem diferenciadas em um padrão regular. A endoderme é suberizada, seguida por um periciclo de camada única. Os elementos do metaxilema são os principais condutores de íons água e nutrientes, dispostos radialmente e intercalados com grupos de floema, este último compreendendo um elemento de peneira com duas células companheiras. A grande massa central de células indiferenciadas forma a medula da raiz. Características anatômicas distintas das cultivares de cana-de-açúcar correspondem às propriedades hidráulicas das raízes, influenciando o movimento da água. Os primeiros estudos sobre as diferenças nas características anatômicas radiculares da cana-de-açúcar revelaram que, sob condições de baixo estresse hídrico, observou-se espessamento pronunciado da parede celular nas camadas imediatamente internas da endoderme, entre a medula e a região vascular, e ao redor dos vasos5. Essas células espessadas podem ser uma adaptação para evitar o fluxo de seiva para trás e para a resistência mecânica durante o estresse.
Algumas características importantes implicadas na resistência da cana-de-açúcar à seca incluem a espessura relativa e o número de camadas exodérmicas, a proporção do córtex para a estela, espaços intercelulares no córtex e pontas de cabelo radiculares espessas. As relações entre a área ocupada pelas células corticais e a área ocupada pelos tecidos estelares das raízes da parte aérea são significativamente diferentes entre as cultivares de cana-de-açúcar, com grande variabilidade em relação à área da estela6. A condutividade hidráulica das raízes da cana-de-açúcar está relacionada ao tamanho e ao número de elementos do metaxilema nas raízes da parte aérea. As camadas de células hidrofóbicas dentro da raiz provavelmente definem zonas de movimento da água apoplástica. Bandas de Casparian suberizadas são encontradas na endoderme e na hipoderme (denominadas exoderme), que servem como barreiras hidrofóbicas. A desintegração das células corticais leva à formação de aerênquima lisígeno em raízes mais velhas e em plantas submetidas a condições hipóxicas, independentemente da idade de desenvolvimento. A formação de aerênquima durante o estresse de encharcamento está correlacionada com a manutenção do crescimento em variedades resistentes7.
A morfologia e anatomia das raízes de Erianthus arundinaceus [Retzius] Jeswiet (gêneros relacionados a Saccharum spp.) estão implicadas em sua forte tolerância a estresses ambientais8. As raízes de Erianthus arundinaceus exibem raízes nodais distribuídas em ângulos acentuados, com pêlos de raízes densas para facilitar a absorção de água e íons nutrientes de zonas mais profundas do solo. O sistema radicular profundo consiste em muitas raízes nodais que crescem com ângulos de crescimento acentuados. O diâmetro das raízes nodais se correlaciona com o tamanho e o número de grandes vasos do xilema, o primeiro variando amplamente de 0,5 mm a 5,0 mm. Essas raízes nodais também formam uma bainha rizomatosa, com uma hipoderme mostrando esclerênquima lignificado no córtex externo (exoderme), aerênquima lisígeno na porção média do córtex e grânulos de amido na estela. Além da arquitetura e das características morfológicas, os compostos orgânicos exsudados pela raiz desempenham um papel importante na determinação da germinação, estabelecimento e sobrevivência das plantas, com efeitos alelopáticos plausíveis e/ou afinidade pela simbiose microbiana.
A atividade enzimática radicular e os detalhes mais sutis da morfologia, incluindo a pigmentação da capa radicular e o potencial de rejuvenescimento após a injúria, foram documentados em variedades de cana-de-açúcar cultivadas sob cultura hidropônica9. O crescimento radicular mostra uma resposta altamente plástica às mudanças no ambiente do solo, tanto em termos de forma quanto de tamanho do sistema radicular. A variedade de cana-de-açúcar mais eficiente seria aquela que tem poucos ou um número ideal de brotos, com um número correspondentemente menor de raízes, auxiliando em uma melhor sobrevivência durante condições estressantes. O estudo sistemático do sistema radicular deve, portanto, constituir um componente importante de qualquer programa de melhoramento de culturas10. A maioria dos experimentos com foco em raízes depende principalmente de aspectos de desenvolvimento, enquanto o foco na plasticidade funcional geralmente falta11. Além da distribuição estrutural, a plasticidade funcional da raiz desempenha um papel crucial na sobrevivência sob estresse e, portanto, apoiaria os melhoristas em seus esforços para incluir características do sistema radicular no pipeline de seleção para tolerância ao estresse abiótico e melhorar a robustez da cana-de-açúcar.
Considerando sua importância na sustentação do crescimento e da produtividade em ambientes estressantes, é essencial explorar e utilizar a variabilidade inerente às características do sistema radicular da cana-de-açúcar. Uma ênfase na seleção de características e mecanismos componentes que conferem sistemas radiculares superiores é o caminho a seguir para um melhor desempenho da cultura sob condições climáticas variáveis. A avaliação fenotípica é um processo longo e caro; no entanto, a integração de abordagens multifacetadas agregaria um tremendo valor à sua utilidade no melhoramento de culturas. Neste manuscrito, quatro abordagens diferentes para fenotipagem radicular em cana-de-açúcar são descritas, cada uma com seu próprio conjunto de méritos e deméritos, implicando que um esforço conjunto é necessário para chegar a resultados abrangentes e holísticos.
Protocolo
1. Escavação de campo por amostragem de valas
- Cultivar híbridos comerciais de cana-de-açúcar (doravante denominados "variedades") no campo a partir de pegamentos de duas gemas plantados em espaçamento de 120 cm, com 90 cm dentro das linhas, seguindo o pacote de práticas (POP) recomendado para garantir o bom estabelecimento e crescimento da cultura.
- No final da fase de maturação da cultura, contrate uma escavadeira para cavar uma trincheira (1,5 m de profundidade e 1,0 m de largura) no campo. Por meio de jato de água contínuo, certifique-se de que os solos das zonas radiculares sejam limpos sem danificar as raízes (Figura 1).
- Quando o solo aderente se soltar, arranque a cana junto com o sistema radicular e leve-a ao laboratório para medição manual do número de raízes, comprimento, volume e peso da raiz.

Figura 1: Método de amostragem de trincheira para a escavação de raízes em campo. (A) Vala lateral cavada ao longo do campo, (B) jato de água e (C) vista interna mostrando a profundidade da trincheira. Clique aqui para ver uma versão maior desta figura.
2. Amostrador de núcleo raiz para reduzir erros de amostragem
- Utilizar um amostrador de núcleo de raiz cilíndrica de 61 cm de altura e 16 cm de diâmetro pesando 8 kg, fabricado com material de aço macio (MS) para amostragem de raízes de cana-de-açúcar no campo. Forneça uma borda afiada na borda inferior do amostrador para facilitar a penetração ao inseri-lo no solo. Fornecer colares de 3 cm de diâmetro para levantar o amostrador (figura 2).
- Cultivar variedades de cana-de-açúcar no campo a partir de pegamentos de duas gemas plantados em espaçamento de 120 cm, com 90 cm dentro das linhas, seguindo o POP recomendado para garantir o bom estabelecimento e crescimento da cultura.
- Na fase de maturação da cultura, fixe a borda superior do amostrador ao broto primário / cana e martele continuamente para atingir a profundidade de solo desejada (45 cm). Levante toda a massa de solo para o amostrador e lave cuidadosamente em água corrente para separar as raízes aderentes.
- Após a lavagem completa das raízes, registre o volume, a área de superfície, o comprimento e o peso por medição manual, bem como espalhando as raízes em bandejas transparentes para digitalizar e analisar as imagens digitalizadas correspondentes usando o software referenciado (consulte a Tabela de Materiais).

Figura 2: Amostrador de núcleo raiz. (A) Dimensões, (B) vista superior e (C) local de amostragem. Clique aqui para ver uma versão maior desta figura.
3. Estrutura de fenotipagem radicular para facilitar a amostragem em diferentes fenofases
- Construa uma estrutura de fenotipagem radicular composta por três compartimentos adjacentes de dimensões 4,5 m x 10,1 m para amostragem das raízes da cana-de-açúcar, com provisões para desmontar manualmente as paredes laterais para revelar o sistema radicular subterrâneo (até uma profundidade de 80-100 cm) (Figura 3). Construa as paredes laterais com lajes pré-moldadas de dimensões de 1,8 m de comprimento, 30 cm de largura e 4 cm de espessura.
- Preencher e compactar a estrutura com solo de campo, deixando um espaço livre de ~20 cm, com orifícios de drenagem adequados para facilitar a aeração do solo.
- Semear as lascas de gemas de clones de germoplasma compreendendo Saccharum officinarum L., Saccharum spontaneum L., Saccharum barberi Jesw., Saccharum sinense Roxb. e Saccharum robustum Brandes e Jeswiet ex Grassl. (a seguir denominados "clones de Saccharum spp.") e deixá-los germinar durante 30 dias em bandejas compostas por suportes de enraizamento (solo vermelho: esterco de quintal: areia = 2:2:1). Transplante assentamentos uniformes e saudáveis para a estrutura em um espaçamento entre linhas de 90 cm, com 60 cm dentro das linhas, seguindo o POP recomendado para garantir um bom estabelecimento e crescimento da cultura.
- Durante as fases formativa (60-120 dias após o plantio [DAP]) e de grande crescimento (120-150 DAP), remova manualmente as paredes laterais feitas das placas pré-moldadas, seguidas de pulverização contínua do jato de água para expor as raízes.
- Arranque todo o sistema radicular e leve-o ao laboratório para medição manual do comprimento, volume e peso, e espalhe as raízes em bandejas transparentes para escanear e analisar as imagens digitalizadas correspondentes no software referenciado (consulte a Tabela de Materiais).
- Imponha o estresse hídrico retendo a irrigação em um dos compartimentos e tampe os orifícios de drenagem no segundo compartimento para manter a saturação do solo e simular o estresse de alagamento. Irrigar o terceiro compartimento de acordo com o POP recomendado para manter a capacidade de campo e servir de controle.

Figura 3: Estrutura de fenotipagem da raiz. (A) Dimensões, (B) visão geral dos três compartimentos e (C) vista de um compartimento. Clique aqui para ver uma versão maior desta figura.
4. Cultivo hidropônico de plantas para estudar a biologia da rizosfera
- Fabricar um sistema hidropônico interno em uma estufa com controle de ambiente, propícia ao cultivo de cana-de-açúcar para estudar os detalhes mais sutis da biologia das raízes. Adicione ~ 15 L de solução nutritiva de Hoagland modificada (Tabela 1) a tanques de vidro de dimensões 20 cm x 20 cm x 50 cm, com aeração fornecida por bombas de aquário (Figura 4).
- Semear os brotos de variedades de cana-de-açúcar e clones de Saccharum spp. e deixá-los germinar por 30 dias em protrays compreendendo medula de coco compostada. Transplante decantações uniformes e saudáveis para tanques hidropônicos na frequência de três decantações por tanque, tendo o cuidado de colocar toda a raiz na solução nutritiva. Cubra os tanques com um pano preto para garantir que as raízes não sejam expostas à luz. Use uma malha de plástico (20 cm x 20 cm) na borda dos tanques de vidro para apoiar as plantas na posição vertical.
- No final da fase de germinação (60 dias), colete os exsudatos radiculares imergindo as raízes das plantas intactas em 50 mL de solução armadilha (água bidestilada estéril) por 4 h (0800 h a 1200 h) durante o período de pico de atividade fotossintética. Filtrar a solução recolhida através de papel de filtro Whatman e, em seguida, passá-la através de colunas de vidro cheias de permuta aniónica seguida de resinas permutadoras catiónicas12. Evaporar as fracções eluídas até à secura e conservar a -20 °C até ao processamento posterior.
- Analisar as amostras de exsudato radicular processadas por HPLC para a determinação de ácidos orgânicos12 e por espectrofotometria para a estimativa de fenólicos totais13, proteínas14, açúcares15 e aminoácidos16 de acordo com o protocolo padrão.
- Monitore o crescimento da raiz em intervalos semanais para registrar a pigmentação da ponta da raiz e a densidade do cabelo da raiz. Avaliar a atividade das enzimas, peroxidase17 e superóxido dismutase18, e o conteúdo fenólico total19 no 3º mês de acordo com o protocolo padrão.
- Avalie a resposta à lesão radicular infligindo uma fatia longitudinal na raiz primária até a ponta da raiz usando uma lâmina cirúrgica estéril e monitore as alterações periodicamente.
| Químico | Concentração final |
| Nitrato de potássio | 0,608 g· L-1 |
| Nitrato de cálcio | 1.415 g· L-1 |
| Di-hidrogenofosfato de potássio | 0.164 gr· L-1 |
| Sulfato de magnésio | 0,560 g· L-1 |
| Sal monossódico EDTA-férrico | 6,00 g·250L-1 |
| Ácido bórico | 1,43 g·250L-1 |
| Cloreto de manganês tetra-hidratado | 0,91 g·250L-1 |
| Sulfato de zinco | 0,11 g·250L-1 |
| Suphate cúprico | 0,04 g·250L-1 |
| Ácido molibdico | 0,01 g250L-1 |
Tabela 1: Composição da solução nutritiva modificada para a cultura hidropônica de cana-de-açúcar.

Figura 4: Configuração da hidroponia. A configuração (A) personalizada para o cultivo de cana-de-açúcar e (B) safra de 5 meses (pano preto removido apenas para fins fotográficos). Essa figura foi modificada de Hari et al.9. Clique aqui para ver uma versão maior desta figura.
Resultados
Variação nas características morfológicas radiculares de variedades de cana-de-açúcar
Imagens representativas do sistema radicular em Co 62175, escavadas do campo por amostragem de trincheiras e cultivadas em uma configuração hidropônica, são apresentadas na Figura 5A, B. Raízes longas (~ 100 cm) foram observadas nas variedades Co 62175 e Co 99006, enquanto Co 99006 registrou o maior peso de raiz (127 g · aglomerado − 1). As características radiculares foram registradas usando um amostrador de núcleo radicular, que revelou que o Co 62175 tinha um sistema radicular superior em comparação com o Co 99006 em relação ao comprimento cumulativo da raiz, área de superfície radicular e volume radicular (Figura 5C-E). No entanto, o diâmetro médio da raiz foi maior em Co 99006 do que em Co 62175 (Figura 5F).
Variação nas características morfológicas radiculares de clones de Saccharum spp.
As características morfológicas na fase formativa mostraram variação significativa entre os clones de Saccharum spp., com o maior comprimento de raiz cumulativo de 39615,72 cm por touceira observado em S. spontaneum (IND 85-490), enquanto o menor foi observado em S. sinense (Oshima) (Figura 6A). A maior área de superfície radicular por touceira (4700,31 cm2) foi observada em S. spontaneum (IND 85-490), seguida por S. officinarum (Awela Green Sport), e a menor foi registrada em S. sinense (Oshima) (Figura 6B). Uma tendência semelhante foi observada no caso do volume radicular e do diâmetro médio da raiz (Figura 6C,D). A morfologia das raízes amostradas na fase de grande crescimento foi medida manualmente e revelou que as raízes mais longas (131 cm) estavam presentes em S. robustum (NG 77-237) (Figura 6E), enquanto o peso seco da raiz foi maior em S. spontaneum (IND 85-490: 57,4 g·clump−1) e menor em S. sinense (Oshima: 11,2 g·clump−1) (Figura 6F). O volume radicular e a relação raiz-parte aérea seguiram uma tendência semelhante à massa seca da raiz (Figura 6G,H).
Variação nas características anatômicas radiculares de clones de Saccharum spp.
A área de secção transversa das raízes a 10 mm da ponta variou significativamente entre os clones de Saccharum spp., com S. spontaneum (IND 85-490) apresentando a maior área (27646,8 mm2), enquanto S. sinense (Oshima) registrou a menor (7539,1 mm2) (Tabela 2). A área principal em S. sinense (Oshima) foi ocupada por células corticais, enquanto em S. spontaneum (IND 85-490), a área ocupada pelo tecido da estela foi proeminente, o que se reflete nos dados sobre a proporção de córtex para estela. O número de elementos do metaxilema variou de 6 (S. officinarum: Awela Green Sport) a 13 (S. spontaneum: IND 85-490), enquanto o número de espaços aéreos (aerênquima lisígeno) variou de 12 (S. barberi: Putli Khajee) a 32 (S. spontaneum: IND 85-490). A área ocupada por elementos metaxilemas foi maior (791,3 mm2) em S. barberi (Putli Khajee) e menor (254,3 mm2) em S. sinense (Oshima). A área ocupada por aerênquima foi maior (4921,3 mm2) em S. spontaneum (IND 85-490), enquanto as raízes de S. sinense (Oshima) e S. robustum (NG 77-237) foram desprovidas de células aerênquimas na condição normal irrigada. Saccharum sinense (Oshima), S. spontaneum (IND 85-490) e S. barberi (Putli Khajee) exibiram fenos anatômicos radiculares superiores sob condições de seca e estresse por encharcamento (Figura 7A-C). Pêlos radiculares longos, exoderme esclerênquima, camadas de células corticais reduzidas, aumento do aerênquima cortical, aumento da área da estela e número de vasos do xilema com grande diâmetro foram favoráveis sob seca, enquanto o aumento do diâmetro da raiz e maior área de células corticais com aumento das células aerênquimas aumentaram a resistência mecânica, a porosidade da raiz e a difusão de oxigênio sob estresse de alagamento.
Variação no tipo e quantidade de exsudatos radiculares de clones de Saccharum spp.
Entre os compostos orgânicos exsudados pelos clones de Saccharum spp. durante a fase de germinação, a proporção de proteína total foi a maior, seguida por carboxilatos, açúcares, fenóis e aminoácidos livres. Saccharum robustum (NG 77-221) apresentou a maior exsudação total de carboxilato (5,11 mg·g−1· peso fresco da raiz [RFW]·h−1), enquanto a menor (0,65 mg·g−1· RFW·h−1) foi registrada em S. spontaneum (IND 85-490), com variação significativa no tipo e quantidade de ácido carboxílico individual exsudado (Figura 8A). Saccharum officinarum (Awela Green Sport) exsudou os maiores níveis de fenóis totais (0,034 mg · g − 1 · RFW·h−1), enquanto o mais baixo (0,002 mg·g−1· RFW·h−1) foram observados no caso de S. spontaneum (IND 85-490) (Figura 8B). A maior exsudação total de proteínas (3,23 mg·g−1· RFW·h−1) foi observado em S. officinarum (Awela Green Sport), enquanto o maior teor de açúcar total (0,22 mg·g−1· RFW·h−1) e aminoácidos livres totais (0,04 mg·g−1· RFW·h−1) foram registrados em S. sinense (Oshima) (Figura 8C-E). A menor exsudação total de proteínas (2,08 mg·g−1· RFW·h−1) foi observada em S. spontaneum (IND 85-490), enquanto S. robustum (NG 77-221) exsudou as menores quantidades de açúcar total (0,05·mg·g−1· RFW·h−1) e aminoácidos livres totais (0,01 mg·g−1· RFW·h−1).
Variação na pigmentação da ponta da raiz, atividade enzimática e teor de fenólicos totais de variedades de cana-de-açúcar
As formas da capa radicular variaram de triângulo simples (Co 62175) a cúpula (Co 86032), enquanto a pigmentação da capa radicular variou de rosa claro (Co 62175) a violeta profundo (Co 86032), com diferenças significativas na densidade do cabelo radicular (Figura 9A-C). A atividade da peroxidase foi mais alta (40 unidades · g − 1 · h − 1) em Co 86032 e mais baixa (26 unidades · g − 1 · h − 1) em Co 62175, enquanto a tendência foi revertida no caso da atividade da superóxido dismutase nas raízes ( Figura 9D , E ). Da mesma forma, o conteúdo fenólico total foi maior (18 μg · g − 1) em Co 86032 e menor (15 μg · g − 1) em Co 62175 ( Figura 9F ).
Variação nas fases de desenvolvimento do rejuvenescimento após a injúria radicular de variedades de cana-de-açúcar
O rejuvenescimento após a injúria radicular foi testado nas variedades de cana-de-açúcar CoC 671 e Co 06022 cultivadas em configuração hidropônica (Figura 10A-I). No CoC 671, as raízes secundárias apareceram no terceiro dia de injúria, enquanto no Co 06022, o início da raiz secundária ocorreu apenas no décimo dia. Além disso, a raiz primária de Co 06022 mostrou sintomas de senescência no terceiro dia, enquanto as raízes de CoC 671 permaneceram relativamente saudáveis. Raízes terciárias também foram observadas no décimo dia em CoC 671.

Figura 5: Sistemas radiculares de Co 62175 e diferentes características morfológicas. Sistema radicular de (A) Co 62175 escavado por amostragem de trincheira, (B) Co 62175 cultivado em uma configuração hidropônica e características morfológicas (C) comprimento cumulativo da raiz, (D) área de superfície da raiz, (E) volume da raiz e (F) diâmetro médio da raiz registrado usando o amostrador de núcleo radicular. Os dados representam a média ± EPM (n = 3). Clique aqui para ver uma versão maior desta figura.

Figura 6: Características morfológicas da raiz. (A) Comprimento cumulativo da raiz, (B) área da superfície da raiz, (C) volume da raiz e (D) diâmetro médio da raiz na fase formativa, e (E) comprimento da raiz mais longa, (F) peso seco da raiz, (G) volume da raiz e (H) relação raiz-parte aérea na fase de grande crescimento de Saccharum spp. clones registrados a partir da estrutura de fenotipagem (S. officinarum: Awela Green Sport, S. spontaneum: IND 85-490, S. sinense: Oshima, S. barberi: Putli Khajee, S. robustum: NG 77-237). Os dados representam a média ± EPM (n = 3). Clique aqui para ver uma versão maior desta figura.

Figura 7: Características anatômicas da raiz do clone de S. sinense Oshima. (A) Condições normais de cultivo e em resposta a (B) seca e (C) estresse de alagamento. Barras de escala = 100 μm. Abreviaturas: rh = pêlos radiculares; AE = aerênquima lisígeno; mx = metaxilema; ex = exoderme; EP = epiderme. Clique aqui para ver uma versão maior desta figura.

Figura 8: Exsudação radicular. (A) Carboxilatos, (B) fenol total, (C) proteína total, (D) açúcar total e (E) aminoácidos livres totais na fase de germinação em clones de Saccharum spp. (S. officinarum: Awela Green Sport, S. spontaneum: IND 85-490, S. sinense: Oshima, S. barberi: Putli Khajee, S. robustum: NG 77-221). Os dados representam a média ± EPM (n = 3). Abreviatura: RFW = peso fresco da raiz. Clique aqui para ver uma versão maior desta figura.
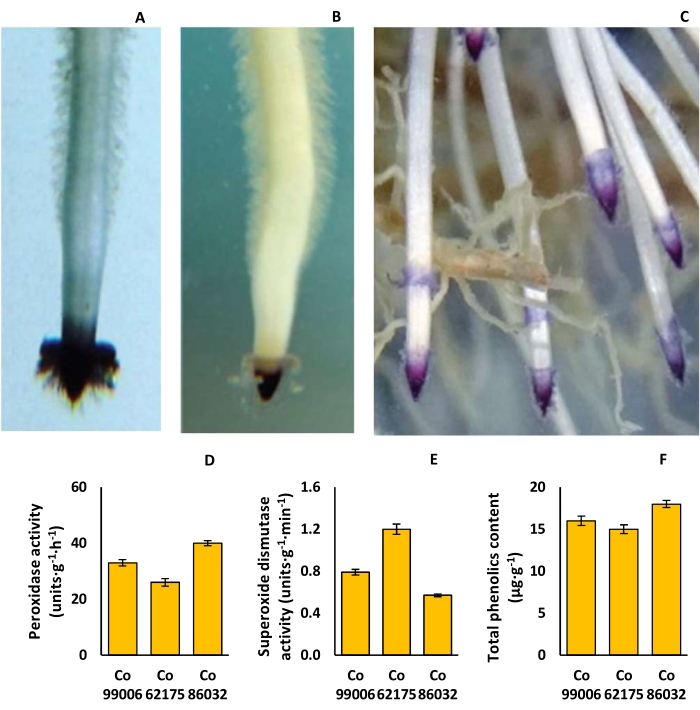
Figura 9: Características da rizosfera em variedades de cana-de-açúcar. (A) Capa radicular triangular em Co 62175, (B) capa radicular em forma de cúpula em Co 86032, (C) pigmentação da ponta da raiz violeta profunda em Co 86032, (D) atividade da peroxidase, (E) atividade da superóxido dismutase e (F) conteúdo fenólico total de plantas criadas na configuração hidropônica. Os dados em D, E e F representam a média ± EPM (n = 3). Essa figura foi modificada de Hari et al.9. Clique aqui para ver uma versão maior desta figura.

Figura 10: Fases de desenvolvimento do rejuvenescimento após injúria radicular em variedades de cana-de-açúcar cultivadas na configuração hidropônica. (A-E) CoC 671 e (F-I) Co 06022; (A,F) raízes não lesionadas; (B,G) raízes feridas por corte longitudinal; (C,H) 3 dias após a lesão; (D,E,I) 10 dias após a lesão. Essa figura foi modificada de Hari et al.9. Clique aqui para ver uma versão maior desta figura.
| Área da seção transversal da raiz (mm2) | Proporção de córtex para estela | Número de camadas exodérmicas | Número de elementos do metaxilema | Diâmetro médio do metaxilema (mm) | Número de espaços aéreos | Área ocupada por metaxilema (mm2) | Área ocupada por espaços aéreos (mm2) | |
| S. officinarum | 6936.3±200.2 | 0,508±0,015 | 1,00±0,03 | 6.00±0.17 | 8,5±0,3 | 14.00±0.40 | 340,3±9,8 | 1993.0±57.5 |
| S. spontaneum | 27646.8±957.7 | 0,481±0,017 | 2,00±0,07 | 13.00±0.45 | 6.6±0.2 | 32.00±1.11 | 444,5±15,4 | 4921.3±170.5 |
| S. sinense | 7539.1±261.2 | 0,727±0,025 | 2,00±0,07 | 9.00±0.31 | 6.0±0.2 | - | 254,3±8,8 | - |
| S. barberi | 18859.6±435.6 | 0,692±0,015 | 1,00±0,02 | 7.00±0.16 | 12.0±0.3 | 12.00±0.28 | 791.3±18.3 | 4454.6±102.8 |
| S. robustum | 8328.1±288.5 | 0,563±0,019 | 2,00±0,07 | 10.00±0.35 | 7.0±0.2 | - | 384,7±13,3 | - |
Tabela 2: Características anatômicas radiculares observadas em clones de Saccharum spp. Os dados representam a média ± EPM (n = 3) (S. officinarum: Awela Green Sport, S. spontaneum: IND 85-490, S. sinense: Oshima, S. barberi: Putli Khajee, S. robustum: NG 77-237).
Discussão
Os sistemas radiculares definem a produtividade acima do solo da cana-de-açúcar, exigindo que todas as suas facetas sejam exploradas e compreendidas minuciosamente para o desenvolvimento de variedades resistentes ao clima. Uma equipe de cientistas do ICAR-SBI, composta por fisiologistas de plantas, um microbiologista, um engenheiro agrônomo, um bioquímico e melhoristas de plantas, empregou abordagens multifacetadas para a fenotipagem de raízes de cana-de-açúcar, incluindo escavação de campo por amostragem de trincheiras, o uso de um amostrador de núcleo de raiz, plataformas elevadas para amostragem de raízes e cultivo de plantas sob cultura hidropônica. Dado que uma metodologia individual pode não ser exaustiva e/ou exclusiva, a integração de informações é necessária para revelar as características e mecanismos componentes de um fenótipo de raiz ideal. Métodos anteriores de amostragem de raízes foram isolados em seus esforços, mas foram úteis para o desenvolvimento da estratégia aqui descrita.
Venkatraman e Thomas5 foram pioneiros no estudo das raízes da cana-de-açúcar, descrevendo três métodos adequados para investigação. No primeiro método, um poço profundo foi cavado ao lado de uma planta, o que permitiu que as raízes fossem dissecadas do solo, caiadas e fotografadas em suas posições naturais. No segundo método, covas profundas foram cavadas nos lados opostos de uma planta. Estruturas de 2 em rede de arame foram colocadas contra as laterais dos poços adjacentes à planta, com barras de ferro inseridas na largura do solo interposto para manter as raízes em suas respectivas posições. O solo foi então lavado com água e as raízes foram fotografadas. Um terceiro método era fazer plantações especiais para estudo de raízes. Uma rede de arame foi colocada em certos níveis em um terreno escavado, e a escavação foi reabastecida, substituindo o solo em suas respectivas camadas como antes. As plantas a serem estudadas foram cultivadas na parcela. No momento do exame, o solo ao redor das plantas foi lavado com água, deixando os sistemas radiculares suspensos em posição nas malhas da tela de arame.
Rege e Wagle20 desenvolveram um método de estudo radicular em condições irrigadas, cavando uma cova verticalmente na borda da cana e expondo o sistema radicular lavando o solo em uma zona especificada. Causou o menor desperdício do material vegetal e permitiu que os pesquisadores estudassem o sistema radicular in situ , tanto qualitativa quanto quantitativamente. Um estudo especial foi realizado para investigar a estrutura, o desenvolvimento e o comportamento das raízes da cana-de-açúcar21. "O método da caixa de raízes" e o "método de escavação do solo" mostraram-se bastante úteis no estudo da distribuição das raízes da cana-de-açúcar. Verificou-se que havia mais raízes rasas em solos pesados do que em solos mistos ou mais leves. A textura solta e a aeração predominantes neste último favoreceram a penetração das raízes em zonas mais profundas do solo, tornando-o mais propício ao desenvolvimento radicular As primeiras raízes a se desenvolverem cresceram diretamente para baixo no solo, penetrando a profundidades de mais de 30-36 pol, seguidas por raízes rasas observadas nas camadas superficiais (~ 14 pol da camada superficial do solo), em que ~ 85% -90% das raízes são distribuídas. As raízes mais profundas, sem dúvida, forneciam umidade para as plantas durante os períodos de seca. A rapidez do crescimento das raízes e brotos variou de acordo com as condições climáticas do ano de cultivo e com a variedade. Manter as raízes em condições fisiológicas ativas é importante para o crescimento ideal das plantas, pois muitas vezes é perturbado por práticas de cultivo, que devem ser evitadas se possível. A variabilidade do sistema radicular em variedades selecionadas de cana-de-açúcar foi estudada em Cuba pelo "método de exame direto"22. Descrições do desenvolvimento radicular foram documentadas juntamente com ilustrações da distribuição radicular no solo.
A escavação de raízes em campo por amostragem de trincheira foi baseada no trabalho de Venkatraman e Thomas5, Rege e Wagle20 e Ryker e Edgerton21. Apesar de ser o método mais trabalhoso e demorado, a amostragem de campo in situ é imperativa para entender os fenótipos radiculares em seu ambiente natural de cultivo. Uma comparação dos métodos de medição radicular em beterraba sacarina e cereais revelou que os dados obtidos da parede do perfil da trincheira devem ser interpretados com cautela, em que as densidades de comprimento de raiz (RLD) calculadas (razão entre o comprimento acumulado da raiz e o volume do solo) foram 4x-10x menores do que as obtidas pelo método do núcleo radicular, dependendo do tipo de solo23. Uma distância apropriada e uniforme da trincheira ao caule é importante para garantir um erro mínimo de amostragem e minimizar a perda de raízes e recursos, incluindo mão de obra. O monitoramento do crescimento radicular por meio de amostragem de trincheiras pode não ser viável para experimentos de longo prazo, pois é de natureza destrutiva e apenas uma pequena parte da raiz é visível com base no plano de observação. No entanto, a amostragem de trincheiras fornece uma estimativa geral da distribuição radicular e interação com o perfil do solo24. Esta investigação sobre a disseminação de sistemas radiculares em híbridos comerciais de cana-de-açúcar revelou que ~70% das raízes fisiologicamente ativas foram encontradas a 50 cm do perfil do solo.
O método de amostragem em trincheira permitiu a diferenciação de várias classes de raízes de acordo com sua profundidade de ocorrência no perfil do solo. Em geral, as raízes que penetravam mais profundamente no solo eram geralmente mais finas do que as encontradas nas zonas rasas. Observou-se ampla variabilidade genotípica em relação ao comprimento, volume e peso das raízes. Os avanços na modelagem e simulação de culturas auxiliam no refinamento dos dados obtidos a partir de métodos convencionais de amostragem, desenvolvendo algoritmos para minimizar erros de amostragem e heterogeneidade experimental. Os dados de DLR da cana-de-açúcar de um perfil de solo in situ foram comparados com os de testemunhos de solo, onde foi observado que a contagem de interseções radiculares em um perfil de solo e a estimativa de DLR usando um modelo forneceram valores de DLR semelhantes aos obtidos com o método do testemunhodo solo 25. Uma comparação dos dados obtidos dos métodos de escavação e retirada do núcleo do solo na soja revelou estimativas semelhantes de biomassa radicular, e a escavação exigiu menos tempo total e mais trabalho26. As amostras baseadas em testemunhos foram mais precisas, permitindo a amostragem em zonas de enraizamento mais profundas com o mínimo de perturbação na parcela experimental. Dada a vantagem de estudar as raízes das plantas em seu ambiente natural de crescimento, a amostragem de trincheiras pode ser útil para combinar dados de perfil de solo e o perfil RLD, mas não facilita a amostragem em uma área extensa27. Nesse contexto, o amostrador de núcleo de raiz provou ser bastante útil para quantificar a distribuição de raízes e permitir mais amostras em uma área maior.
O amostrador de núcleo radicular foi projetado para facilitar a subamostragem de raízes do campo, o que garante uniformidade na amostragem com menor coeficiente de variância; reduziu consideravelmente os erros de amostragem. O uso do amostrador de núcleo radicular tem sido adotado em diversas culturas; Requer uma grande quantidade de tempo de processamento pós-amostragem, pois é necessário ter muito cuidado para evitar a perda de raízes durante a lavagem28. O amostrador de testemunho facilitou a amostragem de raízes em um volume fixo de solo e trouxe a variação genotípica entre os clones testados para características do sistema radicular, permitindo que mais amostras fossem testadas em um determinado período de tempo. O RLD, que é um parâmetro importante para avaliar a saúde das plantas, pode ser derivado precisamente com a ajuda de um amostrador de núcleo radicular. Em geral, a variação sistemática é atribuída à localização da perfuração em termos de distância do caule, o que pode resultar em dados radiculares significativamente diferentes. No entanto, no caso da cana-de-açúcar, o amostrador foi fabricado com base na morfologia única da cultura, e a parte aérea/cana primária é presa a ela durante a amostragem. Assim, um núcleo uniforme de 16 cm de diâmetro ao redor do broto / cana primária é garantido para todas as variedades para minimizar o erro de amostragem.
Foi observada uma correlação significativa entre os dados de volume radicular registrados pelo método root scanner e o método de deslocamento de volume29. Como o tamanho da amostra é muito menor do que o do método de trincheira, a variabilidade entre os genótipos pode ser avaliada usando o amostrador de núcleo de raiz. A variação aleatória devido à plasticidade fenotípica, heterogeneidade do solo e outros fatores desconhecidos afeta a confiabilidade dos dados obtidos de um amostrador de núcleo radicular, que pode ser superada por medições repetidas e pelo uso de software de simulação para restringir diferenças funcionalmente relevantes27. Uma avaliação virtual da variação entre diferentes estratégias de perfuração do solo em milho, com base em modelos tridimensionais de arquitetura do sistema radicular e um algoritmo de ponderação de área30, revelou que essas formas econômicas de obter estimativas confiáveis de DLR podem ser o caminho a seguir para estudos radiculares.
Estruturas de fenotipagem radicular com compartimentos adjacentes servem ao propósito de simular o campo e, ao mesmo tempo, manter a homogeneidade necessária para a triagem da variabilidade inerente ao germoplasma de cana-de-açúcar. A facilidade de amostragem destrutiva com significativamente menos danos e desperdício de raízes do que a amostragem de trincheiras facilita a análise de todo o sistema radicular em diferentes fenofases. Caixas ou câmaras de raízes personalizadas com base na morfologia da cultura e distribuição de raízes provaram ser eficazes em outras culturas, como sorgo31, soja e trigo sarraceno32. Da mesma forma, o tamanho e a profundidade dos compartimentos foram otimizados para suportar o crescimento da cana-de-açúcar. Além disso, as paredes laterais foram construídas usando lajes pré-moldadas, que podem ser facilmente levantadas manualmente durante a amostragem de raízes. As amostras de raízes são coletadas levantando manualmente a parede lateral, seguidas de jato de água para expor as raízes. As paredes laterais são então substituídas e o solo é reabastecido, garantindo danos mínimos às plantas adjacentes. A variação nas características radiculares da cana-de-açúcar e sua relação com o crescimento da parte aérea podem ser documentadas em plantas cultivadas na estrutura de fenotipagem radicular. O excesso de irrigação na cana-de-açúcar produz um sistema radicular superficial, enquanto o déficit hídrico estimula a disseminação lateral com leve penetração profunda33,34. Com o aumento da aplicação de nitrogênio, o peso da raiz é reduzido, enquanto os fertilizantes fosfatados produzem um efeito favorável no desenvolvimento radicular35,36. Compartimentos adjacentes na estrutura permitem o estudo de tais respostas da cana-de-açúcar a diferentes estresses abióticos e níveis de nutrientes no solo, manipulando a quantidade de água de irrigação e usando solo empobrecido em nutrientes, respectivamente.
A cultura hidropônica de plantas é o método de escolha para avaliar as respostas ao estresse nutricional em uma grande e diversificada população de genótipos em soja12, arroz37, trigo38 e milho 39. Estudos simulados de raízes em cana-de-açúcar datam de 192340, em que uma coluna de anéis de barro com tela de arame foi empregada para estudar a profundidade relativa e o plano das raízes. O cultivo hidropônico usando panelas de barro cheias de solução diluída de Knop também foi tentado para monitoramento contínuo do desenvolvimento radicular. Uma instalação hidropônica interna permite o estudo dos detalhes mais sutis do desenvolvimento radicular e mudanças na biologia da rizosfera9. O tamanho do recipiente e a densidade de plantio foram otimizados para a cana-de-açúcar, onde as plantas foram cultivadas por até 10 meses com acamamento mínimo. As características da rizosfera, incluindo a forma da capa radicular e a pigmentação da ponta da raiz, podem ser avaliadas apenas em condições hidropônicas, o que facilita a amostragem e a ausência de aderentes ao solo. A avaliação das respostas de desenvolvimento e estresse no nível da raiz pode não ser possível quando as plantas são cultivadas no campo, enquanto a cultura hidropônica permite tais medições. Facilita a coleta e caracterização de exsudatos radiculares, o que pode não ser possível em condições de campo. Embora a ausência de barreiras físicas à penetração das raízes seja uma grande desvantagem deste método, o monitoramento regular do crescimento das raízes é uma vantagem quando as plantas são cultivadas em condições hidropônicas.
É essencial redesenhar a arquitetura de novas cultivares de cana-de-açúcar com base em um fenótipo radicular forte e ideal que possa atender à demanda por agricultura sustentável. As plataformas de fenotipagem radicular de alto rendimento desenvolvidas para arroz e milho incluem componentes adaptáveis a uma ampla gama de sistemas de crescimento, como solo e hidroponia, técnicas avançadas de imagem radicular e ferramentas de software41; O aumento de escala dessas plataformas para a cana-de-açúcar oferece muito espaço para melhorar a produtividade em um futuro próximo. Apesar da ênfase na biologia radicular como um importante determinante do crescimento e produtividade da cana-de-açúcar e da disponibilidade de técnicas avançadas de fenotipagem radicular, poucos estudos relataram as características radiculares da cana-de-açúcar per se 42,43,44,45. Como as raízes são os órgãos vegetais mais dinâmicos, uma única metodologia para avaliar a variação nos fenótipos radiculares pode não ser conclusiva, especialmente em uma cultura como a cana-de-açúcar. A aplicação e integração de permutações adequadas de metodologias alinhadas com os objetivos do estudo devem melhorar a compreensão dos sistemas subterrâneos da cana-de-açúcar.
Divulgações
Todos os autores declaram que não há conflitos de interesse.
Agradecimentos
Os autores reconhecem a infraestrutura e o apoio estendidos pelo Diretor do ICAR-Sugarcane Breeding Institute, Coimbatore, para o estabelecimento de instalações de fenotipagem radicular para cana-de-açúcar. O financiamento fornecido pelo Conselho de Pesquisa em Ciência e Engenharia, Departamento de Ciência e Tecnologia, Governo da Índia, na forma de Prêmio de Pesquisa em Início de Carreira para KV (ECR / 2017/000738), é devidamente reconhecido. Os autores agradecem a Brindha, Karpagam, Rajesh, Sivaraj e Amburose por sua assistência na geração de dados de maneira meticulosa.
Materiais
| Name | Company | Catalog Number | Comments |
| Aeration pump with pipeline accessories | Purchased from local sources | NA | Used for hydroponic culture of sugarcane |
| Boric acid | Sisco Research Laboratories, India | 80266 | Preparation of modified Hoagland's solution |
| Calcium nitrate | Central Drug House, India | 27606 | Preparation of modified Hoagland's solution |
| Composted coir pith | Purchased from local sources | NA | Used for germinating sugarcane setts |
| Cupric sulphate | Sisco Research Laboratories, India | 38869 | Preparation of modified Hoagland's solution |
| DEAE-cellulose | Sisco Research Laboratories, India | 10529 | anion exchange resin for processing of root exudates |
| EDTA-ferric monosodium salt | Sisco Research Laboratories, India | 59389 | Preparation of modified Hoagland's solution |
| Farm yard manure | Purchased from local sources | NA | Used for germinating sugarcane setts |
| Glass tanks | Fabricated in-house | NA | Used for hydroponic culture of sugarcane |
| HPLC | Agilent Technologies | 1200 Infinity | Quantification of organic acids in root exudates |
| Magnesium sulphate | Sisco Research Laboratories, India | 29117 | Preparation of modified Hoagland's solution |
| Manganese chloride | Sisco Research Laboratories, India | 75113 | Preparation of modified Hoagland's solution |
| Molybdic acid | Sisco Research Laboratories, India | 49664 | Preparation of modified Hoagland's solution |
| Potassium dihydrogen phosphate | Central Drug House, India | 29608 | Preparation of modified Hoagland's solution |
| Potassium nitrate | Central Drug House, India | 29638 | Preparation of modified Hoagland's solution |
| Protrays | Fabricated in-house | NA | Used for germinating sugarcane setts |
| Red soil | Purchased from local sources | NA | Used for germinating sugarcane setts |
| Root core sampler | Fabricated in-house | NA | Used for in situ root sampling |
| Sand | Purchased from local sources | NA | Used for germinating sugarcane setts |
| Seralite-120 | Sisco Research Laboratories, India | 14891 | cation exchange resin for processing of root exudates |
| Supporting frame | Purchased from local sources | NA | Used for hydroponic culture of sugarcane |
| Water motor pump | Purchased from local sources | NA | Used for hydroponic culture of sugarcane |
| Whatman filter paper grade 1 | Universal Scientific | 1001090 | Processing of root exudates |
| WinRhizo PRO (software) | Regent Instruments Inc., Canada | STD4800 | Two-dimensional root scanner with software for analysis of roots |
| Zinc sulphate | Sisco Research Laboratories, India | 76455 | Preparation of modified Hoagland's solution |
Referências
- Food and Agriculture Organization of the United Nations (FAO). Crops and livestock products. FAOSTAT. , Available from: http://www.fao.org/faostat/en/#data/QC (2019).
- Venkatraman, T. S., Thomas, R. Studies of sugarcane roots at different stages of growth. Agricultural Journal of India. 23, 166-176 (1928).
- Smith, D. M., Inman-Bamber, N. G., Thorburn, P. J. Growth and function of the sugarcane root system. Field Crops Research. 92 (2-3), 169-183 (2005).
- Glover, J. The behaviour of the root-system of sugarcane at and after harvest. Proceedings of the South African Sugar Technologists Association. 42, 133-135 (1968).
- Venkatraman, T. S., Thomas, R. Sugarcane root systems: Studies in development and anatomy. Agricultural Journal of India. 17 (4), 416-418 (1922).
- Saliendra, N. Z., Meinzer, F. C. Genotypic, developmental and drought-induced differences in root hydraulic conductance of contrasting sugarcane cultivars. Journal of Experimental Botany. 43 (9), 1209-1217 (1992).
- Gilbert, R. A., Rainbolt, C. R., Morris, D. R., Bennet, A. C. Morphological responses of sugarcane to long-term flooding. Agronomy Journal. 99 (6), 1622-1628 (2007).
- Shiotsu, F., Abe, J., Doi, T., Gau, M., Morita, S. Root morphology and anatomy of field-grown Erianthus arundinaceus. American Journal of Plant Sciences. 6 (1), 103-112 (2015).
- Hari, K., Vasantha, S., Anna Durai, A., Brindha, C., Shruthi, P. Sugarcane root growth and development in hydroponics system. Journal of Sugarcane Research. 7 (2), 71-82 (2017).
- Matsuoka, S., Garcia, A. A. F. Sugarcane underground organs: Going deep for sustainable production. Tropical Plant Biology. 4, 22-30 (2011).
- Koevoets, I. T., Venema, J. H., Elzenga, J. T. M., Testerink, C. Roots withstanding their environment: Exploiting root system architecture responses to abiotic stress to improve crop tolerance. Frontiers in Plant Science. 7, 1335(2016).
- Vengavasi, K., Pandey, R. Root exudation index: Screening organic acid exudation and phosphorus acquisition efficiency in soybean genotypes. Crop and Pasture Science. 67 (10), 1096-1109 (2017).
- Bray, H. G., Thorpe, W. V. Analysis of phenolic compounds of interest in metabolism. Methods of Biochemical Analysis. 1, 27-52 (1954).
- Lowry, O. H., Rosebrough, N. J., Farr, A. L., Randall, R. J. Protein measurement with the folin phenol reagent. The Journal of Biological Chemistry. 193 (1), 265-275 (1951).
- Hedge, J. E., Hofreiter, B. T. Determination of total carbohydrate by anthrone method. Carbohydrate Chemistry: Volume 17. , Academic Press. New York. (1962).
- Moore, S., Stein, W. H. Polyphenol oxidase. Methods in Enzymology. Vol 468. , Academic Press. New York. (1948).
- Malik, C. P., Singh, M. B. Plant Enzymology and Histo-enzymology: A text manual. , Kalyani Publications. New Delhi. (1980).
- Beauchamp, C., Fridovich, I. Superoxide dismutase: Improved assays and an assay applicable to acrylamide gels. Analytical Biochemistry. 44, 276-287 (1971).
- Singleton, V. L., Rossi, J. A. Colorimetry of total phenolics with phosphomolybdic- phosphotungstic acid reagents. American Journal of Enology and Viticulture. 16, 144-158 (1965).
- Rege, R. D., Wagle, P. V. Problems of sugarcane physiology in the Deccan canal tract. III. The root-system. The Indian Journal of Agricultural Science. 2 (3), 356-373 (1940).
- Ryker, T. C., Edgerton, C. W. Studies on sugar cane roots. LSU Agricultural Experiment Station Reports. 223, (1931).
- Jensen, J. H. Some studies of root habits of sugar cane in Cuba. The Tropical Plant Research Foundation. , New York. (1931).
- Kücke, M., Schmid, H., Spiess, A. A comparison of four methods for measuring roots of field crops in three contrasting soils. Plant and Soil. 172 (1), 63-71 (1995).
- Noordwijk, M., et al. Trench Profile Techniques and Core Break Methods. Root Methods: A handbook. , Springer. Berlin, Heidelberg. (2001).
- De Azevedo, M. C. B., Chopart, J. L., Medina, C. C. Sugarcane root length density and distribution from root intersection counting on a trench-profile. Scientia Agricola. 68 (1), 94-101 (2011).
- Nissen, T., Rodriguez, V., Wander, M. Sampling soybean roots: A comparison of excavation and coring methods. Communications in Soil Science and Plant Analysis. 39 (11-12), 1875-1883 (2008).
- Burridge, J. D., et al. An analysis of soil coring strategies to estimate root depth in maize (Zea mays) and common bean (Phaseolus vulgaris). Plant Phenomics. 2020, 3252703(2020).
- Schroth, G., Kolbe, D. A method of processing soil core samples for root studies by subsampling. Biology and Fertility of Soils. 18, 60-62 (1994).
- Chandran, K., Nisha, M., Arun Kumar, R., Krishnapriya, V. Breeding varieties resistant to waterlogging. ICAR-SBI Annual Report 2016-17. , 128(2016).
- Wu, Q., Wu, J., Zheng, B., Guo, Y. Optimizing soil-coring strategies to quantify root-length-density distribution in field-grown maize: Virtual coring trials using 3-D root architecture models. Annals of Botany. 121 (5), 809-819 (2018).
- Joshi, D. C., et al. Development of a phenotyping platform for high throughput screening of nodal root angle in sorghum. Plant Methods. 13, 56(2017).
- Koyama, T., Murakami, S., Karasawa, T., Ejiri, M., Shiono, K. Complete root specimen of plants grown in soil-filled root box: Sampling, measuring, and staining method. Plant Methods. 17, 97(2021).
- Gomathi, R., Gururaja Rao, P. N., Chandran, K., Selvi, A. Adaptive responses of sugarcane to waterlogging stress: An overview. Sugar Tech. 17, 325-338 (2014).
- Misra, V., et al. Morphological assessment of water stressed sugarcane: a comparison of waterlogged and drought affected crop. Saudi Journal of Biological Sciences. 27 (5), 1228-1236 (2020).
- Robinson, N., et al. Sugarcane genotypes differ in internal nitrogen use efficiency. Functional Plant Biology. 34 (12), 1122-1129 (2007).
- Arruda, B., et al. Biological and morphological traits of sugarcane roots in relation to phosphorus uptake. Journal of Soil Science and Plant Nutrition. 16 (4), 901-915 (2016).
- Sharma, S., Borah, P., Meena, M. K., Bindraban, P., Pandey, R. Evaluation of genotypic variation for growth of rice seedlings under optimized hydroponics medium. Indian Journal of Genetics and Plant Breeding. 78 (3), 292-301 (2018).
- Soumya, P. R., Singh, D., Sharma, S., Singh, A. M., Pandey, R. Evaluation of diverse wheat (Triticum aestivum) and triticale (× Triticosecale) genotypes for low phosphorus stress tolerance in soil and hydroponic conditions. Journal of Soil Science. 21, 1236-1251 (2021).
- Ganie, A. H., et al. Metabolite profiling and network analysis reveal coordinated changes in low-N tolerant and low-N sensitive maize genotypes under nitrogen deficiency and restoration conditions. Plants. 9 (11), 1459(2020).
- Venkatraman, T. S., Thomas, R. Simple contrivances for studying root development in agricultural crops. Agricultural Journal of India. 18, 509-514 (1923).
- Clark, R. T., et al. High-throughput two-dimensional root system phenotyping platform facilitates genetic analysis of root growth and development. Plant, Cell and Environment. 36 (2), 454-466 (2013).
- Chopart, J. L., Rodrigues, S. R., Azevedo, M. C. B., Medina, C. C. Estimating sugarcane root length density through root mapping and orientation modelling. Plant and Soil. 313, 101-112 (2008).
- Chopart, J. L., Azevedo, M. C. B., Le Mezo, L., Marion, D. Functional relationship between sugarcane root biomass and length for cropping system applications. Sugar Tech. 12 (3-4), 317-321 (2010).
- De Silva, A. L. C., De Costa, W. A. J. M., Bandara, D. M. U. S. Growth of root system and the patterns of soil moisture utilization in sugarcane under rain-fed and irrigated conditions in Sri Lanka. Sugar Tech. 13 (3), 198-205 (2011).
- Otto, R., Silva, A. P., Franco, H. C. J., Oliveira, E. C. A., Trivelin, P. C. O. High soil penetration resistance reduces sugarcane root system development. Soil and Tillage Research. 117, 201-210 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados