Method Article
表征甘蔗根系的多管齐下表型方法
摘要
表征根系性状是仍处于起步阶段的研究领域之一,尤其是在甘蔗中。整合多种方法来精确对甘蔗根进行表型分析,可产生全面和整体的结果,从而能够利用已确定的性状和机制进行常规和分子育种。
摘要
根是水和养分的主要导体,在压力环境下维持生长和产量方面起着至关重要的作用。植物根系的研究在 原位 评估和采样方面存在方法学上的困难,对于甘蔗 (Saccharum spp.) 尤其如此。1920 年代的传统方法记录了甘蔗根系的基因型变异,此后直到最近才报道了甘蔗根性状 本身 的研究。除了形态学之外,根际特征,包括化感作用和/或对微生物共生的亲和力,决定了植物的建立和生存。
归根系决定了甘蔗的地上生产力。随着气候适应型品种的推动,探索和利用甘蔗根系性状的可变性变得越来越重要。本文描述了甘蔗根表型分析的多管齐下的方法,包括通过沟槽采样进行田间挖掘、使用根芯采样器、用于根采样的高架平台以及在水培培养下培育植物,由印度农业研究委员会-甘蔗育种研究所 (ICAR-SBI) 的科学家团队采用。
通过沟槽取样进行田间挖掘对于评估植物自然生长环境中的根系是必不可少的。使用模拟现场条件的高架平台和根芯采样器是替代方法,可大大缩短时间、均匀样品量和减少根材料的损失。水培植物培养可以研究形态学、解剖学特征和根际生物学,包括有机化合物的渗出和微生物相互作用。使用不同采样方法从不同实验中生成的数据增加了有关甘蔗根系性状的丰富信息。
引言
甘蔗 (Saccharum spp.) 是一种重要的食品和生物能源,是一种重要的经济作物,适合在许多具有热带和亚热带气候条件的国家种植。由于 C4 光合作用途径进行碳同化,甘蔗的生产力很高,可以有效地利用水和肥料等农业投入。甘蔗的收获后加工产生具有经济价值的产品,例如糖和粗糖,以及其副产品——糖蜜、乙醇和能源。近 100 个国家生产甘蔗,面积为 25.97 Mha,约占总耕地面积的 1.5%。仅印度就贡献了世界甘蔗产量的 16%(约 306 公吨),平均生产力为 70 t·ha−1 1。对甘蔗生产产生重大影响的主要非生物胁迫包括缺水、涝渍、极端温度以及土壤特性,如营养缺乏、盐度、钠度和碱度。开发非生物耐逆作物的最大挑战是确定在胁迫条件下赋予巨大产量优势的特定性状。
甘蔗生理学的几个方面知之甚少,包括根-芽关系,它极大地影响了甘蔗的生产力。甘蔗根不如芽得到充分研究,尽管不同的类型,如根、芽根和成根,可能在发育上不同,功能也不同。在发芽过程中出现的 sett 根的数量和长度方面观察到基因型差异2。凝固根与甘蔗芽的发芽有关,确保作物的早期建立,后来被芽根取代,芽根很健壮,从发育中的芽的基部冒出来3。在根部观察到的细枝有助于固定幼苗,并有助于吸收水分和养分,直到它们被芽根取代。与 sett 根类似,芽根也来自甘蔗较低、未展开的节间的根原基。
由于芽根在植物中持续的时间较长,因此它们比 sett 根粗 4 至 10 倍。芽根构成了甘蔗唯一的根系,在甘蔗的进一步生长和发育中起着重要作用。芽根的活力与植物的整体营养活力呈正相关。由于坐根和芽根的更新而导致的根的不断发育产生了甘蔗的“成年根系”,它不断适应当前的环境条件。一般来说,与较浅的根系分布相比,更深、多产的根系为作物提供了更多的水分和养分。定期解剖表明,当土壤含水量高时,观察到较浅的根系,而随着地下水位的下降,根系会发展得更深2。甘蔗的根系即使在作物收获后仍然活跃,有助于再生作物的生长,直到新的芽根从地下芽中冒出4。根角和根分枝水平是决定植物根系探索土壤体积的两个重要因素。根角是一种基因型性状,可以通过常规育种或分子方法改变,以提高对生物和非生物胁迫的耐受性。相反,根分枝的水平主要受环境影响,因此需要定期监测根系发育及其对局部土壤条件的反应。
已经检查了甘蔗根的解剖特征,以确定基因型和环境方面的差异。甘蔗中 sett 根的解剖结构类似于其他禾本科植物(如玉米)中成熟根的解剖结构,其中皮层由规则模式的分化良好的细胞层组成。内皮被亚化,然后是单层周。后木质部元素是主要导体或水和营养离子,呈放射状排列并散布着韧皮部组,后者由一个带有两个伴生细胞的筛元件组成。未分化细胞的大中心团块形成根髓。甘蔗品种的不同解剖特征对应于根系的水力特性,从而影响水分运动。对甘蔗根解剖性状差异的早期研究表明,在低水分胁迫条件下,在内皮内、髓和维管区域之间以及血管周围观察到细胞壁明显增厚5。这种增厚的细胞可能是为了防止树液倒流和应力期间的机械强度而引起的适应。
甘蔗抗旱性涉及的一些重要特征包括外皮层的相对厚度和数量、皮层与柱的比例、皮层中的细胞间隙和增厚的根发尖。皮质细胞占据的面积与芽根的恒状组织占据的面积之比在甘蔗栽培品种之间存在显著差异,在石碑6 的面积方面存在很大差异。甘蔗根的导水率与芽根中后木质部元素的大小和数量有关。根内的疏水细胞层可能定义了质外体水运动的区域。亚生 Casparian 带存在于内皮和皮下组织(称为皮下组织)中,它们用作疏水屏障。皮质细胞的分解导致在较老的根和受低氧条件影响的植物中形成溶原气囊,无论发育年龄如何。淹水胁迫期间通气组织形成与抗性品种的生长维持相关7。
Erianthus arundinaceus [Retzius] Jeswiet(与 Saccharum spp. 相关的属)根的形态和解剖结构与其对环境胁迫的强烈耐受性有关8。Erianthus arundinaceus 根表现出以陡峭的角度分布的节根,具有浓密的根毛,以促进从更深的土壤区域吸收水和营养离子。深根系统由许多以陡峭生长角度生长的节点根组成。节根的直径与大型木质部血管的大小和数量相关,前者从 0.5 毫米到 5.0 毫米不等。这些结根也形成根状鞘,皮下组织在外皮层(皮外)显示木质化的巩膜组织,在皮层中部显示溶原性气团,在石柱中显示淀粉颗粒。除了结构和形态特征外,根系分泌的有机化合物在决定植物发芽、建立和生存方面起着重要作用,具有合理的化感作用和/或对微生物共生的亲和力。
在水培栽培下种植的甘蔗品种中记录了根酶活性和形态的更精细细节,包括根帽色素沉着和受伤后的年轻化潜力9。根系生长显示出对土壤环境变化的高度可塑性反应,无论是在根系的形式还是大小方面。最有效的甘蔗品种是芽数少或最佳数量的甘蔗品种,根数相应较低,有助于在压力条件下更好地生存。因此,对根系的系统研究应该成为任何作物改良计划的重要组成部分10。大多数专注于根的实验主要依赖于发育方面,而关注功能性可塑性往往缺乏11。 除了结构分布外,功能性根的可塑性在胁迫下的生存中起着至关重要的作用,因此,将支持育种者努力将根系性状纳入非生物胁迫耐受性的选择管道中,并提高甘蔗的健壮性。
考虑到甘蔗在压力环境下维持生长和产量的重要性,探索和利用甘蔗根系性状的固有变异性至关重要。强调选择赋予优质根系的成分性状和机制是在不断变化的气候条件下提高作物表现的前进方向。表型评估是一个漫长且昂贵的过程;然而,多管齐下的方法的整合将为其在作物改良中的效用增加巨大的价值。在这份手稿中,描述了甘蔗根系表型的四种不同方法,每种方法都有自己的优点和缺点,这意味着需要共同努力才能获得全面和整体的结果。
研究方案
1. 通过沟槽取样进行现场挖掘
- 按照推荐做法包 (POP) 在田间从行距为 120 厘米、行内 90 厘米的双芽集合中培育商业甘蔗杂交种(以下简称“品种”),以确保良好的作物建立和生长。
- 在作物成熟期结束时,使用挖掘机在田间挖一条沟(1.5 m 深,1.0 m 宽)。通过连续的水射流,确保在不损坏根部的情况下清除根区的土壤(图 1)。
- 当粘附的土壤松动时,将藤条连根拔起,并将其带到实验室手动测量根的数量、根长、体积和重量。

图 1:用于现场挖掘根系的沟槽采样方法。 (A) 沿田地挖掘的侧向沟槽,(B) 水射流,以及 (C) 显示沟槽深度的内部视图。 请单击此处查看此图的较大版本。
2. Root core sampler 以减少采样错误
- 使用高 61 厘米、直径 16 厘米、重 8 公斤的圆柱形根芯取样器,使用低碳钢 (MS) 材料制成,在田间进行甘蔗根取样。在采样器的底部边缘提供锋利的边缘,以便在将其插入土壤时易于穿透。为顶部提供直径为 3 cm 的项圈以抬起采样器(图 2)。
- 按照推荐的 POP 在田间从行距为 120 厘米、行内 90 厘米的双芽集合中培育甘蔗品种,以确保作物的良好建立和生长。
- 在作物的成熟阶段,将取样器的顶部边缘固定在主芽/藤条上,并不断锤击以达到所需的土壤深度(45 厘米)。将整个土壤块提升到采样器中,并在流水下小心清洗以分离粘附的根部。
- 彻底清洗根部后,通过手动测量记录体积、表面积、长度和重量,以及将根部铺在透明托盘上,以使用参考软件扫描和分析相应的数字化图像(参见 材料表)。

图 2:根核心采样器。(A) 尺寸,(B) 俯视图,以及 (C) 采样地点。 请单击此处查看此图的较大版本。
3. 根表型结构,便于在不同表期进行采样
- 构建一个根表型结构,包括三个尺寸为 4.5 m x 10.1 m 的相邻隔室,用于甘蔗根的采样,并规定手动拆卸侧壁以露出地下根系(最深 80-100 cm)(图 3)。用尺寸为 1.8 m 长、30 cm 宽和 4 cm 厚的预制板建造侧墙。
- 用田间土壤填充和压实结构,留出 ~20 厘米的顶部空间,并有足够的排水孔以促进土壤通气。
- 播种种质克隆的芽片,包括 Saccharum officinarum L.、 Saccharum spontaneum L.、 Saccharum barberi Jesw.、 Saccharum sinense Roxb.、 Saccharum robustum Brandes 和 Jeswiet ex Grassl。(以下简称“Saccharum spp. 克隆”)并让它们在包含生根介质的 protrays 中发芽 30 天(红土:农家院子肥料:沙子 = 2:2:1)。按照推荐的 POP 以 90 厘米的行距将均匀和健康的沉降物移植到结构中,行内 60 厘米,以确保作物的良好建立和生长。
- 在形成期(种植后 60-120 天 [DAP])和大生长期(120-150 DAP)阶段,手动去除由预制板制成的侧壁,然后连续喷洒水射流以露出根部。
- 将整个根系连根拔起,带到实验室手动测量长度、体积和重量,并将根铺在透明托盘上,在参考软件中扫描和分析相应的数字化图像(参见 材料表)。
- 通过停止其中一个隔间的灌溉来施加干旱胁迫,并堵塞第二个隔室中的排水孔以保持土壤饱和度,以模拟内涝胁迫。根据推荐的 POP 冲洗第三个隔间,以保持田间容量并用作对照。

图 3:根表型结构。 (A) 尺寸,(B) 三个隔室的概述,以及 (C) 一个隔室的视图。 请单击此处查看此图的较大版本。
4. 植物水培培养研究根际生物学
- 在环境受控的温室中制造一个有利于种植甘蔗的内部水培系统,以研究根系生物学的更精细细节。将 ~15 L 改性 Hoagland 营养液(表 1)添加到 20 cm x 20 cm x 50 cm 的玻璃罐中,由水族箱泵提供曝气(图 4)。
- 播种甘蔗品种和 Saccharum spp. 克隆的芽片,让它们在包含堆肥椰壳髓的 protrays 中发芽 30 天。以每个水箱 3 次沉淀的频率将均匀健康的沉淀物移植到水培池中,注意将整个根部放入营养液中。用黑布盖住水箱,以确保根部不暴露在光线下。在玻璃罐的边缘使用塑料网 (20 cm x 20 cm) 来支撑植物直立。
- 在发芽阶段(60 天)结束时,在光合活性高峰期间,通过将完整植物的根浸入 50 mL 捕集液(无菌双蒸水)中 4 小时(0800 小时至 1200 小时)来收集根系分泌物。通过 Whatman 滤纸过滤收集的溶液,然后通过填充有阴离子交换的玻璃柱,然后通过阳离子交换树脂12。将洗脱的馏分蒸发至干燥并储存在 -20 °C 直至进一步加工。
- 根据标准方案,通过 HPLC 分析处理的根分泌物样品以测定有机酸12 ,并通过分光光度法估计总酚13、蛋白质14、糖15 和氨基酸16 。
- 每周监测根部生长情况,以记录根尖色素沉着和根部毛发密度。根据标准方案,在第 3 个月评估酶、过氧化物酶17 和超氧化物歧化酶18 以及总酚含量19 的活性。
- 通过使用无菌手术刀片在主根直至根尖处施加纵向切片来评估对牙根损伤的反应,并定期监测变化。
| 化学的 | 最终浓度 |
| 硝酸钾 | 0.608 克·L-1 |
| 硝酸钙 | 1.415 克·L-1 |
| 磷酸二氢钾 | 0.164 克·L-1 |
| 硫酸镁 | 0.560 克·L-1 |
| EDTA-单钠铁盐 | 6.00 克·250L-1 |
| 硼酸 | 1.43 克·250L-1 |
| 氯化锰四水合物 | 0.91 克·250L-1 |
| 硫酸锌 | 0.11 克·250升-1 |
| 硫酸铜 | 0.04 克·250升-1 |
| 钼酸 | 0.01 克250升-1 |
表 1:用于甘蔗水培的改性营养液的成分。

图 4:水培设置。 设置 (A) 为种植甘蔗定制,(B) 5 个月大的作物(去除黑布仅用于摄影目的)。该图已从 Hari 等人 9 修改而来。 请单击此处查看此图的较大版本。
结果
甘蔗品种根系形态性状的变化
图 5A、B 显示了 Co 62175 中根系的代表性图像,该图像通过沟槽取样从田间挖掘并在水培设置中生长。在 Co 62175 和 Co 99006 品种中观察到长根 (~100 cm),而 Co 99006 的根重最高 (127 g·clump−1)。使用根芯采样器记录根性状,结果显示与 Co 99006 相比,Co 62175 在累积根长、根表面积和根体积方面具有更好的根系(图 5C-E)。然而,Co 99006 的平均根直径高于 Co 62175(图 5F)。
Saccharum spp. 克隆根形态特征的变化
形成期的形态特征在糖属无性系之间表现出显著差异,在自发性链球菌 (IND 85-490) 中观察到最高的累积根长为每丛 39615.72 厘米,而在香蕉 (Oshima) 中观察到最低(图 6A)。在 S. spontaneum (IND 85-490) 中观察到每丛根表面积最高 (4700.31 cm2),其次是 S. officinarum (Awela Green Sport),在 S. sinense (Oshima) 中记录最低(图 6B)。在根体积和平均根直径的情况下观察到类似的趋势(图 6C,D)。在大生长期取样的根的形态是手动测量的,结果显示最长的根(131 cm)存在于 S. robustum (NG 77-237) (图 6E),而 S. spontaneum 的根干重最高 (IND 85-490: 57.4 g·clump−1) 和最低的 S. sinense (Oshima: 11.2 g·clump−1) (图 6F)。根体积和根冠比遵循与根干重相似的趋势(图 6G,H)。
Saccharum spp. 克隆根解剖特征的变化
在糖属无性系中,距顶端 10 mm 处根的横截面积差异显著,其中 S. spontaneum (IND 85-490) 显示最大面积 (27646.8 mm2),而 S. sinense (Oshima) 记录最低 (7539.1 mm2) (表 2)。S. sinense (Oshima) 的主要区域被皮质细胞占据,而在 S. ssigntaneum (IND 85-490) 中,被柱组织占据的区域突出,这反映在皮层与柱比的数据中。后木质部元素的数量从 6 (S. officinarum: Awela Green Sport) 到 13 (S. spontaneum: IND 85-490) 不等,而空气空间 (溶出通气组织) 的数量从 12 (S. barberi: Putli Khajee) 到 32 (S. spontaneum: IND 85-490) 不等。后木质部元素占据的面积在 S. barberi (Putli Khajee) 中最高 (791.3 mm2),在 S. sinense (Oshima) 中最低 (254.3 mm2)。在正常灌溉条件下,S. spontaneum (IND 85-490) 中通气充质占据的面积最高 (4921.3 mm2),而 S. sinense (Oshima) 和 S. robustum (NG 77-237) 根没有通气细胞。Saccharum sinense (Oshima)、S. spontaneum (IND 85-490) 和 S. barberi (Putli Khajee) 在干旱和淹水胁迫条件下表现出优越的根解剖酚(图 7A-C)。干旱胁迫下,长根毛、巩膜充质外皮层、皮质细胞层减少、皮质通气充质增加、柱面积增加、木质部血管数量大是有利的,而根直径增加和皮质细胞面积增加,通气细胞增加增强了机械强度、根孔隙率和涝水胁迫下的氧气扩散。
Saccharum spp. 克隆根系分泌物类型和数量的变化
在糖属无性系萌发期分泌的有机化合物中,总蛋白的比例最高,其次是羧酸盐、糖类、酚类和游离氨基酸。Saccharum robustum (NG 77-221) 显示总羧酸盐渗出量最高 (5.11 mg·g−1·根鲜重 [RFW]·h−1),而最低 (0.65 mg·g−1·RFW·h-1) 记录在 S. spontaneum (IND 85-490) 中,渗出的单个羧酸的类型和数量存在显着差异(图 8A)。Saccharum officinarum (Awela Green Sport) 渗出的总酚含量最高(0.034 mg·g−1·RFW·h−1),而最低的 (0.002 mg·g−1·RFW·h-1) 在 S. spontaneum (IND 85-490) 的情况下观察到(图 8B)。总蛋白渗出量最高(3.23 mg·g−1·RFW·h−1) 在 S. officinarum (Awela Green Sport) 中观察到,而最高的总糖 (0.22 mg·g−1·RFW·h−1) 和总游离氨基酸 (0.04 mg·g−1·RFW·h−1) 记录在 S. sinense (Oshima) 中(图 8C-E)。最低的总蛋白渗出量 (2.08 mg·g−1·RFW·h−1) 在自发链球菌 (IND 85-490) 中观察到,而 S. robustum (NG 77-221) 渗出的总糖含量最低 (0.05·mg·g−1·RFW·h−1) 和总游离氨基酸 (0.01 mg·g−1·RFW·h−1)。
甘蔗品种根尖色素沉着、酶活性和总酚含量的变化
根帽形状范围从简单的三角形 (Co 62175) 到圆顶 (Co 86032),而根帽色素沉着从浅粉红色 (Co 62175) 到深紫色 (Co 86032) 不等,根毛密度存在显着差异(图 9A-C)。Co 86032 的过氧化物酶活性最高 (40 units·g−1·h−1),Co 62175 最低 (26 units·g−1·h−1),而在根中超氧化物歧化酶活性的情况下,趋势相反(图 9D,E)。同样,Co 86032 的总酚含量最高 (18 μg·g-1),Co 62175 最低 (15 μg·g-1)(图 9F)。
甘蔗品种根系损伤后返血发育阶段的变化
在水培设置中饲养的甘蔗品种 CoC 671 和 Co 06022 中测试了根损伤后的恢复活力(图 10A-I)。在 CoC 671 中,次生根出现在受伤的第 3 天,而在 Co 06022 中,次生根起始仅在第 10 天出现。此外,Co 06022 的原根在第 3 天出现衰老症状,而 CoC 671 根保持相对健康。在第 10 天,在 CoC 671 中也观察到了第三根。

图 5:Co 62175 的根系和不同的形态特征。 (A) 通过沟槽采样挖掘的 Co 62175,(B) 在水培设置中生长的 Co 62175 的根系,以及形态特征 (C) 累积根长,(D) 根表面积,(E) 根体积,以及 (F) 使用根芯采样器记录的平均根直径。数据表示 SEM ±平均值 (n = 3)。 请单击此处查看此图的较大版本。

图 6:根形态特征。 (A) 累积根长,(B) 根表面积,(C) 根体积和 (D) 形成期的平均根直径,以及 (E) 最长根的长度,(F) 根干重,(G) 根体积和 (H) 根冠比 (H) 表型结构记录的 糖 属克隆大生长期 (S. officinarum: Awela Green Sport,S. spontaneum:IND 85-490,S . sinense:大岛, S. barberi:Putli Khajee,S . robustum:NG 77-237)。数据表示 SEM ±平均值 (n = 3)。 请单击此处查看此图的较大版本。

图 7: S. sinense 克隆 Oshima 的根解剖特征。 (A) 正常的生长条件以及对 (B) 干旱和 (C) 涝涝胁迫的响应。比例尺 = 100 μm。缩写: rh = 根毛;ae = 溶原性通气充质;mx = 后木质部;ex = 外皮;ep = 表皮。 请单击此处查看此图的较大版本。

图 8:根系渗出。(A) 羧酸盐,(B) 总酚,(C) 总蛋白,(D) 总糖和 (E) 糖属克隆发芽期的总游离氨基酸(S. officinarum:Awela Green Sport,S. spontaneum:IND 85-490,S. sinense:大岛,S. barberi:Putli Khajee,S. robustum: NG 77-221)。数据表示 SEM ±平均值 (n = 3)。缩写:RFW = 根鲜重。请单击此处查看此图的较大版本。
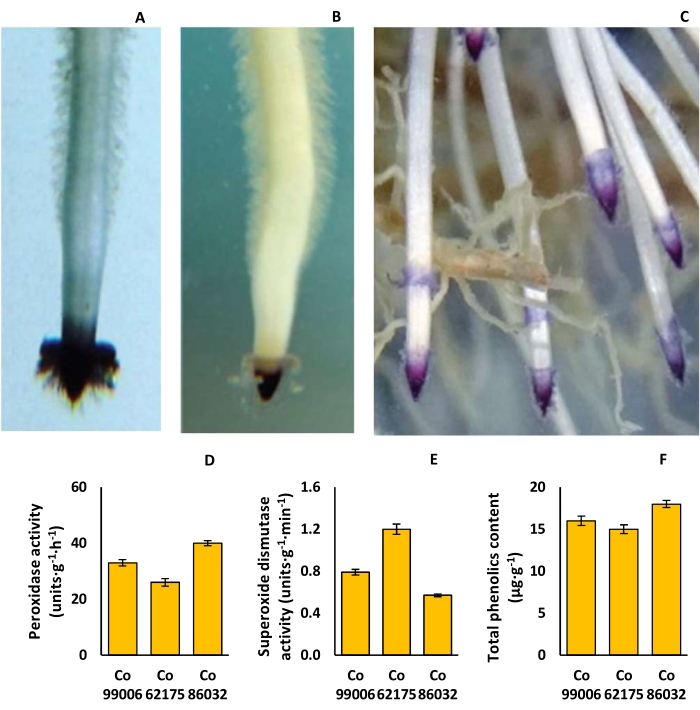
图 9:甘蔗品种的根际性状。 (A) Co 62175 中的三角形根帽,(B) Co 86032 中的圆顶形根帽,(C) Co 86032 中的深紫色根尖色素沉着,(D) 过氧化物酶活性,(E) 超氧化物歧化酶活性,以及 (F) 在水培设置中培育的植物的总酚含量。 D、 E 和 F 中的数据表示 SEM ±平均值 (n = 3)。该图已从 Hari 等人 9 修改而来。 请单击此处查看此图的较大版本。

图 10:在水培设置中培育的甘蔗品种根部受伤后恢复活力的发育阶段。(AE) CoC 671 和 (F-I) Co 06022;(A,F) 未受伤的根;(B,G) 因纵向切片而受伤的根;(C,H) 受伤后 3 天;(D、E、I) 受伤后 10 天。该图已从 Hari 等人 9 修改而来。请单击此处查看此图的较大版本。
| 根部横截面积 (mm2) | 皮层与石柱的比率 | 外皮层数 | 后木质部元素的数量 | 后木质部的平均直径 (mm) | 空域数 | 后木质部占据的面积 (mm2) | 空气空间占用面积 (mm2) | |
| 铁皮葡萄球菌 | 6936.3±200.2 | 0.508±0.015 元 | 1.00±0.03 元 | 6.00±0.17 | 8.5±0.3 元 | 14.00±0.40 元 | 340.3±9.8 元 | 1993 年 0 月 57 日± |
| S. spontaneum 自发链球菌 | 27646.8±957.7 | 0,481±0.017 | 2.00±0.07 元 | 13.00±0.45 元 | 6.6±0.2 | 11 月 32 日00 ± 1 月 11 日 | 444.5±15.4 元 | ¥4921.3±170.5 |
| S. sinense 紫檐 | 7539.1±261.2 | 0.727±0.025 元 | 2.00±0.07 元 | 9.00±0.31 元 | 6.0±0.2 | - | 图元 254.3±8.8 | - |
| S. barberi 巴贝里 | ¥18859.6±435.6 | 0.692±0.015 元 | 1.00±0.02 | 7.00±0.16 元 | 12.0±0.3 | 12.00±0.28 | 791.3±18.3 | ¥4454.6±102.8 |
| 罗氏链球菌 | 8328.1±288.5 | 0,563±0.019 元 | 2.00±0.07 元 | 10.00±0.35 元 | 7.0±0.2 | - | 384.7±13.3 | - |
表 2:在 Saccharum spp. 克隆中观察到的根解剖特征。 数据代表 SEM 的平均± (n = 3)(S. officinarum:Awela Green Sport,S. spontaneum:IND 85-490,S . sinense:Oshima,S . barberi:Putli Khajee,S . robustum:NG 77-237)。
讨论
根系决定了甘蔗的地上生产力,因此需要彻底探索和了解其所有方面,以开发具有气候适应性的品种。ICAR-SBI 的科学家团队由植物生理学家、微生物学家、农业工程师、生物化学家和植物育种家组成,采用多管齐下的方法进行甘蔗根表型分析,包括通过沟槽采样进行田间挖掘、使用根芯采样器、用于根采样的高平台以及在水培下培育植物。鉴于单个方法可能不是详尽和/或排他性的,因此需要整合信息以揭示理想根表型的组成性状和机制。早期的根采样方法在他们的努力中是孤立的,但对于开发本文中描述的策略很有用。
Venkatraman 和 Thomas5 通过描述三种合适的研究方法,开创了甘蔗根的研究。在第一种方法中,在植物的侧面挖一个深坑,这样就可以将根部从土壤中解剖出来,粉刷干净,并在其自然位置拍照。在第二种方法中,在植物的相对两侧挖深坑。将 2 个铁丝网框架靠在植物相邻的坑的侧面,铁棒穿过中间土壤的宽度以将根固定在各自的位置。然后用水清洗土壤,并拍摄根部照片。第三种方法是制作特殊的植物进行根系研究。在挖掘的地块中,在一定水平处放置了铁丝网,然后重新填充挖掘物,像以前一样替换了各自层的土壤。要研究的植物是在地块中种植的。检查时,用水清洗植物周围的土壤,使根系悬浮在金属丝网的网眼中。
Rege 和 Wagle20 开发了一种在灌溉条件下进行根系研究的方法,方法是在甘蔗边缘垂直挖一个坑,并通过在指定区域清洗土壤来露出根系。它造成了最少的植物材料浪费,并使研究人员能够对 根 系进行定性和定量研究。进行了一项专门研究来调查甘蔗根的结构、发育和行为21.事实证明,“根箱法”和“土壤挖掘法”在研究甘蔗根系的分布方面非常有用。研究发现,重土壤中的浅根比混合土壤或较轻的土壤多。后者普遍存在的松散质地和通气性有利于根系渗透到更深的土壤区域,使其更适合根系发育。第一批发育的根直接在土壤中向下生长,渗透到超过 30-36 英寸的深度,随后在表层观察到浅蔓延的根系(距表土 ~14 英寸), 其中 ~85%-90% 的根分布。较深的根无疑在干旱时期为植物提供了水分。根和芽的生长速度根据种植年份的气候条件和品种而变化。在活跃的生理条件下保持根系对于植物的最佳生长很重要,因为它经常受到栽培实践的干扰,必须尽可能避免。在古巴,通过“直接检查法”22 研究了选定甘蔗品种的根系变异性。根系发育的描述与根系在土壤中的分布图一起记录下来。
通过沟槽取样对根部进行田间挖掘是基于 Venkatraman 和 Thomas5、Rege 和 Wagle20 以及 Ryker 和 Edgerton21 的工作。尽管这是最费力和耗时的方法,但 原位 田间采样对于了解自然生长环境中的根表型是必不可少的。甜菜和谷物根系测量方法的比较表明,必须谨慎解释从沟槽剖面墙获得的数据,其中计算出的根长密度 (RLD)(累积根长与土壤体积的比率)比从根芯法获得的数据低 4 倍至 10 倍,具体取决于土壤类型23.从沟到茎的适当且均匀的距离对于确保最小的采样误差并最大限度地减少根和资源(包括劳动力)的损失非常重要。通过沟槽采样监测根系生长对于长期实验来说可能不可行,因为它本质上是破坏性的,而且根据观察平面,只有一小部分根部是可见的。然而,沟槽采样提供了根系分布和与土壤剖面相互作用的总体估计24。这项关于商业甘蔗杂交种中根系传播的调查显示,~70% 的生理活性根位于土壤剖面的 50 厘米范围内。
沟槽采样方法允许根据它们在土壤剖面中出现的深度来区分各种根类别。一般来说,深入土壤的根通常比在浅水区发现的根更细。在根长、体积和重量方面观察到广泛的基因型变异性。作物建模和仿真的进步有助于通过开发算法来完善从传统采样方法获得的数据,以最大限度地减少采样误差和实验异质性。将来自 原位 土壤剖面的甘蔗 RLD 数据与土壤取芯数据进行了比较,其中观察到计算土壤剖面中的根交点并使用模型估计 RLD 得出的 RLD 值与使用土壤芯法获得的 RLD 值相似25。对大豆土壤挖掘和取芯方法获得的数据进行比较,发现根系生物量的估计值相似,挖掘需要的总时间和更多的劳动力26。基于岩芯的样品更精确,允许在更深的根区进行采样,对实验地块的干扰最小。鉴于在自然生长环境中研究植物根系的优势,沟槽采样可能有助于结合土壤剖面数据和 RLD 剖面,但它不利于在大面积上采样27。在这种情况下,根核心采样器已被证明对于量化根分布和允许在更大区域上进行更多采样非常有用。
根芯采样器旨在促进从田间对根进行子采样,这保证了采样的一致性和较低的方差系数;它大大减少了抽样误差。根芯采样器的使用已被多种作物采用;它需要大量的采样后处理时间,因为需要非常小心以避免在洗涤过程中根部流失28。核心采样器有助于在固定体积的土壤中对根进行采样,并带出测试克隆之间根系性状的基因型变异,从而允许在给定的时间范围内测试更多样本。RLD 是评估植物健康状况的重要参数,可以在根芯采样器的帮助下精确得出。一般来说,系统性变化归因于取芯位置与茎的距离,这可能导致根数据明显不同。然而,就甘蔗而言,取样器是根据作物的独特形态制造的,并且在取样过程中将初级芽/甘蔗固定在其上。因此,确保所有品种的初级芽/藤条周围具有直径为 16 cm 的均匀核心,以最大限度地减少采样误差。
观察到使用根扫描仪方法和体积位移法记录的根体积数据之间存在显著相关性29。由于样本量远低于沟槽法,因此可以使用根核心采样器评估基因型之间的变异性。由于表型可塑性、土壤异质性和其他未知因素引起的随机变化会影响从根芯采样器获得的数据的可靠性,这可以通过重复测量和使用模拟软件来缩小功能相关差异来克服27。基于根系结构的三维模型和面积加权算法30 对玉米不同土壤取芯策略之间变化的虚拟评估表明,这种获得可靠 RLD 估计的经济高效的方法可能是根系研究的前进方向。
具有相邻隔室的根表型结构用于模拟田间,同时保持筛选甘蔗种质固有变异性所需的均匀性。与沟槽采样相比,破坏性采样的简便性,根的损伤和浪费明显减少,有助于分析不同物候期的整个根系。基于作物形态和根系分布的定制根箱或腔室已被证明对其他作物有效,例如高粱31、大豆和荞麦32。同样,隔室的大小和深度也得到了优化,以支持甘蔗的生长。此外,侧墙是使用预制板建造的,在根部取样时可以很容易地手动抬起。通过手动抬起侧壁,然后用水射流露出根部来采集根部样本。然后更换侧壁,重新填充土壤,确保对相邻植物的损害最小。甘蔗根性状的变异及其与芽生长的关系可能在根表型结构中培养的植物中得到记录。甘蔗的过度灌溉会产生浅表的根系,而水分不足会促进横向蔓延,略微深入33,34。随着施氮量的增加,根重降低,而磷肥对根系发育产生有利影响35,36。结构中的相邻隔室允许通过分别控制灌溉水量和使用营养枯竭的土壤来研究甘蔗对不同非生物胁迫和土壤养分水平的这种响应。
水培植物培养是评估大豆12、水稻37、小麦38 和玉米 39 中大量多样基因型种群的营养胁迫反应的首选方法。甘蔗的模拟根研究可以追溯到 192340 年,其中使用了一列带有金属丝网的陶器环来研究根的相对深度和平面。还尝试使用装满稀 Knop 溶液的陶制烹饪锅进行水培培养,以持续监测根系发育。内部水培设施可以研究根系发育和根际生物学变化的更精细细节9.甘蔗的容器大小和种植密度进行了优化,其中植物生长长达 10 个月,倒伏最少。根际特征,包括根帽形状和根尖色素沉着,只能在水培条件下进行评估,这有助于易于采样和没有土壤粘附物。当植物在田间种植时,可能无法从根部评估发育和压力反应,而水培文化允许进行此类测量。它有助于收集和表征根系渗出物,这在田间条件下可能无法实现。虽然没有防止根系渗透的物理障碍是这种方法的一个主要缺点,但当植物在水培条件下饲养时,定期监测根系生长是一个优势。
必须根据能够满足可持续农业需求的强大而理想的根表型重新设计新甘蔗栽培品种的结构。为水稻和玉米开发的高通量根系表型分析平台包括适用于各种生长系统的组件,例如土壤和水培、先进的根成像技术和软件工具41;扩大甘蔗的此类平台为在不久的将来提高生产力提供了很大的空间。尽管强调根生物学是甘蔗生长和生产力的重要决定因素,并且有先进的根表型分析技术可用,但很少有研究报道甘蔗根性状本身 42,43,44,45。由于根是最具活力的植物器官,因此评估根表型变化的单一方法可能不是决定性的,尤其是在甘蔗等作物中。根据研究目标应用和整合适当的方法排列应该会增强对甘蔗地下系统的理解。
披露声明
所有作者均声明不存在利益冲突。
致谢
作者感谢哥印拜陀 ICAR-甘蔗育种研究所所长为建立甘蔗根系表型设施提供的基础设施和支持。印度政府科学技术部科学与工程研究委员会以 KV 早期职业研究奖 (ECR/2017/000738) 的形式提供的资金得到正式认可。作者感谢 Brindha、Karpagam、Rajesh、Sivaraj 和 Amburose 在以细致的方式生成数据方面的帮助。
材料
| Name | Company | Catalog Number | Comments |
| Aeration pump with pipeline accessories | Purchased from local sources | NA | Used for hydroponic culture of sugarcane |
| Boric acid | Sisco Research Laboratories, India | 80266 | Preparation of modified Hoagland's solution |
| Calcium nitrate | Central Drug House, India | 27606 | Preparation of modified Hoagland's solution |
| Composted coir pith | Purchased from local sources | NA | Used for germinating sugarcane setts |
| Cupric sulphate | Sisco Research Laboratories, India | 38869 | Preparation of modified Hoagland's solution |
| DEAE-cellulose | Sisco Research Laboratories, India | 10529 | anion exchange resin for processing of root exudates |
| EDTA-ferric monosodium salt | Sisco Research Laboratories, India | 59389 | Preparation of modified Hoagland's solution |
| Farm yard manure | Purchased from local sources | NA | Used for germinating sugarcane setts |
| Glass tanks | Fabricated in-house | NA | Used for hydroponic culture of sugarcane |
| HPLC | Agilent Technologies | 1200 Infinity | Quantification of organic acids in root exudates |
| Magnesium sulphate | Sisco Research Laboratories, India | 29117 | Preparation of modified Hoagland's solution |
| Manganese chloride | Sisco Research Laboratories, India | 75113 | Preparation of modified Hoagland's solution |
| Molybdic acid | Sisco Research Laboratories, India | 49664 | Preparation of modified Hoagland's solution |
| Potassium dihydrogen phosphate | Central Drug House, India | 29608 | Preparation of modified Hoagland's solution |
| Potassium nitrate | Central Drug House, India | 29638 | Preparation of modified Hoagland's solution |
| Protrays | Fabricated in-house | NA | Used for germinating sugarcane setts |
| Red soil | Purchased from local sources | NA | Used for germinating sugarcane setts |
| Root core sampler | Fabricated in-house | NA | Used for in situ root sampling |
| Sand | Purchased from local sources | NA | Used for germinating sugarcane setts |
| Seralite-120 | Sisco Research Laboratories, India | 14891 | cation exchange resin for processing of root exudates |
| Supporting frame | Purchased from local sources | NA | Used for hydroponic culture of sugarcane |
| Water motor pump | Purchased from local sources | NA | Used for hydroponic culture of sugarcane |
| Whatman filter paper grade 1 | Universal Scientific | 1001090 | Processing of root exudates |
| WinRhizo PRO (software) | Regent Instruments Inc., Canada | STD4800 | Two-dimensional root scanner with software for analysis of roots |
| Zinc sulphate | Sisco Research Laboratories, India | 76455 | Preparation of modified Hoagland's solution |
参考文献
- Food and Agriculture Organization of the United Nations (FAO). Crops and livestock products. FAOSTAT. , Available from: http://www.fao.org/faostat/en/#data/QC (2019).
- Venkatraman, T. S., Thomas, R. Studies of sugarcane roots at different stages of growth. Agricultural Journal of India. 23, 166-176 (1928).
- Smith, D. M., Inman-Bamber, N. G., Thorburn, P. J. Growth and function of the sugarcane root system. Field Crops Research. 92 (2-3), 169-183 (2005).
- Glover, J. The behaviour of the root-system of sugarcane at and after harvest. Proceedings of the South African Sugar Technologists Association. 42, 133-135 (1968).
- Venkatraman, T. S., Thomas, R. Sugarcane root systems: Studies in development and anatomy. Agricultural Journal of India. 17 (4), 416-418 (1922).
- Saliendra, N. Z., Meinzer, F. C. Genotypic, developmental and drought-induced differences in root hydraulic conductance of contrasting sugarcane cultivars. Journal of Experimental Botany. 43 (9), 1209-1217 (1992).
- Gilbert, R. A., Rainbolt, C. R., Morris, D. R., Bennet, A. C. Morphological responses of sugarcane to long-term flooding. Agronomy Journal. 99 (6), 1622-1628 (2007).
- Shiotsu, F., Abe, J., Doi, T., Gau, M., Morita, S. Root morphology and anatomy of field-grown Erianthus arundinaceus. American Journal of Plant Sciences. 6 (1), 103-112 (2015).
- Hari, K., Vasantha, S., Anna Durai, A., Brindha, C., Shruthi, P. Sugarcane root growth and development in hydroponics system. Journal of Sugarcane Research. 7 (2), 71-82 (2017).
- Matsuoka, S., Garcia, A. A. F. Sugarcane underground organs: Going deep for sustainable production. Tropical Plant Biology. 4, 22-30 (2011).
- Koevoets, I. T., Venema, J. H., Elzenga, J. T. M., Testerink, C. Roots withstanding their environment: Exploiting root system architecture responses to abiotic stress to improve crop tolerance. Frontiers in Plant Science. 7, 1335(2016).
- Vengavasi, K., Pandey, R. Root exudation index: Screening organic acid exudation and phosphorus acquisition efficiency in soybean genotypes. Crop and Pasture Science. 67 (10), 1096-1109 (2017).
- Bray, H. G., Thorpe, W. V. Analysis of phenolic compounds of interest in metabolism. Methods of Biochemical Analysis. 1, 27-52 (1954).
- Lowry, O. H., Rosebrough, N. J., Farr, A. L., Randall, R. J. Protein measurement with the folin phenol reagent. The Journal of Biological Chemistry. 193 (1), 265-275 (1951).
- Hedge, J. E., Hofreiter, B. T. Determination of total carbohydrate by anthrone method. Carbohydrate Chemistry: Volume 17. , Academic Press. New York. (1962).
- Moore, S., Stein, W. H. Polyphenol oxidase. Methods in Enzymology. Vol 468. , Academic Press. New York. (1948).
- Malik, C. P., Singh, M. B. Plant Enzymology and Histo-enzymology: A text manual. , Kalyani Publications. New Delhi. (1980).
- Beauchamp, C., Fridovich, I. Superoxide dismutase: Improved assays and an assay applicable to acrylamide gels. Analytical Biochemistry. 44, 276-287 (1971).
- Singleton, V. L., Rossi, J. A. Colorimetry of total phenolics with phosphomolybdic- phosphotungstic acid reagents. American Journal of Enology and Viticulture. 16, 144-158 (1965).
- Rege, R. D., Wagle, P. V. Problems of sugarcane physiology in the Deccan canal tract. III. The root-system. The Indian Journal of Agricultural Science. 2 (3), 356-373 (1940).
- Ryker, T. C., Edgerton, C. W. Studies on sugar cane roots. LSU Agricultural Experiment Station Reports. 223, (1931).
- Jensen, J. H. Some studies of root habits of sugar cane in Cuba. The Tropical Plant Research Foundation. , New York. (1931).
- Kücke, M., Schmid, H., Spiess, A. A comparison of four methods for measuring roots of field crops in three contrasting soils. Plant and Soil. 172 (1), 63-71 (1995).
- Noordwijk, M., et al. Trench Profile Techniques and Core Break Methods. Root Methods: A handbook. , Springer. Berlin, Heidelberg. (2001).
- De Azevedo, M. C. B., Chopart, J. L., Medina, C. C. Sugarcane root length density and distribution from root intersection counting on a trench-profile. Scientia Agricola. 68 (1), 94-101 (2011).
- Nissen, T., Rodriguez, V., Wander, M. Sampling soybean roots: A comparison of excavation and coring methods. Communications in Soil Science and Plant Analysis. 39 (11-12), 1875-1883 (2008).
- Burridge, J. D., et al. An analysis of soil coring strategies to estimate root depth in maize (Zea mays) and common bean (Phaseolus vulgaris). Plant Phenomics. 2020, 3252703(2020).
- Schroth, G., Kolbe, D. A method of processing soil core samples for root studies by subsampling. Biology and Fertility of Soils. 18, 60-62 (1994).
- Chandran, K., Nisha, M., Arun Kumar, R., Krishnapriya, V. Breeding varieties resistant to waterlogging. ICAR-SBI Annual Report 2016-17. , 128(2016).
- Wu, Q., Wu, J., Zheng, B., Guo, Y. Optimizing soil-coring strategies to quantify root-length-density distribution in field-grown maize: Virtual coring trials using 3-D root architecture models. Annals of Botany. 121 (5), 809-819 (2018).
- Joshi, D. C., et al. Development of a phenotyping platform for high throughput screening of nodal root angle in sorghum. Plant Methods. 13, 56(2017).
- Koyama, T., Murakami, S., Karasawa, T., Ejiri, M., Shiono, K. Complete root specimen of plants grown in soil-filled root box: Sampling, measuring, and staining method. Plant Methods. 17, 97(2021).
- Gomathi, R., Gururaja Rao, P. N., Chandran, K., Selvi, A. Adaptive responses of sugarcane to waterlogging stress: An overview. Sugar Tech. 17, 325-338 (2014).
- Misra, V., et al. Morphological assessment of water stressed sugarcane: a comparison of waterlogged and drought affected crop. Saudi Journal of Biological Sciences. 27 (5), 1228-1236 (2020).
- Robinson, N., et al. Sugarcane genotypes differ in internal nitrogen use efficiency. Functional Plant Biology. 34 (12), 1122-1129 (2007).
- Arruda, B., et al. Biological and morphological traits of sugarcane roots in relation to phosphorus uptake. Journal of Soil Science and Plant Nutrition. 16 (4), 901-915 (2016).
- Sharma, S., Borah, P., Meena, M. K., Bindraban, P., Pandey, R. Evaluation of genotypic variation for growth of rice seedlings under optimized hydroponics medium. Indian Journal of Genetics and Plant Breeding. 78 (3), 292-301 (2018).
- Soumya, P. R., Singh, D., Sharma, S., Singh, A. M., Pandey, R. Evaluation of diverse wheat (Triticum aestivum) and triticale (× Triticosecale) genotypes for low phosphorus stress tolerance in soil and hydroponic conditions. Journal of Soil Science. 21, 1236-1251 (2021).
- Ganie, A. H., et al. Metabolite profiling and network analysis reveal coordinated changes in low-N tolerant and low-N sensitive maize genotypes under nitrogen deficiency and restoration conditions. Plants. 9 (11), 1459(2020).
- Venkatraman, T. S., Thomas, R. Simple contrivances for studying root development in agricultural crops. Agricultural Journal of India. 18, 509-514 (1923).
- Clark, R. T., et al. High-throughput two-dimensional root system phenotyping platform facilitates genetic analysis of root growth and development. Plant, Cell and Environment. 36 (2), 454-466 (2013).
- Chopart, J. L., Rodrigues, S. R., Azevedo, M. C. B., Medina, C. C. Estimating sugarcane root length density through root mapping and orientation modelling. Plant and Soil. 313, 101-112 (2008).
- Chopart, J. L., Azevedo, M. C. B., Le Mezo, L., Marion, D. Functional relationship between sugarcane root biomass and length for cropping system applications. Sugar Tech. 12 (3-4), 317-321 (2010).
- De Silva, A. L. C., De Costa, W. A. J. M., Bandara, D. M. U. S. Growth of root system and the patterns of soil moisture utilization in sugarcane under rain-fed and irrigated conditions in Sri Lanka. Sugar Tech. 13 (3), 198-205 (2011).
- Otto, R., Silva, A. P., Franco, H. C. J., Oliveira, E. C. A., Trivelin, P. C. O. High soil penetration resistance reduces sugarcane root system development. Soil and Tillage Research. 117, 201-210 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。