Method Article
Многосторонние подходы к фенотипированию для характеристики корневых систем сахарного тростника
В этой статье
Резюме
Характеристика особенностей корневой системы является одной из областей исследований, которая все еще находится в зачаточном состоянии, особенно в области сахарного тростника. Интеграция нескольких подходов к точному фенотипированию корней сахарного тростника приводит к всесторонним и целостным результатам, позволяющим использовать идентифицированные признаки и механизмы для традиционной и молекулярной селекции.
Аннотация
Корни являются основными проводниками воды и питательных веществ и играют жизненно важную роль в поддержании роста и урожайности в стрессовых условиях. Изучение корней растений создает методологические трудности при оценке in situ и отборе проб, что особенно верно для сахарного тростника (Saccharum spp.). Традиционные методы в 1920-х годах документировали генотипическую изменчивость корневых систем сахарного тростника, после чего до недавнего времени сообщалось о небольшом количестве исследований признаков корней сахарного тростника как таковых . В дополнение к морфологии, характеристики ризосферы, включая аллелопатические эффекты и/или сродство к микробному симбиозу, определяют укоренение и выживание растений.
В конечном счете, корневые системы определяют надземную продуктивность сахарного тростника. С появлением устойчивых к изменению климата сортов становится все более актуальным изучение и использование изменчивости свойств корневой системы сахарного тростника. В этой статье описываются многосторонние подходы к фенотипированию корней сахарного тростника, включая выемку грунта на местах путем отбора проб из траншей, использование пробоотборника корневых ядер, поднятые платформы для отбора проб корней и выращивание растений в условиях гидропонной культуры, используемые группой ученых из Индийского совета сельскохозяйственных исследований - Института селекции сахарного тростника (ICAR-SBI).
Выемка грунта в полевых условиях с отбором проб из траншеи крайне важна для оценки корней растений в их естественной среде произрастания. Использование приподнятых платформ, имитирующих полевые условия, и пробоотборника корневого керна являются альтернативными подходами, обеспечивающими значительное сокращение времени, равномерный размер выборки и меньшие потери корневого материала. Гидропонная культура растений позволяет изучать морфологию, анатомические особенности и биологию ризосферы, включая экссудацию органических соединений и микробные взаимодействия. Данные, полученные в результате различных экспериментов с использованием различных методов отбора проб, дополняют богатство информации о характеристиках корневой системы сахарного тростника.
Введение
Сахарный тростник (Saccharum spp.), важный источник продовольствия и биоэнергии, является важной промышленной культурой, пригодной для выращивания во многих странах с тропическими и субтропическими климатическими условиями. Благодаря фотосинтетическому путиС4 для ассимиляции углерода, сахарный тростник является высокопродуктивным, эффективно используя сельскохозяйственные ресурсы, такие как вода и удобрения. Послеуборочная переработка сахарного тростника дает экономически ценные продукты, такие как сахар и джаггери, наряду с его побочными продуктами - патокой, этанолом и энергоносителями. Сахарный тростник производится почти в 100 странах на площади 25,97 МГА, что составляет примерно 1,5% от общей площади пахотных земель. Только на долю Индии приходится 16% мирового производства сахарного тростника (около 306 млн тонн) со средней производительностью 70 т·га-11 . К основным абиотическим стрессам, резко влияющим на производство сахарного тростника, относятся дефицит воды, заболачивание, экстремальные температуры и свойства почвы, такие как дефицит питательных веществ, соленость, засоленность и щелочность. Самая большая проблема для создания абиотических стрессоустойчивых культур заключается в том, чтобы точно определить конкретные черты, которые дают существенное преимущество в урожайности в условиях стресса.
Некоторые аспекты физиологии сахарного тростника плохо изучены, в том числе взаимосвязь корней и побегов, которая резко влияет на продуктивность тростника. Корень сахарного тростника не так хорошо изучен, как побеги, хотя различные типы, такие как сажистые корни, побеговые корни и взрослые корни, могут отличаться в развитии и выполнять различные функции. Наблюдались генотипические различия в отношении количества и длины корней, появляющихся во время прорастания2. Корни посаженцев участвуют в прорастании почек сахарного тростника, обеспечивая раннее укоренение урожая, а затем заменяются корнями побегов, которые являются крепкими, выходящими из основания развивающегося побега3. Тонкие ветви, наблюдаемые в корнях, помогают закрепить молодые растения и способствуют усвоению воды и питательных веществ, пока они не будут заменены корнями побегов. Подобно сажевым корням, побеговые корни также возникают из корневых зачатков, присутствующих в нижних, неразросшихся междоузлиях побега.
Поскольку корни побегов сохраняются в растении в течение более длительного времени, они в 4-10 раз толще, чем корни побега. Побеговые корни представляют собой единственную корневую систему сахарного тростника, играющую важную роль в дальнейшем росте и развитии. Сила корней побега положительно связана с общей вегетативной силой растения. Непрерывное развитие корней в результате смены корней посаженных и побеговых корней приводит к образованию «взрослой корневой системы» сахарного тростника, которая постоянно адаптируется к преобладающим условиям окружающей среды. В целом, более глубокая и плодовитая корневая система обеспечивает больше воды и питательных веществ, доступных для культуры, чем более мелкое распределение корней. Периодические вскрытия показали, что при высоком содержании влаги в почве наблюдалась неглубокая корневая система, в то время как гораздо более глубокая корневая система развиваласьпри снижении уровня грунтовых вод2. Корневая система сахарного тростника остается активной даже после сбора урожая, способствуя росту урожая до тех пор, пока из подземных почек не появятся новые побеговые корни4. Угол наклона корней и уровень разветвления корней являются двумя важными факторами, определяющими объем почвы, исследуемой корнями растений. Корневой угол, генотипический признак, может быть изменен с помощью традиционной селекции или молекулярных подходов для улучшения толерантности к биотическим и абиотическим стрессам. Напротив, уровень ветвления корней в основном зависит от окружающей среды, что обуславливает необходимость периодического мониторинга развития корней и ее реакции на локализованные почвенные условия.
Анатомические особенности корней сахарного тростника были изучены с целью установления различий в отношении генотипа и окружающей среды. Анатомия корней сажистых растений сахарного тростника напоминает анатомию зрелых корней других трав, таких как кукуруза, где кора головного мозга состоит из хорошо дифференцированных клеточных слоев в регулярном порядке. Энтодерма оберизирована, за ней следует однослойный перицикл. Элементы метаксилемы являются основными проводниками воды и ионов питательных веществ, расположенными радиально и перемежающимися с группами флоэм, последние из которых представляют собой ситовой элемент с двумя сопутствующими ячейками. Большая центральная масса недифференцированных клеток образует корневую сердцевину. Ярко выраженные анатомические особенности сортов сахарного тростника соответствуют гидравлическим свойствам корня, тем самым влияя на движение воды. Ранние исследования различий в анатомических особенностях корней сахарного тростника показали, что в условиях низкого влагодефицита выраженное утолщение клеточной стенки наблюдалось в слоях непосредственно внутри эндодермы, между сердцевиной и сосудистой областью, а такжевокруг сосудов. Такие утолщенные клетки могут быть приспособлением для предотвращения обратного потока сока и для механической прочности во время напряжения.
Некоторые важные черты, связанные с засухоустойчивостью сахарного тростника, включают относительную толщину и количество экзодермальных слоев, соотношение коры и стелы, межклеточные пространства в коре и утолщенные кончики корневых волос. Отношение площади, занимаемой корковыми клетками, к площади, занимаемой звездными тканями корней побегов, значительно различается среди сортов сахарного тростника, с широкой вариабельностью относительно площади стелы6. Гидравлическая проводимость корней сахарного тростника связана с размером и количеством элементов метаксилемы в корнях побега. Гидрофобные клеточные слои внутри корня, вероятно, определяют зоны апопластического движения воды. Суберизованные полосы Каспара находятся в энтодерме и в гиподерме (называемой экзодермой), которые служат гидрофобными барьерами. Распад клеток коры головного мозга приводит к образованию лизигенной аэренхимы в старых корнях и у растений, подвергающихся гипоксическим условиям, независимо от возраста развития. Образование аэренхимы при стрессе от переувлажнения коррелирует с поддержанием роста у устойчивых сортов7.
Морфология и анатомия корней Erianthus arundinaceus [Retzius] Jeswiet (роды, родственные Saccharum spp.) связаны с его сильной устойчивостью квоздействиям окружающей среды. Корни Erianthus arundinaceus имеют узловые корни, расположенные под крутыми углами, с густыми корневыми волосками, облегчающими поглощение воды и ионов питательных веществ из более глубоких зон почвы. Система глубоких корней состоит из множества узловых корней, растущих с крутыми углами роста. Диаметр узловых корней коррелирует с размером и количеством крупных сосудов ксилемы, которые варьируются в широких пределах от 0,5 мм до 5,0 мм. Эти узловые корни также образуют ризоматозную оболочку с гиподермой, показывающей одревесневшую склеренхиму во внешней коре (экзодерме), лизигенную аэренхиму в средней части коры и гранулы крахмала в стеле. В дополнение к архитектуре и морфологическим признакам, выделяемые корнями органические соединения играют важную роль в определении прорастания, укоренения и выживания растений, с вероятными аллелопатическими эффектами и/или сродством к микробному симбиозу.
Ферментативная активность корней и более мелкие детали морфологии, включая пигментацию корневой шляпки и потенциал омоложения при повреждении, были задокументированы у сортов сахарного тростника, выращенных в условиях гидропонной культуры9. Рост корней проявляет высокопластичную реакцию на изменения почвенной среды, как с точки зрения формы, так и размера корневой системы. Наиболее эффективным сортом сахарного тростника будет тот, который имеет небольшое или оптимальное количество побегов, с соответственно меньшим количеством корней, что способствует лучшей выживаемости в стрессовых условиях. Таким образом, систематическое изучение корневой системы должно составлять важную составляющую любой программы улучшения сельскохозяйственных культур10. Большинство экспериментов, сосредоточенных на корнях, в основном опираются на аспекты развития, в то время как акцент на функциональной пластичности часто отсутствует. Помимо структурного распределения, функциональная пластичность корней играет решающую роль в выживании в условиях стресса и, следовательно, поддерживает селекционеров в их усилиях по включению признаков корневой системы в процесс отбора для абиотической стрессоустойчивости и повышению устойчивости сахарного тростника.
Учитывая его важность для поддержания роста и урожайности в стрессовых условиях, важно изучить и использовать присущую сахарному тростнику изменчивость свойств корневой системы. Акцент на выборе составляющих признаков и механизмов, придающих превосходную корневую систему, является шагом вперед для повышения производительности урожая в изменяющихся климатических условиях. Фенотипическая оценка является длительным и дорогостоящим процессом; Тем не менее, интеграция многоуровневых подходов повысила бы его полезность для улучшения сельскохозяйственных культур. В этой рукописи описаны четыре различных подхода к фенотипированию корней сахарного тростника, каждый из которых имеет свой набор достоинств и недостатков, подразумевая, что для получения всеобъемлющих и целостных результатов требуются согласованные усилия.
протокол
1. Выемка грунта в полевых условиях методом отбора проб из траншеи
- Выращивайте коммерческие гибриды сахарного тростника (далее именуемые «сортами») в полевых условиях из саж с двумя почками, посаженных с расстоянием между рядами 120 см, с расстоянием между рядами 90 см, в соответствии с рекомендуемым пакетом методов (СОЗ) для обеспечения хорошей укорененности и роста урожая.
- В конце фазы зрелости урожая используйте экскаватор для рытья траншеи (глубиной 1,5 м и шириной 1,0 м) в поле. С помощью непрерывной струи воды убедитесь, что почва в корневой зоне очищена без повреждения корней (Рисунок 1).
- Когда налипшая почва разрыхлится, вырвите с корнем тростник вместе с корневой системой и отнесите его в лабораторию для ручного измерения количества корней, длины корня, объема и веса.

Рисунок 1: Метод отбора проб из траншеи для выемки корней в полевых условиях. (А) боковая траншея, вырытая вдоль поля, (Б) струя воды и (В) внутренний вид, показывающий глубину траншеи. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
2. Пробоотборник корневого керна для уменьшения ошибок отбора проб
- Для отбора проб корней сахарного тростника в полевых условиях используйте цилиндрический пробоотборник корневых пород высотой 61 см и диаметром 16 см весом 8 кг, изготовленный из материала низкоуглеродистой стали (MS). Острый край на нижнем краю пробоотборника для облегчения проникновения при его вдавливании в почву. Снабдите верхнюю часть кольцами диаметром 3 см для подъема пробоотборника (Рисунок 2).
- Выращивайте сорта сахарного тростника в поле из саж с двумя почками, посаженных на расстоянии 120 см между рядами, с 90 см в рядах, следуя рекомендованному СОЗ для обеспечения хорошей укорененности и роста урожая.
- На этапе созревания урожая закрепите верхний край пробоотборника на основном побеге/тростнике и непрерывно забивайте молотком, чтобы достичь желаемой глубины почвы (45 см). Поднимите всю почвенную массу в пробоотборник и тщательно промойте под проточной водой, чтобы отделить прилипшие корни.
- После тщательной промывки корней запишите объем, площадь поверхности, длину и вес путем ручного измерения, а также разложив корни на прозрачных лотках, чтобы отсканировать и проанализировать соответствующие оцифрованные изображения с помощью соответствующего программного обеспечения (см. Таблицу материалов).

Рисунок 2: Пробоотборник корневого керна. (A) Размеры, (B) вид сверху и (C) место отбора проб. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
3. Структура фенотипирования корней для облегчения отбора проб при различных фенофазах
- Построить конструкцию для фенотипирования корней, состоящую из трех смежных отсеков размером 4,5 м х 10,1 м для отбора проб корней сахарного тростника, с возможностью ручного демонтажа боковых стенок для выявления подземной корневой системы (на глубину 80-100 см) (рис. 3). Возведите боковые стены из сборных железобетонных плит размером 1,8 м в длину, 30 см в ширину и 4 см в толщину.
- Заполните и уплотните конструкцию полевой почвой, оставив свободное пространство ~20 см, с достаточным дренажным отверстием для облегчения аэрации почвы.
- Посейте чипсы из почек клонов зародышевой плазмы, включающих Saccharum officinarum L., Saccharum spontaneum L., Saccharum barberi Jesw., Saccharum sinense Roxb. и Saccharum robustum Brandes и Jeswiet ex Grassl. (далее именуемые "Saccharum spp. clones") и дайте им прорасти в течение 30 дней в поддонах, содержащих укореняющие среды (красная почва: навоз на сельскохозяйственном дворе: песок = 2:2:1). Пересадка равномерно и здорово приживается к структуре с расстоянием между рядами 90 см, с 60 см в рядах, в соответствии с рекомендуемым СОЗ для обеспечения хорошей укорененности и роста урожая.
- Во время формирующей (60-120 дней после посадки [DAP]) и фазы большого роста (120-150 DAP) вручную снимите боковые стенки из сборных плит, после чего непрерывно распыляйте струю воды, чтобы обнажить корни.
- Выкорчевайте всю корневую систему и отнесите ее в лабораторию для ручного измерения длины, объема и веса, а затем разложите корни на прозрачных лотках для сканирования и анализа соответствующих оцифрованных изображений в указанном программном обеспечении (см. Таблицу материалов).
- Наложите стресс от засухи, прекратив полив в одном из отсеков, и заткните дренажные отверстия во втором отсеке, чтобы сохранить насыщенность почвы и смоделировать стресс от заболачивания. Орошайте третий отсек в соответствии с рекомендованными СОЗ для поддержания производительности поля и выполнения функций контроля.

Рисунок 3: Структура фенотипирования корней. (А) Размеры, (Б) обзор трех отсеков и (В) вид одного отсека. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
4. Гидропонная культура растений для изучения биологии ризосферы
- Изготовьте собственную гидропонную систему в теплице с контролируемой средой, способствующей выращиванию сахарного тростника, чтобы изучить мельчайшие детали биологии корней. Добавьте ~15 л модифицированного питательного раствора Hoagland (Таблица 1) в стеклянные резервуары размером 20 см x 20 см x 50 см, с аэрацией, обеспечиваемой аквариумными насосами (Рисунок 4).
- Посейте чипсы сортов сахарного тростника и клоны Saccharum spp. и дайте им прорасти в течение 30 дней в пролотках, содержащих компостированную сердцевину кокосового волокна. Пересаживайте равномерные и здоровые осадки в гидропонные резервуары с частотой три оседания на аквариум, следя за тем, чтобы весь корень был помещен в питательный раствор. Накройте емкости черной тканью, чтобы корни не подвергались воздействию света. Используйте пластиковую сетку (20 см х 20 см) по краям стеклянных емкостей, чтобы поддерживать растения в вертикальном положении.
- В конце фазы прорастания (60 дней) соберите корневые выделения, погрузив корни неповрежденных растений в 50 мл раствора ловушки (стерильная вода двойной дистилляции) на 4 ч (от 0800 ч до 1200 ч) во время пика фотосинтетической активности. Собранный раствор процедить через фильтровальную бумагу ватмана, затем пропустить его через стеклянные колонны, заполненные анионообменными смолами, за которыми следуют катионитобменные смолы12. Выпарить элюированные фракции до сухости и хранить при температуре -20 °C до дальнейшей обработки.
- Анализ обработанных образцов корневого экссудата с помощью ВЭЖХ для определения органических кислот12 и с помощью спектрофотометрии для оценки общего фенола13, белков14, сахаров15 и аминокислот16 в соответствии со стандартным протоколом.
- Следите за ростом корней с интервалом в неделю, чтобы зафиксировать пигментацию кончика корня и густоту корневых волос. Оценивают активность ферментов пероксидазы17 и супероксиддисмутазы18, а также общее содержание фенолов19 на 3-м месяце по стандартному протоколу.
- Оцените реакцию на травму корня путем нанесения продольного среза в первичном корне до кончика корня с помощью стерильного хирургического лезвия и периодически контролируйте изменения.
| Химический | Конечная концентрация |
| Нитрат калия | 0,608 г· Л-1 |
| Кальциевая селитра | 1,415 г· Л-1 |
| Дигидрофосфат калия | 0,164 г· Л-1 |
| Сульфат магния | 0,560 г· Л-1 |
| ЭДТА-мононатриевая соль железа | 6,00 г·250л-1 |
| Борная кислота | 1,43 г·250л-1 |
| Тетрагидрат хлорида марганца | 0,91 г·250л-1 |
| Сульфат цинка | 0,11 г·250л-1 |
| Медный суфат | 0,04 г·250л-1 |
| Молибдиновая кислота | 0,01 г250л-1 |
Таблица 1: Состав модифицированного питательного раствора для гидропонной культуры сахарного тростника.

Рисунок 4: Настройка гидропоники. Установка (A) адаптирована для выращивания сахарного тростника и (B) 5-месячного урожая (черная ткань снята только в целях фотосъемки). Эта цифра была изменена по сравнению с Hari et al.9. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Результаты
Вариация морфологических признаков корней сортов сахарного тростника
Репрезентативные изображения корневой системы в Co 62175, извлеченной из поля путем отбора проб из траншеи и выращенной в гидропонной установке, представлены на рисунках 5A, B. Длинные корни (~100 см) наблюдались у сортов Co 62175 и Co 99006, в то время как у Co 99006 была зафиксирована наибольшая масса корней (127 г·комок-1). Признаки корней были зарегистрированы с помощью пробоотборника корневого ядра, который показал, что Co 62175 имеет более высокую корневую систему по сравнению с Co 99006 в отношении совокупной длины корня, площади поверхности корня и объема корня (Рисунок 5C-E). Тем не менее, средний диаметр корня у Co 99006 был выше, чем у Co 62175 (Рисунок 5F).
Вариация морфологических признаков корней клонов Saccharum spp.
Морфологические признаки в фазе формирования показали значительную вариабельность среди клонов Saccharum spp., при этом наибольшая кумулятивная длина корня составила 39615,72 см на скопление, наблюдавшаяся у S. spontaneum (IND 85-490), в то время как самая низкая была отмечена у S. sinense (Oshima) (рис. 6A). Самая высокая площадь поверхности корня на пучок (4700,31см2) была отмечена у S. spontaneum (IND 85-490), за ней следует S. officinarum (Awela Green Sport), а самая низкая - у S. sinense (Oshima) (Рисунок 6B). Аналогичная тенденция наблюдалась в случае объема корня и среднего диаметра корня (рис. 6C, D). Морфология корней, отобранных на фазе большого роста, была измерена вручную и показала, что самые длинные корни (131 см) присутствовали у S. robustum (NG 77-237) (рис. 6E), в то время как сухая масса корня была самой высокой у S. spontaneum (IND 85-490: 57,4 г·г-1) и самой низкой у S. sinense (Oshima: 11,2 г·г-1) (рис. 6F). Объем корня и отношение корня к побегу следовали той же тенденции, что и сухая масса корня (рис. 6G, H).
Вариация анатомических признаков корней клонов Saccharum spp.
Площадь поперечного сечения корней на расстоянии 10 мм от верхушки значительно варьировала среди клонов Saccharum spp., при этом S. spontaneum (IND 85-490) показал наибольшую площадь (27646,8мм2), в то время как S. sinense (Oshima) зафиксировал наименьшую (7539,1мм2) (Таблица 2). У S. sinense (Oshima) основную площадь занимали корковые клетки, тогда как у S. spontaneum (IND 85-490) выделялась ткань стелы, что отражено в данных о соотношении коры и стелы. Количество элементов метаксилемы варьировалось от 6 (S. officinarum: Awela Green Sport) до 13 (S. spontaneum: IND 85-490), в то время как количество воздушных пространств (lysigenoous aerenchyma) варьировалось от 12 (S. barberi: Putli Khajee) до 32 (S. spontaneum: IND 85-490). Площадь, занимаемая элементами метаксилемы, была самой высокой (791,3мм2) у S. barberi (Putli Khajee) и наименьшей (254,3мм2) у S. sinense (Oshima). Наибольшая площадь аэренхимы (4921,3мм2) была занята у S. spontaneum (IND 85-490), в то время как корни S. sinense (Oshima) и S. robustum (NG 77-237) были лишены аэренхиматозных клеток при нормальном орошении. Saccharum sinense (Oshima), S. spontaneum (IND 85-490) и S. barberi (Putli Khajee) продемонстрировали превосходные анатомические фены корней в условиях засухи и заболачивания (рис. 7A-C). Длинные корневые волоски, склеренхиматозная экзодерма, уменьшенные кортикальные клеточные слои, увеличенная корковая эренхима, увеличенная площадь стелы и количество сосудов ксилемы с большим диаметром были благоприятными при засухе, в то время как увеличенный диаметр корня и большая площадь корковых клеток с увеличенными эренхиматозными клетками повысили механическую прочность, пористость корней и диффузию кислорода при воздействии на увлажнение.
Изменение типа и количества корневых выделений клонов Saccharum spp.
Среди органических соединений, выделяемых клонами Saccharum spp. во время фазы прорастания, доля общего белка была самой высокой, за ней следовали карбоксилаты, сахара, фенолы и свободные аминокислоты. Saccharum robustum (NG 77-221) показал самую высокую (5,11 мг·г-1·сырая масса корня [RFW]·ч−1) общую экссудацию карбоксилатов, в то время как самая низкая (0,65 мг·г-1· RFW·h−1) был зарегистрирован у S. spontaneum (IND 85-490) со значительными вариациями в типе и количестве выделяемой отдельной карбоновой кислоты (рис. 8A). Saccharum officinarum (Awela Green Sport) выделял самый высокий общий уровень фенола (0,034 мг·г-1· RFW·h−1), в то время как самый низкий (0,002 мг·г−1· RFW·h−1) наблюдались в случае S. spontaneum (IND 85-490) (рис. 8B). Наибольшая общая экссудация белка (3,23 мг·г−1· RFW·h−1) наблюдался у S. officinarum (Awela Green Sport), при этом самый высокий общий сахар (0,22 мг·г-1· RFW·h−1) и общее количество свободных аминокислот (0,04 мг·г−1· RFW·h−1) были зарегистрированы у S. sinense (Oshima) (рис. 8C-E). Самая низкая общая экссудация белка (2,08 мг·г−1· RFW·h-1) наблюдался у S. spontaneum (IND 85-490), в то время как S. robustum (NG 77-221) выделял наименьшее количество общего сахара (0,05·мг·г−1· RFW·h−1) и общее количество свободных аминокислот (0,01 мг·г−1· RFW·h−1).
Изменение пигментации кончика корня, ферментативной активности и общего содержания фенольных соединений у сортов сахарного тростника
Форма корневой шляпки варьировалась от простого треугольника (Co 62175) до купола (Co 86032), в то время как пигментация корневой шляпки варьировалась от светло-розовой (Co 62175) до темно-фиолетовой (Co 86032), со значительными различиями в густоте корневых волосков (Рисунок 9A-C). Активность пероксидазы была самой высокой (40 единиц ·г−1·ч−1) у Co 86032 и самой низкой (26 единиц ·г−1·ч−1) у Co 62175, в то время как тенденция была обратной в случае активности супероксиддисмутазы в корнях (рис. 9D, E). Аналогичным образом, общее содержание фенолов было самым высоким (18 г·г−1) в Co 86032 и самым низким (15 μг·г−1) в Co 62175 (рисунок 9F).
Вариация фаз развития омоложения при повреждении корней сортов сахарного тростника
Омоложение при повреждении корней было испытано на сортах сахарного тростника CoC 671 и Co 06022, выращенных в гидропонной установке (рис. 10A-I). У CoC 671 вторичные корни появлялись на третий день после повреждения, тогда как у Co06022 инициация вторичного корня происходила только на десятый день. Кроме того, первичный корень Co 06022 показал симптомы старения на третий день, в то время как корни CoC 671 оставались относительно здоровыми. Третичные корни также наблюдались на десятые сутки в CoC 671.

Рисунок 5: Корневые системы Co 62175 и различные морфологические признаки. Корневая система (A) Co 62175 была выкопана путем отбора проб из траншеи, (B) Co 62175 выращена в гидропонной установке, а морфологические признаки (C) совокупная длина корня, (D) площадь поверхности корня, (E) объем корня и (F) средний диаметр корня, зарегистрированный с помощью пробоотборника корневого керна. Данные представляют собой среднее значение ± SEM (n = 3). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 6: Морфологические признаки корней. (A) Кумулятивная длина корня, (B) площадь поверхности корня, (C) объем корня и (D) средний диаметр корня в фазе формирования, а также (E) длина самого длинного корня, (F) сухая масса корня, (G) объем корня и (H) соотношение корней и побегов в фазе большого роста клонов Saccharum spp., зарегистрированных по структуре фенотипирования (S. officinarum: Awela Green Sport, S. spontaneum: IND 85-490, S. sinense: Oshima, S. barberi: Putli Khajee, S. robustum: NG 77-237). Данные представляют собой среднее значение ± SEM (n = 3). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 7: Анатомические особенности корешка клона S. sinense Oshima. (А) Нормальные условия произрастания и в ответ на (В) засуху и (В) стресс от заболачивания. Масштабные линейки = 100 μм. Сокращения: rh = корневые волоски; ae = лизигенная аэренхима; mx = метаксилема; ex = экзодерма; EP = эпидермис. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 8: Экссудация корня. (А) карбоксилаты, (В) общий фенол, (В) общий белок, (Г) общий сахар и (Е) общее количество свободных аминокислот в фазе прорастания в клонах Saccharum spp. (S. officinarum: Awela Green Sport, S. spontaneum: IND 85-490, S. sinense: Oshima, S. barberi: Putli Khajee, S. robustum: NG 77-221). Данные представляют собой среднее значение ± SEM (n = 3). Сокращение: RFW = свежий вес корня. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
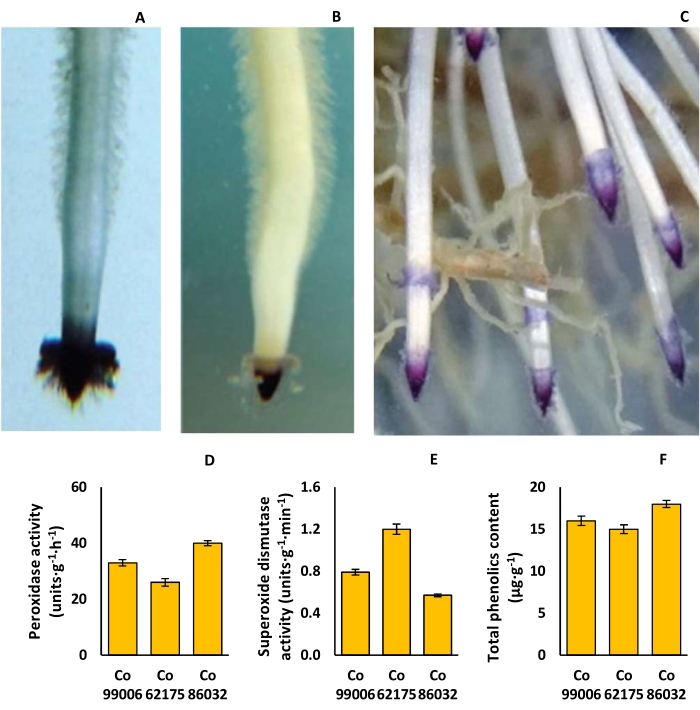
Рисунок 9: Признаки ризосферы у сортов сахарного тростника. (A) треугольная корневая шляпка у Co 62175, (B) куполообразная корневая шляпка у Co 86032, (C) глубокая пигментация кончика фиолетового корня у Co 86032, (D) активность пероксидазы, (E) активность супероксиддисмутазы и (F) общее содержание фенолов в растениях, выращенных в гидропонной установке. Данные в D, E и F представляют среднее значение ± SEM (n = 3). Эта цифра была изменена по сравнению с Hari et al.9. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 10: Фазы развития омоложения при повреждении корней у сортов сахарного тростника, выращенных в гидропонной установке. (A-E) CoC 671 и (F-I) Co 06022; (A,F) неповрежденные корни; (B,G) корни повреждены в результате продольного разреза; (C,H) через 3 дня после травмы; (D,E,I) через 10 дней после травмы. Эта цифра была изменена по сравнению с Hari et al.9. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Площадь поперечного сечения корня (мм2) | Отношение коры к стеле | Количество экзодермальных слоев | Количество элементов метаксилемы | Средний диаметр метаксилемы (мм) | Количество воздушных пространств | Площадь, занимаемая метаксилемой (мм2) | Площадь, занимаемая воздушными пространствами (мм2) | |
| S. officinarum | No 6936.3±200.2 | 0,508±0,015 | 1,00±0,03 | 6,00±0,17 | 8,5±0,3 | 14.00±0.40 | 340.3±9.8 | 1993.0±57.5 |
| S. spontaneum | No 27646.8±957.7 | 0,481±0,017 | 2,00±0,07 | 13.00±0.45 | 6,6±0,2 | 32.00±1.11 | 444.5±15.4 | 4921.3±170.5 |
| S. sinense | 7539.1±261.2 | 0,727±0,025 | 2,00±0,07 | 9,00±0,31 | 6,0±0,2 | - | 254.3±8.8 | - |
| С. barberi | 18859.6±435.6 | 0,692±0,015 | 1,00±0,02 | 7,00±0,16 | 12,0±0,3 | 12.00±0.28 | 791.3±18.3 | 4454.6±102.8 |
| S. robustum | 8328.1±288.5 | 0,563±0,019 | 2,00±0,07 | 10.00±0.35 | 7,0±0,2 | - | 384.7±13.3 | - |
Таблица 2: Анатомические особенности корней, наблюдаемые у клонов Saccharum spp. Данные представляют собой среднее значение ± SEM (n = 3) (S. officinarum: Awela Green Sport, S. spontaneum: IND 85-490, S. sinense: Oshima, S. barberi: Putli Khajee, S. robustum: NG 77-237).
Обсуждение
Корневая система определяет надземную продуктивность сахарного тростника, что требует тщательного изучения и понимания всех ее аспектов для разработки сортов, устойчивых к изменению климата. Группа ученых ICAR-SBI, состоящая из физиологов растений, микробиолога, сельскохозяйственного инженера, биохимика и селекционеров, использовала многосторонние подходы к фенотипированию корней сахарного тростника, включая выемку грунта в полевых условиях путем отбора проб из траншей, использование пробоотборника корневых ядер, поднятые платформы для отбора проб корней и выращивание растений в условиях гидропонной культуры. Учитывая, что индивидуальная методология не может быть исчерпывающей и/или исчерпывающей, требуется интеграция информации для выявления составляющих черт и механизмов идеального корневого фенотипа. Более ранние методы отбора проб корней были изолированы в своих усилиях, но оказались полезными для разработки стратегии, описанной в настоящем документе.
Венкатраман и Томас5 стали пионерами в изучении корней сахарного тростника, описав три подходящих метода для исследования. В первом методе сбоку от растения выкапывалась глубокая яма, которая позволяла отделить корни от почвы, побелить и сфотографировать в их естественном положении. При втором способе глубокие ямы выкапывались с противоположных сторон растения. Каркасы из 2 проволочной сетки были размещены по бокам ям, прилегающих к заводу, с железными стержнями, вставленными через ширину промежуточной почвы, чтобы удерживать корни в их соответствующих положениях. Затем почву промывали водой, а корни фотографировали. Третий метод заключался в создании специальных посадок для изучения корней. Проволочная сетка была размещена на определенных уровнях на выкопанном участке, и выемка была засыпана, заменив почву в соответствующих слоях, как и раньше. На участке были выращены растения, подлежащие изучению. На время осмотра почву вокруг растений промыли водой, оставив корневые системы подвешенными на месте в сетках проволочной сетки.
Реге и Вагл20 разработали метод изучения корней в условиях орошения, выкапывая яму вертикально вниз по краю тростника и обнажая корневую систему путем промывания почвы в указанной зоне. Это привело к наименьшим потерям растительного материала и позволило исследователям изучить корневую систему in situ как в качественном, так и в количественном отношении. Было проведено специальное исследование для изучения структуры, развития и поведения корней сахарного тростника21. «Метод корневой коробки» и «метод выемки почвы» оказались весьма полезными при изучении распространения корней сахарного тростника. Было обнаружено, что на тяжелых почвах было больше неглубоких корней, чем на смешанных или более легких почвах. Рыхлая текстура и аэрация, преобладающие в последнем, способствовали проникновению корней в более глубокие зоны почвы, делая ее более податливой для развития корней. при этом распределяется ~85%-90% корней. Более глубокие корни, несомненно, обеспечивали растения влагой в засушливые периоды. Скорость роста корней и побегов варьировалась в зависимости от климатических условий сельскохозяйственного года и сорта. Поддержание корней в активных физиологических условиях важно для оптимального роста растений, так как это часто нарушается методами выращивания, которых следует по возможности избегать. Изменчивость корневой системы у отдельных сортов сахарного тростника изучалась на Кубе методом «прямого обследования»22. Описания развития корней были задокументированы вместе с иллюстрациями распределения корней в почве.
Полевая выемка корней методом отбора проб из траншей была основана на работах Венкатрамана и Томаса5, Реге и Вагла20 и Райкера и Эджертона21. Несмотря на то, что это самый трудоемкий и трудоемкий метод, отбор проб в поле in situ необходим для понимания фенотипов корней в их естественной среде произрастания. Сравнение методов измерения корней у сахарной свеклы и зерновых культур показало, что данные, полученные с помощью стенки профиля траншеи, следует интерпретировать с осторожностью, при этом рассчитанные плотности длины корней (RLD) (отношение совокупной длины корня к объему почвы) были в 4-10 раз ниже, чем полученные методом корневой сердцевины, в зависимости от типа почвы23. Правильное и равномерное расстояние от траншеи до стебля важно для обеспечения минимальной погрешности отбора проб и минимизации потерь корней и ресурсов, включая рабочую силу. Мониторинг роста корней с помощью отбора проб из траншеи может быть нецелесообразным для долгосрочных экспериментов, так как он является разрушительным по своей природе, и только небольшая часть корня видна на основе плоскости наблюдения. Тем не менее, отбор проб из траншеи дает общую оценку распределения корней и взаимодействия с почвенным профилем24. Это исследование распространения корневых систем у коммерческих гибридов сахарного тростника показало, что ~70% физиологически активных корней были обнаружены в пределах 50 см от профиля почвы.
Метод отбора проб из траншей позволил дифференцировать различные классы корней в зависимости от глубины их залегания в профиле почвы. В целом, корни, проникающие глубже в почву, обычно были тоньше, чем те, которые обнаруживаются в неглубоких зонах. Наблюдалась широкая генотипическая изменчивость в отношении длины, объема и массы корня. Достижения в области моделирования и симуляции сельскохозяйственных культур помогают уточнить данные, полученные с помощью традиционных методов отбора проб, путем разработки алгоритмов для минимизации ошибок выборки и экспериментальной неоднородности. Данные RLD сахарного тростника из профиля почвы in situ сравнивали с данными по отбору керна из почвы, при этом было замечено, что подсчет пересечений корней в профиле почвы и оценка RLD с использованием модели дали значения RLD, аналогичные тем, которые были получены при использовании метода керна почвы25. Сравнение данных, полученных с помощью методов выемки почвы и отбора керна у сои, показало схожие оценки биомассы корней, а выемка потребовала меньше общего времени и больше труда26. Отбор образцов на основе керна был более точным, что позволило отбирать пробы в более глубоких корневых зонах с минимальным нарушением экспериментального участка. Учитывая преимущество изучения корней растений в их естественной среде произрастания, траншейный отбор проб может быть полезен для объединения данных профиля почвы и профиля RLD, но он не облегчает отбор проб на обширной территории27. В этом контексте пробоотборник корневого керна оказался весьма полезным для количественной оценки распределения корней и получения большего количества проб на большей площади.
Пробоотборник корневых кернов был разработан для облегчения суботбора проб корней с месторождения, что гарантирует однородность отбора проб с более низким коэффициентом дисперсии; Это значительно снижает погрешности выборки. Использование пробоотборника корневого керна было принято на нескольких культурах; Это требует большого количества времени на обработку после отбора проб, потому что необходимо уделять большое внимание тому, чтобы избежать потери корней во время промывки28. Пробоотборник керна облегчил отбор проб корней в фиксированном объеме почвы и выявил генотипическую изменчивость среди тестируемых клонов по признакам корневой системы, что позволило протестировать больше образцов за заданный период времени. RLD, который является важным параметром для оценки здоровья растений, может быть получен точно с помощью пробоотборника корневого керна. В целом, систематическая изменчивость объясняется расположением керна с точки зрения расстояния от ствола, что может привести к значительному различию корневых данных. Однако в случае с сахарным тростником пробоотборник был изготовлен на основе уникальной морфологии культуры, и основной побег/тростник крепится к нему во время отбора проб. Таким образом, для всех сортов обеспечивается равномерная сердцевина диаметром 16 см вокруг основного побега/побега, чтобы свести к минимуму ошибку отбора проб.
Наблюдалась значимая корреляция между данными корневого объема, зарегистрированными с помощью метода корневого сканера, и методом объемного смещения29. Поскольку размер выборки намного меньше, чем при использовании метода траншеи, изменчивость между генотипами может быть оценена с помощью пробоотборника корневого керна. Случайные вариации, обусловленные фенотипической пластичностью, неоднородностью почвы и другими неизвестными факторами, влияют на надежность данных, полученных от пробоотборника корневого керна, которая может быть преодолена путем повторных измерений и использования программного обеспечения для моделирования для сужения функционально значимых различий27. Виртуальная оценка вариаций между различными стратегиями отбора проб почвы у кукурузы, основанная на трехмерных моделях архитектуры корневой системы и алгоритме взвешивания площади30, показала, что такие экономически эффективные способы получения надежных оценок RLD могут стать шагом вперед для исследований корневой системы.
Структуры корневого фенотипирования с соседними компартментами служат цели моделирования поля и в то же время поддерживают гомогенность, необходимую для скрининга присущей зародышевой плазме сахарного тростника изменчивости. Легкость разрушающего отбора проб со значительно меньшим повреждением и потерями корней по сравнению с траншейным отбором проб облегчает анализ всей корневой системы на различных фенофазах. Индивидуальные корневые коробки или камеры, основанные на морфологии культуры и распределении корней, доказали свою эффективность при выращивании других культур, таких как сорго31, соя и гречиха32. Аналогичным образом, размер и глубина отсеков были оптимизированы для поддержки роста сахарного тростника. Кроме того, боковые стены были построены с использованием сборных плит, которые можно легко поднять вручную во время отбора проб корней. Образцы корней отбираются путем ручного подъема боковины с последующей струей воды для обнажения корней. Затем боковые стенки заменяются, а почва засыпается, обеспечивая минимальный ущерб соседним растениям. Вариации в признаках корней у сахарного тростника и их связь с ростом побегов могут быть задокументированы у растений, выращенных в структуре фенотипирования корней. Избыточное орошение сахарного тростника приводит к поверхностной корневой системе, в то время как недостаток воды способствует боковому распространению с небольшим глубоким проникновением33,34. При увеличении внесения азота масса корней уменьшается, в то время как фосфатные удобрения оказывают благоприятное влияние на развитие корней35,36. Смежные компартменты в структуре позволяют изучать такие реакции сахарного тростника на различные абиотические стрессы и уровни питательных веществ в почве путем манипулирования количеством поливной воды и использования обедненной питательными веществами почвы соответственно.
Гидропонная культура растений является методом выбора для оценки реакции на питательный стресс в большой и разнообразной популяции генотипов сои12, риса37, пшеницы38 и кукурузы39. Исследования симулированных корней в сахарном тростнике датируются1923-1940 гг., в которых колонна из глиняной посуды с проволочной сеткой использовалась для изучения относительной глубины и плана корней. Гидропонное культивирование с использованием глиняных кастрюль, наполненных разбавленным раствором Кнопа, также было опробовано для непрерывного мониторинга развития корней. Собственная гидропонная установка позволяет изучать мельчайшие детали развития корней и изменений в биологии ризосферы9. Размер контейнера и плотность посадки были оптимизированы для сахарного тростника, где растения выращивались до 10 месяцев с минимальным полеганием. Ризосферные характеристики, включая форму корневой шапки и пигментацию кончика корня, могут быть оценены только в условиях гидропоники, что облегчает отбор проб и исключает наличие прилипающих к почве добавок. Оценка реакций на развитие и стресс на корневом уровне может быть невозможна при выращивании растений в полевых условиях, в то время как гидропонная культура позволяет проводить такие измерения. Это облегчает сбор и определение характеристик корневых выделений, что может быть невозможно в полевых условиях. Хотя отсутствие физических барьеров для проникновения корней является основным недостатком этого метода, регулярный мониторинг роста корней является преимуществом, когда растения выращиваются в условиях гидропоники.
Важно перепроектировать архитектуру новых сортов сахарного тростника на основе сильного и идеального фенотипа корня, который может удовлетворить спрос на устойчивое сельское хозяйство. Высокопроизводительные платформы для фенотипирования корней, разработанные для риса и кукурузы, включают компоненты, адаптируемые к широкому спектру систем роста, таких как почва и гидропоника, передовые методы визуализации корней и программные инструменты41; Масштабирование таких платформ для выращивания сахарного тростника открывает широкие возможности для повышения производительности в ближайшем будущем. Несмотря на акцент на биологии корней как важном факторе, определяющем рост и продуктивность сахарного тростника, а также на наличие передовых методов фенотипирования корней, лишь в немногих исследованиях сообщалось о признаках корней сахарного тростника как таковых 42,43,44,45. Поскольку корни являются наиболее динамичными органами растения, единая методология оценки вариаций фенотипов корней может не быть окончательной, особенно для такой культуры, как сахарный тростник. Применение и интеграция подходящих комбинаций методологий в соответствии с целями исследования должны улучшить понимание подземных систем сахарного тростника.
Раскрытие информации
Все авторы заявляют об отсутствии конфликта интересов.
Благодарности
Авторы отмечают инфраструктуру и поддержку, оказанную директором ICAR-Института селекции сахарного тростника в Коимбатуре для создания объектов по фенотипированию корней сахарного тростника. Финансирование, предоставленное Советом по научным и инженерным исследованиям Департамента науки и технологий правительства Индии в виде премии за исследования в начале карьеры KV (ECR/2017/000738), должным образом признано. Авторы выражают признательность Бриндхе, Карпагаму, Раджешу, Шивараджу и Амбурозе за их помощь в тщательном сборе данных.
Материалы
| Name | Company | Catalog Number | Comments |
| Aeration pump with pipeline accessories | Purchased from local sources | NA | Used for hydroponic culture of sugarcane |
| Boric acid | Sisco Research Laboratories, India | 80266 | Preparation of modified Hoagland's solution |
| Calcium nitrate | Central Drug House, India | 27606 | Preparation of modified Hoagland's solution |
| Composted coir pith | Purchased from local sources | NA | Used for germinating sugarcane setts |
| Cupric sulphate | Sisco Research Laboratories, India | 38869 | Preparation of modified Hoagland's solution |
| DEAE-cellulose | Sisco Research Laboratories, India | 10529 | anion exchange resin for processing of root exudates |
| EDTA-ferric monosodium salt | Sisco Research Laboratories, India | 59389 | Preparation of modified Hoagland's solution |
| Farm yard manure | Purchased from local sources | NA | Used for germinating sugarcane setts |
| Glass tanks | Fabricated in-house | NA | Used for hydroponic culture of sugarcane |
| HPLC | Agilent Technologies | 1200 Infinity | Quantification of organic acids in root exudates |
| Magnesium sulphate | Sisco Research Laboratories, India | 29117 | Preparation of modified Hoagland's solution |
| Manganese chloride | Sisco Research Laboratories, India | 75113 | Preparation of modified Hoagland's solution |
| Molybdic acid | Sisco Research Laboratories, India | 49664 | Preparation of modified Hoagland's solution |
| Potassium dihydrogen phosphate | Central Drug House, India | 29608 | Preparation of modified Hoagland's solution |
| Potassium nitrate | Central Drug House, India | 29638 | Preparation of modified Hoagland's solution |
| Protrays | Fabricated in-house | NA | Used for germinating sugarcane setts |
| Red soil | Purchased from local sources | NA | Used for germinating sugarcane setts |
| Root core sampler | Fabricated in-house | NA | Used for in situ root sampling |
| Sand | Purchased from local sources | NA | Used for germinating sugarcane setts |
| Seralite-120 | Sisco Research Laboratories, India | 14891 | cation exchange resin for processing of root exudates |
| Supporting frame | Purchased from local sources | NA | Used for hydroponic culture of sugarcane |
| Water motor pump | Purchased from local sources | NA | Used for hydroponic culture of sugarcane |
| Whatman filter paper grade 1 | Universal Scientific | 1001090 | Processing of root exudates |
| WinRhizo PRO (software) | Regent Instruments Inc., Canada | STD4800 | Two-dimensional root scanner with software for analysis of roots |
| Zinc sulphate | Sisco Research Laboratories, India | 76455 | Preparation of modified Hoagland's solution |
Ссылки
- Food and Agriculture Organization of the United Nations (FAO). Crops and livestock products. FAOSTAT. , Available from: http://www.fao.org/faostat/en/#data/QC (2019).
- Venkatraman, T. S., Thomas, R. Studies of sugarcane roots at different stages of growth. Agricultural Journal of India. 23, 166-176 (1928).
- Smith, D. M., Inman-Bamber, N. G., Thorburn, P. J. Growth and function of the sugarcane root system. Field Crops Research. 92 (2-3), 169-183 (2005).
- Glover, J. The behaviour of the root-system of sugarcane at and after harvest. Proceedings of the South African Sugar Technologists Association. 42, 133-135 (1968).
- Venkatraman, T. S., Thomas, R. Sugarcane root systems: Studies in development and anatomy. Agricultural Journal of India. 17 (4), 416-418 (1922).
- Saliendra, N. Z., Meinzer, F. C. Genotypic, developmental and drought-induced differences in root hydraulic conductance of contrasting sugarcane cultivars. Journal of Experimental Botany. 43 (9), 1209-1217 (1992).
- Gilbert, R. A., Rainbolt, C. R., Morris, D. R., Bennet, A. C. Morphological responses of sugarcane to long-term flooding. Agronomy Journal. 99 (6), 1622-1628 (2007).
- Shiotsu, F., Abe, J., Doi, T., Gau, M., Morita, S. Root morphology and anatomy of field-grown Erianthus arundinaceus. American Journal of Plant Sciences. 6 (1), 103-112 (2015).
- Hari, K., Vasantha, S., Anna Durai, A., Brindha, C., Shruthi, P. Sugarcane root growth and development in hydroponics system. Journal of Sugarcane Research. 7 (2), 71-82 (2017).
- Matsuoka, S., Garcia, A. A. F. Sugarcane underground organs: Going deep for sustainable production. Tropical Plant Biology. 4, 22-30 (2011).
- Koevoets, I. T., Venema, J. H., Elzenga, J. T. M., Testerink, C. Roots withstanding their environment: Exploiting root system architecture responses to abiotic stress to improve crop tolerance. Frontiers in Plant Science. 7, 1335(2016).
- Vengavasi, K., Pandey, R. Root exudation index: Screening organic acid exudation and phosphorus acquisition efficiency in soybean genotypes. Crop and Pasture Science. 67 (10), 1096-1109 (2017).
- Bray, H. G., Thorpe, W. V. Analysis of phenolic compounds of interest in metabolism. Methods of Biochemical Analysis. 1, 27-52 (1954).
- Lowry, O. H., Rosebrough, N. J., Farr, A. L., Randall, R. J. Protein measurement with the folin phenol reagent. The Journal of Biological Chemistry. 193 (1), 265-275 (1951).
- Hedge, J. E., Hofreiter, B. T. Determination of total carbohydrate by anthrone method. Carbohydrate Chemistry: Volume 17. , Academic Press. New York. (1962).
- Moore, S., Stein, W. H. Polyphenol oxidase. Methods in Enzymology. Vol 468. , Academic Press. New York. (1948).
- Malik, C. P., Singh, M. B. Plant Enzymology and Histo-enzymology: A text manual. , Kalyani Publications. New Delhi. (1980).
- Beauchamp, C., Fridovich, I. Superoxide dismutase: Improved assays and an assay applicable to acrylamide gels. Analytical Biochemistry. 44, 276-287 (1971).
- Singleton, V. L., Rossi, J. A. Colorimetry of total phenolics with phosphomolybdic- phosphotungstic acid reagents. American Journal of Enology and Viticulture. 16, 144-158 (1965).
- Rege, R. D., Wagle, P. V. Problems of sugarcane physiology in the Deccan canal tract. III. The root-system. The Indian Journal of Agricultural Science. 2 (3), 356-373 (1940).
- Ryker, T. C., Edgerton, C. W. Studies on sugar cane roots. LSU Agricultural Experiment Station Reports. 223, (1931).
- Jensen, J. H. Some studies of root habits of sugar cane in Cuba. The Tropical Plant Research Foundation. , New York. (1931).
- Kücke, M., Schmid, H., Spiess, A. A comparison of four methods for measuring roots of field crops in three contrasting soils. Plant and Soil. 172 (1), 63-71 (1995).
- Noordwijk, M., et al. Trench Profile Techniques and Core Break Methods. Root Methods: A handbook. , Springer. Berlin, Heidelberg. (2001).
- De Azevedo, M. C. B., Chopart, J. L., Medina, C. C. Sugarcane root length density and distribution from root intersection counting on a trench-profile. Scientia Agricola. 68 (1), 94-101 (2011).
- Nissen, T., Rodriguez, V., Wander, M. Sampling soybean roots: A comparison of excavation and coring methods. Communications in Soil Science and Plant Analysis. 39 (11-12), 1875-1883 (2008).
- Burridge, J. D., et al. An analysis of soil coring strategies to estimate root depth in maize (Zea mays) and common bean (Phaseolus vulgaris). Plant Phenomics. 2020, 3252703(2020).
- Schroth, G., Kolbe, D. A method of processing soil core samples for root studies by subsampling. Biology and Fertility of Soils. 18, 60-62 (1994).
- Chandran, K., Nisha, M., Arun Kumar, R., Krishnapriya, V. Breeding varieties resistant to waterlogging. ICAR-SBI Annual Report 2016-17. , 128(2016).
- Wu, Q., Wu, J., Zheng, B., Guo, Y. Optimizing soil-coring strategies to quantify root-length-density distribution in field-grown maize: Virtual coring trials using 3-D root architecture models. Annals of Botany. 121 (5), 809-819 (2018).
- Joshi, D. C., et al. Development of a phenotyping platform for high throughput screening of nodal root angle in sorghum. Plant Methods. 13, 56(2017).
- Koyama, T., Murakami, S., Karasawa, T., Ejiri, M., Shiono, K. Complete root specimen of plants grown in soil-filled root box: Sampling, measuring, and staining method. Plant Methods. 17, 97(2021).
- Gomathi, R., Gururaja Rao, P. N., Chandran, K., Selvi, A. Adaptive responses of sugarcane to waterlogging stress: An overview. Sugar Tech. 17, 325-338 (2014).
- Misra, V., et al. Morphological assessment of water stressed sugarcane: a comparison of waterlogged and drought affected crop. Saudi Journal of Biological Sciences. 27 (5), 1228-1236 (2020).
- Robinson, N., et al. Sugarcane genotypes differ in internal nitrogen use efficiency. Functional Plant Biology. 34 (12), 1122-1129 (2007).
- Arruda, B., et al. Biological and morphological traits of sugarcane roots in relation to phosphorus uptake. Journal of Soil Science and Plant Nutrition. 16 (4), 901-915 (2016).
- Sharma, S., Borah, P., Meena, M. K., Bindraban, P., Pandey, R. Evaluation of genotypic variation for growth of rice seedlings under optimized hydroponics medium. Indian Journal of Genetics and Plant Breeding. 78 (3), 292-301 (2018).
- Soumya, P. R., Singh, D., Sharma, S., Singh, A. M., Pandey, R. Evaluation of diverse wheat (Triticum aestivum) and triticale (× Triticosecale) genotypes for low phosphorus stress tolerance in soil and hydroponic conditions. Journal of Soil Science. 21, 1236-1251 (2021).
- Ganie, A. H., et al. Metabolite profiling and network analysis reveal coordinated changes in low-N tolerant and low-N sensitive maize genotypes under nitrogen deficiency and restoration conditions. Plants. 9 (11), 1459(2020).
- Venkatraman, T. S., Thomas, R. Simple contrivances for studying root development in agricultural crops. Agricultural Journal of India. 18, 509-514 (1923).
- Clark, R. T., et al. High-throughput two-dimensional root system phenotyping platform facilitates genetic analysis of root growth and development. Plant, Cell and Environment. 36 (2), 454-466 (2013).
- Chopart, J. L., Rodrigues, S. R., Azevedo, M. C. B., Medina, C. C. Estimating sugarcane root length density through root mapping and orientation modelling. Plant and Soil. 313, 101-112 (2008).
- Chopart, J. L., Azevedo, M. C. B., Le Mezo, L., Marion, D. Functional relationship between sugarcane root biomass and length for cropping system applications. Sugar Tech. 12 (3-4), 317-321 (2010).
- De Silva, A. L. C., De Costa, W. A. J. M., Bandara, D. M. U. S. Growth of root system and the patterns of soil moisture utilization in sugarcane under rain-fed and irrigated conditions in Sri Lanka. Sugar Tech. 13 (3), 198-205 (2011).
- Otto, R., Silva, A. P., Franco, H. C. J., Oliveira, E. C. A., Trivelin, P. C. O. High soil penetration resistance reduces sugarcane root system development. Soil and Tillage Research. 117, 201-210 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены