Method Article
Mehrgleisige Phänotypisierungsansätze zur Charakterisierung von Zuckerrohrwurzelsystemen
In diesem Artikel
Zusammenfassung
Die Charakterisierung von Merkmalen des Wurzelsystems ist eines der Forschungsgebiete, das noch in den Kinderschuhen steckt, insbesondere beim Zuckerrohr. Die Integration mehrerer Ansätze zur präzisen Phänotypisierung von Zuckerrohrwurzeln führt zu umfassenden und ganzheitlichen Ergebnissen, die es ermöglichen, die identifizierten Merkmale und Mechanismen für die konventionelle und molekulare Züchtung zu nutzen.
Zusammenfassung
Wurzeln sind die Hauptleiter von Wasser und Nährstoffen und spielen eine wichtige Rolle bei der Aufrechterhaltung von Wachstum und Ertrag unter stressigen Bedingungen. Die Untersuchung von Pflanzenwurzeln wirft methodische Schwierigkeiten bei der In-situ-Bewertung und -Probenahme auf, was insbesondere für Zuckerrohr (Saccharum spp.) gilt. Traditionelle Methoden in den 1920er Jahren dokumentierten die genotypische Variation des Zuckerrohrwurzelsystems, woraufhin bis vor kurzem nur wenige Studien über die Merkmale der Zuckerrohrwurzel an sich berichtet wurden. Neben der Morphologie bestimmen die Merkmale der Rhizosphäre, einschließlich allelopathischer Effekte und/oder der Affinität zur mikrobiellen Symbiose, die Etablierung und das Überleben der Pflanze.
Letztendlich definieren die Wurzelsysteme die oberirdische Produktivität von Zuckerrohr. Mit dem Impuls für klimaresiliente Sorten wird es immer wichtiger, die Variabilität der Wurzelsystemmerkmale von Zuckerrohr zu erforschen und zu nutzen. In diesem Artikel werden mehrgleisige Ansätze für die Phänotypisierung von Zuckerrohrwurzeln beschrieben, einschließlich Feldaushub durch Grabenprobenahme, die Verwendung eines Wurzelkernprobenehmers, erhöhte Plattformen für die Wurzelprobenahme und die Aufzucht von Pflanzen in hydroponischer Kultur, die von einem Team von Wissenschaftlern des Indian Council of Agricultural Research-Sugarcane Breeding Institute (ICAR-SBI) angestellt wurden.
Der Aushub vor Ort durch Probenahme von Gräben ist unerlässlich, um die Pflanzenwurzeln in ihrer natürlichen Wachstumsumgebung zu beurteilen. Die Verwendung von erhöhten Plattformen, die die Feldbedingungen simulieren, und ein Wurzelkernsammler sind alternative Ansätze mit einer erheblichen Zeitersparnis, einer einheitlichen Probengröße und einem geringeren Verlust von Wurzelmaterial. Die hydroponische Pflanzenkultur ermöglicht die Untersuchung der Morphologie, der anatomischen Merkmale und der Rhizosphärenbiologie, einschließlich der Exsudation organischer Verbindungen und mikrobieller Wechselwirkungen. Die Daten aus verschiedenen Experimenten mit unterschiedlichen Probenahmemethoden ergänzen die Fülle an Informationen über die Merkmale des Wurzelsystems von Zuckerrohr.
Einleitung
Zuckerrohr (Saccharum spp.), eine wichtige Nahrungs- und Bioenergiequelle, ist eine bedeutende Industriepflanze, die in vielen Ländern mit tropischen und subtropischen klimatischen Bedingungen angebaut werden kann. Aufgrund des C4-Photosynthesewegs zur Kohlenstoffassimilation ist Zuckerrohr hochproduktiv und nutzt effiziente landwirtschaftliche Betriebsmittel wie Wasser und Düngemittel. Bei der Nachernteverarbeitung von Zuckerrohr fallen neben den Nebenprodukten Melasse, Ethanol und Energie auch wirtschaftlich wertvolle Produkte wie Zucker und Jaggery an. Zuckerrohr wird in fast 100 Ländern auf einer Fläche von 25,97 Mha angebaut, was etwa 1,5 % der gesamten Ackerfläche entspricht. Allein Indien trägt zu 16% der weltweiten Zuckerrohrproduktion (ca. 306 Mio. t) bei, mit einer durchschnittlichen Produktivität von 70 t·ha-1 1. Zu den wichtigsten abiotischen Stressfaktoren, die sich drastisch auf die Zuckerrohrproduktion auswirken, gehören Wasserdefizite, Staunässe, extreme Temperaturen und Bodeneigenschaften wie Nährstoffmangel, Salzgehalt, Natriumgehalt und Alkalität. Die größte Herausforderung bei der Entwicklung abiotischer stresstoleranter Pflanzen besteht darin, spezifische Merkmale zu identifizieren, die unter Stressbedingungen einen erheblichen Ertragsvorteil bringen.
Mehrere Aspekte der Zuckerrohrphysiologie sind nur unzureichend verstanden, einschließlich der Wurzel-Spross-Beziehung, die die Produktivität des Zuckerrohrs drastisch beeinflusst. Die Zuckerrohrwurzel ist nicht so gut untersucht wie die Sprossen, obwohl die verschiedenen Arten, wie z. B. Settwurzeln, Sprosswurzeln und adulte Wurzeln, entwicklungsbedingt unterschiedlich sein und unterschiedliche Funktionen haben können. Genotypische Unterschiede wurden hinsichtlich der Anzahl und Länge der während der Keimung entstehenden Setzwurzeln beobachtet2. Settwurzeln sind an der Keimung von Zuckerrohrknospen beteiligt, was eine frühe Etablierung der Pflanzen gewährleistet, und werden später durch Sprosswurzeln ersetzt, die robust sind und aus der Basis des sich entwickelnden Sprosses hervorgehen3. Feine Äste, die in den Wurzeln der Setzlinge beobachtet werden, helfen bei der Verankerung der jungen Pflanzen und helfen bei der Aufnahme von Wasser und Nährstoffen, bis sie durch Sprosswurzeln ersetzt werden. Ähnlich wie die Settwurzeln entstehen auch die Sprosswurzeln aus den Wurzelprimordien, die in den unteren, nicht expandierten Internodien des Rohres vorhanden sind.
Da die Sprosswurzeln länger in der Pflanze verbleiben, sind sie 4x-10x dicker als Settwurzeln. Die Sprosswurzeln stellen das einzige Wurzelsystem des Zuckerrohrs dar und spielen eine wichtige Rolle für das weitere Wachstum und die Entwicklung. Die Vitalität der Sprosswurzeln ist positiv mit der gesamten vegetativen Vitalität der Pflanze verbunden. Die kontinuierliche Entwicklung der Wurzeln, die sich aus dem Umsatz von Settenwurzeln und Sprosswurzeln ergibt, führt zur Entstehung des "erwachsenen Wurzelsystems" des Zuckerrohrs, das sich ständig an die vorherrschenden Umweltbedingungen anpasst. Im Allgemeinen stellt ein tieferes, fruchtbareres Wurzelsystem mehr Wasser und Nährstoffe für die Pflanze zur Verfügung als eine flachere Verteilung der Wurzeln. Periodische Sektionen zeigten, dass bei hohem Feuchtigkeitsgehalt des Bodens flache Wurzelsysteme beobachtet wurden, während sich mit sinkendem Grundwasserspiegel ein viel tieferes Wurzelsystem entwickelte2. Das Wurzelsystem des Zuckerrohrs bleibt auch nach der Ernte der Ernte aktiv und trägt zum Wachstum der Ratoon-Pflanze bei, bis neue Triebwurzeln aus den unterirdischen Knospen hervorgehen4. Der Wurzelwinkel und die Höhe der Wurzelverzweigung sind zwei wichtige Faktoren, die das Volumen des Bodens bestimmen, das von den Pflanzenwurzeln erkundet wird. Der Wurzelwinkel, ein genotypisches Merkmal, kann durch konventionelle Züchtung oder molekulare Ansätze verändert werden, um die Toleranz gegenüber biotischem und abiotischem Stress zu verbessern. Im Gegenteil, das Ausmaß der Wurzelverzweigung wird hauptsächlich von der Umwelt beeinflusst, was eine regelmäßige Überwachung der Wurzelentwicklung und ihrer Reaktion auf lokale Bodenbedingungen erforderlich macht.
Anatomische Merkmale von Zuckerrohrwurzeln wurden untersucht, um Unterschiede in Bezug auf Genotyp und Umwelt festzustellen. Die Anatomie der Settwurzeln im Zuckerrohr ähnelt der der reifen Wurzeln in anderen Gräsern wie Mais, wobei die Rinde aus gut differenzierten Zellschichten in einem regelmäßigen Muster besteht. Die Endodermis wird suberisiert, gefolgt von einem einschichtigen Perizyklus. Metaxylemelemente sind die Hauptleiter von Wasser- und Nährstoffionen, radial angeordnet und durchsetzt mit Phloemgruppen, wobei letzteres ein Siebelement mit zwei Begleitzellen umfasst. Die große Zentralmasse aus undifferenzierten Zellen bildet das Wurzelmark. Unterschiedliche anatomische Merkmale von Zuckerrohrsorten entsprechen den hydraulischen Eigenschaften der Wurzeln und beeinflussen dadurch die Wasserbewegung. Frühe Studien zu den Unterschieden in den wurzelanatomischen Merkmalen des Zuckerrohrs zeigten, dass unter Bedingungen mit geringem Feuchtigkeitsstress eine ausgeprägte Verdickung der Zellwand in den Schichten unmittelbar im Inneren der Endodermis, zwischen dem Mark und der Gefäßregion sowie um die Gefäße herum beobachtet wurde5. Solche verdickten Zellen können eine Anpassung sein, um den Rückfluss von Saft zu verhindern und die mechanische Festigkeit bei Stress zu erhöhen.
Zu den wichtigen Merkmalen, die an der Trockenresistenz von Zuckerrohr beteiligt sind, gehören die relative Dicke und Anzahl der exodermalen Schichten, das Verhältnis von Rinde zu Stele, interzelluläre Räume in der Rinde und verdickte Wurzelhaarspitzen. Das Verhältnis der Fläche, die von kortikalen Zellen eingenommen wird, zu der Fläche, die von den stellaren Geweben der Sprosswurzeln eingenommen wird, unterscheidet sich signifikant zwischen den Zuckerrohrsorten, mit großer Variabilität in Bezug auf die Fläche der Stele6. Die hydraulische Leitfähigkeit von Zuckerrohrwurzeln hängt mit der Größe und Anzahl der Metaxylemelemente in den Sprosswurzeln zusammen. Hydrophobe Zellschichten innerhalb der Wurzel definieren wahrscheinlich Zonen apoplastischer Wasserbewegung. Suberisierte Casparian-Banden finden sich in der Endodermis und in der Hypodermis (als Exodermis bezeichnet), die als hydrophobe Barrieren dienen. Der Zerfall der kortikalen Zellen führt zur Bildung eines lysigenen Aerenchyms in älteren Wurzeln und bei Pflanzen, die hypoxischen Bedingungen ausgesetzt sind, unabhängig vom Entwicklungsalter. Die Bildung von Aerenchym bei Staunässe korreliert mit der Aufrechterhaltung des Wachstums bei resistenten Sorten7.
Die Morphologie und Anatomie der Wurzeln von Erianthus arundinaceus [Retzius] Jeswiet (Gattungen, die mit Saccharum spp. verwandt sind) sind mit seiner starken Toleranz gegenüber Umwelteinflüssen verbunden8. Die Wurzeln von Erianthus arundinaceus weisen Knotenwurzeln auf, die in steilen Winkeln verteilt sind, mit dichten Wurzelhaaren, um die Aufnahme von Wasser und Nährstoffionen aus tieferen Bodenzonen zu erleichtern. Das Tiefwurzelsystem besteht aus vielen Knotenwurzeln, die mit steilen Wuchswinkeln wachsen. Der Durchmesser der Knotenwurzeln korreliert mit der Größe und Anzahl der großen Xylemgefäße, wobei erstere stark von 0,5 mm bis 5,0 mm variieren. Diese Knotenwurzeln bilden auch eine rhizomatöse Hülle, wobei eine Hypodermis ein verholztes Sklerenchym in der äußeren Rinde (Exodermis), ein lysigenöses Aerenchym im mittleren Teil der Rinde und Stärkekörner in der Stele aufweist. Neben der Architektur und den morphologischen Merkmalen spielen wurzelexsudierte organische Verbindungen eine wichtige Rolle bei der Bestimmung der Keimung, Etablierung und des Überlebens von Pflanzen, mit plausiblen allelopathischen Effekten und/oder Affinität zur mikrobiellen Symbiose.
Die enzymatische Aktivität der Wurzel und die feineren Details der Morphologie, einschließlich der Pigmentierung der Wurzelkappe und des Verjüngungspotenzials bei Verletzungen, wurden in Zuckerrohrsorten dokumentiert, die in hydroponischer Kultur angebaut wurden9. Das Wurzelwachstum zeigt eine sehr plastische Reaktion auf Veränderungen im Bodenmilieus, sowohl in Bezug auf die Form als auch auf die Größe des Wurzelsystems. Die effizienteste Zuckerrohrsorte wäre eine Sorte mit wenigen oder einer optimalen Anzahl von Trieben und einer entsprechend geringeren Anzahl von Wurzeln, was ein besseres Überleben unter Stressbedingungen ermöglicht. Die systematische Untersuchung des Wurzelsystems sollte daher ein wichtiger Bestandteil jedes Programms zur Verbesserung der Kulturpflanzensein 10. Die Mehrzahl der Experimente, die sich auf Wurzeln konzentrieren, stützen sich hauptsächlich auf Entwicklungsaspekte, während ein Fokus auf die funktionelle Plastizität oft fehlt11. Neben der strukturellen Verteilung spielt die funktionelle Wurzelplastizität eine entscheidende Rolle für das Überleben unter Stress und würde daher die Züchter in ihren Bemühungen unterstützen, Merkmale des Wurzelsystems in die Selektionspipeline für abiotische Stresstoleranz aufzunehmen und die Robustheit des Zuckerrohrs zu verbessern.
In Anbetracht seiner Bedeutung für die Aufrechterhaltung des Wachstums und des Ertrags unter stressigen Bedingungen ist es wichtig, die inhärente Variabilität der Merkmale des Wurzelsystems von Zuckerrohr zu erforschen und zu nutzen. Die Betonung der Auswahl von Komponentenmerkmalen und -mechanismen, die ein überlegenes Wurzelsystem verleihen, ist der Weg zu einer besseren Pflanzenleistung unter sich ändernden klimatischen Bedingungen. Die phänotypische Bewertung ist ein langwieriger und kostspieliger Prozess; Die Integration mehrgleisiger Ansätze würde jedoch einen enormen Mehrwert für den Nutzen bei der Verbesserung der Ernte schaffen. In diesem Manuskript werden vier verschiedene Ansätze für die Wurzelphänotypisierung in Zuckerrohr beschrieben, jeder mit seinen eigenen Vor- und Nachteilen, was bedeutet, dass eine konzertierte Anstrengung erforderlich ist, um zu umfassenden und ganzheitlichen Ergebnissen zu gelangen.
Protokoll
1. Feldaushub durch Probenahme von Gräben
- Züchten Sie kommerzielle Zuckerrohrhybriden (im Folgenden "Sorten" genannt) auf dem Feld aus zweiknospenartigen Beständen, die in einem Reihenabstand von 120 cm und 90 cm innerhalb der Reihen gepflanzt werden, wobei das empfohlene Maßnahmenpaket (POP) befolgt wird, um eine gute Etablierung und ein gutes Wachstum der Pflanzen zu gewährleisten.
- Am Ende der Reifephase der Ernte heben Sie mit einem Bagger einen Graben (1,5 m tief und 1,0 m breit) auf dem Feld aus. Durch kontinuierliches Wasserstrahlen ist darauf zu achten, dass die Wurzelzonen von den Böden befreit werden, ohne die Wurzeln zu beschädigen (Abbildung 1).
- Wenn sich die anhaftende Erde lockert, entwurzeln Sie das Rohr zusammen mit dem Wurzelsystem und bringen Sie es ins Labor, um die Anzahl der Wurzeln, die Wurzellänge, das Volumen und das Gewicht manuell zu messen.

Abbildung 1: Methode zur Probenahme von Gräben für den Feldaushub von Wurzeln. (A) Seitlicher Graben, der entlang des Feldes ausgehoben wurde, (B) Wasserstrahlen und (C) Innenansicht, die die Tiefe des Grabens zeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Wurzelkernprobenehmer zur Reduzierung von Probenahmefehlern
- Verwenden Sie einen zylindrischen Wurzelkernprobenehmer von 61 cm Höhe und 16 cm Durchmesser und einem Gewicht von 8 kg, der aus Baustahl (MS) hergestellt wurde, für die Probenahme von Zuckerrohrwurzeln im Feld. Versehen Sie den Probenehmer mit einer scharfen Kante, um ein leichtes Eindringen beim Einführen in den Boden zu ermöglichen. Versehen Sie die Oberseite mit Manschetten von 3 cm Durchmesser, um den Probenehmer anzuheben (Abbildung 2).
- Züchten Sie Zuckerrohrsorten auf dem Feld aus zweiknospenförmigen Beständen, die in einem Reihenabstand von 120 cm und 90 cm innerhalb der Reihen gepflanzt werden, wobei der empfohlene POP eingehalten wird, um eine gute Etablierung und ein gutes Wachstum der Pflanzen zu gewährleisten.
- In der Reifephase der Pflanze die Oberkante des Probenehmers am Haupttrieb/Stock befestigen und kontinuierlich hämmern, um die gewünschte Bodentiefe (45 cm) zu erreichen. Heben Sie die gesamte Erdmasse in den Probenehmer und waschen Sie sie vorsichtig unter fließendem Wasser, um die anhaftenden Wurzeln zu trennen.
- Nach gründlichem Waschen der Wurzeln erfassen Sie Volumen, Oberfläche, Länge und Gewicht durch manuelle Messung sowie durch Ausbreiten der Wurzeln auf durchsichtigen Schalen, um die entsprechenden digitalisierten Bilder mit der referenzierten Software zu scannen und zu analysieren (siehe Materialtabelle).

Abbildung 2: Wurzelkern-Sampler. (A) Abmessungen, (B) Draufsicht und (C) Ort der Probenahme. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Struktur der Wurzelphänotypisierung, um die Probenahme in verschiedenen Phänophasen zu erleichtern
- Konstruktion einer Wurzelphänotypisierungsstruktur, die aus drei benachbarten Kompartimenten mit den Maßen 4,5 m x 10,1 m für die Probenahme der Zuckerrohrwurzeln besteht, mit Vorkehrungen für die manuelle Demontage der Seitenwände, um das unterirdische Wurzelsystem (bis zu einer Tiefe von 80-100 cm) freizulegen (Abbildung 3). Konstruieren Sie die Seitenwände mit Fertigteilplatten mit den Abmessungen 1,8 m Länge, 30 cm Breite und 4 cm Dicke.
- Füllen und verdichten Sie die Struktur mit Felderde, wobei Sie einen Kopfraum von ~20 cm mit ausreichenden Drainagelöchern lassen, um die Bodenbelüftung zu erleichtern.
- Säen Sie die Knospenspäne von Keimplasma-Klonen aus, die aus Saccharum officinarum L., Saccharum spontaneum L., Saccharum barberi Jesw., Saccharum sinense Roxb. und Saccharum robustum Brandes und Jeswiet ex Grassl bestehen. (im Folgenden "Saccharum spp.-Klone" genannt) und lassen sie 30 Tage lang in Protrays keimen, die aus Bewurzelungsmedien bestehen (rote Erde: Hofdünger: Sand = 2:2:1). Verpflanzen Sie gleichmäßige und gesunde Setzungen in der Struktur mit einem Reihenabstand von 90 cm, mit 60 cm innerhalb der Reihen, unter Beachtung des empfohlenen POP, um eine gute Etablierung und ein gutes Wachstum der Pflanzen zu gewährleisten.
- Während der Formphase (60-120 Tage nach der Pflanzung [DAP]) und der großen Wachstumsphase (120-150 DAP) entfernen Sie die Seitenwände aus den Fertigteilplatten manuell, gefolgt von einem kontinuierlichen Sprühen des Wasserstrahls, um die Wurzeln freizulegen.
- Entwurzeln Sie das gesamte Wurzelsystem und bringen Sie es ins Labor, um die Länge, das Volumen und das Gewicht manuell zu messen, und verteilen Sie die Wurzeln auf durchsichtige Schalen, um die entsprechenden digitalisierten Bilder in der referenzierten Software zu scannen und zu analysieren (siehe Materialtabelle).
- Erzeugen Sie Trockenstress, indem Sie die Bewässerung in einem der Fächer zurückhalten, und verstopfen Sie die Abflusslöcher im zweiten Fach, um die Bodensättigung aufrechtzuerhalten und Staunässe zu simulieren. Bewässern Sie das dritte Kompartiment gemäß dem empfohlenen POP, um die Feldkapazität zu erhalten und als Kontrolle zu dienen.

Abbildung 3: Struktur der Phänotypisierung der Wurzel. (A) Abmessungen, (B) Überblick über die drei Kompartimente und (C) Ansicht eines Kompartiments. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
4. Hydroponische Kultur von Pflanzen zur Erforschung der Rhizosphärenbiologie
- Stellen Sie ein hauseigenes Hydrokultursystem in einem umweltkontrollierten Gewächshaus her, das für den Anbau von Zuckerrohr geeignet ist, um die feineren Details der Wurzelbiologie zu untersuchen. ~15 l modifizierte Hoagland-Nährlösung (Tabelle 1) in Glasbecken mit den Maßen 20 cm x 20 cm x 50 cm geben, wobei die Belüftung durch Aquarienpumpen gewährleistet ist (Abbildung 4).
- Säen Sie die Knospenchips von Zuckerrohrsorten und Saccharum spp.-Klonen aus und lassen Sie sie 30 Tage lang in Protrays aus kompostiertem Kokosmark keimen. Verpflanzen Sie gleichmäßige und gesunde Setzungen in hydroponische Tanks mit der Häufigkeit von drei Setzungen pro Tank und achten Sie darauf, die gesamte Wurzel in die Nährlösung zu legen. Decken Sie die Tanks mit einem schwarzen Tuch ab, um sicherzustellen, dass die Wurzeln nicht dem Licht ausgesetzt werden. Verwenden Sie ein Kunststoffnetz (20 cm x 20 cm) am Rand der Glastanks, um die Pflanzen aufrecht zu stützen.
- Am Ende der Keimphase (60 Tage) sammeln Sie die Wurzelausscheidungen, indem Sie die Wurzeln intakter Pflanzen während der Zeit der maximalen Photosyntheseaktivität 4 h lang (0800 h bis 1200 h) in 50 ml Fallenlösung (steriles doppelt destilliertes Wasser) tauchen. Filtrieren Sie die gesammelte Lösung durch Whatman-Filterpapier und leiten Sie sie dann durch Glassäulen, die mit Anionenaustauscher, gefolgt von Kationenaustauscherharzen, gefüllt sind12. Die eluierten Fraktionen bis zur Trockenheit eindampfen und bis zur Weiterverarbeitung bei -20 °C lagern.
- Analysieren Sie die aufbereiteten Wurzelexsudatproben mittels HPLC zur Bestimmung organischer Säuren12 und mittels Spektrophotometrie zur Abschätzung der Gesamtphenole13, Proteine14, Zucker15 und Aminosäuren16 gemäß dem Standardprotokoll.
- Überwachen Sie das Wurzelwachstum in wöchentlichen Abständen, um die Pigmentierung der Wurzelspitzen und die Dichte des Wurzelhaars aufzuzeichnen. Beurteilen Sie die Aktivität der Enzyme, der Peroxidase17 und der Superoxiddismutase18 sowie des Gesamtphenolgehalts19 im 3. Monat gemäß dem Standardprotokoll.
- Beurteilen Sie die Reaktion auf eine Wurzelverletzung, indem Sie mit einer sterilen chirurgischen Klinge einen Längsschnitt in die Primärwurzel bis zur Wurzelspitze schneiden, und überwachen Sie die Veränderungen regelmäßig.
| Chemisch | Endkonzentration |
| Kaliumnitrat | 0,608 g· L-1 |
| Calciumnitrat | ca. 1.415 g· L-1 |
| Kaliumdihydrogenphosphat | 0,164 g· L-1 |
| Magnesiumsulfat | 0,560 g· L-1 |
| EDTA-Eisen(III)-Mononatriumsalz | 6,00 g·250L-1 |
| Borsäure | 1,43 g·250L-1 |
| Manganchlorid-Tetrahydrat | 0,91 g·250L-1 |
| Zinksulfat | 0,11 g·250L-1 |
| Cupric suphate | 0,04 g·250L-1 |
| Molybdische Säure | 0,01 g250L-1 |
Tabelle 1: Zusammensetzung der modifizierten Nährlösung für die Hydrokultur von Zuckerrohr.

Abbildung 4: Hydroponik-Setup. Das Setup (A) ist auf den Anbau von Zuckerrohr zugeschnitten und (B) die 5 Monate alte Ernte (schwarzes Tuch wird nur zu Fotozwecken entfernt). Diese Abbildung wurde von Hari et al.9 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergebnisse
Variation in den morphologischen Merkmalen der Wurzeln von Zuckerrohrsorten
Repräsentative Bilder des Wurzelsystems in Co 62175, das durch Grabenproben vom Feld aus ausgegraben und in einer Hydrokultur gezüchtet wurde, sind in Abbildung 5A,B dargestellt. Lange Wurzeln (~100 cm) wurden bei den Sorten Co 62175 und Co 99006 beobachtet, während Co 99006 das höchste Wurzelgewicht (127 g·klump−1) aufwies. Die Wurzelmerkmale wurden mit Hilfe eines Wurzelkernsammlers erfasst, der zeigte, dass Co 62175 im Vergleich zu Co 99006 ein überlegenes Wurzelsystem in Bezug auf kumulative Wurzellänge, Wurzeloberfläche und Wurzelvolumen aufwies (Abbildung 5C-E). Der durchschnittliche Wurzeldurchmesser war jedoch in Co 99006 höher als in Co 62175 (Abbildung 5F).
Variation in den morphologischen Wurzelmerkmalen von Saccharum spp.-Klonen
Die morphologischen Merkmale in der Entstehungsphase zeigten eine signifikante Variation zwischen den Klonen von Saccharum spp., wobei die höchste kumulative Wurzellänge von 39615,72 cm pro Büschel bei S. spontaneum (IND 85-490) beobachtet wurde, während die geringste bei S. sinense (Oshima) beobachtet wurde (Abbildung 6A). Die größte Wurzeloberfläche pro Büschel (4700,31 cm2) wurde bei S. spontaneum (IND 85-490) beobachtet, gefolgt von S. officinarum (Awela Green Sport) und die geringste bei S. sinense (Oshima) (Abbildung 6B). Ein ähnlicher Trend wurde bei der Wurzel und dem durchschnittlichen Wurzeldurchmesser beobachtet (Abbildung 6C,D). Die Morphologie der Wurzeln, die in der großen Wachstumsphase beprobt wurden, wurde manuell gemessen und zeigte, dass die längsten Wurzeln (131 cm) bei S. robustum (NG 77-237) vorhanden waren (Abbildung 6E), während das Trockengewicht der Wurzel bei S. spontaneum am höchsten war (IND 85-490: 57,4 gμklump−1) und bei S. sinense am niedrigsten war (Oshima: 11,2 gμklump−1) (Abbildung 6F). Das Wurzelvolumen und das Verhältnis von Wurzel zu Spross folgten einem ähnlichen Trend wie das Trockengewicht der Wurzel (Abbildung 6G,H).
Variation in den wurzelanatomischen Merkmalen von Saccharum spp.-Klonen
Die Querschnittsfläche der Wurzeln 10 mm vor der Spitze variierte signifikant zwischen den Klonen von Saccharum spp., wobei S. spontaneum (IND 85-490) die größte Fläche (27646,8 mm2) aufwies, während S. sinense (Oshima) die geringste Fläche (7539,1 mm2) aufwies (Tabelle 2). Die Hauptfläche in S. sinense (Oshima) war von kortikalen Zellen besetzt, während in S. spontaneum (IND 85-490) die Fläche des Stelegewebes stark ausgeprägt war, was sich in den Daten zum Verhältnis von Kortex zu Stele widerspiegelt. Die Anzahl der Metaxylemelemente reichte von 6 (S. officinarum: Awela Green Sport) bis 13 (S. spontaneum: IND 85-490), während die Anzahl der Lufträume (lysigenöses Aerenchym) von 12 (S. barberi: Putli Khajee) bis 32 (S. spontaneum: IND 85-490) variierte. Die von Metaxylemelementen eingenommene Fläche war in S. barberi (Putli Khajee) am höchsten (791,3 mm2) und in S. sinense (Oshima) am niedrigsten (254,3 mm2). Die vom Aerenchym eingenommene Fläche war bei S. spontaneum (IND 85-490) am höchsten (4921,3 mm2), während die Wurzeln von S. sinense (Oshima) und S. robustum (NG 77-237) unter normalen bewässerten Bedingungen keine aerenchymatösen Zellen aufwiesen. Saccharum sinense (Oshima), S. spontaneum (IND 85-490) und S. barberi (Putli Khajee) zeigten unter Trockenheit und Staunässe überlegene anatomische Wurzelphene (Abbildung 7A-C). Lange Wurzelhaare, sklerenchymatöse Exodermis, reduzierte kortikale Zellschichten, erhöhtes kortikales Aerenchym, vergrößerte Stelenfläche und Xylemgefäßzahl mit großem Durchmesser waren unter Trockenheit günstig, während ein erhöhter Wurzeldurchmesser und eine höhere kortikale Zellfläche mit vermehrten aerenchymatösen Zellen die mechanische Festigkeit, die Wurzelporosität und die Sauerstoffdiffusion unter Staunässe erhöhten.
Variation in der Art und Menge der Wurzelexsudate von Saccharum spp.-Klonen
Unter den organischen Verbindungen, die von Saccharum spp.-Klonen während der Keimphase ausgeschieden wurden, war der Anteil am Gesamtprotein am höchsten, gefolgt von Carboxylaten, Zuckern, Phenolen und freien Aminosäuren. Saccharum robustum (NG 77-221) zeigte die höchste (5,11 mg·g−1·Wurzelfrischgewicht [RFW]·h−1) Gesamtcarboxylatexsudation, während die niedrigste (0,65 mg·g−1· RFW·h−1) wurde in S. spontaneum (IND 85-490) nachgewiesen, wobei die Art und Menge der einzelnen exsudierten Carbonsäure signifikant variiert (Abbildung 8A). Saccharum officinarum (Awela Green Sport) wies die höchsten Gesamtphenolgehalte (0,034 mg·g−1,1· RFW·h−1), während der niedrigste (0,002 mg·g−1,1· RFW·h−1) wurden im Fall von S. spontaneum (IND 85-490) beobachtet (Abbildung 8B). Die höchste Gesamtproteinexsudation (3,23 mg·g−1,1· RFW·h−1) wurde in S. officinarum (Awela Green Sport) beobachtet, während der höchste Gesamtzuckergehalt (0,22 mg·g−1· RFW·h−1) und insgesamt freie Aminosäuren (0,04 mg·g−1· RFW·h−1) wurden in S. sinense (Oshima) nachgewiesen (Abbildung 8C-E). Die niedrigste Gesamtproteinexsudation (2,08 mg·g−1,� RFW·h−1) wurde in S. spontaneum (IND 85-490) beobachtet, während S. robustum (NG 77-221) die geringsten Mengen an Gesamtzucker (0,05 mg·g−1· RFW·h−1) und insgesamt freie Aminosäuren (0,01 mg·g−1· RFW·h−1).
Variation der Pigmentierung der Wurzelspitze, der enzymatischen Aktivität und des Gesamtphenolgehalts von Zuckerrohrsorten
Die Formen der Wurzelkappe reichten von einem einfachen Dreieck (Co 62175) bis zu einer Kuppel (Co 86032), während die Pigmentierung der Wurzelkappe von hellrosa (Co 62175) bis tiefviolett (Co 86032) variierte, mit signifikanten Unterschieden in der Dichte der Wurzelhaare (Abbildung 9A-C). Die Peroxidaseaktivität war in Co 86032 am höchsten (40 Einheiten·g−1·h−1) und in Co 62175 am niedrigsten (26 Einheiten·g−1·h−1), während sich der Trend bei der Superoxiddismutase-Aktivität in den Wurzeln umkehrte (Abbildung 9D,E). In ähnlicher Weise war der Gesamtphenolgehalt in Co 86032 am höchsten (18 μg·g−1) und in Co 62175 am niedrigsten (15 μg·g−1) (Abbildung 9F).
Variation in den Entwicklungsphasen der Verjüngung bei Wurzelverletzung von Zuckerrohrsorten
Die Verjüngung nach Wurzelverletzung wurde an den Zuckerrohrsorten CoC 671 und Co 06022 getestet, die in einem hydroponischen Aufbau aufgezogen wurden (Abbildung 10A-I). Bei CoC 671 traten die Sekundärwurzeln am dritten Tag der Verletzung auf, während bei Co 06022 die Initiierung der Sekundärwurzel erst am zehnten Tag erfolgte. Darüber hinaus zeigte die Primärwurzel von Co 06022 am dritten Tag Symptome der Seneszenz, während die Wurzeln von CoC 671 relativ gesund blieben. Tertiäre Wurzeln wurden auch am zehnten Tag in CoC 671 beobachtet.

Abbildung 5: Wurzelsysteme von Co 62175 und verschiedene morphologische Merkmale. Das Wurzelsystem von (A) Co 62175, das durch Grabenprobenahme ausgegraben wurde, (B) Co 62175, das in einer Hydrokultur gezüchtet wurde, und morphologische Merkmale (C) kumulative Wurzellänge, (D) Wurzeloberfläche, (E) Wurzelvolumen und (F) durchschnittlicher Wurzeldurchmesser, der mit dem Wurzelkernsammler aufgezeichnet wurde. Die Daten stellen den Mittelwert ± SEM dar (n = 3). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Morphologische Merkmale der Wurzel. (A) Kumulative Wurzellänge, (B) Wurzeloberfläche, (C) Wurzelvolumen und (D) durchschnittlicher Wurzeldurchmesser in der Entstehungsphase und (E) Länge der längsten Wurzel, (F) Trockengewicht der Wurzel, (G) Wurzelvolumen und (H) Wurzel-zu-Spross-Verhältnis in der großen Wachstumsphase von Saccharum spp.-Klonen, die anhand der Phänotypisierungsstruktur (S. officinarum: Awela Green Sport, S. spontaneum: IND 85-490, S. sinense: Oshima, S. barberi: Putli Khajee, S. robustum: NG 77-237). Die Daten stellen den Mittelwert ± SEM dar (n = 3). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Anatomische Wurzelmerkmale des S. sinense-Klons Oshima. (A) Normale Wachstumsbedingungen und als Reaktion auf (B) Trockenheit und (C) Staunässestress. Maßstabsleisten = 100 μm. Abkürzungen: rh = Wurzelhaare; ae = lysigenöses Aerenchym; mx = Metaxylem; ex = Exodermis; ep = Epidermis. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 8: Exsudation der Wurzel. (A) Carboxylate, (B) Gesamtphenol, (C) Gesamtprotein, (D) Gesamtzucker und (E) gesamte freie Aminosäuren in der Keimphase in Saccharum spp.-Klonen (S. officinarum: Awela Green Sport, S. spontaneum: IND 85-490, S. sinense: Oshima, S. barberi: Putli Khajee, S. robustum: NG 77-221). Die Daten stellen den Mittelwert ± SEM dar (n = 3). Abkürzung: RFW = Wurzelfrischgewicht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
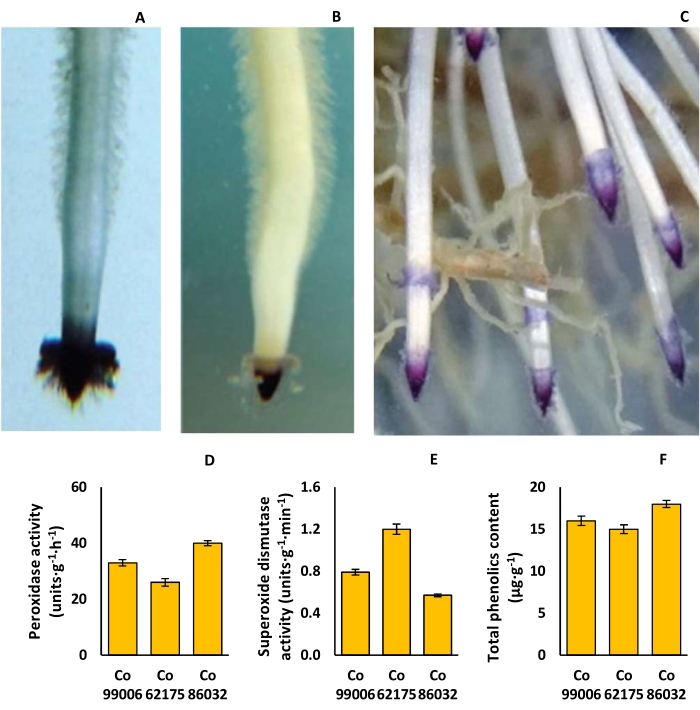
Abbildung 9: Rhizosphärenmerkmale in Zuckerrohrsorten. (A) Dreieckswurzelkappe in Co 62175, (B) kuppelförmige Wurzelkappe in Co 86032, (C) tiefviolette Pigmentierung der Wurzelspitze in Co 86032, (D) Peroxidase-Aktivität, (E) Superoxiddismutase-Aktivität und (F) Gesamtphenolgehalt von Pflanzen, die in der Hydrokultur gezüchtet wurden. Die Daten in D, E und F stellen den Mittelwert ± SEM dar (n = 3). Diese Abbildung wurde von Hari et al.9 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 10: Entwicklungsphasen der Verjüngung nach Wurzelverletzung bei Zuckerrohrsorten, die in der Hydrokultur gezüchtet wurden. (A-E) CoC 671 und (F-I) Co 06022; (A,F) unverletzte Wurzeln; (B,G) Wurzeln, die durch Längsschnitt verletzt wurden; (C,H) 3 Tage nach der Verletzung; (D,E,I) 10 Tage nach der Verletzung. Diese Abbildung wurde von Hari et al.9 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Querschnittsfläche der Wurzel (mm2) | Verhältnis von Kortex zu Stele | Anzahl der exodermalen Schichten | Anzahl der Metaxylemelemente | Durchschnittlicher Durchmesser des Metaxylems (mm) | Anzahl der Lufträume | Vom Metaxylem eingenommene Fläche (mm2) | Fläche der Lufträume (mm2) | |
| S. officinarum | 6936,3±200,2 kg | 0,508±0,015 | 1.00±0.03 Uhr | 6.00±0.17 Uhr | 8,5±0,3 kg | 14.00±0.40 Uhr | 340,3±9,8 kg | 1993.0±57.5 |
| S. spontaneum | Artikel-Nr.: 27646,8±957,7 | 0,481±0,017 | 2.00±0.07 Uhr | 13.00±0.45 Uhr | 6,6±0,2 kg | 32.00±1.11 Uhr | 444,5±15,4 kg | 4921,3±170,5 kg |
| S. sinense | 7539.1±261.2 | 0,727±0,025 | 2.00±0.07 Uhr | 9.00±0.31 Uhr | 6,0±0,2 kg | - | 254,3±8,8 kg | - |
| S. barberi | Artikel-Nr.: 18859,6±435,6 | 0,692±0,015 | 1.00±0.02 Uhr | 7.00±0.16 Uhr | 12,0±0,3 | 12.00±0.28 Uhr | 791,3±18,3 kg | Artikel-Nr.: 4454,6±102,8 |
| S. robustum | 8328.1±288.5 | 0,563±0,019 | 2.00±0.07 Uhr | 10.00±0.35 Uhr | 7,0±0,2 | - | 384,7±13,3 kg | - |
Tabelle 2: Anatomische Merkmale der Wurzel, die bei Klonen von Saccharum spp. beobachtet wurden. Die Daten beziehen sich auf den Mittelwert ± SEM (n = 3) (S. officinarum: Awela Green Sport, S. spontaneum: IND 85-490, S. sinense: Oshima, S. barberi: Putli Khajee, S. robustum: NG 77-237).
Diskussion
Das Wurzelsystem definiert die oberirdische Produktivität des Zuckerrohrs, so dass für die Entwicklung klimaresistenter Sorten alle seine Facetten erforscht und gründlich verstanden werden müssen. Ein Team von Wissenschaftlern am ICAR-SBI, bestehend aus Pflanzenphysiologen, einem Mikrobiologen, einem Agraringenieur, einem Biochemiker und Pflanzenzüchtern, wandte mehrgleisige Ansätze für die Phänotypisierung von Zuckerrohrwurzeln an, einschließlich Feldaushub durch Grabenprobenahme, die Verwendung eines Wurzelkernsammlers, erhöhte Plattformen für die Wurzelprobenahme und die Aufzucht von Pflanzen unter Hydrokultur. Da eine individuelle Methodik möglicherweise nicht erschöpfend und/oder exklusiv ist, ist die Integration von Informationen erforderlich, um die Komponentenmerkmale und Mechanismen eines idealen Wurzelphänotyps aufzudecken. Frühere Methoden der Wurzelprobenahme wurden in ihren Bemühungen isoliert, waren aber nützlich für die Entwicklung der hierin beschriebenen Strategie.
Venkatraman und Thomas5 leisteten Pionierarbeit bei der Erforschung von Zuckerrohrwurzeln, indem sie drei geeignete Untersuchungsmethoden beschrieben. Bei der ersten Methode wurde an der Seite einer Pflanze eine tiefe Grube gegraben, die es ermöglichte, die Wurzeln aus dem Boden zu sezieren, zu übertünchen und in ihrer natürlichen Position zu fotografieren. Bei der zweiten Methode wurden tiefe Gruben auf den gegenüberliegenden Seiten einer Pflanze ausgehoben. An den Seiten der an die Pflanze angrenzenden Gruben wurden 2er-Gerüste aus Drahtgeflecht angebracht, wobei Eisenstangen durch die Breite des dazwischenliegenden Bodens gesteckt wurden, um die Wurzeln in ihrer jeweiligen Position zu halten. Anschließend wurde die Erde mit Wasser gewaschen und die Wurzeln fotografiert. Eine dritte Methode bestand darin, spezielle Pflanzungen für die Wurzelforschung vorzunehmen. In einem ausgehobenen Grundstück wurde ein Drahtgeflecht auf bestimmten Ebenen verlegt, und die Baugrube wurde wieder verfüllt, wobei der Boden in seinen jeweiligen Schichten wie zuvor ersetzt wurde. Die zu untersuchenden Pflanzen wurden auf der Parzelle angebaut. Zum Zeitpunkt der Untersuchung wurde der Boden um die Pflanzen herum mit Wasser gewaschen, so dass das Wurzelsystem in den Maschen des Drahtgeflechts in Position blieb.
Rege und Wagle20 entwickelten eine Methode zur Wurzeluntersuchung unter bewässerten Bedingungen, indem sie eine Grube senkrecht am Rand des Rohres gruben und das Wurzelsystem freilegten, indem sie den Boden in einer bestimmten Zone wäschten. Sie verursachte die geringste Verschwendung des Pflanzenmaterials und ermöglichte es den Forschern, das Wurzelsystem vor Ort sowohl qualitativ als auch quantitativ zu untersuchen. In einer speziellen Studie wurden die Struktur, die Entwicklung und das Verhalten von Zuckerrohrwurzeln untersucht21. "Die Wurzelkastenmethode" und die "Bodenaushubmethode" erwiesen sich als sehr nützlich bei der Untersuchung der Verteilung der Zuckerrohrwurzeln. Es zeigte sich, dass es in schweren Böden mehr flache Wurzeln gab als in gemischten oder leichteren Böden. Die lockere Textur und die Belüftung, die bei letzterem vorherrschen, begünstigten das Eindringen der Wurzeln in tiefere Bodenzonen, was ihn für die Wurzelentwicklung zugänglicher machte. Die ersten Wurzeln, die sich entwickelten, wuchsen direkt nach unten in den Boden und drangen in Tiefen von mehr als 30-36 Zoll ein, gefolgt von flach ausbreitenden Wurzeln, die in den Oberflächenschichten (~14 Zoll vom Oberboden) beobachtet wurden. wobei ~85%-90% der Wurzeln verteilt sind. Die tieferen Wurzeln versorgten die Pflanzen in trockenen Perioden zweifellos mit Feuchtigkeit. Die Schnelligkeit des Wachstums der Wurzeln und Triebe variierte je nach den klimatischen Bedingungen des Anbaujahres und je nach Sorte. Die Erhaltung der Wurzeln unter aktiven physiologischen Bedingungen ist wichtig für ein optimales Pflanzenwachstum, da sie oft durch Anbaupraktiken gestört werden, die nach Möglichkeit vermieden werden müssen. Die Variabilität des Wurzelsystems bei ausgewählten Zuckerrohrsorten wurde in Kuba mit der "direkten Untersuchungsmethode" untersucht22. Es wurden Beschreibungen der Wurzelentwicklung sowie Abbildungen der Wurzelverteilung im Boden dokumentiert.
Die Feldausgrabung von Wurzeln durch Grabenprobenahme basierte auf den Arbeiten von Venkatraman und Thomas5, Rege und Wagle20 sowie Ryker und Edgerton21. Trotz der Tatsache, dass es sich um die aufwendigste und zeitaufwändigste Methode handelt, ist die In-situ-Feldprobenahme unerlässlich, um die Wurzelphänotypen in ihrer natürlichen Wachstumsumgebung zu verstehen. Ein Vergleich von Wurzelmessmethoden in Zuckerrüben und Getreide ergab, dass die Daten aus der Grabenprofilwand mit Vorsicht zu interpretieren sind, wobei die berechneten Wurzellängendichten (RLD) (Verhältnis von kumulativer Wurzellänge zu Bodenvolumen) je nach Bodentyp 4x-10x niedriger waren als die aus der Wurzelkernmethodeerhaltenen Methode 23. Ein angemessener und gleichmäßiger Abstand vom Graben zum Stamm ist wichtig, um einen minimalen Probenahmefehler zu gewährleisten und den Verlust von Wurzeln und Ressourcen, einschließlich Arbeitsaufwand, zu minimieren. Die Überwachung des Wurzelwachstums durch Grabenprobenahme ist für Langzeitexperimente möglicherweise nicht praktikabel, da sie von Natur aus zerstörerisch ist und nur ein kleiner Teil der Wurzel in der Betrachtungsebene sichtbar ist. Die Grabenprobenahme liefert jedoch eine Gesamtschätzung der Wurzelverteilung und der Wechselwirkung mit dem Bodenprofil24. Diese Untersuchung zur Ausbreitung des Wurzelsystems in kommerziellen Zuckerrohrhybriden ergab, dass ~70% der physiologisch aktiven Wurzeln innerhalb von 50 cm um das Bodenprofil zu finden waren.
Die Methode der Grabenprobenahme ermöglichte die Unterscheidung verschiedener Wurzelklassen nach ihrer Vorkommenstiefe im Bodenprofil. Im Allgemeinen waren die Wurzeln, die tiefer in den Boden eindrangen, in der Regel dünner als die in den flachen Zonen. Eine große genotypische Variabilität wurde in Bezug auf Wurzellänge, -volumen und -gewicht beobachtet. Fortschritte in der Modellierung und Simulation von Nutzpflanzen helfen bei der Verfeinerung der mit herkömmlichen Probenahmemethoden gewonnenen Daten durch die Entwicklung von Algorithmen zur Minimierung von Probenahmefehlern und experimenteller Heterogenität. Zuckerrohr-RLD-Daten aus einem In-situ-Bodenprofil wurden mit denen von Bodenkernbohrungen verglichen, wobei beobachtet wurde, dass das Zählen von Wurzelschnittpunkten in einem Bodenprofil und das Schätzen von RLD unter Verwendung eines Modells RLD-Werte ergab, die denen ähnelten, die mit der Bodenkernmethode25 erhalten wurden. Ein Vergleich von Daten aus Bodenaushub- und Kernbohrmethoden in Sojabohnen ergab ähnliche Schätzungen der Wurzelbiomasse, und der Aushub erforderte weniger Gesamtzeit und mehr Arbeit26. Die kernbasierten Proben waren präziser und ermöglichten die Probenahme in tieferen Wurzelzonen mit minimaler Störung des Versuchsfeldes. Angesichts des Vorteils, Pflanzenwurzeln in ihrer natürlichen Anbauumgebung zu untersuchen, kann die Probenahme von Gräben nützlich sein, um Bodenprofildaten und das RLD-Profil zu kombinieren, aber sie erleichtert nicht die Probenahme auf einer ausgedehnten Fläche27. In diesem Zusammenhang hat sich der Wurzelkernprobenehmer als sehr nützlich erwiesen, um die Wurzelverteilung zu quantifizieren und mehr Proben auf einer größeren Fläche zu ermöglichen.
Der Wurzelkernprobenehmer wurde entwickelt, um die Unterprobenahme von Wurzeln aus dem Feld zu erleichtern, was eine Gleichmäßigkeit der Probenahme mit einem niedrigeren Varianzkoeffizienten gewährleistet. Es hat die Probenahmefehler erheblich reduziert. Die Verwendung des Wurzelkernprobenehmers wurde in mehreren Kulturen übernommen; Es erfordert eine große Menge an Verarbeitungszeit nach der Probenahme, da viel Sorgfalt angewendet werden muss, um den Verlust von Wurzeln während des Waschenszu vermeiden 28. Der Kernprobenehmer ermöglichte die Probenahme von Wurzeln in einem festen Bodenvolumen und brachte die genotypische Variation zwischen den getesteten Klonen für Merkmale des Wurzelsystems heraus, so dass mehr Proben in einem bestimmten Zeitrahmen getestet werden konnten. Die RLD, die ein wichtiger Parameter zur Beurteilung der Pflanzengesundheit ist, kann mit Hilfe eines Wurzelkernsammlers präzise abgeleitet werden. Im Allgemeinen wird eine systematische Variation der Kernbohrstelle in Bezug auf den Abstand zum Stamm zugeschrieben, was zu deutlich unterschiedlichen Wurzeldaten führen kann. Im Falle von Zuckerrohr wurde der Probenehmer jedoch auf der Grundlage der einzigartigen Morphologie der Pflanze hergestellt, und der primäre Spross/das Rohr wird während der Probenahme daran befestigt. Dadurch wird für alle Sorten ein einheitlicher Kern mit einem Durchmesser von 16 cm um den Primärtrieb/Stock gewährleistet, um Probenahmefehler zu minimieren.
Es wurde eine signifikante Korrelation zwischen den mit der Wurzel-Scanner-Methode aufgezeichneten Wurzelvolumendaten und der Volumenverdrängungsmethode29 beobachtet. Da die Stichprobengröße viel geringer ist als bei der Grabenmethode, kann die Variabilität zwischen den Genotypen mit dem Wurzelkernsammler beurteilt werden. Zufällige Variationen aufgrund phänotypischer Plastizität, Bodenheterogenität und anderer unbekannter Faktoren beeinflussen die Zuverlässigkeit der von einem Wurzelkernsammler erhaltenen Daten, die durch wiederholte Messungen und den Einsatz von Simulationssoftware zur Eingrenzung funktional relevanter Unterschiede überwunden werden können27. Eine virtuelle Bewertung der Variation zwischen verschiedenen Bodenkernbohrstrategien in Mais, basierend auf dreidimensionalen Modellen der Wurzelsystemarchitektur und einem Flächengewichtungsalgorithmus30, zeigte, dass solche kosteneffizienten Methoden zur Erlangung zuverlässiger RLD-Schätzungen der Weg in die Zukunft für Wurzelstudien sein könnten.
Wurzelphänotypisierungsstrukturen mit angrenzenden Kompartimenten dienen dazu, das Feld zu simulieren und gleichzeitig die Homogenität zu erhalten, die für das Screening der inhärenten Variabilität des Zuckerrohrkeimplasmas erforderlich ist. Die Leichtigkeit der destruktiven Probenahme mit deutlich weniger Beschädigung und Verschwendung von Wurzeln als bei der Grabenprobenahme erleichtert die Analyse des gesamten Wurzelsystems in verschiedenen Phänophasen. Maßgeschneiderte Wurzelkästen oder -kammern, die auf der Morphologie und Wurzelverteilung der Pflanzen basieren, haben sich bei anderen Kulturen wie Sorghum31, Sojabohnen und Buchweizen32 als wirksam erwiesen. Ebenso wurden die Größe und Tiefe der Kammern optimiert, um das Wachstum von Zuckerrohr zu unterstützen. Darüber hinaus wurden die Seitenwände mit vorgefertigten Platten hergestellt, die bei der Wurzelprobenahme leicht manuell angehoben werden können. Die Wurzelproben werden entnommen, indem die Seitenwand manuell angehoben wird, gefolgt von einem Wasserstrahl, um die Wurzeln freizulegen. Anschließend werden die Seitenwände ausgetauscht und die Erde wieder aufgefüllt, um die angrenzenden Pflanzen so wenig wie möglich zu beschädigen. Die Variation der Wurzelmerkmale von Zuckerrohr und ihre Beziehung zum Sprosswachstum können bei Pflanzen dokumentiert werden, die in der Wurzelphänotypisierungsstruktur aufgezogen wurden. Übermäßige Bewässerung des Zuckerrohrs führt zu einem oberflächlichen Wurzelsystem, während ein Wassermangel die seitliche Ausbreitung mit leichter Tiefeneindringtiefe begünstigt33,34. Mit zunehmender Stickstoffapplikation wird das Wurzelgewicht reduziert, während sich phosphatische Düngemittel günstig auf die Wurzelentwicklung auswirken35,36. Benachbarte Kompartimente in der Struktur ermöglichen die Untersuchung solcher Reaktionen von Zuckerrohr auf unterschiedliche abiotische Belastungen und Bodennährstoffgehalte, indem die Menge des Bewässerungswassers manipuliert bzw. nährstoffarme Böden verwendet werden.
Die hydroponische Pflanzenkultur ist die Methode der Wahl, um die Nährstoffstressreaktionen in einer großen und vielfältigen Population von Genotypen in Sojabohnen12, Reis37, Weizen38 und Mais 39 zu bewerten. Simulierte Wurzeluntersuchungen in Zuckerrohr gehen auf das Jahr 192340 zurück, bei dem eine Kolonne von Steingutringen mit Drahtgeflecht verwendet wurde, um die relative Tiefe und den Grundriss der Wurzeln zu untersuchen. Zur kontinuierlichen Überwachung der Wurzelentwicklung wurde auch eine Hydrokultur mit Steingut-Kochtöpfen versucht, die mit verdünnter Knop-Lösung gefüllt waren. Eine hauseigene Hydrokulturanlage ermöglicht die Untersuchung der feineren Details der Wurzelentwicklung und der Veränderungen in der Rhizosphärenbiologie9. Die Behältergröße und die Pflanzdichte wurden für Zuckerrohr optimiert, wobei die Pflanzen bis zu 10 Monate lang mit minimalem Lagerplatz angebaut wurden. Die Merkmale der Rhizosphäre, einschließlich der Form der Wurzelkappe und der Pigmentierung der Wurzelspitzen, können nur unter hydroponischen Bedingungen beurteilt werden, was die Probenahme erleichtert und das Fehlen von Bodenanhaftungen erleichtert. Die Bewertung von Entwicklungs- und Stressreaktionen auf der Wurzelebene ist möglicherweise nicht möglich, wenn Pflanzen auf dem Feld angebaut werden, während die Hydrokultur solche Messungen ermöglicht. Es erleichtert die Sammlung und Charakterisierung von Wurzelexsudaten, was unter Feldbedingungen möglicherweise nicht möglich wäre. Obwohl das Fehlen physischer Barrieren für das Eindringen von Wurzeln ein großer Nachteil dieser Methode ist, ist die regelmäßige Überwachung des Wurzelwachstums ein Vorteil, wenn Pflanzen unter hydroponischen Bedingungen aufgezogen werden.
Es ist wichtig, die Architektur neuer Zuckerrohrsorten auf der Grundlage eines starken und idealen Wurzelphänotyps neu zu gestalten, der die Nachfrage nach nachhaltiger Landwirtschaft erfüllen kann. Hochdurchsatz-Phänotypisierungsplattformen für Wurzeln, die für Reis und Mais entwickelt wurden, umfassen Komponenten, die an eine Vielzahl von Wachstumssystemen angepasst werden können, wie z. B. Boden und Hydrokultur, fortschrittliche Wurzelbildgebungstechniken und Softwaretools41; Die Skalierung solcher Plattformen für Zuckerrohr bietet viel Spielraum für die Verbesserung der Produktivität in naher Zukunft. Trotz der Betonung der Wurzelbiologie als wichtiger Determinante für das Wachstum und die Produktivität von Zuckerrohr und der Verfügbarkeit fortschrittlicher Wurzelphänotypisierungstechniken haben nur wenige Studien über die Merkmale der Zuckerrohrwurzel an sich berichtet 42,43,44,45. Da Wurzeln die dynamischsten Pflanzenorgane sind, ist eine einzige Methode zur Bewertung der Variation der Wurzelphänotypen möglicherweise nicht schlüssig, insbesondere bei einer Kulturpflanze wie Zuckerrohr. Die Anwendung und Integration geeigneter Permutationen von Methoden im Einklang mit den Zielen der Studie sollte das Verständnis der unterirdischen Zuckerrohrsysteme verbessern.
Offenlegungen
Alle Autoren erklären, dass keine Interessenkonflikte bestehen.
Danksagungen
Die Autoren würdigen die Infrastruktur und die Unterstützung, die der Direktor des ICAR-Sugarcane Breeding Institute in Coimbatore für die Einrichtung von Wurzelphänotypisierungseinrichtungen für Zuckerrohr geleistet hat. Die vom Science and Engineering Research Board, Department of Science and Technology, Government of India, bereitgestellte Finanzierung in Form des Early Career Research Award an KV (ECR/2017/000738) wird gebührend gewürdigt. Die Autoren danken Brindha, Karpagam, Rajesh, Sivaraj und Amburose für ihre Unterstützung bei der akribischen Generierung von Daten.
Materialien
| Name | Company | Catalog Number | Comments |
| Aeration pump with pipeline accessories | Purchased from local sources | NA | Used for hydroponic culture of sugarcane |
| Boric acid | Sisco Research Laboratories, India | 80266 | Preparation of modified Hoagland's solution |
| Calcium nitrate | Central Drug House, India | 27606 | Preparation of modified Hoagland's solution |
| Composted coir pith | Purchased from local sources | NA | Used for germinating sugarcane setts |
| Cupric sulphate | Sisco Research Laboratories, India | 38869 | Preparation of modified Hoagland's solution |
| DEAE-cellulose | Sisco Research Laboratories, India | 10529 | anion exchange resin for processing of root exudates |
| EDTA-ferric monosodium salt | Sisco Research Laboratories, India | 59389 | Preparation of modified Hoagland's solution |
| Farm yard manure | Purchased from local sources | NA | Used for germinating sugarcane setts |
| Glass tanks | Fabricated in-house | NA | Used for hydroponic culture of sugarcane |
| HPLC | Agilent Technologies | 1200 Infinity | Quantification of organic acids in root exudates |
| Magnesium sulphate | Sisco Research Laboratories, India | 29117 | Preparation of modified Hoagland's solution |
| Manganese chloride | Sisco Research Laboratories, India | 75113 | Preparation of modified Hoagland's solution |
| Molybdic acid | Sisco Research Laboratories, India | 49664 | Preparation of modified Hoagland's solution |
| Potassium dihydrogen phosphate | Central Drug House, India | 29608 | Preparation of modified Hoagland's solution |
| Potassium nitrate | Central Drug House, India | 29638 | Preparation of modified Hoagland's solution |
| Protrays | Fabricated in-house | NA | Used for germinating sugarcane setts |
| Red soil | Purchased from local sources | NA | Used for germinating sugarcane setts |
| Root core sampler | Fabricated in-house | NA | Used for in situ root sampling |
| Sand | Purchased from local sources | NA | Used for germinating sugarcane setts |
| Seralite-120 | Sisco Research Laboratories, India | 14891 | cation exchange resin for processing of root exudates |
| Supporting frame | Purchased from local sources | NA | Used for hydroponic culture of sugarcane |
| Water motor pump | Purchased from local sources | NA | Used for hydroponic culture of sugarcane |
| Whatman filter paper grade 1 | Universal Scientific | 1001090 | Processing of root exudates |
| WinRhizo PRO (software) | Regent Instruments Inc., Canada | STD4800 | Two-dimensional root scanner with software for analysis of roots |
| Zinc sulphate | Sisco Research Laboratories, India | 76455 | Preparation of modified Hoagland's solution |
Referenzen
- Venkatraman, T. S., Thomas, R. Studies of sugarcane roots at different stages of growth. Agricultural Journal of India. 23, 166-176 (1928).
- Smith, D. M., Inman-Bamber, N. G., Thorburn, P. J. Growth and function of the sugarcane root system. Field Crops Research. 92 (2-3), 169-183 (2005).
- Glover, J. The behaviour of the root-system of sugarcane at and after harvest. Proceedings of the South African Sugar Technologists Association. 42, 133-135 (1968).
- Venkatraman, T. S., Thomas, R. Sugarcane root systems: Studies in development and anatomy. Agricultural Journal of India. 17 (4), 416-418 (1922).
- Saliendra, N. Z., Meinzer, F. C. Genotypic, developmental and drought-induced differences in root hydraulic conductance of contrasting sugarcane cultivars. Journal of Experimental Botany. 43 (9), 1209-1217 (1992).
- Gilbert, R. A., Rainbolt, C. R., Morris, D. R., Bennet, A. C. Morphological responses of sugarcane to long-term flooding. Agronomy Journal. 99 (6), 1622-1628 (2007).
- Shiotsu, F., Abe, J., Doi, T., Gau, M., Morita, S. Root morphology and anatomy of field-grown Erianthus arundinaceus. American Journal of Plant Sciences. 6 (1), 103-112 (2015).
- Hari, K., Vasantha, S., Anna Durai, A., Brindha, C., Shruthi, P. Sugarcane root growth and development in hydroponics system. Journal of Sugarcane Research. 7 (2), 71-82 (2017).
- Matsuoka, S., Garcia, A. A. F. Sugarcane underground organs: Going deep for sustainable production. Tropical Plant Biology. 4, 22-30 (2011).
- Koevoets, I. T., Venema, J. H., Elzenga, J. T. M., Testerink, C. Roots withstanding their environment: Exploiting root system architecture responses to abiotic stress to improve crop tolerance. Frontiers in Plant Science. 7, 1335 (2016).
- Vengavasi, K., Pandey, R. Root exudation index: Screening organic acid exudation and phosphorus acquisition efficiency in soybean genotypes. Crop and Pasture Science. 67 (10), 1096-1109 (2017).
- Bray, H. G., Thorpe, W. V. Analysis of phenolic compounds of interest in metabolism. Methods of Biochemical Analysis. 1, 27-52 (1954).
- Lowry, O. H., Rosebrough, N. J., Farr, A. L., Randall, R. J. Protein measurement with the folin phenol reagent. The Journal of Biological Chemistry. 193 (1), 265-275 (1951).
- Hedge, J. E., Hofreiter, B. T. Determination of total carbohydrate by anthrone method. Carbohydrate Chemistry: Volume 17. , (1962).
- Moore, S., Stein, W. H. Polyphenol oxidase. Methods in Enzymology. Vol 468. , (1948).
- Malik, C. P., Singh, M. B. . Plant Enzymology and Histo-enzymology: A text manual. , (1980).
- Beauchamp, C., Fridovich, I. Superoxide dismutase: Improved assays and an assay applicable to acrylamide gels. Analytical Biochemistry. 44, 276-287 (1971).
- Singleton, V. L., Rossi, J. A. Colorimetry of total phenolics with phosphomolybdic- phosphotungstic acid reagents. American Journal of Enology and Viticulture. 16, 144-158 (1965).
- Rege, R. D., Wagle, P. V. Problems of sugarcane physiology in the Deccan canal tract. III. The root-system. The Indian Journal of Agricultural Science. 2 (3), 356-373 (1940).
- Ryker, T. C., Edgerton, C. W. Studies on sugar cane roots. LSU Agricultural Experiment Station Reports. 223, (1931).
- Jensen, J. H. Some studies of root habits of sugar cane in Cuba. The Tropical Plant Research Foundation. , (1931).
- Kücke, M., Schmid, H., Spiess, A. A comparison of four methods for measuring roots of field crops in three contrasting soils. Plant and Soil. 172 (1), 63-71 (1995).
- Noordwijk, M., et al. Trench Profile Techniques and Core Break Methods. Root Methods: A handbook. , (2001).
- De Azevedo, M. C. B., Chopart, J. L., Medina, C. C. Sugarcane root length density and distribution from root intersection counting on a trench-profile. Scientia Agricola. 68 (1), 94-101 (2011).
- Nissen, T., Rodriguez, V., Wander, M. Sampling soybean roots: A comparison of excavation and coring methods. Communications in Soil Science and Plant Analysis. 39 (11-12), 1875-1883 (2008).
- Burridge, J. D., et al. An analysis of soil coring strategies to estimate root depth in maize (Zea mays) and common bean (Phaseolus vulgaris). Plant Phenomics. 2020, 3252703 (2020).
- Schroth, G., Kolbe, D. A method of processing soil core samples for root studies by subsampling. Biology and Fertility of Soils. 18, 60-62 (1994).
- Chandran, K., Nisha, M., Arun Kumar, R., Krishnapriya, V. Breeding varieties resistant to waterlogging. ICAR-SBI Annual Report 2016-17. , 128 (2016).
- Wu, Q., Wu, J., Zheng, B., Guo, Y. Optimizing soil-coring strategies to quantify root-length-density distribution in field-grown maize: Virtual coring trials using 3-D root architecture models. Annals of Botany. 121 (5), 809-819 (2018).
- Joshi, D. C., et al. Development of a phenotyping platform for high throughput screening of nodal root angle in sorghum. Plant Methods. 13, 56 (2017).
- Koyama, T., Murakami, S., Karasawa, T., Ejiri, M., Shiono, K. Complete root specimen of plants grown in soil-filled root box: Sampling, measuring, and staining method. Plant Methods. 17, 97 (2021).
- Gomathi, R., Gururaja Rao, P. N., Chandran, K., Selvi, A. Adaptive responses of sugarcane to waterlogging stress: An overview. Sugar Tech. 17, 325-338 (2014).
- Misra, V., et al. Morphological assessment of water stressed sugarcane: a comparison of waterlogged and drought affected crop. Saudi Journal of Biological Sciences. 27 (5), 1228-1236 (2020).
- Robinson, N., et al. Sugarcane genotypes differ in internal nitrogen use efficiency. Functional Plant Biology. 34 (12), 1122-1129 (2007).
- Arruda, B., et al. Biological and morphological traits of sugarcane roots in relation to phosphorus uptake. Journal of Soil Science and Plant Nutrition. 16 (4), 901-915 (2016).
- Sharma, S., Borah, P., Meena, M. K., Bindraban, P., Pandey, R. Evaluation of genotypic variation for growth of rice seedlings under optimized hydroponics medium. Indian Journal of Genetics and Plant Breeding. 78 (3), 292-301 (2018).
- Soumya, P. R., Singh, D., Sharma, S., Singh, A. M., Pandey, R. Evaluation of diverse wheat (Triticum aestivum) and triticale (× Triticosecale) genotypes for low phosphorus stress tolerance in soil and hydroponic conditions. Journal of Soil Science. 21, 1236-1251 (2021).
- Ganie, A. H., et al. Metabolite profiling and network analysis reveal coordinated changes in low-N tolerant and low-N sensitive maize genotypes under nitrogen deficiency and restoration conditions. Plants. 9 (11), 1459 (2020).
- Venkatraman, T. S., Thomas, R. Simple contrivances for studying root development in agricultural crops. Agricultural Journal of India. 18, 509-514 (1923).
- Clark, R. T., et al. High-throughput two-dimensional root system phenotyping platform facilitates genetic analysis of root growth and development. Plant, Cell and Environment. 36 (2), 454-466 (2013).
- Chopart, J. L., Rodrigues, S. R., Azevedo, M. C. B., Medina, C. C. Estimating sugarcane root length density through root mapping and orientation modelling. Plant and Soil. 313, 101-112 (2008).
- Chopart, J. L., Azevedo, M. C. B., Le Mezo, L., Marion, D. Functional relationship between sugarcane root biomass and length for cropping system applications. Sugar Tech. 12 (3-4), 317-321 (2010).
- De Silva, A. L. C., De Costa, W. A. J. M., Bandara, D. M. U. S. Growth of root system and the patterns of soil moisture utilization in sugarcane under rain-fed and irrigated conditions in Sri Lanka. Sugar Tech. 13 (3), 198-205 (2011).
- Otto, R., Silva, A. P., Franco, H. C. J., Oliveira, E. C. A., Trivelin, P. C. O. High soil penetration resistance reduces sugarcane root system development. Soil and Tillage Research. 117, 201-210 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten
Wir verwenden Cookies, um Ihre Erfahrung auf unserer Website zu verbessern.
Indem Sie unsere Website weiterhin nutzen oder auf „Weiter“ klicken, stimmen Sie zu, unsere Cookies zu akzeptieren.