Method Article
İn vivo Sıçanlarda Derin Beyin Stimülasyonunun İndüklediği Aktivite Kalıplarını Ortaya Çıkarmak için Pozitron Emisyon Tomografisi
Bu Makalede
Özet
Bu çalışmada, in vivo FDG-PET ile akut derin beyin stimülasyonunun neden olduğu metabolik nöromodülasyonu değerlendirmek için klinik öncesi deneysel bir yöntem tanımlanmıştır. Bu makale, stereotaksik cerrahiden stimülasyon tedavisinin uygulanmasına ve PET görüntülerinin elde edilmesi, işlenmesi ve analizine kadar tüm deneysel adımları içermektedir.
Özet
Derin beyin stimülasyonu (DBS), elektriksel darbelerin hastanın patofizyolojisinde rol oynayan beyin yapılarına uygulanmasına dayanan invaziv bir nöroşirürji tekniğidir. DBS'nin uzun geçmişine rağmen, etki mekanizması ve uygun protokolleri belirsizliğini koruyarak bu gizemleri çözmeyi amaçlayan araştırmalara duyulan ihtiyacı vurgulamaktadır. Bu anlamda, fonksiyonel görüntüleme teknikleri kullanılarak DBS'nin in vivo etkilerinin değerlendirilmesi, stimülasyonun beyin dinamiği üzerindeki etkisini belirlemek için güçlü bir stratejiyi temsil eder. Burada, DBS'nin beyin metabolizması üzerindeki akut sonuçlarını değerlendirmek için uzunlamasına bir çalışma [18F]-florodeoksikloklokoz pozitron emisyon tomografisi (FDG-PET) ile birlikte preklinik modeller (Wistar sıçanları) için deneysel bir protokol tanımlanmıştır. İlk olarak, hayvanlara elektrotların prefrontal kortekse bilateral implantasyonu için stereotaktik cerrahi uygulandı. Elektrot yerleşimini doğrulamak için her hayvanın cerrahi sonrası bilgisayarlı tomografi (BT) taraması yapıldı. İyileşmeden bir hafta sonra, stimülasyon olmadan ameliyat edilen her hayvanın ilk statik FDG-PET'i (D1) edinildi ve iki gün sonra (D2), hayvanlar uyarılırken ikinci bir FDG-PET edinildi. Bunun için elektrotlar, hayvanlara FDG uygulandıktan sonra izole bir uyarıcıya bağlandı. Böylece, FDG alım döneminde (45 dakika) hayvanlar uyarıldı ve DBS'nin beyin metabolizması üzerindeki akut etkileri kaydedildi. Bu çalışmanın keşifsel doğası göz önüne alındığında, FDG-PET görüntüleri, D1 ve D2 çalışmaları arasında eşleştirilmiş bir T-testine dayanan voksel tabanlı bir yaklaşımla analiz edilmiştir. Genel olarak, DBS ve görüntüleme çalışmalarının kombinasyonu, sinir ağları üzerindeki nöromodülasyon sonuçlarının tanımlanmasına izin verir ve sonuçta DBS'yi çevreleyen bilmecelerin çözülmesine yardımcı olur.
Giriş
Nörostimülasyon terimi, sinir sistemini terapötik bir amaçla uyarmayı amaçlayan bir dizi farklı tekniği kapsar1. Bunlar arasında, derin beyin stimülasyonu (DBS), klinik pratikte en yaygın nörostimülasyon stratejilerinden biri olarak öne çıkmaktadır. DBS, derin beyin çekirdeklerinin, stereotaktik cerrahi ile modüle edilmek üzere beyin hedefine yerleştirilen elektrotlar aracılığıyla, doğrudan hastanın vücuduna implante edilen bir nörostimülatör tarafından verilen elektriksel darbelerle uyarılmasından oluşur. Farklı nörolojik ve psikiyatrik bozukluklarda DBS uygulamasının fizibilitesini değerlendiren makalelerin sayısı sürekli artmaktadır2, ancak bunların sadece bir kısmı Gıda ve İlaç Birliği (FDA) tarafından onaylanmıştır (yani, esansiyel tremor, Parkinson hastalığı, distoni, obsesif-kompulsif bozukluk ve tıbbi olarak dirençli epilepsi)3 . Ayrıca, resmi olarak onaylanandan çok daha fazla patolojinin DBS tedavisi için çok sayıda beyin hedefi ve stimülasyon protokolü araştırılmaktadır, ancak bunların hiçbiri kesin olarak kabul edilmemektedir. DBS araştırması ve klinik prosedürlerdeki bu tutarsızlıklar kısmen etki mekanizmasının tam olarak anlaşılmamasından kaynaklanıyor olabilir4. Bu nedenle, DBS'nin beyin dinamikleri üzerindeki in vivo etkilerini deşifre etmek için büyük çabalar sarf edilmektedir, çünkü her ilerleme, ne kadar küçük olursa olsun, DBS protokollerini daha büyük terapötik başarı için rafine etmeye yardımcı olacaktır.
Bu bağlamda, moleküler görüntüleme teknikleri, DBS'nin in vivo nöromodülatör etkilerini gözlemlemek için doğrudan bir pencere açmaktadır. Bu yaklaşımlar, DBS'nin sadece uygulanırken etkisini belirleme fırsatı sunmakla kalmaz, aynı zamanda sonuçlarının doğasını çözme, istenmeyen yan etkileri ve klinik iyileşmeyi önleme ve hatta stimülasyon parametrelerini hastanın ihtiyaçlarına uyarlama fırsatı sunar5. Bu yöntemler arasında, 2-deoksi-2-[18F] floro-D-glukoz (FDG) kullanan pozitron emisyon tomografisi (PET), farklı beyin bölgelerinin aktivasyon durumu hakkında spesifik ve gerçek zamanlı bilgi sağladığı için özellikle ilgi çekicidir6. Spesifik olarak, FDG-PET görüntüleme, nöronlar ve glial hücreler arasındaki metabolik eşleşmenin fizyolojik prensibine dayanan nöral aktivasyonun dolaylı bir değerlendirmesini sağlar6. Bu anlamda, birkaç klinik çalışma FDG-PET kullanarak DBS modüle edilmiş beyin aktivite paternlerini bildirmiştir (inceleme için bkz.3 ). Bununla birlikte, klinik çalışmalar, hastalara odaklanırken, heterojenlik veya işe alım zorlukları gibi, araştırma potansiyellerini güçlü bir şekilde sınırlayan çeşitli dezavantajlara kolayca maruzkalmaktadır 6. Bu bağlam, araştırmacıları, biyomedikal yaklaşımları klinik çevirilerinden önce değerlendirmek veya klinik uygulamada zaten uygulanmışsa, terapötik faydaların veya yan etkilerin fizyolojik kökenini açıklamak için insan koşullarının hayvan modellerini kullanmaya yönlendirmektedir. Bu nedenle, insan patolojisi ile laboratuvar hayvanlarında modellenmiş durum arasındaki büyük mesafelere rağmen, bu klinik öncesi yaklaşımlar klinik uygulamaya güvenli ve etkili bir geçiş için gereklidir.
Bu makalede, DBS'nin beyin metabolizması üzerindeki akut sonuçlarını değerlendirmek için uzunlamasına bir FDG-PET çalışması ile birlikte murin modelleri için deneysel bir DBS protokolü açıklanmaktadır. Bu protokolle elde edilen sonuçlar, DBS tarafından beyin aktivitesinde indüklenen karmaşık modülatör kalıpların çözülmesine yardımcı olabilir. Bu nedenle, stimülasyonun sonuçlarını in vivo olarak incelemek için uygun bir deneysel strateji sağlanarak, klinisyenlerin belirli koşullar altında terapötik etkileri öngörmelerine ve daha sonra stimülasyon parametrelerini hastanın ihtiyaçlarına uyarlamalarına olanak tanır.
Protokol
Deneysel hayvan prosedürleri, Avrupa Toplulukları Konseyi Direktifi 2010/63/EU'ya göre yürütülmüş ve Gregorio Marañón Hastanesi Hayvan Deneyleri Etik Komitesi tarafından onaylanmıştır. Deneysel protokolün grafiksel bir özeti Şekil 1A'da gösterilmiştir.
1. İn vivo nörogörüntüleme ile beyin hedef lokalizasyonu
- Hayvan hazırlığı
NOT: ~300 g'lık erkek Wistar sıçanları kullanılmıştır.- Hayvanı bir anestezi indüksiyon kutusuna yerleştirin ve üstünü kapatın.
- Serofluran buharlaştırıcıyı açın (% 100O2'de indüksiyon için% 5). Sıçan anestezi uygulandığında, gaz akışını burun konisine geçirin. Sıçan pençesini sıkıştırarak anestezi durumunu onaylayın.
- Hayvan sırtüstü yatağını BT yatağına koyun, sevofluran anestezisini koruyun (% 100O2'de bakım için% 3).
- BT görüntüleme
NOT: Amper, voltaj, projeksiyon sayısı, çekim sayısı ve voksel çözünürlüğü seçimi BT tarayıcısına bağlıdır. Burada şu parametreler kullanıldı: 340 mA, 40 KV, 360 projeksiyon, 8 çekim ve 200 μm çözünürlük 7,8,9.- Yüz maskesini veya burun konisini sıçana sabitleyin.
- Sıçan gövdesini başına, omuzlarına, kalçalarına ve kuyruğuna zarar vermeden yeterli kısıtlama sağlamak için ipek bantla sabitleyin.
- Sıçanı sürekli izleyin.
- Kafayı BT tarayıcısının görüş alanının ortasına yerleştirin.
- Tarayıcının özelliklerine göre alma parametrelerini kullanarak BT görüntüsünü almaya devam edin.
- 10 dakika sonra, in vivo BT taraması tamamlandığında, sevofluran akışını durdurun ve sıçanı MRI tarayıcısına yerleştirin.
- MR görüntüleme
NOT: Tarama alma özellikleri, farklı yazılım sistemleri ve daha da önemlisi, belirli araştırma sorusu dahil olmak üzere tarayıcılar arasında farklılık gösterir. Burada 7-Tesla'lık bir tarayıcı kullanıldı. TE = 33 ms, TR = 3732 ms ve 0,8 mm (34 dilim) dilim kalınlığında, 3,5 x 3,5cm2 FOV ile 256 x 256 piksel matris boyutunda T2 ağırlıklı spin-echo dizisi kullanıldı.- Hayvan sırtüstü yatağını MRG yatağına koyun, sevofluran anestezisini koruyun (% 100O2'de bakım için% 3).
- MRG alımı sırasında baş hareketlerini önlemek için kafayı tarayıcı yatağına yerleştirilmiş stereotaktik bir çerçeveye sabitleyin. Ayrıca, sıçan gövdesinin geri kalanını ipek bantla sabitleyin.
- Kafayı MRI tarayıcısının görüş alanının ortasına yerleştirin.
- Pozisyon doğru olduğunda, MRI görüntüsünü almaya devam edin.
- İn vivo MRI taraması tamamlandığında, sevofluran akışını durdurun ve sıçanı kafesine yerleştirin.
- Kafesin yakınında bir ısıtma lambası bulun, çünkü sıçanlar genellikle tarama sırasında vücut ısılarını düşürür.
- Anesteziden iyileşene kadar sıçanı izleyin.
- Atlas ortak yerelleştirme ve hedef koordinatları hesaplama
- BT ve MRG görüntüleri alındıktan ve tarayıcının tavsiyelerine göre yeniden yapılandırıldıktan sonra, BT ve MRI görüntülerini birlikte kaydedin.
- Karşılıklı bilgilere dayalı otomatik bir katı kayıt algoritması kullanarak BT ve MRG'yi mekansal olarak normalleştirmek için bir görüntüleme işleme yazılımı kullanın10.
- Bregma hattını birlikte kayıtlı görüntüde lokalize edin ve Paxinos ve Watson sıçan beyin atlası11'e göre, Bregma'dan hedefe (yani, medial prefrontal korteks, mPFC) anterior/posterior (AP: +3.5 mm), orta hat / lateral (ML: +0.6 mm) ve dorsoventral (DV: -3.4 mm) eksendeki mesafeyi ölçün.
NOT: Bregma'dan hedefe giden koordinatlar, ağırlık, boyut, cinsiyet ve cins farklı olduğunda sıçanlar arasında farklılık gösterebilir.
2. Stereotaksik cerrahi
DİKKAT: Kullanmadan önce tüm cerrahi materyalleri, implantları ve stereotaksik üniteleri otoklav edin ve hayvan refahını etkileyebilecek enfeksiyon ve komplikasyonları önlemek için cerrahi alanı dezenfekte edin. Steril cerrahi eldivenler kullanın ve kontaminasyonu önlemek için hayvanı yapışkan örtülerle örtün.
- Hayvan hazırlama ve anestezi
- Hayvanlara ameliyattan bir gün önce intraperitoneal olarak 0.1 mg/kg buprenorfin uygulandı. Hayvanı bir anestezi indüksiyon kutusu odasına yerleştirin ve üstünü kapatın.
- Serofluran buharlaştırıcıyı açın (% 100O2'de indüksiyon için% 5).
- Sıçan yaslandığında, sevofluran buharlaştırıcısını kapatın ve sıçanı kutu odasından çıkarın.
- Hayvanı anestezik hale getirmek için intraperitoneal olarak ketamin (100 mg / kg) ve ksilazin (10 mg / kg) karışımı uygulayın.
- Hayvan tamamen uyuşturulana kadar bekleyin. Interdigital alanı sıkıştırarak anestezi seviyesini kontrol edin.
- Kulaklar ve gözler arasındaki alanı tıraş edin.
- Stereotaktik çerçeveye yerleştirme ve kraniyotomi
- Hayvanı stereotaktik çerçeve üzerinde yüzüstü pozisyona yerleştirin ve ameliyat sırasında hayvanı doğru pozisyonda tutmak için sıçanlar için baş tutma adaptörünü kullanın.
- Sıçan kulak çubuklarını kullanarak başın hareketsizliğini sağlayın. Kulak çubuklarının takılmasına dikkat edin, çünkü çok derin bir yerleştirme kulak zarına zarar verebilir.
- Ameliyat sırasında kuruluğu önlemek için gözlere oftalmik yağlama jeli uygulayın ve steril gazlı bezle örtün.
- Kirlenmeyi önlemek için yapışkan örtüler kullanarak hayvanı örtün.
- Tıraş edilen bölgeye iyodopovidon çözeltisi uygulayın ve steril gazlı bezle temizleyin.
- Lokal bölgeyi uyuşturmak için traş edilen bölgeye jel içinde mepivakain uygulayın.
- Kulaklar arasındaki kafatasının üzerinde yer alan deride, lambda'dan Bregma'ya (yani kafatası köşesinden gözlere doğru) 1.5-2 cm uzanan uzunlamasına bir kesi yapın.
- Kafatasını 2 veya 3 kelepçe yardımıyla ortaya çıkarın. Periosteumu pamuklu bir tomurcukla çıkarın ve Bregma'yı ve sagital sütürleri açığa çıkarmak için kanı tuzlu su çözeltisiyle temizleyin. Fazla tuzlu su çözeltisini gazlı bezle çıkarın.
- Diş çimento yapışmasını iyileştirmek için kafatası yüzeyini bir neşterle çizin. Alanı hidrojen peroksite batırılmış bir pamuk tomurcuğuyla temizleyin.
- Elektrot yerleştirme ve kafatasına sabitleme
- Ameliyat sırasında doğru yerleşimi sağlamak için elektrotları plastik cımbızla düzeltin.
NOT: Bu protokolde topraklı konsantrik bipolar platin-iridyum elektrotlar kullanılmaktadır. - Stereotaktik çerçevenin sağ kolunun tutucusuna bir elektrot yerleştirin.
NOT: Daha iyi sabitlemek için tutucuyu elektrota uyarlamak gerekebilir (bkz. Şekil 1B). Elektrotun tutucunun eksenine paralel olduğundan emin olun. - Elektrodu tutan sağ kolu stereotaksik çerçeve boyunca hareket ettirin ve elektrotun ucunu tam olarak Bregma'nın üzerine yerleştirin. Elektrot ucunu kafatasına mümkün olduğunca yaklaştırmaya çalışın, ancak elektrotun deformasyonunu önlemek için dokunmadan ve stereotaksik çerçeve tarafından sağlanan Bregma için ortaya çıkan koordinatları not edin. Kafatasında, elektrotun ilk konumunu cerrahi bir kalemle gösteren bir işaret yapın.
- Tutucuyu adım 1.4.3'te elde edilen AP ve ML koordinatlarına taşıyın ve elektrot hedefinin konumunu gösteren cerrahi bir kalemle kafatası üzerinde bir işaret yapın.
- Elektrodu tutan stereotaktik çerçevenin sağ kolunu çıkarın. Elektrotla hiçbir şeye dokunmamaya dikkat edin.
- Dura görünene kadar hedef pozisyonda kafatasından (yaklaşık 1-1,5 mm çapında) bir delik açmak için küçük bir elektrikli matkap kullanın. Bir pamuk tomurcuğu kullanarak herhangi bir kanamayı durdurun.
- Diş çimentosunun yüzey alanını artırmak ve zemini bulmak için 4 vidayı (tercihen 2-3 mm uzunluğunda paslanmaz çelik vidalar) bulmak için kafatası boyunca 4 delik açın. 4 vidayı takın.
- Stereotaktik çerçevenin sağ kolunu sağ elektrotla bulun. Kolu, delikle çakışması gereken hesaplanan konuma getirin. Ardından, elektrodu dura mater'e dokunana kadar indirin. Bu pozisyon DV yönünde 0 seviyesi olarak hizmet edecektir.
- Adım 1.4.3'teki DV konumunu kullanarak elektrotun ucunu DV yönünde yerleştirin. Elektrot bölgesinin etrafındaki kan ve beyin omurilik sıvısını pamuk tomurcuğu ile temizleyin.
- Toprağı elektroda en yakın vidalardan birine takın.
- Elektrot ve vidaların etrafına diş çimentosu uygulayın, diş çimentosunu keskin kenarlardan kaçınarak şekillendirmeye özen gösterin, bu da hayvana zarar verebilir. Diş çimentosu, doku/kafatasında aşırı ısınma/termal hasarı önlemek için bir tabaka halinde uygulanır. Kalın katmanlar, ek katmanlar eklenmeden önce iyileşmek için daha fazla zaman gerektirir. Elektrodu tutucudan çıkarmadan önce diş çimentosunun tamamen sertleştiğinden emin olun.
DİKKAT: Diş çimentosunun hazırlanması, çimentonun katılaşmasıyla biten karışımdan toksik buharların yayılmasını sağlar. Bu nedenle bu noktadan itibaren ve ameliyatın sonuna kadar kimyasal gazlara karşı etkili bir koruma maskesi takın. - Aynı prosedürü beynin diğer yarımküresi için 2.3.2-2.3.11 adımlarından tekrarlayın.
- Elektrodu örtmeden bir kapak oluşturmak için daha fazla diş çimentosu uygulayın. Sertleşene kadar bekleyin.
- Kapağın önünde ve arkasında dikiş atmak için üçgen iğneli örgülü doğal ipek emilemeyen dikiş 1/0 kullanın. Gerekirse, emilemeyen dikişleri, bulundukları vücut bölgesine göre belirli bir zamanda çıkarın. Cerrahi alanı dezenfekte etmek için bir iyodopovidon çözeltisi kullanın.
- Sıçanı stereotaktik çerçeveden çıkarın.
- Ameliyat sırasında doğru yerleşimi sağlamak için elektrotları plastik cımbızla düzeltin.
- Elektrot yerleştirme onayı için BT görüntüleme
- 1.2.4-1.2.5 adımlarını uygulayın ve Şekil 1C'ye bakın.
- İn vivo BT taraması tamamlandıktan sonra, sıçanı kafesine yerleştirin.
- 1.3.6 numaralı adımları izleyin. ve 1.3.7.
- Postoperatif bakım
- Postoperatif bakım olarak 5 gün boyunca antibiyotik (seftriakson, 100 mg/kg, deri altı) ve 3 gün boyunca analjezik (buprenorfin, 0.1 mg/kg, intraperitoneal) uygulayın. Bu antibiyotik rejimi, kapağın etrafında herhangi bir enfeksiyon belirtisi (kızarıklık, şişlik ve eksüda) gözlenirse 5 gün uzatılabilir.
- Her hayvanın günlük olarak görsel bir incelemesini yapın, ağrı veya sıkıntı belirtileri arayın ve kapağı iyodopovidon çözeltisi ile temizleyin.
- Ameliyattan sonra 1 haftaya kadar yoğun bakım sağlayın.
3. PET/BT görüntüleme alımı
NOT: Her hayvan, elektriksel stimülasyonun neden olduğu akut etkileri değerlendirmek için inhale anestezi altında iki PET / BT çalışmasına (yani, yokluğunda ve DBS uygulaması sırasında) tabi tutulur. Her iki tarama seansı da aynı görüntüleme edinme protokolünü izler, ameliyattan 1 hafta sonra (D1, stimülasyon olmadan) ve 2 gün sonra (DBS sırasında D2) gerçekleştirilir.
- Hayvan hazırlama ve anestezi
- Her PET taramasından önce sıçanı 8-12 saat boyunca hızlandırarak beynin FDG'yi daha iyi almasını sağlayarak sinyal-gürültü oranını12 artırır.
- Hayvanı bir anestezi indüksiyon kutusuna yerleştirin ve üstünü kapatın.
- Serofluran buharlaştırıcıyı açın (% 100O2'de indüksiyon için% 5).
- Sıçan anestezi uygulandığında, gaz akısını burun konisine geçirin.
- FDG enjeksiyonu ve alım süresi
DİKKAT: FDG bir radyotracer'dir, bu nedenle radyoaktiviteye maruz kalmayı önlemek için radyoproteksiyon önlemlerini göz önünde bulundurun. Kurumun radyoaktif bileşiklerle çalışmak için tüm izinlere sahip olduğunu onaylayın.- FDG şişesini, istenmeyen radyoaktiviteye maruz kalmayı önlemek için kullanılana kadar kurşun kaplı bir kabinin içinde tutun.
- Küçük bir şırıngayı (~27G), bir aktivimetrede ölçüldüğü gibi, mümkün olan daha az hacimde ~37 MBq FDG çözeltisi ile doldurun.
- Hayvanın kuyruğunun altına bir ısıtma yastığı yerleştirin veya kuyruk damarlarını genişletmek için kızılötesi ışık kullanın.
- Yanal damarlar kuyruğun zirvesinde belirginleştiğinde, bölgeyi sıhhi alkolle temizleyin (% 96).
- FDG çözeltisini lateral kuyruk damarlarından birinden enjekte edin, damara yörüngesine paralel bir şırınga ile yaklaşın ve iğnenin eğimi yukarı bakacak şekilde yaklaşın.
- Anesteziyi kapatın ve bir ısıtma lambasının altında tamamen iyileşmek için hayvanı kafesine geri yerleştirin.
- Görüntü alma oturumuna başlamadan önce 45 dakikalık radyotracer alımına izin verin. Bu süre zarfında, hayvanı uyanık ve kurşun korumalı bir odanın içinde tutun.
- D2 çalışması durumunda, FDG alım süresi boyunca aşağıda bölüm 4'te (Elektriksel stimülasyon uygulaması) açıklandığı gibi DBS'yi teslim edin.
- PET edinimi ve görüntüleme rekonstrüksiyonu
NOT: PET görüntü yakalama özellikleri tarayıcıya ve tarama süresine bağlıdır. Bu protokol için, 400-700 keV 7,8,9'luk bir enerji penceresi kullanılarak, küçük hayvan PET / BT tarayıcısı ile 45 dakika boyunca statik bir PET görüntüsü elde edildi. Satın alma protokolünü tasarlamadan önce PET/CT ekipmanının teknik özelliklerini gözden geçirin.- FDG enjeksiyonundan 45 dakika sonra, hayvanı bir anestezi indüksiyon kutusuna yerleştirin ve üstünü kapatın.
- Serofluran buharlaştırıcıyı açın (% 100O2'de indüksiyon için% 5).
- Hayvanı PET / BT yatağına aktarın ve sırtüstü pozisyonda yatırın, burnu anestezi burun konisine sabitleyin ve sevofluran anestezisini koruyun (% 100O2'de bakım için% 3). Sıçan pençesini sıkıştırarak anestezi durumunu onaylayın.
- 1.2.2 ve 1.2.3 numaralı adımları yineleyin.
- Kafayı PET tarayıcının görüş alanının ortasına yerleştirin.
- Tarayıcının spesifikasyonlarına göre alma parametrelerini kullanarak statik PET görüntüsünü elde edin.
- Bir 2D-OSEM (sıralı alt küme beklenti maksimize etme algoritması) kullanarak görüntüyü yeniden oluşturmaya devam edin vebozulma ve ölü zaman düzeltmeleri 7,8,9'u uygulayın.
- İn vivo PET taraması tamamlandığında, hayvanın tarayıcı yatağındaki baş pozisyonunu değiştirmeden BT edinimine devam etmek için sevoflurane akışını sıçana tutun.
- BT edinimi
- Hayvanın önceki PET edinimine göre konumunu değiştirmeden, BT görüntüsünü almaya devam edin.
- 1.2.3-1.2.5 arasındaki adımları yineleyin.
- İn vivo BT taraması tamamlandıktan sonra, sevofluran akışını durdurun ve sıçanı iyileşme için ilgili kafesine yerleştirin.
- 1.3.6 numaralı adımları izleyin. ve 1.3.7.
- Tamamen radyoaktivite bozunana kadar hayvanı kurşun korumalı bir odaya koyun.
4. Elektriksel stimülasyon yönetimi
NOT: Elektriksel stimülasyon, D2 görüntüleme seansında FDG alım periyodu sırasında verilir. Bu protokol için, stimülasyon, sabit akım modunda yüksek frekanslı (130 Hz) bir elektriksel stimülasyon, 150 μA ve 100 μs 7,13,14 darbe genişliğinde izole bir uyarıcı ile verildi.
- DBS uyarıcı yapılandırması
- İzole edilmiş uyarıcıyı ve gerekli telleri, hayvan kafesleri için yeterli alana ve potansiyel olarak rahatsız edici uyaranların minimum etkisine sahip geniş ve sessiz bir odada hazırlayın.
- Hayvanların kafesleri içinde ve uyarıcıda serbestçe hareket etmelerini sağlamak için stimülasyon tellerini dönerlere bağlayın.
- Stimülasyon parametrelerini çalışmanın ihtiyaçlarına göre ayarlayın.
- Mevcut modu, frekansı ve darbe genişliğini kontrol etmek için bir osiloskop kullanın. Bifazik dalga formunu dikdörtgen darbe şekliyle onaylayın (Şekil 1D).
- DBS teslimi
- D1 görüntüleme seansından sonra ve D2 edinimine kadar, hayvanları stimülasyon sistemine ve operatörün kullanımına alıştırmak için günlük bir alışkanlık protokolüne (45 dakika / gün) maruz bırakın ve D2'de istenmeyen stres tepkilerini önleyin. Stimülasyon sistemini her hayvana bağlayın, ancak stimülasyonu açmadan.
- Stimülatör kurulduktan ve hayvana FDG enjekte edildikten sonra, döner elektrotlara bağlayın ve uyarıcıyı açın.
- 45 dakika sonra, uyarıcıyı kapatın, hayvanı dönme hareketinden ayırın ve adım 3.3'e başlamak için hızlı bir şekilde anestezi indüksiyon odasına aktarın.
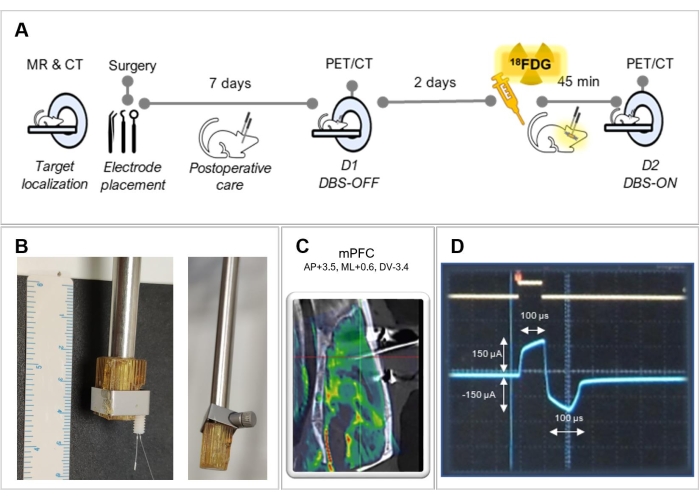
Şekil 1: Deneysel tasarım . (A) Bu protokolde izlenen deneysel adımların özeti. (B) Elektrotun daha iyi sabitlenmesi için bir tutucu adaptasyonunun temsili resimleri, (solda) ve (sağda) bir elektrot olmadan. (C) Bir MRG'nin ameliyat edilen bir hayvanın BT'si ile kaynaşmış görüntüsü, medial prefrontal kortekste (mPFC) doğru elektrot yerleşimini gösterir. (D) Bifazik stimülasyon dalga formunu gösteren osiloskop ekranının ekran görüntüsü. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
5. PET görüntü işleme ve analizi
NOT: Sonraki voksel istatistiksel analiz için karşılaştırılabilir veriler elde etmek üzere D1 ve D2'den gelen görüntülerde aynı görüntü işlemeyi izleyin.
- PET görüntülerinin mekansal kaydı
- Özel görüntüleme işleme yazılımı kullanın. Tüm kayıt iş akışı Şekil 2'de gösterilmiştir.
- Her PET ve BT görüntüsünü görüş alanına ortalayın ve kırpın. Karşılıklı bilgilere dayanan otomatik bir katı kayıt algoritması kullanarak PET görüntüsünü BT'sine kaydedin15.
NOT: Katı kayıt yöntemleri, yalnızca hayvanlar arasında vücut ağırlığı veya büyüklüğünde önemli bir fark olmamasına bakılmaksızın uygundur. Aksi takdirde, elastik yöntemler kullanmayı düşünün. - Her BT görüntüsünü, adım 5.1.2'de olduğu gibi Paxinos ve Watson sıçan beyin atlası11'e uzamsal olarak kayıtlı bir referans BT'ye kaydedin. Elde edilen dönüştürme parametrelerini kaydedin.
- Adım 5.1.3'te elde edilen dönüşüm parametrelerini uygulayın. Referans BT görüntüsüne kayıtlı PET görüntüsünü elde eden her kayıtlı PET görüntüsüne.
- Tüm son PET görüntülerini Nifti formatında kaydedin.
- Yoğunluk normalizasyonu ve PET görüntülerinin yumuşatılması
NOT: Yoğunluk normalleştirme ve yumuşatma, genel kullanıma açık kaynaklara dayalı farklı şirket içi komut dosyalarıyla gerçekleştirilir.- Olası kayıt hatalarını düzeltmek için PET görüntülerini 2 mm Tam Genişlikte Yarım Maksimum (FWHM) izotropik Gauss çekirdeği ile pürüzsüzleştirin.
NOT: Yumuşatma filtresinin boyutu, PET alımının çözünürlüğüne bağlı olacaktır, ancak FWHM'nin voksel boyutunun 2-3 katı kadar bir filtre kullanılması önerilir. - Uygun bir referans kümesi normalleştirme yöntemi16 kullanarak PET voksel değerlerinin yoğunluğunu normalleştirin.
- Bir beyin maskesini, kayıtlı bir referans MRG'den referans BT görüntüsüne segmentlere ayırın.
- Beynin dışındaki vokselleri voksel analizinden dışlamak için beyin maskesini her PET görüntüsüne uygulayın.
- Olası kayıt hatalarını düzeltmek için PET görüntülerini 2 mm Tam Genişlikte Yarım Maksimum (FWHM) izotropik Gauss çekirdeği ile pürüzsüzleştirin.
- Voksel bazında analiz
NOT: PET görüntü verilerinin voksel tabanlı analizinden oluşan istatistiksel analiz, özel görüntüleme analiz yazılımı17 kullanılarak gerçekleştirilmiştir.- D1 ve D2 PET görüntülerini, eşleştirilmiş bir T-testi kullanarak karşılaştırın ve yeterli istatistiksel anlamlı eşikler belirleyin.
- Analizin kesin sonuçları olarak, tip I hatalarını azaltmak için yalnızca 50 bitişik vokselden daha büyük kümeleri düşünün.
- Sonuçları, DBS (FDG azaltımı için soğuk renkler ve FDG artışı için sıcak renkler) tarafından indüklenen glikoz beyin metabolizmasındaki değişiklikleri gösteren bir T2 MRG üzerine yerleştirilmiş T-haritalarında temsil edin.

Şekil 2: Mikro PET/BT görüntüleme kayıt iş akışı. İstatistiksel Parametrik Haritalama (SPM) yazılımı ile sonraki voksel tabanlı analiz için PET görüntü uzamsal normalleştirme işlemenin ayrıntılı adımları. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Hayvanlar, çalışmanın sonunda veya hayvanın refahı tehlikeye girdiğinde CO2 kullanılarak kurban edildi. Ameliyat edilen bir hayvandan tam bir PET/BT çalışması örneği Şekil 3'te gösterilmiştir. Böylece, sıçan beynine yerleştirilen elektrot, Şekil 3A'da gösterilen BT görüntüsünde açıkça gözlemlenebilir. Bu görüntüleme yöntemi, fonksiyonel modalitelerin yapısal görüntülerden daha bulanık olma eğiliminde olduğu göz önüne alındığında, iyi anatomik bilgiler sağlar ve FDG-PET görüntülerinin kaydedilmesini kolaylaştırır (Şekil 3A, B). Ek olarak, aynı hayvanın FDG-PET ve BT görüntülerinin birleştirilmiş bir görüntüsü Şekil 3C'de gösterilmiştir.
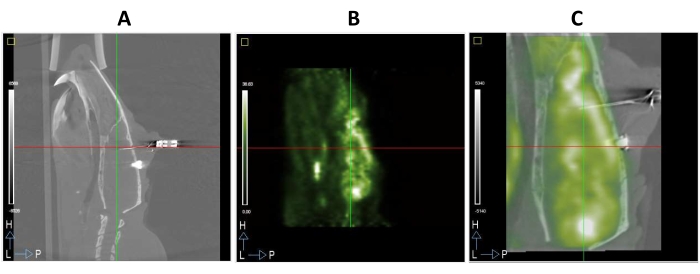
Şekil 3: Bir BT görüntüsünün mPFC. (A) Sagittal bölümüne implante edilen DBS elektrotları ile sıçan beyninin mikro PET/BT görüntülemesi. (B) A. (C) Kaynaşmış bir PET/BT görüntüsü, aynı stereotaksik alana mekansal olarak kayıtlı A ve B görüntülerinin üst üste binmesinden kaynaklanmıştır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
SPM12 yazılımı ile yapılan ve burada örnek olarak verilen voksel tabanlı analiz, aslında daha önce yayınlanmış bir çalışmaya ait olan D1 (DBS'nin yokluğu) ve D2 (FDG alımı sırasında DBS) çalışmaları arasında eşleştirilmiş bir T-testinden oluşuyordu8. Bu nedenle, Şekil 4 , her iki PET seansı arasındaki beyin metabolik farklılıklarını, referans BT görüntüsüne (CTref) kayıtlı bir MRG'den sıralı 1 mm kalınlığındaki beyin dilimleri üzerine bindirilmiş T-haritaları olarak göstermektedir. Bu farklılıklar sırasıyla sıcak ve soğuk renkler olarak gösterilen FDG alımındaki artış ve azalışlardan oluşuyordu. Ayrıca, analizden elde edilen istatistiksel sonuçların ayrıntılı bir özeti Tablo 1'de gösterilmiştir. Burada, modüle edilmiş beyin bölgesini, modülasyonun gözlendiği beyin yarımküresini, T istatistiğini, voksel sayısındaki kümenin büyüklüğünü (k), modülasyonun yönünü (yani, hipermetabolik veya hipometabolik değişiklikler) ve pik ve küme seviyelerinde elde edilen p-değerlerini gösteriyoruz. Bu tablo türü, dilim bindirme şeklinde gözlemlenen modülatör değişikliklerin ayrıntılı bir açıklaması olarak hizmet eder.
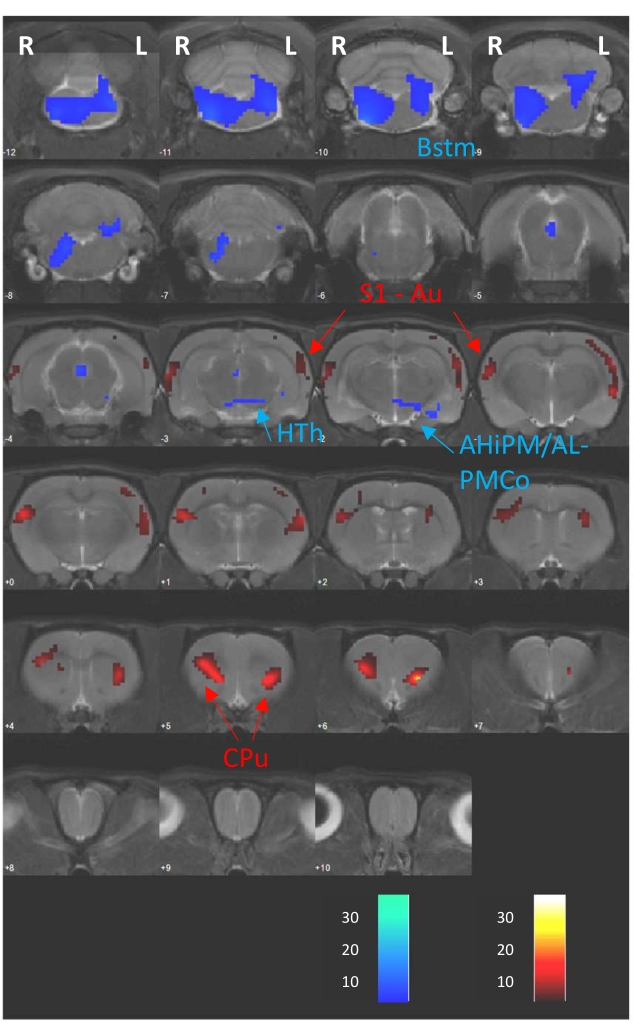
Şekil 4: Eşleştirilmiş T-testi sonuçları. Aynı CTref'e kayıtlı bir T2 MRG üzerine yerleştirilen voksel tabanlı analizden elde edilen T-haritaları, akut DBS protokolünün neden olduğu metabolik değişiklikleri gösterir (D2'ye karşı D1). Görüntünün altındaki renk çubukları, FDG alımının bölgesel artışlarına (sıcak renkler) ve azalışlarına (soğuk renkler) karşılık gelen T değerlerini temsil eder (p < 0,005; k > 50 voksel). Abbrev.: AHiPM/AL - Amigdalohipokampal alan posteromedial/anterolateral kısım, Au - İşitsel Korteks, Bstm - Beyin sapı, Cpu - Kadurat-putamen, HTh - Hipotalamus, L - Sol yarımküre, PMCo - Posteromedial kortikal amigdaloid çekirdek, R - Sağ yarımküre, S1 - Primer somatosensoriyel korteks. Bu rakam Casquero-Veiga ve ark.8'in izniyle değiştirilmiştir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
| D1 vs D2: Stimülasyon etkisi | |||||||
| Roi | Yan | T | k | ↓/↑ | p unç. tepe seviyesi | cesaret | cesaret |
| tepe seviyesi | küme düzeyi | ||||||
| cesaret | Ar-Ge | 18.39 | 1549 | ↓ | <0,001 | 0.432 | <0,001 |
| AHiPM/AL-PMCo - HTh | L | 10.39 | ↓ | <0,001 | 0.949 | ||
| Cpu | L | 37.56 | 738 | ↑ | <0,001 | 0.025 | <0,001 |
| S1-Au | 10.53 | ↑ | <0,001 | 0.947 | |||
| CPu-Pir | R | 17.74 | 695 | ↑ | <0,001 | 0.497 | <0,001 |
| S1-Au | 10.45 | ↑ | <0,001 | 0.948 | |||
Tablo 1: mPFC'de akut DBS sonrası beyin metabolizmasındaki değişiklikler. D1 vs D2: Stimülasyon etkisi. Yapılar: AHiPM/AL: Amigdalohipokampal alan posteromedial/anterolateral kısım, Au: İşitsel Korteks, Bstm: Beyin sapı, CPu: Kadurat-putamen, HTh: Hipotalamus, Pir: Piriform korteks, PMCo: Posteromedial kortikal amigdaloid çekirdek, S1: Primer somatosensoriyel korteks. ROI: İlgilenilen bölge. Yan: Sağ (R) ve Sol (L). T: t değeri, k: küme boyutu. Glikoz metabolizması: Artırın (↑) ve Azaltın (↓). p: p-değeri, unc.: düzeltilmemiş, FWE: Aile bilge hata düzeltme. Bu tablo Casquero-Veiga ve ark.8'in izniyle değiştirilmiştir.
Tartışmalar
Beyin fonksiyonlarının ve nöropsikiyatrik bozuklukların patofizyolojisinde yer alan sinir ağlarının anlaşılmasındaki ilerlemeler göz önüne alındığında, giderek daha fazla araştırma, DBS'nin çok çeşitli nörolojik temelli patolojilerdeki potansiyelini kabul etmektedir2. Bununla birlikte, bu tedavinin etki mekanizması belirsizliğini korumaktadır. Çeşitli teoriler, spesifik patolojik ve stimülasyon koşullarında elde edilen etkileri açıklamaya çalışmıştır, ancak önerilen çalışmaların heterojenliği, kesin sonuçlara ulaşmayı çok zorlaştırmaktadır4. Bu nedenle, büyük çabalara rağmen, gerçek bir fikir birliği yoktur, ancak DBS müdahalesi yapılan hasta sayısı18 artmaya devam etmektedir. Daha sonra, beyindeki DBS sonuçlarını in vivo olarak anlamak, hangi stimülasyon parametrelerinin ve stimülasyon protokollerinin her hastanın ihtiyaçları için daha uygun olduğunu ve böylece daha iyi bir başarı oranı elde edilmesini sağlayacaktır. Bu bağlamda, FDG-PET gibi non-invaziv fonksiyonel nörogörüntüleme yöntemleri, beyindeki elektriksel stimülasyonun doğrudan etkisi altında gerçekte neler olup bittiğine ışık tutmak için gereklidir. Örneğin, burada açıklanan uzunlamasına protokolde, DBS, D2 PET görüntüsünün radyotracer alım periyodu sırasında teslim edilir. Bu nedenle, D2 (DBS-ON) ve D1 (DBS-OFF) PET çalışmalarının karşılaştırılması, FDG'nin "metabolik yakalama" özellikleri, stimülasyon13,19 sırasında doğrudan meydana gelen kümülatif değişikliklerin kaydedilmesine izin verdiğinden, in vivo elektriksel stimülasyon tarafından modüle edilen beyin bölgelerinin görselleştirilmesini sağlar.
Toplamda, bu protokol DBS'nin beyindeki akut sonuçlarını in vivo olarak değerlendirmek için uygulanabilir bir stratejiyi tanımlamaktadır, ancak mevcut DBS parametre kombinasyonlarının ve protokollerinin çeşitliliği muazzamdır (örneğin, sürekli ve aralıklı tedaviler20, yüksek ve düşük frekanslı stimülasyon21) ve hatta DBS'nin etkileri, stimülasyon etkisi altında beyin ağındaki doğrudan değişikliklerin çıkarılması nedeniyle tedaviyle birlikte farklılıkgösterebilir22 . Ayrıca, DBS'nin önerildiği patolojilerin sayısının artması göz önüne alındığında olasılıkların sayısı daha da artmaktadır23. Bu nedenle, DBS tedavisine potansiyel yanıtı tahmin etmeyi sağlayan nöral aktivasyon paternlerini ortaya çıkarmayı amaçlayan uzunlamasına nörogörüntüleme çalışmaları özellikle klinik açıdan önemlidir24,25. Bu bağlamda, farklı DBS protokollerinin FDG-PET ile terapötik etkilerini değerlendiren çok sayıda klinik ve preklinik çalışma bulunmaktadır (derleme için bkz.3). Bu nedenle, çalışılan DBS protokolünün, tedavi altındaki patoloji ile ilişkili beyin metabolik paternine karşı koyduğu, hasta semptomlarının iyileşmesine neden olduğu ve DBS-PET yaklaşımlarının klinik yararlılığını kanıtladığı birkaç örnek vardır. Bunun bir örneği, tedaviye dirençli depresyonu olan hastalar için subkallozal singulat bölgesinin (SCC) uyarılmasında bulunur. SCC, depresyonu26 olan ilaçsız hastalarda metabolik olarak hiperaktiftir ve bu hiperaktivasyon, farmakolojik, psikoterapötik veya DBS tedavisi 27,28,29 ile depresyonun remisyonundan sonra normalleştirilir. Önemli olan, SCC metabolizması, yanıt vermeyenlere kıyasla stimülasyona başlamadan önce DBS'ye yanıt veren hastalarda daha yüksekti. Bu çalışma, SCC-DBS29'a verilen yanıtın tahmininde% 80'lik bir doğruluk gösterdi ve DBS için potansiyel hastaların seçiminde görüntüleme biyobelirteçlerinin önemini vurguladı. Bu nedenle, açıklanan bağlam, depresyonun beyin metabolik paternini, gelecekte diğer nöropsikiyatrik bozukluklara ve DBS protokollerine odaklanan benzer yaklaşımların temelini oluşturması gereken SCC-DBS ile elde edilen terapötik sonuçlarla haritalamayı amaçlayan FDG-PET çalışmalarının klinik başarı öyküsünü yansıtmaktadır.
Bu anlamda, FDG-PET kullanarak DBS'nin fizyolojik etkilerini gözlemlemek için, taranacak DBS protokolünün spesifik zamanlamasını dikkatlice düşünmek özellikle önemlidir. Bu nedenle, aynı DBS parametrelerinin ve aynı protokolün uygulanmasına rağmen, görüntü elde etme zamanlaması, gözlemlenen modülasyonun kökenini açıkça belirleyecektir, bu da elde edilen nihai yanıtta yer alan tüm faktörleri dikkate almayarak potansiyel yanlış anlamalara yol açabilir8. Bu nedenle, cerrahinin planlanması, sonraki tedavinin temelini atmada belirleyici olmakla birlikte, çalışılan stimülasyonun sonuçlarına uygun bir görüntü yakalama protokolünün tasarımı, uygulanan stimülasyon tedavisinin altında yatan moleküler mekanizmayı tam olarak anlamak için esastır. Bu doğrultuda, çeşitli faktörler belirli bir DBS protokolüne verilen yanıtı büyük ölçüde değiştirebilir (örneğin, stimülasyon parametreleri, elektrot yerleştirme, hedeflenen beyin yapısı, tedavi altındaki patoloji, DBS seanslarının süresi ve sıklığı, vb.) 7,8,30. FDG-PET çalışmasında toplanan verilerin yansıttığı fenomenler, görüntülerin elde edildiği terapi sırasındaki belirli zamana bağlı olacaktır. Daha sonra, tüm bu noktalar DBS kaynaklı modülasyonu keşfetmek ve bu tedavinin altında yatan mekanizmaları açıklamaya katkıda bulunmak için farklı araştırma fırsatları sunar.
Bu nedenle, kemirgen ve insan beynini birbirinden ayıran büyük farklılıklara rağmen, translasyonel protokollerin geliştirilmesi amacıyla her düzeyde yeterli uygulamalar uygulanmalıdır. Bu anlamda, DBS'nin elektrotların derin beyin yapılarına erişebilmesi için kraniyotomiye dayalı oldukça invaziv bir ameliyat gerektirdiği göz ardı edilmemelidir31. Bu noktada, iki önemli enfeksiyon ve enflamatuar reaksiyon kaynağı vardır: bir yandan, ameliyat sırasında beyin dokusunun doğrudan maruz kalması ve diğer yandan, iki eksojen elementin bir iç organa sokulması, stimülasyon hedefine doğru yörüngeleriyle bir ekleme izi yaratması32. Bu nedenle, cerrahi ekipmanın sterilizasyonu, temiz bir ameliyat alanının korunması ve antibiyotik ve analjezik tedavilere dayalı yeterli postoperatif bakım33 , deneğin müdahaleden ve en sağlıklı koşullarda en büyük faydayı elde etmesini sağlamak için esastır. Ayrıca, bu FDG-PET görüntüleme çalışmalarında özellikle önemlidir, çünkü cerrahi sonrası komplikasyonların ortaya çıkması, enflamatuar ve enfeksiyöz süreçlerin açıkça hipermetabolik sinyaller olarak görüldüğü göz önüne alındığında, radyotracer alım paternini değiştirebilir34, bu da tedaviye modifiye edilmiş bir yanıta veya DBS tarafından üretilen modülasyonun abartılmasına yol açabilir.
Bununla birlikte, bu deneysel metodoloji bazı sınırlamalara tabidir: Birincisi, DBS protokolleri genellikle uzun vadeli, sürekli ve kronik tedavilerdir. Burada, DBS'nin akut etkilerini gerçek zamanlı olarak değerlendirmek için bir nörogörüntüleme protokolü gösterilmiştir. Bu nedenle, nörogörüntüleme çalışmaları için önerilen zamanlama, DBS kaynaklı uzun vadeli modülasyon hakkında neredeyse gerçek zamanlı bilgi edinmek için yeterli olmayacaktır. Bununla birlikte, DBS kaynaklı yanıtları anlamak için temel bilgi olarak hizmet etmek üzere farklı uzunlamasına yaklaşımlar geliştirmek için zemin hazırlayabilir. İkincisi, bu yöntemi göstermek için sağlıklı hayvanlar kullanıldığından, açıklanan tekniklerin farklı patolojik koşullara uygulanması, daha iyi sonuçlar ve optimal refah koşulları sağlamak için adaptasyonlarını gerektirebilir. Son olarak, voksel tabanlı analizler, her zaman çoklu istatistiksel karşılaştırma probleminden etkilendikleri için güvenilir sonuçlar elde etmek için büyük örneklem boyutları ve / veya güçlü düzeltme faktörleri gerektirir. Bununla birlikte, DBS'nin FDG-PET kullanarak beyin metabolizması üzerindeki sonuçlarının voksel bilge bir yaklaşımla değerlendirilmesi, bu yöntemin içsel keşifsel doğası nedeniyle büyük bir avantajdır ve bu da önceden varsayımlara gerek kalmadan kapsamlı tüm beyin analizlerine izin verir.
DBS ve FDG-PET'i birleştirmenin açıklanan dezavantajlarına rağmen, bu yaklaşımlar geniş bir fırsat penceresi sunmaktadır. Bu nedenle, beyin metabolik bilgilerinin invaziv olmayan bir şekilde elde edilmesi, stimülasyon sırasında ve DBS tedavisi ile birlikte birçok farklı durumda denekten nörofizyolojik verilerin toplanabilmesi açısından büyük bir avantajdır. Ayrıca, FDG-PET, klinik ortamda, bu yöntemi motive eden translasyonel yaklaşımı güçlendiren bir nörogörüntüleme tekniğidir. Benzer şekilde, FDG-PET kullanımı özellikle uygun bir alternatiftir, çünkü diğer görüntüleme modalitelerinin aksine, elde edilen sinyal, nörostimülasyon sisteminden türetilen elektrik veya manyetik alanlardaki ikincil bozulmalardan etkilenmez, bu da hem görüntü kalitesini hem de sistem performansını bozabilir24. Öte yandan, DBS'nin modülatör sonuçlarını değerlendirmeye yönelik araştırma ilgisi, terapötik faydalarla sınırlı değildir. Aslında, DBS odaksal, modülatör ve kalıcı olmayan bir nörostimülasyon tedavisi olduğundan, moleküler görüntüleme teknikleri ile değerlendirilen nörofonksiyonel aktivite yollarının ve sistem35 tarafından sağlanan elektriksel uyaranlara yanıt olarak çözülmeye de yardımcı olabilir. Bu bilgi, sağlıklı ve patolojik koşullarda çözülmemiş nörofizyolojik gizemlerin deşifre edilmesinde özellikle değerli olabilir. Son olarak, bu makalede açıklanan metodoloji, DBS kaynaklı nöromodülasyonun in vivo etkilerini gözlemleme yeteneği sağlar ve uygulama sırasında stimülasyonun etkisini belirlemek için güçlü bir stratejidir. Kısacası, DBS'nin in vivo etkisini anlamak, bu tedavinin istenen ve istenmeyen etkilerini anlamaya, klinik iyileşmeyi tahmin etmeye ve nihayetinde stimülasyon protokollerini her hastanın ihtiyaçlarına uyarlamaya yardımcı olacaktır.
Açıklamalar
Yazarlar bu makale ile ilgili çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Prof. Christine Winter, Julia Klein, Alexandra de Francisco ve Yolanda Sierra'ya burada açıklanan metodolojinin optimizasyonunda paha biçilmez destekleri için teşekkür ederiz. MLS, Avrupa Bölgesel Kalkınma Fonu (ERDF) tarafından ortaklaşa finanse edilen "Avrupa'yı Yapmanın Bir Yolu" olan Ministerio de Ciencia e Innovación, Instituto de Salud Carlos III (proje numarası PI17/01766 ve hibe numarası BA21/0030) tarafından desteklenmiştir; CIBERSAM (proje numarası CB07/09/0031); Delegación del Gobierno para el Plan Nacional sobre Drogas (proje numarası 2017/085); Fundación Mapfre; ve Fundación Alicia Koplowitz. MCV, bu kurumun bursiyeri olarak Fundación Tatiana Pérez de Guzmán el Bueno ve AB Ortak Programı - Nörodejeneratif Hastalık Araştırması (JPND) tarafından desteklenmiştir. DRM, Consejería de Educación e Investigación, Comunidad de Madrid tarafından desteklendi ve Avrupa Sosyal Fonu "Geleceğinize Yatırım Yapmak" (hibe numarası PEJD-2018-PRE / BMD-7899) tarafından desteklendi. NLR, Instituto de Investigación Sanitaria Gregorio Marañón, "Programa Intramural de Impulso a la I+D+I 2019" tarafından desteklenmiştir. MD çalışmaları Ministerio de Ciencia e Innovación (MCIN) ve Instituto de Salud Carlos III (ISCIII) (PT20/00044) tarafından desteklenmiştir. CNIC, Instituto de Salud Carlos III (ISCIII), Ministerio de Ciencia e Innovación (MCIN) ve Pro CNIC Vakfı tarafından desteklenmektedir ve bir Severo Ochoa Mükemmeliyet Merkezidir (SEV-2015-0505).
Malzemeler
| Name | Company | Catalog Number | Comments |
| 7-Tesla Biospec 70/20 scanner | Bruker, Germany | SN0021 | MRI scanner for small animal imaging |
| Betadine | Meda Pharma S.L., Spain | 644625.6 | Iodine solution (iodopovidone) |
| Beurer IL 11 | Beurer | SN87318 | Infra-red light |
| Bipolar cable 50 cm w/50 cm mesh covering up to 100 cm | Plastics One, USA | 305-305 (CM) | |
| Bipolar cable TT2 50 cm up to 100 cm | Plastics One, USA | 305-340/2 | Bipolar cable TT2 50 cm up to 100 cm |
| Buprex | Schering-Plough, S.A | 961425 | Buprenorphine (analgesic) |
| Ceftriaxona Reig Jofré 1g IM | Laboratorio Reig Jofré S.A., Spain | 624239.1 | Ceftriaxone (antibiotic) |
| Commutator | Plastics One, USA | SL2+2C | 4 Channel Commutator for DBS |
| Concentric bipolar platinum-iridium electrodes | Plastics One, USA | MS303/8-AIU/Spc | Electrodes for DBS |
| Driller | Bosh | T58704 | Driller |
| FDG | Curium Pharma Spain S.A., Spain | ----- | 2-[18F]fluoro-2-deoxy-D-glucose (PET radiotracer) |
| Heating pad | DAGA, Spain | 23115 | Heating pad |
| Ketolar | Pfizer S.L., Spain | 776211.9 | Ketamine (anesthetic drug) |
| Lipolasic 2 mg/g | Bausch & Lomb S.A, Spain | 65277 | Ophthalmic lubricating gel |
| MatLab R2021a | The MathWorks, Inc | Support software for SPM12 | |
| MRIcro | McCausland Center for Brain Imaging, University of South Carolina, USA | v2.1.58-0 | Software for imaging preprocessing and analysis |
| Multimodality Workstation (MMWKS) | BiiG, Spain | Software for imaging processing and analysis | |
| Omicrom VISION VET | RGB Medical Devices, Spain | 731100 ReV B | Cardiorrespiratory monitor for small imaging |
| Prevex Cotton buds | Prevex, Finland | ----- | Cotton buds |
| Sevorane | AbbVie Spain, S.L.U, Spain | 673186.4 | Sevoflurane (inhalatory anesthesia) |
| Small screws | Max Witte GmbH | 1,2 x 2 DIN 84 A2 | Small screws |
| Standard U-Frame Stereotaxic Instrument for Rat, 18° Ear Bar | Harvard Apparatus, USA | 75-1801 | Two-arms Stereotactic frame for rat |
| Statistical Parametric Mapping (SPM12) | The Wellcome Center for Human Neuroimaging, UCL Queen Square Institute of Neurology, UK | SPM12 | Software for voxel-wise imaging analysis |
| STG1004 | Multi Channel Systems GmbH, Germany | STG1004 | Isolated stimulator |
| SuperArgus PET/CT scanner | Sedecal, Spain | S0026403 | NanoPET/CT scanner for small animal imaging |
| Suture thread with needle, 1/º | Lorca Marín S.A., Spain | 55325 | Braided natural silk non-absorbable suture 1/0, with triangle needle |
| Technovit 4004 (powder and liquid) | Kulzer Technique, Germany | 64708471; 64708474 | Acrylic dental cement for craniotomy tap |
| Wistar rats (Rattus norvergicus) | Charles River, Spain | animal facility | Animal model used |
| Xylagesic | Laboratorios Karizoo, A.A, Spain | 572599-4 | Xylazine (anesthetic drug) |
| Normon S.A., Spain | 602910 | Mepivacaine in gel for topical use |
Referanslar
- Gildenberg, P. L. Neuromodulation: A historical perspective. Neuromodulation. 1, 9-20 (2009).
- Lee, D. J., Lozano, C. S., Dallapiazza, R. F., Lozano, A. M. Current and future directions of deep brain stimulation for neurological and psychiatric disorders. Journal of Neurosurgery. 131 (2), 333-342 (2019).
- Casquero-Veiga, M. Preclinical molecular neuroimaging in deep brain stimulation. Complutense University of Madrid. , (2021).
- Blaha, C. D. Theories of deep brain stimulation mechanisms. Deep Brain Stimulation: Indictions and Applications. , 314-338 (2016).
- Fins, J. J. Deep brain stimulation: Ethical issues in clinical practice and neurosurgical research. Neuromodulation. 1, 81-91 (2009).
- Desmoulin-Canselier, S., Moutaud, B. Animal models and animal experimentation in the development of deep brain stimulation: From a specific controversy to a multidimensional debate. Frontiers in Neuroanatomy. 13, 51 (2019).
- Casquero-Veiga, M., Hadar, R., Pascau, J., Winter, C., Desco, M., Soto-Montenegro, M. L. Response to deep brain stimulation in three brain targets with implications in mental disorders: A PET study in rats. PLOS One. 11 (12), 0168689 (2016).
- Casquero-Veiga, M., García-García, D., Desco, M., Soto-Montenegro, M. L. Understanding deep brain stimulation: In vivo metabolic consequences of the electrode insertional effect. BioMed Research International. 2018, 1-6 (2018).
- Casquero-Veiga, M., García-García, D., Pascau, J., Desco, M., Soto-Montenegro, M. L. Stimulating the nucleus accumbens in obesity: A positron emission tomography study after deep brain stimulation in a rodent model. PLOS One. 13 (9), 0204740 (2018).
- Pascau, J., Vaquero, J. J., Abella, M., Cacho, R., Lage, E., Desco, M. Multimodality workstation for small animal image visualization and analysis. Scientific Papers. Molecular Imaging and Biology. 8, 97-98 (2006).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (1998).
- Roy, M., et al. A dual tracer PET-MRI protocol for the quantitative measure of regional brain energy substrates uptake in the rat. Journal of Visualized Experiments: JoVE. (82), e50761 (2013).
- Klein, J., et al. A novel approach to investigate neuronal network activity patterns affected by deep brain stimulation in rats. Journal of Psychiatric Research. 45 (7), 927-930 (2011).
- Soto-Montenegro, M. L., Pascau, J., Desco, M. Response to deep brain stimulation in the lateral hypothalamic area in a rat model of obesity: In vivo assessment of brain glucose metabolism. Molecular Imaging and Biology. , 830-837 (2014).
- Pascau, J., et al. Automated method for small-animal PET image registration with intrinsic validation. Molecular Imaging and Biology. 11 (2), 107-113 (2009).
- Andersson, J. L. R. How to estimate global activity independent of changes in local activity. Neuroimage. 244 (60), 237-244 (1997).
- . Wellcome Trust Centre for Neuroimaging SPM12-Statitstical Parametric Mapping Available from: https://www.fil.ion.ucl.ac.uk/spm/software/spm12/ (2022)
- Lozano, A. M., et al. Deep brain stimulation: current challenges and future directions. Nature Reviews Neurology. 15 (3), (2019).
- Boecker, H., Drzezga, A. A perspective on the future role of brain pet imaging in exercise science. NeuroImage. 131, (2016).
- Sprengers, M., et al. Deep brain stimulation reduces evoked potentials with a dual time course in freely moving rats: Potential neurophysiological basis for intermittent as an alternative to continuous stimulation. Epilepsia. 61 (5), 903-913 (2020).
- Middlebrooks, E. H., et al. Acute brain activation patterns of high- versus low-frequency stimulation of the anterior nucleus of the thalamus during deep brain stimulation for epilepsy. Neurosurgery. 89 (5), 901-908 (2021).
- Ashkan, K., Rogers, P., Bergman, H., Ughratdar, I. Insights into the mechanisms of deep brain stimulation. Nature Reviews Neurology. 13 (9), 548-554 (2017).
- Williams, N. R., Taylor, J. J., Lamb, K., Hanlon, C. A., Short, E. B., George, M. S. Role of functional imaging in the development and refinement of invasive neuromodulation for psychiatric disorders. World Journal of Radiology. 6 (10), 756-778 (2014).
- Rodman, A. M., Dougherty, D. D. . Nuclear medicine in neuromodulation. Neuromodulation in Psychiatry. , 81-99 (2016).
- Albaugh, D. L., Shih, Y. -. Y. I. Neural circuit modulation during deep brain stimulation at the subthalamic nucleus for Parkinson's disease: what have we learned from neuroimaging studies. Brain Connectivity. 4 (1), 1-14 (2014).
- Mayberg, H. S., et al. Reciprocal limbic-cortical function and negative mood: Converging PET findings in depression and normal sadness. Neurology, and Radiology. 156 (5), 675-682 (1999).
- Kennedy, S. H., et al. Differences in brain glucose metabolism between responders to CBT and Venlafaxine in a 16-week randomized controlled trial. American Journal of Psychiatry. 164 (5), 778-788 (2007).
- Kennedy, S. H., et al. Changes in regional brain glucose metabolism measured with positron emission tomography after paroxetine treatment of major depression. American Journal of Psychiatry. 158 (6), 899-905 (2001).
- Brown, E. C., Clark, D. L., Forkert, N. D., Molnar, C. P., Kiss, Z. H. T., Ramasubbu, R. Metabolic activity in subcallosal cingulate predicts response to deep brain stimulation for depression. Neuropsychopharmacology. 45, 1681-1688 (2020).
- Klooster, D. C. W., et al. Technical aspects of neurostimulation: Focus on equipment, electric field modeling, and stimulation protocols. Neuroscience & Biobehavioral Reviews. 65, 113-141 (2016).
- Kasoff, W., Gross, R. E. Deep brain stimulation: Introduction and Technical Aspects. Neuromodulation in Psychiatry. , 245-275 (2016).
- Perez-Caballero, L., et al. Early responses to deep brain stimulation in depression are modulated by anti-inflammatory drugs. Molecular Psychiatry. 19, 607-614 (2014).
- Solera Ruiz, I., UñaOrejón, R., Valero, I., Laroche, F. Craniotomy in the conscious patient. Considerations in special situations. Spanish Journal of Anesthesiology and Resuscitation. 60 (7), 392-398 (2013).
- Casali, M., et al. State of the art of 18F-FDG PET/CT application in inflammation and infection: a guide for image acquisition and interpretation. Clinical and Translational Imaging. 9 (4), 299-339 (2021).
- Gonzalez-Escamilla, G., Muthuraman, M., Ciolac, D., Coenen, V. A., Schnitzler, A., Groppa, S. Neuroimaging and electrophysiology meet invasive neurostimulation for causal interrogations and modulations of brain states. NeuroImage. 220, 117144 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır