Method Article
In vivo Tomografia por emissão de pósitrons para revelar padrões de atividade induzidos pela estimulação cerebral profunda em ratos
Neste Artigo
Resumo
Descrevemos um método experimental pré-clínico para avaliar a neuromodulação metabólica induzida por estimulação cerebral profunda aguda com FDG-PET in vivo. Este manuscrito inclui todas as etapas experimentais, desde a cirurgia estereotáxica até a aplicação do tratamento de estimulação e a aquisição, processamento e análise de imagens PET.
Resumo
A estimulação cerebral profunda (DBS) é uma técnica neurocirúrgica invasiva baseada na aplicação de pulsos elétricos a estruturas cerebrais envolvidas na fisiopatologia do paciente. Apesar da longa história da DBS, seu mecanismo de ação e protocolos apropriados permanecem obscuros, destacando a necessidade de pesquisas que visem resolver esses enigmas. Nesse sentido, avaliar os efeitos in vivo da DBS usando técnicas de imagem funcional representa uma estratégia poderosa para determinar o impacto da estimulação na dinâmica cerebral. Aqui, um protocolo experimental para modelos pré-clínicos (ratos Wistar), combinado com um estudo longitudinal [18F]-fluorodesoxiclucose tomografia por emissão de pósitrons (FDG-PET), para avaliar as consequências agudas da DBS no metabolismo cerebral é descrito. Primeiro, os animais foram submetidos à cirurgia estereotáxica para implantação bilateral de eletrodos no córtex pré-frontal. Uma tomografia computadorizada (TC) pós-cirúrgica de cada animal foi adquirida para verificar a colocação do eletrodo. Após uma semana de recuperação, um primeiro FDG-PET estático de cada animal operado sem estimulação (D1) foi adquirido e, dois dias depois (D2), um segundo FDG-PET foi adquirido enquanto os animais eram estimulados. Para isso, os eletrodos foram conectados a um estimulador isolado após a administração de FDG aos animais. Assim, os animais foram estimulados durante o período de captação do FDG (45 min), registrando os efeitos agudos da DBS no metabolismo cerebral. Dada a natureza exploratória deste estudo, as imagens FDG-PET foram analisadas por uma abordagem voxel-wise baseada em um teste T pareado entre os estudos D1 e D2. No geral, a combinação de DBS e estudos de imagem permite descrever as consequências da neuromodulação em redes neurais, ajudando a desvendar os enigmas em torno da DBS.
Introdução
O termo neuroestimulação engloba uma série de diferentes técnicas destinadas a estimular o sistema nervoso com um objetivo terapêutico1. Dentre elas, a estimulação cerebral profunda (ECP) destaca-se como uma das estratégias de neuroestimulação mais difundidas na prática clínica. A DBS consiste na estimulação de núcleos cerebrais profundos com pulsos elétricos entregues por um neuroestimulador, implantados diretamente no corpo do paciente, através de eletrodos colocados no alvo cerebral para serem modulados por cirurgia estereotáxica. O número de artigos que avaliam a viabilidade da aplicação da DBS em diferentes distúrbios neurológicos e psiquiátricos está crescendo continuamente2, embora apenas alguns deles tenham sido aprovados pela Food and Drug Association (FDA) (ou seja, tremor essencial, doença de Parkinson, distonia, transtorno obsessivo-compulsivo e epilepsia clinicamente refratária)3 . Além disso, um grande número de alvos cerebrais e protocolos de estimulação estão sob pesquisa para o tratamento DBS de muito mais patologias do que o oficialmente aprovado, mas nenhum deles é considerado definitivo. Essas inconsistências na pesquisa e nos procedimentos clínicos da DBS podem, em parte, ser devidas à falta de compreensão completa de seu mecanismo de ação4. Portanto, enormes esforços estão sendo feitos para decifrar os efeitos in vivo do DBS na dinâmica cerebral, pois cada avanço, por menor que seja, ajudará a refinar os protocolos DBS para um maior sucesso terapêutico.
Nesse contexto, as técnicas de imagem molecular abrem uma janela direta para observar in vivo os efeitos neuromoduladores da DBS. Essas abordagens oferecem a oportunidade não apenas de determinar o impacto da DBS enquanto ela está sendo aplicada, mas também de desvendar a natureza de suas consequências, prevenir efeitos colaterais indesejados e melhora clínica e até mesmo adaptar os parâmetros de estimulação às necessidades do paciente5. Dentre esses métodos, a tomografia por emissão de pósitrons (PET) utilizando 2-desoxi-2-[18F]fluoro-D-glicose (FDG) é de particular interesse porque fornece informações específicas e em tempo real sobre o estado de ativação de diferentes regiões cerebrais6. Especificamente, a imagem FDG-PET fornece uma avaliação indireta da ativação neural com base no princípio fisiológico do acoplamento metabólico entre neurônios e células gliais6. Nesse sentido, vários estudos clínicos relataram padrões de atividade cerebral modulados por DBS usando FDG-PET (ver3 para revisão). No entanto, os estudos clínicos incorrem facilmente em várias desvantagens quando se concentram nos pacientes, como heterogeneidade ou dificuldades de recrutamento, que limitam fortemente seu potencial de pesquisa6. Esse contexto leva os pesquisadores a utilizarem modelos animais de condições humanas para avaliar abordagens biomédicas antes de sua tradução clínica ou, se já aplicadas na prática clínica, para explicar a origem fisiológica dos benefícios terapêuticos ou efeitos colaterais. Assim, apesar das grandes distâncias entre a patologia humana e a condição modelada em animais de laboratório, essas abordagens pré-clínicas são essenciais para uma transição segura e eficaz para a prática clínica.
Este manuscrito descreve um protocolo experimental de DBS para modelos murinos, combinado com um estudo longitudinal FDG-PET, a fim de avaliar as consequências agudas da DBS no metabolismo cerebral. Os resultados obtidos com este protocolo podem ajudar a desvendar os intrincados padrões modulatórios induzidos na atividade cerebral pela DBS. Portanto, uma estratégia experimental adequada para examinar in vivo as consequências da estimulação é fornecida, permitindo que os médicos antecipem os efeitos terapêuticos em circunstâncias específicas e, em seguida, adaptem os parâmetros de estimulação às necessidades do paciente.
Protocolo
Os procedimentos experimentais em animais foram conduzidos de acordo com a Diretiva 2010/63/UE do Conselho das Comunidades Europeias e aprovados pelo Comitê de Ética em Experimentação Animal do Hospital Gregorio Marañón. Um resumo gráfico do protocolo experimental é mostrado na Figura 1A.
1. Localização do alvo cerebral por neuroimagem in vivo
- Preparação animal
NOTA: Foram utilizados ratos Wistar machos de ~300 g.- Coloque o animal em uma caixa de indução de anestesia e sele a parte superior.
- Ligue o vaporizador de sevoflurano (5% para indução em 100% O2). Quando o rato estiver anestesiado, mude o fluxo de gás para o cone nasal. Confirme o estado da anestesia apertando a pata do rato.
- Deitar o animal em decúbito dorsal no leito tomográfico, mantendo a anestesia com sevoflurano (3% para manutenção em 100% O2).
- Tomografia computadorizada (TC)
NOTA: A seleção de amperagem, tensão, número de projeções, número de disparos e resolução de voxel depende do scanner de TC. Aqui, foram utilizados os seguintes parâmetros: 340 mA, 40 KV, 360 projeções, 8 tiros e resolução de 200 μm 7,8,9.- Prenda a máscara facial ou o cone do nariz ao rato.
- Prenda o corpo do rato na cabeça, ombros, quadris e cauda com fita adesiva de seda para fornecer contenção suficiente sem danos.
- Monitore o rato continuamente.
- Localize a cabeça no centro do campo de visão do tomógrafo.
- Proceder à aquisição da imagem de TC utilizando parâmetros de aquisição de acordo com as especificações do scanner.
- Após 10 minutos, quando a tomografia computadorizada in vivo tiver sido concluída, pare o fluxo de sevoflurano e coloque o rato no scanner de ressonância magnética.
- Ressonância magnética
NOTA: As especificações de aquisição de digitalização variam entre os scanners, incluindo diferentes sistemas de software e, mais importante, a questão de pesquisa específica. Aqui, um scanner de 7 Tesla foi usado. Utilizou-se uma sequência de spin-eco ponderada em T2 7,8,9 com TE = 33 ms, TR = 3732 ms, e uma espessura de corte de 0,8 mm (34 fatias), tamanho de matriz de 256 x 256 pixels com FOV de 3,5 x 3,5 cm 2.- Deitar o animal em decúbito dorsal no leito de RM, mantendo a anestesia com sevoflurano (3% para manutenção em 100% O2).
- Prenda a cabeça a uma estrutura estereotáxica colocada no leito do scanner para evitar movimentos da cabeça durante a aquisição da ressonância magnética. Além disso, prenda o resto do corpo do rato com fita adesiva de seda.
- Localize a cabeça no centro do campo de visão do scanner de ressonância magnética.
- Uma vez que a posição esteja correta, prossiga para adquirir a imagem de ressonância magnética.
- Quando a ressonância magnética in vivo estiver completa, interrompa o fluxo de sevoflurano e coloque o rato em sua gaiola.
- Localize uma lâmpada de aquecimento perto da gaiola, porque os ratos geralmente reduzem a temperatura do corpo durante a varredura.
- Monitore o rato até a recuperação da anestesia.
- Colocalização do Atlas e cálculo das coordenadas de destino
- Uma vez que as imagens de TC e RM são adquiridas e reconstruídas seguindo as recomendações do scanner, co-registre as imagens de TC e RM.
- Utilizar um software de processamento de imagens para normalizar espacialmente a TC e a RM utilizando um algoritmo de registro rígido automático baseado em informações mútuas10.
- Localize a linha de Bregma na imagem co-registrada e meça a distância nos eixos anterior/posterior (AP: +3,5 mm), linha média/lateral (ML: +0,6 mm) e dorsoventral (DV: -3,4 mm) de Bregma ao alvo (ou seja, córtex pré-frontal medial, mPFC), de acordo com o atlas cerebral de ratos Paxinos e Watson11.
NOTA: As coordenadas de Bregma para o alvo podem diferir entre ratos quando peso, tamanho, sexo e raça são diferentes.
2. Cirurgia estereotáxica
CUIDADO: Autoclave todo o material cirúrgico, implantes e unidades estereotáxicas antes do uso e desinfete a área cirúrgica para evitar infecções e complicações que possam afetar o bem-estar animal. Use luvas cirúrgicas estéreis e cubra o animal com cortinas pegajosas para evitar a contaminação.
- Preparação e anestesia animal
- Os animais receberam 0,1 mg/kg de buprenorfina por via intraperitoneal no dia anterior à cirurgia. Coloque o animal em uma câmara de caixa de indução de anestesia e sele a parte superior.
- Ligue o vaporizador de sevoflurano (5% para indução em 100% O2).
- Quando o rato estiver reclinado, desligue o vaporizador de sevoflurano e retire o rato da câmara da caixa.
- Administrar por via intraperitoneal uma mistura de cetamina (100 mg/kg) e xilazina (10 mg/kg) para anestesiar o animal.
- Espere até que o animal esteja completamente anestesiado. Verifique o nível de anestesia apertando a área interdigital.
- Raspe a área entre as orelhas e os olhos.
- Colocação no quadro estereotáxico e craniotomia
- Coloque o animal na posição prona na estrutura estereotáxica e use o adaptador de retenção da cabeça para ratos para manter o animal na posição correta durante a cirurgia.
- Garanta a imobilidade da cabeça usando as barras auriculares de ratos. Tenha cuidado com a inserção das barras auriculares, pois uma inserção muito profunda pode danificar o tímpano.
- Aplique gel lubrificante oftálmico nos olhos para evitar o ressecamento durante a cirurgia e cubra-os com gaze estéril.
- Cubra o animal usando cortinas pegajosas para evitar a contaminação.
- Aplique a solução de iodopovidona na área raspada e limpe-a com gaze estéril.
- Aplique mepivacaína em gel sobre a área raspada para anestesiar a área local.
- Faça uma incisão longitudinal na pele que recobre o crânio entre as orelhas, estendendo-se 1,5-2 cm de lambda a Bregma (ou seja, do vértice craniano em direção aos olhos).
- Exponha o crânio com a ajuda de 2 ou 3 grampos. Retire o periósteo com um cotonete e limpe o sangue com solução salina para expor Bregma e as suturas sagitais. Remova o excesso de solução salina com gaze.
- Risque a superfície do crânio com um bisturi para melhorar a adesão do cimento dental. Limpe a área com um cotonete embebido em peróxido de hidrogênio.
- Colocação e fixação de eletrodos no crânio
- Endireitar os eletrodos com pinças plásticas para garantir a colocação correta durante a cirurgia.
NOTA: Eletrodos bipolares concêntricos de platina-irídio com o solo são usados neste protocolo. - Localize um eletrodo no suporte do braço direito da estrutura estereotáxica.
NOTA: Pode ser necessário adaptar o suporte ao eletrodo para fixá-lo melhor (ver Figura 1B). Certifique-se de que o eletrodo esteja paralelo ao eixo do suporte. - Mova o braço direito segurando o eletrodo através da estrutura estereotáxica e coloque a ponta do eletrodo exatamente sobre Bregma. Tente trazer a ponta do eletrodo o mais próximo possível do crânio, mas sem tocá-lo para evitar a deformação do eletrodo, e observe as coordenadas resultantes para Bregma fornecidas pelo quadro estereotáxico. Faça uma marca no crânio indicando a posição inicial do eletrodo com uma caneta cirúrgica.
- Deslocar o suporte para as coordenadas AP e ML obtidas no passo 1.4.3 e fazer uma marca no crânio com uma caneta cirúrgica que indique a posição do alvo do eléctrodo.
- Remova o braço direito da estrutura estereotáxica que segura o eletrodo. Tenha cuidado para não tocar em nada com o eletrodo.
- Use uma pequena broca elétrica para fazer um furo através do crânio (cerca de 1-1,5 mm de diâmetro) na posição alvo até que a dura-máter seja visível. Pare qualquer sangramento usando um cotonete.
- Faça 4 furos ao longo do crânio para localizar 4 parafusos (de preferência parafusos de aço inoxidável de 2-3 mm de comprimento) para aumentar a área de superfície do cimento dentário e localizar o solo. Fixe os 4 parafusos.
- Localize o braço direito do quadro estereotáxico com o eletrodo direito. Mova o braço para a posição calculada, que deve coincidir com o orifício. Em seguida, abaixe o eletrodo até que ele toque a dura-máter. Esta posição servirá como nível 0 na direção DV.
- Insira a ponta do eléctrodo na direcção DV, utilizando a posição DV no passo 1.4.3. Limpe o sangue e o líquido cefalorraquidiano ao redor da área do eletrodo com um cotonete.
- Fixe o aterramento a um dos parafusos mais próximos do eletrodo.
- Aplique cimento dentário ao redor do eletrodo e parafusos tomando o cuidado de moldar o cimento dentário evitando bordas afiadas, o que poderia ferir o animal. O cimento dentário é aplicado em uma camada para evitar o superaquecimento / lesão térmica no tecido / crânio. Camadas espessas requerem mais tempo para curar antes que camadas adicionais sejam adicionadas. Certifique-se de que o cimento dentário esteja completamente endurecido antes de remover o eletrodo do suporte.
CUIDADO: A preparação do cimento dentário produz a emanação de vapores tóxicos da mistura, o que termina com a solidificação do cimento. Portanto, use uma máscara de proteção eficaz contra gases químicos a partir deste ponto e até o final da cirurgia. - Repita o mesmo procedimento das etapas 2.3.2-2.3.11 para o outro hemisfério do cérebro.
- Aplique mais cimento dental para formar uma tampa sem cobrir o eletrodo. Espere até que ele endureça.
- Use sutura trançada de seda natural não absorvível 1/0, com uma agulha triangular, para sutura na frente e atrás da tampa. Se necessário, remova as suturas não absorvíveis em um determinado momento de acordo com a região do corpo onde estão localizadas. Use uma solução de iodopovidona para desinfetar a área cirúrgica.
- Remova o rato do quadro estereotáxico.
- Endireitar os eletrodos com pinças plásticas para garantir a colocação correta durante a cirurgia.
- Tomografia computadorizada (TC) para confirmação da colocação de eletrodos
- Execute as etapas 1.2.4-1.2.5 e consulte a Figura 1C.
- Uma vez que a tomografia computadorizada in vivo esteja completa, coloque o rato em sua gaiola.
- Siga as etapas 1.3.6. e 1.3.7.
- Cuidados pós-operatórios
- Administrar antibiótico (ceftriaxona, 100 mg/kg, subcutâneo) por 5 dias e analgésico (buprenorfina, 0,1 mg/kg, intraperitoneal) por 3 dias como cuidados pós-operatórios. Este regime antibiótico pode ser prolongado por 5 dias se quaisquer sinais de infecção (vermelhidão, inchaço e exsudato) forem observados ao redor da tampa.
- Realize uma inspeção visual de cada animal diariamente, procurando sinais de dor ou angústia, e limpe a tampa com solução de iodopovidona.
- Fornecer cuidados intensivos por até 1 semana após a cirurgia.
3. Aquisição de imagens PET/CT
NOTA: Cada animal é submetido a dois estudos PET/CT (ou seja, na ausência e durante a administração de DBS) sob anestesia inalatória para avaliar os efeitos agudos induzidos pela estimulação elétrica. Ambas as sessões de varredura seguem o mesmo protocolo de aquisição de imagem, sendo realizadas 1 semana após a cirurgia (D1, sem estimulação) e 2 dias depois (D2, durante a ECP).
- Preparação e anestesia animal
- Acelerar o rato por 8-12 h antes de cada PET scan, a fim de permitir uma maior captação cerebral de FDG, melhorando a relação sinal-ruído12.
- Coloque o animal em uma caixa de indução de anestesia e sele a parte superior.
- Ligue o vaporizador de sevoflurano (5% para indução em 100% O2).
- Quando o rato estiver anestesiado, mude o fluxo de gás para o cone nasal.
- Injeção de FDG e período de captação
CUIDADO: FDG é um radiotraçador, portanto, considere medidas de radioproteção para evitar a exposição à radioatividade. Confirme que a instituição tem toda a permissão para trabalhar com compostos radioativos.- Mantenha o frasco para injetáveis FDG dentro de um armário revestido de chumbo até ser utilizado para evitar a exposição indesejável à radioatividade.
- Encha uma seringa de calibre pequeno (~27G) com ~37 MBq da solução de FDG no menor volume possível, conforme medido num activimetro.
- Coloque uma almofada de aquecimento sob a cauda do animal ou use luz infravermelha para dilatar as veias da cauda.
- Uma vez que as veias laterais estejam evidentes no pico da cauda, limpe a área com álcool sanitário (96%).
- Injetar a solução de FDG através de uma das veias laterais da cauda, aproximando-se da veia com uma seringa paralela à sua trajetória e com o bisel da agulha voltado para cima.
- Desligue a anestesia e coloque o animal de volta em sua gaiola para se recuperar completamente sob uma lâmpada de aquecimento.
- Aguarde 45 minutos de captação do radiotraçador antes de iniciar a sessão de aquisição de imagem. Durante este período, mantenha o animal acordado e dentro de uma câmara blindada de chumbo.
- No caso do estudo D2, administrar DBS conforme explicado abaixo na secção 4 (Administração de estimulação elétrica) durante o período de captação de FDG.
- Aquisição de PET e reconstrução por imagem
NOTA: As especificações de aquisição de imagem PET dependem do scanner e do tempo de digitalização. Para este protocolo, uma imagem estática de PET foi adquirida por 45 min com um scanner PET/CT de animais de pequeno porte, utilizando uma janela de energia de 400-700 keV 7,8,9. Revise as especificações do equipamento PET/CT antes de projetar o protocolo de aquisição.- 45 min após a injeção de FDG, coloque o animal em uma caixa de indução de anestesia e sele o topo.
- Ligue o vaporizador de sevoflurano (5% para indução em 100% O2).
- Transfira o animal para o leito PET/CT e coloque-o em decúbito dorsal, prendendo o nariz ao cone nasal anestésico e mantendo a anestesia com sevoflurano (3% para manutenção em 100% O2). Confirme o estado da anestesia apertando a pata do rato.
- Repita as etapas 1.2.2 e 1.2.3.
- Localize a cabeça no centro do campo de visão do scanner PET.
- Adquira a imagem estática PET usando parâmetros de aquisição de acordo com as especificações do scanner.
- Prossiga para reconstruir a imagem usando um 2D-OSEM (algoritmo de maximização de expectativa de subconjunto ordenado) e aplique correções de decaimento e tempo morto 7,8,9.
- Quando a PET scan in vivo estiver completa, manter o fluxo de sevoflurano para o rato, a fim de proceder subsequentemente à aquisição da TC sem deslocar a posição da cabeça do animal no leito do scanner.
- Aquisição de TC
- Sem alterar a posição do animal em relação à aquisição anterior de PET, proceda à aquisição da imagem de TC.
- Repita as etapas 1.2.3-1.2.5.
- Uma vez concluída a tomografia computadorizada in vivo , interrompa o fluxo de sevoflurano e coloque o rato em sua respectiva gaiola para recuperação.
- Siga as etapas 1.3.6. e 1.3.7.
- Mantenha o animal em uma câmara blindada com chumbo até que a radioatividade decaia completamente.
4. Administração de estimulação elétrica
NOTA: A estimulação elétrica é administrada durante o período de captação de FDG na sessão de imagem D2. Para este protocolo, a estimulação foi realizada com um estimulador isolado, com estimulação elétrica de alta frequência (130 Hz) em modo de corrente constante, 150 μA, e largura de pulso de 100 μs 7,13,14.
- Configuração do estimulador DBS
- Prepare o estimulador isolado e os fios necessários em uma sala ampla e silenciosa, com espaço suficiente para as gaiolas dos animais e influência mínima de estímulos potencialmente perturbadores.
- Conecte os fios de estimulação aos giros para permitir que os animais se movam livremente dentro de suas gaiolas e ao estimulador.
- Defina os parâmetros de estimulação de acordo com as necessidades do estudo.
- Use um osciloscópio para verificar o modo atual, a frequência e a largura de pulso. Confirme a forma de onda bifásica com uma forma de pulso retangular (Figura 1D).
- Entrega de DBS
- Após a sessão de imagem D1 e até a aquisição da D2, submetem os animais a um protocolo de habituação diária (45 min/dia) para acostumá-los ao sistema de estimulação e ao manuseio do operador, evitando respostas indesejáveis ao estresse em D2. Conecte o sistema de estimulação a cada animal, mas sem ligar a estimulação.
- Uma vez que o estimulador tenha sido configurado e o animal tenha sido injetado com FDG, conecte o giro aos eletrodos e ligue o estimulador.
- Após 45 min, desligue o estimulador, desconecte o animal do giro e transfira-o rapidamente para uma câmara de indução anestésica para iniciar a etapa 3.3.
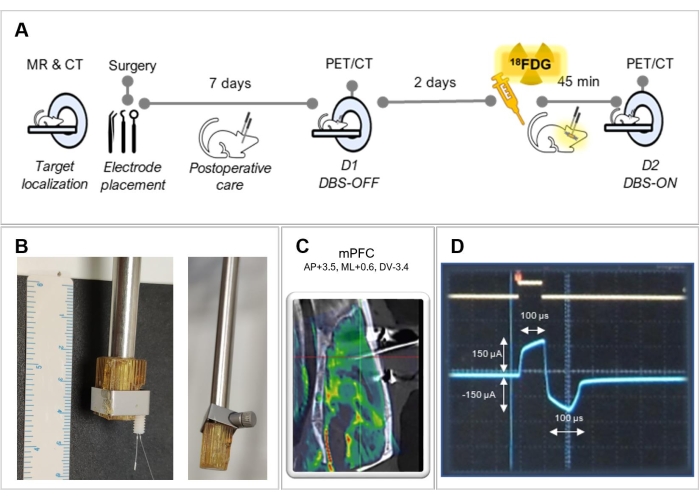
Figura 1: Delineamento experimental . (A) Resumo das etapas experimentais seguidas neste protocolo. (B) Imagens representativas de uma adaptação do suporte para melhor fixação do eletrodo, com (esquerda) e sem (direita) um eletrodo. (C) Imagem fundida de uma ressonância magnética com uma tomografia computadorizada de um animal operado, mostrando a correta colocação do eletrodo no córtex pré-frontal medial (mPFC). (D) Captura de tela da tela do osciloscópio mostrando a forma de onda de estimulação bifásica. Por favor, clique aqui para ver uma versão maior desta figura.
5. Processamento e análise de imagens PET
NOTA: Siga o mesmo processamento de imagem em imagens de D1 e D2 para obter dados comparáveis para análise estatística subsequente em termos de voxel.
- Registro espacial de imagens PET
- Use software especializado de processamento de imagens. Todo o fluxo de trabalho de registro é ilustrado na Figura 2.
- Centralize e corte cada imagem PET e CT no campo de visão. Registrar a imagem PET em seu CT usando um algoritmo de registro rígido automático baseado em informações mútuas15.
NOTA: Os métodos de registo rígidos só são adequados se não existirem diferenças significativas no peso corporal ou no tamanho entre os animais. Caso contrário, considere o uso de métodos elásticos. - Registre cada imagem de TC em uma TC de referência registrada espacialmente no atlas cerebral de ratos Paxinos e Watson11 como na etapa 5.1.2. Salve os parâmetros de transformação resultantes.
- Aplicar os parâmetros de transformação obtidos na etapa 5.1.3. a cada imagem PET registrada obtendo-se a imagem PET registrada na imagem CT de referência.
- Salve todas as imagens PET finais no formato Nifti.
- Normalização da intensidade e suavização das imagens PET
NOTA: A normalização e a suavização da intensidade são executadas com diferentes scripts internos com base nos recursos disponíveis publicamente.- Alise as imagens PET com um núcleo gaussiano isotrópico de 2 mm de Full-Width Half Maximum (FWHM) para corrigir possíveis erros de registro.
NOTA: O tamanho do filtro de alisamento dependerá da resolução da aquisição de PET, mas recomenda-se usar um filtro de 2-3 vezes o tamanho do voxel do FWHM. - Normalizar a intensidade dos valores de voxel PET usando um método de normalização de cluster de referência apropriado16.
- Segmente uma máscara cerebral de uma ressonância magnética de referência registrada para a imagem de TC de referência.
- Aplique a máscara cerebral a cada imagem PET para excluir voxels fora do cérebro da análise voxel-wise.
- Alise as imagens PET com um núcleo gaussiano isotrópico de 2 mm de Full-Width Half Maximum (FWHM) para corrigir possíveis erros de registro.
- Análise Voxel-wise
NOTA: A análise estatística, que consistiu em uma análise voxel-wise dos dados da imagem PET, foi realizada utilizando um software especializado de análise de imagem17.- Compare as imagens de PET D1 e D2 usando um teste T pareado, estabelecendo limiares estatisticamente significativos adequados.
- Considere como resultados definitivos da análise apenas os clusters maiores que 50 voxels adjacentes para reduzir os erros do tipo I.
- Representar os resultados em mapas T sobrepostos em uma ressonância magnética T2, mostrando as alterações no metabolismo cerebral da glicose induzidas pelo DBS (cores frias para redução de FDG e cores quentes para incremento de FDG).

Figura 2: Fluxo de trabalho de registro de imagens de micro PET/CT. Etapas detalhadas do processamento de normalização espacial de imagens PET para posterior análise voxel-wise com o software Statistical Parametric Mapping (SPM). Por favor, clique aqui para ver uma versão maior desta figura.
Resultados
Os animais foram sacrificados com CO2 ao final do estudo ou quando o bem-estar do animal estava comprometido. Um exemplo de um estudo completo de PET/CT de um animal operado é mostrado na Figura 3. Assim, o eletrodo inserido no cérebro do rato pode ser claramente observado na imagem da TC mostrada na Figura 3A. Essa modalidade de imagem fornece boas informações anatômicas e facilita o registro de imagens FDG-PET, uma vez que as modalidades funcionais tendem a ser mais borradas do que as imagens estruturais (Figuras 3A,B). Além disso, uma imagem mesclada das imagens FDG-PET e CT do mesmo animal é mostrada na Figura 3C.
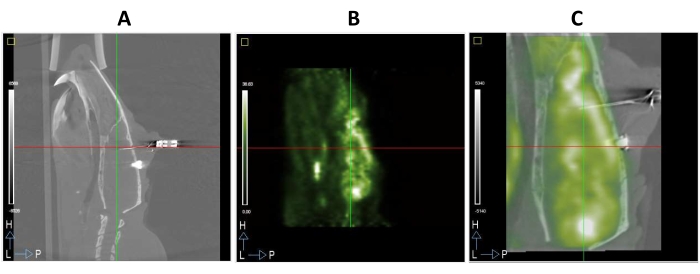
Figura 3: Micro PET/CT do cérebro de rato com eletrodos DBS implantados no mPFC . (A) Seção sagital de uma imagem de TC. (B) Secção sagital de uma imagem FDG-PET do mesmo animal que em A. (C) Uma imagem PET/CT fundida resultou da sobreposição de imagens A e B registadas espacialmente no mesmo espaço estereotáxico. Por favor, clique aqui para ver uma versão maior desta figura.
A análise voxel-wise realizada com o software SPM12 e aqui fornecida como exemplo consistiu em um teste T pareado entre os estudos D1 (ausência de DBS) e D2 (DBS durante a captação do FDG), que na verdade pertencem a um estudo previamente publicado8. Portanto, a Figura 4 mostra as diferenças metabólicas cerebrais entre ambas as sessões de PET como mapas T sobrepostos em cortes cerebrais sequenciais de 1 mm de espessura de uma RM registrada para a imagem de referência da TC (CTref). Essas diferenças consistiram em aumentos e diminuições na captação de FDG mostrados como cores quentes e frias, respectivamente. Além disso, um resumo detalhado dos resultados estatísticos obtidos a partir da análise é mostrado na Tabela 1. Aqui, indicamos a região modulada do cérebro, o hemisfério cerebral no qual a modulação é observada, a estatística T, o tamanho do cluster no número de voxels (k), a direção da modulação (ou seja, alterações hipermetabólicas ou hipometabólicas) e os valores de p obtidos nos níveis de pico e cluster. Este tipo de tabela serve como uma descrição detalhada das mudanças modulatórias observadas na figura de sobreposição de fatia.
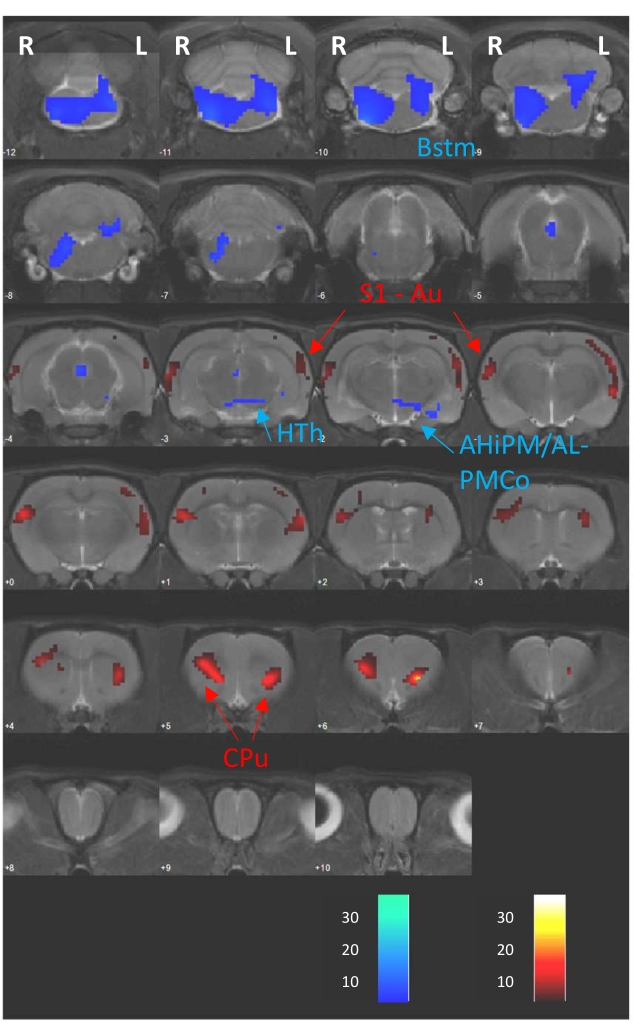
Figura 4: Resultados do teste T pareado. T-maps resultantes da análise voxel-wise sobrepostos em uma RM T2 registrada para a mesma TCref, mostrando as alterações metabólicas induzidas por um protocolo DBS agudo (D2 vs. D1). As barras de cores na parte inferior da imagem representam valores de T correspondentes a aumentos regionais (cores quentes) e diminuições (cores frias) da absorção de FDG (p < 0,005; k > 50 voxels). Abbrev.: AHiPM/AL - Amygdalohippocampal area posteromedial/anterolateral part, Au - Córtex Auditivo, Bstm - Tronco Encefálico, Cpu - Caudado-putâmen, HTh - Hipotálamo, L - Hemisfério esquerdo, PMCo - Núcleo amigdalóide cortical pós-eromedial, R - Hemisfério direito, S1 - Córtex somatossensorial primário. Esta figura foi modificada com permissão de Casquero-Veiga et al.8. Por favor, clique aqui para ver uma versão maior desta figura.
| D1 vs D2: Efeito de estimulação | |||||||
| Roi | Lado | T | k | ↓/↑ | p unc. nível de pico | FWE | FWE |
| nível de pico | nível de cluster | ||||||
| Bstm | R&L | 18.39 | 1549 | ↓ | <0,001 | 0.432 | <0,001 |
| AHiPM/AL-PMCo - HTh | L | 10.39 | ↓ | <0,001 | 0.949 | ||
| CPU | L | 37.56 | 738 | ↑ | <0,001 | 0.025 | <0,001 |
| S1-Au | 10.53 | ↑ | <0,001 | 0.947 | |||
| CPu-Pir | R | 17.74 | 695 | ↑ | <0,001 | 0.497 | <0,001 |
| S1-Au | 10.45 | ↑ | <0,001 | 0.948 | |||
Tabela 1: Alterações no metabolismo cerebral após DBS aguda em mPFC. D1 vs D2: Efeito de estimulação. Estruturas: AHiPM/AL: Área amigdalohipocampal parte póstero-medial/anterolateral, Au: Córtex Auditivo, Bstm: Tronco Encefálico, CPu: Caudado-putâmen, HTh: Hipotálamo, Pir: Córtex piriforme, PMCo: Núcleo amigdalóide cortical pós-eromedial, S1: Córtex somatossensorial primário. ROI: Região de interesse. Lateral: Direita (R) e Esquerda (L). T: valor t, k: tamanho do cluster. Metabolismo da glicose: Aumento (↑) e Diminuição (↓). p: p-valor, unc.: não corrigido, FWE: Correção de erros em termos familiares. Esta tabela foi modificada com permissão de Casquero-Veiga et al.8.
Discussão
Dados os avanços na compreensão da função cerebral e das redes neurais envolvidas na fisiopatologia dos transtornos neuropsiquiátricos, cada vez mais pesquisas estão reconhecendo o potencial da DBS em uma ampla gama de patologias de base neurológica2. No entanto, o mecanismo de ação desta terapia permanece incerto. Diversas teorias têm tentado explicar os efeitos obtidos em circunstâncias patológicas e de estimulação específicas, mas a heterogeneidade dos estudos propostos dificulta muito o alcance de conclusões definitivas4. Portanto, apesar dos grandes esforços, não há consenso real, mas o número de pacientes submetidos à intervenção da DBS continua crescendo18. Então, entender as consequências do DBS no cérebro in vivo permitirá desvendar quais parâmetros de estimulação e protocolos de estimulação são mais adequados às necessidades de cada paciente, obtendo assim uma melhor taxa de sucesso. Nesse contexto, modalidades de neuroimagem funcional não invasivas, como o FDG-PET, são essenciais para lançar luz sobre o que realmente está ocorrendo sob a influência direta da estimulação elétrica no cérebro. Por exemplo, no protocolo longitudinal explicado aqui, o DBS é entregue durante o período de captação do radiotraçador da imagem PET D2. Assim, a comparação dos estudos D2 (DBS-ON) e D1 (DBS-OFF) PET possibilita a visualização das regiões cerebrais que estão sendo moduladas pela estimulação elétrica in vivo, pois as propriedades de "aprisionamento metabólico" do FDG permitem registrar as mudanças cumulativas que ocorrem diretamente durante a estimulação13,19.
Em conjunto, esse protocolo descreve uma estratégia viável para avaliar as consequências agudas da DBS no cérebro in vivo, mas a variedade de combinações e protocolos de parâmetros DBS disponíveis é imensa (por exemplo, tratamentos contínuos vs. intermitentes 20, estimulação de alta vs. baixa frequência21), e mesmo os efeitos da DBS podem diferir junto com o tratamento devido à inferência de mudanças diretas na rede cerebral sob a influência da estimulação22 . Além disso, o número de possibilidades torna-se ainda maior considerando o crescente número de patologias para as quais a ECP é recomendada23. Portanto, estudos longitudinais de neuroimagem com o objetivo de descobrir os padrões de ativação neural que permitem predizer a resposta potencial ao tratamento da ECP são de particular relevância clínica24,25. A este respeito, existe um grande número de estudos clínicos e pré-clínicos que avaliaram os efeitos terapêuticos de diferentes protocolos DBS por FDG-PET (ver3 para revisão). Assim, existem vários exemplos em que o protocolo DBS estudado neutraliza o padrão metabólico cerebral associado à patologia em tratamento, induzindo uma melhora dos sintomas do paciente e comprovando a utilidade clínica das abordagens DBS-PET. Um exemplo disso é encontrado na estimulação da região cingulada subcalosa (CEC) para pacientes com depressão resistente ao tratamento. O CEC é metabolicamente hiperativo em pacientes não medicados com depressão26, e essa hiperativação é normalizada após a remissão da depressão por tratamento farmacológico, psicoterapêutico ou DBS27,28,29. Importante, o metabolismo do CEC foi maior naqueles pacientes que responderam à DBS antes de iniciar a estimulação em comparação com os não respondedores. Este estudo mostrou uma acurácia de 80% na predição da resposta ao SCC-DBS29, destacando a importância dos biomarcadores de imagem na seleção de potenciais pacientes para DBS. Portanto, o contexto explicado reflete uma história de sucesso clínico de estudos de FDG-PET com o objetivo de mapear o padrão metabólico cerebral da depressão com os resultados terapêuticos obtidos com o SCC-DBS, o que deve estabelecer as bases para abordagens semelhantes focadas em outros transtornos neuropsiquiátricos e protocolos DBS no futuro.
Nesse sentido, a fim de observar os efeitos fisiológicos da DBS usando FDG-PET, é particularmente relevante considerar cuidadosamente o tempo específico do protocolo DBS a ser escaneado. Assim, apesar de aplicar os mesmos parâmetros da DBS e o mesmo protocolo, o momento para a aquisição da imagem determinará claramente a origem da modulação observada, o que pode levar a potenciais mal-entendidos por não considerar todos os fatores envolvidos na resposta final obtida8. Portanto, embora o planejamento da cirurgia seja determinante para estabelecer as bases para a terapia subsequente, o desenho de um protocolo de aquisição de imagem adequado às consequências da estimulação em estudo é essencial para entender completamente o mecanismo molecular subjacente ao tratamento de estimulação aplicado. Ao longo dessas linhas, vários fatores podem modificar drasticamente a resposta a um protocolo DBS específico (por exemplo, parâmetros de estimulação, inserção de eletrodos, estrutura cerebral direcionada, patologia sob tratamento, duração e frequência das sessões de DBS, etc.) 7,8,30. Os fenômenos refletidos pelos dados coletados no estudo FDG-PET dependerão do tempo específico no curso da terapia em que as imagens são adquiridas. Então, todos esses pontos abrem diferentes oportunidades de pesquisa para explorar a modulação induzida pela DBS e contribuem para explicar os mecanismos subjacentes a essa terapia.
Assim, apesar das grandes diferenças que separam os cérebros de roedores e humanos, práticas adequadas devem ser implementadas em todos os níveis, com o objetivo de desenvolver protocolos translacionais. Nesse sentido, não se deve ignorar que a DBS requer uma cirurgia altamente invasiva baseada em craniotomia para que os eletrodos possam acessar estruturas cerebrais profundas31. Nesse ponto, existem duas importantes fontes de infecção e reação inflamatória: por um lado, a exposição direta do tecido cerebral durante a cirurgia e, por outro, a inserção de dois elementos exógenos em um órgão interno, criando uma cicatriz insercional por sua trajetória em direção ao alvo de estimulação32. Portanto, a esterilização do equipamento cirúrgico, a manutenção de uma área cirúrgica limpa e os cuidados pós-operatórios adequados baseados em tratamentos com antibióticos e analgésicos33 são essenciais para garantir que o sujeito obtenha o maior benefício da intervenção e nas condições mais saudáveis. Além disso, isso é de particular relevância em estudos de imagem FDG-PET, pois a ocorrência de complicações pós-cirúrgicas pode modificar o padrão de captação do radiotraçador, uma vez que os processos inflamatórios e infecciosos são claramente vistos como sinais hipermetabólicos34, o que pode levar a uma resposta modificada ao tratamento ou a uma superestimação da modulação produzida pela DBS.
No entanto, essa metodologia experimental está sujeita a algumas limitações: primeiro, os protocolos DBS geralmente são tratamentos de longo prazo, contínuos e crônicos. Aqui, um protocolo de neuroimagem é mostrado para avaliar os efeitos agudos da DBS em tempo real. Assim, o momento sugerido para estudos de neuroimagem não seria adequado para obter informações sobre a modulação a longo prazo induzida pela DBS em tempo quase real. No entanto, pode estabelecer as bases para o desenvolvimento de diferentes abordagens longitudinais para servir como conhecimento básico para a compreensão das respostas derivadas do DBS. Em segundo lugar, uma vez que animais saudáveis têm sido utilizados para ilustrar este método, a aplicação das técnicas explicadas a diferentes condições patológicas pode exigir a sua adaptação para garantir melhores resultados e condições de bem-estar óptimas. Finalmente, as análises voxel requerem grandes tamanhos de amostra e/ou fortes fatores de correção para obter resultados confiáveis, pois são sempre afetadas por um problema de múltiplas comparações estatísticas. No entanto, a avaliação das consequências da DBS no metabolismo cerebral usando FDG-PET com uma abordagem voxel-wise é uma grande vantagem devido à natureza exploratória intrínseca deste método, que permite extensas análises de todo o cérebro sem a necessidade de quaisquer suposições prévias.
Apesar das desvantagens explicadas da combinação de DBS e FDG-PET, essas abordagens oferecem uma grande janela de oportunidade. Assim, a obtenção de informações metabólicas cerebrais de forma não invasiva é uma grande vantagem no sentido de que os dados neurofisiológicos podem ser coletados do sujeito durante a estimulação e em muitas ocasiões diferentes, juntamente com o tratamento DBS. Além disso, o FDG-PET é uma técnica de neuroimagem no cenário clínico, o que reforça a abordagem translacional que motiva esse método. Da mesma forma, o uso do FDG-PET é uma alternativa particularmente adequada, uma vez que, diferentemente de outras modalidades de imagem, o sinal obtido não é influenciado por distorções secundárias nos campos elétrico ou magnético derivadas do sistema de neuroestimulação, o que pode prejudicar tanto a qualidade da imagem quanto o desempenho do sistema24. Por outro lado, o interesse da pesquisa em avaliar as consequências modulatórias da DBS não se limita aos benefícios terapêuticos. De fato, como a DBS é uma terapia de neuroestimulação focal, moduladora e não permanente, ela também pode ajudar a desvendar as vias de atividade neurofuncional avaliadas por técnicas de imagem molecular e em resposta a estímulos elétricos fornecidos pelo sistema35. Esta informação pode ser particularmente valiosa para decifrar enigmas neurofisiológicos não resolvidos em condições saudáveis e patológicas. Finalmente, a metodologia explicada neste manuscrito fornece a capacidade de observar os efeitos da neuromodulação induzida por DBS in vivo, sendo uma estratégia poderosa para determinar o impacto da estimulação durante sua aplicação. Em suma, entender o efeito in vivo da DBS ajudará a entender os efeitos desejados e indesejados desse tratamento, prever a melhora clínica e, finalmente, adaptar os protocolos de estimulação às necessidades de cada paciente.
Divulgações
Os autores declaram que não há conflitos de interesse em conexão com este artigo.
Agradecimentos
Agradecemos à Profª Christine Winter, Julia Klein, Alexandra de Francisco e Yolanda Sierra pelo inestimável apoio na otimização da metodologia aqui descrita. O MLS foi apoiado pelo Ministerio de Ciencia e Innovación, Instituto de Salud Carlos III (número de projecto PI17/01766 e número de subvenção BA21/0030) co-financiado pelo Fundo Europeu de Desenvolvimento Regional (FEDER), "Uma forma de fazer a Europa"; CIBERSAM (projecto n.º CB07/09/0031); Delegación del Gobierno para el Plan Nacional sobre Drogas (número de projeto 2017/085); Fundação Mapfre; e Fundación Alicia Koplowitz. O MCV foi apoiado pela Fundación Tatiana Pérez de Guzmán el Bueno como bolsista desta instituição e pelo Programa Conjunto da UE - Pesquisa em Doenças Neurodegenerativas (JPND). O DRM foi apoiado pela Consejería de Educación e Investigación, Comunidad de Madrid, cofinanciado pelo Fundo Social Europeu "Investing in your future" (número de subvenção PEJD-2018-PRE/BMD-7899). O NLR foi apoiado pelo Instituto de Investigación Sanitaria Gregorio Marañón, "Programa Intramural de Impulso a la I+D+I 2019". O trabalho de MD foi apoiado pelo Ministerio de Ciencia e Innovación (MCIN) e pelo Instituto de Salud Carlos III (ISCIII) (PT20/00044). O CNIC é apoiado pelo Instituto de Salud Carlos III (ISCIII), pelo Ministerio de Ciencia e Innovación (MCIN) e pela Fundação Pro CNIC, e é um Centro de Excelência Severo Ochoa (SEV-2015-0505).
Materiais
| Name | Company | Catalog Number | Comments |
| 7-Tesla Biospec 70/20 scanner | Bruker, Germany | SN0021 | MRI scanner for small animal imaging |
| Betadine | Meda Pharma S.L., Spain | 644625.6 | Iodine solution (iodopovidone) |
| Beurer IL 11 | Beurer | SN87318 | Infra-red light |
| Bipolar cable 50 cm w/50 cm mesh covering up to 100 cm | Plastics One, USA | 305-305 (CM) | |
| Bipolar cable TT2 50 cm up to 100 cm | Plastics One, USA | 305-340/2 | Bipolar cable TT2 50 cm up to 100 cm |
| Buprex | Schering-Plough, S.A | 961425 | Buprenorphine (analgesic) |
| Ceftriaxona Reig Jofré 1g IM | Laboratorio Reig Jofré S.A., Spain | 624239.1 | Ceftriaxone (antibiotic) |
| Commutator | Plastics One, USA | SL2+2C | 4 Channel Commutator for DBS |
| Concentric bipolar platinum-iridium electrodes | Plastics One, USA | MS303/8-AIU/Spc | Electrodes for DBS |
| Driller | Bosh | T58704 | Driller |
| FDG | Curium Pharma Spain S.A., Spain | ----- | 2-[18F]fluoro-2-deoxy-D-glucose (PET radiotracer) |
| Heating pad | DAGA, Spain | 23115 | Heating pad |
| Ketolar | Pfizer S.L., Spain | 776211.9 | Ketamine (anesthetic drug) |
| Lipolasic 2 mg/g | Bausch & Lomb S.A, Spain | 65277 | Ophthalmic lubricating gel |
| MatLab R2021a | The MathWorks, Inc | Support software for SPM12 | |
| MRIcro | McCausland Center for Brain Imaging, University of South Carolina, USA | v2.1.58-0 | Software for imaging preprocessing and analysis |
| Multimodality Workstation (MMWKS) | BiiG, Spain | Software for imaging processing and analysis | |
| Omicrom VISION VET | RGB Medical Devices, Spain | 731100 ReV B | Cardiorrespiratory monitor for small imaging |
| Prevex Cotton buds | Prevex, Finland | ----- | Cotton buds |
| Sevorane | AbbVie Spain, S.L.U, Spain | 673186.4 | Sevoflurane (inhalatory anesthesia) |
| Small screws | Max Witte GmbH | 1,2 x 2 DIN 84 A2 | Small screws |
| Standard U-Frame Stereotaxic Instrument for Rat, 18° Ear Bar | Harvard Apparatus, USA | 75-1801 | Two-arms Stereotactic frame for rat |
| Statistical Parametric Mapping (SPM12) | The Wellcome Center for Human Neuroimaging, UCL Queen Square Institute of Neurology, UK | SPM12 | Software for voxel-wise imaging analysis |
| STG1004 | Multi Channel Systems GmbH, Germany | STG1004 | Isolated stimulator |
| SuperArgus PET/CT scanner | Sedecal, Spain | S0026403 | NanoPET/CT scanner for small animal imaging |
| Suture thread with needle, 1/º | Lorca Marín S.A., Spain | 55325 | Braided natural silk non-absorbable suture 1/0, with triangle needle |
| Technovit 4004 (powder and liquid) | Kulzer Technique, Germany | 64708471; 64708474 | Acrylic dental cement for craniotomy tap |
| Wistar rats (Rattus norvergicus) | Charles River, Spain | animal facility | Animal model used |
| Xylagesic | Laboratorios Karizoo, A.A, Spain | 572599-4 | Xylazine (anesthetic drug) |
| Normon S.A., Spain | 602910 | Mepivacaine in gel for topical use |
Referências
- Gildenberg, P. L. Neuromodulation: A historical perspective. Neuromodulation. 1, 9-20 (2009).
- Lee, D. J., Lozano, C. S., Dallapiazza, R. F., Lozano, A. M. Current and future directions of deep brain stimulation for neurological and psychiatric disorders. Journal of Neurosurgery. 131 (2), 333-342 (2019).
- Casquero-Veiga, M. Preclinical molecular neuroimaging in deep brain stimulation. Complutense University of Madrid. , (2021).
- Blaha, C. D. Theories of deep brain stimulation mechanisms. Deep Brain Stimulation: Indictions and Applications. , 314-338 (2016).
- Fins, J. J. Deep brain stimulation: Ethical issues in clinical practice and neurosurgical research. Neuromodulation. 1, 81-91 (2009).
- Desmoulin-Canselier, S., Moutaud, B. Animal models and animal experimentation in the development of deep brain stimulation: From a specific controversy to a multidimensional debate. Frontiers in Neuroanatomy. 13, 51 (2019).
- Casquero-Veiga, M., Hadar, R., Pascau, J., Winter, C., Desco, M., Soto-Montenegro, M. L. Response to deep brain stimulation in three brain targets with implications in mental disorders: A PET study in rats. PLOS One. 11 (12), 0168689 (2016).
- Casquero-Veiga, M., García-García, D., Desco, M., Soto-Montenegro, M. L. Understanding deep brain stimulation: In vivo metabolic consequences of the electrode insertional effect. BioMed Research International. 2018, 1-6 (2018).
- Casquero-Veiga, M., García-García, D., Pascau, J., Desco, M., Soto-Montenegro, M. L. Stimulating the nucleus accumbens in obesity: A positron emission tomography study after deep brain stimulation in a rodent model. PLOS One. 13 (9), 0204740 (2018).
- Pascau, J., Vaquero, J. J., Abella, M., Cacho, R., Lage, E., Desco, M. Multimodality workstation for small animal image visualization and analysis. Scientific Papers. Molecular Imaging and Biology. 8, 97-98 (2006).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (1998).
- Roy, M., et al. A dual tracer PET-MRI protocol for the quantitative measure of regional brain energy substrates uptake in the rat. Journal of Visualized Experiments: JoVE. (82), e50761 (2013).
- Klein, J., et al. A novel approach to investigate neuronal network activity patterns affected by deep brain stimulation in rats. Journal of Psychiatric Research. 45 (7), 927-930 (2011).
- Soto-Montenegro, M. L., Pascau, J., Desco, M. Response to deep brain stimulation in the lateral hypothalamic area in a rat model of obesity: In vivo assessment of brain glucose metabolism. Molecular Imaging and Biology. , 830-837 (2014).
- Pascau, J., et al. Automated method for small-animal PET image registration with intrinsic validation. Molecular Imaging and Biology. 11 (2), 107-113 (2009).
- Andersson, J. L. R. How to estimate global activity independent of changes in local activity. Neuroimage. 244 (60), 237-244 (1997).
- . Wellcome Trust Centre for Neuroimaging SPM12-Statitstical Parametric Mapping Available from: https://www.fil.ion.ucl.ac.uk/spm/software/spm12/ (2022)
- Lozano, A. M., et al. Deep brain stimulation: current challenges and future directions. Nature Reviews Neurology. 15 (3), (2019).
- Boecker, H., Drzezga, A. A perspective on the future role of brain pet imaging in exercise science. NeuroImage. 131, (2016).
- Sprengers, M., et al. Deep brain stimulation reduces evoked potentials with a dual time course in freely moving rats: Potential neurophysiological basis for intermittent as an alternative to continuous stimulation. Epilepsia. 61 (5), 903-913 (2020).
- Middlebrooks, E. H., et al. Acute brain activation patterns of high- versus low-frequency stimulation of the anterior nucleus of the thalamus during deep brain stimulation for epilepsy. Neurosurgery. 89 (5), 901-908 (2021).
- Ashkan, K., Rogers, P., Bergman, H., Ughratdar, I. Insights into the mechanisms of deep brain stimulation. Nature Reviews Neurology. 13 (9), 548-554 (2017).
- Williams, N. R., Taylor, J. J., Lamb, K., Hanlon, C. A., Short, E. B., George, M. S. Role of functional imaging in the development and refinement of invasive neuromodulation for psychiatric disorders. World Journal of Radiology. 6 (10), 756-778 (2014).
- Rodman, A. M., Dougherty, D. D. . Nuclear medicine in neuromodulation. Neuromodulation in Psychiatry. , 81-99 (2016).
- Albaugh, D. L., Shih, Y. -. Y. I. Neural circuit modulation during deep brain stimulation at the subthalamic nucleus for Parkinson's disease: what have we learned from neuroimaging studies. Brain Connectivity. 4 (1), 1-14 (2014).
- Mayberg, H. S., et al. Reciprocal limbic-cortical function and negative mood: Converging PET findings in depression and normal sadness. Neurology, and Radiology. 156 (5), 675-682 (1999).
- Kennedy, S. H., et al. Differences in brain glucose metabolism between responders to CBT and Venlafaxine in a 16-week randomized controlled trial. American Journal of Psychiatry. 164 (5), 778-788 (2007).
- Kennedy, S. H., et al. Changes in regional brain glucose metabolism measured with positron emission tomography after paroxetine treatment of major depression. American Journal of Psychiatry. 158 (6), 899-905 (2001).
- Brown, E. C., Clark, D. L., Forkert, N. D., Molnar, C. P., Kiss, Z. H. T., Ramasubbu, R. Metabolic activity in subcallosal cingulate predicts response to deep brain stimulation for depression. Neuropsychopharmacology. 45, 1681-1688 (2020).
- Klooster, D. C. W., et al. Technical aspects of neurostimulation: Focus on equipment, electric field modeling, and stimulation protocols. Neuroscience & Biobehavioral Reviews. 65, 113-141 (2016).
- Kasoff, W., Gross, R. E. Deep brain stimulation: Introduction and Technical Aspects. Neuromodulation in Psychiatry. , 245-275 (2016).
- Perez-Caballero, L., et al. Early responses to deep brain stimulation in depression are modulated by anti-inflammatory drugs. Molecular Psychiatry. 19, 607-614 (2014).
- Solera Ruiz, I., UñaOrejón, R., Valero, I., Laroche, F. Craniotomy in the conscious patient. Considerations in special situations. Spanish Journal of Anesthesiology and Resuscitation. 60 (7), 392-398 (2013).
- Casali, M., et al. State of the art of 18F-FDG PET/CT application in inflammation and infection: a guide for image acquisition and interpretation. Clinical and Translational Imaging. 9 (4), 299-339 (2021).
- Gonzalez-Escamilla, G., Muthuraman, M., Ciolac, D., Coenen, V. A., Schnitzler, A., Groppa, S. Neuroimaging and electrophysiology meet invasive neurostimulation for causal interrogations and modulations of brain states. NeuroImage. 220, 117144 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados