Method Article
In vivo Tomographie par émission de positons pour révéler les schémas d’activité induits par la stimulation cérébrale profonde chez le rat
Dans cet article
Résumé
Nous décrivons une méthode expérimentale préclinique pour évaluer la neuromodulation métabolique induite par la stimulation cérébrale profonde aiguë avec le FDG-TEP in vivo . Ce manuscrit comprend toutes les étapes expérimentales, de la chirurgie stéréotaxique à l’application du traitement de stimulation et à l’acquisition, au traitement et à l’analyse des images TEP.
Résumé
La stimulation cérébrale profonde (SCP) est une technique neurochirurgicale invasive basée sur l’application d’impulsions électriques aux structures cérébrales impliquées dans la physiopathologie du patient. Malgré la longue histoire de DBS, son mécanisme d’action et ses protocoles appropriés restent flous, soulignant la nécessité de recherches visant à résoudre ces énigmes. En ce sens, l’évaluation des effets in vivo de la SCP à l’aide de techniques d’imagerie fonctionnelle représente une stratégie puissante pour déterminer l’impact de la stimulation sur la dynamique cérébrale. Ici, un protocole expérimental pour des modèles précliniques (rats Wistar), combiné à une étude longitudinale [18F]-fluorodeoxyclucose positron emission tomography (FDG-PET), pour évaluer les conséquences aiguës de la DBS sur le métabolisme cérébral est décrit. Tout d’abord, les animaux ont subi une chirurgie stéréotaxique pour l’implantation bilatérale d’électrodes dans le cortex préfrontal. Une tomodensitométrie (TDM) post-chirurgicale de chaque animal a été acquise pour vérifier l’emplacement des électrodes. Après une semaine de récupération, un premier FDG-PET statique de chaque animal opéré sans stimulation (D1) a été acquis, et deux jours plus tard (D2), un deuxième FDG-PET a été acquis pendant que les animaux étaient stimulés. Pour cela, les électrodes ont été connectées à un stimulateur isolé après administration de FDG aux animaux. Ainsi, les animaux ont été stimulés pendant la période d’absorption du FDG (45 min), enregistrant les effets aigus de la SCP sur le métabolisme cérébral. Compte tenu de la nature exploratoire de cette étude, les images FDG-PET ont été analysées par une approche voxel basée sur un test T apparié entre les études D1 et D2. Dans l’ensemble, la combinaison de la SCP et des études d’imagerie permet de décrire les conséquences de la neuromodulation sur les réseaux neuronaux, aidant finalement à résoudre les énigmes entourant la SCP.
Introduction
Le terme neurostimulation englobe un certain nombre de techniques différentes visant à stimuler le système nerveux avec un objectif thérapeutique1. Parmi elles, la stimulation cérébrale profonde (SCP) se distingue comme l’une des stratégies de neurostimulation les plus répandues dans la pratique clinique. La SCP consiste en la stimulation de noyaux cérébraux profonds avec des impulsions électriques délivrées par un neurostimulateur, implanté directement dans le corps du patient, à travers des électrodes placées dans la cible cérébrale pour être modulées par chirurgie stéréotaxique. Le nombre d’articles évaluant la faisabilité de l’application de la SCP dans différents troubles neurologiques et psychiatriques ne cesse de croître2, bien que seulement certains d’entre eux aient été approuvés par la Food and Drug Association (FDA) (c.-à-d. tremblement essentiel, maladie de Parkinson, dystonie, trouble obsessionnel-compulsif et épilepsie médicalement réfractaire)3 . En outre, un grand nombre de cibles cérébrales et de protocoles de stimulation sont à l’étude pour le traitement de la SCP de beaucoup plus de pathologies que celles officiellement approuvées, mais aucune d’entre elles n’est considérée comme définitive. Ces incohérences dans la recherche et les procédures cliniques de DBS peuvent en partie être dues à un manque de compréhension complète de son mécanisme d’action4. Par conséquent, d’énormes efforts sont déployés pour déchiffrer les effets in vivo de la SCP sur la dynamique cérébrale, car chaque avancée, aussi petite soit-elle, aidera à affiner les protocoles de SCP pour un plus grand succès thérapeutique.
Dans ce contexte, les techniques d’imagerie moléculaire ouvrent une fenêtre directe pour observer les effets neuromodulateurs in vivo de la SCP. Ces approches offrent la possibilité non seulement de déterminer l’impact de la SCP pendant son application, mais aussi de démêler la nature de ses conséquences, de prévenir les effets secondaires indésirables et l’amélioration clinique, et même d’adapter les paramètres de stimulation aux besoins du patient5. Parmi ces méthodes, la tomographie par émission de positrons (TEP) utilisant le 2-désoxy-2-[18F]fluoro-D-glucose (FDG) présente un intérêt particulier car elle fournit des informations spécifiques et en temps réel sur l’état d’activation des différentes régions du cerveau6. Plus précisément, l’imagerie FDG-PET fournit une évaluation indirecte de l’activation neuronale basée sur le principe physiologique du couplage métabolique entre les neurones et les cellules gliales6. En ce sens, plusieurs études cliniques ont rapporté des modèles d’activité cérébrale modulés par la SCP à l’aide de FDG-PET (voir3 pour la revue). Néanmoins, les études cliniques présentent facilement plusieurs inconvénients lorsqu’elles se concentrent sur les patients, tels que l’hétérogénéité ou les difficultés de recrutement, qui limitent fortement leur potentiel de recherche6. Ce contexte amène les chercheurs à utiliser des modèles animaux de conditions humaines pour évaluer les approches biomédicales avant leur application clinique ou, si elles sont déjà appliquées en pratique clinique, pour expliquer l’origine physiologique des bénéfices thérapeutiques ou des effets secondaires. Ainsi, malgré les grandes distances entre la pathologie humaine et l’état modélisé chez les animaux de laboratoire, ces approches précliniques sont essentielles pour une transition sûre et efficace vers la pratique clinique.
Ce manuscrit décrit un protocole expérimental de SCP pour des modèles murins, combiné à une étude longitudinale FDG-TEP, afin d’évaluer les conséquences aiguës de la SCP sur le métabolisme cérébral. Les résultats obtenus avec ce protocole peuvent aider à démêler les schémas modulateurs complexes induits sur l’activité cérébrale par DBS. Par conséquent, une stratégie expérimentale appropriée pour examiner in vivo les conséquences de la stimulation est fournie, permettant aux cliniciens d’anticiper les effets thérapeutiques dans des circonstances spécifiques, puis d’adapter les paramètres de stimulation aux besoins du patient.
Protocole
Les procédures expérimentales sur les animaux ont été menées conformément à la directive 2010/63/UE du Conseil des Communautés européennes et approuvées par le Comité d’éthique pour l’expérimentation animale de l’hôpital Gregorio Marañón. Un résumé graphique du protocole expérimental est présenté à la figure 1A.
1. Localisation de cibles cérébrales par neuroimagerie in vivo
- Préparation des animaux
NOTE: Des rats Wistar mâles de ~300 g ont été utilisés.- Placez l’animal dans une boîte d’induction d’anesthésie et scellez le dessus.
- Allumez le vaporisateur de sévoflurane (5% pour l’induction à 100%O2). Lorsque le rat est anesthésié, basculez le flux de gaz vers le nez. Confirmez l’état d’anesthésie en pinçant la patte du rat.
- Posez l’animal couché sur le dos sur le lit de tomodensitométrie, en maintenant l’anesthésie au sévoflurane (3% pour l’entretien à 100% O2).
- Imagerie par tomodensitométrie
REMARQUE: La sélection de l’ampérage, de la tension, du nombre de projections, du nombre de prises de vue et de la résolution voxel dépend du tomodensitomètre. Ici, les paramètres suivants: 340 mA, 40 KV, projections 360, 8 tirs et résolutionde 200 μm ont été utilisés 7,8,9.- Fixez le masque facial ou le cône nasal au rat.
- Fixez le corps du rat à la tête, aux épaules, aux hanches et à la queue avec du ruban de soie pour fournir suffisamment de retenue sans dommage.
- Surveillez le rat en permanence.
- Localisez la tête au centre du champ de vision du tomodensitomètre.
- Procéder à l’acquisition de l’image CT en utilisant les paramètres d’acquisition selon les spécifications du scanner.
- Après 10 minutes, lorsque la tomodensitométrie in vivo est terminée, arrêtez le flux de sévoflurane et placez le rat dans le scanner IRM.
- Imagerie par résonance magnétique
REMARQUE: Les spécifications d’acquisition de numérisation varient selon les scanners, y compris les différents systèmes logiciels et, plus important encore, la question de recherche spécifique. Ici, un scanner 7-Tesla a été utilisé. Une séquence spin-écho pondérée T2 7,8,9 avec TE = 33 ms, TR = 3732 ms, et une épaisseur de tranche de 0,8 mm (34 tranches), taille de matrice de 256 x 256 pixels avec un champ de vision de 3,5 x 3,5 cm2 a été utilisée.- Posez l’animal couché sur le dos sur le lit d’IRM, en maintenant l’anesthésie au sévoflurane (3% pour l’entretien à 100% O2).
- Fixez la tête à un cadre stéréotaxique placé sur le lit du scanner pour éviter les mouvements de la tête pendant l’acquisition de l’IRM. Fixez également le reste du corps du rat avec du ruban de soie.
- Localisez la tête au centre du champ de vision du scanner IRM.
- Une fois la position correcte, procédez à l’acquisition de l’image IRM.
- Lorsque l’IRM in vivo est terminée, arrêtez l’écoulement de sévoflurane et placez le rat dans sa cage.
- Placez une lampe chauffante près de la cage, car les rats réduisent généralement leur température corporelle pendant l’examen.
- Surveillez le rat jusqu’à ce qu’il se rétablisse de l’anesthésie.
- Colocalisation de l’Atlas et calcul des coordonnées cibles
- Une fois que les images CT et IRM sont acquises et reconstruites en suivant les recommandations du scanner, co-enregistrer les images CT et IRM.
- Utiliser un logiciel de traitement d’imagerie pour normaliser spatialement la TDM et l’IRM à l’aide d’un algorithme d’enregistrement rigide automatique basé sur des informations mutuelles10.
- Localisez la ligne de Bregma dans l’image co-enregistrée et mesurez la distance dans l’axe antérieur/postérieur (AP : +3,5 mm), médian/latéral (ML : +0,6 mm) et dorso-vénétral (DV : -3,4 mm) de Bregma à la cible (cortex préfrontal médial, mPFC), selon l’atlas du cerveau du ratPaxinos et Watson 11.
REMARQUE: Les coordonnées de Bregma à la cible peuvent différer entre les rats lorsque le poids, la taille, le sexe et la race sont différents.
2. Chirurgie stéréotaxique
ATTENTION : Autoclaver tout le matériel chirurgical, les implants et les unités stéréotaxiques avant utilisation, et désinfecter la zone chirurgicale pour éviter les infections et les complications qui pourraient affecter le bien-être animal. Utilisez des gants chirurgicaux stériles et couvrez l’animal avec des champs collants pour éviter toute contamination.
- Préparation et anesthésie des animaux
- Les animaux ont reçu 0,1 mg/kg de buprénorphine par voie intrapéritonéale la veille de la chirurgie. Placez l’animal dans une chambre d’induction d’anesthésie et scellez le dessus.
- Allumez le vaporisateur de sévoflurane (5% pour l’induction à 100%O2).
- Lorsque le rat est couché, éteignez le vaporisateur de sévoflurane et retirez le rat de la chambre à caissons.
- Administrer par voie intrapéritonéale un mélange de kétamine (100 mg/kg) et de xylazine (10 mg/kg) pour anesthésier l’animal.
- Attendez que l’animal soit complètement anesthésié. Vérifiez le niveau d’anesthésie en pinçant la zone interdigitale.
- Rasez la zone entre les oreilles et les yeux.
- Placement dans le cadre stéréotaxique et craniotomie
- Placez l’animal en position couchée sur le cadre stéréotaxique et utilisez l’adaptateur de maintien de la tête pour les rats afin de maintenir l’animal dans la bonne position pendant la chirurgie.
- Assurez-vous de l’immobilité de la tête en utilisant les barres d’oreille de rat. Soyez prudent avec l’insertion des barres d’oreille, car une insertion trop profonde peut endommager le tympan.
- Appliquez un gel lubrifiant ophtalmique sur les yeux pour prévenir la sécheresse pendant la chirurgie et couvrez-les de gaze stérile.
- Couvrez l’animal à l’aide de champs collants pour éviter toute contamination.
- Appliquez la solution d’iodopovidone sur la zone rasée et nettoyez-la avec de la gaze stérile.
- Appliquer la mépivacaïne en gel sur la zone rasée pour anesthésier la zone locale.
- Faites une incision longitudinale dans la peau recouvrant le crâne entre les oreilles, s’étendant de 1,5 à 2 cm du lambda à Bregma (c’est-à-dire du sommet crânien vers les yeux).
- Exposez le crâne à l’aide de 2 ou 3 pinces. Retirez le périoste avec un coton-tige et nettoyez le sang avec une solution saline pour exposer Bregma et les sutures sagittales. Retirer l’excès de solution saline avec de la gaze.
- Grattez la surface du crâne avec un scalpel pour améliorer l’adhérence du ciment dentaire. Nettoyez la zone avec un coton-tige imbibé de peroxyde d’hydrogène.
- Placement et fixation des électrodes sur le crâne
- Redressez les électrodes avec une pince à épiler en plastique pour assurer le placement correct pendant la chirurgie.
REMARQUE: Des électrodes concentriques bipolaires en platine-iridium avec la masse sont utilisées dans ce protocole. - Localisez une électrode sur le support du bras droit du cadre stéréotaxique.
REMARQUE : Il peut être nécessaire d’adapter le support à l’électrode pour mieux le fixer (voir Figure 1B). Assurez-vous que l’électrode est parallèle à l’axe du support. - Déplacez le bras droit tenant l’électrode à travers le cadre stéréotaxique et placez la pointe de l’électrode exactement sur Bregma. Essayez d’amener la pointe de l’électrode le plus près possible du crâne, mais sans la toucher pour éviter la déformation de l’électrode, et notez les coordonnées résultantes pour Bregma fournies par le cadre stéréotaxique. Faites une marque sur le crâne indiquant la position initiale de l’électrode avec un stylo chirurgical.
- Déplacez le support vers les coordonnées AP et ML obtenues à l’étape 1.4.3 et faites une marque sur le crâne avec un stylo chirurgical indiquant la position de la cible de l’électrode.
- Retirez le bras droit du cadre stéréotaxique qui tient l’électrode. Veillez à ne rien toucher avec l’électrode.
- Utilisez une petite perceuse électrique pour faire un trou dans le crâne (environ 1-1,5 mm de diamètre) dans la position cible jusqu’à ce que la dure-mère soit visible. Arrêtez tout saignement à l’aide d’un coton-tige.
- Percez 4 trous le long du crâne pour localiser 4 vis (de préférence des vis en acier inoxydable de 2-3 mm de longueur) pour augmenter la surface du ciment dentaire et localiser le sol. Fixez les 4 vis.
- Localisez le bras droit de la trame stéréotaxique avec l’électrode droite. Déplacez le bras à la position calculée, qui devrait coïncider avec le trou. Ensuite, abaissez l’électrode jusqu’à ce qu’elle touche la dure-mère. Cette position servira de niveau 0 dans la direction DV.
- Insérez l’extrémité de l’électrode dans le sens DV, en utilisant la position DV à l’étape 1.4.3. Nettoyez le sang et le liquide céphalorachidien autour de la zone de l’électrode avec un coton-tige.
- Fixez la masse à l’une des vis les plus proches de l’électrode.
- Appliquez du ciment dentaire autour de l’électrode et des vis en prenant soin de façonner le ciment dentaire en évitant les arêtes vives, qui pourraient blesser l’animal. Le ciment dentaire est appliqué en couche pour éviter la surchauffe / les blessures thermiques au tissu / crâne. Les couches épaisses nécessitent plus de temps pour durcir avant que des couches supplémentaires ne soient ajoutées. Assurez-vous que le ciment dentaire est complètement durci avant de retirer l’électrode du support.
ATTENTION : La préparation du ciment dentaire produit l’émanation de vapeurs toxiques à partir du mélange, qui se termine par la solidification du ciment. Par conséquent, portez un masque de protection efficace contre les gaz chimiques à partir de ce moment et jusqu’à la fin de la chirurgie. - Répétez la même procédure des étapes 2.3.2 à 2.3.11 pour l’autre hémisphère du cerveau.
- Appliquez plus de ciment dentaire pour former un capuchon sans couvrir l’électrode. Attendez qu’il durcisse.
- Utilisez une suture tressée en soie naturelle non résorbable 1/0, avec une aiguille triangulaire, pour suturer devant et derrière le capuchon. Si nécessaire, retirez les sutures non résorbables à un moment donné en fonction de la région du corps où elles se trouvent. Utilisez une solution d’iodopovidone pour désinfecter la zone chirurgicale.
- Retirez le rat du cadre stéréotaxique.
- Redressez les électrodes avec une pince à épiler en plastique pour assurer le placement correct pendant la chirurgie.
- Imagerie CT pour la confirmation de la mise en place des électrodes
- Effectuez les étapes 1.2.4 à 1.2.5 et reportez-vous à la figure 1C.
- Une fois la tomodensitométrie in vivo terminée, placez le rat dans sa cage.
- Suivez les étapes 1.3.6. et 1.3.7.
- Soins postopératoires
- Administrer un antibiotique (ceftriaxone, 100 mg/kg, sous-cutané) pendant 5 jours et un analgésique (buprénorphine, 0,1 mg/kg, intrapéritonéal) pendant 3 jours comme soins postopératoires. Ce régime antibiotique peut être prolongé de 5 jours si des signes d’infection (rougeur, gonflement et exsudat) sont observés autour du capuchon.
- Effectuez une inspection visuelle quotidienne de chaque animal, à la recherche de signes de douleur ou de détresse, et nettoyez le bouchon avec une solution d’iodopodone.
- Fournir des soins intensifs jusqu’à 1 semaine après la chirurgie.
3. Acquisition d’imagerie TEP/TDM
REMARQUE : Chaque animal fait l’objet de deux études TEP/TDM (c.-à-d. en l’absence et pendant l’administration de SCP) sous anesthésie inhalée afin d’évaluer les effets aigus induits par la stimulation électrique. Les deux séances de scan suivent le même protocole d’acquisition d’imagerie, étant effectuées 1 semaine après la chirurgie (J1, sans stimulation) et 2 jours plus tard (D2, pendant DBS).
- Préparation et anesthésie des animaux
- Accélérez le rat pendant 8 à 12 heures avant chaque TEP pour permettre une absorption cérébrale plus élevée du FDG, améliorant ainsi le rapport signal sur bruit12.
- Placez l’animal dans une boîte d’induction d’anesthésie et scellez le dessus.
- Allumez le vaporisateur de sévoflurane (5% pour l’induction à 100%O2).
- Lorsque le rat est anesthésié, basculez le flux de gaz vers le nez.
- Période d’injection et d’absorption de FDG
ATTENTION : Le FDG est un radiotraceur, alors envisagez des mesures de radioprotection pour éviter l’exposition à la radioactivité. Confirmer que l’établissement a toutes les autorisations nécessaires pour travailler avec des composés radioactifs.- Conservez le flacon de FDG dans une armoire doublée de plomb jusqu’à ce qu’il soit utilisé pour éviter une exposition indésirable à la radioactivité.
- Remplissez une seringue de petit calibre (~27G) avec ~37 MBq de la solution FDG dans le volume le plus réduit possible, mesuré dans un activimètre.
- Placez un coussin chauffant sous la queue de l’animal ou utilisez une lumière infrarouge pour dilater les nervures de la queue.
- Une fois que les veines latérales sont évidentes dans le sommet de la queue, nettoyez la zone avec de l’alcool hygiénique (96%).
- Injectez la solution de FDG par l’une des veines latérales de la queue, en vous approchant de la veine avec une seringue parallèle à sa trajectoire et avec le biseau de l’aiguille tourné vers le haut.
- Éteignez l’anesthésie et replacez l’animal dans sa cage pour récupérer complètement sous une lampe chauffante.
- Attendez 45 minutes d’absorption du radiotraceur avant de commencer la session d’acquisition d’images. Pendant cette période, gardez l’animal éveillé et à l’intérieur d’une chambre blindée en plomb.
- Dans le cas de l’étude D2, administrer la SCP comme expliqué ci-dessous à la rubrique 4 (Administration de la stimulation électrique) pendant la période d’absorption du FDG.
- Acquisition TEP et reconstruction par imagerie
REMARQUE: Les spécifications d’acquisition d’images TEP dépendent du scanner et du temps de numérisation. Pour ce protocole, une image TEP statique a été acquise pendant 45 minutes avec un scanner TEP/TDM pour petits animaux, en utilisant une fenêtre d’énergie de 400-700 keV 7,8,9. Passez en revue les spécifications de l’équipement TEP/TDM avant de concevoir le protocole d’acquisition.- 45 min après l’injection de FDG, placez l’animal dans une boîte d’induction d’anesthésie et scellez le dessus.
- Allumez le vaporisateur de sévoflurane (5% pour l’induction à 100%O2).
- Transférer l’animal dans le lit TEP/TDM et le poser en décubitus dorsal, en fixant le nez au cône nasal d’anesthésie et en maintenant l’anesthésie au sévoflurane (3% pour le maintien à 100% O2). Confirmez l’état d’anesthésie en pinçant la patte du rat.
- Répétez les étapes 1.2.2 et 1.2.3.
- Localisez la tête au centre du champ de vision du scanner TEP.
- Acquérir l’image PET statique en utilisant les paramètres d’acquisition selon les spécifications du scanner.
- Procéder à la reconstruction de l’image à l’aide d’un 2D-OSEM (algorithme de maximisation des attentes de sous-ensembles ordonnés) et appliquer les corrections de décroissance et de temps mort 7,8,9.
- Lorsque la TEP in vivo est terminée, maintenir le flux de sévoflurane vers le rat afin de procéder par la suite à l’acquisition de la TDM sans déplacer la position de la tête de l’animal sur le lit du scanner.
- Acquisition de CT
- Sans changer la position de l’animal par rapport à l’acquisition précédente de TEP, procéder à l’acquisition de l’image CT.
- Répétez les étapes 1.2.3-1.2.5.
- Une fois la tomodensitométrie in vivo terminée, arrêtez l’écoulement de sévoflurane et placez le rat dans sa cage respective pour le récupérer.
- Suivez les étapes 1.3.6. et 1.3.7.
- Maintenir l’animal dans une chambre blindée de plomb jusqu’à la désintégration complète de la radioactivité.
4. Administration de la stimulation électrique
REMARQUE: La stimulation électrique est délivrée pendant la période d’absorption du FDG lors de la session d’imagerie D2. Pour ce protocole, la stimulation a été délivrée avec un stimulateur isolé, avec une stimulation électrique à haute fréquence (130 Hz) en mode courant constant, 150 μA, et une largeur d’impulsion de 100 μs 7,13,14.
- Configuration du stimulateur DBS
- Préparez le stimulateur isolé et les fils requis dans une pièce large et silencieuse, avec suffisamment d’espace pour les cages d’animaux et une influence minimale des stimuli potentiellement perturbateurs.
- Connectez les fils de stimulation aux émerillons pour permettre aux animaux de se déplacer librement dans leurs cages et au stimulateur.
- Définissez les paramètres de stimulation en fonction des besoins de l’étude.
- Utilisez un oscilloscope pour vérifier le mode actuel, la fréquence et la largeur d’impulsion. Confirmez la forme d’onde biphasique avec une forme d’impulsion rectangulaire (Figure 1D).
- Livraison DBS
- Après la séance d’imagerie D1 et jusqu’à l’acquisition de D2, soumettre les animaux à un protocole d’accoutumance quotidien (45 min/jour) pour les habituer au système de stimulation et à la manipulation de l’opérateur, en évitant les réponses indésirables au stress en D2. Connectez le système de stimulation à chaque animal, mais sans activer la stimulation.
- Une fois que le stimulateur a été installé et que l’animal a reçu une injection de FDG, connectez le pivot aux électrodes et allumez le stimulateur.
- Après 45 min, éteignez le stimulateur, déconnectez l’animal du pivot et transférez-le rapidement dans une chambre d’induction d’anesthésie pour commencer l’étape 3.3.
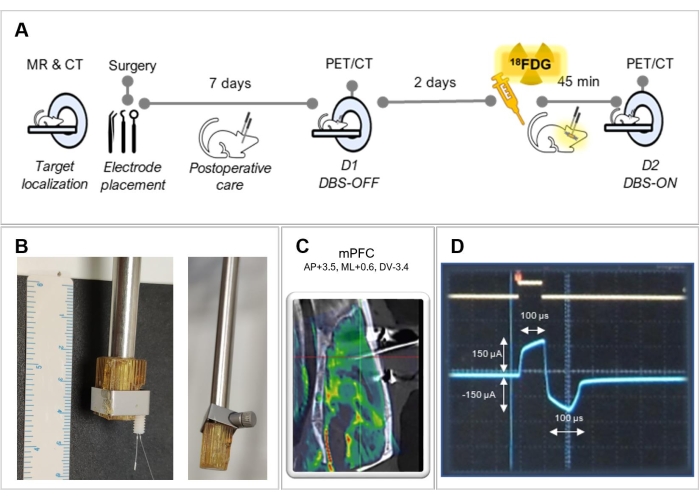
Figure 1 : Plan expérimental. (A) Résumé des étapes expérimentales suivies dans ce protocole. (B) Images représentatives d’une adaptation du support pour une meilleure fixation de l’électrode, avec (à gauche) et sans (à droite) une électrode. (C) Image fusionnée d’une IRM avec tomodensitométrie d’un animal opéré, montrant le placement correct de l’électrode dans le cortex préfrontal médian (mPFC). (D) Capture d’écran de l’écran de l’oscilloscope montrant la forme d’onde de stimulation biphasique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
5. Traitement et analyse d’images TEP
REMARQUE: Suivez le même traitement d’image sur les images de D1 et D2 pour obtenir des données comparables pour une analyse statistique ultérieure au niveau du voxel.
- Enregistrement spatial des images TEP
- Utilisez un logiciel de traitement d’imagerie spécialisé. L’ensemble du flux de travail d’enregistrement est illustré à la figure 2.
- Centrez et recadrez chaque image TEP et TDM dans le champ de vision. Enregistrer l’image TEP sur son CT à l’aide d’un algorithme d’enregistrement rigide automatique basé sur des informations mutuelles15.
NOTA : Les méthodes d’enregistrement rigides ne sont appropriées que s’il n’y a pas de différences significatives de poids corporel ou de taille entre les animaux. Sinon, envisagez d’utiliser des méthodes élastiques. - Enregistrez chaque image CT à un CT de référence enregistré spatialement dans l’atlas du cerveau de rat Paxinos et Watson11 comme à l’étape 5.1.2. Enregistrez les paramètres de transformation résultants.
- Appliquer les paramètres de transformation obtenus à l’étape 5.1.3. à chaque image PET enregistrée en obtenant l’image PET enregistrée sur l’image CT de référence.
- Enregistrez toutes les images PET finales au format Nifti.
- Normalisation de l’intensité et lissage des images TEP
REMARQUE: La normalisation et le lissage de l’intensité sont effectués avec différents scripts internes basés sur des ressources accessibles au public.- Lissez les images PET avec un noyau gaussien isotrope de 2 mm de demi-maximum pleine largeur (FWHM) pour corriger d’éventuelles erreurs d’enregistrement.
REMARQUE: La taille du filtre de lissage dépendra de la résolution de l’acquisition du PET, mais il est recommandé d’utiliser un filtre de 2 à 3 fois la taille du voxel de FWHM. - Normaliser l’intensité des valeurs voxels TEP à l’aide d’une méthode de normalisation de cluster de référenceappropriée 16.
- Segmenter un masque cérébral à partir d’une IRM de référence enregistrée sur l’image CT de référence.
- Appliquez le masque cérébral à chaque image TEP pour exclure les voxels à l’extérieur du cerveau de l’analyse au niveau des voxels.
- Lissez les images PET avec un noyau gaussien isotrope de 2 mm de demi-maximum pleine largeur (FWHM) pour corriger d’éventuelles erreurs d’enregistrement.
- Analyse voxel
REMARQUE : L’analyse statistique, consistant en une analyse voxel des données d’image TEP, a été effectuée à l’aide d’un logiciel d’analyse d’imagerie spécialisé17.- Comparez les images TEP D1 et D2 à l’aide d’un test T apparié, en fixant des seuils statistiquement significatifs adéquats.
- Considérez comme résultats définitifs de l’analyse uniquement les grappes supérieures à 50 voxels adjacents afin de réduire les erreurs de type I.
- Représenter les résultats dans les cartes T superposées sur une IRM T2, montrant les changements dans le métabolisme cérébral du glucose induits par DBS (couleurs froides pour la réduction du FDG et couleurs chaudes pour l’incrément FDG).

Figure 2 : Flux de travail d’enregistrement de l’imagerie microTEP/TDM. Étapes détaillées du traitement de normalisation spatiale de l’image PET pour une analyse voxel ultérieure avec le logiciel de cartographie paramétrique statistique (SPM). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
Les animaux ont été sacrifiés à l’aide de CO2 à la fin de l’étude ou lorsque le bien-être de l’animal était compromis. Un exemple d’étude complète de TEP/TDM sur un animal opéré est présenté à la figure 3. Ainsi, l’électrode insérée dans le cerveau du rat peut être clairement observée dans l’image CT montrée à la figure 3A. Cette modalité d’imagerie fournit de bonnes informations anatomiques et facilite l’enregistrement des images FDG-TEP, étant donné que les modalités fonctionnelles ont tendance à être plus floues que les images structurelles (figures 3A, B). De plus, une image fusionnée des images FDG-TEP et CT du même animal est illustrée à la figure 3C.
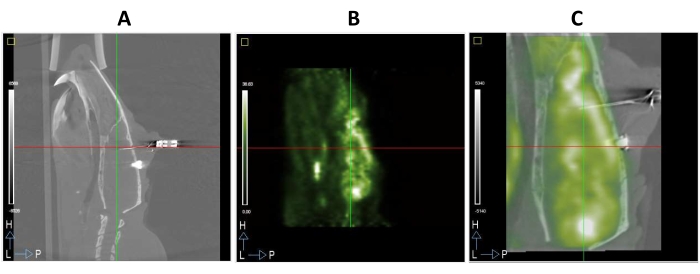
Figure 3 : Imagerie micro TEP/TDM du cerveau du rat avec des électrodes DBS implantées dans le mPFC. (A) Coupe sagittale d’une image CT. (B) Coupe sagittale d’une image FDG-PET du même animal que dans A. (C) Une image PET/CT fusionnée résulte de la superposition d’images A et B enregistrées spatialement dans le même espace stéréotaxique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
L’analyse voxel réalisée avec le logiciel SPM12 et fournie ici à titre d’exemple consistait en un test T apparié entre D1 (absence de DBS) et D2 (DBS pendant l’absorption de FDG), qui appartiennent en fait à une étude publiée précédemment8. Par conséquent, la figure 4 montre les différences métaboliques cérébrales entre les deux séances de TEP sous forme de cartes T superposées à des tranches cérébrales séquentielles de 1 mm d’épaisseur provenant d’une IRM enregistrée à l’image CT de référence (CTref). Ces différences consistaient en des augmentations et des diminutions de l’absorption de FDG sous forme de couleurs chaudes et froides, respectivement. En outre, un résumé détaillé des résultats statistiques obtenus à partir de l’analyse est présenté au tableau 1. Ici, nous indiquons la région cérébrale modulée, l’hémisphère cérébral dans lequel la modulation est observée, la statistique T, la taille de l’amas dans le nombre de voxels (k), la direction de la modulation (c’est-à-dire les changements hypermétaboliques ou hypométaboliques) et les valeurs p obtenues aux niveaux des pics et des amas. Ce type de tableau sert de description détaillée des changements modulateurs observés dans la figure de superposition de tranches.
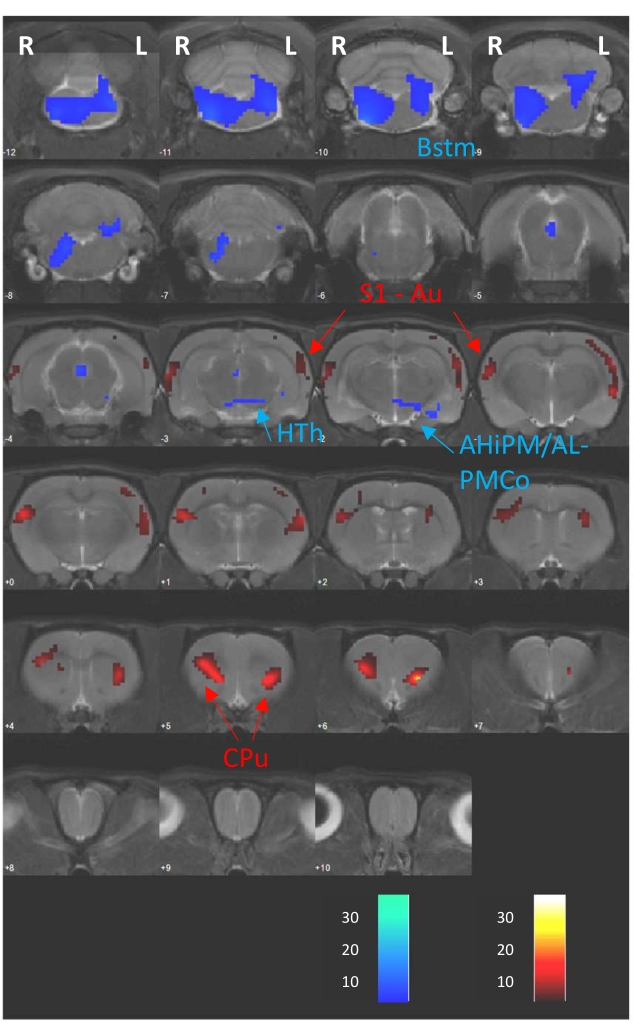
Figure 4 : Résultats du test T apparié. T-maps résultant de l’analyse voxel superposée sur une IRM T2 enregistrée sur le même CTref, montrant les changements métaboliques induits par un protocole DBS aigu (D2 vs D1). Les barres de couleur en bas de l’image représentent les valeurs T correspondant aux augmentations régionales (couleurs chaudes) et aux diminutions (couleurs froides) de l’absorption du FDG (p < 0,005; k > 50 voxels). Abréviation : AHiPM/AL - Zone amygdalohippocampique partie postéromédiale/antérolatérale, Au - Cortex auditif, Bstm - Tronc cérébral, Cpu - Caudé-putamen, HTh - Hypothalamus, L - Hémisphère gauche, PMCo - Noyau amygdaloïde cortical postéromédial, R - Hémisphère droit, S1 - Cortex somatosensoriel primaire. Ce chiffre a été modifié avec la permission de Casquero-Veiga et al.8. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| D1 vs D2 : Effet de stimulation | |||||||
| ROI | Côté | T | k | ↓/↑ | p unc. Niveau de crête | FWE | FWE |
| Niveau de crête | Au niveau du cluster | ||||||
| Bstm | R&L | 18.39 | 1549 | ↓ | <0,001 | 0.432 | <0,001 |
| AHiPM/AL-PMCo - HTh | L | 10.39 | ↓ | <0,001 | 0.949 | ||
| CPU | L | 37.56 | 738 | ↑ | <0,001 | 0.025 | <0,001 |
| S1-Au | 10.53 | ↑ | <0,001 | 0.947 | |||
| CPu-Pir | R | 17.74 | 695 | ↑ | <0,001 | 0.497 | <0,001 |
| S1-Au | 10.45 | ↑ | <0,001 | 0.948 | |||
Tableau 1 : Changements dans le métabolisme cérébral après une SCP aiguë dans le mPFC. D1 vs D2 : Effet de stimulation. Structures: AHiPM/AL: Zone amygdalohippocampique partie postéromédiale/antérolatérale, Au: Cortex auditif, Bstm: Tronc cérébral, CPu: Caudé-putamen, HTh: Hypothalamus, Pir: cortex piriforme, PMCo: Noyau amygdaloïde cortical postéromédial, S1: Cortex somatosensoriel primaire. ROI : Région d’intérêt. Côté : droite (R) et gauche (L). T : valeur t, k : taille du cluster. Métabolisme du glucose : augmentation (↑) et diminution (↓). p: p-value, unc.: non corrigé, FWE: Family wise error correction. Ce tableau a été modifié avec la permission de Casquero-Veiga et al.8.
Discussion
Compte tenu des progrès dans la compréhension de la fonction cérébrale et des réseaux neuronaux impliqués dans la physiopathologie des troubles neuropsychiatriques, de plus en plus de recherches reconnaissent le potentiel de la SCP dans un large éventail de pathologies neurologiques2. Cependant, le mécanisme d’action de cette thérapie reste incertain. Plusieurs théories ont tenté d’expliquer les effets obtenus dans des circonstances pathologiques et de stimulation spécifiques, mais l’hétérogénéité des études proposées rend très difficile l’obtention de conclusions définitives4. Par conséquent, malgré de grands efforts, il n’y a pas de véritable consensus, mais le nombre de patients subissant une intervention DBS continue d’augmenter18. Ensuite, comprendre les conséquences de la SCP dans le cerveau in vivo permettra de déterminer quels paramètres de stimulation et protocoles de stimulation sont les plus adaptés aux besoins de chaque patient, obtenant ainsi un meilleur taux de réussite. Dans ce contexte, les modalités de neuroimagerie fonctionnelle non invasives, telles que le FDG-PET, sont essentielles pour éclairer ce qui se passe réellement sous l’influence directe de la stimulation électrique dans le cerveau. Par exemple, dans le protocole longitudinal expliqué ici, la SCP est délivrée pendant la période d’absorption du radiotraceur de l’image TEP D2. Ainsi, la comparaison des études TEP D2 (DBS-ON) et D1 (DBS-OFF) permet de visualiser les régions cérébrales qui sont modulées par la stimulation électrique in vivo, car les propriétés de « piégeage métabolique » du FDG permettent d’enregistrer les changements cumulatifs qui se produisent directement lors de la stimulation13,19.
Dans l’ensemble, ce protocole décrit une stratégie réalisable pour évaluer les conséquences aiguës de la SCP dans le cerveau in vivo, mais la variété des combinaisons de paramètres et des protocoles de SCP disponibles est immense (par exemple, traitements continus ou intermittents 20, stimulation haute et basse fréquence21), et même les effets de la SCP peuvent différer avec le traitement en raison de l’inférence de changements directs dans le réseau cérébral sous l’influence de la stimulation22 . De plus, le nombre de possibilités devient encore plus grand compte tenu du nombre croissant de pathologies pour lesquelles la SCP est recommandée23. Par conséquent, les études longitudinales de neuroimagerie visant à découvrir les schémas d’activation neuronale qui permettent de prédire la réponse potentielle au traitement par SCP sont particulièrement pertinentes sur le plan clinique24,25. À cet égard, il existe un grand nombre d’études cliniques et précliniques qui ont évalué les effets thérapeutiques de différents protocoles DBS par FDG-PET (voir3 pour la revue). Ainsi, il existe plusieurs exemples dans lesquels le protocole DBS étudié contrecarre le schéma métabolique cérébral associé à la pathologie sous traitement, induisant une amélioration des symptômes du patient et prouvant l’utilité clinique des approches DBS-TEP. Un exemple de ceci est trouvé dans la stimulation de la région cingulaire sous-calleuse (SCC) pour les patients souffrant de dépression résistante au traitement. Le CSC est métaboliquement hyperactif chez les patients non médicamentés souffrant de dépression26, et cette hyperactivation est normalisée après la rémission de la dépression par un traitement pharmacologique, psychothérapeutique ou DBS27,28,29. Fait important, le métabolisme du CSC était plus élevé chez les patients qui ont répondu à la SCP avant de commencer la stimulation par rapport aux non-répondeurs. Cette étude a montré une précision de 80% dans la prédiction de la réponse au SCC-DBS29, soulignant l’importance des biomarqueurs d’imagerie dans la sélection des patients potentiels pour DBS. Par conséquent, le contexte expliqué reflète un historique de succès clinique des études FDG-PET visant à cartographier le schéma métabolique cérébral de la dépression avec les résultats thérapeutiques obtenus avec le SCC-DBS, ce qui devrait jeter les bases d’approches similaires axées sur d’autres troubles neuropsychiatriques et protocoles DBS à l’avenir.
En ce sens, afin d’observer les effets physiologiques de la SCP à l’aide du FDG-PET, il est particulièrement pertinent d’examiner attentivement le moment spécifique du protocole DBS à scanner. Ainsi, malgré l’application des mêmes paramètres DBS et du même protocole, le moment de l’acquisition de l’image déterminera clairement l’origine de la modulation observée, ce qui peut entraîner des malentendus potentiels en ne tenant pas compte de tous les facteurs impliqués dans la réponse finale obtenue8. Par conséquent, bien que la planification de la chirurgie soit déterminante pour jeter les bases du traitement ultérieur, la conception d’un protocole d’acquisition d’images adapté aux conséquences de la stimulation étudiée est essentielle pour bien comprendre le mécanisme moléculaire sous-jacent au traitement de stimulation appliqué. Dans cette optique, plusieurs facteurs peuvent modifier radicalement la réponse à un protocole DBS spécifique (ex. : paramètres de stimulation, insertion d’électrodes, structure cérébrale ciblée, pathologie sous traitement, durée et fréquence des séances de SCP, etc.) 7,8,30. Les phénomènes reflétés par les données recueillies dans l’étude FDG-PET dépendront du moment précis du traitement auquel les images sont acquises. Ensuite, tous ces points ouvrent différentes possibilités de recherche pour explorer la modulation induite par la SCP et contribuer à expliquer les mécanismes sous-jacents à cette thérapie.
Ainsi, malgré les grandes différences qui séparent les cerveaux des rongeurs et des humains, des pratiques adéquates devraient être mises en œuvre à tous les niveaux, dans le but de développer des protocoles translationnels. En ce sens, il ne faut pas ignorer que la SCP nécessite une chirurgie hautement invasive basée sur une craniotomie afin que les électrodes puissent accéder aux structures cérébrales profondes31. À ce stade, il existe deux sources importantes d’infection et de réaction inflammatoire: d’une part, l’exposition directe du tissu cérébral pendant la chirurgie et, d’autre part, l’insertion de deux éléments exogènes dans un organe interne, créant une cicatrice insertionnelle par leur trajectoire vers la ciblede stimulation 32. Par conséquent, la stérilisation du matériel chirurgical, le maintien d’une zone opératoire propre et des soins postopératoires adéquats basés sur des traitements antibiotiques et analgésiques33 sont essentiels pour s’assurer que le sujet tire le meilleur parti de l’intervention et dans les conditions les plus saines. En outre, cela est particulièrement pertinent dans les études d’imagerie FDG-TEP, car la survenue de complications post-chirurgicales peut modifier le schéma d’absorption des radiotraceurs étant donné que les processus inflammatoires et infectieux sont clairement considérés comme des signaux hypermétaboliques34, ce qui peut conduire à une réponse modifiée au traitement ou à une surestimation de la modulation produite par la SCP.
Cependant, cette méthodologie expérimentale est soumise à certaines limites : premièrement, les protocoles de SCP sont généralement des traitements à long terme, continus et chroniques. Ici, un protocole de neuroimagerie est montré pour évaluer les effets aigus de la SCP en temps réel. Ainsi, le moment suggéré pour les études de neuroimagerie ne serait pas adéquat pour obtenir de l’information sur la modulation à long terme induite par la SCP en temps quasi réel. Néanmoins, il peut jeter les bases de l’élaboration de différentes approches longitudinales qui serviront de connaissances de base pour comprendre les réponses dérivées de la SCP. Deuxièmement, étant donné que des animaux sains ont été utilisés pour illustrer cette méthode, l’application des techniques expliquées à différentes conditions pathologiques peut nécessiter leur adaptation pour assurer de meilleurs résultats et des conditions de bien-être optimales. Enfin, les analyses voxels nécessitent des échantillons de grande taille et/ou des facteurs de correction importants pour obtenir des résultats fiables, car elles sont toujours affectées par un problème de comparaisons statistiques multiples. Néanmoins, l’évaluation des conséquences de la SCP sur le métabolisme cérébral à l’aide du FDG-PET avec une approche voxel est un grand avantage en raison de la nature exploratoire intrinsèque de cette méthode, qui permet des analyses approfondies du cerveau entier sans avoir besoin d’hypothèses préalables.
Malgré les inconvénients expliqués de la combinaison de DBS et de FDG-PET, ces approches offrent une grande fenêtre d’opportunité. Ainsi, l’obtention d’informations métaboliques cérébrales de manière non invasive est un grand avantage dans le sens où les données neurophysiologiques peuvent être collectées auprès du sujet pendant la stimulation et à de nombreuses occasions différentes avec le traitement DBS. De plus, le FDG-PET est une technique de neuroimagerie en milieu clinique, ce qui renforce l’approche translationnelle qui motive cette méthode. De même, l’utilisation du FDG-PET est une alternative particulièrement adaptée car, contrairement à d’autres modalités d’imagerie, le signal obtenu n’est pas influencé par des distorsions secondaires des champs électriques ou magnétiques dérivés du système de neurostimulation, ce qui peut altérer à la fois la qualité de l’image et les performances du système24. D’autre part, l’intérêt de la recherche pour l’évaluation des conséquences modulatrices de la SCP ne se limite pas aux avantages thérapeutiques. En effet, puisque la SCP est une thérapie de neurostimulation focale, modulatrice et non permanente, elle peut également aider à démêler les voies d’activité neurofonctionnelle évaluées par les techniques d’imagerie moléculaire et en réponse aux stimuli électriques fournis par le système35. Cette information pourrait être particulièrement utile pour déchiffrer des énigmes neurophysiologiques non résolues dans des conditions saines et pathologiques. Enfin, la méthodologie expliquée dans ce manuscrit permet d’observer les effets de la neuromodulation induite par la SCP in vivo, ce qui constitue une stratégie puissante pour déterminer l’impact de la stimulation lors de son application. En bref, comprendre l’effet in vivo de la SCP aidera à comprendre les effets souhaités et indésirables de ce traitement, à prédire l’amélioration clinique et, finalement, à adapter les protocoles de stimulation aux besoins de chaque patient.
Déclarations de divulgation
Les auteurs déclarent qu’il n’y a pas de conflits d’intérêts en relation avec cet article.
Remerciements
Nous remercions Prof. Christine Winter, Julia Klein, Alexandra de Francisco et Yolanda Sierra pour leur soutien inestimable dans l’optimisation de la méthodologie décrite ici. MLS a été soutenu par le Ministerio de Ciencia e Innovación, Instituto de Salud Carlos III (numéro de projet PI17/01766 et numéro de subvention BA21/0030) cofinancé par le Fonds européen de développement régional (FEDER), « A way to make Europe »; CIBERSAM (numéro de projet CB07/09/0031); Delegación del Gobierno para el Plan Nacional sobre Drogas (numéro de projet 2017/085); Fundación Mapfre; et Fundación Alicia Koplowitz. MCV a été soutenu par la Fundación Tatiana Pérez de Guzmán el Bueno en tant que boursier de cette institution, et le Programme conjoint de l’UE - Recherche sur les maladies neurodégénératives (JPND). La DRM a été soutenue par Consejería de Educación e Investigación, Comunidad de Madrid, cofinancée par le Fonds social européen « Investir dans votre avenir » (numéro de subvention PEJD-2018-PRE/BMD-7899). NLR a été soutenu par Instituto de Investigación Sanitaria Gregorio Marañón, « Programa Intramural de Impulso a la I+D+I 2019 ». Les travaux de médecine ont été soutenus par le Ministerio de Ciencia e Innovación (MCIN) et l’Instituto de Salud Carlos III (ISCIII) (PT20/00044). Le CNIC est soutenu par l’Instituto de Salud Carlos III (ISCIII), le Ministerio de Ciencia e Innovación (MCIN) et la Fondation Pro CNIC, et est un centre d’excellence Severo Ochoa (SEV-2015-0505).
matériels
| Name | Company | Catalog Number | Comments |
| 7-Tesla Biospec 70/20 scanner | Bruker, Germany | SN0021 | MRI scanner for small animal imaging |
| Betadine | Meda Pharma S.L., Spain | 644625.6 | Iodine solution (iodopovidone) |
| Beurer IL 11 | Beurer | SN87318 | Infra-red light |
| Bipolar cable 50 cm w/50 cm mesh covering up to 100 cm | Plastics One, USA | 305-305 (CM) | |
| Bipolar cable TT2 50 cm up to 100 cm | Plastics One, USA | 305-340/2 | Bipolar cable TT2 50 cm up to 100 cm |
| Buprex | Schering-Plough, S.A | 961425 | Buprenorphine (analgesic) |
| Ceftriaxona Reig Jofré 1g IM | Laboratorio Reig Jofré S.A., Spain | 624239.1 | Ceftriaxone (antibiotic) |
| Commutator | Plastics One, USA | SL2+2C | 4 Channel Commutator for DBS |
| Concentric bipolar platinum-iridium electrodes | Plastics One, USA | MS303/8-AIU/Spc | Electrodes for DBS |
| Driller | Bosh | T58704 | Driller |
| FDG | Curium Pharma Spain S.A., Spain | ----- | 2-[18F]fluoro-2-deoxy-D-glucose (PET radiotracer) |
| Heating pad | DAGA, Spain | 23115 | Heating pad |
| Ketolar | Pfizer S.L., Spain | 776211.9 | Ketamine (anesthetic drug) |
| Lipolasic 2 mg/g | Bausch & Lomb S.A, Spain | 65277 | Ophthalmic lubricating gel |
| MatLab R2021a | The MathWorks, Inc | Support software for SPM12 | |
| MRIcro | McCausland Center for Brain Imaging, University of South Carolina, USA | v2.1.58-0 | Software for imaging preprocessing and analysis |
| Multimodality Workstation (MMWKS) | BiiG, Spain | Software for imaging processing and analysis | |
| Omicrom VISION VET | RGB Medical Devices, Spain | 731100 ReV B | Cardiorrespiratory monitor for small imaging |
| Prevex Cotton buds | Prevex, Finland | ----- | Cotton buds |
| Sevorane | AbbVie Spain, S.L.U, Spain | 673186.4 | Sevoflurane (inhalatory anesthesia) |
| Small screws | Max Witte GmbH | 1,2 x 2 DIN 84 A2 | Small screws |
| Standard U-Frame Stereotaxic Instrument for Rat, 18° Ear Bar | Harvard Apparatus, USA | 75-1801 | Two-arms Stereotactic frame for rat |
| Statistical Parametric Mapping (SPM12) | The Wellcome Center for Human Neuroimaging, UCL Queen Square Institute of Neurology, UK | SPM12 | Software for voxel-wise imaging analysis |
| STG1004 | Multi Channel Systems GmbH, Germany | STG1004 | Isolated stimulator |
| SuperArgus PET/CT scanner | Sedecal, Spain | S0026403 | NanoPET/CT scanner for small animal imaging |
| Suture thread with needle, 1/º | Lorca Marín S.A., Spain | 55325 | Braided natural silk non-absorbable suture 1/0, with triangle needle |
| Technovit 4004 (powder and liquid) | Kulzer Technique, Germany | 64708471; 64708474 | Acrylic dental cement for craniotomy tap |
| Wistar rats (Rattus norvergicus) | Charles River, Spain | animal facility | Animal model used |
| Xylagesic | Laboratorios Karizoo, A.A, Spain | 572599-4 | Xylazine (anesthetic drug) |
| Normon S.A., Spain | 602910 | Mepivacaine in gel for topical use |
Références
- Gildenberg, P. L. Neuromodulation: A historical perspective. Neuromodulation. 1, 9-20 (2009).
- Lee, D. J., Lozano, C. S., Dallapiazza, R. F., Lozano, A. M. Current and future directions of deep brain stimulation for neurological and psychiatric disorders. Journal of Neurosurgery. 131 (2), 333-342 (2019).
- Casquero-Veiga, M. Preclinical molecular neuroimaging in deep brain stimulation. Complutense University of Madrid. , (2021).
- Blaha, C. D. Theories of deep brain stimulation mechanisms. Deep Brain Stimulation: Indictions and Applications. , 314-338 (2016).
- Fins, J. J. Deep brain stimulation: Ethical issues in clinical practice and neurosurgical research. Neuromodulation. 1, 81-91 (2009).
- Desmoulin-Canselier, S., Moutaud, B. Animal models and animal experimentation in the development of deep brain stimulation: From a specific controversy to a multidimensional debate. Frontiers in Neuroanatomy. 13, 51 (2019).
- Casquero-Veiga, M., Hadar, R., Pascau, J., Winter, C., Desco, M., Soto-Montenegro, M. L. Response to deep brain stimulation in three brain targets with implications in mental disorders: A PET study in rats. PLOS One. 11 (12), 0168689 (2016).
- Casquero-Veiga, M., García-García, D., Desco, M., Soto-Montenegro, M. L. Understanding deep brain stimulation: In vivo metabolic consequences of the electrode insertional effect. BioMed Research International. 2018, 1-6 (2018).
- Casquero-Veiga, M., García-García, D., Pascau, J., Desco, M., Soto-Montenegro, M. L. Stimulating the nucleus accumbens in obesity: A positron emission tomography study after deep brain stimulation in a rodent model. PLOS One. 13 (9), 0204740 (2018).
- Pascau, J., Vaquero, J. J., Abella, M., Cacho, R., Lage, E., Desco, M. Multimodality workstation for small animal image visualization and analysis. Scientific Papers. Molecular Imaging and Biology. 8, 97-98 (2006).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (1998).
- Roy, M., et al. A dual tracer PET-MRI protocol for the quantitative measure of regional brain energy substrates uptake in the rat. Journal of Visualized Experiments: JoVE. (82), e50761 (2013).
- Klein, J., et al. A novel approach to investigate neuronal network activity patterns affected by deep brain stimulation in rats. Journal of Psychiatric Research. 45 (7), 927-930 (2011).
- Soto-Montenegro, M. L., Pascau, J., Desco, M. Response to deep brain stimulation in the lateral hypothalamic area in a rat model of obesity: In vivo assessment of brain glucose metabolism. Molecular Imaging and Biology. , 830-837 (2014).
- Pascau, J., et al. Automated method for small-animal PET image registration with intrinsic validation. Molecular Imaging and Biology. 11 (2), 107-113 (2009).
- Andersson, J. L. R. How to estimate global activity independent of changes in local activity. Neuroimage. 244 (60), 237-244 (1997).
- . Wellcome Trust Centre for Neuroimaging SPM12-Statitstical Parametric Mapping Available from: https://www.fil.ion.ucl.ac.uk/spm/software/spm12/ (2022)
- Lozano, A. M., et al. Deep brain stimulation: current challenges and future directions. Nature Reviews Neurology. 15 (3), (2019).
- Boecker, H., Drzezga, A. A perspective on the future role of brain pet imaging in exercise science. NeuroImage. 131, (2016).
- Sprengers, M., et al. Deep brain stimulation reduces evoked potentials with a dual time course in freely moving rats: Potential neurophysiological basis for intermittent as an alternative to continuous stimulation. Epilepsia. 61 (5), 903-913 (2020).
- Middlebrooks, E. H., et al. Acute brain activation patterns of high- versus low-frequency stimulation of the anterior nucleus of the thalamus during deep brain stimulation for epilepsy. Neurosurgery. 89 (5), 901-908 (2021).
- Ashkan, K., Rogers, P., Bergman, H., Ughratdar, I. Insights into the mechanisms of deep brain stimulation. Nature Reviews Neurology. 13 (9), 548-554 (2017).
- Williams, N. R., Taylor, J. J., Lamb, K., Hanlon, C. A., Short, E. B., George, M. S. Role of functional imaging in the development and refinement of invasive neuromodulation for psychiatric disorders. World Journal of Radiology. 6 (10), 756-778 (2014).
- Rodman, A. M., Dougherty, D. D. . Nuclear medicine in neuromodulation. Neuromodulation in Psychiatry. , 81-99 (2016).
- Albaugh, D. L., Shih, Y. -. Y. I. Neural circuit modulation during deep brain stimulation at the subthalamic nucleus for Parkinson's disease: what have we learned from neuroimaging studies. Brain Connectivity. 4 (1), 1-14 (2014).
- Mayberg, H. S., et al. Reciprocal limbic-cortical function and negative mood: Converging PET findings in depression and normal sadness. Neurology, and Radiology. 156 (5), 675-682 (1999).
- Kennedy, S. H., et al. Differences in brain glucose metabolism between responders to CBT and Venlafaxine in a 16-week randomized controlled trial. American Journal of Psychiatry. 164 (5), 778-788 (2007).
- Kennedy, S. H., et al. Changes in regional brain glucose metabolism measured with positron emission tomography after paroxetine treatment of major depression. American Journal of Psychiatry. 158 (6), 899-905 (2001).
- Brown, E. C., Clark, D. L., Forkert, N. D., Molnar, C. P., Kiss, Z. H. T., Ramasubbu, R. Metabolic activity in subcallosal cingulate predicts response to deep brain stimulation for depression. Neuropsychopharmacology. 45, 1681-1688 (2020).
- Klooster, D. C. W., et al. Technical aspects of neurostimulation: Focus on equipment, electric field modeling, and stimulation protocols. Neuroscience & Biobehavioral Reviews. 65, 113-141 (2016).
- Kasoff, W., Gross, R. E. Deep brain stimulation: Introduction and Technical Aspects. Neuromodulation in Psychiatry. , 245-275 (2016).
- Perez-Caballero, L., et al. Early responses to deep brain stimulation in depression are modulated by anti-inflammatory drugs. Molecular Psychiatry. 19, 607-614 (2014).
- Solera Ruiz, I., UñaOrejón, R., Valero, I., Laroche, F. Craniotomy in the conscious patient. Considerations in special situations. Spanish Journal of Anesthesiology and Resuscitation. 60 (7), 392-398 (2013).
- Casali, M., et al. State of the art of 18F-FDG PET/CT application in inflammation and infection: a guide for image acquisition and interpretation. Clinical and Translational Imaging. 9 (4), 299-339 (2021).
- Gonzalez-Escamilla, G., Muthuraman, M., Ciolac, D., Coenen, V. A., Schnitzler, A., Groppa, S. Neuroimaging and electrophysiology meet invasive neurostimulation for causal interrogations and modulations of brain states. NeuroImage. 220, 117144 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon