Method Article
Im lebenden Organismus Positronen-Emissions-Tomographie zur Aufdeckung von Aktivitätsmustern, die durch tiefe Hirnstimulation bei Ratten induziert werden
In diesem Artikel
Zusammenfassung
Wir beschreiben eine präklinische experimentelle Methode zur Bewertung der metabolischen Neuromodulation, die durch akute Tiefe Hirnstimulation mit in vivo FDG-PET induziert wird. Dieses Manuskript umfasst alle experimentellen Schritte, von der stereotaktischen Chirurgie über die Anwendung der Stimulationsbehandlung bis hin zur Aufnahme, Verarbeitung und Analyse von PET-Bildern.
Zusammenfassung
Die Tiefenhirnstimulation (THS) ist eine invasive neurochirurgische Technik, die auf der Anwendung elektrischer Impulse auf Gehirnstrukturen basiert, die an der Pathophysiologie des Patienten beteiligt sind. Trotz der langen Geschichte der THS bleiben ihr Wirkmechanismus und die entsprechenden Protokolle unklar, was die Notwendigkeit von Forschung unterstreicht, um diese Rätsel zu lösen. In diesem Sinne stellt die Bewertung der In-vivo-Effekte von THS mit funktionellen Bildgebungsverfahren eine leistungsfähige Strategie dar, um den Einfluss der Stimulation auf die Gehirndynamik zu bestimmen. Hier wird ein experimentelles Protokoll für präklinische Modelle (Wistar-Ratten) in Kombination mit einer Längsschnittstudie [18F]-Fluordesoxyclucose-Positronen-Emissions-Tomographie (FDG-PET) beschrieben, um die akuten Folgen von THS auf den Hirnstoffwechsel zu beurteilen. Zunächst wurden die Tiere stereotaktisch operiert, um Elektroden bilateral in den präfrontalen Kortex zu implantieren. Ein postoperativer Computertomograph (CT) jedes Tieres wurde erstellt, um die Elektrodenplatzierung zu überprüfen. Nach einer Woche der Erholung wurde von jedem operierten Tier ein erstes statisches FDG-PET ohne Stimulation (D1) und zwei Tage später (D2) ein zweites FDG-PET erworben, während die Tiere stimuliert wurden. Dazu wurden die Elektroden nach der Verabreichung von FDG an die Tiere mit einem isolierten Stimulator verbunden. So wurden die Tiere während der FDG-Aufnahmephase (45 min) stimuliert und die akuten Auswirkungen von THS auf den Gehirnstoffwechsel aufgezeichnet. Angesichts des explorativen Charakters dieser Studie wurden FDG-PET-Bilder durch einen voxelweisen Ansatz analysiert, der auf einem gepaarten T-Test zwischen D1- und D2-Studien basiert. Insgesamt ermöglicht die Kombination von THS- und Bildgebungsstudien die Beschreibung der Neuromodulationsfolgen auf neuronale Netze, was letztendlich dazu beiträgt, die Rätsel rund um THS zu lösen.
Einleitung
Der Begriff Neurostimulation umfasst eine Reihe verschiedener Techniken, die darauf abzielen, das Nervensystem mit einem therapeutischen Ziel1 zu stimulieren. Unter ihnen sticht die Tiefe Hirnstimulation (THS) als eine der am weitesten verbreiteten Neurostimulationsstrategien in der klinischen Praxis hervor. THS besteht aus der Stimulation tiefer Hirnkerne mit elektrischen Impulsen, die von einem Neurostimulator abgegeben werden, der direkt in den Körper des Patienten implantiert wird, durch Elektroden, die in das Gehirnziel platziert werden, um durch stereotaktische Chirurgie moduliert zu werden. Die Anzahl der Artikel, die die Durchführbarkeit der DBS-Anwendung bei verschiedenen neurologischen und psychiatrischen Erkrankungen bewerten, wächst kontinuierlich2, obwohl nur einige von ihnen von der Food and Drug Association (FDA) zugelassen wurden (d. h. essentieller Tremor, Parkinson-Krankheit, Dystonie, Zwangsstörung und medizinisch refraktäre Epilepsie)3 . Darüber hinaus wird eine große Anzahl von Gehirnzielen und Stimulationsprotokollen für die THS-Behandlung von viel mehr Pathologien als offiziell genehmigt erforscht, aber keiner von ihnen gilt als endgültig. Diese Inkonsistenzen in der THS-Forschung und den klinischen Verfahren können zum Teil auf ein mangelndes vollständiges Verständnis ihres Wirkmechanismus zurückzuführensein 4. Daher werden große Anstrengungen unternommen, um die In-vivo-Effekte von THS auf die Gehirndynamik zu entschlüsseln, da jeder Fortschritt, wie klein er auch sein mag, dazu beitragen wird, DBS-Protokolle für einen größeren therapeutischen Erfolg zu verfeinern.
In diesem Zusammenhang öffnen molekulare bildgebende Verfahren ein direktes Fenster, um in vivo neuromodulatorische Effekte von THS zu beobachten. Diese Ansätze bieten die Möglichkeit, nicht nur die Auswirkungen der THS während der Anwendung zu bestimmen, sondern auch die Art ihrer Folgen zu entschlüsseln, unerwünschte Nebenwirkungen und klinische Verbesserungen zu verhindern und sogar die Stimulationsparameter an die Bedürfnisse des Patienten anzupassen5. Unter diesen Methoden ist die Positronen-Emissions-Tomographie (PET) mit 2-Desoxy-2-[18F]fluor-D-Glucose (FDG) von besonderem Interesse, da sie spezifische Echtzeitinformationen über den Aktivierungszustand verschiedener Hirnregionen liefert6. Insbesondere bietet die FDG-PET-Bildgebung eine indirekte Bewertung der neuronalen Aktivierung basierend auf dem physiologischen Prinzip der metabolischen Kopplung zwischen Neuronen und Gliazellen6. In diesem Sinne haben mehrere klinische Studien DBS-modulierte Gehirnaktivitätsmuster unter Verwendung von FDG-PET berichtet (siehe3 für die Übersicht). Dennoch haben klinische Studien leicht einige Nachteile, wenn sie sich auf Patienten konzentrieren, wie Heterogenität oder Rekrutierungsschwierigkeiten, die ihr Forschungspotenzial stark einschränken6. Dieser Kontext führt dazu, dass Forscher Tiermodelle menschlicher Erkrankungen verwenden, um biomedizinische Ansätze vor ihrer klinischen Translation zu bewerten oder, wenn sie bereits in der klinischen Praxis angewendet werden, den physiologischen Ursprung therapeutischer Vorteile oder Nebenwirkungen zu erklären. Trotz der großen Distanzen zwischen der menschlichen Pathologie und dem modellierten Zustand bei Labortieren sind diese präklinischen Ansätze für einen sicheren und effektiven Übergang in die klinische Praxis unerlässlich.
Dieses Manuskript beschreibt ein experimentelles DBS-Protokoll für murine Modelle, kombiniert mit einer longitudinalen FDG-PET-Studie, um die akuten Folgen von THS auf den Gehirnstoffwechsel abzuschätzen. Die mit diesem Protokoll erzielten Ergebnisse können dazu beitragen, die komplizierten modulatorischen Muster zu entschlüsseln, die durch THS auf die Gehirnaktivität induziert werden. Daher wird eine geeignete experimentelle Strategie zur Untersuchung der Konsequenzen der Stimulation in vivo bereitgestellt, die es Klinikern ermöglicht, therapeutische Effekte unter bestimmten Umständen zu antizipieren und dann die Stimulationsparameter an die Bedürfnisse des Patienten anzupassen.
Protokoll
Versuchstierversuche wurden gemäß der Richtlinie 2010/63/EU des Rates der Europäischen Gemeinschaften durchgeführt und von der Ethikkommission für Tierversuche des Krankenhauses Gregorio Marañón genehmigt. Eine grafische Zusammenfassung des Versuchsprotokolls ist in Abbildung 1A dargestellt.
1. Lokalisierung des Gehirnziels durch in vivo Neuroimaging
- Tierpräparation
HINWEIS: Männliche Wistar-Ratten von ~ 300 g wurden verwendet.- Legen Sie das Tier in einen Anästhesie-Induktionskasten und verschließen Sie die Oberseite.
- Schalten Sie den Sevofluran-Vaporizer ein (5% für Induktion in 100%O2). Wenn die Ratte betäubt ist, schalten Sie den Gasfluss auf den Nasenzapfen um. Bestätigen Sie den Zustand der Anästhesie, indem Sie die Rattenpfote kneifen.
- Legen Sie das Tier in Rückenlage auf das CT-Bett und behalten Sie die Sevofluran-Anästhesie bei (3% für die Aufrechterhaltung in 100% O2).
- CT-Bildgebung
HINWEIS: Die Auswahl von Stromstärke, Spannung, Anzahl der Projektionen, Anzahl der Aufnahmen und Voxelauflösung hängt vom CT-Scanner ab. Hier wurden folgende Parameter verwendet: 340 mA, 40 KV, 360 Projektionen, 8 Aufnahmen und 200 μm Auflösung 7,8,9.- Befestigen Sie die Gesichtsmaske oder den Nasenkegel an der Ratte.
- Sichern Sie den Rattenkörper an Kopf, Schultern, Hüften und Schwanz mit Seidenband, um genügend Halt ohne Beschädigung zu gewährleisten.
- Überwachen Sie die Ratte kontinuierlich.
- Suchen Sie den Kopf in der Mitte des Sichtfeldes des CT-Scanners.
- Fahren Sie mit der Erfassung des CT-Bildes mit den Aufnahmeparametern gemäß den Spezifikationen des Scanners fort.
- Nach 10 Minuten, wenn der In-vivo-CT-Scan abgeschlossen ist, stoppen Sie den Sevofluran-Fluss und legen Sie die Ratte in den MRT-Scanner.
- MR-Bildgebung
HINWEIS: Die Spezifikationen der Scanerfassung variieren je nach Scanner, einschließlich verschiedener Softwaresysteme und, was noch wichtiger ist, der spezifischen Forschungsfrage. Hier kam ein 7-Tesla-Scanner zum Einsatz. Es wurde eine T2-gewichtete Spin-Echo-Sequenz 7,8,9 mit TE = 33 ms, TR = 3732 ms und einer Schichtdicke von 0,8 mm (34 Scheiben), Matrixgröße von 256 x 256 Pixel mit einem Sichtfeld von 3,5 x 3,5 cm2 verwendet.- Legen Sie das Tier in Rückenlage auf das MRT-Bett und behalten Sie die Sevofluran-Anästhesie bei (3% für die Aufrechterhaltung in 100% O2).
- Befestigen Sie den Kopf an einem stereotaktischen Rahmen, der auf dem Scannerbett platziert ist, um Kopfbewegungen während der MRT-Erfassung zu vermeiden. Sichern Sie auch den Rest des Rattenkörpers mit Seidenband.
- Suchen Sie den Kopf in der Mitte des Sichtfeldes des MRT-Scanners.
- Sobald die Position korrekt ist, fahren Sie mit der Aufnahme des MRT-Bildes fort.
- Wenn die In-vivo-MRT-Untersuchung abgeschlossen ist, stoppen Sie den Sevofluranfluss und setzen Sie die Ratte in ihren Käfig.
- Stellen Sie eine Heizlampe in der Nähe des Käfigs auf, da Ratten während des Scans normalerweise ihre Körpertemperatur senken.
- Überwachen Sie die Ratte bis zur Erholung von der Anästhesie.
- Atlas-Kolokalisierung und Berechnung der Zielkoordinaten
- Sobald CT- und MRT-Bilder nach den Empfehlungen des Scanners aufgenommen und rekonstruiert wurden, registrieren Sie die CT- und MRT-Bilder mit.
- Verwenden Sie eine Bildbearbeitungssoftware, um CT und MRT räumlich zu normalisieren, indem Sie einen automatischen starren Registrierungsalgorithmus verwenden, der auf gegenseitigen Informationen basiert10.
- Lokalisieren Sie die Bregma-Linie im mitregistrierten Bild und messen Sie den Abstand in der vorderen / hinteren (AP: +3,5 mm), Mittellinie/lateralen (ML: +0,6 mm) und dorsoventralen (DV: -3,4 mm) Achse von Bregma zum Ziel (d. H. Medialer präfrontaler Kortex, mPFC), gemäß dem Paxinos und Watson Rattenhirnatlas11.
HINWEIS: Die Koordinaten von Bregma zum Ziel können zwischen Ratten unterschiedlich sein, wenn Gewicht, Größe, Geschlecht und Rasse unterschiedlich sind.
2. Stereotaktische Chirurgie
VORSICHT: Autoklavieren Sie alle chirurgischen Materialien, Implantate und stereotaktischen Einheiten vor Gebrauch und desinfizieren Sie den chirurgischen Bereich, um Infektionen und Komplikationen zu vermeiden, die das Tierwohl beeinträchtigen können. Verwenden Sie sterile OP-Handschuhe und bedecken Sie das Tier mit klebrigen Vorhängen, um eine Kontamination zu vermeiden.
- Tierpräparation und Anästhesie
- Den Tieren wurden am Tag vor der Operation 0,1 mg/kg Buprenorphin intraperitoneal verabreicht. Legen Sie das Tier in eine Anästhesie-Induktionsbox-Kammer und versiegeln Sie die Oberseite.
- Schalten Sie den Sevofluran-Vaporizer ein (5% für Induktion in 100%O2).
- Wenn die Ratte liegend ist, schalten Sie den Sevofluran-Vaporizer aus und entfernen Sie die Ratte aus der Boxkammer.
- Intraperitoneal eine Mischung aus Ketamin (100 mg/kg) und Xylazin (10 mg/kg) verabreichen, um das Tier zu betäuben.
- Warten Sie, bis das Tier vollständig betäubt ist. Überprüfen Sie den Grad der Anästhesie, indem Sie den Interdigitalbereich kneifen.
- Rasieren Sie den Bereich zwischen den Ohren und den Augen.
- Platzierung im stereotaktischen Rahmen und Kraniotomie
- Stellen Sie das Tier in Bauchlage auf den stereotaktischen Rahmen und verwenden Sie den Kopfhalteadapter für Ratten, um das Tier während der Operation in der richtigen Position zu halten.
- Stellen Sie die Unbeweglichkeit des Kopfes sicher, indem Sie die Rattenohrstangen verwenden. Seien Sie vorsichtig mit dem Einführen der Ohrbügel, da ein zu tiefes Einführen das Trommelfell beschädigen kann.
- Tragen Sie ein ophthalmologisches Gleitgel auf die Augen auf, um Trockenheit während der Operation zu verhindern, und bedecken Sie sie mit steriler Gaze.
- Bedecken Sie das Tier mit klebrigen Vorhängen, um eine Kontamination zu vermeiden.
- Tragen Sie Jodpovidonlösung auf den rasierten Bereich auf und reinigen Sie ihn mit steriler Gaze.
- Tragen Sie Mepivacain in Gel auf den rasierten Bereich auf, um den lokalen Bereich zu betäuben.
- Machen Sie einen Längsschnitt in der Haut über dem Schädel zwischen den Ohren, der sich 1,5-2 cm von Lambda bis Bregma (dh vom Schädelscheitel zu den Augen) erstreckt.
- Legen Sie den Schädel mit Hilfe von 2 oder 3 Klemmen frei. Entfernen Sie das Periost mit einem Wattestäbchen und reinigen Sie das Blut mit Kochsalzlösung, um Bregma und die sagittalen Nähte freizulegen. Entfernen Sie die überschüssige Kochsalzlösung mit Gaze.
- Kratzen Sie die Schädeloberfläche mit einem Skalpell, um die Haftung des Zahnzements zu verbessern. Reinigen Sie den Bereich mit einem mit Wasserstoffperoxid getränkten Wattestäbchen.
- Elektrodenplatzierung und Fixierung am Schädel
- Begradigen Sie die Elektroden mit einer Kunststoffpinzette, um die richtige Platzierung während der Operation zu gewährleisten.
HINWEIS: In diesem Protokoll werden konzentrische bipolare Platin-Iridium-Elektroden mit Masse verwendet. - Suchen Sie eine Elektrode am Halter des rechten Arms des stereotaktischen Rahmens.
HINWEIS: Es kann notwendig sein, den Halter an die Elektrode anzupassen, um sie besser zu fixieren (siehe Abbildung 1B). Stellen Sie sicher, dass die Elektrode parallel zur Achse des Halters ist. - Bewegen Sie den rechten Arm, der die Elektrode hält, durch den stereotaktischen Rahmen und legen Sie die Spitze der Elektrode genau über Bregma. Versuchen Sie, die Elektrodenspitze so nah wie möglich an den Schädel zu bringen, ohne sie jedoch zu berühren, um eine Verformung der Elektrode zu vermeiden, und notieren Sie sich die resultierenden Koordinaten für Bregma, die vom stereotaktischen Rahmen bereitgestellt werden. Machen Sie eine Markierung auf dem Schädel, die die Ausgangsposition der Elektrode mit einem chirurgischen Stift anzeigt.
- Bewegen Sie den Halter zu den AP- und ML-Koordinaten, die Sie in Schritt 1.4.3 erhalten haben, und markieren Sie den Schädel mit einem chirurgischen Stift, der die Position des Elektrodenziels anzeigt.
- Entfernen Sie den rechten Arm des stereotaktischen Rahmens, der die Elektrode hält. Achten Sie darauf, nichts mit der Elektrode zu berühren.
- Verwenden Sie eine kleine elektrische Bohrmaschine, um ein Loch durch den Schädel (ca. 1-1,5 mm Durchmesser) in der Zielposition zu machen, bis die Dura sichtbar ist. Stoppen Sie Blutungen mit einem Wattestäbchen.
- Bohren Sie 4 Löcher entlang des Schädels, um 4 Schrauben (vorzugsweise Edelstahlschrauben von 2-3 mm Länge) zu finden, um die Oberfläche des Dentalzements zu vergrößern und den Boden zu lokalisieren. Befestigen Sie die 4 Schrauben.
- Lokalisieren Sie den rechten Arm des stereotaktischen Rahmens mit der rechten Elektrode. Bewegen Sie den Arm in die berechnete Position, die mit dem Loch übereinstimmen sollte. Senken Sie dann die Elektrode, bis sie die Dura Mater berührt. Diese Position dient als 0-Ebene in DV-Richtung.
- Führen Sie die Spitze der Elektrode in DV-Richtung ein, indem Sie die DV-Position in Schritt 1.4.3 verwenden. Reinigen Sie das Blut und die Zerebrospinalflüssigkeit um den Bereich der Elektrode mit einem Wattestäbchen.
- Befestigen Sie die Masse an einer der Schrauben, die der Elektrode am nächsten sind.
- Tragen Sie Zahnzement um die Elektrode und Schrauben auf und achten Sie darauf, den Zahnzement zu formen und scharfe Kanten zu vermeiden, die das Tier verletzen könnten. Zahnzement wird in einer Schicht aufgetragen, um eine Überhitzung / thermische Verletzung des Gewebes / Schädels zu verhindern. Dicke Schichten benötigen mehr Zeit, um auszuhärten, bevor zusätzliche Schichten hinzugefügt werden. Stellen Sie sicher, dass der Zahnzement vollständig ausgehärtet ist, bevor Sie die Elektrode aus dem Halter entfernen.
VORSICHT: Bei der Herstellung des Dentalzements entstehen giftige Dämpfe aus der Mischung, die mit der Erstarrung des Zements enden. Tragen Sie daher ab diesem Zeitpunkt und bis zum Ende der Operation eine Schutzmaske, die gegen chemische Gase wirksam ist. - Wiederholen Sie den gleichen Vorgang aus den Schritten 2.3.2-2.3.11 für die andere Hemisphäre des Gehirns.
- Tragen Sie mehr Zahnzement auf, um eine Kappe zu bilden, ohne die Elektrode zu bedecken. Warten Sie, bis es aushärtet.
- Verwenden Sie geflochtene Naturseide nicht resorbierbare Naht 1/0, mit einer Dreiecksnadel, um vor und hinter der Kappe zu nähen. Entfernen Sie bei Bedarf die nicht resorbierbaren Nähte zu einem bestimmten Zeitpunkt entsprechend der Körperregion, in der sie sich befinden. Verwenden Sie eine Jodpovidonlösung, um den chirurgischen Bereich zu desinfizieren.
- Entfernen Sie die Ratte aus dem stereotaktischen Rahmen.
- Begradigen Sie die Elektroden mit einer Kunststoffpinzette, um die richtige Platzierung während der Operation zu gewährleisten.
- CT-Bildgebung zur Bestätigung der Elektrodenplatzierung
- Führen Sie die Schritte 1.2.4-1.2.5 aus und sehen Sie sich Abbildung 1C an.
- Sobald der In-vivo-CT-Scan abgeschlossen ist, setzen Sie die Ratte in ihren Käfig.
- Führen Sie die Schritte 1.3.6 aus. und 1.3.7.
- Nachsorge
- Antibiotikum (Ceftriaxon, 100 mg/kg, subkutan) für 5 Tage und Analgetikum (Buprenorphin, 0,1 mg/kg, intraperitoneal) für 3 Tage als postoperative Behandlung verabreichen. Dieses Antibiotika-Regime kann um 5 Tage verlängert werden, wenn Anzeichen einer Infektion (Rötung, Schwellung und Exsudat) um die Kappe herum beobachtet werden.
- Führen Sie täglich eine visuelle Inspektion jedes Tieres durch, suchen Sie nach Anzeichen von Schmerzen oder Stress und reinigen Sie die Kappe mit Jodpovidonlösung.
- Intensivpflege für bis zu 1 Woche nach der Operation.
3. PET/CT-Bildgebung
HINWEIS: Jedes Tier wird zwei PET/CT-Studien (d. h. in Abwesenheit und während der THS-Verabreichung) unter inhalativer Anästhesie unterzogen, um die akuten Wirkungen der elektrischen Stimulation zu beurteilen. Beide Scan-Sitzungen folgen dem gleichen Bildgebungsprotokoll und werden 1 Woche nach der Operation (D1, ohne Stimulation) und 2 Tage später (D2, während DBS) durchgeführt.
- Tierpräparation und Anästhesie
- Beschleunigen Sie die Ratte für 8-12 h vor jedem PET-Scan, um eine höhere Gehirnaufnahme von FDG zu ermöglichen und das Signal-Rausch-Verhältniszu verbessern 12.
- Legen Sie das Tier in einen Anästhesie-Induktionskasten und verschließen Sie die Oberseite.
- Schalten Sie den Sevofluran-Vaporizer ein (5% für Induktion in 100%O2).
- Wenn die Ratte betäubt ist, schalten Sie den Gasfluss auf den Nasenzapfen um.
- FDG-Injektions- und Aufnahmezeit
ACHTUNG: FDG ist ein Radiotracer, also erwägen Sie Strahlenschutzmaßnahmen, um eine Radioaktivitätsbelastung zu vermeiden. Bestätigen Sie, dass die Einrichtung über alle Genehmigungen verfügt, mit radioaktiven Verbindungen zu arbeiten.- Bewahren Sie die FDG-Durchstechflasche in einem mit Blei ausgekleideten Schrank auf, bis sie verwendet wird, um unerwünschte Radioaktivitätsexposition zu vermeiden.
- Füllen Sie eine kleine Spritze (~27G) mit ~37 MBq der FDG-Lösung in dem weniger möglichen Volumen, wie in einem Aktivimeter gemessen.
- Legen Sie ein Heizkissen unter den Schwanz des Tieres oder verwenden Sie Infrarotlicht, um die Schwanzvenen zu erweitern.
- Sobald die Seitenvenen in der Spitze des Schwanzes sichtbar sind, reinigen Sie den Bereich mit Hygienealkohol (96%).
- Injizieren Sie die FDG-Lösung durch eine der seitlichen Schwanzvenen und nähern Sie sich der Vene mit einer Spritze parallel zu ihrer Flugbahn und mit der Abschrägung der Nadel nach oben.
- Schalten Sie die Narkose aus und setzen Sie das Tier wieder in seinen Käfig, um sich unter einer Heizlampe vollständig zu erholen.
- Lassen Sie 45 Minuten Radiotracer aufnehmen, bevor Sie mit der Bildaufnahme beginnen. Halten Sie das Tier während dieser Zeit wach und in einer bleiabgeschirmten Kammer.
- Im Falle der D2-Studie ist DBS wie unten in Abschnitt 4 (Verabreichung elektrischer Stimulation) während der FDG-Aufnahmephase erläutert.
- PET-Erfassung und Bildgebungsrekonstruktion
HINWEIS: Die Spezifikationen für die PET-Bildaufnahme hängen vom Scanner und der Scanzeit ab. Für dieses Protokoll wurde ein statisches PET-Bild für 45 min mit einem Kleintier-PET/CT-Scanner unter Verwendung eines Energiefensters von 400-700 keV 7,8,9 aufgenommen. Überprüfen Sie die Spezifikationen der PET/CT-Ausrüstung, bevor Sie das Erfassungsprotokoll entwerfen.- 45 Minuten nach der FDG-Injektion das Tier in eine Anästhesie-Induktionsbox geben und die Oberseite versiegeln.
- Schalten Sie den Sevofluran-Vaporizer ein (5% für Induktion in 100%O2).
- Das Tier wird in das PET/CT-Bett gebracht und in Rückenlage gelegt, wobei die Nase am Nasenzapfen der Anästhesie befestigt und die Sevofluran-Anästhesie aufrechterhalten wird (3% für die Aufrechterhaltung in 100% O2). Bestätigen Sie den Zustand der Anästhesie, indem Sie die Rattenpfote kneifen.
- Wiederholen Sie die Schritte 1.2.2 und 1.2.3.
- Suchen Sie den Kopf in der Mitte des Sichtfeldes des PET-Scanners.
- Erfassen Sie das statische PET-Bild mit Erfassungsparametern gemäß den Spezifikationen des Scanners.
- Rekonstruieren Sie das Bild mit einem 2D-OSEM (Ordered Subset Expectation Maximization Algorithm) und wenden Sie Zerfalls- und Totzeitkorrekturen 7,8,9 an.
- Wenn der In-vivo-PET-Scan abgeschlossen ist, halten Sie den Fluss von Sevofluran zur Ratte aufrecht, um anschließend mit der CT-Erfassung fortzufahren, ohne die Kopfposition des Tieres auf dem Scannerbett zu verschieben.
- CT-Akquisition
- Ohne die Position des Tieres in Bezug auf die vorherige PET-Aufnahme zu ändern, fahren Sie mit der Aufnahme des CT-Bildes fort.
- Wiederholen Sie die Schritte 1.2.3-1.2.5.
- Sobald der In-vivo-CT-Scan abgeschlossen ist, stoppen Sie den Sevofluran-Fluss und setzen Sie die Ratte zur Erholung in ihren jeweiligen Käfig.
- Führen Sie die Schritte 1.3.6 aus. und 1.3.7.
- Halten Sie das Tier in einer bleiabgeschirmten Kammer, bis die Radioaktivität vollständig zerfällt.
4. Verabreichung von Elektrostimulation
HINWEIS: Die elektrische Stimulation erfolgt während der FDG-Aufnahmephase in der D2-Bildgebungssitzung. Für dieses Protokoll wurde die Stimulation mit einem isolierten Stimulator durchgeführt, mit einer hochfrequenten (130 Hz) elektrischen Stimulation in einem Konstantstrommodus, 150 μA, und einer Pulsbreite von 100 μs 7,13,14.
- Konfiguration des DBS-Stimulators
- Bereiten Sie den isolierten Stimulator und die erforderlichen Drähte in einem breiten und ruhigen Raum vor, mit genügend Platz für die Tierkäfige und minimalem Einfluss von potenziell störenden Reizen.
- Verbinden Sie die Stimulationsdrähte mit den Drehgelenken, damit sich die Tiere in ihren Käfigen und mit dem Stimulator frei bewegen können.
- Stellen Sie die Stimulationsparameter entsprechend den Anforderungen der Studie ein.
- Verwenden Sie ein Oszilloskop, um den aktuellen Modus, die Frequenz und die Pulsbreite zu überprüfen. Bestätigen Sie die biphasische Wellenform mit einer rechteckigen Impulsform (Abbildung 1D).
- DBS-Lieferung
- Nach der D1-Bildgebung und bis zur D2-Erfassung werden die Tiere einem täglichen Gewöhnungsprotokoll (45 min/Tag) unterzogen, um sie an das Stimulationssystem und die Handhabung durch den Bediener zu gewöhnen, um unerwünschte Stressreaktionen in D2 zu vermeiden. Verbinden Sie das Stimulationssystem mit jedem Tier, ohne jedoch die Stimulation einzuschalten.
- Sobald der Stimulator eingerichtet und dem Tier FDG injiziert wurde, verbinden Sie den Schwenk mit den Elektroden und schalten Sie den Stimulator ein.
- Schalten Sie nach 45 Minuten den Stimulator aus, trennen Sie das Tier vom Wirbel und übertragen Sie es schnell in eine Anästhesieinduktionskammer, um Schritt 3.3 zu beginnen.
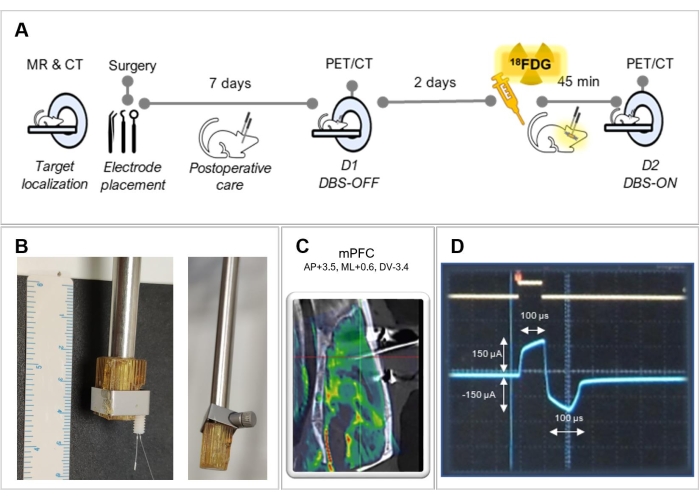
Abbildung 1: Versuchsplan . (A) Zusammenfassung der in diesem Protokoll befolgten Versuchsschritte. (B) Repräsentative Bilder einer Halteranpassung zur besseren Fixierung der Elektrode, mit (links) und ohne (rechts) Elektrode. (C) Fusionsbild eines MRT mit einem CT eines operierten Tieres, das die korrekte Elektrodenplatzierung im medialen präfrontalen Kortex (mPFC) zeigt. (D) Screenshot des Oszilloskopbildschirms mit der biphasischen Stimulationswellenform. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
5. PET-Bildverarbeitung und -analyse
HINWEIS: Führen Sie die gleiche Bildverarbeitung für Bilder von D1 und D2 durch, um vergleichbare Daten für die nachfolgende voxelweise statistische Analyse zu erhalten.
- Räumliche Erfassung von PET-Bildern
- Verwenden Sie spezielle Bildbearbeitungssoftware. Der gesamte Registrierungsworkflow ist in Abbildung 2 dargestellt.
- Zentrieren und schneiden Sie jedes PET- und CT-Bild in das Sichtfeld. Registrieren Sie das PET-Bild in seinem CT unter Verwendung eines automatischen starren Registrierungsalgorithmus, der auf gegenseitigen Informationen basiert15.
HINWEIS: Starre Registrierungsmethoden sind nur dann geeignet, wenn es keine signifikanten Unterschiede in Körpergewicht oder Körpergröße zwischen den Tieren gibt. Andernfalls sollten Sie die Verwendung elastischer Methoden in Betracht ziehen. - Registrieren Sie jedes CT-Bild in einem Referenz-CT, das räumlich im Paxinos und Watson Rattenhirnatlas11 registriert ist, wie in Schritt 5.1.2. Speichern Sie die resultierenden Transformationsparameter.
- Wenden Sie die in Schritt 5.1.3 erhaltenen Transformationsparameter an. zu jedem registrierten PET-Bild, das das auf dem Referenz-CT-Bild registrierte PET-Bild erhält.
- Speichern Sie alle fertigen PET-Bilder im Nifti-Format.
- Intensitätsnormalisierung und Glättung von PET-Bildern
HINWEIS: Die Normalisierung und Glättung der Intensität erfolgt mit verschiedenen internen Skripten, die auf öffentlich verfügbaren Ressourcen basieren.- Glätten Sie die PET-Bilder mit einem isotropen Gaußkern von 2 mm Full-Width Half Maximum (FWHM), um mögliche Registrierungsfehler zu korrigieren.
HINWEIS: Die Größe des Glättungsfilters hängt von der Auflösung der PET-Erfassung ab, es wird jedoch empfohlen, einen Filter mit der 2-3-fachen Voxelgröße von FWHM zu verwenden. - Normalisieren Sie die Intensität der PET-Voxelwerte unter Verwendung einer geeigneten Referenzcluster-Normalisierungsmethode16.
- Segmentieren Sie eine Gehirnmaske aus einem Referenz-MRT, das für das Referenz-CT-Bild registriert ist.
- Tragen Sie die Gehirnmaske auf jedes PET-Bild auf, um Voxel außerhalb des Gehirns von der voxelweisen Analyse auszuschließen.
- Glätten Sie die PET-Bilder mit einem isotropen Gaußkern von 2 mm Full-Width Half Maximum (FWHM), um mögliche Registrierungsfehler zu korrigieren.
- Voxel-weise Analyse
HINWEIS: Die statistische Analyse, bestehend aus einer voxelweisen Analyse der PET-Bilddaten, wurde mit einer speziellen Bildanalysesoftware17 durchgeführt.- Vergleichen Sie D1- und D2-PET-Bilder mit einem gepaarten T-Test und legen Sie angemessene statistische signifikante Schwellenwerte fest.
- Betrachten Sie als definitive Ergebnisse der Analyse nur die Cluster, die größer als 50 benachbarte Voxel sind, um Typ-I-Fehler zu reduzieren.
- Stellen Sie die Ergebnisse in T-Maps dar, die auf einem T2-MRT überlagert sind und die Veränderungen im Glukosehirnstoffwechsel zeigen, die durch DBS induziert werden (kalte Farben für FDG-Reduktion und warme Farben für FDG-Inkrement).

Abbildung 2: Registrierungs-Workflow für Mikro-PET/CT-Bildgebung. Detaillierte Schritte der räumlichen Normalisierungsverarbeitung von PET-Bildern für die anschließende voxelweise Analyse mit SPM-Software (Statistical Parametric Mapping). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergebnisse
Die Tiere wurden am Ende der Studie oder wenn das Wohlergehen des Tieres beeinträchtigt war, mit CO2 geopfert. Ein Beispiel für eine vollständige PET/CT-Studie an einem operierten Tier ist in Abbildung 3 dargestellt. So kann die in das Rattengehirn eingeführte Elektrode in dem in Abbildung 3A gezeigten CT-Bild deutlich beobachtet werden. Diese Bildgebungsmodalität liefert gute anatomische Informationen und erleichtert die Registrierung von FDG-PET-Bildern, da funktionelle Modalitäten tendenziell verschwommener sind als Strukturbilder (Abbildungen 3A,B). Zusätzlich ist in Abbildung 3C ein zusammengeführtes Bild der FDG-PET- und CT-Bilder desselben Tieres dargestellt.
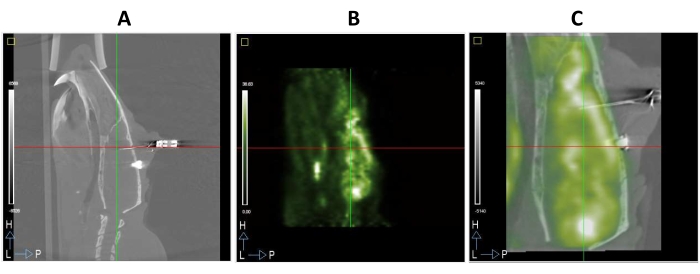
Abbildung 3: Mikro-PET/CT-Bildgebung des Rattengehirns mit THS-Elektroden, die in das mPFC implantiert wurden . (A) Sagittaler Schnitt eines CT-Bildes. (B) Sagittaler Schnitt eines FDG-PET-Bildes desselben Tieres wie in A. (C) Ein fusioniertes PET/CT-Bild ergab sich aus der Überlagerung von A- und B-Bildern, die räumlich im selben stereotaktischen Raum registriert waren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Die voxelweise Analyse, die mit der SPM12-Software durchgeführt und hier als Beispiel angeführt wurde, bestand aus einem gepaarten T-Test zwischen D1 (Abwesenheit von DBS) und D2 (DBS während der FDG-Aufnahme), die tatsächlich zu einer zuvor veröffentlichten Studie gehören8. Daher zeigt Abbildung 4 die metabolischen Unterschiede im Gehirn zwischen beiden PET-Sitzungen als T-Maps, die auf sequenziellen 1 mm dicken Hirnschnitten aus einem MRT überlagert sind, das im Referenz-CT-Bild (CTref) registriert ist. Diese Unterschiede bestanden aus Zu- und Abnahmen der FDG-Aufnahme, die sich als warme bzw. kalte Farben zeigten. Außerdem ist eine detaillierte Zusammenfassung der statistischen Ergebnisse der Analyse in Tabelle 1 dargestellt. Hier geben wir die modulierte Hirnregion, die Gehirnhemisphäre, in der die Modulation beobachtet wird, die T-Statistik, die Größe des Clusters in der Anzahl der Voxel (k), die Richtung der Modulation (d.h. hypermetabolische oder hypometabolische Veränderungen) und die p-Werte an, die auf Spitzen- und Clusterebene erhalten werden. Dieser Tabellentyp dient als detaillierte Beschreibung der modulatorischen Änderungen, die in der Slice-Overlay-Abbildung beobachtet werden.
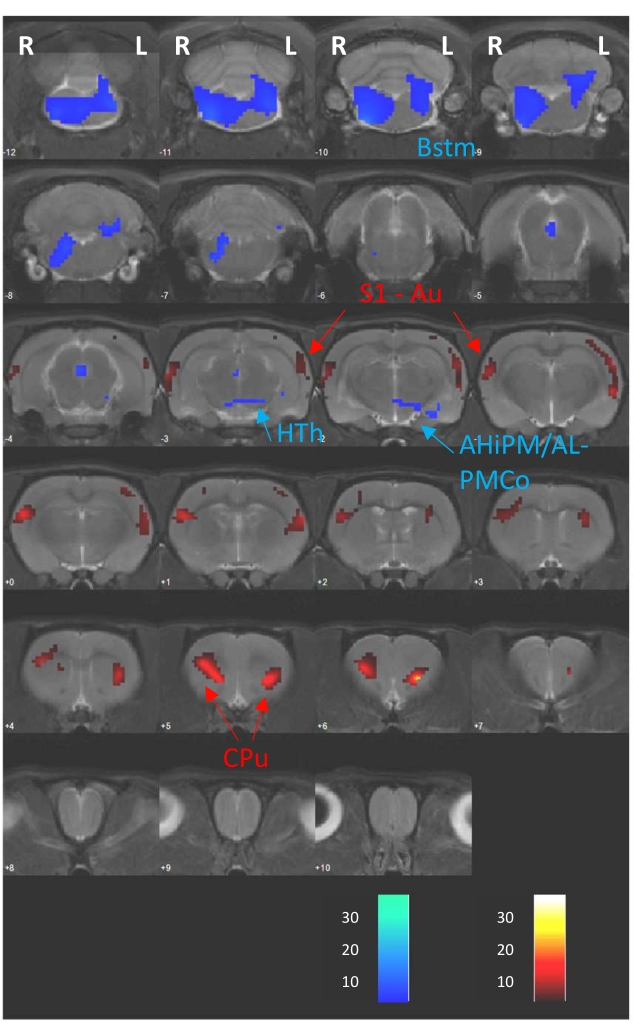
Abbildung 4: Gepaarte T-Testergebnisse. T-Karten, die sich aus der voxelweisen Analyse ergeben, die auf einem T2-MRT überlagert sind, das im selben CTref registriert ist und die metabolischen Veränderungen zeigt, die durch ein akutes DBS-Protokoll induziert werden (D2 vs. D1). Die Farbbalken am unteren Bildrand stellen T-Werte dar, die regionalen Zunahmen (warme Farben) und Abnahmen (kalte Farben) der FDG-Aufnahme entsprechen (p < 0,005; k > 50 Voxel). Abkürzung: AHiPM/AL - Amygdalohippocampal area posteromedial/anterolateral, Au - Auditory Cortex, Bstm - Brainstem, Cpu - Caudate-putamen, HTh - Hypothalamus, L - Linke Hemisphäre, PMCo - Posteromedialer kortikaler Amygdaloidkern, R - Rechte Hemisphäre, S1 - Primärer somatosensorischer Kortex. Diese Zahl wurde mit Genehmigung von Casquero-Veiga et al.8 geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| D1 vs D2: Stimulationseffekt | |||||||
| Roi | Seite | T | k | ↓/↑ | p unc. Spitzenpegel | FWE | FWE |
| Spitzenpegel | Cluster-Ebene | ||||||
| Bstm | F&L | 18.39 | 1549 | ↓ | <0,001 | 0.432 | <0,001 |
| AHiPM/AL-PMCo - HTh | L | 10.39 | ↓ | <0,001 | 0.949 | ||
| CPU | L | 37.56 | 738 | ↑ | <0,001 | 0.025 | <0,001 |
| S1-Au | 10.53 | ↑ | <0,001 | 0.947 | |||
| CPu-Pir | R | 17.74 | 695 | ↑ | <0,001 | 0.497 | <0,001 |
| S1-Au | 10.45 | ↑ | <0,001 | 0.948 | |||
Tabelle 1: Veränderungen im Gehirnstoffwechsel nach akutem THS bei mPFC. D1 vs D2: Stimulationseffekt. Strukturen: AHiPM/AL: Amygdalohippocampaler Bereich posteromedialer / anterolateraler Teil, Au: auditorischer Kortex, Bstm: Hirnstamm, CPu: Caudat-putamen, HTh: Hypothalamus, Pir: Piriformer Kortex, PMCo: Posteromedialer kortikaler amygdaloider Kern, S1: Primärer somatosensorischer Kortex. ROI: Region von Interesse. Seite: Rechts (R) und Links (L). T: t-Wert, k: Clustergröße. Glukosestoffwechsel: Erhöhung (↑) und Abnahme (↓). p: p-Wert, unc.: unkorrigiert, FWE: Familienbezogene Fehlerkorrektur. Diese Tabelle wurde mit Genehmigung von Casquero-Veiga et al.8 geändert.
Diskussion
Angesichts der Fortschritte im Verständnis der Gehirnfunktion und der neuronalen Netzwerke, die an der Pathophysiologie neuropsychiatrischer Erkrankungen beteiligt sind, erkennen immer mehr Forschungen das Potenzial von THS in einer Vielzahl von neurologisch basierten Pathologien2. Der Wirkmechanismus dieser Therapie bleibt jedoch unklar. Mehrere Theorien haben versucht, die unter spezifischen pathologischen und stimulierenden Umständen erzielten Wirkungen zu erklären, aber die Heterogenität der vorgeschlagenen Studien macht es sehr schwierig, endgültige Schlussfolgerungen zu ziehen4. Daher gibt es trotz großer Bemühungen keinen wirklichen Konsens, aber die Zahl der Patienten, die sich einer THS-Intervention unterziehen, wächst weiter18. Wenn man dann die THS-Konsequenzen im Gehirn in vivo versteht, kann man herausfinden, welche Stimulationsparameter und Stimulationsprotokolle den Bedürfnissen jedes Patienten besser entsprechen, wodurch eine bessere Erfolgsrate erzielt wird. In diesem Zusammenhang sind nicht-invasive funktionelle Neuroimaging-Modalitäten wie FDG-PET unerlässlich, um Aufschluss darüber zu geben, was unter dem direkten Einfluss der elektrischen Stimulation im Gehirn wirklich passiert. Zum Beispiel wird in dem hier erläuterten Längsschnittprotokoll DBS während der Radiotracer-Aufnahmephase des D2-PET-Bildes geliefert. So ermöglicht der Vergleich der D2 (DBS-ON) und D1 (DBS-OFF) PET-Studien die Visualisierung der Gehirnregionen, die durch die elektrische Stimulation in vivo moduliert werden, da die "metabolischen Trapping" -Eigenschaften von FDG die Aufzeichnung der kumulativen Veränderungen ermöglichen, die direkt während der Stimulation auftreten13,19.
Insgesamt beschreibt dieses Protokoll eine praktikable Strategie, um die akuten Folgen von THS im Gehirn in vivo zu bewerten, aber die Vielfalt der verfügbaren DBS-Parameterkombinationen und -protokolle ist immens (z. B. kontinuierliche vs. intermittierende Behandlungen20, Hoch- vs. Niederfrequenzstimulation 21), und sogar die Wirkungen der THS können sich zusammen mit der Behandlung unterscheiden, da direkte Veränderungen im Gehirnnetzwerk unter dem Stimulationseinfluss abgeleitet werden22 . Darüber hinaus wird die Anzahl der Möglichkeiten angesichts der zunehmenden Anzahl von Pathologien, für die DBS empfohlen wird, noch größer23. Daher sind longitudinale Neuroimaging-Studien, die darauf abzielen, die neuronalen Aktivierungsmuster aufzudecken, die eine Vorhersage des potenziellen Ansprechens auf eine THS-Behandlung ermöglichen, von besonderer klinischer Relevanz24,25. In diesem Zusammenhang gibt es eine Vielzahl klinischer und präklinischer Studien, die die therapeutischen Wirkungen verschiedener THS-Protokolle mittels FDG-PET bewertet haben (siehe3 zur Übersicht). So gibt es mehrere Beispiele, in denen das untersuchte DBS-Protokoll dem metabolischen Muster des Gehirns entgegenwirkt, das mit der zu behandelnden Pathologie verbunden ist, eine Verbesserung der Patientensymptome induziert und die klinische Nützlichkeit von DBS-PET-Ansätzen beweist. Ein Beispiel dafür ist die Stimulation der subkallosalen cingulären Region (SCC) bei Patienten mit behandlungsresistenter Depression. SCC ist metabolisch hyperaktiv bei nicht medikamentösen Patienten mit Depression26, und diese Hyperaktivierung wird nach Remission der Depression durch pharmakologische, psychotherapeutische oder THS-Behandlungnormalisiert 27,28,29. Wichtig ist, dass der SCC-Metabolismus bei den Patienten, die vor Beginn der Stimulation auf THS ansprachen, höher war als bei Non-Respondern. Diese Studie zeigte eine Genauigkeit von 80% bei der Vorhersage des Ansprechens auf SCC-DBS29 und unterstreicht die Bedeutung bildgebender Biomarker bei der Auswahl potenzieller Patienten für THS. Daher spiegelt der erläuterte Kontext eine Geschichte des klinischen Erfolgs von FDG-PET-Studien wider, die darauf abzielen, das metabolische Muster der Depression im Gehirn mit den mit SCC-DBS erzielten therapeutischen Ergebnissen abzubilden, was die Grundlage für ähnliche Ansätze bilden sollte, die sich in Zukunft auf andere neuropsychiatrische Störungen und DBS-Protokolle konzentrieren.
In diesem Sinne ist es für die Beobachtung der physiologischen Effekte von DBS mit FDG-PET besonders relevant, den spezifischen Zeitpunkt des zu scannenden DBS-Protokolls sorgfältig zu berücksichtigen. Trotz der Anwendung der gleichen DBS-Parameter und des gleichen Protokolls bestimmt der Zeitpunkt für die Bildaufnahme eindeutig den Ursprung der beobachteten Modulation, was zu potenziellen Missverständnissen führen kann, da nicht alle Faktoren berücksichtigt werden, die an der endgültigen Antwort beteiligt sind8. Während also die Planung der Operation entscheidend für die Schaffung der Grundlage für die anschließende Therapie ist, ist die Entwicklung eines Bildaufnahmeprotokolls, das den Folgen der untersuchten Stimulation angemessen ist, unerlässlich, um den molekularen Mechanismus, der der angewandten Stimulationsbehandlung zugrunde liegt, vollständig zu verstehen. In diesem Sinne können mehrere Faktoren die Reaktion auf ein bestimmtes DBS-Protokoll drastisch verändern (z. B. Stimulationsparameter, Elektrodeninsertion, Zielstruktur des Gehirns, Pathologie in Behandlung, Dauer und Häufigkeit von DBS-Sitzungen usw.). 7,8,30. Welche Phänomene sich in den in der FDG-PET-Studie erhobenen Daten widerspiegeln, hängt vom konkreten Zeitpunkt im Therapieverlauf ab, zu dem die Bilder aufgenommen werden. All diese Punkte eröffnen verschiedene Forschungsmöglichkeiten, um die THS-induzierte Modulation zu erforschen und zur Erklärung der Mechanismen beizutragen, die dieser Therapie zugrunde liegen.
Trotz der großen Unterschiede, die Nagetier- und menschliche Gehirne trennen, sollten daher angemessene Praktiken auf allen Ebenen implementiert werden, um translationale Protokolle zu entwickeln. In diesem Sinne sollte nicht außer Acht gelassen werden, dass THS eine hochinvasive Operation auf der Grundlage einer Kraniotomie erfordert, damit Elektroden auf tiefe Hirnstrukturen zugreifen können31. An diesem Punkt gibt es zwei wichtige Quellen für Infektionen und Entzündungsreaktionen: zum einen die direkte Exposition von Hirngewebe während der Operation und zum anderen die Einführung von zwei exogenen Elementen in ein inneres Organ, wodurch durch ihre Flugbahn zum Stimulationsziel32 eine Insertionsnarbe entsteht. Daher sind die Sterilisation der chirurgischen Ausrüstung, die Aufrechterhaltung eines sauberen Operationsbereichs und eine angemessene postoperative Versorgung auf der Grundlage antibiotischer und analgetischer Behandlungen33 unerlässlich, um sicherzustellen, dass der Proband den größten Nutzen aus dem Eingriff und unter den gesündesten Bedingungen zieht. Darüber hinaus ist dies von besonderer Relevanz in FDG-PET-Bildgebungsstudien, da das Auftreten postoperativer Komplikationen das Muster der Radiotraceraufnahme verändern kann, da entzündliche und infektiöse Prozesse eindeutig als hypermetabolische Signale34 angesehen werden, was zu einem veränderten Ansprechen auf die Behandlung oder zu einer Überschätzung der durch THS erzeugten Modulation führen kann.
Diese experimentelle Methodik unterliegt jedoch einigen Einschränkungen: Erstens sind DBS-Protokolle in der Regel langfristige, kontinuierliche und chronische Behandlungen. Hier wird ein Neuroimaging-Protokoll gezeigt, um die akuten Auswirkungen von THS in Echtzeit zu bewerten. Daher wäre das vorgeschlagene Timing für Neuroimaging-Studien nicht ausreichend, um Informationen über DBS-induzierte Langzeitmodulation nahezu in Echtzeit zu erhalten. Nichtsdestotrotz kann es die Grundlage für die Entwicklung verschiedener Längsschnittansätze bilden, die als Basiswissen für das Verständnis von DBS-abgeleiteten Antworten dienen. Zweitens, da gesunde Tiere verwendet wurden, um diese Methode zu veranschaulichen, kann die Anwendung der erklärten Techniken auf verschiedene pathologische Bedingungen ihre Anpassung erfordern, um bessere Ergebnisse und optimale Tierschutzbedingungen zu gewährleisten. Schließlich erfordern voxelweise Analysen große Stichprobengrößen und/oder starke Korrekturfaktoren, um zuverlässige Ergebnisse zu erhalten, da sie immer von einem Problem mehrerer statistischer Vergleiche betroffen sind. Nichtsdestotrotz ist die Bewertung der Folgen von THS auf den Hirnstoffwechsel mittels FDG-PET mit einem voxelweisen Ansatz ein großer Vorteil aufgrund des intrinsischen explorativen Charakters dieser Methode, die umfangreiche Ganzhirnanalysen ohne vorherige Annahmen ermöglicht.
Trotz der erklärten Nachteile der Kombination von DBS und FDG-PET bieten diese Ansätze ein großes Zeitfenster. Daher ist die nicht-invasive Gewinnung von Gehirnstoffwechselinformationen ein großer Vorteil in dem Sinne, dass neurophysiologische Daten während der Stimulation und bei vielen verschiedenen Gelegenheiten zusammen mit der THS-Behandlung vom Subjekt gesammelt werden können. Darüber hinaus ist FDG-PET ein bildgebendes Verfahren im klinischen Umfeld, das den translationalen Ansatz, der diese Methode motiviert, verstärkt. Ebenso ist die Verwendung von FDG-PET eine besonders geeignete Alternative, da das erhaltene Signal im Gegensatz zu anderen Bildgebungsmodalitäten nicht durch sekundäre Verzerrungen in den elektrischen oder magnetischen Feldern beeinflusst wird, die vom Neurostimulationssystem abgeleitet werden, was sowohl die Bildqualität als auch die Systemleistung beeinträchtigen kann24. Andererseits ist das Forschungsinteresse an der Bewertung der modulatorischen Folgen der THS nicht auf den therapeutischen Nutzen beschränkt. Da es sich bei THS um eine fokale, modulatorische und nicht permanente Neurostimulationstherapie handelt, kann sie auch dazu beitragen, die neurofunktionellen Aktivitätswege zu entschlüsseln, die durch molekulare Bildgebungsverfahren und als Reaktion auf elektrische Reize des Systems35 bewertet werden. Diese Informationen könnten besonders wertvoll sein, um ungelöste neurophysiologische Rätsel bei gesunden und pathologischen Zuständen zu entschlüsseln. Schließlich bietet die in diesem Manuskript erläuterte Methodik die Möglichkeit, die Auswirkungen der DBS-induzierten Neuromodulation in vivo zu beobachten, was eine leistungsfähige Strategie zur Bestimmung der Auswirkungen der Stimulation während ihrer Anwendung darstellt. Kurz gesagt, das Verständnis der In-vivo-Wirkung von THS wird dazu beitragen, die gewünschten und unerwünschten Wirkungen dieser Behandlung zu verstehen, klinische Verbesserungen vorherzusagen und letztendlich die Stimulationsprotokolle an die Bedürfnisse jedes Patienten anzupassen.
Offenlegungen
Die Autoren erklären, dass im Zusammenhang mit diesem Artikel keine Interessenkonflikte bestehen.
Danksagungen
Wir danken Prof. Christine Winter, Julia Klein, Alexandra de Francisco und Yolanda Sierra für ihre unschätzbare Unterstützung bei der Optimierung der hier beschriebenen Methodik. MLS wurde vom Ministerio de Ciencia e Innovación, Instituto de Salud Carlos III (Projektnummer PI17/01766 und Fördernummer BA21/0030) unterstützt, kofinanziert vom Europäischen Fonds für regionale Entwicklung (EFRE), "A way to make Europe"; CIBERSAM (Projektnummer CB07/09/0031); Delegación del Gobierno para el Plan Nacional sobre Drogas (Projektnummer 2017/085); Fundación Mapfre; und Fundación Alicia Koplowitz. MCV wurde von der Fundación Tatiana Pérez de Guzmán el Bueno als Stipendiatin dieser Einrichtung und dem EU Joint Programme - Neurodegenerative Disease Research (JPND) unterstützt. DRM wurde unterstützt von Consejería de Educación e Investigación, Comunidad de Madrid, kofinanziert durch den Europäischen Sozialfonds "Investing in your future" (Förderkennzeichen PEJD-2018-PRE/BMD-7899). NLR wurde unterstützt vom Instituto de Investigación Sanitaria Gregorio Marañón, "Programa Intramural de Impulso a la I+D+I 2019". Die MD-Arbeit wurde vom Ministerio de Ciencia e Innovación (MCIN) und dem Instituto de Salud Carlos III (ISCIII) unterstützt (PT20/00044). Das CNIC wird vom Instituto de Salud Carlos III (ISCIII), dem Ministerio de Ciencia e Innovación (MCIN) und der Stiftung Pro CNIC unterstützt und ist ein Severo Ochoa Center of Excellence (SEV-2015-0505).
Materialien
| Name | Company | Catalog Number | Comments |
| 7-Tesla Biospec 70/20 scanner | Bruker, Germany | SN0021 | MRI scanner for small animal imaging |
| Betadine | Meda Pharma S.L., Spain | 644625.6 | Iodine solution (iodopovidone) |
| Beurer IL 11 | Beurer | SN87318 | Infra-red light |
| Bipolar cable 50 cm w/50 cm mesh covering up to 100 cm | Plastics One, USA | 305-305 (CM) | |
| Bipolar cable TT2 50 cm up to 100 cm | Plastics One, USA | 305-340/2 | Bipolar cable TT2 50 cm up to 100 cm |
| Buprex | Schering-Plough, S.A | 961425 | Buprenorphine (analgesic) |
| Ceftriaxona Reig Jofré 1g IM | Laboratorio Reig Jofré S.A., Spain | 624239.1 | Ceftriaxone (antibiotic) |
| Commutator | Plastics One, USA | SL2+2C | 4 Channel Commutator for DBS |
| Concentric bipolar platinum-iridium electrodes | Plastics One, USA | MS303/8-AIU/Spc | Electrodes for DBS |
| Driller | Bosh | T58704 | Driller |
| FDG | Curium Pharma Spain S.A., Spain | ----- | 2-[18F]fluoro-2-deoxy-D-glucose (PET radiotracer) |
| Heating pad | DAGA, Spain | 23115 | Heating pad |
| Ketolar | Pfizer S.L., Spain | 776211.9 | Ketamine (anesthetic drug) |
| Lipolasic 2 mg/g | Bausch & Lomb S.A, Spain | 65277 | Ophthalmic lubricating gel |
| MatLab R2021a | The MathWorks, Inc | Support software for SPM12 | |
| MRIcro | McCausland Center for Brain Imaging, University of South Carolina, USA | v2.1.58-0 | Software for imaging preprocessing and analysis |
| Multimodality Workstation (MMWKS) | BiiG, Spain | Software for imaging processing and analysis | |
| Omicrom VISION VET | RGB Medical Devices, Spain | 731100 ReV B | Cardiorrespiratory monitor for small imaging |
| Prevex Cotton buds | Prevex, Finland | ----- | Cotton buds |
| Sevorane | AbbVie Spain, S.L.U, Spain | 673186.4 | Sevoflurane (inhalatory anesthesia) |
| Small screws | Max Witte GmbH | 1,2 x 2 DIN 84 A2 | Small screws |
| Standard U-Frame Stereotaxic Instrument for Rat, 18° Ear Bar | Harvard Apparatus, USA | 75-1801 | Two-arms Stereotactic frame for rat |
| Statistical Parametric Mapping (SPM12) | The Wellcome Center for Human Neuroimaging, UCL Queen Square Institute of Neurology, UK | SPM12 | Software for voxel-wise imaging analysis |
| STG1004 | Multi Channel Systems GmbH, Germany | STG1004 | Isolated stimulator |
| SuperArgus PET/CT scanner | Sedecal, Spain | S0026403 | NanoPET/CT scanner for small animal imaging |
| Suture thread with needle, 1/º | Lorca Marín S.A., Spain | 55325 | Braided natural silk non-absorbable suture 1/0, with triangle needle |
| Technovit 4004 (powder and liquid) | Kulzer Technique, Germany | 64708471; 64708474 | Acrylic dental cement for craniotomy tap |
| Wistar rats (Rattus norvergicus) | Charles River, Spain | animal facility | Animal model used |
| Xylagesic | Laboratorios Karizoo, A.A, Spain | 572599-4 | Xylazine (anesthetic drug) |
| Normon S.A., Spain | 602910 | Mepivacaine in gel for topical use |
Referenzen
- Gildenberg, P. L. Neuromodulation: A historical perspective. Neuromodulation. 1, 9-20 (2009).
- Lee, D. J., Lozano, C. S., Dallapiazza, R. F., Lozano, A. M. Current and future directions of deep brain stimulation for neurological and psychiatric disorders. Journal of Neurosurgery. 131 (2), 333-342 (2019).
- Casquero-Veiga, M. Preclinical molecular neuroimaging in deep brain stimulation. Complutense University of Madrid. , (2021).
- Blaha, C. D. Theories of deep brain stimulation mechanisms. Deep Brain Stimulation: Indictions and Applications. , 314-338 (2016).
- Fins, J. J. Deep brain stimulation: Ethical issues in clinical practice and neurosurgical research. Neuromodulation. 1, 81-91 (2009).
- Desmoulin-Canselier, S., Moutaud, B. Animal models and animal experimentation in the development of deep brain stimulation: From a specific controversy to a multidimensional debate. Frontiers in Neuroanatomy. 13, 51 (2019).
- Casquero-Veiga, M., Hadar, R., Pascau, J., Winter, C., Desco, M., Soto-Montenegro, M. L. Response to deep brain stimulation in three brain targets with implications in mental disorders: A PET study in rats. PLOS One. 11 (12), 0168689 (2016).
- Casquero-Veiga, M., García-García, D., Desco, M., Soto-Montenegro, M. L. Understanding deep brain stimulation: In vivo metabolic consequences of the electrode insertional effect. BioMed Research International. 2018, 1-6 (2018).
- Casquero-Veiga, M., García-García, D., Pascau, J., Desco, M., Soto-Montenegro, M. L. Stimulating the nucleus accumbens in obesity: A positron emission tomography study after deep brain stimulation in a rodent model. PLOS One. 13 (9), 0204740 (2018).
- Pascau, J., Vaquero, J. J., Abella, M., Cacho, R., Lage, E., Desco, M. Multimodality workstation for small animal image visualization and analysis. Scientific Papers. Molecular Imaging and Biology. 8, 97-98 (2006).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (1998).
- Roy, M., et al. A dual tracer PET-MRI protocol for the quantitative measure of regional brain energy substrates uptake in the rat. Journal of Visualized Experiments: JoVE. (82), e50761 (2013).
- Klein, J., et al. A novel approach to investigate neuronal network activity patterns affected by deep brain stimulation in rats. Journal of Psychiatric Research. 45 (7), 927-930 (2011).
- Soto-Montenegro, M. L., Pascau, J., Desco, M. Response to deep brain stimulation in the lateral hypothalamic area in a rat model of obesity: In vivo assessment of brain glucose metabolism. Molecular Imaging and Biology. , 830-837 (2014).
- Pascau, J., et al. Automated method for small-animal PET image registration with intrinsic validation. Molecular Imaging and Biology. 11 (2), 107-113 (2009).
- Andersson, J. L. R. How to estimate global activity independent of changes in local activity. Neuroimage. 244 (60), 237-244 (1997).
- . Wellcome Trust Centre for Neuroimaging SPM12-Statitstical Parametric Mapping Available from: https://www.fil.ion.ucl.ac.uk/spm/software/spm12/ (2022)
- Lozano, A. M., et al. Deep brain stimulation: current challenges and future directions. Nature Reviews Neurology. 15 (3), (2019).
- Boecker, H., Drzezga, A. A perspective on the future role of brain pet imaging in exercise science. NeuroImage. 131, (2016).
- Sprengers, M., et al. Deep brain stimulation reduces evoked potentials with a dual time course in freely moving rats: Potential neurophysiological basis for intermittent as an alternative to continuous stimulation. Epilepsia. 61 (5), 903-913 (2020).
- Middlebrooks, E. H., et al. Acute brain activation patterns of high- versus low-frequency stimulation of the anterior nucleus of the thalamus during deep brain stimulation for epilepsy. Neurosurgery. 89 (5), 901-908 (2021).
- Ashkan, K., Rogers, P., Bergman, H., Ughratdar, I. Insights into the mechanisms of deep brain stimulation. Nature Reviews Neurology. 13 (9), 548-554 (2017).
- Williams, N. R., Taylor, J. J., Lamb, K., Hanlon, C. A., Short, E. B., George, M. S. Role of functional imaging in the development and refinement of invasive neuromodulation for psychiatric disorders. World Journal of Radiology. 6 (10), 756-778 (2014).
- Rodman, A. M., Dougherty, D. D. . Nuclear medicine in neuromodulation. Neuromodulation in Psychiatry. , 81-99 (2016).
- Albaugh, D. L., Shih, Y. -. Y. I. Neural circuit modulation during deep brain stimulation at the subthalamic nucleus for Parkinson's disease: what have we learned from neuroimaging studies. Brain Connectivity. 4 (1), 1-14 (2014).
- Mayberg, H. S., et al. Reciprocal limbic-cortical function and negative mood: Converging PET findings in depression and normal sadness. Neurology, and Radiology. 156 (5), 675-682 (1999).
- Kennedy, S. H., et al. Differences in brain glucose metabolism between responders to CBT and Venlafaxine in a 16-week randomized controlled trial. American Journal of Psychiatry. 164 (5), 778-788 (2007).
- Kennedy, S. H., et al. Changes in regional brain glucose metabolism measured with positron emission tomography after paroxetine treatment of major depression. American Journal of Psychiatry. 158 (6), 899-905 (2001).
- Brown, E. C., Clark, D. L., Forkert, N. D., Molnar, C. P., Kiss, Z. H. T., Ramasubbu, R. Metabolic activity in subcallosal cingulate predicts response to deep brain stimulation for depression. Neuropsychopharmacology. 45, 1681-1688 (2020).
- Klooster, D. C. W., et al. Technical aspects of neurostimulation: Focus on equipment, electric field modeling, and stimulation protocols. Neuroscience & Biobehavioral Reviews. 65, 113-141 (2016).
- Kasoff, W., Gross, R. E. Deep brain stimulation: Introduction and Technical Aspects. Neuromodulation in Psychiatry. , 245-275 (2016).
- Perez-Caballero, L., et al. Early responses to deep brain stimulation in depression are modulated by anti-inflammatory drugs. Molecular Psychiatry. 19, 607-614 (2014).
- Solera Ruiz, I., UñaOrejón, R., Valero, I., Laroche, F. Craniotomy in the conscious patient. Considerations in special situations. Spanish Journal of Anesthesiology and Resuscitation. 60 (7), 392-398 (2013).
- Casali, M., et al. State of the art of 18F-FDG PET/CT application in inflammation and infection: a guide for image acquisition and interpretation. Clinical and Translational Imaging. 9 (4), 299-339 (2021).
- Gonzalez-Escamilla, G., Muthuraman, M., Ciolac, D., Coenen, V. A., Schnitzler, A., Groppa, S. Neuroimaging and electrophysiology meet invasive neurostimulation for causal interrogations and modulations of brain states. NeuroImage. 220, 117144 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten