Method Article
في الجسم الحي التصوير المقطعي بالإصدار البوزيتروني للكشف عن أنماط النشاط الناجم عن التحفيز العميق للدماغ في الفئران
In This Article
Summary
نحن نصف طريقة تجريبية قبل السريرية لتقييم التعديل العصبي الأيضي الناجم عن التحفيز العميق الحاد للدماغ مع FDG-PET في الجسم الحي . تتضمن هذه المخطوطة جميع الخطوات التجريبية ، من الجراحة المجسمة إلى تطبيق علاج التحفيز والحصول على صور PET ومعالجتها وتحليلها.
Abstract
التحفيز العميق للدماغ (DBS) هو تقنية جراحية عصبية غازية تعتمد على تطبيق النبضات الكهربائية على هياكل الدماغ المشاركة في الفيزيولوجيا المرضية للمريض. على الرغم من التاريخ الطويل ل DBS ، إلا أن آلية عملها وبروتوكولاتها المناسبة لا تزال غير واضحة ، مما يسلط الضوء على الحاجة إلى البحث الذي يهدف إلى حل هذه الألغاز. وبهذا المعنى ، فإن تقييم تأثيرات DBS في الجسم الحي باستخدام تقنيات التصوير الوظيفية يمثل استراتيجية قوية لتحديد تأثير التحفيز على ديناميكيات الدماغ. هنا ، يتم وصف بروتوكول تجريبي للنماذج قبل السريرية (فئران Wistar) ، جنبا إلى جنب مع دراسة طولية [18F] - التصوير المقطعي بالإصدار البوزيتروني فلوروديوكسيكوكوز (FDG-PET) ، لتقييم العواقب الحادة ل DBS على التمثيل الغذائي في الدماغ. أولا ، خضعت الحيوانات لجراحة التجسيم للزرع الثنائي للأقطاب الكهربائية في قشرة الفص الجبهي. تم الحصول على التصوير المقطعي المحوسب بعد الجراحة (CT) لكل للتحقق من وضع القطب الكهربائي. بعد أسبوع واحد من الشفاء ، تم الحصول على أول FDG-PET ثابت لكل يعمل دون تحفيز (D1) ، وبعد يومين (D2) ، تم الحصول على FDG-PET ثان أثناء تحفيز الحيوانات. لذلك ، تم توصيل الأقطاب الكهربائية بمحفز معزول بعد إعطاء FDG للحيوانات. وهكذا ، تم تحفيز الحيوانات خلال فترة امتصاص FDG (45 دقيقة) ، وتسجيل الآثار الحادة ل DBS على التمثيل الغذائي في الدماغ. نظرا للطبيعة الاستكشافية لهذه الدراسة ، تم تحليل صور FDG-PET من خلال نهج فوكسل الحكيم استنادا إلى اختبار T المقترن بين دراسات D1 و D2. بشكل عام ، يسمح الجمع بين DBS ودراسات التصوير بوصف عواقب التعديل العصبي على الشبكات العصبية ، مما يساعد في النهاية على كشف الألغاز المحيطة ب DBS.
Introduction
يشمل مصطلح التحفيز العصبي عددا من التقنيات المختلفة التي تهدف إلى تحفيز الجهاز العصبي بهدف علاجي1. من بينها ، يبرز التحفيز العميق للدماغ (DBS) كواحد من أكثر استراتيجيات التحفيز العصبي انتشارا في الممارسة السريرية. يتكون DBS من تحفيز نوى الدماغ العميقة بنبضات كهربائية يسلمها محفز عصبي ، يتم زرعها مباشرة في جسم المريض ، من خلال أقطاب كهربائية موضوعة في هدف الدماغ ليتم تعديلها بواسطة الجراحة التجسيمية. يتزايد باستمرار عدد المقالات التي تقيم جدوى تطبيق DBS في مختلف الاضطرابات العصبية والنفسية2 ، على الرغم من أن بعضها فقط قد تمت الموافقة عليه من قبل جمعية الغذاء والدواء (FDA) (أي الهزة الأساسية ، ومرض باركنسون ، وخلل التوتر العضلي ، واضطراب الوسواس القهري ، والصرع الحراري طبيا)3 . علاوة على ذلك ، هناك عدد كبير من أهداف الدماغ وبروتوكولات التحفيز قيد البحث لعلاج DBS للعديد من الأمراض أكثر مما تمت الموافقة عليه رسميا ، ولكن لا يعتبر أي منها نهائيا. قد تكون هذه التناقضات في أبحاث DBS والإجراءات السريرية جزئيا بسبب عدم وجود فهم كامل لآلية عملها4. لذلك ، تبذل جهود ضخمة لفك رموز تأثيرات DBS في الجسم الحي على ديناميكيات الدماغ ، حيث أن كل تقدم ، مهما كان صغيرا ، سيساعد على تحسين بروتوكولات DBS لتحقيق نجاح علاجي أكبر.
في هذا السياق ، تفتح تقنيات التصوير الجزيئي نافذة مباشرة لمراقبة الآثار العصبية المعدلة في الجسم الحي ل DBS. توفر هذه الأساليب الفرصة ليس فقط لتحديد تأثير DBS أثناء تطبيقه ولكن أيضا لكشف طبيعة عواقبه ، ومنع الآثار الجانبية غير المرغوب فيها والتحسين السريري ، وحتى تكييف معلمات التحفيز مع احتياجات المريض5. من بين هذه الطرق ، يعد التصوير المقطعي بالإصدار البوزيتروني (PET) باستخدام 2-deoxy-2-[18F] fluoro-D-glucose (FDG) ذا أهمية خاصة لأنه يوفر معلومات محددة وفي الوقت الفعلي عن حالة التنشيط لمناطق الدماغ المختلفة6. على وجه التحديد ، يوفر تصوير FDG-PET تقييما غير مباشر للتنشيط العصبي استنادا إلى المبدأ الفسيولوجي للاقتران الأيضي بين الخلايا العصبية والخلايا الدبقية6. بهذا المعنى ، أبلغت العديد من الدراسات السريرية عن أنماط نشاط الدماغ المعدلة بواسطة DBS باستخدام FDG-PET (انظر3 للمراجعة). ومع ذلك ، فإن الدراسات السريرية تتكبد بسهولة العديد من العيوب عند التركيز على المرضى ، مثل عدم التجانس أو صعوبات التوظيف ، والتي تحد بشدة من إمكاناتها البحثية6. يقود هذا السياق الباحثين إلى استخدام النماذج الحيوانية للحالات البشرية لتقييم النهج الطبية الحيوية قبل ترجمتها السريرية أو ، إذا تم تطبيقها بالفعل في الممارسة السريرية ، لشرح الأصل الفسيولوجي للفوائد العلاجية أو الآثار الجانبية. وبالتالي ، على الرغم من المسافات الكبيرة بين علم الأمراض البشري والحالة النموذجية في المختبر ، فإن هذه الأساليب قبل السريرية ضرورية لانتقال آمن وفعال إلى الممارسة السريرية.
تصف هذه المخطوطة بروتوكول DBS التجريبي لنماذج الفئران ، جنبا إلى جنب مع دراسة FDG-PET الطولية ، من أجل تقييم العواقب الحادة ل DBS على التمثيل الغذائي في الدماغ. قد تساعد النتائج التي تم الحصول عليها باستخدام هذا البروتوكول في كشف الأنماط التعديلية المعقدة التي يسببها DBS على نشاط الدماغ. لذلك ، يتم توفير استراتيجية تجريبية مناسبة لدراسة عواقب التحفيز في الجسم الحي ، مما يسمح للأطباء بتوقع الآثار العلاجية في ظل ظروف محددة ثم تكييف معلمات التحفيز مع احتياجات المريض.
Protocol
أجريت إجراءات التجارب وفقا لتوجيه مجلس الجماعات الأوروبية 2010/63/EU ، ووافقت عليه لجنة أخلاقيات التجارب على الحيوانات في مستشفى غريغوريو مارانون. ويبين الشكل 1 ألف ملخصا بيانيا للبروتوكول التجريبي.
1. توطين هدف الدماغ عن طريق التصوير العصبي في الجسم الحي
- إعداد الحيوانات
ملاحظة: تم استخدام ذكور الفئران Wistar من ~ 300 غرام.- ضع الحيوان في صندوق تحريض التخدير وختم الجزء العلوي.
- قم بتشغيل مبخر سيفوفلوران (5٪ للحث في 100٪ O2). عندما يتم تخدير الفئران ، قم بتبديل تدفق الغاز إلى مخروط الأنف. تأكيد حالة التخدير عن طريق قرص مخلب الفئران.
- ضع الحيوان ضعيفا على سرير التصوير المقطعي المحوسب ، مع الحفاظ على تخدير سيفوفلوران (3٪ للصيانة في 100٪ O2).
- التصوير المقطعي المحوسب
ملاحظة: يعتمد اختيار التيار والجهد وعدد الإسقاطات وعدد اللقطات ودقة voxel على الماسح الضوئي CT. هنا ، تم استخدام المعلمات التالية: 340 مللي أمبير ، 40 كيلو فولت ، 360 إسقاطات ، 8 طلقات ، ودقة 200 ميكرومتر7،8،9.- قم بتأمين قناع الوجه أو مخروط الأنف على الفئران.
- قم بتأمين جسم الفئران على الرأس والكتفين والوركين والذيل بشريط حريري لتوفير ما يكفي من ضبط النفس دون ضرر.
- مراقبة الفئران باستمرار.
- حدد موقع الرأس في وسط مجال رؤية الماسح الضوئي المقطعي.
- تابع للحصول على صورة CT باستخدام معلمات الاكتساب وفقا لمواصفات الماسح الضوئي.
- بعد 10 دقائق ، عند اكتمال التصوير المقطعي المحوسب في الجسم الحي ، أوقف تدفق سيفوفلوران وضع الفئران في ماسح التصوير بالرنين المغناطيسي.
- التصوير بالرنين المغناطيسي
ملاحظة: تختلف مواصفات الحصول على المسح الضوئي بين الماسحات الضوئية، بما في ذلك أنظمة البرامج المختلفة، والأهم من ذلك، مسألة البحث المحددة. هنا ، تم استخدام ماسح ضوئي 7-Tesla. تم استخدام تسلسل صدى الدوران الموزون T2 7,8,9 مع TE = 33 مللي ثانية ، TR = 3732 مللي ثانية ، وسمك شريحة 0.8 مم (34 شريحة) ، وحجم مصفوفة 256 × 256 بكسل مع FOV من 3.5 × 3.5 سم2.- ضع الحيوان ضعيفا على سرير التصوير بالرنين المغناطيسي ، مع الحفاظ على تخدير سيفوفلوران (3٪ للصيانة في 100٪ O2).
- قم بتثبيت الرأس على إطار جسيمي يوضع على سرير الماسح الضوئي لتجنب حركات الرأس أثناء الحصول على التصوير بالرنين المغناطيسي. أيضا ، تأمين بقية جسم الفئران مع شريط الحرير.
- حدد موقع الرأس في وسط مجال رؤية ماسح التصوير بالرنين المغناطيسي.
- بمجرد أن يكون الموقف صحيحا ، تابع للحصول على صورة التصوير بالرنين المغناطيسي.
- عند اكتمال مسح التصوير بالرنين المغناطيسي في الجسم الحي ، أوقف تدفق سيفوفلوران وضع الفئران في قفصها.
- حدد موقع مصباح التدفئة بالقرب من القفص لأن الفئران عادة ما تقلل من درجة حرارة جسمها أثناء الفحص.
- راقب الفئران حتى الشفاء من التخدير.
- التعريب المشترك لأطلس وحساب الإحداثيات المستهدفة
- بمجرد الحصول على صور التصوير المقطعي المحوسب والتصوير بالرنين المغناطيسي وإعادة بنائها وفقا لتوصيات الماسح الضوئي ، شارك في تسجيل صور التصوير المقطعي المحوسب والتصوير بالرنين المغناطيسي.
- استخدم برنامج معالجة التصوير لتطبيع التصوير المقطعي المحوسب والتصوير بالرنين المغناطيسي مكانيا باستخدام خوارزمية تسجيل تلقائية جامدة تستند إلى المعلومات المتبادلة10.
- قم بتوطين خط Bregma في الصورة المسجلة بشكل مشترك ، وقم بقياس المسافة في المحور الأمامي / الخلفي (AP: +3.5 mm) ، وخط الوسط / الجانبي (ML: +0.6 mm) ، والظهري البطني (DV: -3.4 mm) من Bregma إلى الهدف (أي قشرة الفص الجبهي الإنسي ، mPFC) ، وفقا لأطلس الدماغ Paxinos و Watson rat11.
ملاحظة: قد تختلف الإحداثيات من Bregma إلى الهدف بين الفئران عندما يختلف الوزن والحجم والجنس والسلالة.
2. الجراحة المجسمة
تحذير: قم بتعقيم جميع المواد الجراحية والغرسات والوحدات المجسمة قبل الاستخدام ، وقم بتطهير المنطقة الجراحية لتجنب العدوى والمضاعفات التي قد تؤثر على رفاهية الحيوان. استخدم قفازات جراحية معقمة وقم بتغطية الحيوان بستائر لزجة لمنع التلوث.
- إعداد الحيوانات والتخدير
- تم إعطاء الحيوانات 0.1 مغ / كغ من البوبرينورفين داخل الصفاق في اليوم السابق للجراحة. ضع الحيوان في غرفة صندوق تحريض التخدير وختم الجزء العلوي.
- قم بتشغيل مبخر سيفوفلوران (5٪ للحث في 100٪ O2).
- عندما يكون الفئران راقدا ، قم بإيقاف تشغيل مبخر سيفوفلوران وإزالة الفئران من غرفة الصندوق.
- إدارة داخل الصفاق خليط من الكيتامين (100 ملغ / كغ) والزيلازين (10 ملغ / كغ) لتخدير الحيوان.
- انتظر حتى يتم تخدير الحيوان بالكامل. تحقق من مستوى التخدير عن طريق قرص المنطقة بين الديجيتال.
- حلق المنطقة بين الأذنين والعينين.
- التنسيب في الإطار التجسيمي وبضع القحف
- ضع الحيوان في وضع الانبطاح على الإطار التجسيمي واستخدم محول تثبيت الرأس للفئران للحفاظ على الحيوان في الموضع الصحيح أثناء الجراحة.
- ضمان عدم حركة الرأس باستخدام قضبان أذن الفئران. كن حذرا عند إدخال قضبان الأذن ، لأن الإدخال العميق جدا قد يؤدي إلى تلف طبلة الأذن.
- ضع جل تشحيم العيون على العينين لمنع الجفاف أثناء الجراحة ، وقم بتغطيتهما بشاش معقم.
- تغطية الحيوان باستخدام الستائر اللزجة لمنع التلوث.
- ضع محلول يودوبوفيدون على المنطقة المحلوقة وقم بتنظيفها بشاش معقم.
- ضع ميبيفاكاين في جل على المنطقة المحلوقة لتخدير المنطقة المحلية.
- قم بعمل شق طولي في الجلد الذي يغطي الجمجمة بين الأذنين ، ويمتد 1.5-2 سم من لامدا إلى بريغما (أي من قمة الجمجمة نحو العينين).
- فضح الجمجمة بمساعدة 2 أو 3 مشابك. إزالة السمحاق مع برعم القطن وتنظيف الدم بمحلول ملحي لفضح Bregma والغرز السهمية. إزالة المحلول الملحي الزائد مع الشاش.
- خدش سطح الجمجمة بمشرط لتحسين التصاق أسمنت الأسنان. نظف المنطقة ببرعم قطني منقوع في بيروكسيد الهيدروجين.
- وضع القطب الكهربائي وتثبيته على الجمجمة
- قم بتصويب الأقطاب الكهربائية باستخدام ملاقط بلاستيكية لضمان الموضع الصحيح أثناء الجراحة.
ملاحظة: تستخدم أقطاب البلاتين والإيريديوم ثنائية القطب متحدة المركز مع الأرض في هذا البروتوكول. - حدد موقع قطب كهربائي واحد على حامل الذراع الأيمن للإطار التجسيمي.
ملاحظة: قد يكون من الضروري تكييف الحامل مع القطب الكهربائي لإصلاحه بشكل أفضل (انظر الشكل 1B). تأكد من أن القطب الكهربائي مواز لمحور الحامل. - حرك الذراع اليمنى التي تحمل القطب الكهربائي من خلال الإطار المجسم، وضع طرف القطب الكهربائي فوق Bregma تماما. حاول تقريب طرف القطب الكهربائي قدر الإمكان من الجمجمة ولكن دون لمسه لتجنب تشوه القطب الكهربائي ، ولاحظ الإحداثيات الناتجة عن Bregma التي يوفرها الإطار المجسم. ضع علامة على الجمجمة تشير إلى الموضع الأولي للقطب الكهربائي باستخدام قلم جراحي.
- حرك الحامل إلى إحداثيات AP و ML التي تم الحصول عليها في الخطوة 1.4.3 وقم بوضع علامة على الجمجمة باستخدام قلم جراحي يشير إلى موضع هدف القطب الكهربائي.
- قم بإزالة الذراع اليمنى للإطار التجسيمي الذي يحمل القطب الكهربائي. احرص على عدم لمس أي شيء بالقطب الكهربائي.
- استخدم مثقاب كهربائي صغير لعمل ثقب عبر الجمجمة (قطرها حوالي 1-1.5 مم) في الموضع المستهدف حتى يصبح الجافية مرئيا. أوقف أي نزيف باستخدام برعم قطني.
- حفر 4 ثقوب على طول الجمجمة لتحديد موقع 4 مسامير (يفضل مسامير الفولاذ المقاوم للصدأ بطول 2-3 مم) لزيادة مساحة سطح أسمنت الأسنان وتحديد موقع الأرض. نعلق 4 مسامير.
- حدد موقع الذراع اليمنى للإطار التجسيمي باستخدام القطب الأيمن. حرك الذراع إلى الموضع المحسوب ، والذي يجب أن يتزامن مع الثقب. ثم ، اخفض القطب الكهربائي حتى يلمس الأم الجافية. سيكون هذا الموقف بمثابة مستوى 0 في اتجاه DV.
- أدخل طرف القطب الكهربائي في اتجاه DV، باستخدام موضع DV في الخطوة 1.4.3. تنظيف الدم والسائل الدماغي الشوكي حول منطقة القطب الكهربائي مع برعم القطن.
- قم بتوصيل الأرض بأحد البراغي الأقرب إلى القطب الكهربائي.
- ضع أسمنت الأسنان حول القطب الكهربائي والبراغي مع الحرص على تشكيل أسمنت الأسنان وتجنب الحواف الحادة ، والتي يمكن أن تصيب الحيوان. يتم تطبيق أسمنت الأسنان في طبقة لمنع ارتفاع درجة الحرارة / الإصابة الحرارية للأنسجة / الجمجمة. تتطلب الطبقات السميكة مزيدا من الوقت للعلاج قبل إضافة طبقات إضافية. تأكد من تصلب أسمنت الأسنان بالكامل قبل إزالة القطب الكهربائي من الحامل.
تحذير: ينتج عن تحضير أسمنت الأسنان انبعاث أبخرة سامة من الخليط ، والذي ينتهي بتصلب الأسمنت. لذلك ، ارتداء قناع حماية فعال ضد الغازات الكيميائية من هذه النقطة وحتى نهاية الجراحة. - كرر نفس الإجراء من الخطوات 2.3.2-2.3.11 لنصف الكرة الآخر من الدماغ.
- ضع المزيد من أسمنت الأسنان لتشكيل غطاء دون تغطية القطب الكهربائي. انتظر حتى يتصلب.
- استخدم خياطة الحرير الطبيعي المضفر غير القابلة للامتصاص 1/0 ، مع إبرة مثلث ، لخياطة أمام وخلف الغطاء. إذا لزم الأمر ، قم بإزالة الغرز غير القابلة للامتصاص في وقت معين وفقا لمنطقة الجسم التي توجد فيها. استخدم محلول يودوبوفيدون لتطهير المنطقة الجراحية.
- إزالة الفئران من الإطار التجسيمي.
- قم بتصويب الأقطاب الكهربائية باستخدام ملاقط بلاستيكية لضمان الموضع الصحيح أثناء الجراحة.
- التصوير المقطعي المحوسب لتأكيد وضع القطب الكهربائي
- نفذ الخطوات 1.2.4-1.2.5 وراجع الشكل 1C.
- بمجرد اكتمال التصوير المقطعي المحوسب في الجسم الحي ، ضع الفئران في قفصها.
- اتبع الخطوات 1.3.6. و 1.3.7.
- رعاية ما بعد الجراحة
- إدارة المضادات الحيوية (سيفترياكسون ، 100 مغ / كغ ، تحت الجلد) لمدة 5 أيام ومسكن (البوبرينورفين ، 0.1 ملغ / كغ ، داخل الصفاق) لمدة 3 أيام كرعاية ما بعد الجراحة. قد يطول نظام المضادات الحيوية هذا لمدة 5 أيام إذا لوحظت أي علامات للعدوى (احمرار وتورم وإفرازات) حول الغطاء.
- قم بإجراء فحص بصري لكل يوميا ، والبحث عن علامات الألم أو الضيق ، وتنظيف الغطاء بمحلول يودوبوفيدون.
- توفير العناية المركزة لمدة تصل إلى 1 أسبوع بعد الجراحة.
3. الحصول على التصوير المقطعي بالإصدار البوزيتروني / التصوير المقطعي المحوسب
ملاحظة: يخضع كل لدراستين PET / CT (أي في غياب وأثناء إعطاء DBS) تحت التخدير المستنشق لتقييم الآثار الحادة الناجمة عن التحفيز الكهربائي. تتبع كلتا الجلستين المسحيتين نفس بروتوكول الحصول على التصوير ، حيث يتم إجراؤهما بعد أسبوع واحد من الجراحة (D1 ، بدون تحفيز) وبعد يومين (D2 ، أثناء DBS).
- إعداد الحيوانات والتخدير
- قم بتسريع الفئران لمدة 8-12 ساعة قبل كل فحص PET للسماح بامتصاص أعلى للدماغ من FDG ، مما يحسن نسبة الإشارة إلى الضوضاء12.
- ضع الحيوان في صندوق تحريض التخدير وختم الجزء العلوي.
- قم بتشغيل مبخر سيفوفلوران (5٪ للحث في 100٪ O2).
- عندما يتم تخدير الفئران ، قم بتبديل تدفق الغاز إلى مخروط الأنف.
- حقن FDG وفترة الامتصاص
تحذير: FDG هو المقتفي الإشعاعي ، لذلك ضع في اعتبارك تدابير الحماية من الإشعاع لتجنب التعرض للنشاط الإشعاعي. تأكد من أن المؤسسة لديها كل الإذن للعمل مع المركبات المشعة.- احتفظ بقارورة FDG داخل خزانة مبطنة بالرصاص حتى يتم استخدامها لتجنب التعرض غير المرغوب فيه للنشاط الإشعاعي.
- املأ حقنة قياس صغيرة (~ 27G) ب ~ 37 ميجا بايت في محلول FDG في الحجم الأقل ، كما تم قياسه في مقياس النشاط.
- ضع وسادة تدفئة تحت ذيل الحيوان أو استخدم ضوء الأشعة تحت الحمراء لتوسيع عروق الذيل.
- بمجرد أن تكون الأوردة الجانبية واضحة في ذروة الذيل ، قم بتنظيف المنطقة بالكحول الصحي (96٪).
- حقن محلول FDG من خلال أحد عروق الذيل الجانبية ، واقترب من الوريد باستخدام حقنة موازية لمساره ومع شطبة الإبرة متجهة لأعلى.
- أطفئ التخدير وضع الحيوان مرة أخرى في قفصه للتعافي تماما تحت مصباح التدفئة.
- اسمح ب 45 دقيقة من امتصاص المقتفي الإشعاعي قبل بدء جلسة التقاط الصور. خلال هذه الفترة ، حافظ على الحيوان مستيقظا وداخل غرفة محمية بالرصاص.
- في حالة دراسة D2 ، قم بتقديم DBS كما هو موضح أدناه في القسم 4 (إدارة التحفيز الكهربائي) خلال فترة امتصاص FDG.
- اقتناء PET وإعادة بناء التصوير
ملاحظة: تعتمد مواصفات الحصول على صورة PET على الماسح الضوئي ووقت المسح الضوئي. بالنسبة لهذا البروتوكول ، تم الحصول على صورة PET ثابتة لمدة 45 دقيقة باستخدام ماسح ضوئي PET / CT للحيوانات الصغيرة ، باستخدام نافذة طاقة من 400-700 keV 7,8,9. مراجعة مواصفات معدات PET/CT قبل تصميم بروتوكول الاقتناء.- بعد 45 دقيقة من حقن FDG ، ضع الحيوان في صندوق تحريض التخدير وختم الجزء العلوي.
- قم بتشغيل مبخر سيفوفلوران (5٪ للحث في 100٪ O2).
- انقل الحيوان إلى سرير PET / CT وضعه في وضع ضعيف ، وتأمين الأنف إلى مخروط الأنف المخدر والحفاظ على تخدير sevoflurane (3٪ للصيانة في 100٪ O2). تأكيد حالة التخدير عن طريق قرص مخلب الفئران.
- كرر الخطوتين 1.2.2 و1.2.3.
- حدد موقع الرأس في وسط مجال رؤية الماسح الضوئي PET.
- احصل على صورة PET الثابتة باستخدام معلمات الاكتساب وفقا لمواصفات الماسح الضوئي.
- تابع إعادة بناء الصورة باستخدام 2D-OSEM (خوارزمية تعظيم توقع المجموعة الفرعية المرتبة) وتطبيق تصحيحات الاضمحلال والوقت الميت 7,8,9.
- عند اكتمال فحص التصوير المقطعي بالإصدار البوزيتروني في الجسم الحي ، حافظ على تدفق سيفوفلوران إلى الفئران من أجل المضي قدما لاحقا في الحصول على التصوير المقطعي المحوسب دون إزاحة موضع رأس الحيوان على سرير الماسح الضوئي.
- الحصول على CT
- دون تغيير موقف الحيوان فيما يتعلق بالاستحواذ السابق على PET ، تابع الحصول على صورة CT.
- كرر الخطوات 1.2.3-1.2.5.
- بمجرد الانتهاء من التصوير المقطعي المحوسب في الجسم الحي ، أوقف تدفق سيفوفلوران وضع الفئران في قفصها الخاص للتعافي.
- اتبع الخطوات 1.3.6. و 1.3.7.
- الحفاظ على الحيوان في غرفة محمية من الرصاص حتى الاضمحلال الكامل للنشاط الإشعاعي.
4. إدارة التحفيز الكهربائي
ملاحظة: يتم تسليم التحفيز الكهربائي خلال فترة امتصاص FDG في جلسة التصوير D2. بالنسبة لهذا البروتوكول ، تم تسليم التحفيز باستخدام محفز معزول ، مع تحفيز كهربائي عالي التردد (130 هرتز) في وضع تيار ثابت ، 150 ميكروأمبير ، وعرض نبضة 100 ميكروثانية7،13،14.
- تكوين محفز DBS
- قم بإعداد المحفز المعزول والأسلاك المطلوبة في غرفة واسعة وهادئة ، مع مساحة كافية لأقفاص الحيوانات والحد الأدنى من تأثير المحفزات التي يحتمل أن تكون مزعجة.
- قم بتوصيل أسلاك التحفيز بالدوارات للسماح للحيوانات بالتحرك بحرية داخل أقفاصها وإلى المحفز.
- تعيين معلمات التحفيز وفقا لاحتياجات الدراسة.
- استخدم منظار الذبذبات للتحقق من الوضع الحالي والتردد وعرض النبضة. تأكد من الشكل الموجي ثنائي الطور مع شكل نبضة مستطيلة (الشكل 1D).
- تسليم DBS
- بعد جلسة التصوير D1 وحتى الحصول على D2 ، تخضع الحيوانات لبروتوكول التعود اليومي (45 دقيقة / يوم) لتعويدها على نظام التحفيز وتعامل المشغل ، وتجنب استجابات الإجهاد غير المرغوب فيها في D2. قم بتوصيل نظام التحفيز بكل ، ولكن دون تشغيل التحفيز.
- بمجرد إعداد المحفز ، وحقن الحيوان ب FDG ، قم بتوصيل الدوار بالأقطاب الكهربائية وقم بتشغيل المحفز.
- بعد 45 دقيقة ، قم بإيقاف تشغيل المحفز ، وافصل الحيوان عن الدوران وانقله بسرعة إلى غرفة تحريض التخدير لبدء الخطوة 3.3.
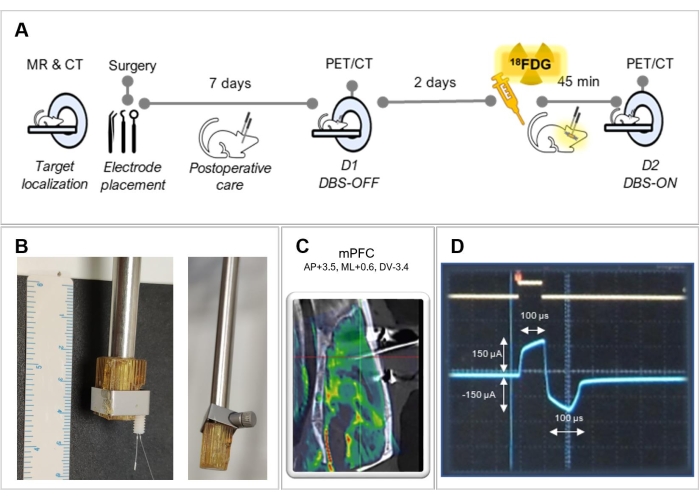
الشكل 1: التصميم التجريبي . (أ) ملخص الخطوات التجريبية المتبعة في هذا البروتوكول. (ب) صور تمثيلية لتكييف حامل لتحسين تثبيت القطب الكهربائي ، مع (يسار) وبدون (يمين) قطب كهربائي. (ج) صورة منصهرة للتصوير بالرنين المغناطيسي مع التصوير المقطعي المحوسب لحيوان يعمل ، تظهر موضع القطب الصحيح في قشرة الفص الجبهي الإنسي (mPFC). (د) لقطة شاشة لشاشة الذبذبات تظهر الشكل الموجي للتحفيز ثنائي الطور. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. معالجة وتحليل صور PET
ملاحظة: اتبع نفس معالجة الصور على الصور من D1 و D2 للحصول على بيانات قابلة للمقارنة للتحليل الإحصائي اللاحق من ناحية voxel.
- التسجيل المكاني لصور PET
- استخدم برامج معالجة التصوير المتخصصة. ويوضح الشكل 2 سير عمل التسجيل بأكمله.
- قم بتوسيط واقتصاص كل صورة من صور PET و CT إلى مجال الرؤية. سجل صورة PET في التصوير المقطعي المحوسب الخاص بها باستخدام خوارزمية تسجيل جامدة تلقائية تستند إلى المعلومات المتبادلة15.
ملاحظة: طرق التسجيل الجامدة مناسبة فقط إذا لم تكن هناك اختلافات كبيرة في وزن الجسم أو حجمه بين الحيوانات. خلاف ذلك ، فكر في استخدام طرق مرنة. - سجل كل صورة من صور التصوير المقطعي المحوسب في مرجع CT مسجل مكانيا في أطلس الدماغ Paxinos و Watson rat11 كما في الخطوة 5.1.2. احفظ معلمات التحويل الناتجة.
- تطبيق معلمات التحويل التي تم الحصول عليها في الخطوة 5.1.3. لكل صورة PET مسجلة تحصل على صورة PET مسجلة في صورة CT المرجعية.
- احفظ جميع صور PET النهائية بتنسيق Nifti.
- تطبيع الكثافة وتنعيم صور PET
ملاحظة: يتم تنفيذ تطبيع الكثافة والتنعيم باستخدام برامج نصية داخلية مختلفة استنادا إلى الموارد المتاحة للجمهور.- قم بتنعيم صور PET باستخدام نواة غاوسية متساوية الخواص تبلغ 2 مم من نصف العرض الكامل (FWHM) لتصحيح أخطاء التسجيل المحتملة.
ملاحظة: يعتمد حجم مرشح التجانس على دقة اكتساب PET ، ولكن يوصى باستخدام مرشح يبلغ 2-3 أضعاف حجم voxel ل FWHM. - تطبيع كثافة قيم PET voxel باستخدام طريقة تطبيع الكتلة المرجعية المناسبة16.
- قم بتقسيم قناع الدماغ من التصوير بالرنين المغناطيسي المرجعي المسجل إلى صورة التصوير المقطعي المحوسب المرجعية.
- ضع قناع الدماغ على كل صورة من صور PET لاستبعاد voxels خارج الدماغ من التحليل الحكيم voxel.
- قم بتنعيم صور PET باستخدام نواة غاوسية متساوية الخواص تبلغ 2 مم من نصف العرض الكامل (FWHM) لتصحيح أخطاء التسجيل المحتملة.
- تحليل فوكسل الحكيم
ملاحظة: تم إجراء التحليل الإحصائي ، الذي يتكون من تحليل فوكسل حكيم لبيانات صورة PET ، باستخدام برنامج تحليل التصوير المتخصص17.- قارن صور D1 و D2 PET باستخدام اختبار T مقترن ، مع وضع عتبات إحصائية ذات دلالة إحصائية كافية.
- ضع في اعتبارك كنتائج نهائية للتحليل فقط تلك المجموعات الأكبر من 50 voxels المجاورة لتقليل أخطاء النوع الأول.
- تمثيل النتائج في خرائط T المتراكبة على التصوير بالرنين المغناطيسي T2 ، مما يدل على التغيرات في استقلاب الجلوكوز في الدماغ الناجم عن DBS (الألوان الباردة لتقليل FDG والألوان الدافئة لزيادة FDG).

الشكل 2: سير عمل تسجيل التصوير المقطعي بالإصدار البوزيتروني (Micro PET/CT). خطوات مفصلة لمعالجة التطبيع المكاني لصور PET للتحليل اللاحق من خلال voxel-wise باستخدام برنامج الخرائط الإحصائية البارامترية (SPM). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
تم التضحية بالحيوانات باستخدام CO2 في نهاية الدراسة أو عندما تم المساس برفاهية الحيوان. ويوضح الشكل 3 مثالا على دراسة كاملة أجريت على التصوير المقطعي بالإصدار البوزيتروني / التصوير المقطعي المحوسب من تم تشغيله. وبالتالي ، يمكن ملاحظة القطب الكهربائي الذي تم إدخاله في دماغ الفئران بوضوح في صورة التصوير المقطعي المحوسب الموضحة في الشكل 3A. توفر طريقة التصوير هذه معلومات تشريحية جيدة وتسهل تسجيل صور FDG-PET ، بالنظر إلى أن الطرائق الوظيفية تميل إلى أن تكون أكثر ضبابية من الصور الهيكلية (الشكلان 3A و B). بالإضافة إلى ذلك ، تظهر صورة مدمجة لصور FDG-PET و CT لنفس الحيوان في الشكل 3C.
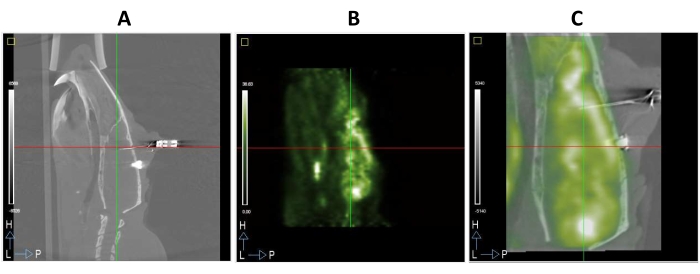
الشكل 3: التصوير المقطعي بالإصدار البوزيتروني / التصوير المقطعي المحوسب لدماغ الفئران باستخدام أقطاب DBS المزروعة في mPFC . (A) قسم القوس من صورة CT. (ب) مقطع القوس من صورة FDG-PET لنفس الحيوان كما في A. (C) ناتجة صورة PET/CT المنصهرة عن تراكب الصور A و B المسجلة مكانيا في نفس الفضاء المجسم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
يتكون التحليل الحكيم voxel الذي تم إجراؤه باستخدام برنامج SPM12 والمقدم هنا كمثال من اختبار T مقترن بين دراسات D1 (غياب DBS) و D2 (DBS أثناء امتصاص FDG) ، والتي تنتمي في الواقع إلى دراسة منشورة سابقا8. لذلك ، يوضح الشكل 4 الاختلافات الأيضية في الدماغ بين جلستي PET كخرائط T متراكبة على شرائح دماغية متسلسلة بسماكة 1 مم من التصوير بالرنين المغناطيسي المسجل إلى صورة CT المرجعية (CTref). تألفت هذه الاختلافات من زيادات ونقصان في امتصاص FDG أظهرت كألوان دافئة وباردة ، على التوالي. ويبين الجدول 1 أيضا موجزا مفصلا للنتائج الإحصائية التي تم الحصول عليها من التحليل. هنا ، نشير إلى منطقة الدماغ المعدلة ، ونصف الكرة المخية الذي لوحظ فيه التعديل ، وإحصائية T ، وحجم الكتلة في عدد voxels (k) ، واتجاه التشكيل (أي التغيرات الأيضية المفرطة أو نقص التمثيل الغذائي) ، والقيم p التي تم الحصول عليها عند مستويات الذروة والعنقود. يعمل هذا النوع من الجداول كوصف مفصل للتغييرات التعديلية التي لوحظت في شكل تراكب الشريحة.
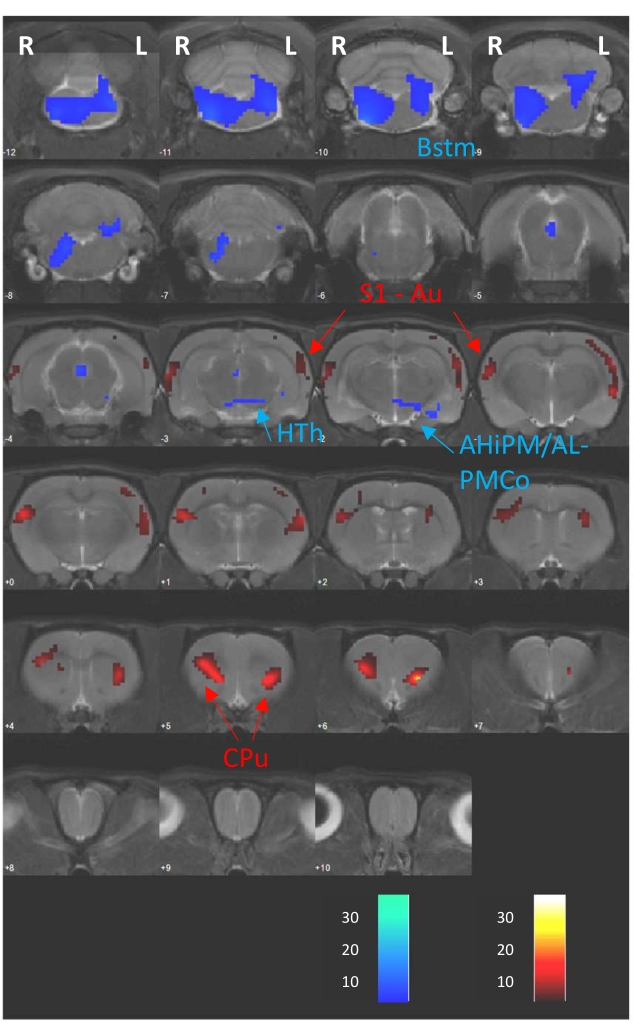
الشكل 4: نتائج اختبار T المقترنة. خرائط T الناتجة عن تحليل voxel-wise المتراكب على التصوير بالرنين المغناطيسي T2 المسجل في نفس CTref ، مما يدل على التغيرات الأيضية الناجمة عن بروتوكول DBS الحاد (D2 مقابل D1). تمثل أشرطة الألوان في أسفل الصورة قيم T المقابلة للزيادات الإقليمية (الألوان الدافئة) والانخفاضات (الألوان الباردة) لامتصاص FDG (p < 0.005 ؛ k > 50 voxels). Abbrev.: AHiPM/AL - منطقة اللوزة الدماغية الحصين الجزء الخلفي / الأمامي الجانبي، Au - القشرة السمعية، Bstm - جذع الدماغ، وحدة المعالجة المركزية - Caudate-putamen، HTh - تحت المهاد، L - نصف الكرة الأيسر، PMCo - نواة اللوزة الدماغية القشرية ما بعد الوسيطة، R - نصف الكرة الأيمن، S1 - القشرة الحسية الجسدية الأولية. وقد عدل هذا الرقم بإذن من كاسكيرو - فيغا وآخرون.8. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| D1 مقابل D2: تأثير التحفيز | |||||||
| دوروا | جنب | T | k | ↓/↑ | ف أونك. مستوى الذروة | FWE | FWE |
| مستوى الذروة | مستوى الكتلة | ||||||
| بستم | R & L | 18.39 | 1549 | ↓ | <0.001 | 0.432 | <0.001 |
| أهرئيس الوزراء / AL-PMCo - HTh | L | 10.39 | ↓ | <0.001 | 0.949 | ||
| وحده المعالجه المركزيه | L | 37.56 | 738 | ↑ | <0.001 | 0.025 | <0.001 |
| S1-الاتحاد الافريقي | 10.53 | ↑ | <0.001 | 0.947 | |||
| CPu-Pir | R | 17.74 | 695 | ↑ | <0.001 | 0.497 | <0.001 |
| S1-الاتحاد الافريقي | 10.45 | ↑ | <0.001 | 0.948 | |||
الجدول 1: التغيرات في استقلاب الدماغ بعد DBS الحاد في mPFC. D1 مقابل D2: تأثير التحفيز. الهياكل: AHiPM/AL: منطقة الحصين اللوزاني الحصين الجزء الخلفي / الأمامي الجانبي، Au: القشرة السمعية، Bstm: جذع الدماغ، وحدة المعالجة المركزية: Caudate-putamen، HTh: تحت المهاد، بير: القشرة الحليمية الشكلية، PMCo: نواة اللوزة الدماغية القشرية ما بعد الوسيطة، S1: القشرة الحسية الجسدية الأولية. عائد الاستثمار: منطقة الاهتمام. الجانب: اليمين (R) واليسار (L). T: قيمة t ، k: حجم العنقود. استقلاب الجلوكوز: زيادة (↑) ونقصان (↓). p: p-value, unc.: uncorrected, FWE: تصحيح الخطأ الحكيم للعائلة. تم تعديل هذا الجدول بإذن من Casquero-Veiga et al.8.
Discussion
بالنظر إلى التقدم في فهم وظائف الدماغ والشبكات العصبية المشاركة في الفيزيولوجيا المرضية للاضطرابات العصبية والنفسية ، فإن المزيد والمزيد من الأبحاث تعترف بإمكانات DBS في مجموعة واسعة من الأمراض العصبية2. ومع ذلك ، فإن آلية عمل هذا العلاج لا تزال غير واضحة. حاولت العديد من النظريات تفسير الآثار التي تم الحصول عليها في ظروف مرضية وتحفيزية محددة ، لكن عدم تجانس الدراسات المقترحة يجعل من الصعب للغاية الوصول إلى استنتاجات نهائية4. لذلك ، على الرغم من الجهود الكبيرة ، لا يوجد إجماع حقيقي ، ولكن عدد المرضى الذين يخضعون لتدخل DBS يستمر في النمو18. بعد ذلك ، سيسمح فهم عواقب DBS في الدماغ في الجسم الحي بالكشف عن معلمات التحفيز وبروتوكولات التحفيز الأكثر ملاءمة لاحتياجات كل مريض ، وبالتالي الحصول على معدل نجاح أفضل. في هذا السياق ، تعد طرق التصوير العصبي الوظيفية غير الغازية ، مثل FDG-PET ، ضرورية لإلقاء الضوء على ما يحدث بالفعل تحت التأثير المباشر للتحفيز الكهربائي في الدماغ. على سبيل المثال ، في البروتوكول الطولي الموضح هنا ، يتم تسليم DBS خلال فترة امتصاص المقتفي الإشعاعي لصورة D2 PET. وبالتالي ، فإن مقارنة دراسات D2 (DBS-ON) و D1 (DBS-OFF) PET تمكن من تصور مناطق الدماغ التي يتم تعديلها بواسطة التحفيز الكهربائي في الجسم الحي ، حيث تسمح خصائص "الاصطياد الأيضي" ل FDG بتسجيل التغيرات التراكمية التي تحدث مباشرة أثناء التحفيز13,19.
إجمالا ، يصف هذا البروتوكول استراتيجية مجدية لتقييم العواقب الحادة ل DBS في الدماغ في الجسم الحي ، ولكن مجموعة متنوعة من مجموعات معلمات DBS والبروتوكولات المتاحة هائلة (على سبيل المثال ، العلاجات المستمرة مقابل المتقطعة20 ، التحفيز عالي مقابل منخفض التردد 21) ، وحتى تأثيرات DBS قد تختلف مع العلاج بسبب استنتاج التغيرات المباشرة في شبكة الدماغ تحت تأثير التحفيز22 . علاوة على ذلك ، يصبح عدد الاحتمالات أكبر بالنظر إلى العدد المتزايد من الأمراض التي يوصى بها DBS23. لذلك ، فإن دراسات التصوير العصبي الطولي التي تهدف إلى الكشف عن أنماط التنشيط العصبي التي تسمح بالتنبؤ بالاستجابة المحتملة لعلاج DBS لها أهمية سريرية خاصة24,25. في هذا الصدد ، هناك عدد كبير من الدراسات السريرية وما قبل السريرية التي قيمت الآثار العلاجية لبروتوكولات DBS المختلفة بواسطة FDG-PET (انظر3 للمراجعة). وبالتالي ، هناك العديد من الأمثلة التي يقاوم فيها بروتوكول DBS المدروس نمط التمثيل الغذائي للدماغ المرتبط بعلم الأمراض قيد العلاج ، مما يؤدي إلى تحسين أعراض المريض وإثبات الفائدة السريرية لنهج DBS-PET. تم العثور على مثال على ذلك في تحفيز منطقة الحزامية تحت الصدفية (SCC) للمرضى الذين يعانون من الاكتئاب المقاوم للعلاج. SCC هو فرط النشاط الأيضي في المرضى غير المعالجين الذين يعانون من الاكتئاب26 ، ويتم تطبيع هذا فرط النشاط بعد مغفرة الاكتئاب عن طريق العلاج الدوائي أو النفسي أو DBS27,28,29. من الأهمية بمكان أن استقلاب SCC كان أعلى في المرضى الذين استجابوا ل DBS قبل البدء في التحفيز مقارنة بغير المستجيبين. أظهرت هذه الدراسة دقة بنسبة 80٪ في التنبؤ بالاستجابة ل SCC-DBS29 ، مما يسلط الضوء على أهمية تصوير المؤشرات الحيوية في اختيار المرضى المحتملين ل DBS. لذلك ، يعكس السياق الموضح تاريخا من النجاح السريري لدراسات FDG-PET التي تهدف إلى رسم خريطة لنمط التمثيل الغذائي للدماغ للاكتئاب مع النتائج العلاجية التي تم الحصول عليها باستخدام SCC-DBS ، والتي يجب أن تضع الأساس لنهج مماثلة تركز على الاضطرابات العصبية والنفسية الأخرى وبروتوكولات DBS في المستقبل.
وبهذا المعنى ، من أجل مراقبة الآثار الفسيولوجية ل DBS باستخدام FDG-PET ، من المهم بشكل خاص النظر بعناية في التوقيت المحدد لبروتوكول DBS المراد مسحه ضوئيا. وبالتالي ، على الرغم من تطبيق نفس معلمات DBS ونفس البروتوكول ، فإن توقيت الحصول على الصورة سيحدد بوضوح أصل التشكيل المرصود ، مما قد يؤدي إلى سوء فهم محتمل من خلال عدم النظر في جميع العوامل التي تنطوي عليها الاستجابة النهائية التي تم الحصول عليها8. لذلك ، في حين أن التخطيط للجراحة هو المحدد في وضع الأساس للعلاج اللاحق ، فإن تصميم بروتوكول اكتساب الصور المناسب لعواقب التحفيز قيد الدراسة أمر ضروري لفهم الآلية الجزيئية الكامنة وراء علاج التحفيز المطبق بشكل كامل. على طول هذه الخطوط ، يمكن لعدة عوامل تعديل الاستجابة بشكل كبير لبروتوكول DBS محدد (على سبيل المثال ، معلمات التحفيز ، وإدخال القطب الكهربائي ، وبنية الدماغ المستهدفة ، وعلم الأمراض قيد العلاج ، ومدة وتواتر جلسات DBS ، وما إلى ذلك) 7,8,30. تعتمد الظواهر التي تعكسها البيانات التي تم جمعها في دراسة FDG-PET على الوقت المحدد في سياق العلاج الذي يتم فيه الحصول على الصور. بعد ذلك ، تفتح كل هذه النقاط فرصا بحثية مختلفة لاستكشاف التعديل الناجم عن DBS والمساهمة في شرح الآليات الكامنة وراء هذا العلاج.
وهكذا ، على الرغم من الاختلافات الكبيرة التي تفصل بين أدمغة القوارض والعقول البشرية ، ينبغي تنفيذ ممارسات مناسبة على جميع المستويات ، بهدف تطوير بروتوكولات انتقالية. بهذا المعنى ، لا ينبغي تجاهل أن DBS يتطلب جراحة شديدة التوغل تعتمد على بضع القحف حتى تتمكن الأقطاب الكهربائية من الوصول إلى هياكل الدماغ العميقة31. في هذه المرحلة ، هناك مصدران مهمان للعدوى والتفاعل الالتهابي: من ناحية ، التعرض المباشر لأنسجة المخ أثناء الجراحة ، ومن ناحية أخرى ، إدخال عنصرين خارجيين في عضو داخلي ، مما يخلق ندبة إدخالية من خلال مسارها نحو هدف التحفيز32. لذلك ، فإن تعقيم المعدات الجراحية ، والحفاظ على منطقة تشغيل نظيفة ، والرعاية الكافية بعد العملية الجراحية القائمة على المضادات الحيوية والعلاجات المسكنة33 ضرورية لضمان حصول الشخص على أكبر فائدة من التدخل وفي أكثر الظروف صحة. علاوة على ذلك ، هذا له أهمية خاصة في دراسات التصوير FDG-PET ، حيث أن حدوث مضاعفات ما بعد الجراحة يمكن أن يعدل نمط امتصاص التتبع الإشعاعي بالنظر إلى أن العمليات الالتهابية والمعدية ينظر إليها بوضوح على أنها إشارات فرط التمثيل الغذائي34 ، مما قد يؤدي إلى استجابة معدلة للعلاج أو المبالغة في تقدير التعديل الناتج عن DBS.
ومع ذلك ، تخضع هذه المنهجية التجريبية لبعض القيود: أولا ، عادة ما تكون بروتوكولات DBS علاجات طويلة الأجل ومستمرة ومزمنة. هنا ، يظهر بروتوكول التصوير العصبي لتقييم الآثار الحادة ل DBS في الوقت الفعلي. وبالتالي ، فإن التوقيت المقترح لدراسات التصوير العصبي لن يكون كافيا للحصول على معلومات حول التعديل طويل الأجل الناجم عن DBS في الوقت الفعلي تقريبا. ومع ذلك، فإنه قد يضع الأساس لتطوير نهج طولية مختلفة لتكون بمثابة المعرفة الأساسية لفهم الاستجابات المستمدة من DBS. ثانيا ، نظرا لاستخدام الحيوانات السليمة لتوضيح هذه الطريقة ، فإن تطبيق التقنيات الموضحة على الظروف المرضية المختلفة قد يتطلب تكييفها لضمان نتائج أفضل وظروف رفاهية مثالية. وأخيرا، تتطلب التحليلات الحكيمة فوكسل أحجام عينات كبيرة و/أو عوامل تصحيح قوية للحصول على نتائج موثوقة، لأنها تتأثر دائما بمشكلة المقارنات الإحصائية المتعددة. ومع ذلك ، فإن تقييم عواقب DBS على استقلاب الدماغ باستخدام FDG-PET مع نهج voxel-wise هو ميزة كبيرة بسبب الطبيعة الاستكشافية الجوهرية لهذه الطريقة ، والتي تسمح بإجراء تحليلات شاملة للدماغ بأكمله دون الحاجة إلى أي افتراضات مسبقة.
على الرغم من العيوب الموضحة للجمع بين DBS و FDG-PET ، فإن هذه النهج توفر نافذة كبيرة من الفرص. وبالتالي ، فإن الحصول على معلومات التمثيل الغذائي للدماغ بشكل غير جراحي هو ميزة كبيرة بمعنى أنه يمكن جمع البيانات العصبية الفسيولوجية من الموضوع أثناء التحفيز وفي العديد من المناسبات المختلفة جنبا إلى جنب مع علاج DBS. علاوة على ذلك ، FDG-PET هي تقنية تصوير عصبي في الإعداد السريري ، مما يعزز النهج الانتقالي الذي يحفز هذه الطريقة. وبالمثل ، فإن استخدام FDG-PET هو بديل مناسب بشكل خاص لأنه ، على عكس طرق التصوير الأخرى ، لا تتأثر الإشارة التي يتم الحصول عليها بالتشوهات الثانوية في المجالات الكهربائية أو المغناطيسية المشتقة من نظام التحفيز العصبي ، مما قد يضعف جودة الصورة وأداء النظام24. من ناحية أخرى ، لا يقتصر الاهتمام البحثي بتقييم العواقب التعديلية ل DBS على الفوائد العلاجية. في الواقع ، نظرا لأن DBS هو علاج تحفيز عصبي بؤري وتعديلي وغير دائم ، فقد يساعد أيضا في كشف مسارات النشاط العصبي الوظيفي التي تم تقييمها بواسطة تقنيات التصوير الجزيئي واستجابة للمحفزات الكهربائية التي يوفرها syste35. يمكن أن تكون هذه المعلومات ذات قيمة خاصة في فك رموز الألغاز العصبية الفسيولوجية التي لم يتم حلها في الحالات الصحية والمرضية. وأخيرا، توفر المنهجية الموضحة في هذه المخطوطة القدرة على مراقبة آثار التعديل العصبي الناجم عن DBS في الجسم الحي، كونها استراتيجية قوية لتحديد تأثير التحفيز أثناء تطبيقه. باختصار ، سيساعد فهم تأثير DBS في الجسم الحي على فهم الآثار المرغوبة وغير المرغوب فيها لهذا العلاج ، والتنبؤ بالتحسن السريري ، وفي النهاية تكييف بروتوكولات التحفيز مع احتياجات كل مريض.
Disclosures
يعلن المؤلفون أنه لا يوجد تضارب في المصالح فيما يتعلق بهذه المقالة.
Acknowledgements
ونشكر البروفيسورة كريستين وينتر وجوليا كلاين وألكسندرا دي فرانسيسكو ويولاندا سييرا على دعمهم القيم في تحسين المنهجية الموصوفة هنا. وحظيت MLS بدعم من وزارة العلوم والابتكار ومعهد كارلوس الثالث (المشروع رقم PI17/01766 والمنحة رقم BA21/0030) بتمويل مشترك من الصندوق الأوروبي للتنمية الإقليمية (ERDF) ، "طريقة لجعل أوروبا" ؛ CIBERSAM (رقم المشروع CB07/09/0031)؛ Delegación del Gobierno para el Plan Nacional sobre Drogas (رقم المشروع 2017/085)؛ مؤسسة مابفري; ومؤسسة أليسيا كوبلويتز. تم دعم MCV من قبل مؤسسة Tatiana Pérez de Guzmán el Bueno كحامل منحة دراسية لهذه المؤسسة ، والبرنامج المشترك للاتحاد الأوروبي - أبحاث الأمراض العصبية التنكسية (JPND). تم دعم DRM من قبل مجلس التعليم والتحقيق ، Comunidad de Madrid ، بتمويل مشترك من الصندوق الاجتماعي الأوروبي "الاستثمار في مستقبلك" (رقم المنحة PEJD-2018-PRE/BMD-7899). تم دعم NLR من قبل معهد التحقيقات الصحية غريغوريو مارانون ، "Programa Intramural de Impulso a la I + D + I 2019". وحظي عمل العضو المنتدب بدعم من وزارة العلوم والابتكار (MCIN) ومعهد كارلوس الثالث (ISCIII) (PT20/00044). يتم دعم CNIC من قبل معهد Salud Carlos III (ISCIII) ، ووزارة العلوم والابتكار (MCIN) ومؤسسة Pro CNIC ، وهو مركز Severo Ochoa للتميز (SEV-2015-0505).
Materials
| Name | Company | Catalog Number | Comments |
| 7-Tesla Biospec 70/20 scanner | Bruker, Germany | SN0021 | MRI scanner for small animal imaging |
| Betadine | Meda Pharma S.L., Spain | 644625.6 | Iodine solution (iodopovidone) |
| Beurer IL 11 | Beurer | SN87318 | Infra-red light |
| Bipolar cable 50 cm w/50 cm mesh covering up to 100 cm | Plastics One, USA | 305-305 (CM) | |
| Bipolar cable TT2 50 cm up to 100 cm | Plastics One, USA | 305-340/2 | Bipolar cable TT2 50 cm up to 100 cm |
| Buprex | Schering-Plough, S.A | 961425 | Buprenorphine (analgesic) |
| Ceftriaxona Reig Jofré 1g IM | Laboratorio Reig Jofré S.A., Spain | 624239.1 | Ceftriaxone (antibiotic) |
| Commutator | Plastics One, USA | SL2+2C | 4 Channel Commutator for DBS |
| Concentric bipolar platinum-iridium electrodes | Plastics One, USA | MS303/8-AIU/Spc | Electrodes for DBS |
| Driller | Bosh | T58704 | Driller |
| FDG | Curium Pharma Spain S.A., Spain | ----- | 2-[18F]fluoro-2-deoxy-D-glucose (PET radiotracer) |
| Heating pad | DAGA, Spain | 23115 | Heating pad |
| Ketolar | Pfizer S.L., Spain | 776211.9 | Ketamine (anesthetic drug) |
| Lipolasic 2 mg/g | Bausch & Lomb S.A, Spain | 65277 | Ophthalmic lubricating gel |
| MatLab R2021a | The MathWorks, Inc | Support software for SPM12 | |
| MRIcro | McCausland Center for Brain Imaging, University of South Carolina, USA | v2.1.58-0 | Software for imaging preprocessing and analysis |
| Multimodality Workstation (MMWKS) | BiiG, Spain | Software for imaging processing and analysis | |
| Omicrom VISION VET | RGB Medical Devices, Spain | 731100 ReV B | Cardiorrespiratory monitor for small imaging |
| Prevex Cotton buds | Prevex, Finland | ----- | Cotton buds |
| Sevorane | AbbVie Spain, S.L.U, Spain | 673186.4 | Sevoflurane (inhalatory anesthesia) |
| Small screws | Max Witte GmbH | 1,2 x 2 DIN 84 A2 | Small screws |
| Standard U-Frame Stereotaxic Instrument for Rat, 18° Ear Bar | Harvard Apparatus, USA | 75-1801 | Two-arms Stereotactic frame for rat |
| Statistical Parametric Mapping (SPM12) | The Wellcome Center for Human Neuroimaging, UCL Queen Square Institute of Neurology, UK | SPM12 | Software for voxel-wise imaging analysis |
| STG1004 | Multi Channel Systems GmbH, Germany | STG1004 | Isolated stimulator |
| SuperArgus PET/CT scanner | Sedecal, Spain | S0026403 | NanoPET/CT scanner for small animal imaging |
| Suture thread with needle, 1/º | Lorca Marín S.A., Spain | 55325 | Braided natural silk non-absorbable suture 1/0, with triangle needle |
| Technovit 4004 (powder and liquid) | Kulzer Technique, Germany | 64708471; 64708474 | Acrylic dental cement for craniotomy tap |
| Wistar rats (Rattus norvergicus) | Charles River, Spain | animal facility | Animal model used |
| Xylagesic | Laboratorios Karizoo, A.A, Spain | 572599-4 | Xylazine (anesthetic drug) |
| Normon S.A., Spain | 602910 | Mepivacaine in gel for topical use |
References
- Gildenberg, P. L. Neuromodulation: A historical perspective. Neuromodulation. 1, 9-20 (2009).
- Lee, D. J., Lozano, C. S., Dallapiazza, R. F., Lozano, A. M. Current and future directions of deep brain stimulation for neurological and psychiatric disorders. Journal of Neurosurgery. 131 (2), 333-342 (2019).
- Casquero-Veiga, M. Preclinical molecular neuroimaging in deep brain stimulation. Complutense University of Madrid. , (2021).
- Blaha, C. D. Theories of deep brain stimulation mechanisms. Deep Brain Stimulation: Indictions and Applications. , 314-338 (2016).
- Fins, J. J. Deep brain stimulation: Ethical issues in clinical practice and neurosurgical research. Neuromodulation. 1, 81-91 (2009).
- Desmoulin-Canselier, S., Moutaud, B. Animal models and animal experimentation in the development of deep brain stimulation: From a specific controversy to a multidimensional debate. Frontiers in Neuroanatomy. 13, 51 (2019).
- Casquero-Veiga, M., Hadar, R., Pascau, J., Winter, C., Desco, M., Soto-Montenegro, M. L. Response to deep brain stimulation in three brain targets with implications in mental disorders: A PET study in rats. PLOS One. 11 (12), 0168689 (2016).
- Casquero-Veiga, M., García-García, D., Desco, M., Soto-Montenegro, M. L. Understanding deep brain stimulation: In vivo metabolic consequences of the electrode insertional effect. BioMed Research International. 2018, 1-6 (2018).
- Casquero-Veiga, M., García-García, D., Pascau, J., Desco, M., Soto-Montenegro, M. L. Stimulating the nucleus accumbens in obesity: A positron emission tomography study after deep brain stimulation in a rodent model. PLOS One. 13 (9), 0204740 (2018).
- Pascau, J., Vaquero, J. J., Abella, M., Cacho, R., Lage, E., Desco, M. Multimodality workstation for small animal image visualization and analysis. Scientific Papers. Molecular Imaging and Biology. 8, 97-98 (2006).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (1998).
- Roy, M., et al. A dual tracer PET-MRI protocol for the quantitative measure of regional brain energy substrates uptake in the rat. Journal of Visualized Experiments: JoVE. (82), e50761 (2013).
- Klein, J., et al. A novel approach to investigate neuronal network activity patterns affected by deep brain stimulation in rats. Journal of Psychiatric Research. 45 (7), 927-930 (2011).
- Soto-Montenegro, M. L., Pascau, J., Desco, M. Response to deep brain stimulation in the lateral hypothalamic area in a rat model of obesity: In vivo assessment of brain glucose metabolism. Molecular Imaging and Biology. , 830-837 (2014).
- Pascau, J., et al. Automated method for small-animal PET image registration with intrinsic validation. Molecular Imaging and Biology. 11 (2), 107-113 (2009).
- Andersson, J. L. R. How to estimate global activity independent of changes in local activity. Neuroimage. 244 (60), 237-244 (1997).
- . Wellcome Trust Centre for Neuroimaging SPM12-Statitstical Parametric Mapping Available from: https://www.fil.ion.ucl.ac.uk/spm/software/spm12/ (2022)
- Lozano, A. M., et al. Deep brain stimulation: current challenges and future directions. Nature Reviews Neurology. 15 (3), (2019).
- Boecker, H., Drzezga, A. A perspective on the future role of brain pet imaging in exercise science. NeuroImage. 131, (2016).
- Sprengers, M., et al. Deep brain stimulation reduces evoked potentials with a dual time course in freely moving rats: Potential neurophysiological basis for intermittent as an alternative to continuous stimulation. Epilepsia. 61 (5), 903-913 (2020).
- Middlebrooks, E. H., et al. Acute brain activation patterns of high- versus low-frequency stimulation of the anterior nucleus of the thalamus during deep brain stimulation for epilepsy. Neurosurgery. 89 (5), 901-908 (2021).
- Ashkan, K., Rogers, P., Bergman, H., Ughratdar, I. Insights into the mechanisms of deep brain stimulation. Nature Reviews Neurology. 13 (9), 548-554 (2017).
- Williams, N. R., Taylor, J. J., Lamb, K., Hanlon, C. A., Short, E. B., George, M. S. Role of functional imaging in the development and refinement of invasive neuromodulation for psychiatric disorders. World Journal of Radiology. 6 (10), 756-778 (2014).
- Rodman, A. M., Dougherty, D. D. . Nuclear medicine in neuromodulation. Neuromodulation in Psychiatry. , 81-99 (2016).
- Albaugh, D. L., Shih, Y. -. Y. I. Neural circuit modulation during deep brain stimulation at the subthalamic nucleus for Parkinson's disease: what have we learned from neuroimaging studies. Brain Connectivity. 4 (1), 1-14 (2014).
- Mayberg, H. S., et al. Reciprocal limbic-cortical function and negative mood: Converging PET findings in depression and normal sadness. Neurology, and Radiology. 156 (5), 675-682 (1999).
- Kennedy, S. H., et al. Differences in brain glucose metabolism between responders to CBT and Venlafaxine in a 16-week randomized controlled trial. American Journal of Psychiatry. 164 (5), 778-788 (2007).
- Kennedy, S. H., et al. Changes in regional brain glucose metabolism measured with positron emission tomography after paroxetine treatment of major depression. American Journal of Psychiatry. 158 (6), 899-905 (2001).
- Brown, E. C., Clark, D. L., Forkert, N. D., Molnar, C. P., Kiss, Z. H. T., Ramasubbu, R. Metabolic activity in subcallosal cingulate predicts response to deep brain stimulation for depression. Neuropsychopharmacology. 45, 1681-1688 (2020).
- Klooster, D. C. W., et al. Technical aspects of neurostimulation: Focus on equipment, electric field modeling, and stimulation protocols. Neuroscience & Biobehavioral Reviews. 65, 113-141 (2016).
- Kasoff, W., Gross, R. E. Deep brain stimulation: Introduction and Technical Aspects. Neuromodulation in Psychiatry. , 245-275 (2016).
- Perez-Caballero, L., et al. Early responses to deep brain stimulation in depression are modulated by anti-inflammatory drugs. Molecular Psychiatry. 19, 607-614 (2014).
- Solera Ruiz, I., UñaOrejón, R., Valero, I., Laroche, F. Craniotomy in the conscious patient. Considerations in special situations. Spanish Journal of Anesthesiology and Resuscitation. 60 (7), 392-398 (2013).
- Casali, M., et al. State of the art of 18F-FDG PET/CT application in inflammation and infection: a guide for image acquisition and interpretation. Clinical and Translational Imaging. 9 (4), 299-339 (2021).
- Gonzalez-Escamilla, G., Muthuraman, M., Ciolac, D., Coenen, V. A., Schnitzler, A., Groppa, S. Neuroimaging and electrophysiology meet invasive neurostimulation for causal interrogations and modulations of brain states. NeuroImage. 220, 117144 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved