Method Article
Merkezi Miyelin'de Tubuline Bağlı Kusurların İncelenmesi için Etiketsiz Doğrusal Olmayan Optikler
Bu Makalede
Özet
Bu makalede, basit, yenilikçi bir ikinci harmonik nesil mikroskopi yaklaşımı ile bir tübülinopati modelinde mikrotübül yüklü oligodendrositleri tespit etmek için bir protokol sunuyoruz.
Özet
Beyindeki sitoiskelet bileşenlerinin tatmin edici bir şekilde görselleştirilmesi zordur. Tüm sinir dokularında mikrotübüller, mikrofilamentler ve ara filamentlerin ağlarının her yerde bulunması, floresan protein füzyon stratejilerinin sonuçlarındaki değişkenlik ve bunların kromofor araçları olarak antikorların ve ilaçların dinamik çalışmalarına sınırlı uygulanabilirliği ile birlikte, klasik optik yaklaşımları diğer proteinler kadar etkili kılmamaktadır. Tubulinin incelenmesi gerektiğinde, ikinci harmoniklerin etiketsiz üretimi, molekülün merkez-simetrik olmayan organizasyonu nedeniyle çok uygun bir seçenektir. Bu teknik, mikroskopiye konjuge edildiğinde, biyolojik örneklerdeki paralel mikrotübül demetlerinin hacimsel dağılımını, sabitlenmemiş ve geçirgenleşmemiş taze dokularla çalışmanın ek avantajıyla niteliksel olarak tanımlayabilir. Bu çalışma, yakın zamanda tanımlanmış bir miyelin bozukluğu olan bazal gangliyon ve serebellum (H-ABC) tübülinopatisinin atrofisi ile hipomiyelinasyonda olduğu gibi, oligodendrositlerin tübülinle zenginleştirilmiş yapılarındaki mikrotübülleri vurgulamak için ticari bir ikinci harmonik nesil mikroskopi kurulumuyla tübülinin nasıl görüntüleneceğini açıklamaktadır.
Giriş
Dokulardaki ve organ preparatlarındaki sitoiskelet yapılarının optik olarak görüntülenmesi kolay bir iş değildir. Sitoiskelet filamentleri her yerde bulunur, bu nedenle jenerik boyama yapılırsa, örneğin, bir epitel örneğinde alfa-tübülin veya beta-aktin veya potansiyel olarak keratine karşı, sinyal muhtemelen numunenin her tarafına homojen bir şekilde dağıtılacaktır. Boyama işlemini hücresel bileşenlerin daha anlamlı bir alt kümesiyle sınırlamak için, hedeflenen ekspresyon1 ile transgenik fareler kullanılabilir veya izoforma özgü antikorlar kullanmayı planlayabilir. İkincisinin çok azı piyasada olsa da (ve çok azı 2,3,4'te mevcut), transgenik bir hayvan modeli mevcut olabilir. Bununla birlikte, laboratuvar tarafından satın alınması ve sürece dahil olan tüm masraflarla birlikte uygun şekilde barındırılması gerekir. Bazı antikorlar veya kimyasallar, örneğin, faloidin veya paklitaksel gibi florofor konjuge ilaçlar, canlı hücrelerde veya dokularda kullanımla kısmen veya tamamen uyumsuz olabilir, bu nedenle uygulanabilirliklerini yalnızca sabit numunelerin çalışmalarına sınırlandırır.
Tübülin durumunda, polimerin fiksasyona duyarlılığı olan ek bir husus dikkate alınmalıdır. Formaldehit ile konvansiyonel kimyasal fiksasyonun, mikrotübüllerin bütünlüğünü en iyi şekilde korumak için yeterli olmadığı bilinmektedir5. Ek olarak, yakın tarihli bir rapor, formaldehit çapraz bağlanmasının, bazı ilaçların veya GTP6 gibi fizyolojik moleküllerin bağlanmasıyla olanlara benzer şekilde, mikrotübülün ultrayapısında ince değişikliklere neden olduğunu doğrulamaktadır.
Bu nedenle, lekesiz, sabitlenmemiş numunelerde mikrotübüllerin doğrudan görselleştirilmesi genellikle arzu edilir. Bunu başarmak için, bir teknik çözüm, paralel mikrotübül demetlerinin harmonofor gibi davranma ve yoğun, darbeli bir kızılötesi lazerle uygun şekilde aydınlatıldığında frekansı iki katına çıkaran ışık yayma yeteneğine dayanan ikinci harmonik nesil (SHG) mikroskopi7'dir. Frekans ikiye katlanabildiği bilinen diğer iki biyolojik materyal olan kollajen ve miyosin'den daha güçlü ve daha kararlı bir ikinci harmonik sinyal üretilebilse de, tübülinden gelen sinyal şimdiye kadar çoğunlukla mitotik iğ yeniden düzenlemelerini incelemek için kullanılmıştır 8,9,10 ve aksonal mikrotübül morfolojisi11,12,13.
Bu çalışmada, tübülin beta 4 A (TUBB4A) tübülinopatisinden etkilenen merkezi sinir sistemi (CNS) dokularını sağlıklı muadillerinden ayırt etmek için tanı aracı olarak SHG mikroskobunun yeni bir kullanımını tanıtıyoruz14. Tübülinin bu ağırlıklı olarak nöral izoformunda meydana gelen mutasyonlardan bazıları, bazal gangliyon ve serebellumun (H-ABC) hipomiyelinasyonuna ve atrofisine neden olanlar gibi, oligodendrositlerde mikrotübül aşırı dolgusunu indükler15,16; sitoiskelet değişiklikleri, sırayla, dismiyelinasyon gibi aşağı akış etkileriyle, motor ve duyusal yolakların derin bozulmasıyla ilişkilidir16,17,18,19. Bu çalışmada kullanılan taiep murin modeli, oligodendrositlerde anormal mikrotübül içeriği gösterir ve H-ABC hastalarının duyusal-motor semptomlarının çoğunu özetler17. Protokol, sağlıklı ve mutant dokular arasındaki SH sinyallerindeki farklılıkları vurgulamak için, genellikle yüksek oranda miyelinli olan ve insan hastalarında ve taiep sıçan19'da ciddi şekilde etkilenen korpus kallozum ve beyincik olarak yapıların nasıl görüntüleneceğini açıklar.
Protokol
Açıklanan tüm prosedürler, Meksika Hükümeti Sağlık Araştırmalarına İlişkin Genel Sağlık Kanunu Yönetmeliği'nin yedinci başlığında (NOM-062-ZOO-1999) ve Deney Hayvanlarının Bakımı ve Kullanımı için Ulusal Sağlık Enstitüleri Rehberi'nin tavsiyelerine uygun olarak onaylanmış ve Universidad de Guanajuato ve Benemérita Universidad Autónoma de araştırmalarında kurumsal biyoetik komitesi tarafından onaylanmıştır. Puebla.
1. Mikroskop ayarları
- Mikroskopi sistemini açın.
- Numune ekstraksiyonu ve hazırlanmasından sonra optimum ve sabit bir güç seviyesinde lase yapmaya hazır olacağını garanti etmek için darbeli lazeri açın.
- Lazeri 810 nm'ye ayarlayın. Tissular mikrotübülleri incelemek için, mevcut lazer gücünün% 10-20'si kullanılır, bu da tarif edilen sistemde, hedefin arka odak düzleminde ölçülen 13-26 mW'a karşılık gelir.
- Mikroskopun SHG görüntülemesi için kullanılacak amaçla Köhler hizalı olduğundan emin olun (Ek Dosya 1).
NOT: Bu önemlidir, çünkü bu çalışmada kullanılan ticari kurulumda, algılama iletim modunda ve kondenser aracılığıyla gerçekleştirilir. - İstenmeyen filtreleri optik algılama yolundan çıkarın (Şekil 1A).
- Bu seviyede gereksiz yere hiçbir ışığın durmadığından emin olmak için kondenser diyaframının tamamen açıldığından emin olun.
- Lense küçük bir damla daldırma yağı ile 25x/0,8 sayısal diyafram açıklığına (NA) yağ daldırma hedefi hazırlayın.
NOT: Bu hedef, 0,55 olan NA≥ kondenserle en iyi eşleşmek için kullanılmıştır (ideal olarak, NAcond NAobj).
2. Mikroskop ön kontrolleri
NOT: Kurulum değiştirilmediği sürece ön mikroskop kontrollerini bir kez gerçekleştirin.
- Görüntü kuru mısır nişastası, lazer polarizasyon yönünü ortaya çıkaran SHG görüntüleri oluşturmak için SHG parametreleri ile cam slaytlar arasına sıkıştırılmıştır. Mısır nişastası için% 5'ten az olan lazer gücü hariç, Ek Dosya 2'de bildirilen adımları izleyin.
- Seyrek mısır nişastası tanelerinin bir görüntüsünü alın ve x-y düzleminde SHG lobüllerinin yönünü işaretleyin. Bu oryantasyon lazer oryantasyonuna karşılık gelir (Şekil 2A).
- Kontrol olarak, lazerin salınım yönünü değiştirmek için optik yola yarım dalga plakası ( Şekil 1A'da gösterilen konum) ekleyerek aynı numunenin başka bir görüntüsünü alın. Elde edilen görüntüde döndürülmüş SHG sinyal lobülleri görüntülenir (Şekil 2B, C).
- SHG için farklı türde bir bant geçişi filtresi kullanıyorsanız, görüntüleri (Şekil 2D, E) ve sinyal yoğunluklarını bir çizgi taraması boyunca piksel piksel karşılaştırarak en iyi iletim özelliklerine sahip olduğundan emin olun (Şekil 2F).
3. Doku ekstraksiyonu
NOT: Cerrahi prosedürleri gerçekleştirmek için daima temiz aletler kullanın.
- 6-12 aylık taiep sıçanları ve yaşa uygun Sprague-Dawley kontrollerini (WT) kullanın.
- Hayvanları,% 0.9'luk steril bir NaCl çözeltisi içinde seyreltilmiş bir ketamin-ksilazin karışımının (0.125 mg / Kg ve 5 mg / Kg) bir i.p. enjeksiyonu ile anestezi yapın.
- Ağrı reflekslerini kontrol edin ve sadece yoksa, devam edin.
- Hayvanı kafasını keserek kurban et.
- Kafa izole edildikten sonra, kafatası tonozunun kemiklerini, üstteki en kaudal noktadan buruna doğru, orbital boşluklardan orta hatta doğru ve daha sonra en kaudal noktadan beynin ve beyinciğin altına kadar orta hat boyunca dikkatlice açın.
NOT: Kemik kesiciler ve Rongeur'lar, beyin yapılarına zarar vermeden kafa kemiklerinin uygun şekilde çıkarılmasını sağlar. - Beyni ve beyinciği kemikten serbest bırakın. İki yarımküre ayrılabilir. Yarımküreler bölünmüşse, SHG görüntüleme için bir yarısını kullanın ve diğer yarısını, sonraki bölümleme ve boyama için kimyasal bir başlık içinde 20 dakika boyunca fosfat tamponlu salin (PBS) içinde% 3.7 paraformaldehit içinde sabitleyin.
4. Vibratom kesitleme
- Sıcak (37 °C) Hank'in Dengeli Tuz Çözeltisi (HBSS) ile doldurulmuş bir vibratom tampon tepsisi hazırlayın.
- Beyni, bir parça maskeleme bandı aracılığıyla siyanoakrilat yapıştırıcı kullanarak numune plakasına sabitleyin. En kaudal kısım / bölge tutkalla temas eder, böylece karşıttan kullanılabilir koronal bölümler, rostral kısım kesilebilir.
- Numunenin etkili bir şekilde bağlanmasını sağlamak için tutkalın polimerize olması için ~ 10 s bekleyin.
NOT: En iyi sonuçlar, beyin bıçağın "bir yandan diğer yana" yerine "yukarıdan aşağıya" keseceği şekilde yönlendirildiğinde elde edilir (Şekil 1B).
- Numunenin etkili bir şekilde bağlanmasını sağlamak için tutkalın polimerize olması için ~ 10 s bekleyin.
- Numune plakasını tampon tepsisinin içindeki manyetik desteğine aktarın.
- Üretilen dilimler beynin tüm yüzeyini kapsayana kadar 300-500 μm kesitleri kesmeye başlayın.
- Bu noktada, bölümün kalınlığını 160 μm'ye düşürün.
- Korpus kallozum seviyesinde tam bir 160 μm kesit kesildikten sonra, büyük, alevli bir deliğe sahip modifiye edilmiş bir cam Pasteur pipet ile geri kazanın (Şekil 1C).
- Yeni sıcak HBSS ile temiz bir Petri kabına veya mikroskopi için doğrudan cam desteğine (kapak kayması veya cam tabanlı tabak) aktarın.
NOT: Açıklanan deneysel koşullar için, numunenin üzerine bir kapak lipi eklemek görüntülemeye zararlıdır.
5. Mikroskopa aktarma
- Mikroskop farklı bir odadaysa, sıcaklığı korurken doku bölümlerini aktarmak için ısıtılmış jel paketleriyle yalıtımlı bir kutu hazırlayın. Kutu ayrıca bölümleri görüntülenene kadar sıcak tutmaya da yarar.
- Numuneyi mikroskop altına koyun ve iletilen ışıkla oküler boyunca doğrudan gözlem yaparak hedefin altına doğru şekilde yerleştirildiğinden emin olun.
NOT: Amaç, yayılan (ve dolayısıyla algılanan) SHG sinyalini en üst düzeye çıkarmak için tahmin edilen yayan yapıları lazerin salınım yönüyle hizalamaktır. - İnce bir sıvı filmin tüm numuneyi kaplaması için fazla HBSS'yi çıkarın. Numunenin aşırı buharlaşmasını ve kurumasını önlemek için sıvı filmi birkaç dakikada bir görsel olarak kontrol edin.
NOT: Açıklanan koşullarda, bir bölüm en fazla 20 dakika kullanılır. Numunenin kurutulması ciddi yapay etkilere neden olur (Ek Şekil 1A). Daha fazla HBSS eklemek yerine, daha uzun görüntüleme sürelerine ihtiyaç duyulursa, bölümün periyodik olarak ılık, taze ortamda ıslatılması önerilir. Dokuyu hareketsiz hale getirmek için perfüzyon odalarının ve tutkal veya düşük erime noktalı agarozun kullanılması da daha uzun deneyler yapılacağında önerilir. - Mikroskop aşamasını, karanlık inkübasyon odasının tüm kapılarını kapatmayı veya kuluçka odasını siyah naylon poliüretan kaplı bir kumaşla kaplamayı içerebilecek taranmamış görüntüleme için hazırlayın.
6. Görüntüleme
- İletim yolu boyunca "taranmamış" görüntüleme modunu seçin. Bu şekilde, tübülinin zayıf SH sinyalinin yakalanması optimize edilecektir.
- LCI Plan-Neofluar 25x/0,8 NA hedefini seçin.
- 12,6 μs piksel bekleme süresiyle 13 mW ile 26 mW arasında bir lazer gücü ayarlayın. Ortalama 15 sn'lik bir yakalama süresi için 512 piksel x 512 pikselden daha büyük olmayan, hız 5 ve ortalama 2 olan görüntüler çekin.
NOT: Daha yüksek lazer güçleri ve/veya daha uzun bekleme süreleri kullanmak numuneye zarar verebilir (Ek Şekil 1B). - Önce 485 nm kısa geçişli filtre (SP485) kullanarak görüntü alın ve ikinci adımda keskin bir 405 nm bant geçişi filtresi ekleyin (BP405; Şekil 3). Ek Dosya 2'de bildirilen adımları izleyin.
NOT: Sahte parlak alan görüntüleri, görünür bir çizginin artık lazer ışığı kullanılarak aynı dedektör aracılığıyla alınabilir (405 nm veya 488 nm lazerler en iyi sonucu verir).
7. Beyinciğin işlenmesi
- İlk olarak, beyinciği bir neşterle iki yarım küreye kesin ve daha sonra orta kısımla (kesimden sonra elde edilen düz kısım) vibratom desteğine yapıştırın.
- Beyinciği beyin için tarif edildiği gibi kesit ve görüntü (160 μm kesitler, aynı vibratom ayarları, aynı bıçak, aynı mikroskop ayarları, vb.).
NOT: Beyinciğin anatomisi nedeniyle, bölümleme anındaki yönü kritik değildir; yüzeyden uzakta üretilen dilimlerin çoğunda, beyaz maddeye iyi kesitlenmiş folia olacaktır.
Sonuçlar
Bu metodoloji ile elde edilen görüntüler, biyolojik dokularda bulunan çok sınırlı sayıda harmonofor nedeniyle içsel düşük bir arka plan seviyesine sahiptir ve bu da yöntemin önemli avantajlarından biridir.
Korpus kallozumun lifleri görüntülendiğinde, lif benzeri kısa yapılar ve yuvarlak elemanlar taiep beyninde tutarlı bir şekilde bulunabilir (Şekil 3B), kontrol beyninin korpus kallozumu beyin bölgesi boyunca çok daha heterojen ve izotropik bir sinyal gösterir (Şekil 3A). Diferansiyel sinyalin kökeni özellikle ikinci harmonik jenerasyon fenomeninde yatmaktadır, çünkü dar bant geçişi filtresinin eklenmesi sadece kontrol görüntülerinden spesifik olmayan sinyal yoğunluğunu azaltır (Şekil 3C-D), bu düşük, dağınık sinyali soma benzeri çevreden seçici olarak kaldırır ve taiep görüntülerindeki kısa, uzun yapılar, her zaman yoğun SH ışığı üretir (Şekil 3E-F).
Analiz edilen diğer yapı, serebellar beyaz cevher, karşılaştırılabilir sonuçlar verir. Spesifik olarak, kontrol dokusunda SH sinyalinin neredeyse tamamen yokluğu varken (Şekil 4B) ve kısa geçişli filtre kullanıldığında Purkinje hücreleri zar zor görülebilirken, uzatılmış ve yuvarlak yapılar SH görüntüsünde taiep dokusundan devam eder (Şekil 4D).
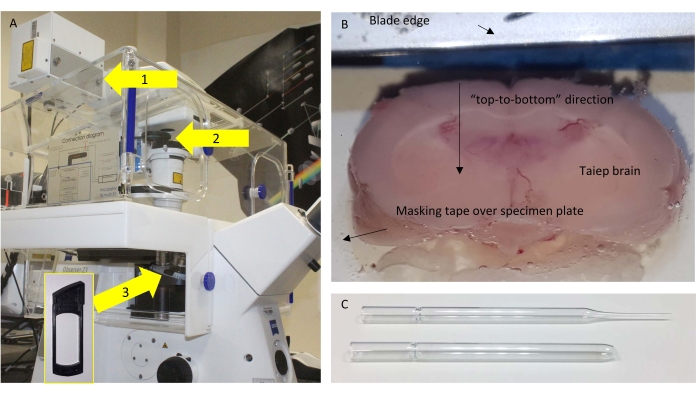
Şekil 1: Mikroskop ve kesitleme . (A) Kullanılan mikroskobun şeması, ilgili bileşenler vurgulanmış. Oklar: 1 = SP485'in dedektörün yakınında bulunduğu NDD bağlantı noktası; 2 = BP405'in yerleştirildiği çıkarılabilir çerçeveler; 3 = kontrol deneyleri için yarım dalga plakasının (HWP) yerleştirildiği hedefin altındaki konum. İç kısım, HWP'nin eklenebileceği çerçeveyi gösterir. (B) Vibratom tampon tepsisinin üstten görünümü, yapıştırılmış beyin ince kesitlenmeye hazır. (C) Bölümleri aktarmak için kullanılan orijinal (üst) ve değiştirilmiş (alt) Pasteur pipet. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 2: Ön kontroller. (A) Mısır nişastası taneleri tarafından yayılan SHG sinyali, lazerin salınım yönüyle çakışan baskın bir yönelim gösterir (bu durumda yatay). (B) Hızlı ekseni yataya göre 45 ° 'ye yönlendirilmiş bir yarım dalga plakası yerleştirildikten sonra, sinyal 90 ° döndürülür. (C) Yarım dalga plaka yerleştirmeden önce ve sonra sinyalin birleştirilmesi. (D) Mısır nişastası tanelerinden yayılan 485 nm'nin altındaki sinyal. (E) 405/10 nm'de tespit edilen nişasta tanelerinden gelen SHG sinyali. (F) D ve E'nin yakınlaştırılmış eklerinde gösterilen çizgi taramalarına karşılık gelen iki sinyalin karşılaştırmasını gösteren grafik. Kullanılan SHG filtresi ihmal edilebilir sinyal kaybına neden olur. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Resim 3: taiep ve WT korpus kallozumdan SHG görüntüleri. Korpus kallozumdan elde edilen (A) WT ve (B) taiep sinyallerinin temsili örnekleri. (C) WT korpus kallozumundan SP485 filtrelenmiş görüntü. (D) C. (E) SP485'te olduğu gibi aynı örnekten BP405 filtrelenmiş görüntü, taiep corpus callosum'dan filtrelenmiş görüntü. (F) E'deki ile aynı örneğin BP405 filtrelenmiş görüntüsü. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Resim 4: Taiep ve WT beyinciklerinden SHG görüntüleri. Serebellar foliadan elde edilen (A-B) WT ve (C-D) taiep sinyallerinin temsili örnekleri. (A) WT yaprağından SP485 filtrelenmiş görüntü; sadece bazı Purkinje hücreleri görülebilir. (B) A'dakiyle aynı örnekten BP405 filtrelenmiş görüntü. (C) Bir taiep foliumundan SP485 filtrelenmiş görüntü. (D) C'deki ile aynı numunenin BP405 filtrelenmiş görüntüsü. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: Yapıtlara örnekler. (A) Numunenin kuruması nedeniyle oluşan eser. (B) Aşırı maruz kalma nedeniyle oluşan eser. Ölçek çubukları: 30 μm. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 1: Köhler hizalaması. Dosya, Köhler hizalamasını gerçekleştirme adımlarını sunar. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Dosya 2: SHG görüntü alımı için ZEN yazılım adımları. Bu Dosyayı indirmek için lütfen tıklayınız.
Tartışmalar
SHG mikroskopisi, iki foton uyarma mikroskobu, üçüncü harmonik nesil mikroskopi ve tutarlı anti-Stokes Raman saçılma mikroskobu içeren ve geleneksel optik mikroskopinin yaşam bilimlerine uygulama yelpazesinin genişletilmesine katkıda bulunan bir grup doğrusal olmayan optik tekniğin bir parçasıdır20.
Spesifik olarak, SHG mikroskobunun ana gücü ve zayıflığı aynı durumla ilgilidir: sinyal üreteci merkez-simetrik olmayan21'dir. Böyle özel bir mimari durum genellikle inorganik ve organik kristaller alanında bulunur, ancak biyolojik nesneler arasında nadirdir. Kollajen ve kas miyozini ile birlikte, mikrotübüller, paralel polimer demetlerinde yeterli toplama meydana gelirse mikroskopla tespit edilebilen ikinci bir harmonik sinyal22 üretebilir. Hücrelerin içinde, tübülin, aksonların çekirdeklerinde (hücre tipine özgü bir konum), mitotik iğlerde (zamansal-spesifik bir dağılım) ve bu çalışmada sunulduğu gibi, yakın zamanda tanımlanmış bir tübülinopati-hipomiyelinasyonun bazal gangliyon ve beyincik atrofisi veya H-ABC (bu türün ilk bildirilen patolojik dağılımını temsil eden) ile ticari marka mikrotübül ilişkisinde paralel demetler oluşturmak için ilişkilidir14, 16,23.
Bu duyusal-motor sendrom hala yetim bir hastalıktır, çünkü birçok nörolog henüz tüm semptomlara aşina değildir ve / veya tanıyı doğrulamak için şüpheli hastaların genetik taramasını karşılayamaz, bu da en azından bazı popülasyonlarda yetersiz tanıya neden olur. Bunun da ötesinde, moleküler ve hücresel düzeyde patoloji hakkında fazla bir şey bilinmemektedir, bu nedenle bu dejeneratif sürecin spesifik mekanizmalarına ışık tutmaya yardımcı olabilecek teknikler, temel düzeyde de çok değerlidir.
Bu nedenle, SHG mikroskobunun bu miyelin bozukluğu ile ilgili iki kullanımı önerilmektedir. Uzun vadede, SHG mikroskobu biyopsi taraması veya doğrudan intrakraniyal analiz için tanısal yaklaşımlara entegre edilebilir, ancak en büyük etki hastalığın moleküler temelini deşifre etmeye çalışmakla ilişkili olabilir.
SHG mikroskopisinin diğer mikroskopi tekniklerine göre birçok avantajı vardır. Gerçekten de, SHG mikroskopisi, mikrotübüller durumunda numune hazırlamanın özellikle hassas bir adımı olan dokunun sabitlenmesini gerektirmez ve herhangi bir lekelenme gerektirmez. En büyük avantaj, ilgili fiziksel fenomenle ilgilidir. Bir yandan, neredeyse hiç bulunmayan arka plan nedeniyle, üretilen zayıf sinyallere rağmen yüksek kontrast sağlarken, diğer yandan, frekansın iki katına çıkması için gereken ışık yoğunlukları çok yüksek olduğundan ve bu yoğunluklar yalnızca numunenin çok sınırlı bir hacminde karşılandığından, teknik içsel optik kesitleme sağlar, böylece 3D rekonstrüksiyonlara izin verir.
Bu mikroskopi tekniğinin en büyük sınırlamaları, ekipmanın maliyeti ile ilgilidir. Bu uygulama için darbeli kızılötesi (IR) lazer ile birlikte iyi bir konfokal mikroskop gereklidir ve birçok sinirbilim laboratuvarında SHG kurulumuna kolayca değiştirilebilen iki fotonlu bir uyarma sistemi mevcut olmasına rağmen, geleneksel bir epifloresan kurulumuna kıyasla maliyetteki fark hala önemlidir. Ek olarak, kırınım sınırlı bir teknik olarak, çözünürlüğü aydınlatma için IR ışığının kullanılmasından etkilenir.
Birçok öncü uygulamada olduğu gibi, yaşam bilimlerine uygulanan SHG mikroskobu üzerindeki ilk deneyler için kullanılan kurulumlar, deneycilere her bir bileşeni optimize etme imkanı veren açık sistemler 11,24,25 olarak inşa edilmiş tamamen özelleştirilmiş optik kurulumlardı. Yaşam bilimleri laboratuvarlarında, ticari bir kuruluma erişmek daha yaygın olduğundan, bu sistemlerden birinin, kollajen kadar güçlü harmonoforlar olmadığı bilinen tissular mikrotübül demetleri tarafından yayılan zayıf sinyali tespit edecek kadar hassas olup olmadığını test etmek istedik. Zeiss'ın LSM710 NLO sistemi, iletim ve "epi" modunda taranmamış algılama modülleri ve Tutarlı Bukalemun ayarlanabilir IR lazerli ters çevrilmiş bir konfokal mikroskoptan oluşur. SHG fenomeninin tutarlı doğası nedeniyle, numuneden frekans olarak ikiye katlanan ışığın toplanmasını en üst düzeye çıkarmak için iletim yolunu seçmek çok önemlidir ve bu nedenle algılama, entegrasyon yoluyla 0.55 NA kondenserinden gerçekleştirilmiştir. Numuneyi alttan aydınlatmak ve kondenser NA'ya yaklaştırmak için bir LCI Plan-Neofluar 25X/0.8 NA daldırma hedefi kullanıldı. Bu makalede açıklanan koşullarla, TUBB4A mutasyonunu taşıyan dokudan gelen bir sinyali güvenilir bir şekilde tespit edebildik ve bu sinyal kontrollerde her zaman yoktu.
Bildirilen protokolde, en iyi görüntüleme koşullarını elde etmek için iki adım ayarlamalar gerektiriyordu: doku bölümünün kalınlığı ve kondenser diyaframının açılması. Kesitler, SH fotonlarının aşırı emilimini, saçılmasını ve kaybını önlemek için mümkün olduğunca ince olmalıdır, çünkü özellikle amaç, fiziksel fenomenin tutarlı doğası nedeniyle iletimde görüntü elde etmektir. Bizim olgumuzda, sınırlayıcı faktör, 160-180 μm'nin altındaki homojen kalın kesitlerde kesitlemeyi engelleyen taiep dokusunun tutarlılığıydı. Geleneksel Köhler hizalamasıyla, kondenser diyaframı, iletilen ışık görüntüsünde kontrast oluşturmak için genellikle alanının yaklaşık% 60'ına kapatılır; tersine, bu uygulama için amaç, mümkün olduğunca çok sayıda foton toplamak, dolayısıyla diyaframın toplam açılmasını sağlamaktır.
SHG mikroskobunun bu uygulaması, tübülin bakımından zengin dokuya karşı tübülin-normal dokuyu ayırt etme imkanı sağladığı için önemlidir, tübülin bakımından zengin doku tespit edilebilir bir sinyal yayar. Henüz tanımlanmamış diğer tübülinopati mutasyonlarının, diğer dokularda sitoiskelet bozukluklarına neden olması da mümkündür26, bu da tübülin zenginleştirmesini içerebilir.
Diğer olası uygulamalar açısından, SHG mikroskopisi, tübülin-normal dokuda, ince, ayrışmış aksonlar veya karışık polariteye sahip hücre içi demetlerde bulunanlar gibi daha zayıf sinyallerin incelenmesine genişletilebilir. Bunu yapmak için, hava kondenserinin daha yüksek sayısal açıklığa sahip ve / veya daldırma ile değiştirilmesi veya daha hassas bir dedektörün kullanılması gibi kurulum değişiklikleri önemli bir fark yaratabilir.
Açıklamalar
Yazarların rekabet eden finansal çıkarları yoktur.
Teşekkürler
Bu çalışma Consejo Nacional de Ciencia y Tecnología (CONACYT) tarafından aşağıdaki hibelerle desteklenmiştir: VP-CIO'ya infraestructura 226450, V.P.'ye infraestructura 255277 ve FORDECYT-PRONACES/194171/2020 V.H.'ye. CIO'daki Juvenal Hernández Guevara'nın video yapımındaki desteğini kabul ediyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 405/10 nm BrightLine(R) single-band bandpass filter | Semrock | FF01-405/10-25 | 32 mm diameter, with housing ring |
| Black Nylon, Polyurethane-Coated Fabric | Thorlabs | BK5 | 5' x 9' (1.5 m x 2.7 m) x 0.005" (0.12 mm) Thick |
| Blades for vibratome | any commercial; e.g. Wilkinson Sword | Classic stainless steel double edge razor blades | |
| Cell culture dishes, 35 mm | any commercial; e.g. Falcon | 351008 | |
| Confocal microscope | Zeiss | LSM710NLO AxioObserver Z1 | Inverted microscope, objective used is LCI Plan-Neofluar 25x/0.8 NA |
| Cooler | any commercial | Any insulated, polystyrene box could work, to mantain the sample at about 37 °C | |
| Corn stach | e.g. Maizena | From the supermarket | |
| Coverslips #1.5 | any commercial | Rectangular | |
| Cyanoacrylate glue | e.g. Loctite | To glue the brain to the masking tape | |
| Fine forceps | fine science tools | 11412-11 | To manipulate tissue sections by handling from the meninges |
| Fine scissors | fine science tools | 14370-22 | To cut the skin |
| Fine scissors curved tip | fine science tools | 14061-09 | To cut along the midline |
| Formaldehyde 37% | Sigma-Aldrich | 252549 | To dilute 1:10 in PBS |
| Friedman Rongeur | fine science tools | 16000-14 | To cut the bone |
| Gel packs | any commercial | Prewarmed to 37 °C, to help mantaining the temperature inside the cooler | |
| Glass Pasteur pipette, modified | any commercial | To transfer the tissue section | |
| Hanks′ Balanced Salt solution (HBSS) | Gibco | 14025-076 | Could be prepared from powders |
| Kelly hemostats | fine science tools | 13018-14 | To separate the bone |
| Masking tape | any commercial | To protect th surface of the specimen plate | |
| NDD module, type C | Zeiss | 000000-1410-101 | To detect the signal, reducing light loss. Housing the 000000-1935-163 filter set with the SP485 |
| Offset bone nippers | fine science tools | 16101-10 | To cut the bone |
| Phosphate buffered saline (PBS) | Gibco | 10010-031 | Could be prepared from powders or tabs |
| Pulsed laser | Coherent | Chameleon Vision II | 680–1080 nm tunable laser |
| Scalpel | any commercial | Straight blade with sharp point | |
| Standard pattern forceps | fine science tools | 11000-18 | |
| Vannas spring scissors | fine science tools | 15018-10 | To cut meninges that remain joined to both the slice obtained from vibratome cutting and the section glued to the specimen plate. |
| Vibratome | any commercial; e.g. Leica | VT1200 |
Referanslar
- Palmiter, R. D., et al. Cell lineage ablation in transgenic mice by cell-specific expression of a toxin gene. Cell. 50 (3), 435-443 (1987).
- Banerjee, A., et al. A monoclonal antibody against the type II isotype of beta-tubulin. Preparation of isotypically altered tubulin. The Journal of Biological Chemistry. 263 (6), 3029-3034 (1988).
- Banerjee, A., Roach, M. C., Trcka, P., Luduena, R. F. Preparation of a monoclonal antibody specific for the class IV isotype of beta-tubulin. Purification and assembly of alpha beta II, alpha beta III, and alpha beta IV tubulin dimers from bovine brain. The Journal of Biological Chemistry. 267 (8), 5625-5630 (1992).
- Banerjee, A., et al. Localization of βv tubulin in the cochlea and cultured cells with a novel monoclonal antibody. Cell Motility and the Cytoskeleton. 65 (6), 505-514 (2008).
- Cross, A. R., Williams, R. C. Kinky microtubules: Bending and breaking induced by fixation in vitro with glutaraldehyde and formaldehyde. Cell Motility and the Cytoskeleton. 20 (4), 272-278 (1991).
- Van Steenbergen, V., et al. Molecular understanding of label-free second harmonic imaging of microtubules. Nature Communications. 10 (1), 3530(2019).
- Campagnola, P. J., Clark, H. A., Mohler, W. A., Lewis, A., Loew, L. M. Second-harmonic imaging microscopy of living cells. Journal of Biomedical Optics. 6 (3), 277(2001).
- Campagnola, P. J., et al. Three-dimensional high-resolution second-harmonic generation imaging of endogenous structural proteins in biological tissues. Biophysical Journal. 82 (1), 493-508 (2002).
- Yu, C. -H., et al. Measuring microtubule polarity in spindles with second-harmonic generation. Biophysical Journal. 106 (8), 1578-1587 (2014).
- Bancelin, S., et al. Probing microtubules polarity in mitotic spindles in situ using Interferometric Second Harmonic Generation Microscopy. Scientific Reports. 7, 6758(2017).
- Dombeck, D. A., et al. Uniform polarity microtubule assemblies imaged in native brain tissue by second-harmonic generation microscopy. Proceedings of the National Academy of Sciences of the United States of America. 100 (12), 7081-7086 (2003).
- Psilodimitrakopoulos, S., et al. Estimation of the effective orientation of the SHG source in primary cortical neurons. Optics Express. 17 (16), 14418(2009).
- Sharoukhov, D., Bucinca-Cupallari, F., Lim, H. Microtubule imaging reveals cytoskeletal deficit predisposing the retinal ganglion cell axons to atrophy in DBA/2J. Investigative Opthalmology & Visual Science. 59 (13), 5292(2018).
- Alata, M., Piazza, V., Eguibar, J. R., Cortes, C., Hernandez, V. H. H-ABC tubulinopathy revealed by label-free second harmonic generation microscopy. Scientific Reports. 12, 14417(2022).
- Duncan, I. D., Lunn, K. F., Holmgren, B., Urba-Holmgren, R., Brignolo-Holmes, L. The taiep rat: A myelin mutant with an associated oligodendrocyte microtubular defect. Journal of Neurocytology. 21 (12), 870-884 (1992).
- Duncan, I. D., et al. A mutation in the Tubb4a gene leads to microtubule accumulation with hypomyelination and demyelination: Tubb4a Mutation. Annals of Neurology. 81 (5), 690-702 (2017).
- Garduno-Robles, A., et al. MRI features in a rat model of H-ABC tubulinopathy. Frontiers in Neuroscience. 14, 555(2020).
- Lopez-Juarez, A., et al. Auditory impairment in H-ABC tubulinopathy. Journal of Comparative Neurology. 529 (5), 957-968 (2021).
- Alata, M., et al. Longitudinal evaluation of cerebellar signs of H-ABC tubulinopathy in a patient and in the taiep model. Frontiers in Neurology. 12, 702039(2021).
- Parodi, V., et al. Nonlinear optical microscopy: From fundamentals to applications in live bioimaging. Frontiers in Bioengineering and Biotechnology. 8, 585363(2020).
- Lefort, C. A review of biomedical multiphoton microscopy and its laser sources. Journal of Physics D: Applied Physics. 50 (42), 423001(2017).
- Campagnola, P. J., Loew, L. M. Second-harmonic imaging microscopy for visualizing biomolecular arrays in cells, tissues and organisms. Nature Biotechnology. 21 (11), 1356-1360 (2003).
- vander Knaap, M. S., et al. New syndrome characterized by hypomyelination with atrophy of the basal ganglia and cerebellum. American Journal of Neuroradiology. 23 (9), 1466(2002).
- Stoller, P., Kim, B. -M., Rubenchik, A. M., Reiser, K. M., Da Silva, L. B. Polarization-dependent optical second-harmonic imaging of a rat-tail tendon. Journal of Biomedical Optics. 7 (2), 205(2002).
- Brown, E. B., et al. In vivo measurement of gene expression, angiogenesis and physiological function in tumors using multiphoton laser scanning microscopy. Nature Medicine. 7 (7), 864-868 (2001).
- Chakraborti, S., Natarajan, K., Curiel, J., Janke, C., Liu, J. The emerging role of the tubulin code: From the tubulin molecule to neuronal function and disease. Cytoskeleton. 73 (10), 521-550 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır