Method Article
Ottica non lineare label-free per lo studio dei difetti tubulina-dipendenti nella mielina centrale
In questo articolo
Riepilogo
In questo articolo, presentiamo un protocollo per rilevare oligodendrociti caricati con microtubuli in un modello di tubulopatia attraverso un approccio di microscopia di seconda generazione armonica semplice e innovativo.
Abstract
La visualizzazione soddisfacente dei componenti citoscheletrici nel cervello è impegnativa. La distribuzione ubiquitaria delle reti di microtubuli, microfilamenti e filamenti intermedi in tutti i tessuti neurali, insieme alla variabilità negli esiti delle strategie di fusione delle proteine fluorescenti e alla loro limitata applicabilità agli studi dinamici di anticorpi e farmaci come veicoli cromofori, rendono gli approcci ottici classici non efficaci come per altre proteine. Quando la tubulina deve essere studiata, la generazione label-free di seconde armoniche è un'opzione molto adatta a causa dell'organizzazione non centrosimmetrica della molecola. Questa tecnica, quando coniugata alla microscopia, può descrivere qualitativamente la distribuzione volumetrica di fasci paralleli di microtubuli in campioni biologici, con l'ulteriore vantaggio di lavorare con tessuti freschi non fissati e non permeabilizzati. Questo lavoro descrive come visualizzare la tubulina con una configurazione commerciale di microscopia di seconda generazione armonica per evidenziare i microtubuli nelle strutture arricchite di tubulina degli oligodendrociti, come nell'ipomielinizzazione con atrofia dei gangli della base e della tubulopatia del cervelletto (H-ABC), un disturbo mielinico recentemente descritto.
Introduzione
L'imaging ottico delle strutture citoscheletriche nei tessuti e nei preparati di organi non è un compito facile. I filamenti citoscheletrici sono onnipresenti, quindi se viene eseguita una colorazione generica, ad esempio, contro alfa-tubulina o beta-actina o potenzialmente cheratina in un campione epiteliale, il segnale sarà probabilmente distribuito in modo piuttosto omogeneo su tutto il campione. Per limitare la colorazione a un sottoinsieme più significativo di componenti cellulari, è possibile utilizzare topi transgenici con espressione mirata1 o pianificare l'uso di anticorpi isoforma-specifici. Mentre pochissimi di questi ultimi sono sul mercato (e pochissimi esistono affatto 2,3,4), potrebbe essere disponibile un modello animale transgenico. Tuttavia, deve essere acquisito dal laboratorio e adeguatamente alloggiato, con tutte le spese coinvolte nel processo. Alcuni anticorpi o sostanze chimiche, ad esempio i farmaci coniugati con fluorofori come la falloidina o il paclitaxel, possono essere parzialmente o totalmente incompatibili con l'uso in cellule o tessuti viventi, limitando così la loro applicabilità ai soli studi su campioni fissi.
Nel caso della tubulina, un ulteriore aspetto deve essere preso in considerazione, ovvero la sensibilità del polimero alla fissazione. La fissazione chimica convenzionale con la formaldeide è nota per non essere adeguata a preservare in modo ottimale l'integrità dei microtubuli5. Inoltre, un recente rapporto conferma che la reticolazione della formaldeide induce sottili cambiamenti nell'ultrastruttura del microtubulo, simile a quanto accade con il legame di alcuni farmaci o molecole fisiologiche come GTP6.
La visualizzazione diretta di microtubuli in campioni non colorati e non fissati è, quindi, spesso auspicabile. Per raggiungere questo obiettivo, una soluzione tecnica è la microscopia di seconda generazione armonica (SHG)7, che si basa sulla capacità di fasci di microtubuli paralleli di agire come monofori e di emettere luce raddoppiata in frequenza quando adeguatamente illuminati con un intenso laser a infrarossi pulsato. Sebbene un secondo segnale armonico più forte e più stabile possa essere generato dal collagene e dalla miosina, che sono gli unici altri due materiali biologici noti per essere in grado di raddoppiare la frequenza, il segnale della tubulina è stato finora utilizzato principalmente per studiare i riarrangiamenti del fuso mitotico 8,9,10 e la morfologia dei microtubuli assonali11,12,13.
In questo lavoro, introduciamo un nuovo uso della microscopia SHG come strumento diagnostico per distinguere i tessuti del sistema nervoso centrale (SNC) affetti da tubulopatia beta 4 A (TUBB4A) dalle loro controparti sane14. Alcune delle mutazioni che si verificano in questa isoforma prevalentemente neurale della tubulina, come quelle che causano l'ipomielinizzazione e l'atrofia dei gangli della base e del cervelletto (H-ABC), inducono un riempimento eccessivo di microtubuli negli oligodendrociti15,16; Le alterazioni citoscheletriche, a loro volta, sono associate ad effetti a valle come la dismielinizzazione, con profonda compromissione delle vie motorie e sensoriali16,17,18,19. Il modello murino taiep utilizzato in questo lavoro mostra un contenuto anormale di microtubuli negli oligodendrociti e ricapitola la maggior parte dei sintomi senso-motori dei pazienti con H-ABC17. Il protocollo spiega come visualizzare strutture come il corpo calloso e il cervelletto, che di solito sono altamente mielinizzati e che sono gravemente colpiti nei pazienti umani e nel ratto taiep 19, per evidenziare le differenze nei segnali SH tra tessuti sani e mutanti.
Protocollo
Tutte le procedure descritte sono state eseguite in conformità con le leggi e i codici approvati nel settimo titolo del Regolamento della Legge Sanitaria Generale sulla Ricerca Sanitaria del Governo Messicano (NOM-062-ZOO-1999) e in conformità con le raccomandazioni del National Institutes of Health Guide for the Care and Use of Experimental Animals e sono state approvate dal comitato istituzionale di bioetica nella ricerca dell'Universidad de Guanajuato e della Benemérita Universidad Autónoma de Puebla.
1. Impostazioni del microscopio
- Accendere il sistema di microscopia.
- Accendere il laser pulsato per garantire che sia pronto per il lase a un livello di potenza ottimale e costante dopo l'estrazione e la preparazione del campione.
- Sintonizzare il laser su 810 nm. Per studiare i microtubuli tissular, viene utilizzato il 10% -20% della potenza laser disponibile, che, nel sistema descritto, corrisponde a 13-26 mW misurati sul piano focale posteriore dell'obiettivo.
- Assicurarsi che il microscopio sia allineato a Köhler (file supplementare 1), con l'obiettivo che verrà utilizzato per l'imaging SHG.
NOTA: Questo è importante poiché, nella configurazione commerciale utilizzata in questo lavoro, il rilevamento viene eseguito in modalità di trasmissione e attraverso il condensatore. - Rimuovere i filtri indesiderati dal percorso di rilevamento ottico (Figura 1A).
- Assicurarsi che il diaframma del condensatore sia completamente aperto per garantire che nessuna luce venga interrotta inutilmente a questo livello.
- Preparare un obiettivo ad immersione in olio con apertura numerica (NA) 25x/0,8 con una piccola goccia di olio ad immersione nell'obiettivo.
NOTA: Questo obiettivo è stato utilizzato per abbinare al meglio il condensatore NA, che era 0,55 (idealmente, NAcond≥ NAobj).
2. Controlli preliminari al microscopio
NOTA: eseguire i controlli preliminari del microscopio una volta, a meno che l'impostazione non venga modificata.
- Immagine di amido di mais secco inserito tra vetrini con parametri SHG per generare immagini SHG che rivelano la direzione della polarizzazione laser. Seguire i passaggi riportati nel file supplementare 2, ad eccezione della potenza laser, che è inferiore al 5% per l'amido di mais.
- Prendi un'immagine di grani di amido di mais sparsi e segna l'orientamento dei lobuli SHG nel piano x-y. Questo orientamento corrisponde all'orientamento del laser (Figura 2A).
- Come controllo, prendere un'altra immagine dello stesso campione, inserendo nel percorso ottico una piastra a mezza onda (posizione mostrata in Figura 1A) per alterare la direzione di oscillazione del laser. L'immagine risultante mostra lobuli di segnale SHG ruotati (Figura 2B, C).
- Se si utilizza un diverso tipo di filtro passa banda per l'SHG, assicurarsi che abbia proprietà di trasmissione ottimali confrontando le immagini (Figura 2D, E) e le intensità del segnale pixel per pixel lungo una scansione lineare (Figura 2F).
3. Estrazione dei tessuti
NOTA: Utilizzare sempre strumenti puliti per eseguire le procedure chirurgiche.
- Utilizzare ratti taiep di 6-12 mesi e controlli Sprague-Dawley (WT) di età corrispondente.
- Anestetizzare gli animali con un'iniezione endovenosa di una miscela di ketamina-xilazina (0,125 mg/Kg e 5 mg/Kg) diluita in una soluzione sterile di NaCl allo 0,9%.
- Controlla i riflessi del dolore e procedi solo se sono assenti.
- Sacrifica l'animale tramite decapitazione.
- Una volta isolata la testa, aprire attentamente le ossa della volta cranica lungo la linea mediana, partendo dal punto più caudale in alto verso il naso, dalle cavità orbitali verso la linea mediana, e poi dal punto più caudale fino a sotto il cervello e il cervelletto.
NOTA: I tagliatori ossei e i Rongeurs consentono una corretta rimozione delle ossa della testa senza danneggiare le strutture cerebrali. - Rilascia il cervello e il cervelletto dall'osso. I due emisferi potrebbero essere separati. Se gli emisferi sono divisi, utilizzare una metà per l'imaging SHG e fissare l'altra metà in paraformaldeide al 3,7% in soluzione salina tamponata con fosfato (PBS) per 20 minuti all'interno di una cappa chimica per il successivo sezionamento e colorazione.
4. Sezionamento della vibratoma
- Preparare un vassoio tampone vibratome riempito con la soluzione salina bilanciata (HBSS) calda (37 °C) di Hank.
- Fissare il cervello alla piastra del campione usando colla cianoacrilica tramite un pezzo di nastro adesivo. La porzione / regione più caudale entra in contatto con la colla in modo che le sezioni coronali utilizzabili dalla porzione opposta, rostrale, possano essere tagliate.
- Lasciare ~10 s per polimerizzare la colla per ottenere un attacco efficace del campione.
NOTA: I migliori risultati si ottengono quando il cervello è orientato in modo che la lama tagli "dall'alto verso il basso" piuttosto che "da un lato all'altro" (Figura 1B).
- Lasciare ~10 s per polimerizzare la colla per ottenere un attacco efficace del campione.
- Trasferire la piastra del campione sul suo supporto magnetico all'interno del vassoio tampone.
- Inizia a tagliare sezioni da 300-500 μm fino a quando le fette prodotte comprendono l'intera superficie del cervello.
- A questo punto, ridurre lo spessore della sezione a 160 μm.
- Una volta tagliata una sezione completa di 160 μm a livello del corpo calloso, recuperarla con una pipetta Pasteur in vetro modificato con un grande orifizio fiammato (Figura 1C).
- Trasferirlo in una capsula di Petri pulita con un nuovo HBSS caldo o direttamente sul supporto di vetro per microscopia (coprivetrino o piatto con fondo di vetro).
NOTA: Per le condizioni sperimentali descritte, l'aggiunta di un coprivetrino sopra il campione è dannosa per l'imaging.
5. Trasferimento al microscopio
- Se il microscopio si trova in una stanza diversa, preparare una scatola isolata con confezioni di gel riscaldate per trasferire le sezioni di tessuto mantenendo la temperatura. La scatola serve anche a mantenere le sezioni calde fino a quando non vengono visualizzate.
- Mettere il campione al microscopio e assicurarsi che sia posizionato correttamente sotto l'obiettivo mediante osservazione diretta attraverso gli oculari con luce trasmessa.
NOTA: L'obiettivo è quello di allineare le strutture di emissione previste con la direzione di oscillazione del laser per massimizzare il segnale SHG emesso (e, quindi, rilevato). - Rimuovere l'HBSS in eccesso in modo che un sottile film liquido copra l'intero campione. Controllare visivamente il film liquido ogni pochi minuti per evitare un'eccessiva evaporazione e asciugatura del campione.
NOTA: Nelle condizioni descritte, una sezione viene utilizzata per non più di 20 minuti. L'essiccazione del campione provoca drastici effetti artefici (figura supplementare 1A). Piuttosto che aggiungere più HBSS, si consiglia di immergere periodicamente la sezione in un mezzo caldo e fresco se sono necessari tempi di imaging più lunghi. L'uso di camere di perfusione e colla o agarosio a basso punto di fusione per immobilizzare il tessuto è raccomandato anche quando devono essere fatti esperimenti più lunghi. - Preparare la fase del microscopio per l'imaging non scansionato, che potrebbe includere la chiusura di tutte le porte della camera di incubazione buia o la copertura della camera di incubazione con un tessuto rivestito in poliuretano di nylon nero.
6. Imaging
- Selezionare la modalità di imaging "non scansionata" lungo il percorso di trasmissione. In questo modo, la cattura del debole segnale SH della tubulina sarà ottimizzata.
- Selezionare l'obiettivo LCI Plan-Neofluar 25x/0.8 NA.
- Imposta una potenza laser compresa tra 13 mW e 26 mW, con un tempo di permanenza dei pixel di 12,6 μs. Scatta immagini non più grandi di 512 pixel x 512 pixel, con velocità 5 e media di 2, per un tempo medio di acquisizione di circa 15 s.
NOTA: L'utilizzo di potenze laser più elevate e/o tempi di permanenza più lunghi può danneggiare il campione (Figura supplementare 1B). - Scatta prima le immagini utilizzando un filtro passa-corto da 485 nm (SP485) e, in una seconda fase, aggiungi un filtro passa banda nitido da 405 nm (BP405; Figura 3). Seguire i passaggi riportati nel file supplementare 2.
NOTA: Le immagini pseudo-in campo chiaro possono essere prese attraverso lo stesso rivelatore utilizzando la luce laser residua di una linea visibile (i laser a 405 nm o 488 nm funzionano meglio).
7. Lavorazione del cervelletto
- Per prima cosa, tagliare il cervelletto con un bisturi in due emisferi, quindi incollarli al supporto del vibratomo dalla parte centrale (la parte piatta ottenuta dopo il taglio).
- Sezione e immagine del cervelletto nello stesso modo descritto per il cervello (sezioni da 160 μm, stesse impostazioni di vibratomo, stessa lama, stesse impostazioni del microscopio, ecc.).
NOTA: A causa dell'anatomia del cervelletto, il suo orientamento al momento del sezionamento non è critico; Nella maggior parte delle fette generate lontano dalla superficie, ci saranno folia sezionati bene nella sostanza bianca.
Risultati
Le immagini ottenute con questa metodologia hanno un livello di fondo intrinsecamente basso a causa del numero molto limitato di armonofori presenti nei tessuti biologici, che è uno dei vantaggi significativi del metodo.
Quando vengono visualizzate le fibre del corpo calloso, strutture corte simili a fibre ed elementi arrotondati possono essere trovati costantemente nel cervello taiep (Figura 3B), mentre il corpo calloso del cervello di controllo mostra un segnale molto più eterogeneo e isotropo in tutta la regione del cervello (Figura 3A). L'origine del segnale differenziale risiede specificamente nel secondo fenomeno di generazione armonica, poiché l'aggiunta del filtro passa-banda stretto diminuisce solo l'intensità del segnale non specifico dalle immagini di controllo (Figura 3C-D) mentre rimuove selettivamente questo segnale basso e diffuso intorno alle strutture simili a soma e corte e allungate nelle immagini taiep, che generano sempre un'intensa luce SH (Figura 3E-F).
L'altra struttura analizzata, la sostanza bianca cerebellare, dà risultati comparabili. In particolare, mentre nel tessuto di controllo c'è una quasi completa assenza di segnale SH (Figura 4B), e le cellule di Purkinje sono appena visibili quando si utilizza il filtro short-pass, le strutture allungate e arrotondate persistono nell'immagine SH dal tessuto taiep (Figura 4D).
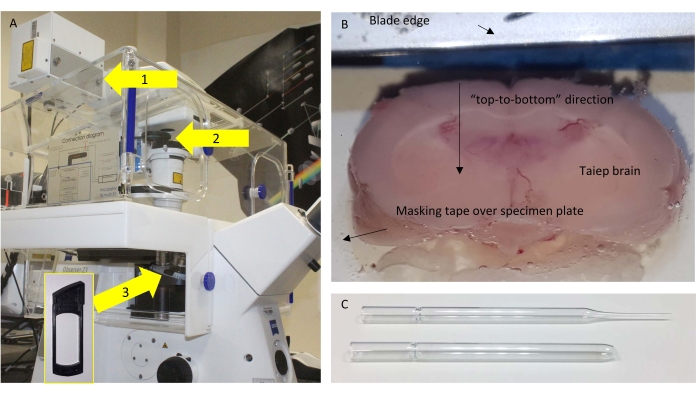
Figura 1: Microscopio e sezionamento . (A) Schema del microscopio utilizzato, con i relativi componenti evidenziati. Frecce: 1 = porta NDD in cui si trova l'SP485 vicino al rilevatore; 2 = telai rimovibili in cui è posizionato il BP405; 3 = posizione sotto l'obiettivo in cui è posizionata la piastra a mezza onda (HWP) per gli esperimenti di controllo. L'inserto mostra il frame in cui è possibile inserire l'HWP. (B) Vista dall'alto del vassoio tampone vibratome con il cervello incollato pronto per essere sezionato finemente. (C) La pipetta Pasteur originale (in alto) e modificata (in basso) utilizzata per trasferire le sezioni. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 2: Controlli preliminari. (A) Il segnale SHG emesso dai chicchi di amido di mais mostra un orientamento predominante che coincide con la direzione di oscillazione del laser (orizzontale in questo caso). (B) Dopo aver inserito una piastra a mezza onda con il suo asse veloce orientato a 45° rispetto all'orizzontale, il segnale viene ruotato di 90°. (C) Fusione del segnale prima e dopo l'inserimento della piastra a mezza onda. (D) Il segnale inferiore a 485 nm emesso dai chicchi di amido di mais. E) Il segnale SHG dei grani di amido rilevati a 405/10 nm. (F) Grafico che mostra un confronto tra i due segnali corrispondenti alle scansioni di linea mostrate negli inserti ingranditi di D ed E. Il filtro SHG utilizzato causa una perdita di segnale trascurabile. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 3: Immagini SHG da taiep e WT corpus callosum. Esempi rappresentativi di (A) WT e (B) segnali taiep ottenuti dal corpo calloso. (C) SP485 immagine filtrata da un corpo calloso WT. (D) Immagine filtrata BP405 dallo stesso campione di C. (E) SP485 immagine filtrata da un corpo calloso taiep . (F) Immagine filtrata BP405 dello stesso campione di E. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Immagini SHG da cervelletti taiep e WT. Esempi rappresentativi di segnali taiep (A-B) WT e (C-D) ottenuti da folia cerebellare. (A) Un'immagine filtrata SP485 da un folium WT; solo alcune cellule di Purkinje sono visibili. (B) Un'immagine filtrata BP405 dallo stesso campione di A. (C) Un'immagine filtrata SP485 da un folium taiep. (D) Un'immagine filtrata BP405 dello stesso campione di C. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Figura supplementare 1: Esempi di artefatti. (A) Artefatto dovuto all'essiccazione del campione. (B) Artefatto dovuto a un'esposizione eccessiva. Barre di scala: 30 μm. Clicca qui per scaricare questo file.
Fascicolo supplementare 1: Allineamento di Köhler. Il file presenta i passaggi per eseguire l'allineamento Köhler. Clicca qui per scaricare questo file.
File supplementare 2: Passaggi del software ZEN per l'acquisizione di immagini SHG. Clicca qui per scaricare questo file.
Discussione
La microscopia SHG fa parte di un gruppo di tecniche di ottica non lineare, che includono la microscopia a eccitazione a due fotoni, la microscopia a generazione di terza armonica e la microscopia a diffusione Raman anti-Stokes coerente, che hanno contribuito ad ampliare la gamma di applicazioni della microscopia ottica convenzionale alle scienze della vita20.
In particolare, la maggiore forza e debolezza della microscopia SHG si riferiscono alla stessa condizione: il generatore di segnale non è centrosimmetrico21. Una condizione architettonica così specifica si trova spesso nel regno dei cristalli inorganici e organici, ma è rara tra gli oggetti biologici. Insieme al collagene e alla miosina muscolare, i microtubuli sono in grado di generare un secondo segnale armonico22, che può essere rilevato con un microscopio se si verifica una somma sufficiente nei fasci di polimeri paralleli. All'interno delle cellule, la tubulina si associa a formare fasci paralleli nei nuclei degli assoni (una posizione specifica del tipo di cellula), nei fusi mitotici (una distribuzione temporal-specifica) e, come presentato in questo lavoro, nell'associazione microtubulosa di una tubulopatia-ipomielinizzazione recentemente descritta con atrofia dei gangli della base e del cervelletto, o H-ABC (che rappresenta la prima distribuzione patologica riportata di questo tipo)14, 16,23.
Questa sindrome senso-motoria è ancora una malattia orfana, poiché molti neurologi non hanno ancora familiarità con tutti i sintomi e / o non possono permettersi lo screening genetico dei pazienti sospetti per confermare la diagnosi, che molto probabilmente causa sottodiagnosi, almeno in alcune popolazioni. Inoltre, non si sa molto sulla patologia a livello molecolare e cellulare, quindi le tecniche che potrebbero aiutare a far luce sui meccanismi specifici di questo processo degenerativo sono molto preziose, anche a livello di base.
Pertanto, vengono proposti due usi della microscopia SHG riguardanti questo disturbo della mielina. A lungo termine, la microscopia SHG potrebbe essere integrata negli approcci diagnostici per lo screening bioptico o l'analisi intracranica diretta, ma l'impatto maggiore potrebbe essere associato al tentativo di decifrare le basi molecolari della malattia.
Ci sono molti vantaggi della microscopia SHG rispetto ad altre tecniche di microscopia. Infatti, la microscopia SHG non richiede la fissazione del tessuto, che è una fase particolarmente delicata della preparazione del campione nel caso dei microtubuli, e non richiede colorazioni di alcun tipo. Il vantaggio maggiore è legato al fenomeno fisico coinvolto. Da un lato, a causa dello sfondo praticamente assente, fornisce un contrasto elevato nonostante i deboli segnali generati, e dall'altro, poiché le intensità luminose necessarie per il raddoppio della frequenza sono molto elevate e queste intensità sono soddisfatte solo in un volume molto ristretto del campione, la tecnica fornisce un sezionamento ottico intrinseco, consentendo così ricostruzioni 3D.
I principali limiti di questa tecnica di microscopia sono legati al costo dell'apparecchiatura. Un buon microscopio confocale, insieme a un laser a infrarossi pulsati (IR), è necessario per questa applicazione, e sebbene un sistema di eccitazione a due fotoni sia disponibile in molti laboratori di neuroscienze, che può essere facilmente modificato in una configurazione SHG, la differenza di costo rispetto a una configurazione di epifluorescenza convenzionale è ancora significativa. Inoltre, come tecnica limitata alla diffrazione, la sua risoluzione è influenzata dall'uso della luce IR per l'illuminazione.
Come per molte applicazioni pionieristiche, i setup utilizzati per i primi esperimenti sulla microscopia SHG applicata alle scienze della vita erano setup ottici totalmente personalizzati costruiti come sistemi aperti 11,24,25, dando agli sperimentatori la possibilità di ottimizzare ogni singolo componente. Poiché, nei laboratori di scienze della vita, è più comune avere accesso a una configurazione commerciale, abbiamo voluto verificare se uno di questi sistemi è abbastanza sensibile da rilevare il debole segnale emesso dai fasci di microtubuli tissular, che sono noti per non essere forti come il collagene. Il sistema NLO LSM710 di Zeiss è costituito da un microscopio confocale invertito con moduli per il rilevamento non descanizzato in modalità trasmissione ed "epi" e con un laser IR sintonizzabile a camaleonte coerente. A causa della natura coerente del fenomeno SHG, è fondamentale selezionare il percorso di trasmissione per massimizzare la raccolta di luce raddoppiata in frequenza dal campione e, pertanto, il rilevamento è stato eseguito attraverso il condensatore da 0,55 NA per integrazione. Un obiettivo di immersione LCI Plan-Neofluar 25X/0.8 NA è stato utilizzato per illuminare il campione dal basso e approssimare il condensatore NA. Con le condizioni descritte in questo articolo, abbiamo potuto rilevare in modo affidabile un segnale dal tessuto portatore della mutazione TUBB4A, e questo segnale era sempre assente nei controlli.
Nel protocollo riportato, due passaggi hanno richiesto aggiustamenti per ottenere le migliori condizioni di imaging: lo spessore della sezione di tessuto e l'apertura del diaframma del condensatore. Le sezioni dovrebbero essere il più sottili possibile per evitare un'eccessiva assorbanza, dispersione e perdita di fotoni SH, soprattutto perché l'obiettivo è quello di visualizzare in trasmissione a causa della natura coerente del fenomeno fisico. Nel nostro caso, il fattore limitante era la consistenza del tessuto taiep , che ostacolava il sezionamento in sezioni omogeneamente spesse al di sotto di 160-180 μm. Con l'allineamento Köhler convenzionale, il diaframma del condensatore viene solitamente chiuso a circa il 60% della sua area per generare contrasto nell'immagine a luce trasmessa; Al contrario, per questa applicazione, lo scopo è quello di raccogliere il maggior numero possibile di fotoni, da qui l'apertura totale del diaframma.
Questa applicazione della microscopia SHG è importante in quanto fornisce la possibilità di discernere il tessuto ricco di tubulina rispetto al tessuto normale della tubulina, con il tessuto ricco di tubulina che emette un segnale rilevabile. È anche possibile che altre mutazioni della tubulopatia ancora da descrivere causino disturbi citoscheletrici in altri tessuti26, che possono anche comportare l'arricchimento della tubulina.
In termini di altre possibili applicazioni, la microscopia SHG potrebbe essere estesa allo studio di segnali più deboli, come quelli presenti nel tessuto tubulino-normale, in assoni fini e dissociati o in fasci intracellulari con polarità mista. Per fare ciò, modifiche di configurazione, come la sostituzione del condensatore d'aria con uno con un'apertura numerica più elevata e/o con immersione o l'uso di un rivelatore più sensibile, potrebbero fare una differenza importante.
Divulgazioni
Gli autori non hanno interessi finanziari concorrenti.
Riconoscimenti
Questo lavoro è stato sostenuto dal Consejo Nacional de Ciencia y Tecnología (CONACYT) attraverso le seguenti sovvenzioni: infraestructura 226450 a VP-CIO, infraestructura 255277 a V.P. e FORDECYT-PRONACES/194171/2020 a V.H. Riconosciamo il supporto di Juvenal Hernández Guevara al CIO nella realizzazione del video.
Materiali
| Name | Company | Catalog Number | Comments |
| 405/10 nm BrightLine(R) single-band bandpass filter | Semrock | FF01-405/10-25 | 32 mm diameter, with housing ring |
| Black Nylon, Polyurethane-Coated Fabric | Thorlabs | BK5 | 5' x 9' (1.5 m x 2.7 m) x 0.005" (0.12 mm) Thick |
| Blades for vibratome | any commercial; e.g. Wilkinson Sword | Classic stainless steel double edge razor blades | |
| Cell culture dishes, 35 mm | any commercial; e.g. Falcon | 351008 | |
| Confocal microscope | Zeiss | LSM710NLO AxioObserver Z1 | Inverted microscope, objective used is LCI Plan-Neofluar 25x/0.8 NA |
| Cooler | any commercial | Any insulated, polystyrene box could work, to mantain the sample at about 37 °C | |
| Corn stach | e.g. Maizena | From the supermarket | |
| Coverslips #1.5 | any commercial | Rectangular | |
| Cyanoacrylate glue | e.g. Loctite | To glue the brain to the masking tape | |
| Fine forceps | fine science tools | 11412-11 | To manipulate tissue sections by handling from the meninges |
| Fine scissors | fine science tools | 14370-22 | To cut the skin |
| Fine scissors curved tip | fine science tools | 14061-09 | To cut along the midline |
| Formaldehyde 37% | Sigma-Aldrich | 252549 | To dilute 1:10 in PBS |
| Friedman Rongeur | fine science tools | 16000-14 | To cut the bone |
| Gel packs | any commercial | Prewarmed to 37 °C, to help mantaining the temperature inside the cooler | |
| Glass Pasteur pipette, modified | any commercial | To transfer the tissue section | |
| Hanks′ Balanced Salt solution (HBSS) | Gibco | 14025-076 | Could be prepared from powders |
| Kelly hemostats | fine science tools | 13018-14 | To separate the bone |
| Masking tape | any commercial | To protect th surface of the specimen plate | |
| NDD module, type C | Zeiss | 000000-1410-101 | To detect the signal, reducing light loss. Housing the 000000-1935-163 filter set with the SP485 |
| Offset bone nippers | fine science tools | 16101-10 | To cut the bone |
| Phosphate buffered saline (PBS) | Gibco | 10010-031 | Could be prepared from powders or tabs |
| Pulsed laser | Coherent | Chameleon Vision II | 680–1080 nm tunable laser |
| Scalpel | any commercial | Straight blade with sharp point | |
| Standard pattern forceps | fine science tools | 11000-18 | |
| Vannas spring scissors | fine science tools | 15018-10 | To cut meninges that remain joined to both the slice obtained from vibratome cutting and the section glued to the specimen plate. |
| Vibratome | any commercial; e.g. Leica | VT1200 |
Riferimenti
- Palmiter, R. D., et al. Cell lineage ablation in transgenic mice by cell-specific expression of a toxin gene. Cell. 50 (3), 435-443 (1987).
- Banerjee, A., et al. A monoclonal antibody against the type II isotype of beta-tubulin. Preparation of isotypically altered tubulin. The Journal of Biological Chemistry. 263 (6), 3029-3034 (1988).
- Banerjee, A., Roach, M. C., Trcka, P., Luduena, R. F. Preparation of a monoclonal antibody specific for the class IV isotype of beta-tubulin. Purification and assembly of alpha beta II, alpha beta III, and alpha beta IV tubulin dimers from bovine brain. The Journal of Biological Chemistry. 267 (8), 5625-5630 (1992).
- Banerjee, A., et al. Localization of βv tubulin in the cochlea and cultured cells with a novel monoclonal antibody. Cell Motility and the Cytoskeleton. 65 (6), 505-514 (2008).
- Cross, A. R., Williams, R. C. Kinky microtubules: Bending and breaking induced by fixation in vitro with glutaraldehyde and formaldehyde. Cell Motility and the Cytoskeleton. 20 (4), 272-278 (1991).
- Van Steenbergen, V., et al. Molecular understanding of label-free second harmonic imaging of microtubules. Nature Communications. 10 (1), 3530 (2019).
- Campagnola, P. J., Clark, H. A., Mohler, W. A., Lewis, A., Loew, L. M. Second-harmonic imaging microscopy of living cells. Journal of Biomedical Optics. 6 (3), 277 (2001).
- Campagnola, P. J., et al. Three-dimensional high-resolution second-harmonic generation imaging of endogenous structural proteins in biological tissues. Biophysical Journal. 82 (1), 493-508 (2002).
- Yu, C. -. H., et al. Measuring microtubule polarity in spindles with second-harmonic generation. Biophysical Journal. 106 (8), 1578-1587 (2014).
- Bancelin, S., et al. Probing microtubules polarity in mitotic spindles in situ using Interferometric Second Harmonic Generation Microscopy. Scientific Reports. 7, 6758 (2017).
- Dombeck, D. A., et al. Uniform polarity microtubule assemblies imaged in native brain tissue by second-harmonic generation microscopy. Proceedings of the National Academy of Sciences of the United States of America. 100 (12), 7081-7086 (2003).
- Psilodimitrakopoulos, S., et al. Estimation of the effective orientation of the SHG source in primary cortical neurons. Optics Express. 17 (16), 14418 (2009).
- Sharoukhov, D., Bucinca-Cupallari, F., Lim, H. Microtubule imaging reveals cytoskeletal deficit predisposing the retinal ganglion cell axons to atrophy in DBA/2J. Investigative Opthalmology & Visual Science. 59 (13), 5292 (2018).
- Alata, M., Piazza, V., Eguibar, J. R., Cortes, C., Hernandez, V. H. H-ABC tubulinopathy revealed by label-free second harmonic generation microscopy. Scientific Reports. 12, 14417 (2022).
- Duncan, I. D., Lunn, K. F., Holmgren, B., Urba-Holmgren, R., Brignolo-Holmes, L. The taiep rat: A myelin mutant with an associated oligodendrocyte microtubular defect. Journal of Neurocytology. 21 (12), 870-884 (1992).
- Duncan, I. D., et al. A mutation in the Tubb4a gene leads to microtubule accumulation with hypomyelination and demyelination: Tubb4a Mutation. Annals of Neurology. 81 (5), 690-702 (2017).
- Garduno-Robles, A., et al. MRI features in a rat model of H-ABC tubulinopathy. Frontiers in Neuroscience. 14, 555 (2020).
- Lopez-Juarez, A., et al. Auditory impairment in H-ABC tubulinopathy. Journal of Comparative Neurology. 529 (5), 957-968 (2021).
- Alata, M., et al. Longitudinal evaluation of cerebellar signs of H-ABC tubulinopathy in a patient and in the taiep model. Frontiers in Neurology. 12, 702039 (2021).
- Parodi, V., et al. Nonlinear optical microscopy: From fundamentals to applications in live bioimaging. Frontiers in Bioengineering and Biotechnology. 8, 585363 (2020).
- Lefort, C. A review of biomedical multiphoton microscopy and its laser sources. Journal of Physics D: Applied Physics. 50 (42), 423001 (2017).
- Campagnola, P. J., Loew, L. M. Second-harmonic imaging microscopy for visualizing biomolecular arrays in cells, tissues and organisms. Nature Biotechnology. 21 (11), 1356-1360 (2003).
- vander Knaap, M. S., et al. New syndrome characterized by hypomyelination with atrophy of the basal ganglia and cerebellum. American Journal of Neuroradiology. 23 (9), 1466 (2002).
- Stoller, P., Kim, B. -. M., Rubenchik, A. M., Reiser, K. M., Da Silva, L. B. Polarization-dependent optical second-harmonic imaging of a rat-tail tendon. Journal of Biomedical Optics. 7 (2), 205 (2002).
- Brown, E. B., et al. In vivo measurement of gene expression, angiogenesis and physiological function in tumors using multiphoton laser scanning microscopy. Nature Medicine. 7 (7), 864-868 (2001).
- Chakraborti, S., Natarajan, K., Curiel, J., Janke, C., Liu, J. The emerging role of the tubulin code: From the tubulin molecule to neuronal function and disease. Cytoskeleton. 73 (10), 521-550 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon